Method Article
העשרה של פכיטנא ספרציטים וספרטידים מאשכים עכבר באמצעות ציוד מעבדה סטנדרטית
* These authors contributed equally
In This Article
Summary
מוצג כאן הוא פרוטוקול עבור העשרת החומר העשיר pachytene, עגול spermatocytes, ו להאריך spermatocytes מתוך האשכים עכבר למבוגרים באמצעות סרום מתמשך פרה אלבומין הדרגתי עם מעבדה סטנדרטית ציוד.
Abstract
כדי לאפיין כל שלב של הזרע, החוקרים חייבים להפריד אוכלוסיות משנה שונות של תאי הנבט מן האשכים. עם זאת, בידוד אוכלוסיות דיסקרטיות הוא מאתגר, משום שהבלבול במבוגרים מכיל שילוב מורכב של תאי נבט מכל הצעדים של הזרע יחד עם אוכלוסיות מסוימות של תאים סומטיים. במהלך העשורים האחרונים, טכניקות שונות כגון משחררות צנטריפוגלי, מיון תאים עם הפעלה פלואורסצנטית (FACS), ו-STA-לשים כבר להחיל בהצלחה על בידוד של תאי הנבט. חיסרון הוא שכולם דורשים מכשירים ייעודיים והכשרה מיוחדת. העקרונות הבאים בבסיס השיטה STA-שים, פרוטוקול פשוט פותחה לבידוד של הספרציטים pachytene, עגול spermatocytes, ו להאריך spermatocytes מתוך האשכים העכבר. לאחר הכנת השעיית תא בודד של תאי האשכים, אוכלוסיות תאים ספציפיות מועשר על ידי שיפוע הכבידה דרך מעבר מתמשך של סרום של שור (BSA) צפיפות הדרגתי. לאחר מכן, שברים בתא נאספים ומנותח באופן ידני. ניתן להחיל באופן נרחב את מעבר הצבע של דחיסות שהשתנתה עבור פרוטוקול שיפוע (MDR) בצפיפות, מכיוון שהיא דורשת ציוד מעבדה סטנדרטי בלבד. יתרה מזו, הפרוטוקול דורש חומרי התחלה מינימליים, הפחתת העלות והשימוש בבעלי חיים מעבדתיים.
Introduction
הרבה עדיין לא ידוע על האירועים המולקולריים והביולוגיים שמתרחשים במהלך היונקים התאיים, תהליך מורכב שבו תאי גזע spermatogonial להפוךמיוחדים מאודהזרע1,2. הזרע מתרחש בתוך. הטובולים של הבולים Tubules מכילים תערובת של תאי הנבט מכל שלב של בידול, כולל תאי גזע spermatogonial, החלוקה באופן מיוסטי הפרדה, מיאיוציטים, ו postmeiotic הספרדים (אשר עוברים בידול מסביב spermatids כדי להאריך spermatids, ולבסוף לזרע בוגרת. תאים סומטיים של הבולים כוללים תאי Sertoli כי הם התערבבו עם תאי הנבט בתוך tubules הסימיניטיים, תאים peritubular myoid היוצרים קירות של tubules, ו טסטוסטרון-ייצור תאים ליידיג במרחב ביניים בין tubules.
לימוד תהליכים מולקולריים וביוכימיים במהלך הזרע דורש לעיתים קרובות הפרדה של אוכלוסיות שונות של תאי הנבט מתערובת מורכבת של תאי האשכים. אסטרטגיות שונות רבות פותחו עבור העשרה תאים. השיטות המוצלחות ביותר הן STA-לשים מהירות שכבות על ידי יחידת כוח הכבידה3,4,5,6, משחררות צנטריפוגלי מבוסס על זרימה נגדית צנטריפוגה7,8, ומיון תאים מופעל על-ידי קרינה פלואורסצנטית (FACS) המפריד בין התאים לפי תוכן ה-DNA ו/או סמנים ספציפיים. שיטות אלה משמשות בדרך כלל בקרב החוקרים הזרע ולאפשר העשרה יעילה של סוגים ספציפיים תא הנבט. עם זאת, הגבלה של טכניקות אלה היא שהם דורשים חומרה מיוחדת ויקרה הדורשת מומחיות.
הציגו כאן הוא פרוטוקול פשוט וזול כדי לבודד אוכלוסיות מועשר של שלושת האוכלוסיות הנפוצות ביותר של תאים של האשכים העכבר: מעגלי הזרע, spermatids ספרציטים, ו להאריך spermatids. פרוטוקול זה נקרא הדרגתי צפיפות משתנה עבור spermatids עגול (MDR), כי זה עובד טוב במיוחד להעשרת spermatids עגול. השיטה MDR מבוססת על אותם עקרונות כמו משקעי המהירות STA-שים, אך הוא דורש רק ציוד מעבדה סטנדרטי. תאים חיים מותרים משקעים דרך מוכן באופן ידני שאינו מתמשך סרום שור (BSA) צפיפות מעבר הצבע בתוך צינור 50 mL סטנדרטי תחת שדה הכבידה של כדור הארץ. תאים גדולים יותר לנוע מהר יותר דרך המעבר, אשר מפריד אוכלוסיות שונות של תאי הנבט. לאחר משקעי השאיפה, שברים מועשרים של שלושה סוגי תאים נאספים באופן ידני. הטוהר של אוכלוסיות אלה מועשר בתאים מקבילה לאלה שהתקבלו על ידי STA-לשים ו צנטריפוגלי.
בנוסף לכיסוי הבנייה והשימוש במעבר BSA לצורך שיפוע מהירות, הפרוטוקול מתאר גם את שיטת העיכול לשחרור תאי האשכים מtubules. הפרוטוקול השתנה מאותה שפותחה על ידי רומרול ואח '9 וכוללת מדיקות סדרתית עם קולגן ו טריפסין. מעכל סדרתי בשילוב עם שימוש של מאגר ביקרבונט (כלומר, הפתרון Krebs) הוכחו מאוד לשפר את ההפרדה ואת הכדאיות של תאי הנבט9.
במהלך העשרה MDR, התאים להשקיע בסביבות 4 שעות ביחד מחוץ לסביבה של tubules ה, ואינם חשופים כוחות מכניים מלחיצים, אשר מאפשר איסוף של שברים סלולריים מאוד קיימא לניתוח במורד הזרם. בנוסף, בדומה משחררות הצנטריפוגלי ו-STA-שים, פרוטוקול MDR אינו דורש שום טיפול כימי או תוויות של תאים, אשר גם מסייע לשמור על הכדאיות שלהם. חשוב מכך, מעט כמו שתי האשכים בוגרים העכבר מספיקים עבור בידוד MDR ולכן, עכבר אחד מבוגר מספק תאים מועשר מספיק הן עבור RNA והן ניתוח חלבון. פרוטוקול STA-שים סטנדרטי ממליץ על שימוש של עד 12 עכברים למבוגרים לבידוד התא6; למרות, בהתבסס על ניסיון קודם, ידוע כי בידוד מוצלח יכול להיעשות משלושה עד ארבעה עכברים למבוגרים. הכמות הנמוכה ביותר של חומר ההתחלה שדווח כי מספיקה לשיטריציה צנטריפוגליים היא שישה האשכים של העכבר (שלושה עכברים)8. לכן, מלבד ביטול הצורך ציוד מיוחד יקר, פרוטוקול MDR מפחית את מספר חיות המעבדה הנדרשות.
Protocol
תחזוקת עכברי מעבדה וכל הניסויים בוצעו בהתאם להנחיות ולתקנות הרלוונטיות לטיפול ולשימוש בבעלי חיים מעבדתיים.
1. ציוד והגדרת מגיב
- הגדר את אמבטיית המים ל-37 ° c.
- הגדר את החממה לתרבות התא עד 34 ° c, 5% CO2, 95% לחות. שים את מסובבי הצינור. בתוך החממה
הערה: החממות דורשות זמן רב לשנות את הטמפרטורה הפנימית. אם חממה שנקבעה באופן קבוע ב-34 ° c אינה זמינה, הגדר אחת ליום לפני הניסוי. - הכן ותייג את הכמות המתאימה של מגלשות זכוכית מיקרוסקופית. צייר טבעת של ~ 1 ס מ קוטר עם עט גריז ולתת את השומן יבש.
- הכינו מאגר קרבס של 1x, pH 7.8 (טבלה 1). שימו שתי שפופרות חרוט עם 50 mL של 1x קרבס כדי 34 ° צ' כדי לחמם מראש עבור שלבים 2.5-2.8. אחסן את שאר ה-1x קרבס ב-4 ° צלזיוס או על קרח.
- הכן פתרונות BSA. ראשית להכין 25 מ ל של 10% (w/v) פתרון BSA ב Krebs על ידי המסת 2.5 g של BSA ב-1x קרבס מאגר לנפח הסופי של 25 מ ל. לדלל את 10% הפתרון BSA עם מאגר בגודל 1x קרבס כדי להשיג ריכוזי BSA שונים (טבלה 2). שמור את כל פתרונות ה-BSA ב-4 ° c.
הערה: הכינו פתרונות באותו יום של ההליך והחנות ב-4 ° צ' עד השימוש. - הכינו את אנזימי העיכול באמצעות שקילה על כמות הטריפסין הנכונה והקולגנאז ל-50 מ"ל צינורות חרוטי (שולחן 3).
2. בעלי חיים והכנת הבולם של תא נבט
הערה: . זה לוקח בערך 1 שעות להשלים
- להקריב עכבר זכר מבוגר (בגיל 7 שבועות או מעלה, ביקורות ששוקל 80 ל 120 מ"ג בהתאם למתח ולגיל) דרך נקע בצוואר הרחם או שיתוף2 חנק.
- לרסס את הבטן הגחוני של העכבר עם 70% אתנול. פתח את חלל הבטן האופטית באמצעות מספריים, ביצוע פתיחה בצורת V.
- משיכת משטח שומן אפידימל עם מלקחיים, לאתר את האשכים ולהסיר אותם עם מספריים. הימנע מהפרעה אלבומין המנהרה. מניחים את האשכים על צלחת פטרי 6 ס"מ המכיל 1x קרבס.
- עריפת ראש האשכים ולהשליך את אלבומין המנהרה. קצת לפזר את tubules הסולת על ידי להקניט אותם בעדינות לגזרים עם מלקחיים.
- מלקחיים להשתמש כדי להעביר את tubules הסולת לתוך צינור 50 mL מכיל 2 מ ל של הפתרון המוכן טרי התמיסה (שולחן 3).
- מודטה את הטובולים באמבט המים 37 ° c במשך 3 דקות.. מתפרעים בעדינות על ידי הנדנדה
הערה: Tubules צף חופשי צריך להתרחש בתוך 3 דקות עקב הסרת תאים ביניים. הטמפרטורה הפיזיולוגית לתאי האשכים היא 34 ° c; לכן, לעיכול ארוך נעשים בדרך כלל בטמפרטורה זו. עם זאת, ניתן לנהל את העיכול הקצר 3 דקות ב37 ° צ' (הטמפ ' המומלצת על ידי היצרן). שימו לב כי אם משתמשים ב-34 ° c, יש למטב מחדש את זמן העיכול. - הוסף לפחות 40 mL של חם 1x Krebs ולאפשר tubules לשקע (~ 1 דקות) בטמפרטורת החדר (RT). הסר את הסופרנטאנט וחזור על 1x.
- הוסיפו 25 מ ל של פתרון טריפסין טרי (שולחן 3), הניחו את הצינור על מסובבי הצינור בתוך החממה 34 ° c, ו-הדגירה עבור 15-20 דקות (~ 15 סל ד). . בדיקת הנבגים במצב של הטובולים לאחר הפתרון הופך מעונן ורק חתיכות קטנות של tubules להישאר, למקם את הצינור על הקרח ומיד להמשיך לשלב הבא.
הערה: כדי להימנע מעיכול יתר ומפירוק תאים, הזז במהירות לשלבי הכביסה הבאים. פרוטוקולים מסוימים כוללים את הביטול של טריפסין על ידי סרום של שור עוברי (FBS). בפרוטוקול זה, טיפול FBS מושמט, ובמקום זאת, טריפסין מוסר על ידי צנטריפוגה מיידית ושוטף הבאים עם קר 1x Krebs. - לסנן את הפתרון באמצעות מסננת תא 40 יקרומטר לתוך צינור חדש 50 mL חרוט על קרח.
- צנטריפוגה 600 x g עבור 5 דקות ב 4 ° צ' כדי גלולה התאים.
הערה: צנטריפוגה עם כוח חזק מדי עלול להזיק לתאים. - הסר את הסופרנטנט על ידי שפיכת החוצה בזהירות.
- הקש על הגלולה הסלולרית כדי להשעות את התאים בשארית של 1x Krebs.
- הוסף לפחות 40 mL של קר 1x קרבס לתאים מושעה מחדש.
- חזור על שלבים 2.10 ו-2.11.
- הקש על השפופרת עם הגלולה כדי להשעות מחדש את התאים. הוסף 1 מ ל של 0.5% BSA ב 1x קרבס ובעזרת פיפטה חיתוך מחדש את התאים על ידי ליטוף הפתרון למעלה ולמטה. להימנע מעשיית בועות.
- לבסוף, הוסף 1 ל-3 מ"ל של 0.5% BSA ב-1x Krebs כך שאמצעי האחסון הסופי הוא ~ 3 mL. Filtrate תא הנבט השעיה דרך מסננת תא 40 יקרומטר ולהמשיך מיד כדי לטעון את התאים על מעבר הצבע bsa.
3. הפרדת תאי הנבט באמצעות הדרגה הרציפה של BSA
הערה: סעיף זה לוקח בערך 2 h כדי להשלים. התחל להכין את מעבר הצבע הקטוע של BSA במהלך שלבי הכביסה (השלבים 2.10-2.14) כדי לטעון את התאים ברגע שהטיפול הקדם מוכן.
- להתאים שפופרת 50 mL אנכית על הקרח, כך שניתן לראות צד אחד של הצינור. לחלופין, הפעל את הפרוטוקול בחדר קר ב-4 ° c, ובמקרה זה אין צורך בקרח.
- חותכים את הקצה של הצינורות בגודל 10 מ"ל בערך 5-10 מ"מ מהקצה כדי להשיג צמצם גדול יותר (איור 1א), ומהר אותו על בקר הפיפטה (איור 1ג).
הערה: זה יהיה להקטין את המהירות במהלך ליטוף, אשר מקלה על הערמה של פתרונות BSA שונים. לחילופין, השתמש בפיפטה מכני אחד מ-mL עם בוכנה חלקה וגזור את עצות הפיפטה עם צמצם של כ -3 מ"מ קוטר (איור 1B). - התחל על ידי ליטוף 5 מ ל של 5% הפתרון BSA בתחתית הצינור 50 mL.
- באופן איטי pipet 5 מ"ל של 4% BSA הפתרון על גבי הפתרון 5%. התחל על ידי נגיעה עדינה על פני השטח של הפתרון 5% עם קצהו החתוך של הפיפטה ושכבה את שני הפתרונות תוך שמירה קפדנית על מגע עם פני השטח, ומבטיחים שלא לאפשר את הטיפ הפיפט להיות שקוע.
הערה: קו ברור צריך להיות גלוי בין שתי השכבות בסוף שלב זה. - חזור על שלב 3.4 עם פתרונות ה-BSA האחרים לקבלת מעבר הדרגתי לא רציף מ-5% עד 1% (איור 1D).
- טען בזהירות את ההשעיה של התא היחיד מעל מעבר הצבע מבלי להפריע. תן התאים משקע דרך הדרגתי עבור 1.5 h ב 4 ° צ' או על קרח.
4. אוסף של שברים של תא נבט מועשר
הערה: סעיף זה לוקח בערך 30 דקות כדי להשלים.
- הר a 1 מ ל מעלה לתוך הצנרת מכני 1 mL וחותכים את הקצה כך הצמצם הוא ~ 3 מ"מ קוטר (איור 1B).
- בזהירות לאסוף ~ 1 שברי mL ב 1.5 הנפרדים צינורות mL, החל מראש הדרגתי של BSA, ולאחסן אותם על הקרח. מספר את הצינורות באותו סדר כמו השברים ייאספו.
הערה: בשלב זה, צריך להיות סדרה של ~ 28 צינורות המכילים השעיות תא. השתמש בפיפטה מכני 1 mL עם בוכנה חלקה וחותכים את עצות הפיפטה כדי למזער את הסיכון להפריע למעבר הצבע BSA. - צנטריפוגה את שברי תא הנבט ב 600 x g עבור 10 דקות ב 4 ° c.
- להיזהר לא להפריע את הגלולה, להשליך את רוב supernatant ולהשעות את הגלולה התא על ידי מצליף בצינור. הוסף 1 מ ל של מאגר הקרח קר 1x קרבס לכל צינור וחזור על צנטריפוגה.
הערה: חזור על צעד הכביסה אם BSA מפריעה לניתוח במורד הזרם. - למחוק את רוב supernatant אבל לעזוב ~ 100 μL לאחר השטיפה האחרונה. . השהה מחדש את הגלולה בזהירות
הערה: השעיית התאים מחדש בזהירות מבטיחה שהמדגם שנלקח מפתרון זה מייצג את כל התאים של השבר הנתון. השאר את השפני התאים על הקרח בזמן הכנת השקופיות.
5. ניתוח שברים של תאים
הערה: . הניתוח לוקח 2 שעות להשלים
- אחד בכל פעם, pipet 20 μL של 4% פאראפורמלדהיד (בתחתית) בתוך כל טבעת משחה העט על שקופית מיקרוסקופ ממוספרים.
- הוסף מיד 2 μL של השעיית תא מחדש מהשבר המקביל. חזור על הפעולה עבור כל שבר.
הערה: בעת הכנת שקופיות, השאר את כל השעיות התאים על הקרח. - יבש את השקופיות בשעה RT עבור 1 h עד לילה (O/N).
הערה: במהלך שלב זה, לאחר נטילת דגימה מכל שבר, ניתן לעבד את התאים עבור ניתוח או אחסון במורד הזרם (סעיף 6). - לשטוף את השקופיות פעם עם 1x PBS ו הר עם הרכבה בינונית עם 4 ′, 6-diamidino-2-פנילילינדול (DAPI) (שולחן החומרים).
- לנתח את השקופיות תחת מיקרוסקופ פלואורסצנטית כדי להעריך איזה סוג תא הנבט מסוים מועשר בכל שבר.
הערה: סוגי תאים שונים ניתן לזהות על ידי המבנה הגרעיני האופייני שלהם דמיינו על ידי כתמים DAPI. איור 2 מראה שברים נציג מועשר להאריך spermatids, מעגלי הזרע והספרציטים pachytene. גרעין הזרע העגול קטן (6-7 יקרומטר בקוטר) ועגול (איור 2א). העכבר מסביב גרעיני spermatid מאופיינים גם על ידי יחיד, עגול הטרוכרומטין מבנה הנקרא כרומוסנטר. גרעינים של להאריך spermatids יש צורה מוארך טיפוסי מופחתת גודל גרעיני עקב עיבוי כרומטין (איור 2א). גרעיני הספרטין הם הרבה יותר גדולים (קוטר יותר מ -10 μm) ויותר לא סדיר בצורה, עם אזורים של כרומטותין בצפיפות צפופה המופצים בכל רחבי (איור 2א). -
במקרה הצורך, בצע כתמים מסוג חיסוני בנוסף לצביעת DAPI כדי לתמוך בזיהוי סוגי התאים השונים.
- במקרה זה, להפיץ 2 μL של ההשעיה של התא עם 20 μL של פתרון תיקון (4% בתחתית ו 0.1% nonionic החומר ב-PBS) בתוך טבעת משחה העט. לאחר ייבוש השקופיות, postfix את התאים עם 4% כלפי מע עבור 10 דקות ב RT.
- לשטוף עם PBS, ולאחר מכן החדיר עם 0.1% nonionic חומרים פעילי שטח ב-PBS עבור 5 דקות. לשטוף עם PBS ולבטל את כל השאר בתוך האלבום האחרון על ידי מגלשות שקופיות ב 100 mM NH4Cl עבור 5 דקות.
- לשטוף עם PBS ולהמשיך לפרוטוקול אימונוofluorooooooooov, המורכב מחסימת וincubations עם נוגדנים עיקריים ונוגדנים משני בעלי תוויות פלואורואוכרום. הר את השקופיות עם מפעיל לדעוך עם DAPI (טבלת חומרים) ולאפשר להם להגדיר עבור 24 h.
הערה: דוגמאות של סמנים שימושיים עבור נוגדנים הראשי incubations כוללים בוטנים ציטינטין (הרשות הפלסטינית; 1:2000 בפתרון חסימה) כי כתמי אקרוכמה בסיבוב ו להאריך spermatids, אנטי DDX4 נוגדן (1:200 בפתרון חסימה) כי תוויות יחיד cytoplasmic הגרניט בתוך spermatids עגול, אנטי γH2AX נוגדן (1:100 בפתרון חסימה) כי מזהה את גופי המין בספרציטים pachytene. עיין בתוצאות הנציגים ובאיור 2ג, ד לקבלת דוגמאות של ניתוח אימונוoforc של השברים.
6. עיבוד הדגימות הנותרות לאחסון
הערה: סעיף 6 לוקח כ 20 דקות להשלים.
- לאחר מדגם מכל שבר נלקח לשקופית מיקרוסקופ, להוסיף 1 מ ל של קרח קר 1x קרבס לכל שבר ו צנטריפוגה את התאים למטה ב 600 ל13000 x g עבור 10 דקות ב 4 ° c.
הערה: מהירות נמוכה צנטריפוגה תוצאות בגלולה רופף, מה שמקשה להסיר לחלוטין 1x Krebs, בעוד צנטריפוגה במהירות גבוהה עלול לפגוע בתאים. בחר את מהירות הצנטריפוגה בהתאם לדרישות הספציפיות של פרוטוקול הזרם. - להסיר ולמחוק את הסופרנטאנט ולהמשיך בניתוח מועדף במורד הזרם.
הערה: בשלב זה, התאים יכולים להיות מוקפאים בחנקן נוזלי ומאוחסנים ב-70 ° c. לאחר היכרות עם טכניקה זו, ניתן להמשיך עם פרוטוקול במורד הזרם של העדפה ישירה, אבל תמיד מומלץ לקחת דגימה ולהבטיח את הטוהר של כל שבר. סך RNA ניתן לחילוץ, כימות ומנותח על-ידי שיטות כגון תגובת שרשרת של היפוך פולימראז (PCR) ורצפי RNA. תמציות חלבון סה כ יכולים גם להיות מוכנים שבהם ניתוח immunoprecipitation או מערבי ניתן לבצע (איור 3).
תוצאות
העשרה מספקת של סוג תא נבט נחשב בדרך כלל להיות מעל 80%6. פרוטוקול MDR פועל היטב במיוחד עבור מעשיר spermatids עגול. מספר גבוה של > 90% spermatids עגול ניתן להשיג באופן שגרתי באמצעות טכניקה זו. שברים אופטימליים של הספרציטים pachytene ו להאריך spermatocytes מועשר ~ 75% ו ~ 80%, בהתאמה. להאריך spermatids נוטים להישאר על גבי מעבר הצבע והם נאספים עם השבר הראשון. בדוגמה המוצגת, שבר 1 הכיל ~ 80% של להאריך spermatids (איור 2ב). רוב להאריך spermatids שהתקבלו עם טכניקה זו יש גרעינים מרוכז, בעוד שאינם מרוכז מוקדם להאריך spermatids הם נדירים (איור 2א). השברים הבאים מכילים ספרטידים עגולים מועשרים. בדוגמה, העשרת הספרדים העגולים היו יותר מ-90% בשברים 2, 3 ו -4, והעשרה מעל 80% נראו לגמרי בשבעה שברים (2-8) (איור 2ב). בשל גודלם הגדול, משקע הספרציטים pachytene מהר יותר, נאספים אחרון. בדוגמת הטיהור, העשרה היתה סביב 75% בשברים 14 ו -15 (איור 2ב).
בעוד מורפולוגיה גרעינית, דמיינו על ידי כתמים DAPI, בדרך כלל מספיק להכרה של התאים, ניתוח מאימונוoforסנס ניתן לבצע כדי לתמוך בניתוח. הרשות הפלסטינית כתמי את האקרוזומים המתפתחים של עגול ו להאריך spermatids, ואת המראה האקרוזומלית ניתן לנצל כדי לסווג את החלק הנוסף של הזרע לתוך צעדים 1-8 של בידול10. הבחנה בלהאריך הפלסטינית ומוכתמת spermatids מסתמך על ההבדלים בצורתם הגרעינית (איור 2C, שמאל פאנל). Anti-DDX4 הנוגדן הוא סמן שימושי עבור שברים spermatid עגול מאז הוא ומדמיין אחד יחיד DDX4-חיוביות perd ברור, הגוף chromatoid (CB), בציטופלסמה של כל מעגלי. זה כתמים באופן ספציפי CB קל להבדיל מתוך כתמים יותר מופץ cytoplasmic ב spermatocytes (איור 2C, הלוח האמצעי). הספרציטים pachytene יכול להיות מוכר על ידי נוגדן anti-γH2AX כי תוויות גוף המין הגרעיני במיוחד המופיעים בשלב pachytene של החלוקה meiotic הראשון (איור 2C, הלוח הימני). בטיהור זה, כתמים של הרשות הפלסטינית גילה כי MDR מועשר שברים spermatid הכיל תערובת של spermatid עגול בשלבים שונים של בידול, כל המכילים מבנה החתימה שלהם, DDX4-חיובית CB (איור 2ד, שבר RS). Anti-γH2AX מאומתת עוד יותר את ספרציטים העשרה בשבר 16 (איור 2D, חלק pspc).
ספירת התא עולה כי מספר התאים העגול spermatid ו שברים spermatid הולם מספיקים עבור ניתוחים שונים במורד הזרם. עגול שברים spermatid (5-8) כל אחד הכיל סביב 2.5 x 106 תאים. לכן, על-ידי צירוף שברים אלה, ניתן להשיג יותר מ-10,000,000 תאים. השברים הספרניים (14 ו -15) הכילו בדרך כלל פחות תאים. בבידוד זה, בסביבות 1.5-2.0 x 106 תאים לכל שבריר נספרו. השבר הראשון הכיל 0.75 x 106 להאריך spermatids.
כפי שמוצג באיור 3A, סכום ה-RNA הכולל שהושג מרוב השברים נע בין 0.5 ל-2.5 μg, אשר מספיקה עבור ניתוח rna במורד הזרם, כגון שעתוק הפוכה PCR, רצפי rna, או ויזואליזציה של rna על ג'ל. כמות החלבון המתקבל מכל שבר בדרך כלל נע בין 20 על 140 μg (איור 3ב), אשר מספיקה עבור מספר blots מערביים. ליקוטים תא שלם היו מוכנים שברים שנאספו, וניתוח כתמי המערבי בוצע באמצעות נוגדנים זיהוי DDX4, PIWIL1, ו PIWIL2, אשר מבוטאים באופן מאוד מאוד ביטוי בספרציטים ומעגלי, כמו גם באופן אוביקוויטאלי הביע גליצראלדהיד 3-פוספט דהידרוגנאז (הגנד).
בפרוטוקול זה, 10% מהחלבון שנגזר משברים בודדים היה מספיק כדי לזהות בבירור את כל החלבונים האלה על הגדרת אבן חשופה מערבית סטנדרטית (איור 3ג). כמות החלבון בשבר אחד הוכח גם להיות מספיק עבור immunoprecipitation באמצעות נוגדן נגד PIWIL1, כמו גם לאיתור של שיתוף immunoprecipitated PIWIL2 (איור 3D). יתר על כן, פרוטוקול זה נעשה שימוש בהצלחה כדי להשיג שברים מועשר של הספרציטים pachytene ו spermatocytes עגול מן השליטה ועכברים מהונדסים גנטית עבור יישומי במורד כגון שעתוק הפוכה כמותית PCR11 ותפוקה גבוהה של RNA רצף של12.

איור 1: הכנת מעבר צבע מקוטע של BSA. (א) טיפ משנת 5 מ"ל להכנת מעבר הצבע. (ב) מפית להכנת מעבר הצבע והאוסף של שברים של תאי הנבט לאחר שיפוע. (ג) הציוד הדרוש להכנת מעבר הצבע. (ד) השקפה לרוחב של צפיפות bsa שאינה רציפה מעבר ל -5% (למטה) לפתרון bsa 1 (למעלה); הפתרונות BSA של 2% ו-4% כחולים בצבע כחול להדמיה טובה יותר. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
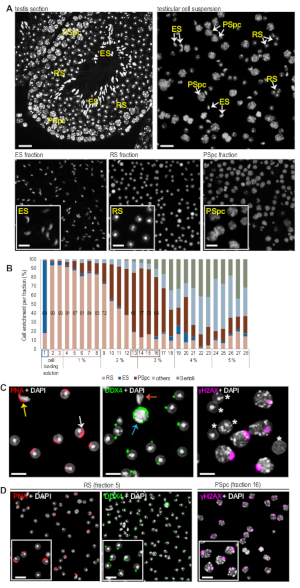
איור 2: תמונות מייצגות של שברי התאים הנאספים וניתוח העשרה. (A) dapi-תאיהאשכיםויטראז '. השורה העליונה מראה תאי האשכים של האפיתל הסמיניאני השלם של מקטע בלשון קבוע, פרפין מוטבע בסעיף (משמאל) או בהשעיה (מימין). השורה התחתונה מראה שברים של להאריך spermatids מועשר (ES), עגול spermatids (RS), או פכיטנא spermatids (PSpc). קנה מידה של סרגלים = 20 יקרומטר עבור השורה העליונה ו-10 יקרומטר עבור ניסות של השורה התחתונה. (ב) כימות יחסית של סוגי תאי הנבט השונים בכל שבר. התאים נספרו באופן ידני באמצעות תוכנת ImageJ וסווגו לתאים RS, ES, PSpc, Sertoli ותאים אחרים. מספרי השברים והאחוזים המתאימים של BSA במעבר הצבע מצוינים בציר ה-x. (ג) אימונוoforסנס ניתוח של תאי האשכים. הפנל השמאלי: הרשות הפלסטינית כתמי את האקרוכמה ב-ES (חץ צהוב) ו-RS (חץ לבן). הפאנל האמצעי: DDX4 נוגדן כתמי בודד ברור למדי ב RS, אשר קל להבחין בין האות cytoplasmic יותר מפוזר ב spermatocytes (חץ כחול). לא DDX4 אות מזוהה ES (חץ כתום). פאנל ימני: הנוגדן γH2AX מזהה גוף המין הגרעיני האופייני הנוכחי רק ב-pachytene spermatocytes (תאים שליליים γH2AX מסומנים על ידי כוכבית לבן). קנה מידה ברים = 10 μm. (ד) mdr שברים סלולריים מועשר היו מתויג עם הרשות הפלסטינית (השבר rs), ANTI-DDX4 (השבר rs), ו Anti-γH2AX (השבר pspc) כדי לאמת את העשרה התא בכל שבר. קנה מידה של סרגלים = 10 μm. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
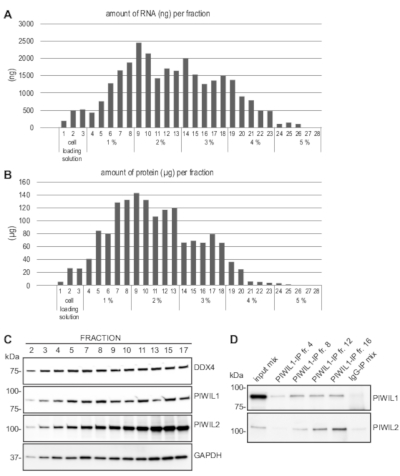
איור 3: במורד הזרם ניתוח לאחר העשרה תא MDR. (א) RNA הופק מכל שבר לאחר העשרה התאים הנציג mdr וכימות. מספרי השברים והאחוזים המתאימים של BSA במעבר הצבע מצוינים בציר ה-x. (ב) חלבונים חולצו מכל שבר על ידי לישיר את הגלולה תא בradioimmunoprecipitation (ריפה) מאגר באמצעות כימות. (C) כל תמציות החלבון מוכנים ומנותח על ידי הכתמים המערביים באמצעות נוגדנים נגד DDX4, PIWIL1, PIWIL2 ו-"גנד". 10% של הליפוסט היה טעון מכל שבר שצוין. (ד) Immunoprecipitation בוצע משברים המצוין באמצעות ANTI-PIWIL1 ואחריו בלוק מערבי עם אנטי PIWIL1 ו אנטי PIWIL2 נוגדנים. דגימת הקלט כוללת תערובת של חלבון lysates משברים שונים, ושליטה immunoprecipitation (IP) באמצעות ארנבת IgG התבצע גם מתוך ליפוסט מעורב. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
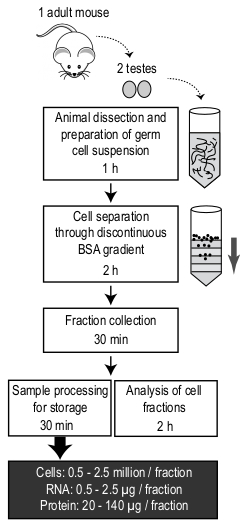
איור 4: ייצוג סכמטי של פרוטוקול MDR וזמן הנדרש להשלמת כל שלב. חומר מתחיל מורכב משתי האשכים מעכבר מבוגר. מספר התאים הממוצע וכמות ה-RNA והחלבון המתקבלים משבר אחד מצוינים. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| אגר | ריאגנטים | כנה | אחסון |
| מאגר קרבס (10x) | 3.26 g KH2פו4 | להביא 2 L עם H2O, מסנן 0.22 יקרומטר ו החיטוי. | ניתן לאחסן ב -4 ° c במשך מספר חודשים |
| 139.5 g | |||
| 5.89 g מגכה4 •7h2o | |||
| 50 דקסטרוז g | |||
| 3.78 g cacl2•2h2O | |||
| 7.12 g כפיר | |||
| מאגר קרבס (1x) | 4.24 משחק3 | מתמוסס נחקו3 עד 100 ML של H2O, להוסיף 200 מ ל של 10x קרבס מאגר, ולהביא 2 L עם H2O. | להיות מוכנים טרי |
| 200 mL-מאגר קרבס בגודל 10x |
שולחן 1: הכנת מאגר קרבס.
| ריכוז BSA (w/v) | 10% פתרון BSA | 1x מאגר קרבס |
| 0.50% | 0.5 מ ל | 9.5 מ ל |
| 1 | 1 מ ל | 9 מ ל |
| 2 | 2 מ ל | 8 מ ל |
| 3 | 3 מ ל | 7 מ ל |
| 4 | 4 מ ל | 6 מ ל |
| 5% | 5 מ ל | 5 מ ל |
שולחן 2: הכנת פתרונות BSA.
| פתרון העיכול | ריכוז העבודה | ריאגנטים | כנה |
| קולגנאז | 1 מ"ג/mL | קולאגנאז הרביעי | שוקל 2 מ ג של הקולגן הרביעי לצינור 50 mL, ולהוסיף 2 מ ל חם מאגר קרבס של 1x בדיוק לפני העיכול (שלב 2.3). |
| טריפסין | 0.6 מ"ג/mL | טריפסין | שוקלים 15 מ"ג של טריפסין לצינור 50 mL, ולהוסיף 25 מ ל של מאגר החמים 1x KREBS ו 40 μL של DNase אני ממש לפני העיכול (שלב 2.6). |
| > 3.2 ku/mL | . אני |
שולחן 3: הכנת אנזימי העיכול.
Discussion
מוצג כאן הוא פרוטוקול פשוט זול כדי לבודד אוכלוסיות מועשר של spermatids עגולים, פכיטנא ספרציטים, ו להאריך spermatids באמצעות ציוד מעבדה סטנדרטית (מבט כולל של הפרוטוקול המוצג באיור 4). למרות שאין צורך בשום מומחיות או מכונות יקר, ישנם כמה צעדים קריטיים שיש לשקול במהלך העיכול, בניית מעבר הצבע, וטעינת התא הבולם על מעבר הצבע.
תאי הנבט שוחררו מטובולים באמצעות שני מעכל אנזימטיים רצופים. העיכול הראשון עם הקולגן הרביעי מפריד tubules ביניים על ידי הסרת התאים הבין-מפרידים. זמן העיכול ממושך עלול לפגוע tubules ולהוביל אובדן של spermatids, כמו (אם שוחרר מתוך tubules בשלב זה) הם יימחקו בשלבים הבאים. צעד העיכול השני עם טריפסין משחרר את תאי הנבט מפני הזרע. ייתכנו מזדמנים לפירוק תאים ובדרך כלל הטופס גושים כתוצאה משחרור DNA גנומית. מעבר למשך הזמן או הטמפרטורה המוצעים של העיכול אינו מומלץ, מאחר שפעולה זו עלולה להוביל לכדאיות נמוכה יותר, הגדלת הפירוק התאים וההפייפת. אם מתרחשות מבצע מתון, ניתן להתעלם מהגושים. עם זאת, במקרים של הסדר משמעותי ואובדן של תאים, טריפסין זמן העיכול או ריכוז צריך להיות מופחת. יש לציין כי הפעילות האנזימטית של טריפסין עשויה להשתנות בין קבוצות ובזמן ממושך של אחסון. ניתן להגדיל את כמות DNase I במהלך העיכול בטריפסין כדי להסיר את הגושים העודפים, אך יש להתייחס לזה כפתרון משני. חשוב להשיג הבולם האחיד תא יחיד בסוף הטיפול מראש, מאז התאים המקרקשים משקעים מהר יותר, מזהם את השברים ומשבש את מעבר הצבע.
בניית מעבר הצבע עשויה לדרוש תרגול כלשהו. אם יש אי נוחות באמצעות טיפ 5 מ ל מפיפטה עם בקר פיפטה, מומלץ להשתמש בצנרת רגילה 1 mL עם בוכנה חלקה ולאחר מכן חותכים את עצות הפיפטה לצמצם של ~ 3 מ"מ קוטר (איור 1B). צמצם רחב יותר וטעינה חלקה של פתרונות BSA תפחית את הסיכון לערבב את מעבר הצבע. כאשר הוכנו כראוי, ניתן לראות את הגבולות בין פתרונות BSA סמוכים עקב מדדי השבירה השונים שלהם. יש להפיק את מעבר הצבע ישירות לפני השימוש. יש לציין כי כל טלטול או רטט קטנים עלולים להפריע למעבר הצבע, כך שיש להגדיר את מעבר הצבע בסביבה שבה לא יפריעו לו.
טעינת תא ההשעיה על מעבר הצבע חייבת להיעשות בזהירות רבה. לאחר טעינת, השעיית התא צריך להישאר על גבי מעבר הצבע, שממנו התאים באיטיות להתחיל משקע דרך השכבה הראשונה. אם קבוצות גדולות של תאים נראים נעים במהירות דרך מעבר הצבע, סביר להניח שהתאים לא מושעים מחדש בזהירות או שיש הגזמה עודפת. אם התאים אינם נשארים בחלק העליון של מעבר הצבע BSA שאינו רציף בעת טעינת הטעינה אך מיד בין השכבות של 1% ו-2% BSA (שלב 3.6), ההשעיה של התא עשויה להיות צפופה מדי. פרוטוקול זה כבר אופטימיזציה באמצעות שתי האשכים של עכבר מבוגר (80-120 מ"ג/בדיקות) כחומר התחלתי; למרות זאת, בוצע מבודדים מוצלחים באמצעות כמויות מופחתות של חומר התחלתי. כדי להתאים את הפרוטוקול ולהשיג תאים נבט מועשר יותר ממספרים גבוהים יותר של האשכים, יותר 50 mL צינורות עם מעבר הצבע צריך להיות הציג.
הפרוטוקול פותחה בתחילה ממוטבת כדי להעשיר את הסביבה spermatids מתוך האשכים עכבר למבוגרים, ואת הטוהר של שברים spermatids עגול צפוי להיות יותר מ 90%. בנוסף מאוד טהור שברים העגול, תוצאות משביע רצון עבור העשרת הספרציטים pachytene ו להאריך spermatid הושגו. יצוין כי אריתרופוציטים עשוי לזהם את שברים להאריך spermatid, ושלבים נוספים כדי לחסל אותם יש לנקוט אם נוכחותם צפויה להפריע ניתוח במורד הזרם. לא היינו מסוגלים להעשיר סוגים אחרים של תאים כגון premeiotic או תאי meiotic מוקדם (לפני שלב pachytene) מעכברים למבוגרים באמצעות פרוטוקול MDR.
בנוסף, STA-לשים משקעי המשמש בהצלחה כדי לקבל שברים מועשר של הזרע או טרום לפטוין, לפטוטנא, וזימטציטים זוגניות באמצעות האשכים הקטינים שנאספו בנקודות זמן נתון לאחר הלידה13. גישה זו מנצלת את המראה של סוגי תאים אלה במהלך הגל הראשון של הזרע. אותה גישה עשויה להיות מוחלת על העשרה MDR, אבל זה עדיין לא נבדק בפועל. שיטה נוספת היא אופציה טובה לטיהור של תאים premeiotic ו meiotic בשלבים ספציפיים של בידול הוא FACS, אשר יש את היתרון החשוב של מתן אפשרות לבידוד של סוגי תאים ספציפיים בהתבסס על סמנים ספציפיים לנוכחות14 ,15,16,17.
בסך הכל, משקעי מהירות MDR משמש כשיטה שימושית עבור העשרה של תאי הנבט. בעוד שיטה זו אינה עולה על שיטות אחרות מבוססות היטב במונחים של טוהר או כמות של תאים מועשר, יתרונות ברורים שלה הם הפשטות שלה הגדרת עלויות נמוכות. זה, יחד עם הכמות הנמוכה של חומרי ההתחלה הנדרשים, להפוך את הפרוטוקול הזה אופציה נהדרת עבור חוקרים בשדה הזרע ואלה בתחומים אחרים שאולי לא רוצה להשקיע בחומרה מיוחדת או קבוצות גדולות של בעלי חיים.
Disclosures
. למחברים אין מה לגלות
Acknowledgements
ברצוני להודות לכל חברי המעבדה של Kotaja על תרומתם במהלך פיתוח הפרוטוקול, והשימוש הפעיל והבדיקה של הפרוטוקול בפרויקטי המחקר שלהם. במיוחד אנו מעריכים את תרומתו של יאן Lindström לקבלת עזרה במיטוב הפרוטוקול. מחקר זה היה נתמך על ידי האקדמיה של פינלנד, Sigrid Jusélius קרן, ו טורקו תוכנית של רפואה מולקולרית.
Materials
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | Preference of researcher | ||
| AlexaFluor488 donkey anti-rabbit IgG | Thermo Fisher Scientific | A-21206 | |
| AlexaFluor647 donkey anti-mouse IgG | Thermo Fisher Scientific | A-31571 | |
| Bovine Serum Albumin (BSA) | Sigma | A9647 | |
| CaCl2·2H2O | Preference of researcher | ||
| Collagenase IV | Sigma | C5138 | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| DDX4 antibody | Abcam | ab13840 | |
| Dextrose | Preference of researcher | ||
| DNase I | Worthington | LS006355 | |
| GAPDH | HyTest | 5G4 | |
| HRP-linked anti-mouse IgG | GE Healthcare Life Sciences | NA931 | |
| HRP-linked anti-rabbit IgG | GE Healthcare Life Sciences | NA934 | |
| KCl | Preference of researcher | ||
| KH2PO4 | Preference of researcher | ||
| MgSO4·7H2O | Preference of researcher | ||
| NaCl | Preference of researcher | ||
| NaHCO3 | Preference of researcher | ||
| NH4Cl | Preference of researcher | ||
| Pierce BCA protein assay kit | Life Technologies | 23227 | |
| PIWIL1 | Cell Signaling Technology | G82 | |
| PIWIL2, clone 13E-3 | Millipore | MABE363 | |
| Prolong Diamond Antidafe Mountant with DAPI | Thermo Fisher Scientific | P36962 | for Alexa Fluor immunostainings |
| Rabbit IgG | Neomarkers | NC-100-P | |
| Rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| RIPA buffer | 50 mM Tris-HCl, pH 7.5, 1% NP-40, 0.5% w/v sodium deoxycholate, 0.05% w/v SDS, 1 mM EDTA, 150 mM NaCl, 1x protease inhibitor cocktail, 0.2 mM PMSF and 1 mM DTT | ||
| TRIsure | Bioline | BIO-38033 | |
| Triton X-100 | Preference of researcher | nonionic surfactant | |
| Trypsin | Worthington | LS003703 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | for standard DAPI analysis of cell fractions |
| γH2AX antibody | Millipore | 05-636 | |
| 0.22 µm filter | Sartorius | Sartolab BT 180C6 | or equivalent |
| 1 mL mechanical pipette | Preference of researcher | ||
| 1.5 mL or 2 mL tubes | Preference of researcher | ||
| 40 µm cell sieves for 50 mL tubes | Greiner Bio-One | 542040 | or equivalent cell strainer |
| 5 mL serological pipettes | Sarstedt | 86.1254.001 | or equivalent |
| 50 mL conical tubes | Preference of researcher | ||
| 6 cm Petri dishes | Preference of researcher | ||
| Cell culture incubator | Preference of researcher | ||
| Centrifuge for 50 mL tubes | Preference of researcher | ||
| Grease pen for microscopy glass slides | Preference of researcher | ||
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | or equivalent cell rotator |
| Microdissection forcepts | Preference of researcher | ||
| Microdissection scissors | Preference of researcher | ||
| Microscopy glass slides and coverslips | Preference of researcher | ||
| Nanodrop 1000 | Thermo Scientific | ||
| Pipetboy Acu 2 | Integra | 155 000 | or equivalent pipette controller |
| Refrigerated centrifuge for 1.5 mL tubes | Preference of researcher | ||
| Tips for 1 mL mechanical pipette | Preference of researcher | ||
| Water bath | Preference of researcher | ||
| Widefield fluorescence microscope | Preference of researcher |
References
- Hess, R. A., Renato de Franca, L. Spermatogenesis and cycle of the seminiferous epithelium. Advances in Experimental Medicine and Biology. 636, 1-15 (2008).
- Lehtiniemi, T., Kotaja, N. Germ granule-mediated RNA regulation in male germ cells. Reproduction. 155 (2), R77-R91 (2018).
- Lam, D. M., Furrer, R., Bruce, W. R. The separation, physical characterization, and differentiation kinetics of spermatogonial cells of the mouse. Proceedings of the National Academy of Sciences of the United States of America. 65 (1), 192-199 (1970).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Experimental Cell Research. 79 (1), 213-227 (1973).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods in Molecular Biology (Clifton, N.J.). 558, 279-297 (2009).
- Bryant, J. M., Meyer-Ficca, M. L., Dang, V. M., Berger, S. L., Meyer, R. G. Separation of spermatogenic cell types using STA-PUT velocity sedimentation. Journal of Visualized Experiments. (80), e50648 (2013).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. Journal of Cellular Physiology. 86 (1), 177-189 (1975).
- Barchi, M., Geremia, R., Magliozzi, R., Bianchi, E. Isolation and analyses of enriched populations of male mouse germ cells by sedimentation velocity: the centrifugal elutriation. Methods in Molecular Biology (Clifton, N.J.). 558, 299-321 (2009).
- Romrell, L. J., Bellvé, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Developmental Biology. 49 (1), 119-131 (1976).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Korhonen, H. M., et al. DICER Regulates the Formation and Maintenance of Cell-Cell Junctions in the Mouse Seminiferous Epithelium. Biology of Reproduction. 93 (6), 139 (2015).
- Da Ros, M., et al. FYCO1 and autophagy control the integrity of the haploid male germ cell-specific RNP granules. Autophagy. 13 (2), 302-321 (2017).
- Bellvé, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. The Journal of Cell Biology. 74 (1), 68-85 (1977).
- Mays-Hoopes, L. L., Bolen, J., Riggs, A. D., Singer-Sam, J. Preparation of spermatogonia, spermatocytes, and round spermatids for analysis of gene expression using fluorescence-activated cell sorting. Biology of Reproduction. 53 (5), 1003-1011 (1995).
- Suter, L., Koch, E., Bechter, R., Bobadilla, M. Three-parameter flow cytometric analysis of rat spermatogenesis. Cytometry. 27 (2), 161-168 (1997).
- Lima, A. C., et al. Multispecies Purification of Testicular Germ Cells. Biology of Reproduction. 95 (4), 85-85 (2016).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry. Part A: the Journal of the International Society for Analytical Cytology. 65 (1), 40-49 (2005).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved