Method Article
Standart Laboratuvar Ekipmanları Kullanılarak Fare Testlerinden Pachytene Spermatosit ve Spermatidlerin Zenginleşmesi
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Burada sunulan pachytene spermatositler zenginleştirmek için bir protokol, yuvarlak spermatidler, ve yetişkin fare testislerinden uzayan spermatidler standart laboratuvar ekipmanları ile bir kesintili sığır serum albumin yoğunluğu gradyanı kullanarak.
Özet
Spermatogenezin her bir adımını karakterize etmek için araştırmacılar, mikrop hücrelerinin farklı alt popülasyonlarını testislerden ayırmalıdır. Ancak, ayrık popülasyonları izole etmek zordur, çünkü yetişkin testissomatik hücrelerin bazı popülasyonları ile birlikte spermatogenezin tüm adımlarından mikrop hücrelerinin karmaşık bir karışımını içerir. Son birkaç on yıl içinde, santrifüj elutriation, floresan-aktif hücre sıralama (FACS) ve STA-PUT gibi farklı teknikler başarıyla mikrop hücrelerinin izolasyon uygulanmıştır. Bir dezavantajı, hepsi özel cihazlar ve özel eğitim gerektirir. STA-PUT yönteminin altında yatan ilkeler doğrultusunda, pachytene spermatositlerin, yuvarlak spermatitlerin ve fare testislerinden uzamış spermatitlerin izolasyonu için basit bir protokol geliştirilmiştir. Testis hücrelerinin tek hücreli süspansiyon hazırlandıktan sonra, belirli hücre popülasyonları bir kesintili sığır serum albumin (BSA) yoğunluk gradyanı ile yerçekimi sedimantasyon ile zenginleştirilmiştir. Hücre fraksiyonları daha sonra elle toplanır ve mikroskobik analiz edilir. Yuvarlak spermatidler (MDR) sedimantasyon protokolü için bu modifiye yoğunluk gradyanı yaygın olarak uygulanabilir, çünkü sadece standart laboratuvar ekipmanı gerektirir. Ayrıca protokol, maliyetini ve laboratuvar hayvanlarının kullanımını azaltarak minimum başlangıç malzemesi gerektirmemektedir.
Giriş
Çok hala memeli spermatogenez sırasında yer alan moleküler ve biyolojik olaylar hakkında bilinmemektedir, hangi spermatogonial kök hücrelerin son derece özel spermatozoa dönüştürmek karmaşık bir süreç1,2. Spermatogenez testisin seminifer tübüllerinin içinde gerçekleşir. Tübüller spermatogonial kök hücreler, mitotik spermatogonia, meyotik spermatositler ve postmeiyotik spermatitler (yuvarlakdan haploid farklılaşması nı geçiren) dahil olmak üzere farklılaşmanın her adımındaki mikrop hücrelerinin bir karışımını içerir. spermatidler uzamış spermatidler için, ve son olarak spermatozoa olgun). Testissomatik hücreleri seminiferous tübüller içinde mikrop hücreleri ile iç içe olan Sertoli hücreleri içerir, tübüllerin duvarları oluşturan peritubuler miyoid hücreler, ve tübüller arasındaki interstisyel boşlukta testosteron üreten Leydig hücreleri.
Spermatogenez sırasında moleküler ve biyokimyasal süreçlerin incelenmesi genellikle testis hücrelerinin karmaşık bir karışımından farklı germ hücre popülasyonlarının ayrılmasını gerektirir. Hücre zenginleştirme için birçok farklı strateji geliştirilmiştir. En başarılı yöntemlerbirimyerçekimi3,4,5,6, karşı akış santrifüj 7 dayalı santrifüj elutriation tarafından STA-PUT hız sedimantasyonu vardır7,8, ve hücreleri DNA içeriğine ve/veya spesifik belirteçlere göre ayıran floresan aktive hücre sıralama (FACS). Bu yöntemler spermatogenez araştırmacıları arasında yaygın olarak kullanılır ve belirli germ hücre tiplerinin verimli zenginleşmesine olanak sağlar. Ancak, bu tekniklerin bir sınırlama onlar uzmanlık gerektiren özel, pahalı donanım gerektirir.
Yuvarlak spermatidler, pachytene spermatositler ve uzamış spermatitler: Burada sunulan fare testislerinin üç en bol hücre popülasyonlarının zenginleştirilmiş popülasyonları izole etmek için basit ve ucuz bir protokoldür. Yuvarlak spermatidler zenginleştirmek için özellikle iyi çalıştığı için bu protokol, yuvarlak spermatidler (MDR) için modifiye yoğunluk gradyanı olarak adlandırılır. MDR yöntemi STA-PUT hız sedimantasyonu ile aynı ilkelere dayanmaktadır, ancak sadece standart laboratuvar ekipmanı gerektirir. Canlı hücreler, dünyanın çekim alanı altında standart bir 50 mL tüp içinde elle hazırlanmış kesintisiz bir büyükbaş serum albumin (BSA) yoğunluk gradyanı ile tortu sağlar. Daha büyük hücreler, mikrop hücrelerinin farklı popülasyonlarını ayıran degrade dendaha hızlı hareket eder. Sedimantasyondan sonra, üç hücre türünün zenginleştirilmiş fraksiyonları el ile toplanır. Bu zenginleştirilmiş hücre popülasyonlarının saflığı STA-PUT ve santrifüj elutriation ile elde edilenlerle karşılaştırılabilir.
Hız sedimantasyonu için BSA gradyan yapımı ve kullanımını kapsayan ek olarak, protokol de seminifer tübüllerden testis hücreleri serbest bırakmak için bir sindirim yöntemi açıklar. Protokol Romrell ve ark.9 tarafından geliştirilen ve kollajenaz IV ve tripsin ile sıralı sindirim içerir değiştirildi. Bir bikarbonat tampon kullanımı ile birlikte sıralı sindirim (yani, Krebs çözüm) büyük ölçüde ayırma ve mikrop hücrelerinin canlılığını artırmak için gösterilmiştir9.
MDR zenginleştirme sırasında, hücreler seminiferous tübüllerin ortamı dışında birlikte yaklaşık 4 saat harcamak ve stresli mekanik kuvvetlere tabi değildir, hangi downstream analizi için son derece uygun hücresel fraksiyonları toplama sağlar. Buna ek olarak, santrifüj elutriation ve STA-PUT benzer, MDR protokolü herhangi bir kimyasal tedavi veya hücrelerin etiketleme gerektirmez, hangi da canlılığını korumaya yardımcı olur. Daha da önemlisi, iki yetişkin fare testisi MDR izolasyonu için yeterli dir ve bu nedenle, bir yetişkin fare hem RNA hem de protein analizi için yeterli zenginleştirilmiş hücreler sağlar. Standart STA-PUT protokolü hücre izolasyonu için 12 yetişkin farenin kullanılmasını önerir6; ancak, önceki deneyimlere dayanarak, başarılı izolasyon üç ila dört yetişkin fareler yapılabilir bilinmektedir. Santrifüj elutriation için yeterli olduğu bildirilen başlangıç malzemesinin en düşük miktarı altı fare testisleri (üç fare)8. Bu nedenle, pahalı özel ekipman ihtiyacını ortadan kaldırmanın yanı sıra, MDR protokolü gerekli laboratuvar hayvan sayısını azaltır.
Protokol
Laboratuvar farelerinin bakımı ve tüm deneyler, laboratuvar hayvanlarının bakımı ve kullanımına ilişkin ilgili yönerge ve yönetmeliklere uygun olarak gerçekleştirilmiştir.
1. Ekipman ve Reaktif Kurulumu
- Su banyosunu 37 °C'ye ayarlayın.
- Hücre kültürünü 34 °C, %5 CO2,%95 nem oranına ayarlayın. Tüp rotator'u kuvöze koy.
NOT: Kuvözlerin iç sıcaklığını değiştirmesi uzun zaman alar. Sürekli olarak 34 °C'de ayarlanmış bir kuluçka makinesi yoksa, deneyden 1 gün önce bir tane ayarlayın. - Uygun miktarda mikroskopi cam slayt hazırlayın ve etiketlendi. Bir gres kalemi ile çapı ~ 1 cm bir halka çizin ve yağ kuru izin.
- 1x Krebs tamponu hazırlayın, pH 7.8 (Tablo 1). 2,5−2,8 adımlarını önceden ısıtmak için 50 mL 1x Krebs ile 34 °C arasında iki konik tüp koyun. 1x Krebs'in geri kalanını 4 °C'de veya buzüzerinde saklayın.
- BSA çözümleri hazırlayın. Önce 1x Krebs tamponunda 2,5 g BSA eriterek Krebs'te %10 (w/v) BSA çözeltisinin 25 mL'sini 25 mL'lik son hacmine kadar hazırlayın. Farklı BSA konsantrasyonları elde etmek için %10'lu BSA çözeltisini 1x Krebs tamponuyla seyreltin(Tablo 2). Tüm BSA çözeltilerini 4 °C'de saklayın.
NOT: İşlemin olduğu gün çözeltiler hazırlayın ve kullanıma kadar 4 °C'de saklayın. - Doğru miktarda tripsin ve kollajenaz miktarını 50 mL konik tüplere tartarak sindirim enzimlerini hazırlayın(Tablo 3).
2. Hayvan Diseksiyonu ve Germ Hücre Süspansiyonhazırlanması
NOT: Bu tamamlamak için yaklaşık 1 saat sürer.
- Servikal çıkık veya CO2 boğulma yoluyla yetişkin bir erkek fareyi (7 hafta veya daha büyük, testis 80−120 mg ağırlığında, sınma ve yaşa bağlı olarak) kurban edin.
- % 70 etanol ile farenin ventral karın sprey. Abdominopelvik boşluğu makasla açarak V şeklinde bir açıklık haline getirin.
- Forceps ile epididymal yağ yastığı çekerek, testisler bulmak ve makas ile kaldırın. Tunica albuginea rahatsız kaçının. Testisleri 1x Krebs içeren 6 cm'lik petri kabına yerleştirin.
- Testisleri dekapsulate ve tunica albuginea atın. Seminiferous tübülleri, forcep'lerle hafifçe alay ederek hafifçe dağıtın.
- Seminiferous tübülleri 2 mL taze hazırlanmış kollajenaz çözeltisi içeren 50 mL konik bir tüpe aktarmak için forseps kullanın(Tablo 3).
- 37 °C'lik su banyosundaki tübülleri 3 dk. tüpü sallayarak hafifçe çalkalayın.
NOT: Serbestçe yüzen tübüller interstisyel hücrelerin kaldırılması nedeniyle 3 dakika içinde oluşmalıdır. Testis hücrelerinin fizyolojik sıcaklığı 34 °C'dir; bu nedenle, uzun sindirim genellikle bu sıcaklıkta yapılır. Ancak, kısa 3 dk sindirim 37 °C (üretici tarafından önerilen sıcaklık) yapılabilir. 34 °C kullanılırsa, sindirim süresinin yeniden optimize edilmesi gerektiğini unutmayın. - En az 40 mL sıcak 1x Krebs ekleyin ve tübüllerin oda sıcaklığında (RT) tortu (~1 dk) olmasını bekleyin. Supernatant çıkarın ve 1x tekrarlayın.
- 25 mL taze hazırlanmış tripsin çözeltisi(Tablo 3),tüpü 34 °C inkübatörün içine tüp rotatörüne yerleştirin ve 15−20 dakika (~15 rpm) kuluçkaya yatırın. Düzensiz tübüllerin durumunu kontrol edin. Çözüm bulutlu hale geldikten sonra ve sadece küçük tübül parçaları kaldı, tüpü buza yerleştirin ve hemen bir sonraki adıma geçin.
NOT: Aşırı hazımsızlık ve hücre lisisinden kaçınmak için, hızla aşağıdaki yıkama adımlarına geçin. Bazı protokoller fetal sığır serumu (FBS) ile tripsin inaktive sini içerir. Bu protokolde, FBS tedavisi atlanır ve bunun yerine, tripsin hemen santrifüj ve soğuk 1x Krebs ile sonraki yıkar tarafından kaldırılır. - Çözeltiyi 40 m'lik hücresüzden buz üzerinde yeni bir 50 mL konik tüpe filtreleyin.
- 4 °C'de 5 dk için 600 x g santrifüj ve hücreler.
NOT: Çok güçlü bir kuvvetle santrifüj hücrelere zarar verebilir. - Dikkatle dışarı dökerek supernatant çıkarın.
- 1x Krebs geri kalanında hücreleri yeniden askıya almak için hücre pelet dokunun.
- Resuspended hücrelere en az 40 mL soğuk 1x Krebs ekleyin.
- Adımları 2.10 ve 2.11'i yineleyin.
- Hücreleri yeniden askıya almak için hücre peletile tüp dokunun. 1x Krebs'e %0,5 BSA 1 mL ekleyin ve kesme pipet ucu yla çözeltiyi yukarı ve aşağı boruhaline vererek hücreleri yeniden askıya alın. Kabarcıklar yapmaktan kaçının.
- Son olarak, son hacmi ~3 mL olacak şekilde 1x Krebs'e %0,5 BSA'dan 1−3 mL ekleyin. 40 μm hücreli süzgeç aracılığıyla germ hücre süspansiyon filtrate ve BSA gradyan hücreleri yükleme ye hemen devam edin.
3. Kesintili BSA Gradyan Yoluyla Germ Hücrelerinin Ayrılması
NOT: Bu bölümün tamamlanması yaklaşık 2 saat sürer. Yıkama adımları sırasında (adım 2.10−2.14) hücreleri ön işlem hazır olur olmaz yüklemek için sürekli bsa degradesini hazırlamaya başlayın.
- Tüpün bir tarafını görebilmeniz için 50 mL'lik bir tüpü dikey olarak buz üzerinde barındırın. Alternatif olarak, protokolü 4 °C'de soğuk bir odada çalıştırın, bu durumda buz gerekmez.
- 10 mL'lik serolojik pipetin ucunu ucundan yaklaşık 5−10 mm kesin ve daha büyük bir diyafram açıklığı elde edin(Şekil 1A), ve pipet denetleyicisine monte edin(Şekil 1C).
NOT: Bu, farklı BSA çözümlerinin istifleme kolaylaştırır pipetleme sırasında hızını azaltacaktır. Alternatif olarak, pürüzsüz bir pistonlu 1 mL mekanik pipet kullanın ve pipet uçlarını yaklaşık 3 mm çapında diyafram açıklığıyla kesin(Şekil 1B). - 50 mL borunun altına %5 BSA çözeltisi 5 mL boru ile başlayın.
- %5 çözeltinin üzerine %4 BSA çözeltisinin 5 mL'ini yavaşça pipet. Pipetin kesme ucu ile %5'lik çözeltinin yüzeyine hafifçe dokunarak başlayın ve iki çözeltiyi yüzeye dikkatlice tutarak pipet ucunun batırılmasını sağlamayın.
NOT: Bu adımın sonunda iki katman arasında net bir çizgi görülmelidir. - Diğer BSA çözümleriyle birlikte 3.4 adımını tekrarlayın %5'ten %1'e kadar kesintisiz bir degrade eldeedin (Şekil 1D).
- Tek hücreli süspansiyonu rahatsız etmeden degradenin üzerine dikkatlice yükleyin. Hücrelerin 4 °C'de veya buz üzerinde 1,5 saat boyunca degradeden geçirmelerini sağlar.
4. Zenginleştirilmiş Germ Hücre Fraksiyonları Koleksiyonu
NOT: Bu bölümün tamamlanması yaklaşık 30 dakika sürer.
- 1 mL mekanik pipete üzerine 1 mL'lik bir pipet ucu monte edin ve diyafram açıklığı ~3 mm çapında olacak şekilde ucu kesin(Şekil 1B).
- BSA degradesinin üstünden başlayarak 1,5 mL'lik ayrı tüplerde ~1 mL kesirleri dikkatlice toplayın ve buzüzerinde saklayın. Tüpleri kesirlerle aynı sırada numaralandırın.
NOT: Bu noktada, hücre süspansiyonları içeren ~ 28 tüpler bir dizi olmalıdır. Pürüzsüz bir pistonlu 1 mL mekanik pipet kullanın ve BSA degradesini bozma riskini en aza indirmek için pipet uçlarını kesin. - 4 °C'de 10 dk için 600 x g'de germ hücre fraksiyonlarını santrifüj edin.
- Pelet rahatsız etmemeye dikkat edin, supernatant en atın ve tüp flicking hücre pelet resuspend. Her tüpe 1 mL buz gibi 1x Krebs tamponu ekleyin ve santrifüjü tekrarlayın.
NOT: BSA akış aşağı analizine müdahale ederse yıkama adımını tekrarlayın. - Supernatant çoğu atın ama son yıkamadan sonra ~ 100 μL bırakın. Hücre peletini dikkatlice yeniden askıya alın.
NOT: Hücreleri dikkatle yeniden susulamak, bu çözeltiden alınan numunenin verilen fraksiyonun tüm hücrelerini temsil ettiğini garanti eder. Slaytları hazırlarken hücre süspansiyonlarını buzüzerinde tutun.
5. Hücre Kesirlerinin Analizi
NOT: Analizin tamamlanması 2 saat sürer.
- Birer birer, pipet 20 μL 4% paraformaldehit (PFA) numaralanmış bir mikroskopslayt üzerinde her gres kalem halkası içinde.
- Hemen ilgili fraksiyondan resuspended hücre süspansiyon 2 μL ekleyin. Her kesir için tekrarlayın.
NOT: Slaytları hazırlarken, tüm hücre süspansiyonlarını buzda tutun. - Slaytları RT'de 1 saat ila bir gece (O/N) kurutun.
NOT: Bu adımda, her fraksiyondan bir örnek alındıktan sonra, hücreler aşağı analizleri veya depolama için işlenebilir (bölüm 6). - 1x PBS ile slaytlar bir kez durular ve 4',6-diamidino-2-fenilindole (DAPI) (Malzeme Tablosuile montaj orta ile monte.
- Bir floresan mikroskobu altında slaytlar analiz belirli germ hücre tipi her fraksiyonu zenginleştirilmiş olduğunu tahmin etmek.
NOT: Farklı hücre tipleri DAPI boyama ile görselleştirilmiş karakteristik nükleer morfolojisi ile tanınabilir. Şekil 2 Uzamış spermatitler, yuvarlak spermatitler ve pachytene spermatositlerle zenginleştirilmiş temsili fraksiyonlar gösterir. Yuvarlak spermatid çekirdeği küçük (çapı 6−7 μm) ve yuvarlaktır(Şekil 2A). Fare yuvarlak spermatid çekirdekleri de kromocenter denilen tek, yuvarlak heterokromatin yapısı ile karakterizedir. Uzamış spermatidlerin çekirdekleri tipik bir uzatılmış şekle ve kromatin yoğuşması nedeniyle nükleer boyutu azalmıştır(Şekil 2A). Pachytene spermatosit çekirdekleri çok daha büyük (çapı 10 μm'den fazla) ve daha düzensiz şekil, yoğun paketlenmiş kromatin alanları boyunca dağıtılan (Şekil 2A). -
Gerekirse, farklı hücre tiplerinin tanınmasını desteklemek için DAPI boyama ek olarak immünboyama gerçekleştirin.
- Bu durumda, bir gres kalemi halkasının içine 20 μL sabitleme çözeltisi (%4 PFA ve PBS'de %0,1 noniyonik yüzey aktif madde) ile 2 μL hücre süspansiyonu yayılır. Slaytlar kurutultuktan sonra hücreleri RT'de 10 dk boyunca %4 PFA ile düzeltin.
- PBS ile durulayın, sonra PBS'de %0.1 noniyonik yüzeyaktif madde ile 5 dk. PBS ile durulayın ve 100 mM NH4Cl'de slaytları 5 dk boyunca kuluçkaya yatırarak kalan PFA'ları etkisiz hale getirin.
- PBS ile durulanın ve spesifik primer antikorlar ve florokrom etiketli ikincil antikorlarla bloke ve kuluçkalardan oluşan standart bir immünorfloresan protokolüne devam edin. Slaytları DAPI(Malzeme Tablosu)ile antifade montaj antile monte edin ve 24 saat boyunca ayarlamalarını bekleyin.
NOT: Primer antikor inkübasyonları için yararlı belirteçlere örnek olarak, akrozomu yuvarlak ve uzamış spermatidler, anti-DDX4 antikorları (blokaj çözeltisinde 1:200) tek bir etiketle lekeleyen yer fıstığı agglutinin (PNA; 1:2,000 bloklama çözeltisinde) verilebilir. yuvarlak spermatidlerde sitoplazmik granül ve pachyten spermatositlerde cinsiyet bedenlerini tanıyan anti-γH2AX antikor (blokaj çözeltisinde 1:100). Kesirlerin immünoresans analizi örnekleri için temsili sonuçlara ve Şekil 2C,D'ye bakın.
6. Depolama Için Kalan Numunelerin İşlenmesi
NOT: Bölüm 6 tamamlamak için yaklaşık 20 dakika sürer.
- Her bir kesirden bir numune alındıktan sonra, her fraksiyona 1 mL buz gibi 1x Kreb ekleyin ve hücreleri 4 °C'de 10 dakika boyunca 600−13.000 x g'de santrifüj edin.
NOT: Düşük hızlı santrifüj gevşek bir pelet ile sonuçlanır, bu da 1x Krebs'in tamamen çıkarılmasını zorlaştırırken, yüksek hızlı bir santrifüj hücrelere zarar verebilir. Downstream protokolünün belirli gereksinimlerine göre santrifüj hızını seçin. - Supernatant'ı çıkarın ve atın ve tercih edilen akış aşağı analizine devam edin.
NOT: Bu noktada hücreler sıvı nitrojende dondurulabilir ve -70 °C'de depolanabilir. Bir kez bu tekniği aşina, doğrudan tercih downstream protokolü ile devam etmek mümkündür, ama her zaman bir örnek almak ve her kesir saflığını sağlamak için tavsiye edilir. Toplam RNA ayıklanabilir, ölçülebilir ve ters transkripsiyon polimeraz zincir reaksiyonu (PCR) ve RNA sıralama gibi yöntemlerle analiz edilebilir. Total protein özleri de hangi immünopresipitasyon veya batı lekeleme analizi yapılabilir(Şekil 3)hazırlanabilir.
Sonuçlar
Bir germ hücre tipinin yeterli zenginleşmesi genellikle % 806'nınüzerinde olarak kabul edilir. MDR protokolü özellikle yuvarlak spermatidleri zenginleştirmek için iyi çalışır. Bu teknik kullanılarak rutin olarak %90 oranında saf yuvarlak spermatid elde edilebilir. Pachytene spermatositlerin optimal fraksiyonları ve uzamış spermatitler sırasıyla ~%75 ve ~%80'e kadar zenginleştirilmiştir. Uzayan spermatidler degradenin üstünde kalma eğilimindedirler ve ilk fraksiyonu ile toplanır. Gösterilen örnekte, kesir 1 uzaan spermatidlerin ~% 80 'ini içeriyordu(Şekil 2B). Bu teknikle elde edilen uzayan spermatidlerin çoğunda yoğunlaşmış çekirdekbulunurken, yoğun olmayan erken uzayan spermatidler azdır(Şekil 2A). Aşağıdaki kesirler zenginleştirilmiş yuvarlak spermatidler içerir. Örnekte, yuvarlak spermatidlerin zenginleştirme si, 2, 3 ve 4 kesirlerinde %90'dan fazla, %80'in üzerindeki zenginleştirme ise yedi kesirte (2−8)(Şekil 2B)olarak görüldü. Onların büyük boyutu nedeniyle, pachytene spermatositler daha hızlı tortu ve son toplanır. Arınma örneğinde, zenginleştirme 14 ve 15 kesirlerinde %75 civarındaydı(Şekil 2B).
DAPI boyama ile görselleştirilen nükleer morfoloji genellikle hücrelerin tanınması için yeterli iken, analiz desteklemek için immünororeskence analizi yapılabilir. PNA, yuvarlak ve uzamış spermatidlerin gelişen akrozomlarını lekeler ve akrozomal görünüm yuvarlak spermatidleri 1−8 diferansiyasyon10'un1−8. Ayırt edici PNA lekeli uzatan ve yuvarlak spermatidler nükleer şekil farklılıklarına dayanır(Şekil 2C, sol panel). Anti-DDX4 antikor, her yuvarlak spermatidin sitoplazmasında tek bir DDX4-pozitif perinükleer granül, kromatoid cisim (CB) görselleştirdiği için yuvarlak spermatid fraksiyonları için yararlı bir belirteçtir. Bu CB'ye özgü boyama spermatositlerde daha yaygın olarak dağılmış sitoplazmik boyamadan ayırt etmek kolaydır(Şekil 2C, orta panel). Pachytene spermatositler, nükleer seks vücudunu özellikle ilk meyyolik bölünmenin pachytene evresinde(Şekil 2C, sağ panel) etiketleyen anti-γH2AX antikorları ile tanınabilir. Bu arıtmada PNA boyama, MDR zenginleştirilmiş yuvarlak spermatid fraksiyonlarının farklılaşmanın çeşitli adımlarında yuvarlak spermatid karışımı içerdiğini, bunların hepsinin imza yapısını içerdiğini ortaya koymuştur, DDX4-pozitif CB (Şekil 2D, RS fraksiyonu). Anti-γH2AX daha fazla kesir 16(Şekil 2D, PSpc fraksiyonu) zenginleştirme pachytene spermatositler doğruladı.
Hücre sayımı yuvarlak spermatid ve pachyten spermatosit fraksiyonları hücre sayısı çeşitli downstream analizleri için yeterli olduğunu ortaya koymuştur. Yuvarlak spermatid fraksiyonları (5−8) her biri 2.5 x 106 hücre civarındadır. Bu nedenle, bu kesirler havuzlama ile, 10 milyondan fazla hücre elde etmek mümkündür. Pachytene spermatosit fraksiyonları (14 ve 15) genellikle biraz daha az hücre içeriyordu. Bu izolasyonda, kesir başına yaklaşık 1,5−2.0 x 106 hücre sayılmıştır. İlk kesir 0.75 x 106 uzayan spermatid içeriyordu.
Şekil 3A'dagösterildiği gibi, kesirlerin çoğundan elde edilen toplam RNA miktarı 0,5−2,5 μg arasında değişmekteolup, ters transkripsiyon PCR, RNA sıralaması veya bir jel üzerinde RNA'yı görselleştirme gibi aşağı RNA analizleri için yeterlidir. Her fraksiyondan elde edilen protein miktarı tipik olarak 20−140 μg(Şekil 3B)arasında değişmektedir ve bu da birkaç batı lekesi için yeterlidir. Toplanan fraksiyonlardan tam hücre lisatları hazırlandı ve batı leke analizi pachytene spermatositleri ve yuvarlak spermatidlerin yanı sıra her yerde yaygın olarak ifade edilen DDX4, PIWIL1 ve PIWIL2 antikorları kullanılarak yapıldı. gliserindehit 3-fosfat dehidrogenaz (GAPDH) ifade.
Bu protokolde, tek fraksiyonlardan elde edilen protein lisatlarının %10'u standart batı leke ayarında tüm bu proteinleri açıkça tespit etmek için yeterliydi(Şekil 3C). Bir fraksiyondaki protein miktarının piwil1'e karşı antikor kullanarak immünopredididipite için yeterli olduğu ve co-immünopprepititated PIWIL2'nin saptanması için yeterli olduğu gösterilmiştir (Şekil 3D). Ayrıca, bu protokol başarıyla pachytene spermatositler ve yuvarlak spermatidler kontrol ve genetik olarak değiştirilmiş fareler den kantitatif ters transkripsiyon PCR 11 gibi downstream uygulamaları için zenginleştirilmiş fraksiyonları elde etmek için kullanılmıştır ve yüksek iş elde RNA sıralama12.

Şekil 1: Kesintili bir BSA degradesinin hazırlanması. (A) Degradehazırlanması için 5 mL serolojik pipet ucu. (B) Sedimantasyon sonrası germ hücre fraksiyonlarının degradesinin hazırlanması ve toplanması için 1 mL pipet ucu. (C) Degradenin hazırlanması için gerekli ekipman. (D) Kesintili BSA yoğunluk gradientinin %5'ten (alt) %1 'e (üstte) BSA çözeltisine yanal görünümü; %2 ve %4'lük BSA çözümleri daha iyi görselleştirme için mavi renktedir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
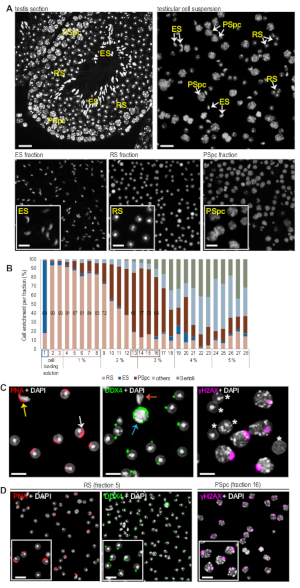
Şekil 2: Toplanan hücre fraksiyonlarının temsili görüntüleri ve zenginleştirme analizi. (A) DAPI lekeli testis hücreleri. Üst sıra, PFA'nın sabit, parafingömülü testis kesitinin (solda) veya süspansiyonda (sağda) sağlam seminiferous epitelindeki testis hücrelerini gösterir. Alt sıra zenginleştirilmiş uzamış spermatidler kesirleri gösterir (ES), yuvarlak spermatidler (RS), veya pachytene spermatositler (PSpc). Ölçek çubukları = üst satır için 20 μm ve alt sıranın insets için 10 m. (B) Her fraksiyonda farklı germ hücre türlerinin göreli nicelliği. Hücreler ImageJ yazılımı kullanılarak elle sayıldı ve RS, ES, PSpc, Sertoli hücreleri ve diğer hücreler olarak sınıflandırıldı. Degradedeki BSA'nın kesir sayıları ve ilgili yüzdeleri x ekseninde gösterilir. (C) Testis hücrelerinin immünororesans analizi. Sol panel: rhodamine etiketli PNA hem ES (sarı ok) hem de RS (beyaz ok) akrozom lekeleri. Orta panel: DDX4 antikor, spermatositlerde (mavi ok) daha diffüz sitoplazmik sinyalden ayırt etmek kolay olan RS'de tek bir perinükleer granülle lekelenir. ES'de (turuncu ok) DDX4 sinyali algılanmadı. Sağ panel: γH2AX antikor karakteristik nükleer seks vücut pachytene spermatositler sadece mevcut tanır (γH2AX-negatif hücreler beyaz yıldız ile işaretlenmiş). Ölçek çubukları = 10 μm. (D) MDR zenginleştirilmiş hücre fraksiyonları, her kesitteki hücre zenginleştirmesini daha da doğrulamak için PNA (RS fraksiyonu), anti-DDX4 (RS fraksiyonu) ve anti-γH2AX (PSpc fraksiyonu) ile etiketlenmiştir. Ölçek çubukları = 10 μm. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
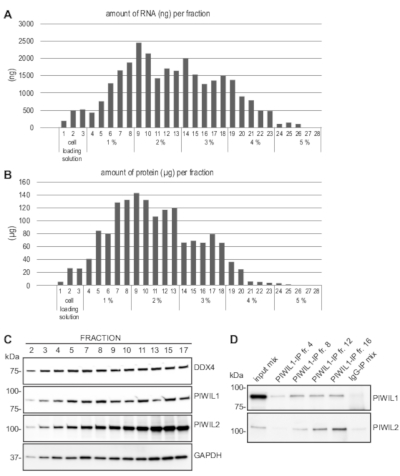
Şekil 3: MDR hücre zenginleştirme sonrası downstream analizleri. (A) RNA temsili bir MDR hücre zenginleştirme ve nicel sonra her fraksiyonu ayıklanır. Degradedeki BSA'nın kesir sayıları ve ilgili yüzdeleri x ekseninde gösterilir. (B) Proteinler her fraksiyondan radyoimmünananan analiz (RIPA) tamponundaki hücre peleti ölçüldükten sonra çıkarıldı. (C) Tüm hücre proteini özleri DDX4, PIWIL1, PIWIL2 ve GAPDH'ye karşı antikorlar kullanılarak batı lekeleme ile hazırlandı ve analiz edildi. Lysatın %10'u belirtilen her bir kesitten yüklenmiş. (D) İmmünoenf, anti-PIWIL1 ve anti-PIWIL2 antikorları ile batı lekelenmesi ile birlikte anti-PIWIL1 kullanılarak endike fraksiyonlardan yapıldı. Giriş örneği farklı fraksiyonlardan protein lisatlarının bir karışımını içerir ve tavşan IgG kullanılarak kontrol immünopresidümüksiyonu (IP) de karışık bir lysate'den yapılmıştır. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
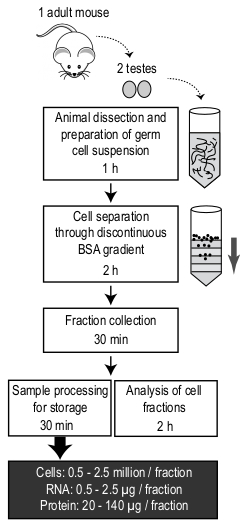
Şekil 4: MDR protokolünün şematik gösterimi ve her adımın tamamlanması için gereken süre. Başlangıç materyali yetişkin bir fareden iki testisten oluşur. Ortalama hücre sayısı ve bir fraksiyondan elde edilen RNA ve protein miktarı belirtilir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Arabellek | Reaktif | Hazırlık | Depolama |
| Krebs arabellek (10x) | 3.26 g KH2PO4 | H2O, filtre 0.22 μm ve otoklav ile 2 L getirin. | 4 °C'de birkaç ay saklanabilir |
| 139.5 g NaCl | |||
| 5.89 g MgSO4•7H2O | |||
| 50 g dekstroz | |||
| 3,78 g CaCl2•2H2O | |||
| 7,12 g KCl | |||
| Krebs arabelleği (1x) | 4.24 g NaHCO3 | NaHCO3 ila 100 mL H2O çözün, 10x Krebs tampon 200 mL ekleyin ve H2O ile 2 L getirmek. | Taze hazırlanacak |
| 200 mL 10x Krebs tampon |
Tablo 1: Krebs tamponunun hazırlanması.
| BSA konsantrasyonu (w/v) | %10 BSA çözeltisi | 1x Krebs tampon |
| 0.50% | 0,5 mL | 9,5 mL |
| 1% | 1 mL | 9 mL |
| 2% | 2 mL | 8 mL |
| 3% | 3 mL | 7 mL |
| 4% | 4 mL | 6 mL |
| 5% | 5 mL | 5 mL |
Tablo 2: BSA çözümlerinin hazırlanması.
| Sindirim çözeltisi | Çalışma konsantrasyonu | Reaktif | Hazırlık |
| Kollajenaz | 1 mg/mL | Kollajenaz IV | 50 mL konik tüp kollajenaz IV 2 mg tartın ve sindirim (adım 2.3) hemen önce sıcak 1x Krebs tampon 2 mL ekleyin. |
| Tripsin | 0.6 mg/mL | Tripsin | 50 mL konik tüpe 15 mg tripsin tartın ve sindirimden hemen önce 25 mL ılık 1x KREBS tamponu ve 40 μL DNase I ekleyin (adım 2.6). |
| >3.2 ku/mL | DNase I |
Tablo 3: Sindirim enzimlerinin hazırlanması.
Tartışmalar
Burada sunulan yuvarlak spermatidler, pachytene spermatositler zenginleştirilmiş popülasyonları izole etmek için basit ve ucuz bir protokol, ve standart laboratuvar ekipmanları kullanarak uzamış spermatidler (Şekil 4gösterilen protokole genel bakış). Hiçbir uzmanlık veya pahalı makine gerekli olmasına rağmen, doku sindirimi sırasında göz önünde bulundurulması gereken bazı kritik adımlar vardır, degrade inşaat, ve degrade üzerine hücre süspansiyon yükleme.
Mikrop hücreleri art arda iki enzimatik sindirim tarafından seminifer tübüllerden salınır. Kollajenaz IV ile ilk sindirim interstisyel hücreleri kaldırarak seminifer tübülleri ayırır. Uzun sindirim süresi tübüllere zarar verebilir ve spermatid kaybına yol açabilir, çünkü (bu adımda tübüllerden salgılanırsa) aşağıdaki adımlarda atılırlar. Tripsin ile ikinci sindirim adımı seminifer tübüllerden mikrop hücrelerini salgılar. Zaman zaman hücre lisisi olabilir ve genellikle serbest genomik DNA nedeniyle bazı kümeler oluşabilir. Bu daha kötü canlılık, artan hücre lisis ve kümelenme yol açabilir gibi sindirim önerilen süre veya sıcaklık aşılması tavsiye edilmez. Hafif kümelenme oluşursa, kümeler yoksayılabilir. Ancak, önemli kümelenme ve hücre kaybı durumlarında, tripsin sindirim süresi veya konsantrasyon azaltılmalıdır. Ayrıca tripsin enzimatik aktivitesi toplu gruplar arasında ve depolama uzun süre boyunca değişebilir unutulmamalıdır. Tripsin sindirimi sırasında DNase I miktarı da aşırı kümeleri kaldırmak için artırılabilir, ancak bu ikincil bir çözüm olarak kabul edilmelidir. Kümelenmiş hücreler daha hızlı tortu, kesirler kontamine ve gradyan bozan, çünkü ön tedavi sonunda homojen tek hücreli süspansiyon elde etmek önemlidir.
Degradenin oluşturulması için biraz pratik gerekebilir. Pipet kumandalı 5 mL pipet ucu kullanılarak rahatsızlık varsa, düz bir pistonlu normal 1 mL mekanik pipet kullanılması ve pipet uçlarının ~3 mm çapında bir diyafram açıklığına kesilmesi tavsiye edilir(Şekil 1B). BSA çözümlerinin daha geniş bir diyafram açıklığı ve sorunsuz bir şekilde yüklenmesi degradenin karıştırılma riskini azaltacaktır. Düzgün bir şekilde hazırlandığında, farklı kırılma endeksleri nedeniyle komşu BSA çözümleri arasındaki sınırları görmek mümkündür. Degrade doğrudan kullanımdan önce üretilmelidir. Ayrıca herhangi bir küçük sallayarak veya titreşim degrade rahatsız olabilir unutulmamalıdır, bu nedenle degrade rahatsız olmayacak bir ortamda ayarlanmalıdır.
Hücre süspansiyonunun degradeye yüklenmesi çok dikkatli bir şekilde yapılmalıdır. Yüklemeden sonra, hücre süspansiyongrad üstünde kalmalıdır, hangi hücreler yavaş yavaş ilk katman yoluyla tortu başlayacak. Büyük hücre gruplarının degradede hızlı hareket ettiğini görülürse, hücreler büyük olasılıkla dikkatlice askıya alınmadı veya aşırı kümelenme oldu. Hücreler yükleme üzerine kesintili BSA degradesinin üstünde kalmaz, ancak hemen %1 ile %2 BSA katmanları (adım 3.6) arasında batarlarsa, hücre süspansiyonu büyük olasılıkla çok yoğundur. Bu protokol başlangıç malzemesi olarak yetişkin bir farenin iki testisi (80-120 mg/testis) kullanılarak optimize edilmiştir; ancak, azaltılmış sayıda başlangıç malzemesi kullanılarak başarılı yalıtımlar gerçekleştirilmiştir. Protokolü yükseltmek ve daha yüksek sayıda testisten daha zenginleştirilmiş mikrop hücreleri elde etmek için, degradeli daha fazla 50 mL tüp tanıtılmalıdır.
Protokol başlangıçta yetişkin fare testislerinden haploid yuvarlak spermatidleri zenginleştirmek için geliştirilmiş ve optimize edilmiş ve yuvarlak spermatid fraksiyonlarının saflık %90'dan fazla olması beklenmektedir. Son derece saf yuvarlak spermatid fraksiyonlarına ek olarak pachytene spermatositlerin zenginleşmesi ve uzaması spermatidlerinin zenginleşmesi için tatmin edici sonuçlar elde edildi. Eritrositlerin uzaan spermatid fraksiyonlarını kontamine edebileceği unutulmamalıdır ve bunların varlığının downstream analizlerine müdahale etmesi bekleniyorsa ortadan kaldırmak için daha ileri adımlar atılmalıdır. MDR protokolünü kullanarak erişkin farelerden premeiyotik veya erken meyolitik hücreler (pachytene fazı öncesinde) gibi diğer hücre tiplerini zenginleştiremedik.
Ayrıca, STA-PUT sedimantasyon başarıyla spermatogonia veya preleptoten, leptoten ve zigot spermatositler doğumdan sonra verilen zaman noktalarında toplanan çocuk testisleri kullanarak zenginleştirilmiş fraksiyonları elde etmek için kullanılmıştır13. Bu yaklaşım, spermatogenezin ilk dalgasısırasında bu hücre tiplerinin görünümünden yararlanır. Aynı yaklaşım büyük olasılıkla MDR zenginleştirme için uygulanabilir, ancak henüz uygulamada test edilmemiştir. Farklılaşmanın belirli aşamalarında premeiyotik ve meyotik hücrelerin saflaştırılması için iyi bir seçenek olan bir diğer yöntem de, varlığa özgü belirteçlere dayalı belirli hücre tiplerinin izolasyonuna izin verme avantajına sahip olan FACS'tır14 ,15,16,17.
Genel olarak, MDR hız sedimantasyonu germ hücre zenginleştirme için yararlı bir yöntem olarak hizmet vermektedir. Bu yöntem, zenginleştirilmiş hücrelerin saflığı veya miktarı açısından diğer köklü yöntemlerden üstün olmasa da, açık avantajları basitliği ve düşük kurulum maliyetleridir. Bu, gerekli başlangıç malzemelerinin düşük miktarı ile birlikte, bu protokolü spermatogenez alanında araştırmacılar ve özel donanım veya hayvanların büyük gruplar yatırım yapmak istemeyen diğer alanlarda araştırmacılar için harika bir seçenek hale.
Açıklamalar
Yazarların açıklayacak bir şeyi yok.
Teşekkürler
Tüm Kotaja laboratuvar üyelerine protokolün geliştirilmesi ne kadar katkıları ve araştırma projelerinde protokolün aktif kullanımı ve test edilmesi için teşekkür ederiz. Özellikle jan Lindström'ün protokolü optimize etmedeki katkıları için teşekkür ederiz. Bu çalışma Finlandiya Akademisi, Sigrid Jusélius Vakfı ve Turku Moleküler Tıp Doktora Programı tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | Preference of researcher | ||
| AlexaFluor488 donkey anti-rabbit IgG | Thermo Fisher Scientific | A-21206 | |
| AlexaFluor647 donkey anti-mouse IgG | Thermo Fisher Scientific | A-31571 | |
| Bovine Serum Albumin (BSA) | Sigma | A9647 | |
| CaCl2·2H2O | Preference of researcher | ||
| Collagenase IV | Sigma | C5138 | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| DDX4 antibody | Abcam | ab13840 | |
| Dextrose | Preference of researcher | ||
| DNase I | Worthington | LS006355 | |
| GAPDH | HyTest | 5G4 | |
| HRP-linked anti-mouse IgG | GE Healthcare Life Sciences | NA931 | |
| HRP-linked anti-rabbit IgG | GE Healthcare Life Sciences | NA934 | |
| KCl | Preference of researcher | ||
| KH2PO4 | Preference of researcher | ||
| MgSO4·7H2O | Preference of researcher | ||
| NaCl | Preference of researcher | ||
| NaHCO3 | Preference of researcher | ||
| NH4Cl | Preference of researcher | ||
| Pierce BCA protein assay kit | Life Technologies | 23227 | |
| PIWIL1 | Cell Signaling Technology | G82 | |
| PIWIL2, clone 13E-3 | Millipore | MABE363 | |
| Prolong Diamond Antidafe Mountant with DAPI | Thermo Fisher Scientific | P36962 | for Alexa Fluor immunostainings |
| Rabbit IgG | Neomarkers | NC-100-P | |
| Rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| RIPA buffer | 50 mM Tris-HCl, pH 7.5, 1% NP-40, 0.5% w/v sodium deoxycholate, 0.05% w/v SDS, 1 mM EDTA, 150 mM NaCl, 1x protease inhibitor cocktail, 0.2 mM PMSF and 1 mM DTT | ||
| TRIsure | Bioline | BIO-38033 | |
| Triton X-100 | Preference of researcher | nonionic surfactant | |
| Trypsin | Worthington | LS003703 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | for standard DAPI analysis of cell fractions |
| γH2AX antibody | Millipore | 05-636 | |
| 0.22 µm filter | Sartorius | Sartolab BT 180C6 | or equivalent |
| 1 mL mechanical pipette | Preference of researcher | ||
| 1.5 mL or 2 mL tubes | Preference of researcher | ||
| 40 µm cell sieves for 50 mL tubes | Greiner Bio-One | 542040 | or equivalent cell strainer |
| 5 mL serological pipettes | Sarstedt | 86.1254.001 | or equivalent |
| 50 mL conical tubes | Preference of researcher | ||
| 6 cm Petri dishes | Preference of researcher | ||
| Cell culture incubator | Preference of researcher | ||
| Centrifuge for 50 mL tubes | Preference of researcher | ||
| Grease pen for microscopy glass slides | Preference of researcher | ||
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | or equivalent cell rotator |
| Microdissection forcepts | Preference of researcher | ||
| Microdissection scissors | Preference of researcher | ||
| Microscopy glass slides and coverslips | Preference of researcher | ||
| Nanodrop 1000 | Thermo Scientific | ||
| Pipetboy Acu 2 | Integra | 155 000 | or equivalent pipette controller |
| Refrigerated centrifuge for 1.5 mL tubes | Preference of researcher | ||
| Tips for 1 mL mechanical pipette | Preference of researcher | ||
| Water bath | Preference of researcher | ||
| Widefield fluorescence microscope | Preference of researcher |
Referanslar
- Hess, R. A., Renato de Franca, L. Spermatogenesis and cycle of the seminiferous epithelium. Advances in Experimental Medicine and Biology. 636, 1-15 (2008).
- Lehtiniemi, T., Kotaja, N. Germ granule-mediated RNA regulation in male germ cells. Reproduction. 155 (2), R77-R91 (2018).
- Lam, D. M., Furrer, R., Bruce, W. R. The separation, physical characterization, and differentiation kinetics of spermatogonial cells of the mouse. Proceedings of the National Academy of Sciences of the United States of America. 65 (1), 192-199 (1970).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Experimental Cell Research. 79 (1), 213-227 (1973).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods in Molecular Biology (Clifton, N.J.). 558, 279-297 (2009).
- Bryant, J. M., Meyer-Ficca, M. L., Dang, V. M., Berger, S. L., Meyer, R. G. Separation of spermatogenic cell types using STA-PUT velocity sedimentation. Journal of Visualized Experiments. (80), e50648(2013).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. Journal of Cellular Physiology. 86 (1), 177-189 (1975).
- Barchi, M., Geremia, R., Magliozzi, R., Bianchi, E. Isolation and analyses of enriched populations of male mouse germ cells by sedimentation velocity: the centrifugal elutriation. Methods in Molecular Biology (Clifton, N.J.). 558, 299-321 (2009).
- Romrell, L. J., Bellvé, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Developmental Biology. 49 (1), 119-131 (1976).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Korhonen, H. M., et al. DICER Regulates the Formation and Maintenance of Cell-Cell Junctions in the Mouse Seminiferous Epithelium. Biology of Reproduction. 93 (6), 139(2015).
- Da Ros, M., et al. FYCO1 and autophagy control the integrity of the haploid male germ cell-specific RNP granules. Autophagy. 13 (2), 302-321 (2017).
- Bellvé, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. The Journal of Cell Biology. 74 (1), 68-85 (1977).
- Mays-Hoopes, L. L., Bolen, J., Riggs, A. D., Singer-Sam, J. Preparation of spermatogonia, spermatocytes, and round spermatids for analysis of gene expression using fluorescence-activated cell sorting. Biology of Reproduction. 53 (5), 1003-1011 (1995).
- Suter, L., Koch, E., Bechter, R., Bobadilla, M. Three-parameter flow cytometric analysis of rat spermatogenesis. Cytometry. 27 (2), 161-168 (1997).
- Lima, A. C., et al. Multispecies Purification of Testicular Germ Cells. Biology of Reproduction. 95 (4), 85-85 (2016).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry. Part A: the Journal of the International Society for Analytical Cytology. 65 (1), 40-49 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır