Method Article
Arricchimento di spermatociti pachytene e Spermatidi da test del mouse utilizzando attrezzature di laboratorio standard
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Presentato qui è un protocollo per arricchire gli spermatociti pachytene, gli spermatidi rotondi e gli spermatidi allunganti dei testicoli del topo adulti utilizzando un gradiente didiscontinuo di densità di albumina del siero bovino con attrezzature di laboratorio standard.
Abstract
Per caratterizzare ogni fase della spermatogenesi, i ricercatori devono separare diverse sottopopolazioni di cellule germinali dai testicoli. Tuttavia, isolare le popolazioni discrete è difficile, perché il testicolo adulto contiene un complesso mix di cellule germinali da tutti i passaggi della spermatogenesi insieme ad alcune popolazioni di cellule somatiche. Nel corso degli ultimi decenni, diverse tecniche come l'eluriazione centrifuga, lo smistamento cellulare attivato dalla fluorescenza (FACS) e STA-PUT sono state applicate con successo all'isolamento delle cellule germinali. Uno svantaggio è che tutti richiedono dispositivi dedicati e formazione specializzata. Seguendo i principi alla base del metodo STA-PUT, è stato sviluppato un protocollo semplice per l'isolamento degli spermatociti del papacifone, degli spermatidi rotondi e degli spermatidi allunganti dai testicoli del topo. Dopo aver preparato una singola sospensione cellulare delle cellule testicolari, specifiche popolazioni cellulari vengono arricchite dalla sedimentazione gravitazionale attraverso un gradiente discontinuo di densità di albumina del siero bovino (BSA). Le frazioni cellulari vengono quindi raccolte manualmente e analizzate al microscopio. Questo gradiente di densità modificato per il protocollo di sedimentazione mando (MDR) può essere ampiamente applicato, perché richiede solo apparecchiature di laboratorio standard. Inoltre, il protocollo richiede materiali di partenza minimi, riducendone i costi e l'uso di animali da laboratorio.
Introduzione
Molto è ancora sconosciuto sugli eventi molecolari e biologici che si svolgono durante la spermatogenesi dei mammiferi, un processo complesso in cui le cellule staminali spermatogoniche si trasformano in spermatozoi altamente specializzati1,2. La spermatogenesi avviene all'interno dei tubuli seminiferi del teste. I tubuli contengono una miscela di cellule germinali da ogni fase della differenziazione, comprese le cellule staminali spermatogoniche, la divisione mitotica di spermatogonia, gli spermatociti meiotici e gli spermatidi postmeiotici (che subiscono la differenziazione aploidi aploidi dalla spermatidi a spermatidi allunganti, e infine a maturare spermatozoi). Le cellule somatiche del testicolo includono cellule Sertoli che sono mescolate con cellule germinali all'interno dei tubuli seminiferi, cellule mioidi peripolari che formano pareti dei tubuli e cellule di Leydig che producono testosterone nello spazio interstiziale tra i tubuli.
Lo studio dei processi molecolari e biochimici durante la spermatogenesi spesso richiede la separazione di distinte popolazioni di cellule germinali da una complessa miscela di cellule testicolari. Sono state sviluppate molte strategie diverse per l'arricchimento cellulare. I metodi di maggior successo sono la sedimentazione della velocità STA-PUT per unità di gravità3,4,5,6, eluizione centrifuga basata sulla centrifugazione del controflusso7,8, e lo smistamento delle cellule attivato dalla fluorescenza (FACS) che separa le cellule in base al contenuto di DNA e/o a marcatori specifici. Questi metodi sono comunemente utilizzati tra i ricercatori di spermatogenesi e consentono l'arricchimento efficiente di specifici tipi di cellule germinali. Tuttavia, una limitazione di queste tecniche è che richiedono hardware specializzato e costoso che richiedono competenze.
Presentato qui è un protocollo semplice e poco costoso per isolare le popolazioni arricchite delle tre popolazioni cellulari più abbondanti di testicoli murini: spermatidi rotondi, spermatociti pachytene e spermatidi allunganti. Questo protocollo è indicato come il gradiente di densità modificato per gli spermatidi rotondi (MDR), perché funziona particolarmente bene per arricchire gli spermatidi rotondi. Il metodo MDR si basa sugli stessi principi della sedimentazione della velocità STA-PUT, ma richiede solo apparecchiature di laboratorio standard. Le cellule viventi sono autorizzate a sedimentare attraverso un gradiente di secco bovino (BSA) preparato manualmente all'interno di un tubo standard da 50 mL sotto il campo gravitazionale terrestre. Le cellule più grandi si muovono più velocemente attraverso il gradiente, che separa diverse popolazioni di cellule germinali. Dopo la sedimentazione, le frazioni arricchite dei tre tipi di cellule vengono raccolte manualmente. La purezza di queste popolazioni cellulari arricchite è paragonabile a quelle ottenute da STA-PUT e dall'eluriazione centrifuga.
Oltre a coprire la costruzione e l'uso del gradiente BSA per la sedimentazione della velocità, il protocollo descrive anche un metodo di digestione per rilasciare le cellule testicolari dai tubuli seminiferi. Il protocollo è stato modificato rispetto a quello sviluppato da Romrell et al.9 e comprende digestione sequenziali con collagene IV e trypsin. Le digestione sequenziali combinate con l'uso di un tampone di bicarbonato (cioè la soluzione Krebs) hanno dimostrato di migliorare notevolmente la separazione e la vitalità delle cellule germinali9.
Durante l'arricchimento mDR, le cellule trascorrono circa 4 h insieme al di fuori dell'ambiente dei tubuli seminiferi e non sono soggette a forze meccaniche stressanti, che consentono la raccolta di frazioni cellulari altamente vitali per l'analisi a valle. Inoltre, simile all'eluiriazione centrifuga e allo STA-PUT, il protocollo MDR non richiede alcun trattamento chimico o etichettatura delle cellule, che aiuta anche a mantenere la loro vitalità. È importante sottolineare che solo due testicoli di topi adulti sono sufficienti per l'isolamento MDR e, quindi, un topo adulto fornisce abbastanza cellule arricchite per l'analisi dell'RNA e delle proteine. Il protocollo STA-PUT standard raccomanda l'uso di ben 12 topi adulti per l'isolamento cellulare6; anche se, sulla base di esperienze precedenti, è noto che l'isolamento di successo può essere fatto da tre a quattro topi adulti. La quantità più bassa di materiale di partenza riportata come sufficiente per l'eluiriazione centrifuga è sei testicoli murini (tre topi)8. Pertanto, oltre ad eliminare la necessità di costose attrezzature specializzate, il protocollo MDR riduce il numero di animali da laboratorio necessari.
Protocollo
La manutenzione dei topi da laboratorio e di tutti gli esperimenti è stata eseguita in conformità con le linee guida e le normative pertinenti per la cura e l'uso degli animali da laboratorio.
1. Configurazione dell'apparecchiatura e del reagente
- Impostare il bagno d'acqua a 37 gradi centigradi.
- Impostare l'incubatrice a coltura cellulare a 34 gradi centigradi, il 5% di CO2,il 95% di umidità. Mettere il rotatore del tubo all'interno dell'incubatrice.
NOT: Gli incubatori richiedono molto tempo per cambiare la temperatura interna. Se non è disponibile un'incubatrice costantemente impostata a 34 gradi centigradi, impostarne una 1 giorno prima dell'esperimento. - Preparare ed etichettare la quantità appropriata di vetrini in microscopia. Disegnare un anello di 1 cm di diametro con una penna di grasso e lasciare asciugare il grasso.
- Preparare 1x buffer Krebs, pH 7.8 (Tabella 1). Mettete due tubi conici con 50 mL di 1x Krebs a 34 gradi centigradi per preriscaldare i passi 2,5,2,8. Conservare il resto delle 1x Krebs a 4 gradi centigradi o sul ghiaccio.
- Preparare le soluzioni BSA. Preparare prima 25 mL di 10% (w/v) soluzione BSA a Krebs sciogliendo 2,5 g di BSA in 1x Krebs buffer ad un volume finale di 25 mL. Diluire la soluzione 10% BSA con 1x Krebs buffer per ottenere diverse concentrazioni di BSA (Tabella 2). Mantenere tutte le soluzioni BSA a 4 gradi centigradi.
NOT: Preparare le soluzioni lo stesso giorno della procedura e conservare a 4 gradi centigradi fino all'uso. - Preparare gli enzimi di digestione pesando la giusta quantità di trypsin e collagenasi a 50 mL di tubi conici (Tabella 3).
2. Dissezione animale e preparazione della sospensione delle cellule germinali
NOT: Questo richiede circa 1 h per completare.
- Sacrificare un topo maschio adulto (invecchiato 7 settimane o più, testicoli del peso di 80-120 mg a seconda del ceppo e dell'età) attraverso la lussazione cervicale o l'asfissia di CO2.
- Spruzzare l'addome ventrale del topo con il 70% di etanolo. Aprire la cavità adominopelvic utilizzando le forbici, facendo un'apertura a forma di V.
- Tirando sul cuscinetto di grasso epidiale con pinze, individuare i testicoli e rimuoverli con le forbici. Evitare di disturbare la tunica albuginea. Disporre i testicoli su una teglia Petri di 6 cm contenente 1x Krebs.
- Decapsulare i testicoli e scartare la tunica albuginea. Disperdere leggermente i tubuli seminiferi strappandoli delicatamente a parte con pinze.
- Utilizzare le pinze per trasferire i tubuli seminiferi in un tubo conico da 50 mL contenente 2 mL di soluzione di collagenane appena preparata (Tabella 3).
- Incubare i tubuli nel bagno d'acqua a 37 gradi centigradi per 3 min.
NOT: Tubuli liberamente galleggianti dovrebbero verificarsi entro 3 min a causa della rimozione delle cellule interstiziali. La temperatura fisiologica per le cellule testicolari è di 34 gradi centigradi; pertanto, lunghe digestione sono di solito fatte a questa temperatura. Tuttavia, la breve digestione di 3 min può essere condotta a 37 gradi centigradi (temperatura consigliata dal produttore). Si noti che se si utilizza 34 gradi centigradi, il tempo di digestione deve essere ri-ottimizzato. - Aggiungere almeno 40 mL di 1x Krebs caldi e lasciare che i tubuli sedimentino (1 min) a temperatura ambiente (RT). Rimuovere il supernatante e ripetere 1x.
- Aggiungere 25 mL di soluzione di prova appena preparata (Tabella 3), posizionare il tubo sul rotatore del tubo all'interno dell'incubatrice 34 sc e incubare per 15-20 min (15 giri/m). Controllare sporadicamente lo stato dei tubuli. Una volta che la soluzione diventa torbida e rimangono solo piccoli pezzi di tubuli, posizionare il tubo sul ghiaccio e procedere immediatamente alla fase successiva.
NOT: Per evitare diiperdire e lisi cellulare, passare rapidamente alle seguenti fasi di lavaggio. Alcuni protocolli includono la disattivazione della trypsin da parte del siero bovino fetale (FBS). In questo protocollo, il trattamento FBS viene omesso, e invece, la trypsina viene rimossa dalla centrifugazione immediata e dai successivi fumi con 1x Krebs freddi. - Filtrare la soluzione attraverso un colino a 40 m in un nuovo tubo conico da 50 mL sul ghiaccio.
- Centrifuga 600 x g per 5 min a 4 gradi centigradi per pelletare le cellule.
NOT: La centrifugazione con una forza troppo forte può danneggiare le cellule. - Rimuovere supernatante versandolo con cura.
- Toccare il pellet cellulare per risospendere le celle nel resto di 1x Krebs.
- Aggiungere almeno 40 mL di 1x Krebs freddi alle celle risospese.
- Ripetere i passaggi 2.10 e 2.11.
- Toccare il tubo con il pellet cellulare per risospendere le cellule. Aggiungere 1 mL di 0,5% di BSA in 1x Krebs e con una punta di pipetta tagliata rispendi le celle con il pipisso la soluzione su e giù. Evitare di fare bolle.
- Infine, aggiungere 1/3 mL di 0,5% BSA in 1x Krebs in modo che il volume finale sia di 3 mL. Filtrare la sospensione delle cellule germinali attraverso un colino a cellule di 40 m e procedere immediatamente a caricare le cellule sul gradiente BSA.
3. Separazione delle cellule germinali attraverso il gradiente BSA discontinuo
NOT: Questa sezione richiede circa 2 h per essere completata. Iniziare a preparare il gradiente DIscontinuo di BSA durante le fasi di lavaggio (passaggi 2.10-2.14) per caricare le cellule non appena il pretrattamento è pronto.
- Ospitare un tubo da 50 mL verticalmente sul ghiaccio in modo che sia possibile vedere un lato del tubo. In alternativa, eseguire il protocollo in una cella frigorifera a 4 gradi centigradi, nel qual caso non è necessario ghiaccio.
- Tagliare la punta di una pipetta sierologica da 10 mL a circa 5-10 mm dalla punta per ottenere un'apertura più grande (Figura 1A) e montarla sul controller pipetta (Figura 1C).
NOT: Questo diminuirà la velocità durante la pipettatura, che facilita l'impilamento delle diverse soluzioni BSA. In alternativa, utilizzare una pipetta meccanica da 1 mL con un pistone liscio e tagliare le punte della pipetta con un'apertura di circa 3 mm di diametro (Figura 1B). - Iniziare con il pipettaggio 5 mL del 5% soluzione BSA sul fondo del tubo da 50 mL.
- Lentamente pipet 5 mL di 4% soluzione BSA sopra la soluzione 5%. Iniziare toccando delicatamente la superficie della soluzione 5% con la punta di taglio della pipetta e strato le due soluzioni mantenendo con attenzione il contatto con la superficie, assicurando di non consentire la punta del tubo di immergersi.
NOT: Una linea chiara dovrebbe essere visibile tra i due livelli alla fine di questo passaggio. - Ripetere il passaggio 3.4 con le altre soluzioni BSA per ottenere un gradiente discontinuo dal 5% fino all'1% (Figura 1D).
- Caricare con attenzione la sospensione a cella singola sopra il gradiente senza disturbare. Lasciate che le cellule si sedimentino attraverso il gradiente per 1,5 h a 4 gradi centigradi o sul ghiaccio.
4. Collezione di frazioni di cellule germinali arricchite
NOT: Questa sezione richiede circa 30 minuti per essere completata.
- Montare una punta di pipetta da 1 mL su una pipetta meccanica da 1 mL e tagliare la punta in modo che l'apertura abbia un diametro di 3 mm (Figura 1B).
- Raccogliere con cura 1 mL di frazioni in tubi separati da 1,5 mL, a partire dalla parte superiore del gradiente BSA, e conservarle sul ghiaccio. Numerare i tubi nello stesso ordine in cui verranno raccolte le frazioni.
NOT: A questo punto, ci dovrebbe essere una serie di tubi da 28 dollari contenenti sospensioni cellulari. Utilizzare una pipetta meccanica da 1 mL con un pistone liscio e tagliare le punte delle pipette per ridurre al minimo il rischio di disturbare il gradiente BSA. - Centrifugare le frazioni delle cellule germinali a 600 x g per 10 min a 4 gradi centigradi.
- Attento a non disturbare il pellet, scarta la maggior parte del supernatante e respendi il pellet cellulare facendo scorrere il tubo. Aggiungere 1 mL di 1x tampone di Krebs ghiacciato ad ogni tubo e ripetere la centrifugazione.
NOT: Ripetere la fase di lavaggio se BSA interferisce con l'analisi a valle. - Scartare la maggior parte del supernatante, ma lasciare 100 dollari l dopo il lavaggio finale. Risospendere attentamente il pellet cellulare.
NOT: La sospensione delle cellule assicura con attenzione che il campione prelevato da questa soluzione rappresenti tutte le cellule della frazione specificata. Mantenere le sospensioni cellulari sul ghiaccio durante la preparazione dei vetrini.
5. Analisi delle frazioni cellulari
NOT: Il completamento dell'analisi richiede 2 h.
- Uno alla volta, pipet 20 - L del 4% di paraformaldeide (PFA) all'interno di ogni anello di penna di grasso su un vetrino di microscopia numerato.
- Aggiungere immediatamente 2 le quote di sospensione cellulare risospese dalla frazione corrispondente. Ripetere l'operazione per ogni frazione.
NOT: Durante la preparazione dei vetrini, tenere tutte le sospensioni cellulari sul ghiaccio. - Asciugare i vetrini a RT per 1 h per una notte (O/N).
NOT: Durante questa fase, dopo aver prestato un campione da ogni frazione, le cellule possono essere elaborate per analisi o stoccaggio a valle (sezione 6). - Sciacquare i vetrini una volta con 1x PBS e montare con supporto di montaggio con 4,6-diamidino-2-fenylindole (DAPI) (Tabella dei materiali).
- Analizzare i vetrini al microscopio a fluorescenza per stimare quale particolare tipo di cellula germinale è arricchito in ogni frazione.
NOT: Diversi tipi di cellule possono essere riconosciuti dalla loro caratteristica morfologia nucleare visualizzata dalla colorazione DAPI. Figura 2 A mostra frazioni rappresentative arricchite in spermatidi allunganti, spermatidi rotondi e spermatociti pachytene. Il nucleo di spermatide rotondo è piccolo (6,7 m di diametro) e rotondo (Figura 2A). I nuclei spermatidi rotondi del topo sono caratterizzati anche da un'unica struttura eterocromatica rotonda chiamata cromocentro. Nuclei di spermatidi allunganti hanno una tipica forma allungata e ridotto dimensione nucleare a causa della condensazione cromatina (Figura 2A). I nuclei di spermatotociti di Pachytene sono molto più grandi (diametro superiore a 10 m) e di forma più irregolare, con aree di cromatina densamente imballate distribuite in tutto (Figura 2A). -
Se necessario, eseguire l'immunostaining oltre alla colorazione DAPI per supportare il riconoscimento dei diversi tipi di cellule.
- In questo caso, diffondere 2 - L di sospensione cellulare con 20 -L di una soluzione di fissaggio (4% PFA e 0,1% anti-inrealtà nonionico in PBS) all'interno di un anello penna di grasso. Dopo aver asciugato i vetrini, suffisso le cellule con 4% PFA per 10 min a RT.
- Risciacquare con PBS, quindi permeabilizzare con 0,1% di sovraffattoto nonionico in PBS per 5 min.
- Risciacquare con PBS e procedere a un protocollo di immunofluorescenza standard costituito da blocchi e incubazioni con specifici anticorpi primari e anticorpi secondari con etichetta fluorocromatica. Montare i vetrini con montante anti-dissolvenza con DAPI (Tabella dei materiali) e lasciarli impostare per 24 ore.
NOT: Esempi di marcatori utili per le incubazioni primarie di anticorpi includono l'agglutininina di arachidi (PNA; 1:2,000 nella soluzione di blocco) che macchia l'acrosoma negli spermatidi rotondi e allunganti, anticorpi anti-DDX4 (1:200 nella soluzione di blocco) che un singolo etichetta il granulo citoplasmatico negli spermatidi rotondi e l'anticorpo anti-z-H2AX (1:100 in soluzione di blocco) che riconosce i corpi sessuali negli spermatociti pachytene. Vedere i risultati rappresentativi e Figura 2C,D per esempi di analisi dell'immunofluorescenza delle frazioni.
6. Elaborazione dei campioni rimanenti per l'archiviazione
NOT: La sezione 6 richiede circa 20 minuti per essere completata.
- Una volta che un campione da ogni frazione è stato prelevato per una diapositiva di microscopia, aggiungere 1 mL di 1x Krebs ghiacciato ad ogni frazione e centrificare le cellule a 600,13.000 g per 10 min a 4 gradi centigradi.
NOT: Una centrifugazione a bassa velocità si traduce in un pellet sciolto, che rende difficile rimuovere completamente 1x Krebs, mentre una centrifugazione ad alta velocità può danneggiare le cellule. Scegliere la velocità di centrifugain in base ai requisiti specifici del protocollo a valle. - Rimuovere e scartare il supernatante e continuare con l'analisi a valle preferita.
NOT: A questo punto, le cellule possono essere congelate a scatto in azoto liquido e conservate a -70 gradi centigradi. Una volta che si ha familiarità con questa tecnica, è possibile continuare con il protocollo a valle di preferenza direttamente, ma è sempre consigliabile prendere un campione e garantire la purezza di ogni frazione. L'RNA totale può essere estratto, quantificato e analizzato con metodi come la reazione a catena della trascrizione inversa (PCR) e il sequenziamento dell'RNA. Possono anche essere preparati estratti totali di proteine da cui è possibile eseguire l'immunoprecipitazioni o l'analisi di gonfiore occidentale(Figura 3).
Risultati
Un arricchimento sufficiente di un tipo di cellula germinale è di solito considerato superiore all'80%6. Il protocollo MDR funziona particolarmente bene per arricchire spermatidi rotondi. Un numero elevato di spermatidi rotondi puri >90% può essere ottenuto regolarmente utilizzando questa tecnica. Le frazioni ottimali di spermatotociti di pachytene e spermatidi allunganti sono arricchite rispettivamente al 75% e all'80%. Gli spermatidi allunganti tendono a rimanere in cima al gradiente e vengono raccolti con la prima frazione. Nell'esempio riportato, la frazione 1 conteneva l'80% degli spermatidi di allungamento (Figura 2B). La maggior parte degli spermatidi allunganti ottenuti con questa tecnica hanno nuclei condensati, mentre gli spermatidi allunganti non condensati sono scarsi (Figura 2A). Le seguenti frazioni contengono spermatidi rotondi arricchiti. Nell'esempio, l'arricchimento degli spermatidi rotondi era superiore al 90% in frazioni 2, 3 e 4 e l'arricchimento superiore all'80% è stato visto del tutto in sette frazioni (2-8) (Figura 2B). A causa delle loro grandi dimensioni, gli spermatociti di pachytene si sedimentano più velocemente e vengono raccolti per ultimi. Nell'esempio di purificazione, l'arricchimento era di circa il 75% in frazioni 14 e 15 (Figura 2B).
Mentre la morfologia nucleare, visualizzata dalla colorazione DAPI, di solito è sufficiente per il riconoscimento delle cellule, l'analisi dell'immunofluorescenza può essere eseguita per supportare l'analisi. PNA macchia gli acrosomi in via di sviluppo di spermatidi rotondi e allunganti, e l'aspetto acrosomico può essere sfruttato per classificare ulteriormente gli spermatidi rotondi in passi 1-8 di differenziazione10. La distinzione di spermatidi allungati e rotondi macchiati di PNA si basa sulle differenze nella loro forma nucleare (Figura 2C, pannello sinistro). Anticorpo anti-DDX4 è un marcatore utile per le frazioni di spermatide rotondo in quanto visualizza un singolo granulo perinucleare DDX4 positivo, il corpo cromatoide (CB), nel citoplasma di ogni spermatide rotonda. Questa colorazione specifica CB è facilmente distinguibili dalla colorazione citoplasmica più ampiamente distribuita negli spermatociti (Figura 2C, pannello centrale). Gli spermatociti di Pachytene possono essere riconosciuti dall'anticorpo anti-H2AX che etichetta il corpo sessuale nucleare che appare specificamente nella fase del pachytene della prima divisione meiotica (Figura 2C, pannello destro). In questa purificazione, la colorazione PNA ha rivelato che le frazioni di spermatide rotonde arricchite da MDR contenevano una miscela di spermatidi rotondi in varie fasi di differenziazione, tutti contenenti la loro struttura di firma, la DDX4-positiva CB (Figura 2D, RS). Anti-ZH2AX ha ulteriormente convalidato gli spermatociti pachytene di arricchimento nella frazione 16(Figura 2D, frazione PSpc).
Il conteggio delle cellule ha rivelato che il numero di cellule nelle frazioni di spermatociti spermatidi rotondi e pachytene è adeguato per varie analisi a valle. Frazioni spermatide rotonde (5-8) ciascuna contenuta di circa 2,5 x 106 celle. Pertanto, raggruppando queste frazioni, è possibile ottenere più di 10 milioni di cellule. Le frazioni di spermatotototemi di Pachytene (14 e 15) di solito contenevano un po 'meno cellule. In questo isolamento, sono state contate circa 1,5 x 2,0 x 106 celle per frazione. La prima frazione conteneva 0,75 x 106 spermatidi allunganti.
Come mostrato nella Figura 3A, la quantità totale di RNA ottenuta dalla maggior parte delle frazioni variava da 0,5,5 g, il che è sufficiente per le analisi dell'RNA a valle come la trascrizione inversa PCR, il sequenziamento dell'RNA o la visualizzazione dell'RNA su un gel. La quantità di proteine ottenute da ogni frazione varia tipicamente da 20-140 g (Figura 3B), che è sufficiente per diverse macchie occidentali. Listi interi cellulari sono stati preparati dalle frazioni raccolte, e l'analisi delle macchie occidentali è stata eseguita utilizzando anticorpi che rilevano DDX4, PIWIL1 e PIWIL2, che sono tutti altamente espressi in spermatociti di papalete e spermatidi rotondi, nonché onnipresenti espresso gliceralde 3 dehydrogenasi (GAPDH).
In questo protocollo, il 10% delle listi proteiche derivate da singole frazioni era sufficiente a rilevare chiaramente tutte queste proteine su un'impostazione standard delle macchie occidentali (Figura 3C). La quantità di proteine in una frazione è stata dimostrata anche sufficiente per l'immunoprecipitazioni utilizzando un anticorpo contro PIWIL1, così come per l'individuazione di PIWIL2 co-immunoprecipitato (Figura 3D). Inoltre, questo protocollo è stato utilizzato con successo per ottenere frazioni arricchite di spermatociti pachytene e spermatidi rotondi da topi di controllo e geneticamente modificati per applicazioni a valle come la trascrizione inversa quantitativa PCR11 e sequenziamento di RNA ad alta velocità effettiva12.

Figura 1: Preparazione di un gradiente BSA discontinuo. (A) Una punta di pipetta sierologica da 5 mL per la preparazione del gradiente. (B) Una punta pipetta da 1 mL per la preparazione del gradiente e la raccolta delle frazioni di cellule germinali dopo la sedimentazione. (C) L'attrezzatura necessaria per la preparazione del gradiente. (D) Vista laterale del gradiente di densità BSA discontinuo dal 5% (in basso) alla soluzione BSA dell'1% (in alto); le soluzioni BSA del 2% e del 4% sono di colore blu per una migliore visualizzazione. Fare clic qui per visualizzare una versione più grande di questa figura.
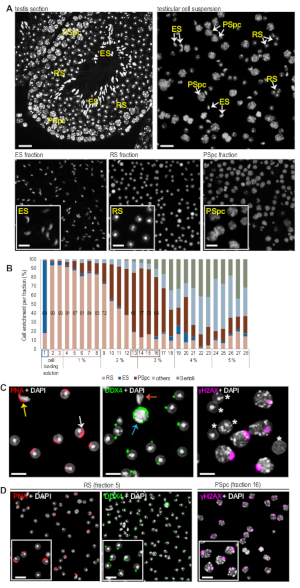
Figura 2: Immagini rappresentative delle frazioni cellulari raccolte e dell'analisi dell'arricchimento. (A) Cellule testicolari macchiate DAPI. La fila superiore mostra le cellule testicolari nell'epitelio seminifero intatto di una sezione testiri con polpa fissata a PFA (a sinistra) o in sospensione (a destra). La riga inferiore mostra frazioni di spermatidi allunganti arricchiti (ES), spermatidi rotondi (RS), o spermatociti di pachytene (PSpc). Barre di scala: 20 m per la fila superiore e 10 m per gli insetdellati della riga inferiore. (B) Quantificazione relativa dei diversi tipi di cellule germinali in ogni frazione. Le celle sono state conteggiate manualmente utilizzando il software ImageJ e classificate in CELLE RS, ES, PSpc, Sertoli e altre celle. I numeri di frazione e le rispettive percentuali di BSA nel gradiente sono indicati sull'asse x. (C) Analisi dell'immunofluorescenza delle cellule testicolari. Pannello sinistro: PNA etichettato come rhodamina macchia l'acromo sia in ES (freccia gialla) che in RS (freccia bianca). Pannello centrale: l'anticorpo DDX4 macchia un singolo granulo perinucleare in RS, che è facile da distinguere dal segnale citoplasmico più diffuso negli spermatociti (freccia blu). Nessun segnale DDX4 rilevato in ES (freccia arancione). Pannello destro : anticorpo hH2AX riconosce il caratteristico corpo sessuale nucleare presente solo negli spermatociti pachytene (cellule negative di z contrassegnate da un asterisco bianco). Le barre di scala (D) frazioni di cellule arricchite MDR sono state etichettate con PNA (frazione RS), anti-DDX4 (frazione RS) e anti-HX2AX (frazione PSpc) per convalidare ulteriormente l'arricchimento cellulare in ogni frazione. Barre di scala : 10 m. Fare clic qui per visualizzare una versione più grande di questa figura.
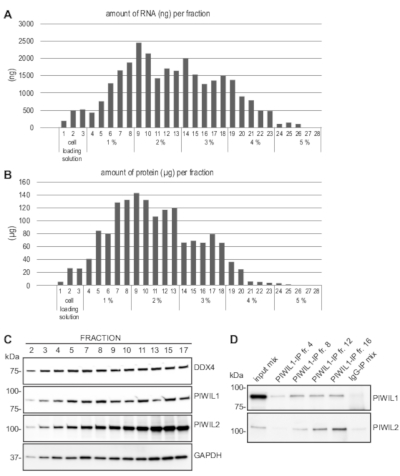
Figura 3: Analisi a valle dopo l'arricchimento delle cellule MDR. (A) l'RNA è stato estratto da ogni frazione dopo l'arricchimento e il quantificamento di una cellula MDR rappresentativa. I numeri di frazione e le rispettive percentuali di BSA nel gradiente sono indicati sull'asse x. (B) Le proteine sono state estratte da ogni frazione mediante il listo del pellet cellulare nel buffer di analisi radioimmunoprecipitazione (RIPA) poi quantificate. (C) Gli estratti di proteine a cellule intere sono stati preparati e analizzati dalla blotting occidentale utilizzando anticorpi contro DDX4, PIWIL1, PIWIL2 e GAPDH. Il 10% del lisato è stato caricato da ciascuna frazione indicata. (D) L'immunoprecipitazioni è stata eseguita da frazioni indicate con antiPIWIL1 seguita da gonfiore occidentale con anticorpi anti-PIWIL1 e anti-PIWIL2. Il campione di input include una miscela di listi proteici provenienti da diverse frazioni, e l'immunoprecipitazioni di controllo (IP) utilizzando il coniglio IgG è stato eseguito anche da un lisato misto. Fare clic qui per visualizzare una versione più grande di questa figura.
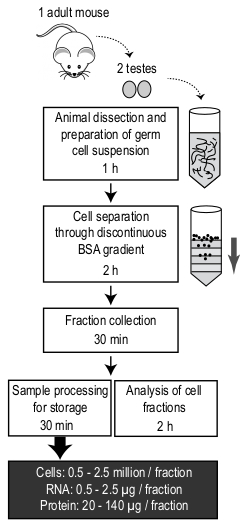
Figura 4: Rappresentazione schematica del protocollo MDR e tempo necessario per completare ogni passaggio. Il materiale di partenza è composto da due testicoli di un topo adulto. Viene indicato il numero medio di cellule e la quantità di RNA e proteine ottenuta da una frazione. Fare clic qui per visualizzare una versione più grande di questa figura.
| buffer m inv | Reagenti | preparazione | deposito |
| Buffer Krebs (10x) | 3,26 g KH2PO4 | Portare a 2 L con H2O, filtrare 0,22 m e autoclave. | Può essere conservato a 4 gradi centigradi per diversi mesi |
| 139,5 g NaCl | |||
| 5,89 g MgSO4o7H2O | |||
| 50 g di destrosio | |||
| 3,78 g CaCl2-2H2O | |||
| 7.12 g KCl | |||
| Buffer Krebs (1x) | 4,24 g NaHCO3 | Sciogliere NaHCO3 a 100 mL di H2O, aggiungere 200 mL di 10x Krebs buffer e portare a 2 L con H2O. | Da preparare fresco |
| Buffer Krebs da 200 mL 10x |
Tabella 1: Preparazione del buffer Krebs.
| Concentrazione di BSA (w/v) | 10% soluzione BSA | 1x tampone Krebs |
| 0.50% | 0,5 mL | 9,5 mL |
| 1% | 1 mL | 9 mL |
| 2% | 2 mL | 8 mL |
| 3% | 3 mL | 7 mL |
| 4% | 4 mL | 6 mL |
| 5% | 5 mL | 5 mL |
Tabella 2: Preparazione delle soluzioni BSA.
| Soluzione di digestione | Concentrazione di lavoro | Reagenti | preparazione |
| Collagenae | 1 mg/mL | Collagenae IV | Pesare 2 mg di collagenasi IV a un tubo conico 50 mL, e aggiungere 2 mL di caldo 1x Krebs tampone proprio prima della digestione (passaggio 2.3). |
| tripsina | 0,6 mg/mL | tripsina | Pesare 15 mg di trypsin a un tubo conico da 50 mL e aggiungere 25 mL di caldo 1x tampone KREBS e 40 -L di DNase I proprio prima della digestione (passaggio 2.6). |
| >3.2 ku/mL | DNase I |
Tabella 3: Preparazione degli enzimi di digestione.
Discussione
Presentato qui è un protocollo semplice ed economico per isolare le popolazioni arricchite di spermatidi rotondi, spermatociti pachytene e spermatidi allunganti utilizzando apparecchiature di laboratorio standard (panoramica del protocollo mostrato nella Figura 4). Anche se non è richiesto alcuna esperienza o macchinario costoso, ci sono alcuni passaggi critici che devono essere considerati durante la digestione dei tessuti, la costruzione del gradiente e il caricamento della sospensione cellulare sul gradiente.
Le cellule germinali vengono rilasciate dai tubuli seminiferi da due digestione enzimatica consecutiva. La prima digestione con collagene IV separa i tubuli seminiferi rimuovendo le cellule interstiziali. Il tempo di digestione prolungato può danneggiare i tubuli e portare alla perdita di spermatidi, poiché (se rilasciati dai tubuli durante questa fase) saranno scartati nei seguenti passi. Il secondo passo di digestione con la trypsin rilascia cellule germinali da tubuli seminiferi. Ci può essere occasionale lisi cellulare e in genere alcuni grumi si formano a causa del DNA genomico rilasciato. Non è consigliabile superare la durata o la temperatura suggerita della digestione, in quanto ciò può portare a una redditività più povera, aumento della lisi cellulare e agglomeramento. Se si verifica un leggero agglomeramento, i grumi possono essere ignorati. Tuttavia, nei casi di agglomeramento significativo e perdita di cellule, il tempo di digestione della trypsin o la concentrazione dovrebbero essere ridotti. Va anche notato che l'attività enzimatica di trypsin può variare tra i lotti e durante i periodi prolungati di stoccaggio. La quantità di DNase I durante la digestione della tripsina può anche essere aumentata per rimuovere i grumi in eccesso, ma questo dovrebbe essere considerato una soluzione secondaria. È importante ottenere una sospensione omogenea a singola cellula alla fine del pretrattamento, poiché le cellule agglomerate si sedimentano più velocemente, contaminando le frazioni e interrompendo il gradiente.
La creazione del gradiente può richiedere una certa pratica. In caso di disagio utilizzando una punta di pipetta da 5 mL con un controller pipetta, si consiglia di utilizzare una normale pipetta meccanica da 1 mL con un pistone liscio, quindi tagliare le punte della pipetta ad un'apertura di 3 mm di diametro (Figura 1B). Un'apertura più ampia e un carico fluido delle soluzioni BSA ridurranno il rischio di miscelazione del gradiente. Una volta adeguatamente preparati, è possibile vedere i confini tra le soluzioni BSA adiacenti a causa dei loro diversi indici di rifrazione. Il gradiente deve essere prodotto direttamente prima dell'uso. Va anche notato che qualsiasi piccola scossa o vibrazione può disturbare il gradiente, quindi il gradiente deve essere impostato in un ambiente in cui non sarà disturbato.
Il caricamento della sospensione cellulare sul gradiente deve essere fatto con molta attenzione. Dopo il caricamento, la sospensione delle celle deve rimanere in cima al gradiente, da cui le cellule inizieranno lentamente a sedimentarsi attraverso il primo strato. Se si vedono grandi gruppi di cellule muoversi velocemente attraverso il gradiente, è probabile che le cellule non siano state risospese con attenzione o che ci sia un agglomerato in eccesso. Se le celle non rimangono in cima al gradiente BSA discontinuo al caricamento, ma affondano immediatamente tra gli strati BSA dell'1% e del 2% (passaggio 3.6), la sospensione cellulare è probabilmente troppo densa. Questo protocollo è stato ottimizzato utilizzando due testicoli di un topo adulto (80-120 mg/testis) come materiale di partenza; anche se, isolamento di successo utilizzando una quantità ridotta di materiale di partenza è stato eseguito. Per aumentare il protocollo e ottenere cellule germinali più arricchite da un maggior numero di testicoli, dovrebbero essere introdotti più tubi da 50 mL con il gradiente.
Il protocollo è stato inizialmente sviluppato e ottimizzato per arricchire gli spermatidi rotondi aploidi da testicoli di topi adulti, e la purezza delle frazioni di spermatidi rotonde dovrebbe essere superiore al 90%. Oltre alle frazioni di spermatidi rotonde altamente pure, sono stati ottenuti risultati soddisfacenti per l'arricchimento di spermatociti pachytene e spermatidi allunganti. Va notato che gli eritrociti possono contaminare le frazioni di spermatide allunganti, e ulteriori misure per eliminarle dovrebbero essere prese se si prevede che la loro presenza interferisca con le analisi a valle. Non siamo stati in grado di arricchire altri tipi di cellule come le cellule premeiotiche o meiotiche prime (prima della fase del pachitene) da topi adulti utilizzando il protocollo MDR.
Inoltre, la sedimentazione STA-PUT è stata utilizzata con successo per ottenere frazioni arricchite di spermatogonia o preleptotene, leptotene e spermatociti di zygotene utilizzando testicoli giovanili raccolti in determinati momenti dopo la nascita13. Questo approccio sfrutta l'aspetto di questi tipi di cellule durante la prima ondata di spermatogenesi. Lo stesso approccio può probabilmente essere applicato all'arricchimento della MDR, ma non è ancora stato testato nella pratica. Un altro metodo che è una buona opzione per la purificazione delle cellule premeiotiche e meiotiche in specifiche fasi di differenziazione è FACS, che ha l'importante vantaggio di consentire l'isolamento di specifici tipi di cellule in base ai marcatori specifici presenza14 ,15,16,17.
Nel complesso, la sedimentazione della velocità MDR serve come metodo utile per l'arricchimento delle cellule germinali. Anche se questo metodo non è superiore ad altri metodi consolidati in termini di purezza o quantità di cellule arricchite, i suoi chiari vantaggi sono la sua semplicità e bassi costi di set-up. Questo, insieme alla bassa quantità di materiali di partenza necessari, rende questo protocollo una grande opzione per i ricercatori nel campo della spermatogenesi e quelli in altri campi che potrebbero non voler investire in hardware specializzato o in grandi gruppi di animali.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo ringraziare tutti i membri del laboratorio Kotaja per il loro contributo durante lo sviluppo del protocollo, e l'uso attivo e il test del protocollo nei loro progetti di ricerca. In particolare apprezziamo il contributo di Jan Lindstrom per l'aiuto nell'ottimizzazione del protocollo. Questo studio è stato sostenuto dall'Accademia di Finlandia, dalla Fondazione Sigrid Jusélius e dal Programma di dottorato Turku di medicina molecolare.
Materiali
| Name | Company | Catalog Number | Comments |
| 4% Paraformaldehyde | Preference of researcher | ||
| AlexaFluor488 donkey anti-rabbit IgG | Thermo Fisher Scientific | A-21206 | |
| AlexaFluor647 donkey anti-mouse IgG | Thermo Fisher Scientific | A-31571 | |
| Bovine Serum Albumin (BSA) | Sigma | A9647 | |
| CaCl2·2H2O | Preference of researcher | ||
| Collagenase IV | Sigma | C5138 | |
| Complete protease inhibitor cocktail | Roche | 11836145001 | |
| DDX4 antibody | Abcam | ab13840 | |
| Dextrose | Preference of researcher | ||
| DNase I | Worthington | LS006355 | |
| GAPDH | HyTest | 5G4 | |
| HRP-linked anti-mouse IgG | GE Healthcare Life Sciences | NA931 | |
| HRP-linked anti-rabbit IgG | GE Healthcare Life Sciences | NA934 | |
| KCl | Preference of researcher | ||
| KH2PO4 | Preference of researcher | ||
| MgSO4·7H2O | Preference of researcher | ||
| NaCl | Preference of researcher | ||
| NaHCO3 | Preference of researcher | ||
| NH4Cl | Preference of researcher | ||
| Pierce BCA protein assay kit | Life Technologies | 23227 | |
| PIWIL1 | Cell Signaling Technology | G82 | |
| PIWIL2, clone 13E-3 | Millipore | MABE363 | |
| Prolong Diamond Antidafe Mountant with DAPI | Thermo Fisher Scientific | P36962 | for Alexa Fluor immunostainings |
| Rabbit IgG | Neomarkers | NC-100-P | |
| Rhodamine-labelled Peanut agglutinin (PNA) | Vector Laboratories | RL-1072 | |
| RIPA buffer | 50 mM Tris-HCl, pH 7.5, 1% NP-40, 0.5% w/v sodium deoxycholate, 0.05% w/v SDS, 1 mM EDTA, 150 mM NaCl, 1x protease inhibitor cocktail, 0.2 mM PMSF and 1 mM DTT | ||
| TRIsure | Bioline | BIO-38033 | |
| Triton X-100 | Preference of researcher | nonionic surfactant | |
| Trypsin | Worthington | LS003703 | |
| VECTASHIELD Antifade Mounting Medium with DAPI | Vector Laboratories | H-1200 | for standard DAPI analysis of cell fractions |
| γH2AX antibody | Millipore | 05-636 | |
| 0.22 µm filter | Sartorius | Sartolab BT 180C6 | or equivalent |
| 1 mL mechanical pipette | Preference of researcher | ||
| 1.5 mL or 2 mL tubes | Preference of researcher | ||
| 40 µm cell sieves for 50 mL tubes | Greiner Bio-One | 542040 | or equivalent cell strainer |
| 5 mL serological pipettes | Sarstedt | 86.1254.001 | or equivalent |
| 50 mL conical tubes | Preference of researcher | ||
| 6 cm Petri dishes | Preference of researcher | ||
| Cell culture incubator | Preference of researcher | ||
| Centrifuge for 50 mL tubes | Preference of researcher | ||
| Grease pen for microscopy glass slides | Preference of researcher | ||
| HulaMixer Sample Mixer | Thermo Fisher Scientific | 15920D | or equivalent cell rotator |
| Microdissection forcepts | Preference of researcher | ||
| Microdissection scissors | Preference of researcher | ||
| Microscopy glass slides and coverslips | Preference of researcher | ||
| Nanodrop 1000 | Thermo Scientific | ||
| Pipetboy Acu 2 | Integra | 155 000 | or equivalent pipette controller |
| Refrigerated centrifuge for 1.5 mL tubes | Preference of researcher | ||
| Tips for 1 mL mechanical pipette | Preference of researcher | ||
| Water bath | Preference of researcher | ||
| Widefield fluorescence microscope | Preference of researcher |
Riferimenti
- Hess, R. A., Renato de Franca, L. Spermatogenesis and cycle of the seminiferous epithelium. Advances in Experimental Medicine and Biology. 636, 1-15 (2008).
- Lehtiniemi, T., Kotaja, N. Germ granule-mediated RNA regulation in male germ cells. Reproduction. 155 (2), R77-R91 (2018).
- Lam, D. M., Furrer, R., Bruce, W. R. The separation, physical characterization, and differentiation kinetics of spermatogonial cells of the mouse. Proceedings of the National Academy of Sciences of the United States of America. 65 (1), 192-199 (1970).
- Meistrich, M. L., Bruce, W. R., Clermont, Y. Cellular composition of fractions of mouse testis cells following velocity sedimentation separation. Experimental Cell Research. 79 (1), 213-227 (1973).
- La Salle, S., Sun, F., Handel, M. A. Isolation and short-term culture of mouse spermatocytes for analysis of meiosis. Methods in Molecular Biology (Clifton, N.J.). 558, 279-297 (2009).
- Bryant, J. M., Meyer-Ficca, M. L., Dang, V. M., Berger, S. L., Meyer, R. G. Separation of spermatogenic cell types using STA-PUT velocity sedimentation. Journal of Visualized Experiments. (80), e50648 (2013).
- Grabske, R. J., Lake, S., Gledhill, B. L., Meistrich, M. L. Centrifugal elutriation: separation of spermatogenic cells on the basis of sedimentation velocity. Journal of Cellular Physiology. 86 (1), 177-189 (1975).
- Barchi, M., Geremia, R., Magliozzi, R., Bianchi, E. Isolation and analyses of enriched populations of male mouse germ cells by sedimentation velocity: the centrifugal elutriation. Methods in Molecular Biology (Clifton, N.J.). 558, 299-321 (2009).
- Romrell, L. J., Bellvé, A. R., Fawcett, D. W. Separation of mouse spermatogenic cells by sedimentation velocity. A morphological characterization. Developmental Biology. 49 (1), 119-131 (1976).
- Kotaja, N., et al. Preparation, isolation and characterization of stage-specific spermatogenic cells for cellular and molecular analysis. Nature Methods. 1 (3), 249-254 (2004).
- Korhonen, H. M., et al. DICER Regulates the Formation and Maintenance of Cell-Cell Junctions in the Mouse Seminiferous Epithelium. Biology of Reproduction. 93 (6), 139 (2015).
- Da Ros, M., et al. FYCO1 and autophagy control the integrity of the haploid male germ cell-specific RNP granules. Autophagy. 13 (2), 302-321 (2017).
- Bellvé, A. R., et al. Spermatogenic cells of the prepuberal mouse. Isolation and morphological characterization. The Journal of Cell Biology. 74 (1), 68-85 (1977).
- Mays-Hoopes, L. L., Bolen, J., Riggs, A. D., Singer-Sam, J. Preparation of spermatogonia, spermatocytes, and round spermatids for analysis of gene expression using fluorescence-activated cell sorting. Biology of Reproduction. 53 (5), 1003-1011 (1995).
- Suter, L., Koch, E., Bechter, R., Bobadilla, M. Three-parameter flow cytometric analysis of rat spermatogenesis. Cytometry. 27 (2), 161-168 (1997).
- Lima, A. C., et al. Multispecies Purification of Testicular Germ Cells. Biology of Reproduction. 95 (4), 85-85 (2016).
- Bastos, H., et al. Flow cytometric characterization of viable meiotic and postmeiotic cells by Hoechst 33342 in mouse spermatogenesis. Cytometry. Part A: the Journal of the International Society for Analytical Cytology. 65 (1), 40-49 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon