Method Article
PeptiQuick, שילוב של צעד אחד של חלבונים ממברנות לתוך ביוטילדיסקי Peptiquick עבור כריכת חלבון מפושטת
In This Article
Summary
אנו מציגים שיטה המשלבת טיהור חלבון ממברנה והחוקה לתוך peptidiscs בצעד כרומטוגרפי יחיד. מקפלים ביולוגיים משמשים להחזקה ישירה של פני השטח ולמדידה של מדידת חלבונים ואינטראקציות באמצעות האינטרפרומטריה.
Abstract
חלבונים ממברנות, כולל מובילי, ערוצים, וקולטנים, מהווים כמעט רבע של פרוטאום הסלולר ויותר ממחצית מטרות התרופה הנוכחית. ובכל זאת, המכשול העיקרי לאפיון ולניצול שלהם בהגדרות אקדמיות או תעשייתיות הוא האסטרטגיות הביוכימיות, הביופיזיקלי והתרופות מחייבות את החלבונים האלה להיות במצב מסיס למים. המעבדה שלנו פיתחה לאחרונה peptidisc, הממברנה מיטיסי מציע "בגודל אחד מתאים לכולם" גישה לבעיה של מסיסות חלבון ממברנה. אנו מציגים כאן פרוטוקול יעיל המשלב טיהור חלבון ו peptidisc מחדש החוקה בשלב כרומטוגרפי יחיד. זרימת עבודה זו, כינה את PeptiQuick, מאפשרת לעקוף דיאליזה ודגירה עם מחרוזות פוליסטירן, ובכך מפחיתה באופן משמעותי את החשיפה לחומר ניקוי, חלבון הדנטורציה, ואובדן לדוגמה. כאשר PeptiQuick מבוצעת עם מקפלים פיגומים ביולוגיים, ההכנה יכולה להיות מחוברת ישירות למשטחים מצופים בstreptavidin. אין צורך biotinylate או לשנות את המטרה חלבון הממברנה. Peptiquick הוא לראווה כאן עם קולטן קרום fhua ו מיקרוביאלית ליגנד colicin M, באמצעות הפרעות ביואולייר כדי לקבוע את הקינטיקה המדויקת של האינטראקציה שלהם. המסקנה היא כי PeptiQuick היא דרך נוחה להכין ולנתח חלבון ממברנה-ליגניות ואינטראקציות בתוך יום אחד בסביבה נטולת כביסה.
Introduction
חלבונים ממברנה מושמטים לעתים קרובות מפני מחקר של תרופות או נוגדנים גילוי מחקרים בשל הנטייה של חלבונים הממברנה לצבור מחוץ לסביבה bilayer ליפיד, במיוחד בנוכחות של דטרגנטים1. לכן, בשנים האחרונות, מספר mimetics ממברנה (כינה את הפיגומים) פותחו כדי להקל על הבידוד והחקירה של חלבונים ממברנה בסביבה ללא חומרי ניקוי לחלוטין (כלומר, ננודיסקי, SMALPs, אמפיפולים, וכו ') . שתיים,שלוש,ארבע,חמש,שש עם זאת, החוקה של חלבונים ממברנות אלה mimetics לעתים קרובות דורש אופטימיזציה נרחבת, אשר צורכת זמן ובדרך כלל מלווה עם אובדן של חלבון שחזור7,8. כדי להתגבר על מגבלות אלה, המעבדה שלנו פיתחה לאחרונה "בגודל אחד מתאים" ניסוח המכונה peptidisc9. הפטיפדיסק נוצר כאשר מספר עותקים של מעצב 4.5 kDa מעוצב באמצעות פפטיד ביהליינית מאוגד למשטח ההידרופובי של חלבון ממברנה מטרה. החוקה היציבה של peptidisc מתרחשת בעת הסרת אבקת כביסה, להפוך שומנים אנדוגניים וחלבונים ממברנה מסיסות לתוך חלקיקים מסיסים במים. החלקיקים האלה מיוצבים. עכשיו ליישומים רבים במורד הזרם
שיטת peptidisc מציעה מספר יתרונות; לדוגמה, החוקה היא פשוטה, מאז הכריכה של הפיגומים peptidisc על היעד מונחה על ידי תבנית החלבון עצמה9,10. הסטויכוריקה הפפטיד היא גם בעלת נחישות עצמית, ותוספת של שומנים אקסוגני אינם נחוצים. היווצרות peptidisc מתרחשת על ידי דילול כביסה פשוטה, יתרון חשוב מעל דיאליזה או ספיחה על חרוזי פוליסטירן, אשר לעתים קרובות לגרום לתשואה נמוכה בחלבון בשל שיוך משטח לא ספציפי וצבירה11,12 ,13. ההרכבה הסופית של peptidisc הינה מאוד מתוחכמת ומסיסה תמיד במאגרים שונים או בנוכחות של הסדר הדיאונטי (למשל, Ni2 +). הטוהר והאחידות המבבניים של הפיגום גבוה גם כן (למשל, אנטוקסין-נטול), והפפטיד ניתן להתאמה אישית עם קבוצות פונקציונליות ממוקמות בתנוחות שונות.
אנו מציגים כאן זרימת עבודה מעבדה בשם PeptiQuick, הידוע גם בשם מחדש חרוזים החוקה9. פרוטוקול זה משלב טיהור חלבון ממברנה והחוקה peptidisc לשלב אחד על התמיכה כרומטוגרפית זהה. כפי שהשם מציין, PeptiQuick הוא מהיר לעומת שיטות אחרות לחוקה מחדש, וזה גם מפחית ברצינות את זמן החשיפה לניקוי. אפקטים של חומרי ניקוי שליליים כגון התפתחות החלבון והצבירה מתרחשים לעתים קרובות באופן תלוי-זמן; לכן, הפחתת חשיפה לחומרי ניקוי היא קריטית לשמירה על היווצרות חלבון מקורי14,15. הדבר חיוני לדיוק של שיטות שדווחו על אינטראקציות חלבונים וליגוניות כריכה.
תוך כדי פיתוח פרוטוקול זה, אנו מציגים את הגרסה הביוטילתיתיאותשל הרומן של הפיגום פטישיו, הנקרא ביו-פטיפדיסק. קבוצות פונקציונלית ביוטין לאפשר החזקה של חלבון ממברנה היעד על משטחים מצופים streptavidin. מאז תיוג ביוטין מוגבל הפיגום, אתרי קשירה על חלבון ממברנה היעד נשארים ללא שמות. באמצעות ביו-Peptidisc, קינטיקה מחייבת של קולטן קרום בקטריאלי FhuA ו מיקרוביאלית פפטיד מדיום (קולם) נקבעים16. אהדה זו נמדדת על-ידי ביטוייר אינטרמוטמטריה (בלי), המנתח אינטראקציות בזמן אמת על בסיס דפוסי הפרעות אור לבן המשתקף מעצת חיישן.
על-ידי שימוש בפרוטוקול זה, הצורך בניקוי במהלך ניתוח בלי הפרעה מסולק, שהוא התפתחות חשובה, כמו שחומרי ניקוי יכולים לשבש את האינטראקציות. כריכת קשרים ניתן למדוד במהירות עם שיטה זו, ואת התוצאות הן דומות לאלה שדווחו מוקדם יותר באמצעות nanodiscs ו איזותרמי טיטור calorimetry (התיכון)16. השלבים הקריטיים בזרימת העבודה PeptiQuick מוצגים ודנים, כגון הכנה לחלבונים, דילול חומרי ניקוי, תוספת פפטיד ושיטת החוקה, יחד עם עצות לפתרון בעיות של ליגו ו-אנליטה כריכה בתוך המסגרת. באמצעות זרימת העבודה PeptiQuick, מתגלה כי חלבונים ממברנה ניתן ללכוד ב peptiquick והאינטראקציות שלהם נמדד בתוך יום.
Protocol
1. הכנה ומסיסות של קולטן קרום FhuA
- לבטא את שלו6-Tagged Fhua ב esAW740 מאמץ קולי זן. הגדל תאים עבור 18 h ב 37 ° צ' ב M9 מדיה (טבלה 1). ראה מילס ואח '16 לפרוטוקול ביטוי מפורט.
- הקציר תאים על ידי צנטריפוגה (5,000 x g, 10 דקות, 4 ° צ') ולהשעות אותם מחדש ב 50 ML של טריס-מלח, גליצרול (tsg) מאגר (שולחן 1). מוריד את התאים המושהים ומוסיף פנילמתאנסולולגון (PMSF) לריכוז סופי של 1 מ"מ רק לפני הליזה.
התראה: PMSF הוא רעיל ומאכל. - Lyse את התאים באמצעות מיקרופלואידיצר (שלושה מעברים) ב-15,000 psi או בעיתונות צרפתית (שלושה מעברים) ב 8,000 psi. גלולה את התאים הבלתי מצנטריפוגה וחומרים אחרים בעלי מהירות נמוכה (5,000 x g, 10 דקות, 4 ° c).
- Ultracentrifuge הסופרנטנט (200,000 x g, 40 דקות, 4 ° צ') כדי לבודד את שבר הקרום הגולמי. להיפטר supernatant, להשעות מחדש את הגלולה בכמות מינימלית של מאגר tsg, ו-דאונס באמצעות זכוכית או מכשיר מתכת מערכת כדי להבטיח הומוגניות.
- לבצע שיטת ברדפורד כדי לבדוק את ריכוז החלבון של הקרום הגולמי המושהה מחדש. לדלל את הקרום הגולמי לריכוז הסופי של 3 מ"ג/mL באמצעות מאגר TSG לפני מסיסות.
- הוספת אבקת הניקוי טריטון X-100 לריכוז הסופי של 1% (v/v) כדי באופן סלקטיבי מסיסות הקרום הפנימי החיידקי עבור 1 h ב 4 ° צ' עם נדנדה עדינה. מצננת את החומר השולי (שבר הממברנה החיצוני) על ידי הגבלת הדרך (200,000 x g, 40 דקות, 4 ° c).
- להיפטר supernatant המכיל את הקרום מסיסות ולהשעות מחדש את הגלולה ב TSG לריכוז הסופי של 3 מ"ג/mL. הוסף לכאן את ה-תחמוצת הלורלאמין (LDAO) לריכוז של 1% (v/v) עד שבר הקרום החיצוני מחדש ו מסיסות עבור 1 h ב 4 ° צ' עם נדנדה עדינה.
- לבצע צעד צנטריפוגה הסופי כדי גלולה כל החומר מסיסים (200,000 x g, 40 דקות, 4 ° c).
הערה: supernatant התוצאה מכיל חלבונים הממברנה החיצונית מסיסות, כולל היעד שלו-מתויג FhuA.
2. טיהור והחוקה של FhuA באמצעות זרימת העבודה PeptiQuick
- מקדם-השפה המקדימה של הטור Ni-נ. ת. ע (5 מ ל שרף) עם שני כרכים של עמודות של כרומטוגרפיה של זיקה מתכת (IMAC) לשטוף מאגר (שולחן 1).
- לדלל את הקרום החיצוני מסיסות מ 1% LDAO כדי 0.04% LDAO באמצעות TSG. לאחר מכן, הוסיפו את הסרזאזול. לריכוז הסופי של 5 מ"מ
התראה: הסרפירון הוא רעיל ומאכל. - טען את החלבונים החיצוניים מסיסות הקרום על שרף Ni-נ. ת. א. ולאסוף את הפרח. טען מחדש את flowthrough אל שרף כדי להגדיל את הכריכה שרף של FhuA ולאסוף את הפרח המשני.
הערה: לשמור על 20 μl סדרת מחלקים של חומר מסיסות כהתייחסות למועד מאוחר יותר נתרן dodecyl סולפט אלקטרופורזה ג'ל אלקטרופורזה (sds-PAGE) ניתוח. - לשטוף את שרף עם 250 mL של מאגר לשטוף IMAC ולאסוף את הראשון 50 mL של האלוטה. לנקז את מאגר לשטוף לגובה של נפח המיטה שרף ולסגור את הסטוזין על הטור.
- הוסף 1 מ ל של מרוכז 10 mg/mL בביו-Peptidisc פתרון פפטיד (טבלה 1) לעמודה. הוסף 50 mL של לדלל 1 mg/mL ביו-Peptidisc הפתרון פפטיד ב TSG ו מערבבים את שרף עם מוט זכוכית כדי להשעות את החרוזים ב TSG.
- לאחר השמנה peptidisc, לאפשר שרף ליישב ולנקז את עודף 1 מ"ג/mL ביו-Peptidisc פתרון דרך שרף.
- שטוף את החלקיקים המחוברים של Ni-נ. א. עם 50 mL של TSG. המלט חלקיקי peptidisc עם 15 מ ל של מאגר משחרלי IMAC (שולחן 1) המכיל 600 מ"מ סרדיזציה ב-tsg. לאסוף 1 שברים mL ומיד להוסיף 10 μL של 0.5 M EDTA כדי לאכול יוני ניקל.
התראה: EDTA הוא מטרד.
3. הערכת החוקה החוזרת של PeptiQuick
- SDS-ניתוח עמודים
- טען 10 μL של החומר להתחיל, flowthrough, לשטוף (es), ושברים משחררהחוקה PeptiQuick על 12% SDS-denaturing רפתקאות ג'ל ואלקטרופורמית עבור 30 דקות בזרם קבוע של 60 mA.
- הכתם את הג עם הצבע הכחול של Coomassie הכתים את הג, והמחש בסורק.
- כרומטוגרפיה של החרגת מהגודל (SEC)
- מבוסס על 12% SDS-ניתוח העמוד של החוקה מהירה PeptiQuick, לבודד ולבריכה את השברים הרלוונטיים, ולרכז אותם באמצעות מרכז צנטריפוגלי 30 kDa לגזור.
הערה: בווידאו הנלווה, שברים F3 – F7 מתחברים ביחד ומרוכזים מתחת ל-1 mL (נפח לולאת ההזרקה במכשיר ה-SEC). - הכנס ~ 1 מ ל של שברים מאגר IMAC במאגר אל S200 ג'ל סינון (300/10) בעמודה בקצב הזרימה של 0.25 mL/min במאגר TSG. לאסוף 1 שברים mL ולהפעיל אותם על 12% SDS ג'ל כדי לקבוע איזה שברים SEC לבריכה ולהתרכז.
הערה: שברים מהירים של peptiquick עשויים להיות מוזרקים ללא ריכוז, ו-סדרת מחלקים ניתן להזריק על השנייה כדי לבדוק את איכות החוקה החוזרת. זהו שליטה חשובה עבור חלבונים ממברנה העשויים להיות רגישים לצבירה במהלך ריכוז צנטריפוגלי.
- מבוסס על 12% SDS-ניתוח העמוד של החוקה מהירה PeptiQuick, לבודד ולבריכה את השברים הרלוונטיים, ולרכז אותם באמצעות מרכז צנטריפוגלי 30 kDa לגזור.
4. ביאולייר אינטרפרומטריה
- התקנה ניסויית בלי.
- הגדר את צלחת הטוב 96 ביד.
הערה: כל הבארות מולאו לנפח סופי של 200 μL. - בעמודה 1, שורות A-E, טען 200 μL של מאגר קינטיקה כדי לאפשר את העצות כדי ליצור אות בסיסית.
- לדלל את ליגו (FhuA ב ביו-Peptidisc) לריכוז של 2.5 μg/mL במאגר הקינטיקה (טבלה 1). טען 200 μL של דילול זה לשורות A-A-D בטור 2.
- הוסף 200 μL של מאגר קינטיקה רק ל-E2 (חיישן הייחוס).
- הוסף 200 μL של מאגר קינטיקה לעמודה 3, שורות A-E כדי לשטוף את העודפים FhuA מהקצה.
- בטור 4, יש לבצע דילול סדרתי דו-מתקפל של האנליטה (קולם) במורד הצלחת מ-A4 עד D4. התחל עם 28 ננומטר (8 * Kd) ב-A4 ל 3.5 nM (1 * Kd) ב D4.
- הוסף 28 ננומטר לE4 כדי למדוד עבור איגוד לא ספציפי (הריכוז הגבוה ביותר של קולם בשימוש).
- הוסף 200 μL של מאגר קינטיקה לעמודה 5, שורות A-E.
הערה: כאן, קולם לא ינתק מהקצה, והדיסוציאציה נמדדת. - מניחים את צלחת ההתקנה. במכשיר בלי
- מניחים את מגש החיישן במכשיר בלי.
- פתח את תוכנת רכישת הנתונים בלי בחירה ובחר ניסוי קינטיקה חדש באשף התוכנה.
- השתמש בכרטיסיה הגדרת לוח כדי להזין את הפריסה של 96 צלחת היטב לתוך התוכנה.
הערה: הבארות המכילות את הליגאס, FhuA מפוערות כ"עומס". וולס המכיל חוצץ בלבד מכיל את המאגר. בארות המכילות את האנליטה, קולם, מנותחת כ"מדגם". - השתמש בכרטיסייה הגדרת הסדר כדי להגדיר את משך הזמן ומהירות סיבוב הצלחת עבור כל שלב בניסוי.
הערה: השלבים הניסיוניים מוגדרים כ: 1) בסיסי: 60 s; 2) טעינה: 250 s; 3) בסיסי2:300 s; 4) האגודה: 450 s; ו -5) דיסוציאציה: 900 s. השאר את מהירות הטלטול כברירת מחדל (1,000 rpm). השלבים שלעיל מוקצים בנפרד לכל עמודה בלוח ה96 של הבאר על-ידי בחירת הצעד הרצוי ולחיצה ימנית על הוסף שלב שיטת הפעולה בכל עמודה. - הקצה את הצעד הראשון על-ידי לחיצה ימנית על העמודה הראשונה ובחר באפשרות ' הפעלשיוך חדש '. ודא שהשלב הבסיסי מוקצה כראוי באמצעות החלון הימני התחתון ושנה עם התפריט הנפתח בהתאם לצורך.
- הקצה את השלבים הבאים לכל עמודה על-ידי לחיצה ימנית לאורך הלוח ובחירה באפשרות ' הוסף שלב שיטתשיוך '. הקצה אותם לעמודה המתאימה, כפי שנקבע בשלב 4.1.13.
- השתמש בלשונית הקצאת החיישן כדי לוודא שמכשיר השמיניה מקבל פינים בלי שימוש מהמיקום הנכון במגש החיישן.
הערה: בכרטיסיה הקצאת החיישן, יש להדגיש רק את A1-E1. ודא שתיאור חיישן קיים במיקומים אלה במגש החיישן וודא ש-F1-H1 ריק. - סמן את F1-H1 על המסך, לאחר מכן לחץ לחיצה ימנית ובחר באפשרות הסר כדי לסמן אותן כריקות. שנתות החלפת חיישנים במגש לאחר השימוש כדי לשמור את החיישנים המשמשים.
- בכרטיסיה ניסוי סקירה, המספקת סקירה סופית של הניסוי לפני ביצוע, עבור על השלבים הניסיוניים כדי לוודא שההתקנה כולה נכונה.
- בכרטיסיה ניסוי הפעלה, בחר מיקום קובץ כדי לשמור את קבצי השיטה.
- שינוי טמפרטורת הצלחת. לטמפרטורת החדר
- בחר באפשרות ' עבור ' כדי להפעיל את הניסוי.
- הגדר את צלחת הטוב 96 ביד.
- ניתוח מידע בבלי
- פתח את תוכנת ניתוח הנתונים של האוקטט.
- השתמש בכרטיסיה בחירת נתונים כדי לאתר את הניסוי ולבדוק את התקציר הנסיוני. יבא את קובץ הפרוייקט ממיקום השמירה שלו שהוגדר במהלך 4.1.19 step.
- הקלט את ריכוזי האנליטה (כאן, קולם) על ידי בחירת מידע החיישן עבור כל ניסוי.
- הקצה את הקצה ב-E1 כקצה ההפניה.
- השתמש בלשונית העיבוד כדי להחסיר את אות ההתייחסות (E1) מהנתונים הניסיוניים. בדוק את הנתונים הגולמיים מתיאור האסמכתא עבור איגוד מסוים שאינו מוגדר. . אם אף אחד לא נצפה, המשך
הערה: זהו שליטה שלילית חשובה. אם לא ניתן לצפות באיגוד ספציפי, הדבר יוצג בשלב 4.2.7. - יישר את ציר ה-y לשלב הבסיסי השני. אל תסמן את החיבור בין השלבים. בחר בסינון Savitzky-Golay. בחר נתוני תהליך!.
- בכרטיסיה ניתוח, בחר את הנתונים הניסיוניים בטבלה שמתחת לעלילה כדי לראות את השיוך ואת עקומות הדיסוציאציה עם האות מחיישן הייחוס שהחיסור.
- בחרו בדגם האיגוד 1:1 ובחרו בהתאמת עקומה חלקית. בחר באפשרות ' התאם עקומות '!.
- לנתח את העלילה תצוגה שיורית כדי לבדוק את התאמת העקומה.
- גלול בטבלה כדי לראות את ה-K dהמחושב.
- בחר ' שמור דוח '. .. כדי לשמור מסמך גיליון אלקטרוני המפרט את הכיוונון, החלקות של הנתונים הגולמיים והמנותחים וקבועי הדיסוציאציה המחושבים.
תוצאות
קולטן ממברנה FhuA מתבטאת במעבדה E. coli זן. שבר הקרום החיצוני הוא נקצרו על ידי צנטריפוגה, חלבונים הם מסיסות באמצעות החילוץ שני שלבים ניקוי. חלבונים ממברנה מסיסות נטענים על Ni-נ. ת. ע. חרוזים ארז בטור פלסטיק, ואחריו זרימת העבודה PeptiQuick כפי שהוצג בפרוטוקול. לאחר שליטה באיכות באמצעות כרומטוגרפיה של הוצאת הגודל, חלקיקי ביו-Peptidisc מקורמים אל פינים מצופים streptavidin. ניתוח בלי מתבצע כדי למדוד קינטיקה של האינטראקציות בין FhuA וקולם. הסקירה הסכמטית של ניסוי זה מוצגת באיור 1.
ג'ל SDS מופעל כדי לקבוע את האיכות של החוקה לאחר הימנעות החלקיקים FhuA ביו-Peptidisc מתוך עמודת ה-IMAC (איור 2). שברים של השברים המתאימים להתחיל, flowthrough, שוטף, ושברי הימנעות נטענים על SDS-ג'ל כדי להעריך את ההצלחה של שיטת PeptiQuick. דלדול של FhuA ב-flowthrough השבר הוא בקורלציה עם העשרה שברים להתחמק, אשר מציין כי טיהור של החלבון היה יעיל. להקות חלבון מזהם משניות נצפו בשברים המתחלקים. ניתוח ה-SDS משמש כדי לקבוע אילו שברים יש לקיים במאגר לפני ניתוח SEC. ג'ל יליד החלקיקים FhuA ביו-Peptidisc מופעל גם כדי לאשר מסיסות FhuA (איור משלים 1). הגירה של חלבון מחדש לתוך ג'ל יליד מעיד על מסיסות חלבונים בסביבה נטולת כביסה.
ניתוח SEC מבוצע כדי להעריך את המיסיסות של חלקיקי peptidisc. כרומאטוגרמה הציג באיור 3A מראה בודד, השיא סימטרי משחררי בערך 14 מ ל (6 מ ל אחרי נפח הריק של 8.0 ml על סינון ג'ל S200 10/300 עמודה). מיקומו של שיא זה, מעבר לנפח הריק, מאשר את המיסיסות של חלקיקי ה-FhuA Bio-Peptidisc. לצורך התייחסות, איור 3B ממחיש הכנה תיאורטית של הפטיפדיסק האופטימלי. במקרה זה, chromatogram מראה שיא חלבון גדול משחררי בנפח הריק, המציין את נוכחותם של אגרגטים חלבון. שיא קטן משחררי רק אחרי השיא peptidisc הראשי מתאים פפטידים peptidisc עודף.
האינטראקציה של FhuA עם האנליטה קולם נקבעת לאחר החזקה של peptidiscs לחיישנים streptavidin מצופים. תיאורי החיישן הם הראשונים המסובטים במאגר הקינטיקה, ולאחר מכן מועברים למאגר המכיל את ה-FhuA Bio-Peptidiscs. הריכוז של FhuA Bio-Peptidiscs ואת משך הזמן שבו הם מודבטים עם הקצה ממוטב לפני הניסוי הזה (איור משלים 1). בעקבות שלבי הטעינה והשטיפה, צעד השיוך מודד את האינטראקציות בין הטיפים הטעונים וארבעה ריכוזים שונים של colicin M. התנועה הבאה של הטיפים בחזרה לתוך תוצאות מאגר הדיסוציאציה, אשר נמדד על ידי אורך הגל של אור לבן המשקף את הקצה.
איור 4A מציג את פלט הנתונים הגולמיים מניסוי זה. כל הסימנים נראים אחידים בשלבי הטעינה והבסיס, מלבד מעקב הייחוס בצהוב. לתיאור ההפניה אין ליגאין טעון אך הוא נחשף ליישום כדי לקבוע את הצורך באיגוד שאינו ספציפי, שהוא פקד שלילי חשוב. לניתוח מפורט יותר של התוצאות, האות מקצה ההפניה מופחתים מהעקבות של העצות הנסיוניות לחשבון עבור איגוד שאינו ספציפי. הנתונים מיושרים לתחילת שלב השיוך כדי לאפשר השוואה חזותית ישירה, כפי שמוצג באיור 4B. השוואה זו מראה עלייה במעבר גל עבור ריכוזי הגדלת של colicin M. העקומה מתאימה לנתונים ומציגה דגם מחייב 1:1 קלאסי.
מגרש התצוגה השרידי (איור 4B, למטה), המתאר את ההבדלים בין הנתונים המתאימים והניסיוניים, מראה את ההתאמה לריכוז הגבוה ביותר של קולם (28 ננומטר) הוא עני בהשוואה לשלושת הריכוזים הנמוכים יותר. לפרופיל העקומה חסרה רמת עקומת הכריכה, האופיינית לרוויית האתר בניסוי מחייב אופייני. חוסר הרמה מציע כריכה הטרוגנית, שהיא כנראה פריט של ריכוז קולם הגבוה. ריכוז קולם הגבוה ביותר מגיע לפיכך מהניתוח, ושלושת הריכוזים האחרים משמשים לקביעת קבוע הדיסוציאציה (איור 4ג, ד). T-test של סטודנט דו-זנבית, ברמת ביטחון 95%, מצאה שקבוע הדיסוציאציה הנצפה מניסוי זה אינו שונה באופן משמעותי מהערכים המתקבלים באמצעות טכניקות שונות (איור 4e)16.

איור 1: סקירה של זרימת העבודה PeptiQuick באמצעות בדיקות ביו-Peptiquick וניתוח בלי. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: ניתוח ג'ל SDS (12%) של התחלה, flowthrough, לשטוף, ושברים משחררים שנאספו באמצעות זרימת העבודה PeptiQuick. כ 10 μL של המדגם נטען לתוך כל נתיב ולרוץ 30 דקות בזרם קבוע של 60 mA. הג היה מוכתם בכחול כחול, מוכתם ומדמיין על סורק ג'ל. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
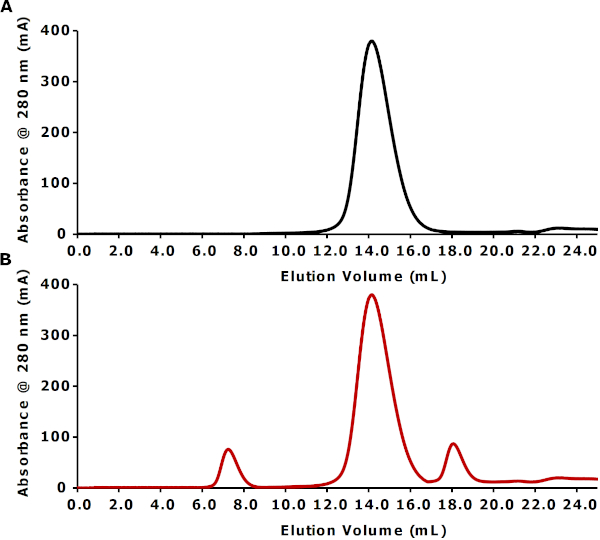
איור 3: פרופילי שניה ניסיוניים ותיאורטיים המייצגים חוקות מיטביות ומיטביות, בהתאמה. (א) הפרופיל הניסיוני של שניה של פטישיו מהיר (~ 82 kda) בביו-Peptiquick. משחרל IMAC שברים F3-F7 היו במאגר ומרוכזים באמצעות 30 kDa לחתוך את הרכז צנטריפוגלי ל ~ 1 mL. זה מדגם מרוכז הוזרק ב 0.25 mL/min על S200 ג'ל סינון (10/300) עמודה במאגר TSG. (ב) בפרופיל שניה תיאורטית של החוקה החוזרת מהירה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
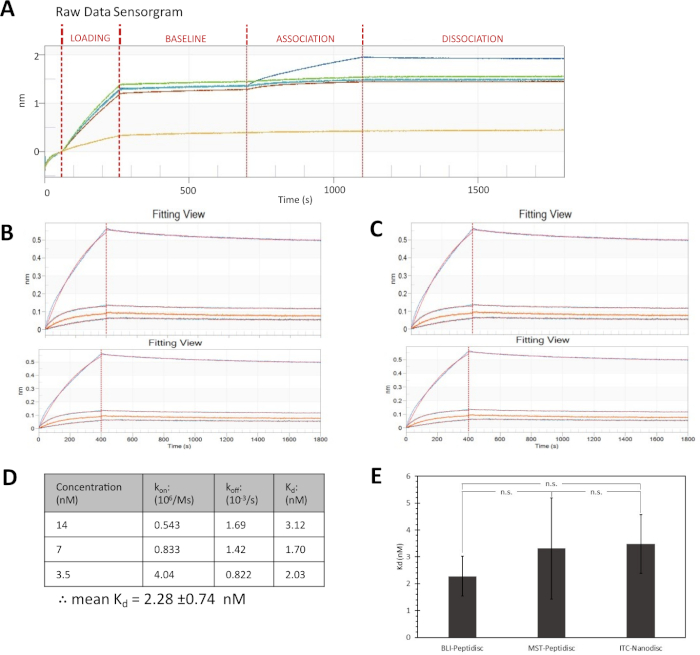
איור 4: חקירת אינטראקציות קולם עם FhuA מחדש ב-Bio-Peptidiscs. (א) נתונים גולמיים מסוסגרמה עם מעקב חיישן התייחסות בצהוב. (ב, ג) למעלה: שלבי השיוך והדיסוציאציה עם התאמת עקומת 1:1 חלקית. למטה: שרידי תצוגות המתארות את ההפרש בין נתונים ניסיוניים והתאמה חישובית. (ג) הוצאת הריכוז הגבוה ביותר של קולם. (ד) נצפו שיעורי שיוך והדיסוציאציה (kביטול,בהתאמה ) וקבועי הדיסוציאציה (kd). (ה) השוואה בין קבועי הדיסוציאציה של פהואה-קולם, שהושגו על-ידי peptidisc ובין בלי (בניסוי זה), peptidisc ותרמואזיס מיקרוסקאלה (saville, נתונים שלא פורסמו), ננו-דיסק ואיזותרמי טיטור קלורימטריה16. קווי שגיאה מייצגים SD אחת של חוסר ודאות, בעוד שנ לא מציין הבדל משמעותי ברמת הביטחון 95%. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| M9 מדיה (לליטר) |
| 200 מ ל M9 מלח |
| 800 מ ל2או |
| 10 מ"ל 40% גלוקוז |
| 80 μL 1 מטרים לשעה2 |
| 2.5 מ"ל 1 M MgSO4 |
| 300 μL 15 מ"ג/מ"ל ויטמין |
| מאגר TSG |
| 50 mM טריס-HCl, pH 7.8 |
| 50 ממ י |
| 10% גליצרול |
| מאגר שטיפת IMAC |
| 50 mM טריס-HCl, pH 7.8 |
| 50 ממ י |
| 10% גליצרול |
| 0.04% LDAO |
| 5 מילימטר סרפירון |
| פתרון ביו-פטיפדיסק |
| מפזר את המוכן לשימוש ביו-Peptidisc (> 95% טוהר) ב-dH הסטרילי2O. הריכוז והנפח של פתרון הפפטיד תלוי בשלב בתהליך החוקה החוזרת. |
| 50 mM טריס-HCl, pH 7.8 |
| 50 ממ י |
| הערה: מלאי הביו-פטיפדיסק הזה יציב ב-4 ° c במשך יותר מחודש. |
| מאגר האלויון IMAC |
| 50 mM טריס-HCl, pH 7.8 |
| 50 ממ י |
| 10% גליצרול |
| 600 מ"מ |
| מאגר קינטיקה |
| 50 mM טריס-HCl, pH 7.8 |
| 50 ממ י |
| 0.002% יצירת רצף-20 |
| 0.1% BSA |
טבלה 1: מתכונים להכנת מדיה ופתרונות.
איור משלים 1:4% – 16% בהיר ניתוח ג'ל מקורי של שברים שנאספו מתוך זרימת העבודה PeptiQuick. כ 10 μL של המדגם נטען לתוך כל נתיב ולרוץ עבור 40 דקות בזרם קבוע של 30 mA. הג היה מוכתם בכחול כחול, מוכתם ומדמיין על סורק. אנא לחץ כאן כדי להוריד את האיור.
איור משלים 2: ליג, אופטימיזציה ריכוז באמצעות סיכה אחת. (א) ששת ריכוזים שונים של Fhua ב ביו-Peptidisc נבדק לכריכה לפין streptavidin מצופה יחיד. זה הוגדר בצלחת 96 היטב עם מאגר בבארות בין ליגולים (עיין בקובץ משלים 1 עבור פרוטוקול ההתקנה). (ב) נתונים גולמיים מסוסגרמה לניסוי ליגואופטימיזציה. ה-pin נותן את התגובה הגדולה ביותר ובנוסף מגיע לרוויה בספר הריכוז 4 (או 2.5 μg/mL). אנא לחץ כאן כדי להוריד את האיור.
קובץ משלים 1. אנא לחץ כאן כדי להציג קובץ זה (לחץ לחיצה ימנית כדי להוריד).
Discussion
בעוד דטרגנטים להישאר את השיטה הפשוטה ביותר כדי לחלץ ולטהר חלבונים ממברנה, אלה הגולש יכול להיות השפעות לא רצויות רבות על יציבות החלבון, פונקציה, וניתוחים במורד1,2,3, 4,5,6,7,8,9. קשיים אלה התקשו על התפתחות מימטיקה קרום, אשר שואפים למזער את הנוכחות של דטרגנטים ולשכפל את הסביבה ממברנה יליד ככל האפשר2,3,4 ,5,6. הרוב של שיטות החוקה, לעומת זאת, דורשים אופטימיזציה משמעותית של תנאי החוקה ולעתים קרובות דורשים שלבי טיהור נוספים, אשר מפחיתים את התשואה הסופית7,8. Peptidisc באופן ספונטני מסתגל לחלבון ממברנה היעד יחסית, דורש אופטימיזציה קטנה וטיהור במורד הזרם9,10. בפרוטוקול זה, PeptiQuick מוצג כאמצעי פשוט כדי לייעל את פרוטוקול החוקה של במורד הזרם חלבון-חלבון ניתוח.
למרות שברור, ישנן מספר אזהרות נסיוניות שיכולות להוביל לכינון מחדש לא מוצלח. בין אלה, הנפוץ ביותר הוא בשל צבירת חלבון. לפיכך, קריטי לבצע את הגודל כרומטוגרפיה כדי לפקח על תהליך החוקה החוזרת. לדוגמה, שיא החרגת מהגודל בנפח הריק מעיד על אגרגטים בחלבון (איור 3b)17,18. אגרגטים ממברנות חלבון בדרך כלל ליצור על חשיפה ממושכת לתנאי ניקוי תת-אופטימלי לפני החוקה מחדש. בפרט, זה נמצא כי חלבונים הממברנה בדטרגנטים נוטים ליצור אגרגטים כאשר מרוכזים על ידי אולטראפילטרציה על מכשירים צנטריפוגליים. במקרה זה, חלבונים קרום רגיש עשוי להיות מרוכז באמצעות ואקום אולטרה סינון, שיטה עדינה יותר הומוגנית של ריכוז מאז ספיחה של חלבונים למסנן הוא פחתה.
באופן כללי, כדי למנוע ריכוז חלבונים, שברים IMAC מתחמק צריך להיות ממאגר, ו סדרת מחלקים מוזרק על עמודה הדרה גודל כדי לבדוק את איכות החוקה החוזרת שלה. יש לציין כי ללא שולבו משחרלי פפטיד בחינם רק לאחר שיא peptidisc הראשי (איור 3B). הגרדום החופשי לא בהכרח. מעכב ניסויים במורד הזרם עם זאת, אם יש צורך, עודף זה יכול להיות מוסר על ידי כרומטוגרפיה הדרה בגודל. לחילופין, הגדלת נפח לשטוף במהלך החוקה, ולפני הימנעות שרף IMAC, מספיק כדי להסיר ביעילות את רוב פפטיד peptidisc בחינם. לכן, כרומטוגרפיה של החרגת מהגודל מומלצת כאמצעי מהיר ופשוט לבדיקת איכות החוקה החוזרת.
הניסוי בלי מחייב אופטימיזציה קפדנית של ריכוזי ליגו ואנליטה. הכריכה צריכה להספיק כדי לקבל אות ברור, אך העמסת יתר תגרום לרוויית אות, מה שמביא לנתוני נתונים מצפיפות יתר ומעיכוב הפרעה במשטח הקצה. לפיכך, הן ריכוז הליזמן ואורך החיים שבהם התשר מעביר את התמיסה והפתרון חייב להיות מיטבי עבור כל דגימת חלבון (איור משלים 2). ריכוז האנליטה חייב גם להיות מיטבי. אם קבוע הדיסוציאציה ידוע, צעד זה הופך לקל יותר, מכיוון שניתן לשלב את טווח הריכוז. נקודת התחלה טובה לניתוח זה משתמשת בריכוזים של חלבון בין 0.1-ו-20-לקפל את המצופה Kd19.
בעקבות רכישת נתונים בלי לעשות זאת, יש לבצע ניתוח נתונים קפדני כדי להימנע מפענוח שגוי. החישוב של קבוע הדיסוציאציה תלוי בהתאמה של עקומה מחייבת. אלא אם כן הסטואיצ'ימטריה כבר ידוע, מודל האינטראקציה הקלאסית 1:1 biמולקולריים יש להשתמש עבור המדידה הראשונית. יש לציין כי עקומת קשירה הטרוגנית היא לעתים קרובות תוצאה של חפצי אמנות והתנהגות לא אידיאלית הנגרמת על ידי ריכוז אנליטה גבוהה, אשר יכול להיות מפורש כמודל כריכה מורכבת. לכן, הפחתת הריכוז האנליטה עד שהפרופיל הססורגרם מציג 1:1 כריכת הסטויכמטריה יכולה לעזור להבדיל בין הכריכה הטרוגנית לבין אינטראקציות מורכבות יותר. כל שרידי נתוני קשירה הטרוגנית מוזלים לאחר מכן כמוצג באיור 420.
בדוח זה, קבוע הדיסוציאציה של 2.28 ± 0.74 nM עבור האינטראקציה של FhuA-קולם נמדדת. ערך זה מתאים לקבוע הדיסוציאציה שנקבע בעבר בקבוצה שלנו עם ננו-דיסק או peptidisc באמצעות החברה האלקטרונית או MST, בהתאמה (איור 4E)16. עקביות זו מספקת ביטחון על החוקה peptidisc וניתוח בלי לעשות כאמצעי כדי לקבוע את הקינטיקה אינטראקציה. חשוב מכך, יש לציין כי חלבונים הם בדרך כלל מקיבוע על streptavidin אנלייזרים או באמצעות ביוטין החוצה קישור כימי או תוספת ספציפית לאתר באמצעות E. coli ביוטין ליגאז בירה21. במקום חלבון הממברנה המיועד. יש יתרונות רבים ביוטילציה הגרדום חוסך זמן וממזער את הפוטנציאל לשבש אתרי כריכת חלבונים חשובים. גילינו גם כי PeptiQuick הוא ישים מגוון רחב של שיעורי היעד חלבון, כולל G-חלבון מצמידים קולטנים (GPCRs), ערוצי יון, ו β-חביות חלבונים ממברנה. באופן כללי, יש לציין כי תמצית חומרי הניקוי הראשונית של חלבונים ממברנות למצב ללא צבירה היא קריטית, והחוקה המיידית של peptidisc מקטינה את בעיות צבירת הזרם. לאור הפשטות, זה נראה כי PeptiQuick יהיה מורחב streptavidin אחרים מבוססי איגוד מבוסס, כגון משטח תהודה המשטח (SPR), אליסה assays, ואהדה משיכה מורדות באמצעות חרוזים streptavidin.
Disclosures
FD הוא המייסד של ביוטכנולוגיה Peptidisc כדי להפיץ פפטידים peptidisc לקהילה האקדמית. ביוטכנולוגיה peptidisc הוא גם שיתוף פעולה עם הביוטכנולוגיה תעשייתי חברות פארמה ליישם peptidisc בתהליכי הגילוי שלהם. פרסום Access פתוח של מאמר זה המומן על ידי Fortele.
Acknowledgements
אנו מודים על מדעי הטבע והמועצה לחקר ההנדסה של קנדה. JS מכיל מלגת CGS-M CIHR. זה היה נתמך על ידי המחקר ביוטכנולוגיה ומדעי ביולוגי המועצה במימון הכשרה לדוקטורט בדרום מערב Biosciences הדרכה [הכשרת הפניה BB/M009122/1]. FD הוא יו ר מחקר ברמה II של קנדה.
Materials
| Name | Company | Catalog Number | Comments |
| 30 kDa cut-off centrifugal concentrator | Millipore Sigma | C7715 | - |
| Ampicillin | BioShop | 69-52-3 | Sodium Salt |
| Bio-Peptidisc Peptide | Peptidisc Biotech | https://peptidisc.com | - |
| Bovine Serum Albumin (BSA) | Sigma | 9048-46-8 | Lyophilized powder |
| CaCl2 | Fisher Chemical | 10035-04-8 | Certified ACS |
| EDTA | BioShop | 6381-92-6 | Biotechnology Grade |
| Ettan LC (AKTA) | Amersham Pharmacia Biotech | 18-1145-58 | - |
| Glucose | BioShop | 50-99-7 | Anhydrous, Reagent Grade |
| Glycerol | Fisher Chemical | 56-81-5 | Certified ACS |
| Imidazole | BioShop | 288-32-4 | Biotechnology Grade |
| Lauryldimethylamine oxide (LDAO) | Sigma | 101822204 | ~30% in H2O |
| MgSO4 | Fisher Chemical | 10034-99-8 | Certified ACS |
| Microfluidizer | Microfluidics | M-110L | Fit with F20Y 75µ diruption chamber |
| Ni-NTA Resin | Gold Biotechnology | H-320-50 | - |
| Non-binding 96well BLI Plate | Greiner Bio-one | 655076 | Microplate, PS, 96 well, F-Bottom (chimney well), Black, Fluotrac, Med. Binding |
| Octet Red96 | FortéBio | OCTET RED96E-GxP | Octet RED96e instrument, Octet CFR software, desktop computer, LC monitor, accessory kit, IQ/OQ kit, PQ Kits and one-year warranty |
| Phenylmethanesulfonylfluoride (PMSF) | Sigma | P-7626 | - |
| Protein Assay Dye - Reagent Concentrate | Bio-Rad | 5000006 | Used in the bradford assay to determine protein concentration - 5x concentration |
| Sodium Chloride (NaCl) | BioShop | 7647-14-5 | Biotechnology Grade |
| Streptavidin (SA) Biosensors | ForteBio | 18-5019 | One tray of 96 biosensors coated with streptavidin for quantitation, screening, or kinetic applications. |
| Superdex S200 (300/10) | Amersham Pharmacia Biotech | 175175-01 | - |
| Thiamine | Merck | 69271 | - |
| Tris-HCl | BioShop | 77-86-1 | Reagent Grade |
| Triton X-100 | BioShop | 900998-1 | Biotechnology Grade |
| Tween-20 | BioShop | 56-40-6 | Reagent Grade |
| Ultra centrifuge | Beckman Coulter | 365668 | - |
References
- Rawlings, A. E. Membrane proteins: always an insoluble problem. Biochemical Society Transactions. 44 (3), 790-795 (2016).
- Popot, J. L. Amphipols, Nanodiscs, and Fluorinated Surfactants: Three Non Conventional Approaches to Studying Membrane Proteins in Aqueous Solutions. Annual Review of Biochemistry. 79, 737-775 (2010).
- Lee, S. C., et al. A Method for Detergent-Free Isolation of Membrane Proteins in their Local Lipid Environment. Nature Protocols. 11, 1149-1162 (2016).
- Frauenfeld, J., et al. A Saposin-Lipoprotein Nanoparticle System for Membrane Proteins. Nature Methods. 13, 345-351 (2016).
- Bayburt, T. H., Grinkova, Y. V., Sligar, S. G. Assembly of Single Bacteriorhodopsin Trimers in Bilayer Nanodiscs. Archives of Biochemistry and Biophysics. 450, 215-222 (2006).
- Denisov, I. G., Grinkova, Y. V., Lazarides, A. A., Sligar, S. G. Directed Self-Assembly of Monodisperse Phospholipid Bilayer Nanodiscs with Controlled Size. Journal of the American Chemical Society. 126, 3477-3487 (2004).
- Denisov, I. G., Sligar, S. G. Nanodiscs for Structural and Functional Studies of Membrane Proteins. Nature Structural, Molecular Biology. 23, 481-486 (2016).
- Hagn, F., Etzkorn, M., Raschle, T., Wagner, G. Optimized Phospholipid Bilayer Nanodiscs Facilitate High-Resolution Structure Determination of Membrane Proteins. Journal of the American Chemical Society. 135, 1919-1925 (2013).
- Carlson, M. L., et al. The Peptidisc, A Simple Method for Stabilizing Membrane Proteins in Detergent-Free Solution. eLife. 7, 34085 (2018).
- Carlson, M. L., et al. Profiling the E. coli Membrane Interactome Captured in Peptidisc Libraries. eLife. 8, 46615 (2019).
- Serdakowski, A., et al. A novel method to determine residual detergent in biological samples post endotoxin reduction treatment and evaluation of strategies for subsequent detergent removal. International Immunopharmacology. 37, 16-22 (2016).
- Smith, S. M. Strategies for the Purification of Membrane Proteins. Protein Chromatography. 681, 485-496 (2011).
- Lin, S. H., Guidotti, G. Purification of Membrane Proteins. Methods in Enzymology. 463, 619-629 (2009).
- Wolfe, A. J., Gugel, J. F., Chen, M., Movileanu, L. Kinetics of Membrane Protein-Detergent Interactions Depend on Protein Electrostatics. Journal of Physical Chemistry B. 122 (41), 9471-9481 (2018).
- Montigny, C., et al. Slow Phospholipid Exchange between a Detergent-Solubilized Membrane Protein and Lipid-Detergent Mixed Micelles: Brominated Phospholipids as Tools to Follow Its Kinetics. PLoS ONE. 12 (1), 0170481 (2017).
- Mills, A. T., Le H, T., Coulton, J. W., Duong, F. FhuA Interactions in a Detergent-Free Nanodisc Environment. Biochimica et Biophysica Acta - Biomembranes. 1838 (1), 364-371 (2014).
- Hong, P., Koza, S., Bouvier, E. S. P. Size-Exclusion Chromatography for the Analysis of Protein Biotherapeutics and their Aggregates. Journal of Liquid Chromatography Related Technologies. 35 (20), 2923-2950 (2012).
- Mahler, H. C., Friess, W., Grauschopf, U., Kiese, S. Protein aggregation: Pathways, induction factors and analysis. Journal of Pharmaceutical Sciences. 98 (9), 2909-2934 (2009).
- Trinkle-Mulcahy, L. Recent advances in proximity-based labeling methods for interactome mapping. F1000Research. 8, 135 (2019).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved