Method Article
גניבות של גבישי חלבון עם I3C באמצעות הקרנת מטריצת מיקרו-זרעים אקראית
In This Article
Summary
מאמר זה מציג שיטה ליצירת גבישי חלבון נגזר עם I3C (5-אמינו-2,4,6-triiodoisophthalic חומצה) באמצעות microseeding כדי ליצור תנאי התגבשות חדשים במסכי מטריצה דלילה. ניתן להגדיר את המגשים באמצעות רובוטים לחלק נוזלים או ביד.
Abstract
ההברה במבנה החלבון באמצעות קריסטלוגרפיה של קרני רנטגן דורשת הן גבישי מפזר באיכות גבוהה והן פתרון חישובי של בעיית שלב ההתפוררות. מבנים חדשניים שאין להם מודל הומולוגיה מתאים נגזרים לעתים קרובות עם אטומים כבדים כדי לספק מידע שלב ניסיוני. הפרוטוקול המוצג מייצר ביעילות גבישי חלבון נגזרים על ידי שילוב של הקרנת מטריצת microseeding אקראית עם נגזרת עם מולקולת אטום כבדה I3C (5-אמינו-2,4,6-triiodoisophthalic חומצה). על-ידי שילוב I3C לתוך סריג הגביש, ניתן לפתור ביעילות את בעיית שלב ההתפזרות באמצעות פיזור חריג באורך גל יחיד (SAD). סידור המשולש ההשוותי של אטומי יוד ב- I3C מאפשר אימות מהיר של תת-מבנה חריג נכון. פרוטוקול זה יהיה שימושי ביולוגים מבניים לפתור מבנים מקרומולקולריים באמצעות טכניקות מבוססות קריסטלוגרפיה עם עניין phasing ניסיוני.
Introduction
בתחום הביולוגיה המבנית, קריסטלוגרפיה רנטגן נחשבת טכניקה סטנדרטית זהב כדי לקבוע את המבנים ברזולוציה אטומית של מקרומולקולות. זה כבר נוצל בהרחבה כדי להבין את הבסיס המולקולרי של מחלות, מדריך פרויקטים עיצוב תרופה רציונלית ולהאריך את המנגנון הקטליטישל אנזימים 1,2. למרות שנתונים מבניים מספקים שפע של ידע, תהליך ביטוי וטיהור חלבונים, התגבשות וקביעת מבנה יכול להיות מייגע ביותר. מספר צווארי בקבוק נתקלים בדרך כלל כי לעכב את ההתקדמות של פרויקטים אלה וזה חייב להיות ממוען ביעילות לייעל ביעילות את צינור קביעת מבנה גביש.
בעקבות ביטוי רקומביננטי וטיהור, יש לזהות תנאים ראשוניים התגבשות אשר לעתים קרובות היבט מפרך וגוזל זמן של גבישים רנטגן. מסכי מטריצה ודלילה מסחריים המאחדים תנאים ידועים ופורסמו פותחו כדי להקל על צוואר בקבוקזה 3,4. עם זאת, זה נפוץ לייצר כמה להיטים מהסכים הראשוניים האלה למרות שימוש בדגימות חלבון טהורות ומרוכזות מאוד. התבוננות בטיפות ברורות מצביעה על כך שהחלבון לא יכול להגיע לרמות של שינון העל הנדרש כדי לגרום גביש. כדי לעודד גרעין קריסטל וצמיחה, ניתן להוסיף זרעים מופקים מקריסטלים קיימים מראש לתנאים וזה מאפשר דגימה מוגברת של מרחב התגבשות. איירטון וסטודרד הציגו לראשונה את שיטת הסינון של מטריצתהמיקרו-זרעים 5. גבישים באיכות ירודה נמחצו כדי ליצור מלאי זרעים ולאחר מכן נוספו באופן שיטתי לתנאי התגבשות המכילים מלחים שונים כדי ליצור גבישים חדשים באיכות iffraction שלא היו נוצרים אחרת. טכניקה זו שופרה עוד יותר על ידי D'Arcy ואח', שפיתחה הקרנה אקראית של מטריצת microseed (rMMS) שבה זרעים הוכנסולמסך התגבשות מטריצה רזרבי 6,7. זה שיפר את איכות הגבישים והגביר את מספר להיטי ההתגבשות בממוצע על ידי גורם של 7.
לאחר יצירת גבישים בהצלחה ומתקבלת תבנית פעירת רנטגן, נתקלים צוואר בקבוק נוסף בצורה של פתרון 'בעיית פאזה'. במהלך תהליך רכישת הנתונים, עוצמת iffraction (פרופורציונלי לריבוע של משרעת) נרשם אבל מידע השלב הולך לאיבוד, מה שנועץ לבעיית השלבים העוצרת קביעת מבנה מיידית8. אם חלבון היעד חולק זהות רצף גבוה לחלבון עם מבנה שנקבע קודם לכן, ניתן להשתמש בתחליף מולקולרי כדי להעריך אתמידע שלב 9,10,11,12. למרות ששיטה זו מהירה וזולת, ייתכן שמבני המודל לא יהיו זמינים או מתאימים. ההצלחה של שיטת החלפת מולקולרית מבוססת מודל הומולוגיה יורדת באופן משמעותי כמו זהות רצף נופל מתחת 35%13. בהיעדר מודל הומולוגיה מתאים, ניתן לבדוק שיטות ab initio, כגון ARCIMBOLDO14,15 ו- AMPLE16. שיטות אלה משתמשות במודלים או שברים חזויים חישוביים כנקודות התחלה להחלפה מולקולרית. AMPLE, המשתמשת במודלים דמה חזוי כנקודות התחלה, נאבקת לפתור מבנים של חלבונים גדולים (>100 שאריות) וחלבונים המכילים בעיקר β שונים. ARCIMBOLDO, אשר מנסה להתאים שברים קטנים כדי להרחיב לתוך מבנה גדול יותר, מוגבל לנתונים ברזולוציה גבוהה (≤2 Å) ועל ידי היכולת של אלגוריתמים להרחיב את השברים למבנה מלא.
אם שיטות החלפה מולקולריות נכשלות, יש להשתמש בשיטות ישירותכגוןהחלפת איזומורפית17,18 ופיזור חריג באורך גל יחיד (SAD19)או באורכי גל מרובים (MAD20). זה לעתים קרובות המקרה עבור מבנים חדשניים באמת, שבו הגביש חייב להיווצר או נגזר עם אטום כבד. זה יכול להיות מושגת על ידי השריה או שיתוף התגבשות עם תרכובת אטום כבד, שינוי כימי (כגון 5-bromouracil התאגדות ב RNA) או ביטוי חלבון מתויג (כגון שילוב חומצות סלנומטיונין או selenocysteine אמינו לתוך המבנה הראשי)21,22. הדבר מסבך עוד יותר את תהליך ההתגבשות ודורש סינון ואופטימיזציה נוספים.
מחלקה חדשה של תרכובות phasing, כולל I3C (5-אמינו-2,4,6-triiodoisophthalic חומצה) ו B3C (5-אמינו-2,4,6-tribromoisophthalic חומצה), מציעים יתרונות מרגשים על פני תרכובות phasing קייםמראש 23,24,25. הן I3C והן B3C כוללים פיגום טבעת ארומטי עם סידור לסירוגין של פיזורים חריגים הנדרשים עבור שיטות phasing ישיר וקבוצות פונקציונליות אמינו או קרבוקסילטים אינטראקציה ספציפית עם החלבון ולספק ספציפיות אתר מחייב. הסידור המשולש ההשוותי הבא של קבוצות מתכת כבדה מאפשר אימות פשוט יותר של מבנה המשנה phasing. בעת איסוף החומר למדריך, ישנם 26 מבנים המאוגדים ב- I3C בבנק נתוני החלבון (PDB), מהם 20 נפתרו באמצעות phasing SAD26.
פרוטוקול זה משפר את היעילות של צינור קביעת מבנה על ידי שילוב השיטות של נגזרת מתכת כבדה והקרנת rMMS כדי להגדיל בו זמנית את מספר להיטי התגבשות ולפשט את תהליך גביש derivatization. הראינו ששיטה זו הייתה יעילה מאוד עם ליזוים לבנים ביצה ותחום של חלבון ליצין חדשני מבקטריופט P6827. פתרון מבנה באמצעות צינור קביעת מבנה אוטומטי-ריקשה אוטומטי מאוד מתואר, מותאם במיוחד עבור מתחם phasing I3C. קיימים צינורות אוטומטיים אחרים שניתן להשתמש בהם כגון AutoSol28, ELVES29 ו- CRANK230. ניתן להשתמש גם בחבילות לא אוטומטיות לחלוטין כגון SHELXC/D/E31,32,33. שיטה זו מועילה במיוחד לחוקרים החוקרים חלבונים חסרי מודלים הומולוגיים ב-PDB, על ידי צמצום משמעותי של מספר שלבי הסינון והאופטימיזציה. תנאי מוקדם לשיטה זו הוא גבישי חלבון או משקע גבישי של חלבון היעד, שהושג מניסויים קודמים התגבשות.
Protocol
1. תכנון ושיקולים ניסיוניים
- השתמש גבישים קיימים מראש של החלבון של עניין, רצוי שנוצר באמצעות התגבשות אדי. לקבלת פרוטוקול כללי של התגבשות אדי, ראה בנוונוטי ומנגאני34. שיטות אחרות של התגבשות כגון microbatch תחת שמן דיפוזיה ממשק חינם ידרוש קצירת הגבישים לפני ריסוק כדי ליצור microseeds.
- בהכנת מלאי זרעים, השתמשו גבישים באיכות הגבוהה ביותר שניתן להקריב. ניתן לשפוט את הגביש האיכותי ביותר מבחינה ויזואלית בהתבסס על מורפולוגיה או שניתן לבחור את גביש ההתפוררות הטוב ביותר, אם נתונים כאלה זמינים. סביר מאוד כי גבישים באיכות טובה יותר מתקבלים לאחר אופטימיזציה באמצעות זריעה. במקרה שבו אין גבישים זמינים, משקעים גבישיים כגון spherulites ומחטים ניתן להשתמש.
- זהה גבישי מלח. גבישי מלח יכולים לגדול במסכי התגבשות יכולים להיראות כמו גבישי חלבון. שימוש גבישי מלח ב rMMS לא יספק תועלת ויבזבז מדגם יקר, ולכן חשוב לחסל מלח חיובי כוזב.
- גבישי מלח הם חזקים כאשר הם מרוסקים. יש למחוץ גבישים כדי ליצור מלאי זרעים, כך שאסטרטגיה זו רלוונטית במיוחד. אם נשמע קול סדק נשמע בעת ריסוק הגבישים, הגביש עשוי להיות מלח.
- אם החלבון מכיל שאריות טריפטופן וטירוסין, השתמש במיקרוסקופ פלואורסצנטי אולטרה סגול כדי לזהות גבישי חלבון אשר פלואורסמים בתנאי תאורה אלה.
- השתמשו בצבע Izit (מתילן כחול) כדי להכתים גבישי חלבון כדי להבדיל אותם גבישי מלח אשר נשארים לא מוכתמים יחסית. עם זאת, הליך זה הוא הרסני יותר ומומלץ רק אם אחד יש גבישים כדי לחסוך משכפלים של אותה טיפה.
הערה: למרות הבדיקות הנ"ל עשוי לתת תוצאות מבטיחות, גבישי מלח עדיין עשוי להיות בטעות גבישי חלבון. במקרה זה, ניתן להשתמש בניסויי iffraction כדי להבחין באופן מוחלט בין חלבון וגביש מלח.
2. הכנת מניות ליתיום I3C
- למדוד 120 מ"ג של I3C (5-אמינו-2,4,6-triiodoisophthalic חומצה) לתוך צינור 1.5 מ"ל microcentrifuge.
- להמיס I3C ב 200 μL של 2 M ליתיום הידרוקסיד. ניתן לחמם בעדינות את הפתרון באמצעות בלוק חום של 40-60°C כדי לעודד פירוק. פתרון ליתיום I3C שנוצר צריך להיות חום ויש לו ריכוז של 1 M.
התראה: ליתיום הידרוקסיד הוא מאכל. יש ללבוש משקפי בטיחות, כפפות ושכבת מעבדה. - מדוד את ה-pH של הפתרון. במידת הצורך, להוסיף כמויות קטנות של 1 M חומצה הידרוכלורית או 2 M ליתיום הידרוקסיד כדי להתאים את ה-pH בין 7 ו 8. להוסיף מים milliQ כדי להפוך את נפח הפתרון הסופי 400 μL. הריכוז של פתרון מניית I3C הוא 0.5 מיליון.
הערה: שלב 2.3 הוא אופציונלי. ה-pH של הפתרון צריך להיות בין pH 7-8 לפני כל התאמת pH. שלב זה צריך להתבצע אם החלבון של עניין מושפע מאוד על ידי pH. ניתן להשהות את הפרוטוקול כאן. ליתיום I3C ניתן לשמור בחושך ב 4 ° C לפחות שבועיים35.
3. תוספת I3C למלאי החלבון
- שיטה 1
- להוסיף ליתיום מלאי I3C ל 150 μL aliquot של חלבון היעד. הריכוז הסופי צריך להיות בין 5-40 mM ליתיום I3C.
- שיטה 2 (שיטה עדינה יותר)
- הכן מאגר דילול חלבונים התואם למאגר של חלבון היעד. למאגר דילול זה, הוסף ליתיום I3C מלאי כדי לתת ריכוז של ליתיום I3C בין 10-80 mM.
- לדלל את החלבון 1:1 עם מאגר דילול חלבון לתת ריכוז סופי של ליתיום I3C בין 5-40 mM.
הערה: חלבונים מסוימים יהיה לזרז עם בא במגע עם ריכוזים גבוהים של ליתיום I3C בשיטה 1, בעוד חלבונים אחרים יכולים לסבול את זה. שיטה 2 מפחיתה את הסבירות למשקעים. עם זאת, שיטה זו חצתה את ריכוז החלבון. עבור חלבונים שאין להם פרוטוקול התגבשות מבוסס, ריכוז חלבון של 10 מ"ג/מ"ל מומלץ בדרך כלל להקרנה ראשונית של התגבשות. מומלץ להשתמש ביחס טוחנת ראשוני של I3C לחלבון של 8. ניתן לייעל את ריכוז החלבון ויחס התחינה הטוחנת של I3C לחלבון לאחר המסך הראשוני.
4. ביצוע מלאי זרעים
- תכין גשוש מעוגל לריסוק גבישים.
- עם מבער בונזן על הלהבה הכחולה, לחמם פיפטה פסטר לכיוון האמצע שלה. בעזרת פינצטה, משוך את קצה הפיפטה פסטר כדי למשוך אותו החוצה לתוך קוטר דק של פחות מ 0.3 מ"מ.
- ברגע שהמקטע האמצעי דק מספיק, החזק את הקטע בלהבה כדי להפריד את הפיפטה בשלב זה וסבב את קצה הפיפטה כדי לסיים את גשושית הזכוכית.
הערה: מגרסה קריסטל בדיקה מעוגלת נמכרים על-ידי ספקי צד שלישי. אלה הם חלופה להכנת גששים מגולגלים.
- מניחים 5 צינורות מיקרוצנטריפוגה ב-1.5 מ"ל על קרח.
- תחת מיקרוסקופ אור, בדוק את מגש התגבשות עבור מצב מתאים כדי ליצור microcrystals. באופן אידיאלי, מורפולוגיה טובה גבישים גדולים נבחרים. עם זאת, טכניקה זו עובדת גם עם גבישי מורפולוגיה עניים, מחטים, צלחות, מיקרוקריסטלים וspherulites.
- פתח היטב את מגש ההתגבשות. ל-96 מגשי התגבשות אטומים בפלסטיק, השתמשו באזמל כדי לחתוך את הפלסטיק האוטם את הבאר. עבור מגשי טיפה תלויים אטומים בגריז, ניתן להסיר את הכיסוי באמצעות פינצטה והפוך על משטח אחיד.
- להעביר 70 μL של תמיסת מאגר לצינור microcentrifuge ולקרר אותו על קרח. לצינורות מיקרוצנטריפוגה אחרים, להוסיף 90 μL של תמיסת מאגר ולחזור לקרח כדי לצנן.
הערה: אם המאגר אינו כולל מספיק נפח או שאינו קיים (במקרה של מיקרובאץ' מתחת לשמן), צור מאגר התגבשות על-ידי ערבוב של הריגנטים המתאימים. - להרגיז את הגביש בטיפה באמצעות גשוש הגביש כדי למחוץ אותו ביסודיות. הגביש צריך להיות מרוסק לחלוטין אשר ניתן לפקח תחת המיקרוסקופ.
- מוציאים את כל הנוזל מהטיפה ומעבירים אותו לצינור המיקרו-צנטריפוגה עם תמיסת המאגר. מערבבים ולאחר מכן לקחת 2 μL של תערובת מצינור microcentrifuge ולהוסיף אותו בחזרה לבאר. לשטוף את הבאר עם הפתרון ולהעביר אותו לצינור microcentrifuge. חזור על שלב שטיפה זה פעם נוספת. מעתה ועד למקום, שמרו על צינור המיקרוצנטריפוגה קר כדי להימנע מהמסת המיקרו-זרעים בתערובת.
- מערבולת הצינור במהירות מקסימלית במהירות מקסימלית של 4 °C במשך 3 דקות, עוצר באופן קבוע כדי לצנן את הצינור על קרח כדי למנוע התחממות יתר.
הערה: פרוטוקולים מסוימים microseeding להוסיף חרוז זרעי polytetrafluoroethylene לצינור microcentrifuge כדי לסייע ריסוקקריסטל 7,36. השתמשנו בטכניקה ללא שימוש בחרוז זרעים בהצלחה, אבל לא רואים שום בעיה עם ניצול חרוז זרעים כדי לרסק גבישים. - בצע 1 ב 10 דילול סדרתי של מלאי הזרע על ידי העברה רצפת 10 μL בין פתרונות מאגר מקורר.
- אחסן מניות זרעים שלא ישמשו באופן מיידי ב- -80 °C.
5. הגדרת מסך rMMS
- הגדרת צלחת סינון 96 גם באמצעות רובוט חלוקת נוזל. בהיעדר רובוט, ניתן להשתמש בפיפטה רב ערוצית.
- להעביר 75 μL מבלוק באר עמוקה למגש התגבשות 96 היטב. להוסיף 1 μL לירידה התגבשות ו 74 μL למאגר.
- להעביר 1 μL של חלבון בתוספת ליתיום I3C, עשה בשלב 2, לירידה התגבשות.
- להעביר 0.1 μL של מלאי זרעים לירידה התגבשות.
- אטמו את הצלחת עם סרט איטום צלול ותדבו את הצלחת בטמפרטורה קבועה כדי לאפשר צמיחה גבישית.
- הגדרת מסכי שחרור תלויים
- משמנים את הקצוות של בארות הטיפה התלויות (מגשי התגבשות תלויים ניתן למצוא ב-24 ו-48 פורמטים טובים).
- להעביר 500 μL תמיסת גביש לתוך מאגר.
- ליד מרכז מגלשת כיסוי זכוכית, מניחים טיפה 1 μL של חלבון בתוספת ליתיום I3C, עשה בשלב 2.
- הוסף 1 μL של פתרון התגבשות לטיפה.
- להעביר 0.1 μL של מלאי זרעים לירידה התגבשות.
- הפוך את החלקה של הכיסוי ואטום היטב את התגבשות על-ידי דחיפת החלקה על הכריכה לתוך הגריז.
- דגירה את הצלחת בטמפרטורה קבועה כדי לאפשר צמיחה גבישית.
הערה: עם מלאי זרעים חדש ולא נבדק, מומלץ להשתמש במלאי הזרעים המרוכז ביותר כדי למקסם את הסיכויים לקבל להיטי התגבשות. ניתן להגדיר את התנאים הבאים עם ריכוז זרע מופחת כדי לייעל את מספר הגבישים.
- בדוק מגשי קריסטל תחת מיקרוסקופ באופן קבוע לצמיחת קריסטל. אם גבישים הם באיכות מספקת, הם יכולים להיקצר לאיסוף נתונים. גבישים יכולים לשמש גם כדי ליצור מניות זרעים חדשים מסכי rMMS חדשים כדי לאפשר אופטימיזציה איטרטיבית.
6. איסוף נתונים
- גבישי קציר באמצעות cryoloops, cryoprotect גבישים פלאש לקרר אותם בחנקן נוזלי. למידע נוסף על גבישי קירור פלאש, עייןTeng 37 ו Garman ו מיטשל38.
- במהלך שלב ההקפאה, אם הגביש עובר דרך תמיסה מים חדשה, I3C יכול ללכת לאיבוד מן הגביש בשל זה עלוקות לתוך פתרון cryoprotection. השתמש ליתיום I3C בתמיסת cryoprotection בריכוז התואם את מצב התגבשות כדי למתן את זה.
- גבישים שגדלו באמצעות פרוטוקול זה כבר cryoprotected בהצלחה באמצעות Parabar 10312 שמן מבוסס cryoprotectant (המפטון מחקר).
הערה: ניתן להשהות את הפרוטוקול כאן בזמן גבישים מאוחסנים בחנקן נוזלי.
התראה: חנקן נוזלי יכול לגרום לכוויות קור. חנקן נוזלי יכול גם לגרום לחנק אם נעשה שימוש בחללים סגורים.
- הר את הגביש על מניומטר מקור הרנטגן ולאסוף נתוני מפזר באמצעות הפרוטוקול הספציפי למקור הרנטגן.
- טכניקה זו מסתמכת על אות חריג מאיטומי יוד ב- I3C. לכן, בחר את האנרגיה של קרני הרנטגן כדי למקסם את האות הזה.
- הגדר מקורות רנטגן synchrotron עם אנרגיות tunable נמוך ככל האפשר. עבור קווי קרן גביסטלוגרפיה מקרומולקולריים רבים, האנרגיה הנמוכה ביותר הניתנת להגדרה היא 8000 עד 8500 eV.
- אין אפשרות לכוונן מקורות רנטגן של אנודה מסתובבת. מקורות אנודה נפוצים עם נחושת יש קצה Kα ב 8046 eV, אשר מספק אות חריג טוב עבור יוד (f" = 6.9 e). מקורות אנודה עם כרום יש קצה Kα ב 5415 eV, אשר מספק אות חריג גדול עבור יוד (f" = 12.6 e).
- נזק לקרינה הוא בעיה משמעותית במהלך איסוף נתונים כפי שהוא יהיה לבזות את האות החריג39. בחר את זמן החשיפה ואת ההחלקה של הקרן כדי להשיג את השיעור הטוב ביותר תוך מזעור מינון הקרינה.
הערה: בתרכובת phasing דומה עם אטומי יוד הוחלפו אטומי ברום, נזק קרינה כבר הראה לגרום לרדיוליזה של קשר פחמן ברום וירידה בתפוסה של אטומי ברום24.- השתמש בקרן הפוכה SAD איסוף נתונים כאסטרטגיית איסוף. הנתונים נאספים טריזים, עם טריזים הפוכים שנאספו אחד אחרי השני. זה מאפשר זוגות פרידל להיאסף עם מינון שווה ערך, וכתוצאה מכך מדידה משופרת של אות חריג פחות מושפע נזק לקרינה. לדוגמא, אסטרטגיית טריז שמונה לאסוף 360° תכלול איסוף הנתונים בסדר של טריז 1 (0°-45°), טריז 2 (180°-225°), טריז 3 (46°-90°), טריז 4 (225°) -270°), טריז 5 (90°-135°), טריז 6 (270°-315°), טריז 7 (135°-180°) וטריז 8 (315°-360°).
הערה: סיבוב רציף הוא אסטרטגיית איסוף חלופית לאסטרטגיית איסוף של אוסף נתוני קרן הפוכה. להשוואה עדכנית של אסטרטגיות האיסוף, ראו Garcie-Bonte & Katona40.
- השתמש בקרן הפוכה SAD איסוף נתונים כאסטרטגיית איסוף. הנתונים נאספים טריזים, עם טריזים הפוכים שנאספו אחד אחרי השני. זה מאפשר זוגות פרידל להיאסף עם מינון שווה ערך, וכתוצאה מכך מדידה משופרת של אות חריג פחות מושפע נזק לקרינה. לדוגמא, אסטרטגיית טריז שמונה לאסוף 360° תכלול איסוף הנתונים בסדר של טריז 1 (0°-45°), טריז 2 (180°-225°), טריז 3 (46°-90°), טריז 4 (225°) -270°), טריז 5 (90°-135°), טריז 6 (270°-315°), טריז 7 (135°-180°) וטריז 8 (315°-360°).
7. עיבוד נתונים ופתרון מבנה
- בצע הפחתת נתונים על נתוני ההתפלה באמצעות XDS41, במטרה למקסם את האות החריג. פרמטרי קלט להפחתת נתונים הם ספציפיים ל- dataset עשויים לדרוש ניסוי וטעייה מסוימים. הנה כמה המלצות להתחלה.
- קבע את החוק של פרידל כ"שקר". בצע את CORRECT פעמיים, STRICT_ABSORPTION_CORRECT = TRUE ו- STRICT_ABSORPTION_CORRECT = FALSE. ריצה אחת יכולה להיות אות חריג גבוה יותר מהשני. השווה את האותות החריגים בין הריצות באמצעות הדיסציפלינות 'אנומליה קור' ו'SigAno' בפלט. פעולה זו מספקת מחוון של איכות הנתונים.
- הפעל SHELXC על XDS_ASCII. קובץ HKL לאינדיקציה מדויקת יותר של אות חריג. המשמעת של ראנום תיתן אינדיקציה לאות החריג ברזולוציות שונות.
- הפעל חסר טעם42 ו- AIMLESS43 כדי להגדיל את הנתונים. ב- AIMLESS, הגדר את הפרמטר אנומלי. אם נעשה שימוש ב- GUI, בחר באפשרות הפרד זוגות חריגים עבור דחייה חריגה ומיזוג סטטיסטיקה. בדיקת ניתובים ברזולוציה שונה עשויה להידרש כדי למקסם את האות החריג.
- לפתור את מבנה החלבון באמצעות צינור אוטומטי ריקשה אוטומטי מבנה גבישקביעת 44. אוטו-ריקשה תנסה לפתור את בעיית השלב ולבנות את מבנה הגביש של החלבון באופן אוטומטי עם מידול חלבונים ותוכנות עידון.
- עבור חלבונים ללא תבנית מודל הומולוגיה, הפעל את פרוטוקול SAD של ריקשה אוטומטית במצב מתקדם. הזן את הפרמטרים הדרושים.
- בחר חלבון כסוג המולקולה.
- הזן את אורך הגל של איסוף הנתונים באנגסטרום (Å).
- בחר "I" כרכיב תת-מבנה כדי לציין שנעשה שימוש באטומי יוד.
- בחר "i3c" כסוג מבנה משנה כדי לציין I3C היה מולקולת phasing.
- בחר "sub_direct" כשיטת קביעת מבנה המשנה. שיטה זו משתמשת ב- SHELXD32 כדי לחפש את מבנה המשנה.
- בחר "3" כמספר מבנה המשנה הצפוי לכל מונומר.
- הזן "1" כחיתוך הרזולוציה של חיפוש במבנה משנה. הדבר מאפשר לריקשה האוטומטית לקבוע באופן אוטומטי ניתק רזולוציה מתאים.
- הזן את מספר השאריות במונומר יחיד, קבוצת חלל של ערכת הנתונים ומספר המולקולות ביחידה האסימטרית המבוססת על מקדם מתיוס.
- בחר את רמת ההפצה המתאימה של נתוני רנטגן המתאימה לצרכים. בחירת "מפתחי AutoRickshaw" תאפשר למפתחי אוטו-ריקשה לפתור את הריצה בשאלה אם מתעוררות בעיות.
- הזן את הנתונים החריגים כקובץ mtz.
- הזן את רצף החלבון כקובץ seq, pir או txt. ניתן ליצור קובץ seq בעורך טקסט (כגון פנקס רשימות++9 ב- Windows או ננו בלינוקס). צור קובץ חדש, הזן את הרצף הראשי של החלבון כקו ארוך אחד או מופרד באמצעות מעברי שורה. שמור את הקובץ עם סיומת הקובץ .seq
- הזן כתובת דואר אלקטרוני מוסדית.
- עבור חלבונים ללא תבנית מודל הומולוגיה, הפעל את פרוטוקול SAD של ריקשה אוטומטית במצב מתקדם. הזן את הפרמטרים הדרושים.
- התוצאות מועברות באמצעות קישור אינטרנט הנשלח לכתובת הדואר האלקטרוני שסופקה.
הערה: AutoRickshaw הוא צינור אוטומטי המפעיל חבילות תוכנה קריסטלוגרפיה שונות כדי לפתור מבנה גביש רנטגן32,33,45,46,47,48,49,50,51,52,53,54,55,56,57,58. אם הריצה של ריקשה אוטומטית לא מצליחה לפתור את המבנה, ניתן לבדוק הגדרות אחרות של ריקשה אוטומטית. ניתן לשנות את שיטת קביעת המבנה ל- "sub_phassade" כדי להשתמש ב- Phaser59 במקום SHELXD32. ניתן גם להגדיל או להקטין את מספר מבנה המשנה הצפוי לכל מונומר. - במהלך ההתפלה הניסיונית של מבנה הגביש, אוטו-ריקשה תנסה למקם אטומים כבדים בתא היחידה, וליצור תת-מבנה. סידור המשולש ההוויוני של אטומי יוד ב-I3C מציג דרך יעילה לאימות מבנה המשנה. אם שלב 6.3 נכשל, אימות מבנה המשנה עשוי לסייע בפתרון פתרון מבנה.
- הורד את רשימת אתרי האטום הכבדים מדף התוצאות של ריקשה אוטומטית. זהו היפר-קישור הנקרא "אתרי אטום כבדים". פעולה זו תוריד קובץ טקסט עם אתרי האטום הכבדים.
- שנה את סיומת הקובץ של הקובץ .txt .pdb.
- פתח את קובץ PDB ב- Coot60. הפעל סימטריה כדי לראות אטומים כבדים אחרים מיחידות אסימטריות שכנות.
- למדוד את המרחקים בין האטומים הכבדים, כולל על פני יחידות אסימטריות. I3C יופיע כמשולש שווה צלעות עם אורך צד של 6 אנגסטרום. הנוכחות של משולש עם ממדים אלה מצביעה על כך שמיקום האטומים הכבדים האלה נכונים.
תוצאות
שילוב I3C לתוך rMMS יכול ליצור תנאים חדשים התומכים בצמיחת קריסטל נגזרת
היעילות של הקרנת RMMS בו זמנית וdivatization I3C הוכח בשני חלבונים, ליזוזים לבן ביצה תרנגולת (HEWL, שהושג כאבקה lyophilized) ואת Orf11 lysin N-תחום (Orf11 NTD) מן החיידק P68. כל חלבון הוקרן נגד PEG/ION HT בארבעה תנאים שונים, כולל: unseeded, זרעים, לא זרעים עם I3C וזרע עם I3C (איור 1). עבור שני החלבונים, התוספת היחידה של I3C לא להגדיל את מספר התנאים התגבשות. במקרה של Orf11 NTD, זוהה מצב מתאים אחד בלבד עם ובלי I3C (איור 1B). כאשר I3C נוסף למסכי HEWL, מספר הלהיטים הצטמצם מ-31 ל-26, והדגיש את המורכבות הנוספת של התגבשות בעת הצגת תרכובות phasing (איור 1A). עולה בקנה אחד עם מחקרים אחרים, הוספת זרעים למסכי מטריצה דליל מסחרי כדי ליצור מסך rMMS הגדילה באופן משמעותי את מספר תנאי התגבשות אפשריים עבור שני החלבונים, וכתוצאה מכך עלייה של פי 2.1 ו-6 עבור HEWL ו-Orf11 NTD,בהתאמה 6,61 ( איור1). והכי חשוב, תוספת בו-זמנית של I3C וזרע הגדילה את מספר הלהיטים ביחס למסך לא מוזרע, מה שהפגין גידול של פי 2.3 ו-7 עבור HEWL ו-Orf11 NTD, בהתאמה. רבים מהקריסטלים של rMMS בנוכחות I3C להראות מורפולוגיה קריסטל מעולה (איור 2).
זריעה מאפשרת שליטה זהירה במספר גביש במסכי I3C rMMS
בניסויי microseeding, מספר הזרעים שהוכנסו לתוך ניסוי התגבשות יכול להיות נשלט על ידי דילול של מלאי הזרעים וזה מאפשר שליטה מדויקת של גרעיןבטיפה 7,36. זה לעתים קרובות מאפשר גבישים גדולים יותר ליצור מאז יש תחרות מופחתת של מולקולות חלבון באתרי גרעין. יתרון זה משתרע גם על שיטת I3C-rMMS והוכח בהצלחה הן ב-HEWL והן ב-Orf11 NTD. בילוי של מצב התגבשות שזוהה ממסך I3C-rMMS עם מלאי זרעים מדולל הניב פחות אך גבישים גדולים יותר(איור 3).
phasing עצוב יכול לשמש כדי לפתור את המבנים מקריסטלים נגזר rMMS I3C מסך
גבישים שגדלו באמצעות מלאי הזרעים מדולל המוצג איור 3 שימשו כדי לפתור את המבנה של החלבונים באמצעות phasing SAD באמצעות נתוני iffraction מקריסטל יחיד(איור 4). הנתונים נאספו בקו הקרן האוסטרלי Synchrotron MX162. פרטים מפורטים על איסוף נתונים ופתרון מבנה מתוארים במקוםאחר 27.
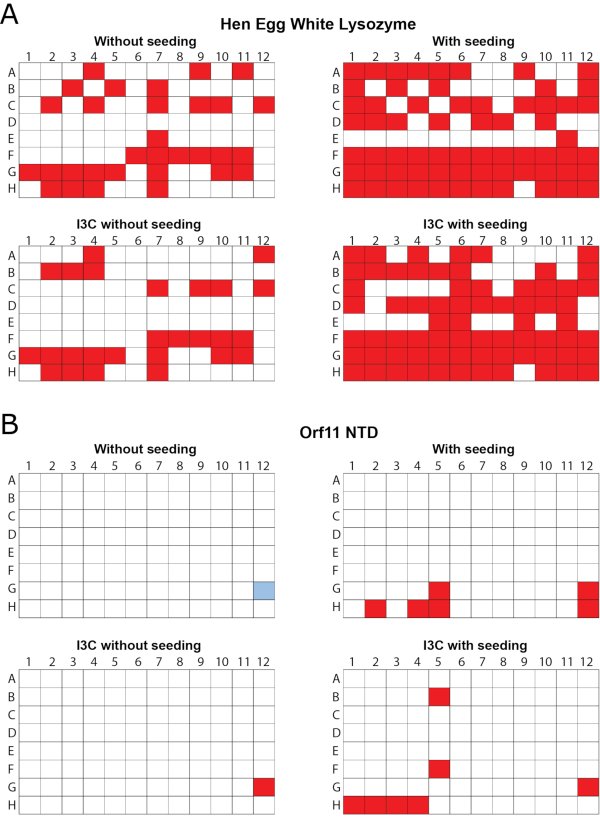
איור 1 - rMMS שימש ליצירת תנאים חדשים לצמיחת קריסטל בנוכחות I3C עבור שני חלבוני בדיקה. 96 מסכי התגבשות דיפוזיה אדים היטב בוצעו באמצעות מסכי מטריצה דליל מסחרי. (א)ליזום לבן ביצה חן נבדק עם מסך HT אינדקס. מגשים נזרעו עם גבישי HEWL גדל 0.2 M אמוניום טרטרט dibasic pH 7.0, 20% (w / v) פוליאתילן גליקול 3350. (ב)Orf11 NTD מ bacteriophage P68 נבדק עם מסך PEG / ION. מגשי NTD Orf11 נזרעו מקריסטלים ממצב G12 מהמסך ללא זרעים, המוצג בכחול. תנאים התומכים בצמיחת קריסטל מוצגים באדום. rMMS זריעה בנוכחות והיעדר I3C שניהם נתנו באופן משמעותי יותר להיטי קריסטל מאשר מגשים לא זרעים. איור הותאם מ-Truong ואח '27. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
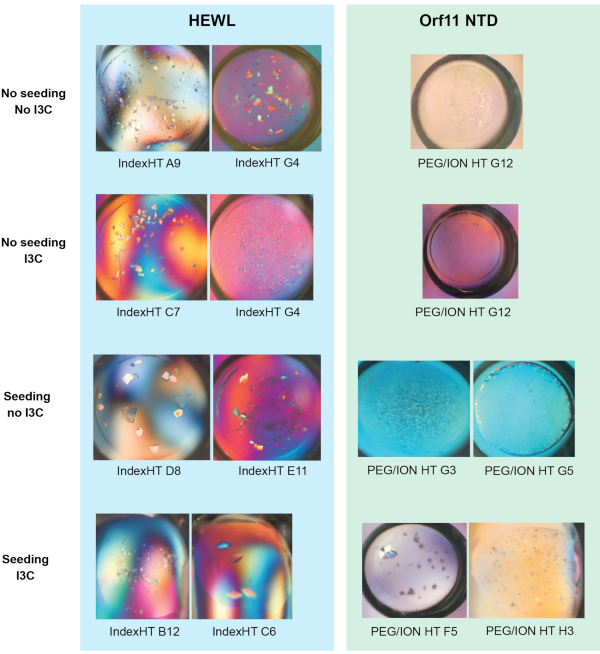
איור 2 - תמונות מייצגות של גבישים הגדלים מניסויים דיפוזיה אדים המוצגים איור 1 (א) ו- (ב). איור הותאם מ-Truong ואח '27. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 3 - דילול מלאי הזרעים הוא דרך יעילה להפחית את הגרעין במצב התגבשות שנמצא באמצעות שיטת I3C-rMMS, כדי לשלוט במספר הגבישים הנוצרים. הפחתת גרעין בתוך ירידה לעתים קרובות גורמת גבישים גדל לממדים גדולים יותר. איור הותאם מ-Truong ואח '27. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.

איור 4 - Orf11 NTD (PDB ID 6O43) ו- HEWL (PDB ID 6PBB) התגבשו באמצעות שיטת I3C-rMMS ונפתרו באמצעות ריקשה אוטומטית SAD phasing. (א)מבני רצועת הכלים של HEWL ו- Orf11 NTD נפתרו באמצעות phasing ניסיוני. (ב)מולקולת I3C הקשורה ל-HEWL ו-Orf11 NTD. (ג) אטומי יוד חריגים ב- I3C מסודרים במשולש שווה צלעות של 6 Å. לכן הנוכחות של משולש זה במבנה המשנה phasing מצביע על כך שיש מולקולת I3C במיקום זה. לחץ כאן כדי להציג גירסה גדולה יותר של נתון זה.
Discussion
קביעת מבנה של חלבון חדשני בהיעדר מודל הומולוגיה מתאים להחלפה מולקולרית דורשת ניסויים. שיטות אלה דורשות התאגדות של אטומים כבדים לתוך גביש החלבון אשר מוסיף רמה של מורכבות לצינור קביעת מבנה יכול להציג מכשולים רבים שיש לטפל. אטומים כבדים יכולים להיות משולבים ישירות לתוך החלבון באמצעות ביטוי מתויג באמצעות סלנומטיונין וסלנוצישטאין. מכיוון ששיטה זו יקרה, מייגעת עלולה לגרום לתפוקות חלבון נמוכות יותר, חלבון מתויג מתבטא לעתים קרובות לאחר שנמצאו תנאי התגבשות ואופטימיזציה עם חלבון ללא תווית. לחלופין, ניתן להפיק קריסטלים על-ידי השריה בתמיסה המכילהאטומים כבדים 22,63,64. שיטה זו משתמשת לעתים קרובות גבישים באיכות גבוהה ולכן מבוצעת לאחר שיטת התגבשות חזקה כבר פותחה. בהצלחה להשיג גביש נגזר באמצעות שיטה זו דורש אופטימיזציה נוספת של הליכי השריה והקרנה של תרכובות phasing שונות, ולכן הוספת זמן נוסף לתהליך מייגע כבר.
התגבשות משותפת של החלבון עם האטום הכבד יכולה להתבצע בשלב ההקרנה, ובכך לייעל ביעילות את התהליך ולהפחית את צעדי המניפולציה הגבישית שיכולים לגרום נזק. עם זאת, עדיין קיים התרחיש הפוטנציאלי של השגת כמה להיטי התגבשות ראשוניים ואת הבעיה של בחירת תרכובת אטום כבד תואם. תרכובות phasing רבות הזמינות כיום אינן תואמות עם מקדים, מאגרים ותוספים נמצאים בדרך כלל בתנאי התגבשות. הם עשויים להיות מסיסים במאגרי גופרית ופוספט, chelate כדי ציטראט ואצטט, להגיב שלילי עם HEPES וטריס מאגרים או להיות מבודד על ידי DTT ו β-mercaptoethanol21. כמו תרכובת phasing I3C אינו סובל מאי-תואמות אלה, זה תרכובת phasing חזקה שיכול להיות מותנה לתנאים רבים ושונים.
במחקר זה, שיטה יעילה של ייצור גבישים נגזרים מוכן phasing SAD באמצעות התגבשות בו-זמנית של תרכובת phasing I3C ו rMMS מוצג. השילוב של שתי הטכניקות מגדיל את מספר להיטי ההתגבשות, כאשר רבים מהתנאים שיפרו את מאפייני המורפולוגיה וההתפכה. הן במקרי בדיקה של Orf11 NTD והן במקרי בדיקת HEWL, זוהו תנאים חדשים במסך I3C-rMMS שנעדרו כאשר I3C לא היה נוכח. פוטנציאל, I3C עשוי להיקשר לטובה לחלבון, להקל על היווצרות וייצוב של מגעים גביש27. בתורו, זה עלול לגרום התגבשות ואולי לשפר את מאפייני ההתגבשות. מלבד היותו מתחם תואם מסכי מטריצה דלילה, I3C הוא גם מתחם phasing אטרקטיבי בשל המאפיינים הפנימיים שלה. הקבוצות הפונקציונליות המחליפיות עם יוד על פיגום הטבעת הארומטי מאפשרות כריכה ספציפית לחלבונים. זה מוביל לתפוסה גדולה יותר ועלול להפחית את אות הרקע23. יתר על כן, הסידור של מפזרים חריגים במשולש שווה צלעות ברור בתת-מבנה וניתן להשתמש בו כדי לאמת במהירות איגוד של I3C (איור 4B ו- 4C). לבסוף, הוא יכול לייצר אות חריג עם קרינת סינכרוטרון tunable, כמו גם כרום ונחושת מסתובב מקורות רנטגן אנודה. לכן, ניתן להחיל אותו על זרימות עבודה רבות ושונות. כמו I3C זמין נרחב ולא יקר לרכישה, גישה זו היא בהישג יד עבור רוב מעבדות ביולוגיה מבנית.
קיימים מספר שיקולים ניסיוניים שיש לטפל בהם בעת שימוש בשיטת I3C-rMMS. אין אפשרות להחיל שיטה זו אם לא ניתן להשיג חומר גבישי ראשוני של החלבון. במקרים קשים, חומר גבישי מחלבון הומולוגי יכול לשמש גם כדי ליצור מלאי זרעים. גישה זו צולבת זרעים rMMS הראה כמה תוצאות מבטיחות7. אופטימיזציה של מספר גביש באמצעות דילול של מלאי הזרעים היא צעד מכריע, אשר אין להתעלם, כדי למקסם את הסיכוי לייצר גבישים גדולים באיכות גבוהה ורכישת נתוני iffraction מתאימים. אם יש מעט אתרי I3C שזוהו ביחידה האסימטרית, יש למטב את התנאים התגבשות עוד יותר עם ריכוז מוגבר של I3C. זה עשוי להגדיל את התפוסה של I3C כדי למקסם את האות החריג ולסייע גביש נגזר.
יכולים להיות מקרים שבהם טכניקה זו לא יכולה להיות השיטה האופטימלית כדי להפיק גבישי חלבון. ככל שגודלו של חלבון או קומפלקס חלבון גדל, המספר המוגבל של אתרי I3C על פני השטח של החלבון לא יכול לספק מספיק כוח phasing כדי לפתור את המבנה. בתרחישים אלה שבהם גודל החלבון חשוד להיות phasing, תיוג סלנומתיון של החלבון עשוי להיות גישה בת קיימא יותר כדי phasing החלבון. אם החלבון יש מספר מספיק של שאריות מתיונין בחלבון (מומלץ שיש לפחות מתיונין אחד לכל 100שאריות 65) ויעילותגבוהה התאגדות סלנומתיונין לתוך חלבון ניתן להשיג (כגון במערכות ביטויחיידקים 66), אטומי סלניום תפוסה גבוהה מרובים יהיו נוכחים גבישים לשלב את המבנה.
בנוסף, חלבונים מסוימים עשויים מטבעם להיות לא מתאימים לדריבעה עם I3C. אתרי איגוד I3C על חלבונים תלויים במבנה החלבון. ייתכנו חלבונים שבאופן טבעי יש כמה תיקונים חשופים תואמים לאיגוד I3C. לכן, זה לא בלתי צפוי כי ייתכנו קשיים בהתגבשות חלק חלבוני היעד עם I3C.
Disclosures
לסופרים אין מה לחשוף.
Acknowledgements
מחקר זה נערך על קו הקרן MX1 ב Synchrotron האוסטרלי, חלק ANSTO. המחברים רוצים להכיר חברים במעבדות שירווין וברונינג לדיונים על עבודה זו. המחברים רוצים גם להכיר ד"ר סנטוש Panjikar וד"ר לינדה Whyatt-Shearwin שתרמו לעבודה המקורית שהייתה חלוצה פרוטוקול זה.
המימון הבא מוכר: מועצת המחקר האוסטרלית (להעניק Nos. DP150103009 ו- DP160101450 לקית' א. שירווין); אוניברסיטת אדלייד (תוכנית ההכשרה הממשלתית האוסטרלית למחקר מלגה ג'יה קויין טרונג וסטפני נגוין).
Materials
| Name | Company | Catalog Number | Comments |
| 10 mL disposable luer lock syringes | Adelab Scientific | T3SS10LAT | Used for dispensing vacuum grease for hanging drop crystal tray wells |
| 24 well tissue culture plate | Sigma Aldrich | CLS3527 | Used for hanging drop crystal tray |
| 3 inch wide Crystal Clear Sealing Tape | Hampton Research | HR4-506 | For 96 well crystallization screens set up by robot |
| 5-amino-2,4,6-triiodoisophthalic acid | Alfa Aesar | B22178 | Commonly referred to as I3C in the article |
| Art Robbins Intelli-Plate 96-2 Original | Hampton Research | HR3-297 | For 96 well crystallization screens set up by robot |
| Coverslips | Thermo Fisher Scientific | 18X18-2 | Coverslips for hanging drop crystal tray wells |
| Dow Corning vacuum grease | Hampton Research | HR3-510 | Used for sealing hanging drop crystal tray wells |
| Eppendorf Pipette 0.1 μL-2.5 μL | Eppendorf | 3120000011 | |
| Gilson Pipette 2 μL-20 μL | John Morris Group | 1153247 | |
| Gilson Pipette 20 μL-200 μL | John Morris Group | 1152006 | |
| Glass pasteur pipettes | Adelab Scientific | HIR92601.01 | |
| Hen Egg White Lysozyme | Sigma-Aldrich | L6876 | Approximately 95% pure |
| IndexHT screen | Hampton Research | HR2-134 | |
| Microscope illuminator | Meiji Techno | FT192/230 | Light source to illuminate crystallography experiments |
| PEG/ION HT screen | Hampton Research | HR2-139 | |
| Phoenix Liquid Dispenser | Art Robbins Instruments | 602-0001-10 | |
| Scalpel with scalpel blade no. 15 | Adelab Scientific | LV-SMSCPO15 | |
| Seed bead kit | Hampton Research | HR2-320 | Kit contains a glass probe for crushing crystals. A PTFE seed bead, designed for crushing crystals, is also part of the kit but not used in this protocol. |
| Stereo microscope | Meiji Techno | EMZ-5TR | Microscope for visualising crystallography experiments |
| Tweezers | Sigma-Aldrich | T5415 | |
| Vortex mixer | Adelab Scientific | RAVM1 |
References
- Zheng, H., Hou, J., Zimmerman, M. D., Wlodawer, A., Minor, W. The future of crystallography in drug discovery. Expert Opinion on Drug Discovery. 9 (2), 125-137 (2014).
- Oakley, A. J., Wilce, M. C. J. Macromolecular crystallography as a tool for investigating drug, enzyme and receptor interactions. Clinical and Experimental Pharmacology and Physiology. 27 (3), 145-151 (2000).
- Jancarik, J., Kim, S. H. Sparse matrix sampling. A screening method for crystallization of proteins. Journal of Applied Crystallography. 24, 409-411 (1991).
- Newman, J., et al. Towards rationalization of crystallization screening for small- To medium-sized academic laboratories: The PACT/JCSG+ strategy. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1426-1431 (2005).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta Crystallographica Section D: Biological Crystallography. 60 (3), 601-605 (2004).
- D'Arcy, A., Villard, F., Marsh, M. An automated microseed matrix-screening method for protein crystallization. Acta Crystallographica Section D: Biological Crystallography. 63 (4), 550-554 (2007).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Taylor, G. The phase problem. Acta Crystallographica - Section D Biological Crystallography. 59 (11), 1881-1890 (2003).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A. 46 (2), 73-82 (1990).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Millán, C., Jiménez, E., Schuster, A., Diederichs, K., Usón, I. ALIXE: a phase-combination tool for fragment-based molecular replacement. Acta Crystallographica Section D. 76 (3), 209-220 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: Recent developments in Phenix. Acta Crystallographica Section D: Structural Biology. 75, 861-877 (2019).
- Abergel, C. Molecular replacement: Tricks and treats. Acta Crystallographica Section D: Biological Crystallography. 69 (11), 2167-2173 (2013).
- Pröpper, K., et al. Structure solution of DNA-binding proteins and complexes with ARCIMBOLDO libraries. Acta Crystallographica Section D: Biological Crystallography. 70 (6), 1743-1757 (2014).
- Rodríguez, D. D., et al. Crystallographic ab initio protein structure solution below atomic resolution. Nature Methods. 6 (9), 651-653 (2009).
- Bibby, J., Keegan, R. M., Mayans, O., Winn, M. D., Rigden, D. J. AMPLE: A cluster-and-truncate approach to solve the crystal structures of small proteins using rapidly computed ab initio models. Acta Crystallographica Section D: Biological Crystallography. 68 (12), 1622-1631 (2012).
- Green, D. W., Ingram, V. M., Perutz, M. F. The structure of haemoglobin - IV. Sign determination by the isomorphous replacement method. Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 225 (1162), 287-307 (1954).
- Blow, D. M., Rossmann, M. G. The single isomorphous replacement method. Acta Crystallographica. 14 (11), 1195-1202 (1961).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods in Enzymology. 115, 90-112 (1985).
- Hendrickson, W. A. Determination of macromolecular structures from anomalous diffraction of synchrotron radiation. Science. 254 (5028), 51-58 (1991).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallographica Section D: Structural Biology. 72 (3), 303-318 (2016).
- Dauter, Z., Dauter, M., Rajashankar, K. R. Novel approach to phasing proteins: Derivatization by short cryo-soaking with halides. Acta Crystallographica Section D: Biological Crystallography. 56 (2), 232-237 (2000).
- Beck, T., Krasauskas, A., Gruene, T., Sheldrick, G. M. A magic triangle for experimental phasing of macromolecules. Acta Crystallographica Section D: Biological Crystallography. 64 (11), 1179-1182 (2008).
- Beck, T., Gruene, T., Sheldrick, G. M. The magic triangle goes MAD: Experimental phasing with a bromine derivative. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 374-380 (2010).
- Beck, T., Da Cunha, C. E., Sheldrick, G. M. How to get the magic triangle and the MAD triangle into your protein crystal. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (10), 1068-1070 (2009).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Truong, J. Q., Panjikar, S., Shearwin-Whyatt, L., Bruning, J. B., Shearwin, K. E. Combining random microseed matrix screening and the magic triangle for the efficient structure solution of a potential lysin from bacteriophage P68. Acta Crystallographica Section D: Structural Biology. 75 (7), 670-681 (2019).
- Terwilliger, T. C., et al. Decision-making in structure solution using Bayesian estimates of map quality: The PHENIX AutoSol wizard. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 582-601 (2009).
- Holton, J., Alber, T. Automated protein crystal structure determination using ELVES. Proceedings of the National Academy of Sciences of the United States of America. 101 (6), 1537-1542 (2004).
- Skubák, P., Pannu, N. S. Automatic protein structure solution from weak X-ray data. Nature Communications. 4, (2013).
- Sheldrick, G. M. Crystal structure refinement with SHELXL. Acta Crystallographica Section C: Structural Chemistry. 71, 3-8 (2015).
- Schneider, T. R., Sheldrick, G. M. Substructure solution with SHELXD. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1772-1779 (2002).
- Sheldrick, G. M. Macromolecular phasing with SHELXE. Zeitschrift fur Kristallographie. 217 (12), 644-650 (2002).
- Benvenuti, M., Mangani, S. Crystallization of soluble proteins in vapor diffusion for x-ray crystallography. Nature Protocols. , (2007).
- Beck, T. . Sticky triangles New tools for experimental phasing of biological macromolecules. , (2010).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 55 (5), 988-993 (1999).
- Teng, T. -. Y. Mounting of crystals for macromolecular crystallography in a free-standing thin film. Journal of Applied Crystallography. 23 (5), 387-391 (1990).
- Garman, E. F., Mitchell, E. P. Glycerol concentrations required for cryoprotection of 50 typical protein crystallization solutions. Journal of Applied Crystallography. 29, 584-587 (1996).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garcia-Bonete, M. J., Katona, G. Bayesian machine learning improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section A: Foundations and Advances. 75, 851-860 (2019).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D: Biological Crystallography. 62 (1), 72-82 (2006).
- Evans, P. R., Murshudov, G. N. How good are my data and what is the resolution. Acta Crystallographica Section D: Biological Crystallography. 69 (7), 1204-1214 (2013).
- Panjikar, S., Parthasarathy, V., Lamzin, V. S., Weiss, M. S., Tucker, P. A. Auto-Rickshaw: An automated crystal structure determination platform as an efficient tool for the validation of an X-ray diffraction experiment. Acta Crystallographica Section D: Biological Crystallography. 61 (4), 449-457 (2005).
- Jones, T. A., Thirup, S. Using known substructures in protein model building and crystallography. The EMBO journal. 5 (4), 819-822 (1986).
- Kleywegt, G. J., Jones, T. A. Template convolution to enhance or detect structural features in macromolecular electron-density maps. Acta Crystallographica Section D: Biological Crystallography. 53 (2), 179-185 (1997).
- Perrakis, A., Morris, R., Lamzin, V. S. Automated protein model building combined with iterative structure refinement. Nature Structural Biology. 6 (5), 458-463 (1999).
- Morris, R. J., et al. Breaking good resolutions with ARP/wARP. Journal of Synchrotron Radiation. 11 (1), 56-59 (2004).
- Yao, D. Q., et al. SAD phasing by OASIS-2004: Case studies of dual-space fragment extension. Acta Crystallographica Section D: Biological Crystallography. 62 (8), 883-890 (2006).
- Hao, Q. ABS: A program to determine absolute configuration and evaluate anomalous scatterer substructure. Journal of Applied Crystallography. 37 (3), 498-499 (2004).
- Collaborative Computational Project Number 4. The CCP4 suite: Programs for protein crystallography. Acta Crystallographica Section D: Biological Crystallography. 50 (5), 760-763 (1994).
- Sheldrick, G. M., Hauptman, H. A., Weeks, C. M., Miller, R., Usón, I. Ab initio phasing. International Tables for Crystallography. , 333-345 (2006).
- Smith, G. D. Matching selenium-atom peak positions with a different hand or origin. Journal of Applied Crystallography. 35 (3), 368-370 (2002).
- Pannu, N. S., McCoy, A. J., Read, R. J. Application of the complex multivariate normal distribution to crystallographic methods with insights into multiple isomorphous replacement phasing. Acta Crystallographica - Section D Biological Crystallography. 59 (10), 1801-1808 (2003).
- Pannu, N. S., Read, R. J. The application of multivariate statistical techniques improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section D: Biological Crystallography. 60 (1), 22-27 (2004).
- De La Fortelle, E., Bricogne, G. Maximum-likelihood heavy-atom parameter refinement for multiple isomorphous replacement and multiwavelength anomalous diffraction methods. Methods in Enzymology. 276, 472-494 (1997).
- Cowtan, K. Joint CCP4 and ESF-EACBM Newsletter on Protein. Crystallography. 31, 34-38 (1994).
- Terwilliger, T. C. Maximum-likelihood density modification. Acta Crystallographica Section D: Biological Crystallography. 56 (8), 965-972 (2000).
- Read, R. J., McCoy, A. J. Maximum-likelihood determination of anomalous substructures. Acta Crystallographica Section D: Structural Biology. , (2018).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 486-501 (2010).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. Journal of visualized experiments JoVE. (78), e50548 (2013).
- McPhillips, T. M., et al. Blu-Ice and the distributed control system: Software for data acquisition and instrument control at macromolecular crystallography beamlines. Journal of Synchrotron Radiation. 9 (6), 401-406 (2002).
- Nagem, R. A. P., Polikarpov, I., Dauter, Z. Phasing on Rapidly Soaked Ions. Methods in Enzymology. 374, 120-137 (2003).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 325-338 (2010).
- Hendrickson, W. A., Ogata, C. M. Phase determination from multiwavelength anomalous diffraction measurements. Methods in Enzymology. 276, 494-523 (1997).
- Doublié, S. Production of Selenomethionyl Proteins in Prokaryotic and Eukaryotic Expression Systems. Macromolecular Crystallography Protocols. Methods in Molecular Biology. , 91-108 (2007).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved