Method Article
ランダムマイクロシードマトリックススクリーニングによるI3Cによるタンパク質結晶の誘導体化
要約
本稿では、マイクロシードを用いてI3C(5-アミノ-2,4,6-トリヨードイソフタル酸)で誘導体化したタンパク質結晶を生成し、まばらなマトリックススクリーンで新しい結晶化条件を生成する方法を紹介します。トレイは液体分配ロボットを使用して、または手で設定することができます。
要約
X線結晶学を用いたタンパク質構造解明は、高品質の回折結晶と回折相問題の計算溶液の両方を必要とする。適切な相同性モデルを欠く新しい構造は、しばしば重原子で誘導され、実験段階情報を提供する。提示されたプロトコルは、ランダムマイクロ播種マトリックススクリーニングと重原子分子I3C(5-アミノ2,4,6-トリヨードイソフタル酸)と誘導体化を組み合わせることにより、誘導体化タンパク質結晶を効率的に生成します。I3Cを結晶格子に組み込むことで、単一波長の変性分散(SAD)フェスを用いて回折相問題を効率的に解決できる。I3Cにおけるヨウ素原子の正三角形配置により、正しい異常な部分構造を迅速に検証することができます。このプロトコルは、実験的なフェスに興味を持って結晶学ベースの技術を用いて高分子構造を解く構造生物学者にとって有用であろう。
概要
構造生物学の分野では、X線結晶学は、高分子の原子分解能構造を決定するゴールドスタンダード技術と見なされています。疾患の分子基盤を理解し、合理的な薬剤設計プロジェクトを導き、酵素1,2の触媒機構を解明するために広く利用されている。構造データは豊富な知識を提供しますが、タンパク質の発現と精製、結晶化、構造決定のプロセスは非常に面倒です。これらのプロジェクトの進行を妨げるボトルネックがいくつか発生することが多く、結晶構造決定パイプラインを効率的に合理化するために対処する必要があります。
組み換え式と精製の後、結晶化を助長する予備的な条件を特定する必要があり、これはしばしばX線結晶学の困難で時間のかかる側面である。既知の条件と公開された条件を統合する商用のまばらな行列画面は、このボトルネックを緩和するために開発されています3,4.しかし、非常に純粋で濃縮されたタンパク質サンプルを使用しているにもかかわらず、これらの初期スクリーンから少数のヒットを生成することが一般的です。透明な滴を観察することは、タンパク質が結晶を核生成するために必要な過飽和レベルに達していない可能性があることを示しています。結晶の核化と成長を促進するために、既存の結晶から生成された種子を条件に加えることができ、これは結晶化空間のサンプリングを増加させることができます。アイルトンとストッダードは、最初にマイクロシードマトリックススクリーニング方法5を導入しました。質の悪い結晶を粉砕して種子ストックを作り、異なる塩を含む結晶化条件に体系的に添加し、他の方法では形成されなかった新しい回折品質の結晶を生成しました。この技術は、予備のマトリックス結晶化スクリーン6,7に種子を導入したランダムマイクロシードマトリックススクリーニング(rMMS)を開発したD'Arcyらによってさらに改善された。これにより、結晶の品質が向上し、平均して結晶化ヒット数が7倍増加しました。
結晶が正常に生成され、X線回折パターンが得られた後、「位相問題」を解決する形で別のボトルネックが発生します。データ取得処理の間、回折の強度(振幅の二乗に比例)が記録されるが、位相情報が失われ、直ちに構造判定8を停止する位相問題を生じる。標的タンパク質が以前に決定された構造を有するタンパク質に高い配列同一性を共有する場合、分子置換を用いて相情報9、10、11、12を推定することができる。この方法は高速で安価ですが、モデル構造は利用できないか、または適切でない場合があります。相同性モデルベースの分子置換法の成功は、配列同一性が35%13を下回るにつれて大幅に低下する。適切な相同性モデルがない場合、AB initioメソッド、例えばARCIMBOLDO14、15およびAMPLE16、試験することができる。これらの方法は、分子置換の出発点として計算予測モデルまたはフラグメントを使用します。予測されたおとりモデルを出発点として使用するAMPLEは、主にβシートを含む大規模な(>100残基)タンパク質およびタンパク質の構造を解決するのに苦労しています。より大きな構造に拡張するために小さな断片を収めようとするARCIMBOLDOは、高解像度データ(≤2 Å)と、アルゴリズムがフラグメントを完全な構造に拡張する能力に限定されます。
分子置換法が失敗した場合、単一波長(SAD19)または複数波長(MAD20)における同型置換17、18および異常散乱などの直接的な方法を用いる必要がある。これは、結晶を形成または重い原子で誘導しなければならない本当に新しい構造のためにしばしば当てはまりません。これは、重原子化合物と共結晶化したり、化学修飾(RNAに5-ブロモウラシルを組み込むなど)または標識タンパク質発現(セレノメチオニンまたはセレノシステインアミノ酸を一次構造に組み込むなど)21,22に浸すことによって達成できる。これはさらに結晶化プロセスを複雑にし、追加のスクリーニングと最適化を必要とします。
I3C(5-アミノ-2,4,6-トリヨードイソフタル酸)およびB3C(5-アミノ-2,4,6-トリブロマイソフタル酸)を含む新しいクラスのフェージング化合物は、既存のフェージング化合物23、24、25よりもエキサイティングな利点を提供します。I3CとB3Cの両方は、タンパク質と特異的に相互作用し、結合部位特異性を提供する直接フェース法およびアミノまたはカルボキシレート官能基に必要な異常散乱の交互配置を有する芳香環足場を特徴とする。重金属基のその後の正三角形配置により、フェス構造の検証が簡単になります。執筆時点では、タンパク質データバンク(PDB)には26のI3C結合構造があり、そのうち20個はSADフェス処理26を使用して解決された。
このプロトコルは、重金属誘導体化とrMMSスクリーニングの方法を組み合わせて、同時に結晶化ヒットの数を増やし、結晶誘導体化プロセスを簡素化することによって、構造決定パイプラインの有効性を向上させます。我々は、この方法が、鶏卵白リソザイムおよびバクテリオファージP6827からの新規リジンタンパク質のドメインと非常に効果的であることを実証した。高度に自動化された自動人力車構造決定パイプラインを用いた構造溶液が記載され、具体的にはI3Cフェス化合物に合わせた。オートソル28、ELVES29 、および CRANK230など、他の自動化されたパイプラインが存在します。SHELXC/D/E などの完全に自動化されていないパッケージも31、32、33を使用できます。この方法は、PDBで相同モデルを欠くタンパク質を研究している研究者にとって特に有益であり、スクリーニングおよび最適化のステップの数を大幅に減らすことによって有用である。この方法の前提条件は、タンパク質結晶または標的タンパク質の結晶性沈殿であり、以前の結晶化試験から得られる。
プロトコル
1. 実験計画と検討
- 目的のタンパク質の既存の結晶を使用し、好ましくは、蒸気拡散結晶化を通じて生成する。蒸気拡散結晶化の一般化プロトコルについては、Benvenuti および Mangani34を参照してください。油脂や自由界面拡散下のマイクロバッチのような結晶化の他の方法は、マイクロシードを生成するために破砕する前に結晶を収穫する必要があります。
- 種子ストックの調製では、犠牲にすることができる最高品質の結晶を使用してください。最高品質の結晶は、形態に基づいて視覚的に判断することができ、またはそのようなデータが利用可能であれば、最良の回折結晶を選択することができます。さらに良質の結晶が、最適化後にシード処理を行う可能性が非常に高い。結晶が存在しない場合には、球状石や針などの結晶性析出物を使用できます。
- 塩結晶を識別します。塩結晶は結晶化スクリーンで成長し、タンパク質結晶のように見える可能性があります。rMMSで塩結晶を使用しても何のメリットもなく、貴重なサンプルを無駄にするので、塩偽陽性を排除することが重要です。
- 塩の結晶は、それらが押しつぶされると大きくなります。結晶は、種子ストックを生成するために粉砕する必要がありますので、この戦略は特に関連しています。結晶を押しつぶすと、聞こえるひび割れ音が聞こえる場合、結晶は塩である可能性があります。
- タンパク質にトリプトファンおよびチロシン残基が含まれている場合は、紫外線蛍光顕微鏡を使用して、これらの照明条件下で蛍光を発するタンパク質結晶を同定します。
- Izit色素(メチレンブルー)を使用して、タンパク質結晶を染色し、比較的染色されていない塩結晶に分化します。ただし、この手順はより破壊的であり、同じ落下の複製から予備の結晶がある場合にのみ推奨されます。
注:上記のテストは有望な結果を与えるかもしれませんが、塩結晶はまだタンパク質結晶と間違えられるかもしれません。この場合、回折実験を用いて、タンパク質と塩結晶を明確に識別することができる。
2. リチウムI3Cストックの準備
- 120 mgのI3C(5-アミノ-2,4,6-トリヨードイソフタル酸)を1.5 mLマイクロ遠心分離チューブに測定します。
- I3Cを2M水酸化リチウムの200μLに溶かします。この溶液は、40~60°Cのヒートブロックを用いて穏やかに加熱し、溶解を促すことができる。得られたリチウムI3C溶液は茶色で、濃度は1Mである必要があります。
注意: 水酸化リチウムは腐食性です。安全メガネ、手袋、ラボコートを着用する必要があります。 - 溶液のpHを測定します。必要に応じて、1 M塩酸または2M水酸化リチウムを少量加え、pHを7~8の間に調整します。ミリQ水を加えると、最終溶液の容積を400μLにします。I3Cストック溶液の濃度は0.5 Mです。
注: ステップ 2.3 はオプションです。溶液のpHは、pH調整の前にpH 7-8の間にあるべきです。このステップは、目的のタンパク質がpHによって強く影響を受ける場合に実行されるべきである。プロトコルはここで一時停止することができます。リチウムI3Cは、少なくとも2週間35のために4°Cで暗闇の中に保つことができます。
3. タンパク質ストックへのI3Cの追加
- 方法 1
- ターゲットタンパク質の150 μLアリコートにストックリチウムI3Cを加えます。最終的な濃度は5-40 mMリチウムI3Cの間でなければなりません。
- 方法2(穏やかな方法)
- 標的タンパク質のバッファーに一致するタンパク質希釈バッファーを準備します。この希釈バッファーに、10-80 mMの間のリチウムI3Cの濃度を与えるために、ストックリチウムI3Cを追加します。
- タンパク質1:1をタンパク質希釈バッファーで希釈し、5〜40 mMの間でリチウムI3Cの最終濃度を与えます。
注:一部のタンパク質は、方法1で高濃度のリチウムI3Cに接触すると沈殿し、他のタンパク質はそれを許容することができます。方法2は沈殿の可能性を低減する。しかし、この方法はタンパク質濃度を半分にする。確立された結晶化プロトコルを持たないタンパク質の場合、一般的に初期結晶化スクリーニングには10mg/mLのタンパク質濃度が推奨されます。8のタンパク質に対するI3Cの初期モル比が推奨されます。I3Cのタンパク質濃度およびモル比は、第一画面後に最適化することができる。
4. 種子ストックの作成
- 結晶を粉砕するための丸みを帯びたプローブを作ります。
- 青い炎の上にブンゼンバーナーで、パスツールピペットを真ん中に向かって加熱します。トゥイーザーを使用して、パスツールピペットの端部を引き出して、0.3mm未満の細い直径に引き出します。
- 中間部が十分に薄い場合は、そのセグメントを炎の中に保持してこの時点でピペットを分離し、ピペットの端を丸め、ガラスプローブを仕上げます。
注:丸いプローブクリスタルクラッシャーは、サードパーティベンダーによって販売されています。これらは丸みを帯びたプローブを作る代わりです。
- 氷の上に5つの1.5 mLマイクロ遠心分離管を置きます。
- 光学顕微鏡の下で、結晶化トレイを調べ、マイクロクリスタルを生成するのに適した状態を調べます。理想的には、良好な形態の大きな結晶が選択される。しかし、この技術は、貧弱な形態結晶、針、プレート、微結晶および球形にも作用する。
- 結晶化トレイをよく開きます。プラスチックで密封された96の井戸結晶化トレイのために、ウェルを密封するプラスチックを切断するためにメスを使用する。グリースで密封された吊り下げ皿のために、カバースリップはピンセットを使用して取除き、均等な表面に逆張ることができる。
- 70 μLのリザーバー溶液をマイクロ遠心分離チューブに移し、氷の上で冷やします。他のマイクロ遠心チューブに、90 μLのリザーバー溶液を加え、氷に戻して冷やします。
注:貯蔵所に十分な容積がない場合、または(オイルの下でマイクロバッチの場合)存在しない場合は、適切な試薬を混合することによって結晶化貯留槽を作成する。 - 結晶プローブを使用してドロップ中の結晶を攪拌し、徹底的に粉砕します。結晶は顕微鏡で監視することができる完全に粉砕される必要がある。
- 滴からすべての液体を取り出し、リザーバ溶液とマイクロ遠心チューブに移します。ミクロ遠心分離管から2μLの混合物を混合し、その後、ウェルに戻します。溶液でウェルをすすい、マイクロ遠心分離チューブに移します。このすすいのステップをもう一度繰り返します。この時点から、マイクロ遠心分離管を冷たく保ち、混合物中のマイクロシードを溶かさないようにします。
- 4 °Cで最高速度で3分間、チューブを3分間渦し、過熱を防ぐために定期的に停止して氷上でチューブを冷やします。
注:いくつかのマイクロ播種プロトコルは、結晶破砕7、36を支援するためにマイクロ遠心チューブにポリテトラフルオロエチレンシードビーズを追加します。私たちは成功したシードビーズを使用せずに技術を採用してきましたが、種子ビーズを使用して結晶を粉砕することに問題はありません。 - 冷却貯留液の間で10 μLを順次移動して、シードストックの10個の連続希釈を10個にします。
- -80 °Cですぐに使用しない種子ストックを保管してください。
5. rMMS画面の設定
- 液体分配ロボットを使用して96井戸スクリーニングプレートを設置する。ロボットが存在しない場合、マルチチャンネルピペットも使用できます。
- 深いウェルブロックから96ウェル結晶化トレイに75 μLを移します。結晶化ドロップに1 μL、リザーバーに74 μLを加えます。
- リチウムI3Cを補ったタンパク質1μLをステップ2で作り、結晶化低下に移す。
- 0.1 μLのシードストックを結晶化ドロップに移します。
- プレートを透明なシールテープで密封し、一定の温度でプレートをインキュベートして結晶成長を可能にします。
- ハングドロップ画面の設定
- 吊り下げドロップウェルの端をグリース(吊り下げドロップ結晶化トレイは24と48ウェルフォーマットで見つけることができます)。
- 500 μLの結晶化溶液をリザーバーに移します。
- ガラスカバースライドの中央近くに、ステップ2で作られたリチウムI3Cを補ったタンパク質の1μL滴を置きます。
- 結晶化液を1μL加えます。
- 0.1 μLのシードストックを結晶化ドロップに移します。
- カバースライドを反転し、カバースライドをグリースに押し込んで結晶をよく密封します。
- 結晶成長を可能にするために一定の温度でプレートをインキュベートします。
注:新しい、テストされていないシードストックでは、結晶化ヒットの可能性を最大化するために、最も濃縮された種子ストックを使用することをお勧めします。その後の条件は、結晶の数を最適化するために、減少した種子濃度で設定することができます。
- 結晶成長のために定期的に顕微鏡下で結晶トレイを検査します。結晶が十分な品質であれば、データ収集のために収穫することができます。結晶はまた反復的な最適化を可能にするために新しいシードストックおよび新しいrMMSスクリーンを生成するために使用することができる。
6. データ収集
- クライオループを使用して結晶を収穫し、結晶を凍結保護し、液体窒素でそれらを冷却フラッシュします。フラッシュ冷却結晶の詳細については、Teng37 および Garman とミッチェル38を参照してください。
- 凍結保護段階では、結晶が新しい水溶液を通過した場合、I3Cは凍結保護溶液にリーチングするため、結晶から失われる可能性があります。これを軽減するために結晶化条件に一致する濃度で凍結保護溶液にリチウムI3Cを使用してください。
- このプロトコルを使用して成長した結晶は正常にパラバー10312油ベースの凍結保護剤(ハンプトンリサーチ)を使用して凍結保護されています。
注: このプロトコルは、水晶が液体窒素に保存されている間、ここで一時停止することができます。
注意:液体窒素は冷ややを引き起こす可能性があります。液体窒素は、密閉空間で使用すると窒息を引き起こす可能性があります。
- X線源ゴニオメーターに結晶を取り付け、X線源に固有のプロトコルを使用して回折データを収集します。
- この技術は、I3Cのヨウ素原子からの異常なシグナルに依存しています。このように、X線のエネルギーを選択してこの信号を最大にする。
- 可能な限り調整可能なエネルギーを持つシンクロトロンX線源を設定します。多くの高分子結晶学ビームラインでは、最も低い構成可能なエネルギーは8000〜8500 eVです。
- 回転アノード X 線源は調整できません。銅を持つ一般的に使用されるアノード源は、8046 eVのKαエッジを有し、ヨウ素に対して良好な異常信号を提供する(f" = 6.9 e)。クロムを有するアノード源は5415 eVでKαエッジを有し、ヨードに対して大きな異常信号を提供する(f" = 12.6 e)。
- 放射線損傷は、異常信号39を劣化させるため、データ収集中に重大な問題となる。放射線量を最小限に抑えながら、最良の回折を達成するためにビームの露出時間と減衰を選択します。
注:ヨウ素原子を臭素原子に置換した同様のフェージング化合物では、放射損傷が炭素臭素結合の放射線の起こす原因となり、臭素原子24の占有率の低下を引き起こすことが示されている。- 逆ビーム SAD データ収集を収集戦略として使用します。データはウェッジで収集され、逆のウェッジが互いに収集されます。これにより、フリーデルペアを同等の線量で収集することができ、放射線損傷の影響を受けにくい異常信号の測定が改善されました。たとえば、 360°を収集する8つのくさび戦略は、ウェッジ1(0°-45°)、ウェッジ2(180°-225°)、ウェッジ3(46°-90°)、ウェッジ4(225)の順序でデータを収集することを含むであろう °-270°、ウェッジ5(90°-135°)、ウェッジ6(270°-315°)、ウェッジ7(135°-180°)、ウェッジ8(315°-360°)。
注: 連続回転は、逆ビーム データ収集の代替の収集方法です。コレクション戦略の最近の比較については、ガルシー・ボンテ&カトナ40を参照してください。
- 逆ビーム SAD データ収集を収集戦略として使用します。データはウェッジで収集され、逆のウェッジが互いに収集されます。これにより、フリーデルペアを同等の線量で収集することができ、放射線損傷の影響を受けにくい異常信号の測定が改善されました。たとえば、 360°を収集する8つのくさび戦略は、ウェッジ1(0°-45°)、ウェッジ2(180°-225°)、ウェッジ3(46°-90°)、ウェッジ4(225)の順序でデータを収集することを含むであろう °-270°、ウェッジ5(90°-135°)、ウェッジ6(270°-315°)、ウェッジ7(135°-180°)、ウェッジ8(315°-360°)。
7. データ処理と構造ソリューション
- 異常信号を最大化することを目的として、XDS41を用いて回折データのデータ削減を行う。データ削減入力パラメーターはデータセットに固有であり、試行錯誤が必要な場合があります。開始する推奨事項を次に示します。
- フリーデルの法則=FALSE を設定します。[正しい] を 2 回実行し、STRICT_ABSORPTION_CORRECT = TRUE、STRICT_ABSORPTION_CORRECT = FALSE を設定します。一方のランは、他方よりも高い異常信号を持つことができます。出力で「アノマル・コル」と「シグアーノ」の分野を使用して、ラン間の異常な信号を比較します。これにより、データ品質の指標が提供されます。
- XDS_ASCIIで SHELXC を実行します。異常信号をより正確に示す HKL ファイル。「Ranom」の規律は、異なる解像度で異常信号の指標を与えます。
- POINTLESS42 とAIMLESS43 を実行して、データをスケーリングします。AIM レスで、パラメーター [異常オン] を設定します。GUI を使用する場合は、[ 異常なペアを分離して外れ値の拒否と統計のマージを行う] オプションを選択します。異なる解像度カットオフをテストして、異常信号を最大化する必要があります。
- 自動人力車自動結晶構造決定パイプライン44を用いてタンパク質構造を解く。自動人力車は、相の問題を解決し、タンパク質モデリングと精製ソフトウェアで自動的にタンパク質の結晶構造を構築しようとします。
- 相同性モデルのテンプレートを持たないタンパク質の場合は、高度なモードで自動人力車のSADプロトコルを実行します。必要なパラメータを入力します。
- 分子タイプとして「タンパク質」を選択します。
- オングストローム(Å)でデータ収集波長を入力します。
- ヨウ素原子が使用されたことを示す部分構造要素として「I」を選択します。
- I3Cがフェス構造分子であることを示す部分構造型として「i3c」を選択します。
- 部分構造決定方法として「sub_direct」を選択します。この方法では、下構造を検索するために SHELXD32 を使用します。
- モノマー当たりの予想されるサブストラクチャの数として「3」を選択します。
- サブ構造検索の分解能カットオフとして「1」と入力します。これにより、自動人力車は適切な解像度カットオフを自動的に決定できます。
- マシューズ係数に基づいて、単一のモノマーの残基数、データセットのスペースグループ、非対称単位の分子数を入力します。
- ニーズに合ったX線データの適切な普及レベルを選択します。「AutoRickshaw 開発者」を選択すると、Auto-人力車の開発者は、問題が発生した場合に実行のトラブルシューティングを行うことができます。
- 異常データを mtz ファイルとして入力します。
- タンパク質配列を、seq、pir、またはtxtファイルとして入力します。seq ファイルは、テキスト エディター (Windows のメモ帳++9、Linux では nano など) で生成できます。新しいファイルを作成し、1つの長い行としてタンパク質のプライマリシーケンスを入力するか、改行で区切ります。ファイルを .seq ファイル拡張子で保存します。
- 機関の電子メール アドレスを入力します。
- 相同性モデルのテンプレートを持たないタンパク質の場合は、高度なモードで自動人力車のSADプロトコルを実行します。必要なパラメータを入力します。
- 結果は、提供された電子メールアドレスに送信されたウェブリンクを介して配信されます。
メモ:AutoRickshawは、X線結晶構造32、33、45、46、47、48、49、50、51、52、53、54、55、56、57、58を解決するために、さまざまな結晶学ソフトウェアパッケージを呼び出す自動化されたパイプラインです。自動人力車の実行で構造が解析されない場合は、他の自動人力車の設定をテストできます。構造決定方法は、SHELXD32の代わりにフェイザー59を使用するように「sub_phassade」に変更することができる。モノマー当たりの予想されるサブ構造の数も増減することができる。 - 結晶構造の実験的なフェスの間に、自動力車は、サブ構造を作成し、ユニットセル内の重い原子を配置しようとします。I3Cにおけるヨウ素原子の正三角形配置は、その部分構造を検証する効率的な方法を提示する。ステップ 6.3 が失敗した場合、サブ構造の検証は、構造のトラブルシューティングの解決に役立ちます。
- 自動人力車の結果ページから重い原子サイトのリストをダウンロードします。「重原子サイト」と呼ばれるハイパーリンクです。これは、重い原子サイトとのテキストファイルをダウンロードします。
- ファイルの拡張子を.txtから.pdbに変更します。
- PDB ファイルを Coot60で開きます。対称をオンにすると、隣接する非対称単位から他の重い原子が表示されます。
- 非対称単位を含む重い原子間の距離を測定します。I3C は、6 つのオングストロームの辺の長さを持つ正三角形として表示されます。これらの寸法を持つ三角形の存在は、それらの重い原子の配置が正しいことを示しています。
結果
I3CをrMMSに組み込むことで、誘導体化結晶成長を支える新しい条件を生み出すことができる
同時rMMSスクリーニングとI3C誘導体化の有効性は、卵白リゾチーム(HEWL、凍結乾燥粉末として得られる)とバクテリオファージP68由来の推定Orf11リシンN末端ドメイン(Orf11 NTD)の2つのタンパク質において実証された。各タンパク質は、シードなし、シード、I3Cでシードなし、I3Cでシードされる(図1)を含む4つの異なる条件でPEG / ION HTに対してスクリーニングされた(図1)。両方のタンパク質について、I3Cの単独添加は結晶化に役立つ条件の数を増加させなかった。Orf11 NTDの場合、I3Cの有無にかかわらず、適切な条件が1つだけ同定された(図1B)。I3CをHEWL画面に追加すると、ヒット数が31から26に減少し、フェージング化合物を導入する際の結晶化の複雑さが強調されました(図1A)。他の研究と一致して、市販のまばらなマトリックススクリーンに種子を加えてrMMSスクリーンを生成すると、両方のタンパク質に対して可能な結晶化条件の数が大幅に増加し、HEWLおよびOrf11 NTDのそれぞれ6、61(図1)に対して2.1倍および6倍の増加をもたらした。最も重要なことは、I3Cとシードの同時添加は、非シードスクリーンに対するヒット数を増加させ、HEWLとOrf11 NTDのそれぞれ2.3倍と7倍の増加を示した。I3Cの存在下でのrMMSからの結晶の多くは、優れた結晶形態を示す(図2)。
シード処理により、I3C rMMS 画面での結晶数の慎重な制御が可能
マイクロシード実験では、結晶化試験に導入された種子の数は、種子ストックの希釈によって制御することができ、これは、ドロップ7、36における核生成の正確な制御を可能にする。これは、多くの場合、核形成部位でのタンパク質分子の競争が減少しているため、より大きな結晶を形成することができます。この利点はI3C-rMMS法にも及び、HEWLとOrf11 NTDの両方で実証されています。I3C-rMMSスクリーンから希釈された種子ストックで同定された結晶化条件の再作成は、より少ないが大きな結晶を生み出した(図3)。
SADのフェージングは、rMMS I3C画面から導出された結晶から構造を解決するために使用することができます
図3に示す希釈種子ストックを用いて成長させた結晶を用いて、単結晶からの回折データを用いてSADフェースを用いてタンパク質の構造を解いた(図4)。データは、オーストラリアのシンクロトロンMX1ビームライン62で収集されました。詳細なデータ収集と構造ソリューションの詳細については、他の場所27.
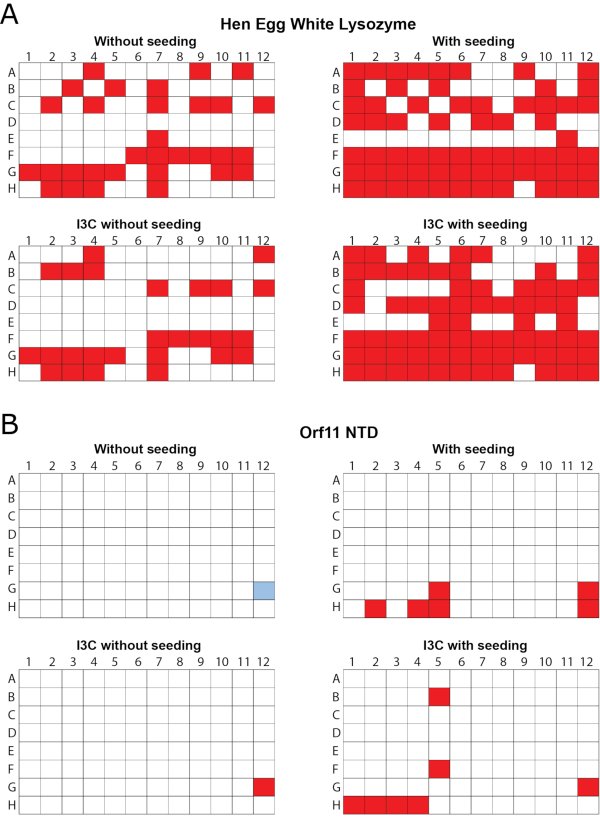
図1- rMMSは、2つの試験タンパク質に対するI3Cの存在下での結晶成長のための新しい条件を生成するために使用された。96ウェル蒸気拡散結晶化スクリーンは、市販のまばらなマトリックススクリーンを用いて行った。(A)ヘン卵白リソザイムは、インデックスHT画面でテストされました。トレイは、0.2 Mのタルゲン酸アンモニウム二塩基pH 7.0、20%(w/v)ポリエチレングリコール3350で成長させたHEWL結晶を播種した。(B) 細菌ファージ P68 から Orf11 NTD を PEG/ION 画面で試験した。Orf11 NTDトレイは、青色で示された未播種のスクリーンから条件G12から結晶から播種した。結晶成長を支える条件は赤色で示されている。I3Cの存在下および不在でのrMMSシードは、いずれもシードされていないトレイよりも有意に多くの結晶ヒットを与えた。Truongらから適応した図27.この図の大きなバージョンを表示するには、ここをクリックしてください。
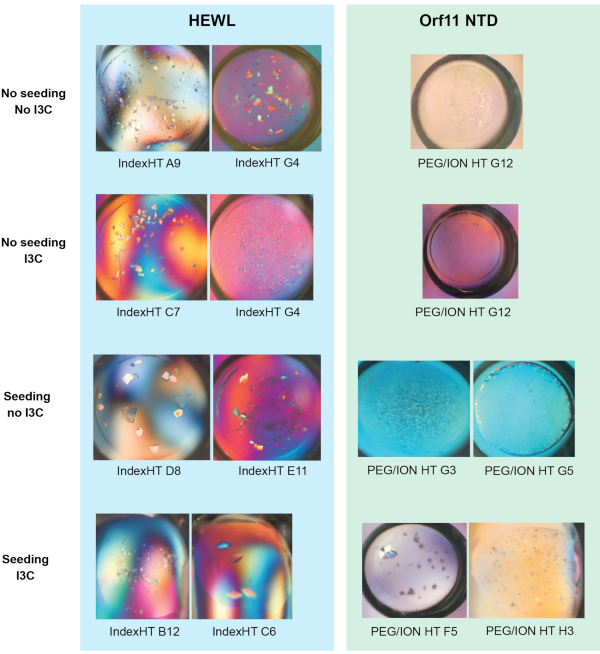
図2-図1(a)および(b)に示す蒸気拡散試験から成長した結晶の代表的な画像。Truongらから適応した図27.この図の大きなバージョンを表示するには、ここをクリックしてください。

図3-種子ストックの希釈は、I3C-rMMS法を用いて見つけた結晶化条件における核生成を低減する有効な方法であり、形成する結晶の数を制御する。落下内の核形成を減らすと、結晶が大きな寸法に成長することがよくあります。Truongらから適応した図27.この図の大きなバージョンを表示するには、ここをクリックしてください。

図4 - Orf11 NTD(PDB ID 6O43)およびHEWL(PDB ID 6PBB)をI3C-rMMS法を用いて結晶化し、自動人力車SADフェースを用いて解いた。(A)HEWLとOrf11 NTDのリボン構造は実験的なフェージングによって解いた。(B) I3C分子をHEWLとOrf11 NTDに結合した。(C)I3Cにおける異常ヨウ素原子は、6Åの正三角形に配置されている。従って、この三角形がフェス構造下に存在することは、その位置にI3C分子があることを示している。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
分子置換のための適切な相同性モデルがない場合の新規タンパク質の構造決定には、実験的なフェスを必要とする。これらの方法は、構造決定パイプラインに複雑さのレベルを追加し、対処しなければならない多くの障害を導入することができるタンパク質結晶に重原子を組み込む必要があります。重原子は、セレノメチオニンおよびセレノシステインを用いた標識発現を介してタンパク質に直接組み込むことができる。この方法は高価であり、手間がかかり、より低いタンパク質収率をもたらし得る、標識されたタンパク質は、結晶化条件が発見され、標識されていないタンパク質で最適化された後にしばしば発現される。あるいは、結晶は、重原子22、63、64を含む溶液に浸すことによって誘導体化することができる。この方法は、多くの場合、高品質の結晶を使用し、堅牢な結晶化方法が既に開発された後に行われます。この方法を用いて誘導体化結晶を得るためには、浸漬手順のさらなる最適化と異なるフェス化合物のスクリーニングが必要であり、すでに面倒なプロセスに時間を追加します。
重原子とタンパク質の共結晶化は、スクリーニング段階で行うことができるので、プロセスを効率的に合理化し、損傷を引き起こす可能性のある結晶操作ステップを低減することができます。しかし、まだいくつかの初期結晶ヒットを得る潜在的なシナリオと互換性のある重原子化合物を選択する問題が存在します。現在入手可能な多くのフェス化合物は、結晶化条件で一般的に見られる沈殿剤、緩衝剤および添加物と相容れない。これらは、硫酸およびリン酸塩緩衝液に不溶性であり、クエン酸塩および酢酸塩に対して、HEPESおよびTrisバッファーと好ましくない反応をするか、またはDTTおよびβ-メルカプトエタノール21によって隔離される。I3Cフェス化合物はこれらの非互換性に苦しんでいないので、多くの異なる条件に適している可能性がある堅牢なフェスチン化合物です。
本研究では、I3Cフェース化合物とrMMSの同時共結晶化を通じてSADフェージングの準備ができて誘導体化結晶を作製する合理化された方法を提示する。両方の技術の組み合わせは、形態と回折特性を改善した条件の多くを持つ結晶化ヒットの数を増加させます。Orf11 NTD と HEWL の両方のテストケースで、I3C-rMMS 画面の新しい条件が、I3C が存在しないときに存在しなかったことが確認されました。潜在的に、I3Cはタンパク質に良好に結合し、結晶接点27の形成および安定化を促進する。この結果、結晶化を誘導し、回折特性が向上する可能性があります。疎なマトリックススクリーンと互換性のある化合物であることに加えて、I3Cは、その本質的な特性のために魅力的なフェス化合物でもあります。芳香環足場上のヨウ素と交互に作用する官能基は、タンパク質に特異的な結合を可能にする。これは、より大きな占有率につながり、潜在的にバックグラウンド信号23を減少させます。さらに、正三角形における異常散乱散乱装置の配置は、部分構造において明らかであり、I3Cの結合を迅速に検証するために使用することができる(図4B および 4C)。最後に、調整可能な放射光、クロム、銅回転アノードX線源を用いた異常信号を生成することができます。したがって、多くの異なるワークフローに適用できます。I3Cは広く利用可能で購入コストが安いため、このアプローチはほとんどの構造生物学研究所にとって手の届くところにあります。
I3C-rMMS メソッドを使用する場合は、いくつかの実験的な考慮事項に対処する必要があります。タンパク質の初期結晶性材料が得られない場合、この方法は適用できません。困難な場合には、相同タンパク質からの結晶性物質を使用して種子ストックを生成することもできる。rMMSへのこのクロスシードアプローチは、いくつかの有望な結果を示しています 7.種子ストックの希釈によって結晶数を最適化することは、高品質の大きな結晶を生成し、適切な回折データを取得する可能性を最大化するために、見逃してはならない重要なステップです。非対称ユニットで同定されたI3C部位が少ない場合、I3C濃度の上昇により、結晶化に役立つ条件をさらに最適化する必要があります。これは、異常な信号を最大化し、結晶誘導体化を助けるためにI3Cの占有率を増加させる可能性があります。
この手法がタンパク質結晶を誘導する最適な方法ではない場合があります。タンパク質またはタンパク質複合体のサイズが大きくなるにつれて、タンパク質表面上の限られた数のI3C部位は、構造を解決するのに十分なフェージングパワーを提供しない場合がある。タンパク質サイズがフェスを妨げていると疑われるこれらのシナリオでは、タンパク質のセレノメチオニン標識は、タンパク質をフェースするより実行可能なアプローチである可能性があります。タンパク質がタンパク質に十分な数のメチオニン残基を有する場合(100残基あたり少なくとも1つのメチオニンを有することを推奨する65)、高効率のセレノメチオニンをタンパク質に組み込むこと(細菌発現系66など)、複数の高占有セレン原子が結晶中に存在して相相構造に存在する。
また、一部のタンパク質は、I3Cによる誘導体化には本質的に適していない場合があります。タンパク質上のI3C結合部位は、タンパク質構造に依存する。I3C結合と互換性のある露出したパッチが自然にほとんど存在しないタンパク質が存在する可能性があります。したがって、I3Cと一部の標的タンパク質を共結晶化することは困難である可能性があることは予測できない。
開示事項
著者らは開示するものは何もない。
謝辞
この研究は、ANSTOの一部であるオーストラリアのシンクロトロンでMX1ビームラインで行われました。著者らは、この研究に関する議論のためにシアウィンとブランニング研究所のメンバーを認めたいと思います。著者らはまた、このプロトコルを開拓した元の研究に貢献したサントシュ・パンジカール博士とリンダ・ホワイアット・シアウィン博士を認めたいと考えています。
次の資金が認められています:オーストラリア研究評議会(グラントNos.DP150103009とDP160101450からキース・E・シアウィンへ;アデレード大学(オーストラリア政府研究訓練プログラムは、ジア・クイエン・チュオンとステファニー・グエンに奨学金を得る)。
資料
| Name | Company | Catalog Number | Comments |
| 10 mL disposable luer lock syringes | Adelab Scientific | T3SS10LAT | Used for dispensing vacuum grease for hanging drop crystal tray wells |
| 24 well tissue culture plate | Sigma Aldrich | CLS3527 | Used for hanging drop crystal tray |
| 3 inch wide Crystal Clear Sealing Tape | Hampton Research | HR4-506 | For 96 well crystallization screens set up by robot |
| 5-amino-2,4,6-triiodoisophthalic acid | Alfa Aesar | B22178 | Commonly referred to as I3C in the article |
| Art Robbins Intelli-Plate 96-2 Original | Hampton Research | HR3-297 | For 96 well crystallization screens set up by robot |
| Coverslips | Thermo Fisher Scientific | 18X18-2 | Coverslips for hanging drop crystal tray wells |
| Dow Corning vacuum grease | Hampton Research | HR3-510 | Used for sealing hanging drop crystal tray wells |
| Eppendorf Pipette 0.1 μL-2.5 μL | Eppendorf | 3120000011 | |
| Gilson Pipette 2 μL-20 μL | John Morris Group | 1153247 | |
| Gilson Pipette 20 μL-200 μL | John Morris Group | 1152006 | |
| Glass pasteur pipettes | Adelab Scientific | HIR92601.01 | |
| Hen Egg White Lysozyme | Sigma-Aldrich | L6876 | Approximately 95% pure |
| IndexHT screen | Hampton Research | HR2-134 | |
| Microscope illuminator | Meiji Techno | FT192/230 | Light source to illuminate crystallography experiments |
| PEG/ION HT screen | Hampton Research | HR2-139 | |
| Phoenix Liquid Dispenser | Art Robbins Instruments | 602-0001-10 | |
| Scalpel with scalpel blade no. 15 | Adelab Scientific | LV-SMSCPO15 | |
| Seed bead kit | Hampton Research | HR2-320 | Kit contains a glass probe for crushing crystals. A PTFE seed bead, designed for crushing crystals, is also part of the kit but not used in this protocol. |
| Stereo microscope | Meiji Techno | EMZ-5TR | Microscope for visualising crystallography experiments |
| Tweezers | Sigma-Aldrich | T5415 | |
| Vortex mixer | Adelab Scientific | RAVM1 |
参考文献
- Zheng, H., Hou, J., Zimmerman, M. D., Wlodawer, A., Minor, W. The future of crystallography in drug discovery. Expert Opinion on Drug Discovery. 9 (2), 125-137 (2014).
- Oakley, A. J., Wilce, M. C. J. Macromolecular crystallography as a tool for investigating drug, enzyme and receptor interactions. Clinical and Experimental Pharmacology and Physiology. 27 (3), 145-151 (2000).
- Jancarik, J., Kim, S. H. Sparse matrix sampling. A screening method for crystallization of proteins. Journal of Applied Crystallography. 24, 409-411 (1991).
- Newman, J., et al. Towards rationalization of crystallization screening for small- To medium-sized academic laboratories: The PACT/JCSG+ strategy. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1426-1431 (2005).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta Crystallographica Section D: Biological Crystallography. 60 (3), 601-605 (2004).
- D'Arcy, A., Villard, F., Marsh, M. An automated microseed matrix-screening method for protein crystallization. Acta Crystallographica Section D: Biological Crystallography. 63 (4), 550-554 (2007).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Taylor, G. The phase problem. Acta Crystallographica - Section D Biological Crystallography. 59 (11), 1881-1890 (2003).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A. 46 (2), 73-82 (1990).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Millán, C., Jiménez, E., Schuster, A., Diederichs, K., Usón, I. ALIXE: a phase-combination tool for fragment-based molecular replacement. Acta Crystallographica Section D. 76 (3), 209-220 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: Recent developments in Phenix. Acta Crystallographica Section D: Structural Biology. 75, 861-877 (2019).
- Abergel, C. Molecular replacement: Tricks and treats. Acta Crystallographica Section D: Biological Crystallography. 69 (11), 2167-2173 (2013).
- Pröpper, K., et al. Structure solution of DNA-binding proteins and complexes with ARCIMBOLDO libraries. Acta Crystallographica Section D: Biological Crystallography. 70 (6), 1743-1757 (2014).
- Rodríguez, D. D., et al. Crystallographic ab initio protein structure solution below atomic resolution. Nature Methods. 6 (9), 651-653 (2009).
- Bibby, J., Keegan, R. M., Mayans, O., Winn, M. D., Rigden, D. J. AMPLE: A cluster-and-truncate approach to solve the crystal structures of small proteins using rapidly computed ab initio models. Acta Crystallographica Section D: Biological Crystallography. 68 (12), 1622-1631 (2012).
- Green, D. W., Ingram, V. M., Perutz, M. F. The structure of haemoglobin - IV. Sign determination by the isomorphous replacement method. Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 225 (1162), 287-307 (1954).
- Blow, D. M., Rossmann, M. G. The single isomorphous replacement method. Acta Crystallographica. 14 (11), 1195-1202 (1961).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods in Enzymology. 115, 90-112 (1985).
- Hendrickson, W. A. Determination of macromolecular structures from anomalous diffraction of synchrotron radiation. Science. 254 (5028), 51-58 (1991).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallographica Section D: Structural Biology. 72 (3), 303-318 (2016).
- Dauter, Z., Dauter, M., Rajashankar, K. R. Novel approach to phasing proteins: Derivatization by short cryo-soaking with halides. Acta Crystallographica Section D: Biological Crystallography. 56 (2), 232-237 (2000).
- Beck, T., Krasauskas, A., Gruene, T., Sheldrick, G. M. A magic triangle for experimental phasing of macromolecules. Acta Crystallographica Section D: Biological Crystallography. 64 (11), 1179-1182 (2008).
- Beck, T., Gruene, T., Sheldrick, G. M. The magic triangle goes MAD: Experimental phasing with a bromine derivative. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 374-380 (2010).
- Beck, T., Da Cunha, C. E., Sheldrick, G. M. How to get the magic triangle and the MAD triangle into your protein crystal. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (10), 1068-1070 (2009).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Truong, J. Q., Panjikar, S., Shearwin-Whyatt, L., Bruning, J. B., Shearwin, K. E. Combining random microseed matrix screening and the magic triangle for the efficient structure solution of a potential lysin from bacteriophage P68. Acta Crystallographica Section D: Structural Biology. 75 (7), 670-681 (2019).
- Terwilliger, T. C., et al. Decision-making in structure solution using Bayesian estimates of map quality: The PHENIX AutoSol wizard. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 582-601 (2009).
- Holton, J., Alber, T. Automated protein crystal structure determination using ELVES. Proceedings of the National Academy of Sciences of the United States of America. 101 (6), 1537-1542 (2004).
- Skubák, P., Pannu, N. S. Automatic protein structure solution from weak X-ray data. Nature Communications. 4, (2013).
- Sheldrick, G. M. Crystal structure refinement with SHELXL. Acta Crystallographica Section C: Structural Chemistry. 71, 3-8 (2015).
- Schneider, T. R., Sheldrick, G. M. Substructure solution with SHELXD. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1772-1779 (2002).
- Sheldrick, G. M. Macromolecular phasing with SHELXE. Zeitschrift fur Kristallographie. 217 (12), 644-650 (2002).
- Benvenuti, M., Mangani, S. Crystallization of soluble proteins in vapor diffusion for x-ray crystallography. Nature Protocols. , (2007).
- Beck, T. . Sticky triangles New tools for experimental phasing of biological macromolecules. , (2010).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 55 (5), 988-993 (1999).
- Teng, T. -. Y. Mounting of crystals for macromolecular crystallography in a free-standing thin film. Journal of Applied Crystallography. 23 (5), 387-391 (1990).
- Garman, E. F., Mitchell, E. P. Glycerol concentrations required for cryoprotection of 50 typical protein crystallization solutions. Journal of Applied Crystallography. 29, 584-587 (1996).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garcia-Bonete, M. J., Katona, G. Bayesian machine learning improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section A: Foundations and Advances. 75, 851-860 (2019).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D: Biological Crystallography. 62 (1), 72-82 (2006).
- Evans, P. R., Murshudov, G. N. How good are my data and what is the resolution. Acta Crystallographica Section D: Biological Crystallography. 69 (7), 1204-1214 (2013).
- Panjikar, S., Parthasarathy, V., Lamzin, V. S., Weiss, M. S., Tucker, P. A. Auto-Rickshaw: An automated crystal structure determination platform as an efficient tool for the validation of an X-ray diffraction experiment. Acta Crystallographica Section D: Biological Crystallography. 61 (4), 449-457 (2005).
- Jones, T. A., Thirup, S. Using known substructures in protein model building and crystallography. The EMBO journal. 5 (4), 819-822 (1986).
- Kleywegt, G. J., Jones, T. A. Template convolution to enhance or detect structural features in macromolecular electron-density maps. Acta Crystallographica Section D: Biological Crystallography. 53 (2), 179-185 (1997).
- Perrakis, A., Morris, R., Lamzin, V. S. Automated protein model building combined with iterative structure refinement. Nature Structural Biology. 6 (5), 458-463 (1999).
- Morris, R. J., et al. Breaking good resolutions with ARP/wARP. Journal of Synchrotron Radiation. 11 (1), 56-59 (2004).
- Yao, D. Q., et al. SAD phasing by OASIS-2004: Case studies of dual-space fragment extension. Acta Crystallographica Section D: Biological Crystallography. 62 (8), 883-890 (2006).
- Hao, Q. ABS: A program to determine absolute configuration and evaluate anomalous scatterer substructure. Journal of Applied Crystallography. 37 (3), 498-499 (2004).
- Collaborative Computational Project Number 4. The CCP4 suite: Programs for protein crystallography. Acta Crystallographica Section D: Biological Crystallography. 50 (5), 760-763 (1994).
- Sheldrick, G. M., Hauptman, H. A., Weeks, C. M., Miller, R., Usón, I. Ab initio phasing. International Tables for Crystallography. , 333-345 (2006).
- Smith, G. D. Matching selenium-atom peak positions with a different hand or origin. Journal of Applied Crystallography. 35 (3), 368-370 (2002).
- Pannu, N. S., McCoy, A. J., Read, R. J. Application of the complex multivariate normal distribution to crystallographic methods with insights into multiple isomorphous replacement phasing. Acta Crystallographica - Section D Biological Crystallography. 59 (10), 1801-1808 (2003).
- Pannu, N. S., Read, R. J. The application of multivariate statistical techniques improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section D: Biological Crystallography. 60 (1), 22-27 (2004).
- De La Fortelle, E., Bricogne, G. Maximum-likelihood heavy-atom parameter refinement for multiple isomorphous replacement and multiwavelength anomalous diffraction methods. Methods in Enzymology. 276, 472-494 (1997).
- Cowtan, K. Joint CCP4 and ESF-EACBM Newsletter on Protein. Crystallography. 31, 34-38 (1994).
- Terwilliger, T. C. Maximum-likelihood density modification. Acta Crystallographica Section D: Biological Crystallography. 56 (8), 965-972 (2000).
- Read, R. J., McCoy, A. J. Maximum-likelihood determination of anomalous substructures. Acta Crystallographica Section D: Structural Biology. , (2018).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 486-501 (2010).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. Journal of visualized experiments JoVE. (78), e50548 (2013).
- McPhillips, T. M., et al. Blu-Ice and the distributed control system: Software for data acquisition and instrument control at macromolecular crystallography beamlines. Journal of Synchrotron Radiation. 9 (6), 401-406 (2002).
- Nagem, R. A. P., Polikarpov, I., Dauter, Z. Phasing on Rapidly Soaked Ions. Methods in Enzymology. 374, 120-137 (2003).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 325-338 (2010).
- Hendrickson, W. A., Ogata, C. M. Phase determination from multiwavelength anomalous diffraction measurements. Methods in Enzymology. 276, 494-523 (1997).
- Doublié, S. Production of Selenomethionyl Proteins in Prokaryotic and Eukaryotic Expression Systems. Macromolecular Crystallography Protocols. Methods in Molecular Biology. , 91-108 (2007).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved