Method Article
Вывод белковых кристаллов с I3C с помощью случайного скрининга матрицы микросея
В этой статье
Резюме
В этой статье представлен метод генерации кристаллов белка, полученных с помощью I3C (5-амино-2,4,6-трийодоизофталеновой кислоты) с использованием микросея, чтобы генерировать новые условия кристаллизации в редких матричных экранах. Лотки могут быть настроены с помощью жидких роботов дозирования или вручную.
Аннотация
Разъяснение структуры белка с помощью рентгеновской кристаллографии требует как высококачественных дифракционных кристаллов, так и вычислительного решения проблемы фазы дифракции. Новые структуры, которые не имеют подходящей гомологической модели, часто получают тяжелые атомы для предоставления экспериментальной фазовой информации. Представленный протокол эффективно генерирует производные кристаллы белка путем объединения случайного микросеяного матричного скрининга с производным с тяжелой молекулой атома I3C (5-амино-2,4,6-трийодоизофталиковая кислота). Путем включения I3C в кристаллическую решетку, проблема фазы дифракции может быть эффективно решена с помощью одноволновой аномальной дисперсии (SAD) поэтапного. Равностороннее расположение атомов йода в I3C позволяет быстро исправлять правильную аномальную подструктуру. Этот протокол будет полезен структурным биологам, которые решают макромолекулярные структуры с использованием методов на основе кристаллографии, интересующихся экспериментальным фазированием.
Введение
В области структурной биологии рентгеновская кристаллография рассматривается как техника золотого стандарта для определения структуры макромолекулы с атомным разрешением. Он был широко использован для понимания молекулярной основы заболеваний, руководство рациональных проектов дизайна наркотиков и выяснить каталитический механизмферментов 1,2. Хотя структурные данные предоставляют богатые знания, процесс экспрессии и очищения белка, кристаллизации и определения структуры может быть чрезвычайно трудоемким. Обычно встречаются несколько узких мест, которые препятствуют продвижению этих проектов, и это необходимо решить для эффективной оптимизации трубопровода определения кристаллической структуры.
После рекомбинантного выражения и очищения необходимо определить предварительные условия, способствующие кристаллизации, что зачастую является трудным и трудоемким аспектом рентгеновской кристаллографии. Коммерческие редкие матричные экраны, которые консолидируют известные и опубликованные условия, были разработаны, чтобы облегчитьэто узкое место 3,4. Тем не менее, он является общим для создания нескольких хитов из этих первоначальных экранов, несмотря на использование высоко чистых и концентрированных образцов белка. Наблюдение за явными каплями указывает на то, что белок может не достигать уровня супернасыщения, необходимого для нуклеата кристалла. Для поощрения кристаллизации и роста, семена, произведенные из уже существующих кристаллов могут быть добавлены к условиям, и это позволяет увеличить выборку пространства кристаллизации. Ireton и Stoddard впервые представили метод скрининга матрицы микросея5. Кристаллы низкого качества были измельчены, чтобы сделать запас семян, а затем систематически добавляются к условиям кристаллизации, содержащим различные соли для создания новых кристаллов дифракции качества, которые иначе не сформировались бы. Этот метод был дополнительно усовершенствован D'Arcy et al., который разработал случайный микросеяный матричный скрининг (rMMS), в котором семена были введены в запасной экран кристаллизацииматрицы 6,7. Это улучшило качество кристаллов и увеличило количество кристаллизации хитов в среднем в 7 раз.
После успешного производства кристаллов и получения рентгеновского дифракционного шаблона возникает еще одно узкое место в виде решения «фазовой проблемы». В процессе сбора данных регистрируется интенсивность дифракции (пропорционально квадрату амплитуды), но фазовая информация теряется, что порождает фазовую проблему, которая останавливает немедленное определениеструктуры 8. Если целевой белок разделяет высокую последовательность идентичности белка с ранее определенной структурой, молекулярная замена может быть использованадля оценки фазовой информации 9,10,11,12. Хотя этот метод является быстрым и недорогим, структуры моделей могут быть недоступны или пригодны. Успех метода молекулярной замены на основе гомологии значительно снижается по мере того, как идентичность последовательности опускается ниже 35%13. При отсутствии подходящей гомологической модели можно протестировать методы ab initio, такие как ARCIMBOLDO14,15 и AMPLE16. Эти методы используют компьютерно предсказанные модели или фрагменты в качестве отправной точки для молекулярной замены. AMPLE, которая использует предсказанные модели приманки в качестве отправной точки, изо всех сил пытается решить структуры больших (100 остатков) белков и белков, содержащих преимущественно β-листы. ARCIMBOLDO, который пытается поместить мелкие фрагменты, чтобы расширить в большую структуру, ограничивается данными высокого разрешения (≤2 К) и способностью алгоритмов расширить фрагменты в полную структуру.
Если методы молекулярной замены не удается, прямыеметоды, такие как изоморфная замена 17,18 и аномальное рассеяние наодной длине волны(SAD 19 ) или несколько длин волн (MAD20) должны быть использованы. Это часто имеет место для по-настоящему новых структур, где кристалл должен быть сформирован или выведен с тяжелым атомом. Это может быть достигнуто путем замачивания или совместного кристаллизации с тяжелым соединением атома, химической модификации (например, 5-бромурацилов включения в РНК) или помечены выражение белка (например, включение селенометионина или селеноцистеина аминокислоты впервичную структуру) 21,22. Это еще больше усложняет процесс кристаллизации и требует дополнительного скрининга и оптимизации.
Новый класс фазирования соединений, в том числе I3C (5-амино-2,4,6-трийодоизофталеновая кислота) и B3C (5-амино-2,4,6-трибромуазофталовая кислота), предлагают захватывающие преимущества по сравнению с уже существующимисоединениями фазирования 23,24,25. Оба I3C и B3C имеют ароматические эшафот кольца с чередующимся расположением аномальных рассеяний, необходимых для прямых методов поэтапного и аминокислот или карбоксилат функциональных групп, которые взаимодействуют конкретно с белком и обеспечивают связывающую специфичность сайта. Последующее равностороннее треугольное расположение групп тяжелых металлов позволяет упростить проверку фазированной подструктуры. На момент написания статьи в Банке данных о белках (PDB) было 26 связанных I3C структур, из которых 20 были решены с помощью SAD26.
Этот протокол повышает эффективность конвейера определения структуры путем объединения методов производных тяжелых металлов и скрининга rMMS для одновременного увеличения числа кристаллизации хитов и упрощения процесса производных кристаллизации. Мы продемонстрировали, что этот метод был чрезвычайно эффективен с куриным яичным белком лизозимом и областью нового белка лизина из бактериофажа P6827. Описано структурированное решение с использованием высокоагматизированных конвейеров определения структуры Auto-rickshaw, специально разработанных для поэтапного соединения I3C. Существуют и другие автоматизированные трубопроводы, которые могут быть использованы, такие как AutoSol28,ELVES29 и CRANK230. Не полностью автоматизированные пакеты, такие как SHELXC/D/E также могут бытьиспользованы 31,32,33. Этот метод особенно полезен исследователям, изучающим белки, не имеющие гомологичные модели в PDB, значительно уменьшая количество этапов скрининга и оптимизации. Предпосылкой для этого метода являются кристаллы белка или кристаллический осадок целевого белка, полученный в ходе предыдущих испытаний кристаллизации.
протокол
1. Экспериментальное планирование и соображения
- Используйте уже существующие кристаллы белка, представляющие интерес, предпочтительно генерируемые путем кристаллизации диффузии пара. Для обобщенного протокола кристаллизации диффузии пара см. Другие методы кристаллизации, такие как микробэтч под маслом и свободное распространение интерфейса потребует сбора кристаллов до дробления для получения микросея.
- При приготовлении семенного запаса используйте кристаллы высочайшего качества, которые можно принести в жертву. Кристалл высочайшего качества можно судить визуально на основе морфологии или лучший кристалл диффрактинга может быть выбран, если такие данные доступны. Весьма вероятно, что еще более качественные кристаллы получаются после оптимизации путем посева. В случае, когда нет кристаллов доступны, кристаллические осадки, такие как сферулиты и иглы могут быть использованы.
- Определите кристаллы соли. Кристаллы соли могут расти в кристаллизации экранов и может выглядеть как кристаллы белка. Использование кристаллов соли в rMMS не принесет никакой пользы и будет тратить драгоценные образцы, поэтому важно, чтобы устранить соль ложных срабатываний.
- Кристаллы соли громки, когда они раздавлены. Кристаллы должны быть измельчены для создания семенного запаса, поэтому эта стратегия особенно актуальна. Если слышен звук трещины при дроблении кристаллов, кристалл, скорее всего, соль.
- Если белок содержит триптофан и тирозин остатки, используйте ультрафиолетовую микроскопию флуоресценции для выявления кристаллов белка, которые флуоресце в этих условиях освещения.
- Используйте изитовый краситель (метиленовый синий) для окрашивания кристаллов белка, чтобы дифференцировать их к кристаллам соли, которые остаются относительно неокрашенными. Тем не менее, эта процедура является более разрушительной и рекомендуется только в том случае, если есть кристаллы, чтобы избавить от репликаций той же капли.
ПРИМЕЧАНИЕ: Хотя вышеупомянутые тесты могут дать многообещающие результаты, кристаллы соли все еще могут быть ошибочно приняты за кристаллы белка. В этом случае эксперименты по дифракции могут быть использованы для окончательного различевания белка и кристалла соли.
2. Подготовка литиевого запаса I3C
- Измерьте 120 мг I3C (5-амино-2,4,6-трийодуазофталовая кислота) в микроцентрифугную трубку 1,5 мл.
- Растворите I3C в 200 МКл 2 М гидроксида лития. Раствор можно аккуратно нагреть с помощью теплового блока при температуре 40-60 градусов по Цельсию, чтобы стимулировать растворение. Полученный раствор лития I3C должен быть коричневым и иметь концентрацию 1 М.
ВНИМАНИЕ: Гидроксид лития коррозионный. Следует надеть защитные очки, перчатки и лабораторное пальто. - Измерьте рН раствора. При необходимости добавьте небольшое количество соляной кислоты 1 М или 2 М гидроксида лития, чтобы настроить рН до 7-8. Добавьте миллиз воды, чтобы сделать окончательный объем раствора до 400 мл. Концентрация биржевого раствора I3C составляет 0,5 М.
ПРИМЕЧАНИЕ: Шаг 2.3 не является обязательным. РН раствора должен быть между рН 7-8 до любой регулировки рН. Этот шаг должен быть выполнен, если белок интереса сильно зависит от рН. Протокол можно приостановить здесь. Литий I3C может храниться в темноте при 4 градусов по Цельсию, по крайней мере двенедели 35.
3. Добавление I3C в белковый запас
- Метод 1
- Добавьте запас лития I3C к алициту целевого белка в 150 мкл. Окончательная концентрация должна быть между 5-40 мМм лития I3C.
- Метод 2 (более мягкий метод)
- Подготовье буфер разбавления белка, который соответствует буферу целевого белка. К этому буферу разбавления добавьте запас лития I3C, чтобы дать концентрацию лития I3C между 10-80 мМ.
- Разбавить белок 1:1 буфером разбавления белка, чтобы дать окончательную концентрацию лития I3C между 5-40 мММ.
ПРИМЕЧАНИЕ: Некоторые белки будут осаждать при контакте с высокой концентрацией лития I3C в методе 1, в то время как другие белки могут терпеть его. Метод 2 снижает вероятность осадков. Тем не менее, этот метод вдвое концентрации белка. Для белков, которые не имеют установленного протокола кристаллизации, концентрация белка 10 мг/мл, как правило, рекомендуется для первоначального скрининга кристаллизации. Рекомендуется первоначальное соотношение моляров I3C к белку 8. Концентрация белка и соотношение моляров I3C к белку могут быть оптимизированы после первоначального экрана.
4. Изготовление семенного запаса
- Сделайте округлый зонд для дробления кристаллов.
- С горелки Bunsen на синем пламени, тепло Пастер пипетки к его середине. Используя пинцет, вытяните конец пипетки Pasteur, чтобы вытянуть ее в тонкий диаметр менее 0,3 мм.
- После того, как животик достаточно тонкий, удерживайте этот сегмент в пламени, чтобы отделить пипетки в этой точке и вокруг конца пипетки, чтобы закончить стеклянный зонд.
ПРИМЕЧАНИЕ: Округлые зондные кристаллические дробилки продаются сторонними поставщиками. Это альтернатива созданию округлых зондов.
- Поместите на лед пять микроцентрифуговых труб 1,5 мл.
- Под световым микроскопом изучите лоток кристаллизации для подходящего состояния для генерации микрокристалл. В идеале выбираются хорошие морфологии больших кристаллов. Тем не менее, этот метод также работает с плохими кристаллами морфологии, иглы, пластины, микрокристаллы и сферулиты.
- Откройте кристаллизацию лоток хорошо. Для 96 хорошо кристаллизации лотки запечатаны пластиком, используйте скальпель, чтобы сократить пластиковые уплотнения хорошо. Для висячих лотков капли запечатаны с жиром, coverslip могут быть удалены с помощью пинцета и перевернутый на ую поверхность.
- Перенесите 70 МКЛ раствора резервуара в микроцентрифугную трубку и охладите ее на льду. К другим трубам микроцентрифуга добавьте 90 МКЛ раствора резервуара и вернитесь во льду, чтобы охладиться.
ПРИМЕЧАНИЕ: Если резервуар не имеет достаточного объема или не существует (в случае микробатча под маслом), создайте резервуар кристаллизации путем смешивания соответствующих реагентов. - Агитировать кристалл в падении с помощью кристаллического зонда, чтобы тщательно раздавить его. Кристалл должен быть полностью раздавлен, который можно контролировать под микроскопом.
- Удалите всю жидкость из капли и перенесите ее в трубку микроцентрифуга раствором резервуара. Смешайте и затем возьмите 2 мкл смеси из микроцентрифуг трубки и добавить его обратно в колодец. Промыть колодец раствором и перенести его в трубку микроцентрифуга. Повторите этот шаг полоскания еще раз. С этого момента, держать микроцентрифуг трубки холодной, чтобы избежать таяния микросея в смеси.
- Vortex трубки на максимальной скорости при 4 градусов по Цельсию в течение 3 минут, останавливаясь регулярно, чтобы охладить трубку на льду, чтобы предотвратить перегрев.
ПРИМЕЧАНИЕ: Некоторые протоколы микросея, добавляющие политтрафторэтиленовый шарик семян в трубку микроцентрифуга, чтобы помочь кристаллудробления 7,36. Мы использовали технику без использования семенного шарика с успехом, но не видим никаких проблем с использованием семенного шарика, чтобы раздавить кристаллы. - Сделайте 1 из 10 серийного разбавления семенного запаса путем последовательной передачи 10 йл между охлажденными растворами резервуара.
- Храните запасы семян, которые не будут использоваться сразу при -80 градусов по Цельсию.
5. Настройка экрана rMMS
- Настройка 96 хорошо скрининг пластины с помощью жидкости дозирования робота. При отсутствии робота можно также использовать многокананеловую пипетку.
- Передача 75 йл из глубокого блока хорошо 96 хорошо кристаллизации лоток. Добавьте 1 йл к падению кристаллизации и 74 МКЛ к резервуару.
- Передача 1 мл белка, дополненного литием I3C, сделанного в шаге 2, к падению кристаллизации.
- Передача 0,1 МЛ семенного запаса в каплю кристаллизации.
- Печать пластины с ясной уплотнительной лентой и инкубировать пластины при постоянной температуре, чтобы кристалл роста.
- Настройка висячих экранов капли
- Смазать края висячих колодцев капли (висящие лотки кристаллизации капли можно найти в 24 и 48 форматах скважины).
- Перенесите раствор кристаллизации 500 МКЛ в резервуар.
- Рядом с центром стеклянной крышки слайд, место 1 йл капли белка, дополненного лития I3C, сделанные в шаге 2.
- Добавьте к капле 1 мл раствора кристаллизации.
- Передача 0,1 МЛ семенного запаса в каплю кристаллизации.
- Инвертировать крышку слайда и печать кристаллизации хорошо, нажав крышку слайд в жир.
- Инкубировать пластину при постоянной температуре, чтобы обеспечить рост кристалла.
ПРИМЕЧАНИЕ: С новыми и непроверенными запасами семян, рекомендуется использовать наиболее концентрированный запас семян, чтобы максимизировать шансы на получение кристаллизации хитов. Последующие условия могут быть созданы с пониженной концентрацией семян для оптимизации количества кристаллов.
- Регулярно проверяй кристаллические подносы под микроскопом на кристаллический рост. Если кристаллы имеют достаточное качество, они могут быть собраны для сбора данных. Кристаллы также могут быть использованы для создания новых запасов семян и новых экранов rMMS, чтобы обеспечить итеративную оптимизацию.
6. Сбор данных
- Урожай кристаллов с помощью криолупов, криопротезатор кристаллов и вспышки охладить их в жидком азоте. Для получения дополнительной информации о кристаллах флэш-охлаждения, обратитесь к Teng37 и Гарман иМитчелл 38.
- Во время стадии криопротезирования, если кристалл проходит через новый aqueous раствор, I3C может быть потерян из кристалла из-за его пиявки в раствор криопротезирования. Используйте литий I3C в растворе криопротекторной раствора в концентрации, которая соответствует условию кристаллизации, чтобы смягчить это.
- Кристаллы, выращенные с помощью этого протокола, успешно были криопротезированы с помощью криопротектора на основе масла Parabar 10312 (Hampton Research).
ПРИМЕЧАНИЕ: Протокол можно приостановить здесь, пока кристаллы хранятся в жидком азоте.
ВНИМАНИЕ: жидкий азот может вызвать холодные ожоги. Кроме того, жидкий азот может вызывать удушье при использовании в закрытых помещениях.
- Накрените кристалл на рентгеновский источник гониометра и соберите данные дифракции с помощью протокола, специфичного для рентгеновского источника.
- Этот метод опирается на аномальный сигнал от атомов йода в I3C. Таким образом, выберите энергию рентгеновского излучения, чтобы максимизировать этот сигнал.
- Установите синхротронные рентгеновские источники с настраиваемыми энергиями как можно меньше. Для многих макромолекулярных кристаллических лучей самая низкая настраиваемая энергия составляет от 8000 до 8500 эВ.
- Вращающиеся рентгеновские источники анода не могут быть настроены. Обычно используемые источники анода с медью имеют край КЗ на уровне 8046 eV, который обеспечивает хороший аномальный сигнал для йода (f" 6,9 e). Источники анода с хромом имеют край КЗ на уровне 5415 эВ, который обеспечивает большой аномальный сигнал для йода (f" 12,6 e).
- Радиационный ущерб является серьезной проблемой при сборе данных, так как он ухудшит аномальныйсигнал 39. Выберите время облучения и затухание луча для достижения наилучшей дифракции при минимизации дозы облучения.
ПРИМЕЧАНИЕ: В аналогичном поэтапном соединении с атомами йода, замененных атомами брома, было показано, что радиационное повреждение вызывает радиолиз связи брома углерода и снижение заполняемости атомов брома24.- Используйте обратный луч SAD сбора данных в качестве стратегии сбора. Данные собираются в клинья, с противоположными клиньями, собранными друг за другом. Это позволяет собирать пары Фриделя с эквивалентной дозой, что приводит к улучшению измерения аномального сигнала, менее пострадавшего от радиационного повреждения. Например, восемь клин стратегии для сбора 360 "будет включать в себя сбор данных в порядке клина 1 (0 '-45 "), клин 2 (180 "-225"), клин 3 (46 "-90"), клин 4 (225 "-270), клин 5 (90-135), клин 6 (270-315), клин 7 (135-180) и клин 8 (315-360).
ПРИМЕЧАНИЕ: Непрерывное вращение является альтернативной стратегией сбора данных обратного луча. Для недавнего сравнения стратегий сбора, см. Гарсия-Бонте и Катона40.
- Используйте обратный луч SAD сбора данных в качестве стратегии сбора. Данные собираются в клинья, с противоположными клиньями, собранными друг за другом. Это позволяет собирать пары Фриделя с эквивалентной дозой, что приводит к улучшению измерения аномального сигнала, менее пострадавшего от радиационного повреждения. Например, восемь клин стратегии для сбора 360 "будет включать в себя сбор данных в порядке клина 1 (0 '-45 "), клин 2 (180 "-225"), клин 3 (46 "-90"), клин 4 (225 "-270), клин 5 (90-135), клин 6 (270-315), клин 7 (135-180) и клин 8 (315-360).
7. Решение по обработке и структуре данных
- Выполняйте снижение данных по данным дифракции с помощью XDS41с целью максимизации аномального сигнала. Параметры ввода снижения данных специфичны для набора данных и могут потребовать некоторых проб и ошибок. Вот некоторые рекомендации, чтобы начать.
- Установить ФРИДЕЛЬ В LAW-FALSE. Выполните CORRECT дважды, установив STRICT_ABSORPTION_CORRECT TRUE и STRICT_ABSORPTION_CORRECT FALSE. Один запуск может иметь более высокий аномальный сигнал, чем другой. Сравните аномальные сигналы между трассами с использованием дисциплин «Аномалия Корр» и «СигАно» на выходе. Это обеспечивает показатель качества данных.
- Вы запустите SHELXC на XDS_ASCII. Файл HKL для более точного указания аномального сигнала. Дисциплина «Раном» даст представление об аномальном сигнале в разных разрешениях.
- Вызапустите POINTLESS 42 и AIMLESS43 для масштабирования данных. В AIMLESS установите параметр ANOMALOUS ON. Если используется графический интерфейс, выберите опцию Отдельные аномальные пары для отклонения выбросов и слияния статистики. Для максимального аномальных сигналов может потребоваться тестирование различных разрешений.
- Решите структуру белка с помощью Auto-Rickshaw автоматизированной кристаллической структуры определениятрубопровода 44. Авто-рикша будет пытаться решить проблему фазы и построить кристаллическую структуру белка автоматически с белкового моделирования и уточнения программного обеспечения.
- Для белков без шаблона модели гомологии запустите протокол SAD Auto-rickshaw в расширенном режиме. Введите необходимые параметры.
- Выберите PROTEIN в качестве типа молекулы.
- Введите длину волны сбора данных в ангстремах (Я).
- Выберите "I" в качестве элемента подструктуры для обозначения атомов йода.
- Выберите "i3c" в качестве подструктурного типа, чтобы указать, что I3C является фазированной молекулой.
- Выберите "sub_direct" в качестве метода определения подструктуры. Этот метод использует SHELXD32 для поиска подструктуры.
- Выберите "3" в качестве числа ожидаемых подструктур на мономер.
- Введите "1" в качестве разрешения отсечения подструктуры поиска. Это позволяет Auto-rickshaw автоматически определить подходящее разрешение отсечения.
- Введите количество остатков в одном мономере, космическую группу набора данных и количество молекул в асимметричном блоке на основе коэффициента Мэтьюса.
- Выберите соответствующий уровень распространения рентгеновских данных, который соответствует потребностям. Выбор "AutoRickshaw разработчиков" позволит разработчикам Auto-Rickshaw устранения неполадок в случае возникновения проблем.
- Вввеку аномальные данные в качестве файла mtz.
- Вввейте белковую последовательность в качестве файла seq, pir или txt. Файл seq может быть сгенерирован в текстовом редакторе (например, Notepad9 на Windows или nano в Linux). Создайте новый файл, введите первичную последовательность белка в качестве одной длинной линии или разделенных разрывами линий. Сохраните файл с расширением файла .seq.
- Введите институциональный адрес электронной почты.
- Для белков без шаблона модели гомологии запустите протокол SAD Auto-rickshaw в расширенном режиме. Введите необходимые параметры.
- Результаты доставляются через веб-ссылку, отправленную на предоставленный адрес электронной почты.
ПРИМЕЧАНИЕ: AutoRickshaw является автоматизированным трубопроводом, который вызывает различные пакеты программного обеспечения кристаллографии для решения рентгеновскойкристаллической структуры 32,33,45,46,47,48,49,50,51,52,53,54,55,56,57,58. Если запуск Auto-Rickshaw не решает структуру, другие настройки Auto-rickshaw могут быть протестированы. Метод определения структуры может быть изменен на "sub_phassade" использовать Phaser59 вместо SHELXD32. Число ожидаемых подструктур на мономер также может быть увеличено или уменьшено. - Во время экспериментального поэтапного отказа от кристаллической структуры, Auto-rickshaw попытается позиционировать тяжелые атомы в ячейке единицы, создавая подструктуру. Равностороннее расположение атомов йода в I3C представляет собой эффективный способ проверки подструктуры. Если шаг 6.3 не удается, проверка подструктуры может помочь в устранении неполадок структурного решения.
- Скачать список тяжелых атомов сайтов из Auto-Рикша результаты страницы. Это гиперссылка называется "тяжелых атомных участков". Это будет скачать текстовый файл с тяжелым атомом сайтов.
- Измените расширение файла с .txt до .pdb.
- Откройте файл PDB в Кут60. Включите симметрию, чтобы увидеть другие тяжелые атомы из соседних асимметричных единиц.
- Измерьте расстояния между тяжелыми атомами, в том числе через асимметричные единицы. I3C будет отображаться как равносторонний треугольник с боковой длиной 6 ангстремов. Наличие треугольника с этими измерениями указывает на правильность размещения этих тяжелых атомов.
Результаты
Включение I3C в rMMS может создать новые условия, поддерживающие производный кристаллический рост
Эффективность одновременного скрининга rMMS и производной I3C была продемонстрирована в двух белках, лизозиме куриного яичного белка (HEWL, полученном как лиофилизированный порошок) и предполагаемом домене Orf11 lysin N-terminal (Orf11 NTD) из бактериофажа P68. Каждый белок был проверен на PEG/ION HT при четырех различных условиях, включая: несеяные, семенами, несеяные с I3C и посеяны с I3C (Рисунок 1). Для обоих белков, единственное добавление I3C не увеличить количество условий, способствующих кристаллизации. В случае Orf11 NTD, только одно подходящее условие было определено с и без I3C (Рисунок 1B). Когда I3C был добавлен на экраны HEWL, количество попаданий было сокращено с 31 до 26, подчеркивая дополнительные сложности кристаллизации при введении фазирования соединений(рисунок 1A). В соответствии с другими исследованиями, добавление семян в коммерческие редкие матричные экраны для создания экрана rMMS значительно увеличило количество возможных условий кристаллизации для обоих белков, в результате чего в 2,1 и 6 раз больше для HEWL и Orf11 NTD,соответственно 6,61 (Рисунок 1). Самое главное, одновременное добавление I3C и семян увеличило количество попаданий относительно несеяного экрана, продемонстрировав увеличение в 2,3 и 7 раз для HEWL и Orf11 NTD, соответственно. Многие кристаллы из rMMS в присутствии I3C показывают отличную кристаллическую морфологию(рисунок 2).
Посев позволяет тщательно контролировать количество кристаллов на экранах I3C rMMS
В экспериментах по микросеянию количество семян, введенных в испытание кристаллизации, можно контролировать путем разбавления семенного запаса, что позволяет точно контролировать нуклеациюпри падении 7,36. Это часто позволяет более крупным кристаллам формироваться, так как существует снижение конкуренции белковых молекул в местах нуклеации. Это преимущество также распространяется на метод I3C-rMMS и успешно продемонстрировано как в HEWL, так и в Orf11 NTD. Восстановление состояния кристаллизации, идентифицированного на экране I3C-rMMS с разбавленным запасом семян, дало меньше, но больших кристаллов(рисунок 3).
SAD поэтапное может быть использовано для решения структур из кристаллов, полученных из экрана rMMS I3C
Кристаллы, выращенные с использованием разбавленного семенного запаса, показанного на рисунке 3, использовались для решения структуры белков с использованием SAD phasing с использованием данных дифракции из одногокристалла (рисунок 4). Данные были собраны на австралийском синхротроне MX1 луч62. Подробные детали сбора данных и структурного решения описаны вдругом месте 27.
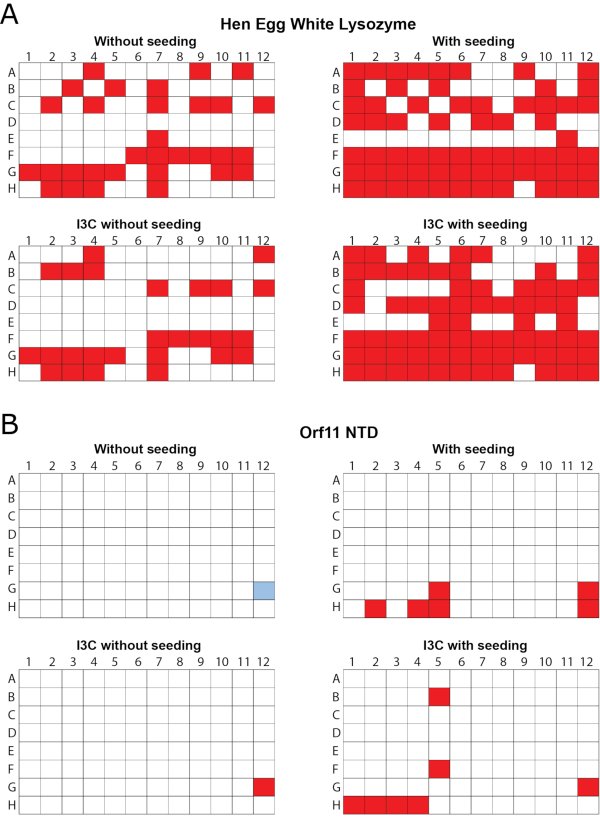
Рисунок 1 - rMMS был использован для создания новых условий для роста кристалла в присутствии I3C для двух тестовых белков. 96 хорошо пара диффузии кристаллизации экраны были проведены с использованием коммерческих редких матричных экранов. (A) Куриный яичный белок лизозим был протестирован с экраном индекс HT. Треи были посеяны с кристаллами HEWL, выращенными в 0.2 M аммония tartrate dibasic pH 7.0, 20% (w/v) полиэтиленгликоль 3350. (B) Orf11 NTD из бактериофажа P68 был протестирован с экраном PEG/ION. Лотки Orf11 NTD были посеяны из кристаллов из состояния G12 с несеяного экрана, показанного синим цветом. Условия, поддерживающие рост кристалла, показаны красным цветом. rMMS посева в присутствии и отсутствии I3C как дал значительно больше кристаллических хитов, чем несеяные лотки. Рисунок адаптирован из Труонг и др.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
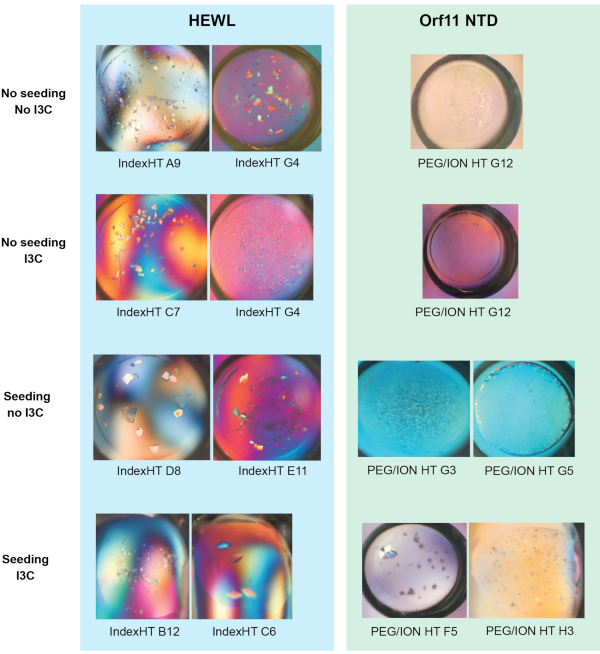
Рисунок 2 - Репрезентативные изображения кристаллов, выращенных в результате диффузионных испытаний пара, показанных на рисунке 1 (a) и b). Рисунок адаптирован из Труонг и др.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 3 - Разбавление семенного запаса является эффективным способом уменьшения нуклеации в состоянии кристаллизации, найденной с использованием метода I3C-rMMS, для контроля количества кристаллов, которые образуются. Уменьшение нуклеации в капле часто приводит к росту кристаллов до больших размеров. Рисунок адаптирован из Труонг и др.27. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.

Рисунок 4 - Orf11 NTD (PDB ID 6O43) и HEWL (PDB ID 6PBB) были кристаллизованы с помощью метода I3C-rMMS и решены с помощью автоматического поэтапного отказа от рикши SAD. (A)Лентоные структуры HEWL и Orf11 NTD решаются путем экспериментального поэтапного отказа. (B) молекула I3C связана с HEWL и Orf11 NTD. (C) Аномальные атомы йода в I3C расположены в равностороннем треугольнике 6. Таким образом, наличие этого треугольника в фазированной подструктуре указывает на то, что в этом положении находится молекула I3C. Пожалуйста, нажмите здесь, чтобы просмотреть большую версию этой цифры.
Обсуждение
Определение структуры нового белка при отсутствии подходящей гомологической модели для молекулярной замены требует экспериментального поэтапного отказа. Эти методы требуют включения тяжелых атомов в кристалл белка, что добавляет уровень сложности трубопровода определения структуры и может ввести многочисленные препятствия, которые должны быть решены. Тяжелые атомы могут быть включены непосредственно в белок через маркированные выражения с использованием селенометионина и селеноцистеина. Поскольку этот метод является дорогостоящим, трудоемким и может привести к снижению урожайности белка, маркированный белок часто выражается после того, как условия кристаллизации были найдены и оптимизированы с немаркированный белок. Кроме того, кристаллы могут быть выведены путем замачивания в растворе,содержащем тяжелые атомы 22,63,64. Этот метод часто использует высококачественные кристаллы и поэтому выполняется после того, как уже разработан надежный метод кристаллизации. Успешное получение производных кристаллов с использованием этого метода требует дальнейшей оптимизации процедур замачивания и скрининга различных фазовых соединений, поэтому добавляет больше времени к и без того трудоемкому процессу.
Сокристаллизация белка с тяжелым атомом может быть выполнена на стадии скрининга, таким образом эффективно оптимизируя процесс и уменьшая шаги манипуляции кристаллом, которые могут привести к повреждению. Тем не менее, по-прежнему существует потенциальный сценарий получения нескольких первоначальных хитов кристаллизации и проблема выбора совместимого тяжелого атома соединения. Многие имеющиеся в настоящее время соединения поэтапного отказа несовместимы с обрывистыми, буферами и добавками, обычно встречаемыми в условиях кристаллизации. Они могут быть нерастворимыми в сульфатных и фосфатных буферов, хелат цитрат и ацетат, реагировать неблагоприятно с HEPES и Tris буферов или стать секвестрирован DTT и β-меркаптоэтанол21. Поскольку соединение I3C поэтапно не страдает от этих несовместимостей, это надежное поэтапное соединение, которое может быть поденципным для многих различных условий.
В этом исследовании представлен обтекаемый метод производства производных кристаллов, готовых к поэтапному отказу от САД путем одновременной совместной кристаллизации соединения I3C и rMMS. Сочетание обоих методов увеличивает количество кристаллизации хитов, со многими условиями, имеющих улучшение морфологии и дифракции характеристики. В обоих случаях испытаний Orf11 NTD и HEWL были выявлены новые условия на экране I3C-rMMS, которые отсутствовали, когда I3C не присутствовал. Потенциально I3C может благоприятно связываться с белком, способствуя образованию и стабилизации кристаллических контактов27. В свою очередь, это может вызвать кристаллизацию и, возможно, улучшить дифракционные характеристики. Помимо того, что соединение совместимо с редкими матричными экранами, I3C также является привлекательным соединением поэтапного отказа из-за его внутренних свойств. Функциональные группы, которые чередуются с йодом на ароматических эшафот кольцо позволяют конкретные связывания с белками. Это приводит к большей заполняемости и потенциально уменьшает фоновыйсигнал 23. Кроме того, расположение аномальных рассеяний в равностороннем треугольнике очевидно в подструктуре и может быть использовано для быстрой проверки связывания I3C(рисунок 4B и 4C). Наконец, он может производить аномальный сигнал с настраиваемым синхротронным излучением, а также хромом и медью вращающихся рентгеновских источников анода. Таким образом, он может быть применен к различным рабочим процессам. Поскольку I3C широко доступен и недорог в покупке, этот подход находится в пределах досягаемости для большинства лабораторий структурной биологии.
Существует несколько экспериментальных соображений, которые необходимо учитывать при использовании метода I3C-rMMS. Этот метод не может быть применен, если первоначальный кристаллический материал белка не может быть получен. В сложных случаях кристаллический материал из гомологового белка также может быть использован для генерации семенного запаса. Этот кросс-посев подход к rMMS показал некоторые многообещающие результаты7. Оптимизация кристаллического числа за счет разбавления семенного запаса является важным шагом, который не следует упускать из виду, чтобы максимизировать шансы на производство высококачественных крупных кристаллов и получение подходящих данных дифракции. Если в асимметричной единице выявлено несколько участков I3C, условия, способствующие кристаллизации, следует дополнительно оптимизировать с повышенной концентрацией I3C. Это может увеличить заполняемость I3C, чтобы максимизировать аномальный сигнал и помощь кристалла вытекают.
Там могут быть случаи, когда этот метод не может быть оптимальным методом для производных кристаллов белка. По мере увеличения размера белка или белкового комплекса ограниченное число сайтов I3C на поверхности белка может не обеспечить достаточную силу поэтапного решения структуры. В этих сценариях, где размер белка, как сообщается, является мтукации, селенометионин маркировки белка может быть более жизнеспособным подходом к поэтапному отказу от белка. Если белок имеет достаточное количество остатков метамфетамина в белке (рекомендуется иметь по крайней мере один methionine на 100остатков 65) и высокая эффективность селенометионина включения в белок может быть достигнуто (например, в бактериальныхсистем выражения 66), несколько высокой занятости атомов селена будет присутствовать в кристаллах фазы структуры.
Кроме того, некоторые белки могут по своей сути быть непригодными для производных с I3C. Места связывания I3C на белках зависят от структуры белка. Там могут существовать белки, которые, естественно, имеют несколько открытых патчей совместимы с I3C связывания. Таким образом, не предвидится, что могут возникнуть трудности в совместной кристаллизации некоторых целевых белков с I3C.
Раскрытие информации
Авторов нечего раскрывать.
Благодарности
Это исследование было проведено на линии пучка MX1 на австралийском синхротроне, в составе ANSTO. Авторы хотели бы поблагодарить сотрудников лабораторий Ширвина и Брунинга за обсуждение этой работы. Авторы также хотели бы отметить д-ра Сантуха Панджикара и д-ра Линду Уайтт-Шервин, которые внесли свой вклад в первоначальную работу, которая стала инициатором этого протокола.
Признается следующее финансирование: Австралийский исследовательский совет (грант Nos. DP150103009 и DP160101450 Кит Э. Ширвин); Университет Аделаиды (Австралийская государственная программа подготовки научных исследований стипендию стипендию Цзя Куйен Труонг и Стефани Нгуен).
Материалы
| Name | Company | Catalog Number | Comments |
| 10 mL disposable luer lock syringes | Adelab Scientific | T3SS10LAT | Used for dispensing vacuum grease for hanging drop crystal tray wells |
| 24 well tissue culture plate | Sigma Aldrich | CLS3527 | Used for hanging drop crystal tray |
| 3 inch wide Crystal Clear Sealing Tape | Hampton Research | HR4-506 | For 96 well crystallization screens set up by robot |
| 5-amino-2,4,6-triiodoisophthalic acid | Alfa Aesar | B22178 | Commonly referred to as I3C in the article |
| Art Robbins Intelli-Plate 96-2 Original | Hampton Research | HR3-297 | For 96 well crystallization screens set up by robot |
| Coverslips | Thermo Fisher Scientific | 18X18-2 | Coverslips for hanging drop crystal tray wells |
| Dow Corning vacuum grease | Hampton Research | HR3-510 | Used for sealing hanging drop crystal tray wells |
| Eppendorf Pipette 0.1 μL-2.5 μL | Eppendorf | 3120000011 | |
| Gilson Pipette 2 μL-20 μL | John Morris Group | 1153247 | |
| Gilson Pipette 20 μL-200 μL | John Morris Group | 1152006 | |
| Glass pasteur pipettes | Adelab Scientific | HIR92601.01 | |
| Hen Egg White Lysozyme | Sigma-Aldrich | L6876 | Approximately 95% pure |
| IndexHT screen | Hampton Research | HR2-134 | |
| Microscope illuminator | Meiji Techno | FT192/230 | Light source to illuminate crystallography experiments |
| PEG/ION HT screen | Hampton Research | HR2-139 | |
| Phoenix Liquid Dispenser | Art Robbins Instruments | 602-0001-10 | |
| Scalpel with scalpel blade no. 15 | Adelab Scientific | LV-SMSCPO15 | |
| Seed bead kit | Hampton Research | HR2-320 | Kit contains a glass probe for crushing crystals. A PTFE seed bead, designed for crushing crystals, is also part of the kit but not used in this protocol. |
| Stereo microscope | Meiji Techno | EMZ-5TR | Microscope for visualising crystallography experiments |
| Tweezers | Sigma-Aldrich | T5415 | |
| Vortex mixer | Adelab Scientific | RAVM1 |
Ссылки
- Zheng, H., Hou, J., Zimmerman, M. D., Wlodawer, A., Minor, W. The future of crystallography in drug discovery. Expert Opinion on Drug Discovery. 9 (2), 125-137 (2014).
- Oakley, A. J., Wilce, M. C. J. Macromolecular crystallography as a tool for investigating drug, enzyme and receptor interactions. Clinical and Experimental Pharmacology and Physiology. 27 (3), 145-151 (2000).
- Jancarik, J., Kim, S. H. Sparse matrix sampling. A screening method for crystallization of proteins. Journal of Applied Crystallography. 24, 409-411 (1991).
- Newman, J., et al. Towards rationalization of crystallization screening for small- To medium-sized academic laboratories: The PACT/JCSG+ strategy. Acta Crystallographica Section D: Biological Crystallography. 61 (10), 1426-1431 (2005).
- Ireton, G. C., Stoddard, B. L. Microseed matrix screening to improve crystals of yeast cytosine deaminase. Acta Crystallographica Section D: Biological Crystallography. 60 (3), 601-605 (2004).
- D'Arcy, A., Villard, F., Marsh, M. An automated microseed matrix-screening method for protein crystallization. Acta Crystallographica Section D: Biological Crystallography. 63 (4), 550-554 (2007).
- D'Arcy, A., Bergfors, T., Cowan-Jacob, S. W., Marsh, M. Microseed matrix screening for optimization in protein crystallization: What have we learned. Acta Crystallographica Section:F Structural Biology Communications. 70 (9), 1117-1126 (2014).
- Taylor, G. The phase problem. Acta Crystallographica - Section D Biological Crystallography. 59 (11), 1881-1890 (2003).
- Rossmann, M. G. The molecular replacement method. Acta Crystallographica Section A. 46 (2), 73-82 (1990).
- McCoy, A. J., Grosse-Kunstleve, R. W., Adams, P. D., Winn, M. D., Storoni, L. C., Read, R. J. Phaser crystallographic software. Journal of Applied Crystallography. 40 (4), 658-674 (2007).
- Millán, C., Jiménez, E., Schuster, A., Diederichs, K., Usón, I. ALIXE: a phase-combination tool for fragment-based molecular replacement. Acta Crystallographica Section D. 76 (3), 209-220 (2020).
- Liebschner, D., et al. Macromolecular structure determination using X-rays, neutrons and electrons: Recent developments in Phenix. Acta Crystallographica Section D: Structural Biology. 75, 861-877 (2019).
- Abergel, C. Molecular replacement: Tricks and treats. Acta Crystallographica Section D: Biological Crystallography. 69 (11), 2167-2173 (2013).
- Pröpper, K., et al. Structure solution of DNA-binding proteins and complexes with ARCIMBOLDO libraries. Acta Crystallographica Section D: Biological Crystallography. 70 (6), 1743-1757 (2014).
- Rodríguez, D. D., et al. Crystallographic ab initio protein structure solution below atomic resolution. Nature Methods. 6 (9), 651-653 (2009).
- Bibby, J., Keegan, R. M., Mayans, O., Winn, M. D., Rigden, D. J. AMPLE: A cluster-and-truncate approach to solve the crystal structures of small proteins using rapidly computed ab initio models. Acta Crystallographica Section D: Biological Crystallography. 68 (12), 1622-1631 (2012).
- Green, D. W., Ingram, V. M., Perutz, M. F. The structure of haemoglobin - IV. Sign determination by the isomorphous replacement method. Proceedings of the Royal Society of London. Series A. Mathematical and Physical Sciences. 225 (1162), 287-307 (1954).
- Blow, D. M., Rossmann, M. G. The single isomorphous replacement method. Acta Crystallographica. 14 (11), 1195-1202 (1961).
- Wang, B. C. Resolution of phase ambiguity in macromolecular crystallography. Methods in Enzymology. 115, 90-112 (1985).
- Hendrickson, W. A. Determination of macromolecular structures from anomalous diffraction of synchrotron radiation. Science. 254 (5028), 51-58 (1991).
- Pike, A. C. W., Garman, E. F., Krojer, T., Von Delft, F., Carpenter, E. P. An overview of heavy-atom derivatization of protein crystals. Acta Crystallographica Section D: Structural Biology. 72 (3), 303-318 (2016).
- Dauter, Z., Dauter, M., Rajashankar, K. R. Novel approach to phasing proteins: Derivatization by short cryo-soaking with halides. Acta Crystallographica Section D: Biological Crystallography. 56 (2), 232-237 (2000).
- Beck, T., Krasauskas, A., Gruene, T., Sheldrick, G. M. A magic triangle for experimental phasing of macromolecules. Acta Crystallographica Section D: Biological Crystallography. 64 (11), 1179-1182 (2008).
- Beck, T., Gruene, T., Sheldrick, G. M. The magic triangle goes MAD: Experimental phasing with a bromine derivative. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 374-380 (2010).
- Beck, T., Da Cunha, C. E., Sheldrick, G. M. How to get the magic triangle and the MAD triangle into your protein crystal. Acta Crystallographica Section F: Structural Biology and Crystallization Communications. 65 (10), 1068-1070 (2009).
- Berman, H. M., et al. The Protein Data Bank. Nucleic Acids Research. , (2000).
- Truong, J. Q., Panjikar, S., Shearwin-Whyatt, L., Bruning, J. B., Shearwin, K. E. Combining random microseed matrix screening and the magic triangle for the efficient structure solution of a potential lysin from bacteriophage P68. Acta Crystallographica Section D: Structural Biology. 75 (7), 670-681 (2019).
- Terwilliger, T. C., et al. Decision-making in structure solution using Bayesian estimates of map quality: The PHENIX AutoSol wizard. Acta Crystallographica Section D: Biological Crystallography. 65 (6), 582-601 (2009).
- Holton, J., Alber, T. Automated protein crystal structure determination using ELVES. Proceedings of the National Academy of Sciences of the United States of America. 101 (6), 1537-1542 (2004).
- Skubák, P., Pannu, N. S. Automatic protein structure solution from weak X-ray data. Nature Communications. 4, (2013).
- Sheldrick, G. M. Crystal structure refinement with SHELXL. Acta Crystallographica Section C: Structural Chemistry. 71, 3-8 (2015).
- Schneider, T. R., Sheldrick, G. M. Substructure solution with SHELXD. Acta Crystallographica Section D: Biological Crystallography. 58 (10), 1772-1779 (2002).
- Sheldrick, G. M. Macromolecular phasing with SHELXE. Zeitschrift fur Kristallographie. 217 (12), 644-650 (2002).
- Benvenuti, M., Mangani, S. Crystallization of soluble proteins in vapor diffusion for x-ray crystallography. Nature Protocols. , (2007).
- Beck, T. . Sticky triangles New tools for experimental phasing of biological macromolecules. , (2010).
- Luft, J. R., DeTitta, G. T. A method to produce microseed stock for use in the crystallization of biological macromolecules. Acta Crystallographica Section D: Biological Crystallography. 55 (5), 988-993 (1999).
- Teng, T. -. Y. Mounting of crystals for macromolecular crystallography in a free-standing thin film. Journal of Applied Crystallography. 23 (5), 387-391 (1990).
- Garman, E. F., Mitchell, E. P. Glycerol concentrations required for cryoprotection of 50 typical protein crystallization solutions. Journal of Applied Crystallography. 29, 584-587 (1996).
- Garman, E. F., Weik, M. X-ray radiation damage to biological samples: recent progress. Journal of Synchrotron Radiation. 26 (4), 907-911 (2019).
- Garcia-Bonete, M. J., Katona, G. Bayesian machine learning improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section A: Foundations and Advances. 75, 851-860 (2019).
- Kabsch, W. XDS. Acta Crystallographica Section D Biological Crystallography. 66 (2), 125-132 (2010).
- Evans, P. Scaling and assessment of data quality. Acta Crystallographica Section D: Biological Crystallography. 62 (1), 72-82 (2006).
- Evans, P. R., Murshudov, G. N. How good are my data and what is the resolution. Acta Crystallographica Section D: Biological Crystallography. 69 (7), 1204-1214 (2013).
- Panjikar, S., Parthasarathy, V., Lamzin, V. S., Weiss, M. S., Tucker, P. A. Auto-Rickshaw: An automated crystal structure determination platform as an efficient tool for the validation of an X-ray diffraction experiment. Acta Crystallographica Section D: Biological Crystallography. 61 (4), 449-457 (2005).
- Jones, T. A., Thirup, S. Using known substructures in protein model building and crystallography. The EMBO journal. 5 (4), 819-822 (1986).
- Kleywegt, G. J., Jones, T. A. Template convolution to enhance or detect structural features in macromolecular electron-density maps. Acta Crystallographica Section D: Biological Crystallography. 53 (2), 179-185 (1997).
- Perrakis, A., Morris, R., Lamzin, V. S. Automated protein model building combined with iterative structure refinement. Nature Structural Biology. 6 (5), 458-463 (1999).
- Morris, R. J., et al. Breaking good resolutions with ARP/wARP. Journal of Synchrotron Radiation. 11 (1), 56-59 (2004).
- Yao, D. Q., et al. SAD phasing by OASIS-2004: Case studies of dual-space fragment extension. Acta Crystallographica Section D: Biological Crystallography. 62 (8), 883-890 (2006).
- Hao, Q. ABS: A program to determine absolute configuration and evaluate anomalous scatterer substructure. Journal of Applied Crystallography. 37 (3), 498-499 (2004).
- Collaborative Computational Project Number 4. The CCP4 suite: Programs for protein crystallography. Acta Crystallographica Section D: Biological Crystallography. 50 (5), 760-763 (1994).
- Sheldrick, G. M., Hauptman, H. A., Weeks, C. M., Miller, R., Usón, I. Ab initio phasing. International Tables for Crystallography. , 333-345 (2006).
- Smith, G. D. Matching selenium-atom peak positions with a different hand or origin. Journal of Applied Crystallography. 35 (3), 368-370 (2002).
- Pannu, N. S., McCoy, A. J., Read, R. J. Application of the complex multivariate normal distribution to crystallographic methods with insights into multiple isomorphous replacement phasing. Acta Crystallographica - Section D Biological Crystallography. 59 (10), 1801-1808 (2003).
- Pannu, N. S., Read, R. J. The application of multivariate statistical techniques improves single-wavelength anomalous diffraction phasing. Acta Crystallographica Section D: Biological Crystallography. 60 (1), 22-27 (2004).
- De La Fortelle, E., Bricogne, G. Maximum-likelihood heavy-atom parameter refinement for multiple isomorphous replacement and multiwavelength anomalous diffraction methods. Methods in Enzymology. 276, 472-494 (1997).
- Cowtan, K. Joint CCP4 and ESF-EACBM Newsletter on Protein. Crystallography. 31, 34-38 (1994).
- Terwilliger, T. C. Maximum-likelihood density modification. Acta Crystallographica Section D: Biological Crystallography. 56 (8), 965-972 (2000).
- Read, R. J., McCoy, A. J. Maximum-likelihood determination of anomalous substructures. Acta Crystallographica Section D: Structural Biology. , (2018).
- Emsley, P., Lohkamp, B., Scott, W. G., Cowtan, K. Features and development of Coot. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 486-501 (2010).
- Till, M., et al. Improving the success rate of protein crystallization by random microseed matrix screening. Journal of visualized experiments JoVE. (78), e50548 (2013).
- McPhillips, T. M., et al. Blu-Ice and the distributed control system: Software for data acquisition and instrument control at macromolecular crystallography beamlines. Journal of Synchrotron Radiation. 9 (6), 401-406 (2002).
- Nagem, R. A. P., Polikarpov, I., Dauter, Z. Phasing on Rapidly Soaked Ions. Methods in Enzymology. 374, 120-137 (2003).
- Taylor, G. L. Introduction to phasing. Acta Crystallographica Section D: Biological Crystallography. 66 (4), 325-338 (2010).
- Hendrickson, W. A., Ogata, C. M. Phase determination from multiwavelength anomalous diffraction measurements. Methods in Enzymology. 276, 494-523 (1997).
- Doublié, S. Production of Selenomethionyl Proteins in Prokaryotic and Eukaryotic Expression Systems. Macromolecular Crystallography Protocols. Methods in Molecular Biology. , 91-108 (2007).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены