Method Article
הקמת תרבויות בינאריות יציבות של סקרייבקטריה סימביוטית מחלל הפה
* These authors contributed equally
In This Article
Summary
אנו מדגימים שיטה לבודד חברים קשים לגידול של פילום חיידקי הרומן, Saccharibacteria, על ידי סינון פלאק שיניים שיתוף culturing עם חיידקים מארחים.
Abstract
מינים חיידקיים רבים אינם יכולים להיות תרבותיים במעבדה בשיטות סטנדרטיות, מה שמציב מחסום משמעותי לחקר רוב המגוון המיקרוביאלי על פני כדור הארץ. גישות חדשניות נדרשות לתרבות חיידקים לא תרבותיים אלה, כך שהחוקרים יוכלו לחקור ביעילות את הפיזיולוגיה ואורח החיים שלהם באמצעות הכלים החזקים הזמינים במעבדה. קרינת פילה המועמדת היא אחת הקבוצות הגדולות ביותר של חיידקים לא תרבותיים, המהווים ~ 15% מהמגוון החי על פני כדור הארץ. הבידוד הראשון של קבוצה זו היה חבר בפילום Saccharibacteria, 'Nanosynbacter lyticus' זן TM7x. TM7x הוא חיידק קטן במיוחד שחי כסימביונט במגע ישיר עם מארח חיידקי, Schaalia odontolytica, זן XH001. תוך ניצול גודל התא הקטן מהרגיל ואורח החיים שלו כאורגניזם סימביוטי, פיתחנו פרוטוקול לתרבות המהירה Saccharibacteria מלוח שיניים. פרוטוקול זה יראה כיצד לסנן השעיה של פלאק שיניים באמצעות מסנן 0.2 מיקרומטר, ולאחר מכן לרכז את תאי Saccharibacteria שנאספו ולהדביק תרבות של אורגניזמים מארחים. Coculture וכתוצאה מכך ניתן להעביר כמו כל תרבות חיידקית נורמלית זיהום מאושר על ידי PCR. התרבות הבינארית המתקבלת יכולה להישמר במעבדה ולהשתמש בה לניסויים עתידיים. בעוד זיהום הוא אפשרות, התרבות הבינארית יכולה להיות מטוהרת על ידי סינון נוסף והדבקה חוזרת של המארח, או על ידי ציפוי התרבות הבינארית והקרנה למושבות נגועות. אנו מקווים שניתן יהיה להרחיב פרוטוקול זה לסוגי מדגמים וסביבות אחרות, מה שיוביל לטיפוח מינים רבים נוספים בהחייאה.
Introduction
Culturing מינים חדשים של חיידקים ולהביא אותם למעבדה מאפשר ניסויים רבי עוצמה כדי להבין טוב יותר את הפיזיולוגיה שלהם אינטראקציות רחבות יותר בתוך הקהילה המיקרוביאלית שלהם. בעוד שישן שיטות ללא תרבות לחקור את השאלות הללו (למשל, "מטא-אומיקה"), האינטראקציות המורכבות של אוכלוסיות מיקרוביאליות מגוונות מקשות על הקנטות בנפרד ומשתנים בודדים ולהגיע למסקנות משמעותיות. בעוד חיידקים culturing יש יתרונות רבים, ישנם מחסומים פוטנציאליים רבים כדי לבודד חיידק ולגדל אותו בתרבות טהורה. דרישות צמיחה ספציפיות פוטנציאליות כוללות pH, מתח חמצן, ויטמינים, גורמי גדילה, מולקולות איתות או אפילו מגע תא ישיר כדי לעורר צמיחה1. עם זאת, הוא האמין כי auxotrophies ספציפיים הם ההרתעה העיקרית culturing מינים חדשים של חיידקים. ניסוחים סטנדרטיים במדיה חסרים חומרים מזינים רבים הנדרשים על ידי חיידקים לא תרבותיים, כגון ויטמינים ספציפיים או מקורות פחמן. מולקולות חסרות אלה יכולות להיות המפתח לפיזיולוגיה של החיידקים הלא תרבותיים והן מסופקות בדרך כלל על ידי אורגניזם אחר בקהילה המיקרוביאלית או אורגניזם מארח. לדוגמה, פחמימות מורכבות כגון mucins יכול להיות מסופק על ידי מארחי בעלי חיים. הוספת אלה לתקשורת אפשרה טיפוח של כמה חיידקים ממעיים של בעלי חיים, כולל אקרמנסיה מוקיניפילה ו Mucinivorans hirudinis2,3,4. חיידקים פתוגניים רבים פיתחו את היכולת להשתמש בברזל הקשור להמין בתאי בעלי חיים, כולל הפתוגן הפה פורפירומונס gingivalis5. במעבדה, הצמיחה של פורפירומונס ואורגניזמים אחרים, יכול להיות מגורה על ידי תוספת של hemin6.
לאחרונה, פריצות דרך רבות בפולחן מבודדים חדשניים של חיידקים הגיעו באמצעות פולחן משותף, באמצעות אורגניזם "מאכיל" כדי לספק גורמים ספציפיים לחיידקים לא תרבותיים הדרושים לצמיחתם. מחקר אלגנטי של Vartoukian ועמיתיו הראה כי siderophores, מולקולות מחייב ברזל המיוצר על ידי חיידקים, עורר את הצמיחה של כמה מבודדים אוראלי הרומן. Pyoverdines, סוג של siderophore המיוצר על ידי מינים pseudomonad, הוצגו כדי להקל באופן משמעותי על הצמיחה של מין Prevotella הרומן 7. באותו מחקר, האי מבודד אוראלי הראשון עבור פילום Chloroflexi היה מעובד, גם באמצעות F. גרעין כעוזר לספק כמה תרכובת עדיין לא ידוע7. לאחרונה, חיידק מן הסוג Ruminococcaceae היה מבודד באמצעות fragilis חיידק כמו אורגניזם עוזר8. מאוחר יותר הוכח כי גאמא אמינו בוטירית (גאבא), נוירוטרנסמיטר מעכבות, נדרש לצמיחה על מדיה במעבדה. שימוש באורגניזמים מאכילים הוכיח את עצמו כאסטרטגיה מרכזית לחיקוי מיקרו-וירוסים ספציפיים שבהם גדלים חיידקים לא תרבותיים, בהיותם יעילים יותר מאשר שיקום מתמיד של מדיית צמיחה עם תוספים שונים בריכוזים משתנים.
אחת הקבוצות הגדולות ביותר של חיידקים לא תרבותיים נמצאים "מועמד Phyla קרינה" (החייאה), קבוצה מונופילטית של מספר מועמדים phyla חיידקי9,10. נכון לכתיבת שורות אלה, רק חברי פירלום סקרייבקטריה במסגרת ההחייאה עברו בהצלחה במעבדה. האי מבודד הראשון, 'Nanosynbacter lyticus' זן TM7x, היה מבודד באמצעות סטרפטומיצין אנטיביוטי, אשר היה צפוי להעשיר עבור TM711,12. תגלית מרכזית של עבודה זו הייתה כי המבודד החדש גדל כמו טפיל גדל במגע ישיר עם מארח חיידקי, Schaalia odontolytica, ומיקרוסקופיה הראה טפילים אלה היו חיידקים אולטרה-סמל.
באמצעות רמזים אלה, פיתחנו שיטה להקים במהירות cocultures בינארי של Saccharibacteria עם השותפים שלהם על ידי סינון פלאק שיניים ודגימות אוראליות אחרות באמצעות מסנן 0.2 מיקרומטר, איסוף תאים בסינון על ידי צנטריפוגה ושימוש בהם כדי להדביק תרבויות של חיידקים מארחים מועמדים. שיטה זו יש את היתרון של הימנעות תרבויות העשרה, אשר יכול להיות מוצף אורגניזמים הגדלים במהירות. זה גם נמנע משימוש באנטיביוטיקה, אשר יכול לעצור את הצמיחה של מין Saccharibacteria ממוקד או המארחים שלהם. בשיטה שהוכח כאן, יש לנו בהצלחה תרבית 32 מבודדים מן פילום Saccharibacteria.
Protocol
בעת פיתוח פרוטוקול זה, אישור IRB היה מבוקש ואושר (#14-10) והסכמה מדעת הושגה מכל הנושאים.
1. הכנה
- בעת עבודה עם נבדקים אנושיים, לקבל אישור IRB הדרוש והסכמה מדעת.
- התחל תרבויות של חיידקים מארחים עם מספיק זמן לגדול לשלב נייח מוקדם. לדוגמה, לחסן 2-5 מ"ל של מרק סויה טריפטית עם 0.1% תמצית שמרים הוסיף (TSBY) עם Propionica Arachnia ודגרת ב 37 °C (69 °F) עבור 24 שעות.
- הרכב מחזיקי מסנן עם קרום מסנן 0.2 מיקרומטר חרוט. לעטוף את ההרכבה בנייר כסף ולעקר על ידי autoclaving.
- לעקר צינורות צנטריפוגה ומכלולי כובעים.
2. השג דגימה של חיידקי הפה
הערה: בעוד דגימות אוראליות רבות מכילות Saccharibacteria (למשל, רוק, ספוגיות של שקדים, שריטות לשון) רובד שיניים באופן שגרתי הוא המוצלח ביותר.
- קח גירוד פלאק באמצעות נקודת נייר סטרילית, קורט גרייסי, או, אם דגימה עצמית, להשתמש קיסם סטרילי או קצה פיפטה. לוחית העברה למאגר מתאים, כגון דילול שחזור מקסימלי (MRD, 0.85% NaCl, 0.1% פפטון) או PBS. אם לא מעובד באופן מיידי, לשמור את המדגם על הקרח עד מוכן להמשיך.
- במרץ resuspend את רובד השיניים במאגר MRD באמצעות שילוב של מערבולת צינור עם קצה צינור קטן.
- הוסף דגימת פלאק לשימוש חוזר למאגר MRD נוסף של 9 מ"ל.
3. הכן סינון מדגם אוראלי
- בטכניקה אספטית, בטלו את התוסף של מכלול מסנן סטרילי. בטל את ההפעלה של רבע סיבוב והפעל מחדש את מחזיק המסנן כדי לוודא שהאשכולות מופעלים כראוי והמנגנון סגור כראוי. באמצעות מזרק, לשטוף את הממברנה על ידי העברת 10 מ"ל של חיץ MRD דרך המנגנון. הרכבה לא נכונה מתגלה בשלב זה על ידי נוזל דולף מתוך מחזיק המסנן. במקרה של דליפה, השג הרכבה סטרילית נוספת של המסנן וחזור על שלב הכביסה.
- החל את המדגם על המסנן שנשטף. הסר את הוכנה ממזרק וחבר אותה למנגנון הסינון. יוצקים את דגימת השיניים המפוזרת, עכשיו ב 10 מ"ל של מאגר MRD, לתוך מזרק לטעון אותו על המסנן.
- מניחים צינור צנטריפוגה סטרילי מתחת למנגנון המסנן כדי לתפוס את הסינון, ולאחר מכן להחיל לחץ אור על הבוכנה כדי לדחוף את המדגם דרך המסנן.
- חזור על ההליך עם עוד 10 מ"ל של מאגר MRD לשטוף את הממברנה, איסוף הזרימה דרך באותו צינור כמו מדגם מסונן. מכסה את הצינור בצורה לא מתאימה.
4. לרכז את תאי Saccharibacteria על ידי צנטריפוגה
- לעשות סימן התמצאות על הצינור ואת הכובע ומניחים את הצינור בצנטריפוגה במהירות גבוהה עם הסימן בצד העליון. גלולה שנוצר צנטריפוגה הוא בדרך כלל בלתי נראה. הסימון יעזור לקבוע היכן הכדור של תאי Saccharibacteria ממוקם כאשר צנטריפוגה נעשית הצינור הוסר מן הצנטריפוגה.
- צנטריפוגה הדגימות ב 60,000 x g עבור 1 שעה ב 4 מעלות צלזיוס.
הערה: כוח זה וזמן מספיק כדי גלולות כל התאים Saccharibacteria. עם זאת, תאים Saccharibacteria יכול להיות לפחות חלקית pelleted על ידי צנטריפוגה עבור קטן כמו 20 דקות ב 20,000 xg . - הסר בזהירות את הצינורות מצנטריפוגה. יוצקים את הנוזל מהצינור, שמירה על גלולה בצד העליון של הצינור.
- Resuspend גלולה בלתי נראית בדרך כלל ב 1-2 מ"ל של מאגר MRD על ידי מערבולת נמרצת.
5. להדביק תרבויות מארחות עם סינון מועשר בסכריבקטריה
- הכן צינורות תרבות על ידי aliquoting 2 מ"ל של מדיה צמיחה מתאימה (למשל, TSBY, BHI, וכו ') לתוך צינורות.
- הוסף 200 μL של תרבות לילה של אורגניזמים מארחים לכל צינור. הוסף 100-200 μL של resuspended, מדגם מסונן לכל צינור.
- דגירה משולבת דגימות בהתאם המתאים האורגניזם המארח (למשל, 37 °C (69 °F), באווירה אירובית עבור A. propionica).
- מעבר התאים כל יומיים עד שלושה ימים על ידי העברת 200 μL של תרבות בינארית ל 2 מ"ל של מדיום צמיחה טרי בצינור חדש. אם נראה כי תרבויות המעבר אינן מראות צמיחה (כלומר, הצפיפות השעורה /האופטית של התרבות אינה גדלה לאחר המעבר למדיה טרייה) הסכריבקטריה יכולה להיות מהממת או להרוג את כל האורגניזם המארח. כדי לתקן זאת, להוסיף 200 μL של תרבות מארחת לא מושפעת בעת העברת התאים. חזור על הפעולה לפחות 5 קטעים.
6. אשר זיהום על ידי PCR
- לאחר 5 קטעים, לאשר זיהום עם PCR. חמישה קטעים יבטיחו יותר מכל תאי Saccharibacteria שאינם גדלים התרוקנו מעבר לגבול הגילוי באמצעות 25 מחזורים של PCR.
- הכן מאסטרמיקס PCR. מתכון מוצע באמצעות הוא כדלקמן, עבור כל צינור צורך, להכין 12.5 μL 2x PCR מאגר, 0.75 μL 10 מיקרומטר קדימה פריימר (580F12 - AYT GGG CGT AAA GAG TTG C), 0.75 μL 10 פריימר הפוך מיקרומטר (1177R13- GAC CTG ACA TCA TCC CCT TCC), 1 μL 25 מ"מ MgCl2 ו 9 מ"ל מים. מערבבים על ידי מערבולת.
- Aliquot 24 μL של מאסטרמיקס לתוך צינור PCR 0.2 מ"ל. הוסף 1 μL של תרבות נגועה Saccharibacteria לתגובת PCR. מניחים את הצינור בתרמוציקלר ומבצעים את הפרוטוקול הבא: denaturation הראשונית 95 מעלות צלזיוס במשך 5 דקות, 25 מחזורים של 95 מעלות צלזיוס במשך 30 s, 60 °C (60 °F) עבור 30 °C (72 °F) עבור 30 s, התארכות סופית ב 72 °C (72 °F) למשך 2 דקות, ולאחר מכן אחיזה סופית ב 4 °C (60 °F).
- לטעון ולהפעיל את מוצרי PCR ב 1% ג'ל agarose. להקה של ~ 600 בסיסים יצביעו על נוכחותו של Saccharibacteria.
7. בדוק טוהר ולהסיר אורגניזמים מזהמים
- אשר טוהר של תרבויות חיוביות על ידי ציפוי coculture של Saccharibacteria על אגר מים מזינים מספיק לצמיחה של האורגניזם המארח. בצע דילול סדרתי פי 10 של התרבות במאגר סטרילי (למשל, MRD או PBS) והתפשט 100 μL על צלחת אגר. בצע דילול כך שיהיו כ 20-200 מושבות גדל על צלחת אגר.
- דגירה התרבות בתנאי צמיחה מתאימים להתבונן אורגניזמים מזהמים.
הערה: מושבות Saccharibacteria Axenic מעולם לא נצפו, כך שרק האורגניזם המארח נצפה גדל על הצלחות האלה. יותר מסוג מושבה אחד בדרך כלל מצביע על זיהום. אם זיהום מתרחש, התרבות צריכה להיות מסוננת מחדש כדי להסיר את המזהמים לא רצויים מחוסנים מחדש על מארח טרי. - מדי פעם מתרחש זיהום כפול, שבו שני מינים Saccharibacteria להדביק את אותו מארח. כדי להפריד את המינים Saccharibacteria, resuspend מושבות בודדות ב 20 μL סטרילי PBS ולהשתמש 1 μL של השעיה בתגובת PCR כדי לזהות מושבות עם זיהומים Saccharibacteria.
- העבר את ההשעיות שנתנו תוצאה חיובית למדיום צמיחה כדי להתחיל תרבות בינארית. שיעור ההצלחה יהיה תלוי בטיטר של כל מין Saccharibacteria בתרבות. ייתכן שיהיה צורך לסנן יותר מ -50 מושבות כדי למצוא אחד נגוע להפצה.
8. אחסון תרבויות
- הגדל תרבות בינארית של נפח מספיק (10-50 מ"ל) בן לילה.
- כדורי תאים על ידי צנטריפוגה (4,000 x g במשך 10 דקות).
הערה: צנטריפוגה במהירות גבוהה אינה נחוצה כאן כמו תאי Saccharibacteria יהיה מחובר לתאים גדולים יותר, כבדים יותר של המארח יהיה גלולה איתם. - יש לוותר מחדש על תאים בהקפאה. מדיה צמיחה בתוספת או 5% DMSO או 20% גליצרול הוא בדרך כלל מספיק. ודא כי האורגניזם המארח תואם עם מדיה cryoprotectant (למשל, צמיחה של A. propionica מעוכבת על ידי גליצרול מניות קפואות לא יכול להחיות). בדוק את הכדאיות של תרבות מארחת לא מושפעת עם cryoprotectant כדי להבטיח מניות יכול לשרוד הקפאה.
- גלולת תא resuspend באותו נפח של תרבות (10-50 מ"ל). Aliquot 0.5 מ"ל לתוך cryovials שכותרתו. להקפיא תרביות תאים ב -80 מעלות צלזיוס.
תוצאות
PCR לגילוי Saccharibacteria עשוי להיראות שלילי (כלומר, לא נראה מוצר) בתרבויות זיהום ראשוניות עקב מספר נמוך של סימביונים Saccharibacteria. עם זאת, לאחר מספר קטעים אמור להופיע מוצר PCR חזק המראה כי התרחש זיהום יציב (איור 1A). לעומת זאת, זיהומים מסוימים יופיעו בתחילה חיוביים על ידי PCR, אך פוחתים לבלתי ניתנים לגילוי לאחר 1-4 קטעים (לא מוצג). הדבר מצביע על כך שכמות גדולה של תאי Saccharibacteria היו נוכחים בסינון הראשוני אך מדוללים על ידי מעבר ואף אחד מהם לא הצליח להיכנס לסימביוזה יציבה עם התרבות המארחת. בדיקת מספר מינים מארחים עם אותו סינון Saccharibacteria מחלל הפה בדרך כלל יהיה שיעור הצלחה נמוך (איור 1B) כמו האינטראקציה symbiont-המארח הוא מאוד ספציפי. חוקר יכול גם לבדוק את אותו מארח עם פילטרטים ממספר נושאים שונים. אם נעשה שימוש באורגניזם מארח טוב (כגון Arachnia propionica או Schaalia odontolytica), ניתן לצפות לשיעור הצלחה של 50%.
בדיקה על ידי PCR היא קריטית. חוקרים מנוסים ניסו לאשר זיהום על ידי מיקרוסקופיה, רק כדי לדווח על תוצאות חיוביות שגויות. תאי Saccharibacteria הם קטנים וקשה להבחין בין סיקיקים או בליטות מעטפת תא לא סדיר. אות PCR יציב דרך מספר מעברים הוא המפתח לאישור זיהום מוצלח.
ככל שהתרבויות הנגועות גדלות, צמיחה עכור נורמלי צריך להופיע. ככל שהסימביוזה מבססת את עצמה, תרבויות נגועות ייראו פחות עכורות מתרבויות של אורגניזמים מארחים לא נגועים(איור 2A). במקרים מסוימים, תרבויות נגועות עשויות להיראות להפסיק לגדול לחלוטין ולא להיות עכור בכלל. זה יכול להיות בגלל זיהום שבו תאי Saccharibacteria מציפים את האורגניזם המארח. הוספת מארח "טרי" (לא מושפע) לתרבויות אלה אמורה לספק אוכלוסייה מספקת של מארחים כדי לתמוך בהמשך הצמיחה של טפילי סקרייבקטריה.
עודף, או תרבויות עכורות יתר על המידה, עשוי להצביע על זיהום על ידי מזהם מעבדה או חיידק אוראלי קטן אחר שהצליח לעבור דרך מסנן 0.2 מיקרומטר. קמפילובקטר וקפנוציטופאגה spp. הם מזהמים אוראלי טיפוסי של ניסויים אלה. זה יכול להיות מאושר על ידי ציפוי התרבות ומחפש מושבות כי הם לא טיפוסי של האורגניזם המארח ואחריו רצף 16S rRNA. אם זיהום נראה, סינון תרבויות אלה באמצעות מסנן 0.2 מיקרומטר הוא בדרך כלל מספיק כדי להסיר את המזהמים. תאי Saccharibacteria בסינון יכולים להיות מרוכזים על ידי צנטריפוגה ומשמשים להדביק מחדש תרבות מארחת טהורה.
דרך נוספת לטהר תרבות מזוהמת היא על ידי קטיף מושבות נגועות מציפוי תרבות נגועה. מושבות של מחשבים מארחים נגועים יכולות לפעמים להיות מזוהות על ידי צורת מושבה לא סדירה בהשוואה למושבות לא נגועות(איור 2B-D). מושבות לא סדירות אלה תלויות בטיטר של סכריבקטריה בתרבות הבינארית ושיעור קטן יותר של מושבות ייראה לא סדיר אם הטיטר נמוך. זה יכול להקל על זיהוי מושבות נגועות, אשר ניתן לבחור ולהשתמש בהם כדי להתחיל תרבות בינארית טהורה. אם לא נראות מושבות לא סדירות על ציפוי מתרבות נגועה ב-Saccharibacteria, ייתכן שהסימביונט נמצא על טיטר נמוך או אינו גורם למושבות בעלות צורה לא סדירה. במקרה כזה, PCR הקרנת מושבות עם מראה נורמלי יכול להראות זיהום על ידי Saccharibacteria, אבל בשיעור נמוך (2-10% מכל המושבות).
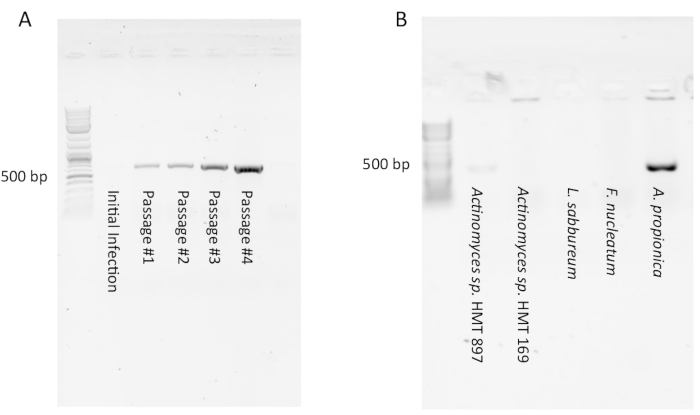
איור 1: תוצאות PCR אופייניות של זיהומים Saccharibacteria של תרבויות מארחות. (A) מוצר PCR המציין נוכחות של Saccharibacteria לא יכול להופיע עם הזיהום הראשוני אבל יכול להופיע ולהתחזק בקטעים הבאים כמו coculture מבסס את עצמו. (B)רוב המארחים הנגועים בסינון מועשר בסכריבקטריה לא יתמכו בצמיחתם בשל הספציפיות של סימביוזה. בדוגמה זו, רק A. propionica נדבק בהצלחה. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
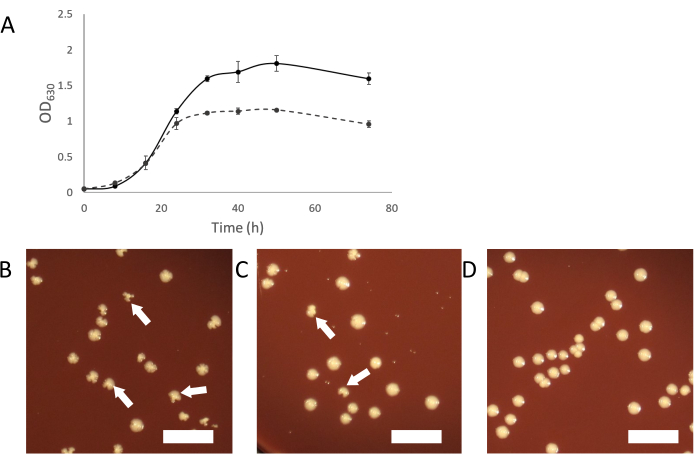
איור 2: מאפייני הצמיחה של תרבויות נגועות Saccharibacteria. (A) עקומות צמיחה של תרבויות נגועות ולא נגועות של A. propionica מראה תרבות נגועה לא יגדל לאותה צפיפות כמו שליטה נגועה ונראה פחות עכור. (B-D) ציפוי של cocultures יכול לייצר מושבות לא סדירות, הנגרמת על ידי זיהומים Saccharibateria. מושבות לא סדירות יפחתו בפרופורציה יחסית לכתר של סכריבקטריה בקוקולטורה. (B)מארח עם רמה גבוהה של סכריבקטריה. (C)10-פי 10 מדולל Saccharibacteria(ד)תרבות מארחת לא מושפעת. חצים לבנים מצביעים על דוגמאות למושבות לא סדירות. סרגל קנה מידה = 1 ס"מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
Discussion
השיטה שלנו של סינון פלאק וליישם אותו על תרבויות טהורות של אורגניזמים מארחים מבוססת במידה רבה על תצפיות קודמות על Saccharibacteria התרבותי הראשון, 'Nanosynbacter lyticus' זן TM7x11,14,15. בהתחשב בגודל התא הקטן, הסקנו כי הם יכולים להיות מופרדים פלאק שיניים באמצעות מסנן מרוכז עם צנטריפוגה. שנית, כאשר אורגניזמים אלה חיים כטפילים, מתן תאים אלה תרבויות טהורות של צבאות יאפשר להם להיכנס לסימביוזה ולגדול כתרבויות בינאריות.
אחד היתרונות של שיטה זו הוא שהיא אינה דורשת תרבות העשרה או לחץ סלקטיבי. 'Nanosynbacter lyticus' זן TM7x היה מתורבת מתרבות העשרה באמצעות סטרפטומיצין כסוכן סלקטיבי, אשר רצף הציע יהיה יעיל בהעשרה עבור Saccharibacteria. למרבה המזל, המארח של 'Nanosynbacter lyticus' Schaalia odontolytica, ידוע כעמיד בפני סטרפטומיצין16. שימוש באנטיביוטיקה כסוכן סלקטיבי יכול גם למנוע את האורגניזם המארח מלגדול, אשר בתורו ימנע את הצמיחה של Saccharibacteria.
סוגיה גדולה יותר של שימוש בתרבויות העשרה היא שאורגניזמים הגדלים במהירות יעקרו במהירות אורגניזמים בעלי עניין. בחלל הפה, למשל, מיני סטרפטוקוקוס יכולים לגדול במהירות, ואם סוכר קיים במדיום הצמיחה, לייצר מספיק חומצה כדי לחומץ את המדיום, עוד בחירה נגד אורגניזמים של עניין. על ידי הימנעות מתרבות העשרה ואנטיביוטיקה סלקטיבית, השיטה שלנו מספקת גישה כללית שניתן ליישם על מגוון רחב יותר של Saccharibacteria ומארחים פוטנציאליים ללא סיבוכים של שיטות אחרות אלה.
יש כמה מכשולים לשיטה המוצגת כאן. ראשית, שיטה זו מניחה כי Saccharibacteria לחיות בתרבות בינארית. לא בדקנו שילובים של תרבויות טרינריות או טרנריות כדי לאמוד את יעילותן, אך סביר להניח שישנם סכריבקטריה הדורשים גורמי גדילה שאורגניזם מארח יחיד אינו יכול לספק. בדיקת השילובים העצומים של חיידקים אוראליים שיכולים לתמוך בצמיחה של Saccharibacteria תהיה משימה מרתיעה. שנית, השיטה מניחה שכל Saccharibacteria הם קטנים מספיק כדי לעבור דרך מסנן 0.2 מיקרומטר. זה יכול להיות כי Saccharibacteria אחרים גדולים יותר מאשר האמין המסנן הוא בוחר נגד אורגניזמים אלה. מסנן עם גודל נקבובי גדול יותר יכול לשמש, אבל זה מסתכן לאפשר חיידקים אוראליים לא רצויים יותר לתוך תרבות משותפת נגוע. לבסוף, קשה מאוד למצוא מינים מארחים מחוץ לאלה שכבר פורסמו. עד כה, המארחים המוצלחים היחידים הם מינים מן הסוגים Actinomyces, Schaalia, Arachnia ו Cellulosimicrobium, כל חברי phylum Actinobacteria15,17,18. עם זאת, מארחים אלה תומכים רק בצמיחה של Saccharibacteria ספציפי. כדי להתרבות יותר מינים של Saccharibacteria, מארחים רבים יותר יש לחקור.
אנו מקווים שהשיטה המוצגת כאן תסייע למחקר עתידי של הסכריבקטריה ואורגניזמים אחרים של החייאה. רצף מטגנומי מרמז כי אורגניזמים אלה יש גם גנומים קטנים חשודים להיות סימביונים או להסתמך על הקהילה המיקרוביאלית המקומית כדי לספק מטבוליטים וגורמים אחרים קריטיים להישרדותם19. אסטרטגיית סינון דומה יכולה לשמש לבידוד אורגניזמים אלה, בתנאי שהם קטנים מספיק וכי האורגניזמים המארחים שלהם יכולים להיות תרבותיים. השיטות המתוארות כאן הן צעד ראשון להבאת הכלים החזקים של תרבות המעבדה לקבוצה גדולה ומגוונת זו של חיידקים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
המחברים מבקשים להודות אן טאנר, ברוס פסטר, הייקה Boisvert, Xuesong הוא ו Batbileg בור עבור דיונים מועילים על מתן זנים חיידקיים. אנו מודים לסוזן יוסט וג'סיקה וודס על הסיוע הטכני המיקרוביאלי. מחקר שדווח בפרסום זה נתמך על ידי המכון הלאומי למחקר שיניים Craniofacial של המכונים הלאומיים לבריאות תחת מספרי הפרס R37 DE016937 (FED), R01 DE024468 (FED) ו T32 DE007327 (AJC). התוכן הוא באחריות המחברים בלבד ואינו מייצג בהכרח את השקפותיהם הרשמיות של המכונים הלאומיים לבריאות.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Fisher Scientific | BP160-100 | |
| Alphaimager | Cell Biosciences | FluorChem HD2 | Or equivalent UV gel imaging system |
| Aluminum foil | Fisher Scientific | 01-213-101 | |
| Brain Heart Infusion Broth (dehydrated powder) | Becton-Dickinson | 211059 | Or other growth media suitable for target organisms |
| Centrifuge Rotor 70-Ti | Beckman Coulter | 337922 | |
| Cryovials | Fisher Scientific | 12-567-500 | |
| DMSO | Fisher Scientific | BP231-100 | |
| Electrophoresis Power Supply | Bio-Rad | 1645052 | |
| Electrophoresis Rig | Bio-Rad | 1704467 | |
| Filter Forceps | Millipore Sigma | XX6200006P | Not essential, helps ensure filters are not punctured during handling |
| Glycerol | Fisher Scientific | G33-500 | |
| GoTaq Green Mastermix | Promega | M7122 | |
| Mastercycler Pro Thermocycler | Eppendorf | 950040025 | Or equivalent thermocycler for PCR |
| MgCl2 solution 25mM | Promega | A3513 | |
| Molecular Biology grade water | Fisher Scientific | BP2819100 | |
| O2 Control InVitro Glove Box | Coy Laoratories | 031615 | If needed for microaerobic organisms |
| Optima L-100 XP High Speed Centrifuge | Beckman Coulter | 8043-30-1124 | |
| P-10 micro pipette | Gilson | F144802 | |
| P-1000 micro pipette | Gilson | F123601G | |
| P-2 micro pipette | Gilson | F144801 | |
| P-20 micro pipette | Gilson | F123600 | |
| P-200 micro pipette | Gilson | F123602G | |
| PBS | Fisher Scientific | BP399500 | |
| PCR tubes 0.2 mL | Fisher Scientific | 14-230-205 | |
| Peptone | Fisher Scientific | BP1420-500 | |
| Pipette tips - 10 μL | Fisher Scientific | 02-717-157 | |
| Pipette tips - 1000 μL | Fisher Scientific | 02-717-166 | |
| Pipette tips - 20 μL | Fisher Scientific | 02-717-161 | |
| Pipette tips - 200 μL | Fisher Scientific | 02-717-165 | |
| Polycarbonate filters - 47mm, 0.2 μm pore size | Millipore | GTTP04700 | |
| Screw-cap conical centrifuge tubes 15 mL | Falcon | 352096 | Or other tube suitable for bacterial culture |
| Sodium chloride | Fisher Scientific | BP358-1 | |
| Swin-Lok Filter - 47mm | Whatman | 4200400 | |
| SYBR Safe DNA Gel stain | ThermoFisher Scientific | S33102 | |
| Syringes - 20 mL | Fisher Scientific | 14-955-460 | |
| TAE Buffer (50x) concentrate | Fisher Scientific | P1332500 | |
| Thickwall Polycarbonate 25 x 89 mm (26.3mL capacity) centrifuge tubes with caps | Beckman Coulter | 355618 | |
| Tryptic Soy Blood Agar Plates | Northeast Laboratory Services | P1100 | Or other agar plate sufficient for growth of host organisms |
| Tryptic Soy Broth (dehydrated powder) | Becton-Dickinson | 211825 | Or other growth media suitable for target organisms |
| Vinyl Anaerobic Chamber | Coy Laboratories | 032714 | If needed for anaerobic organisms |
| Vortex mixer | Scientific Industries | SI-0236 | |
| Yeast Extract | Fisher Scientific | BP1422-500 |
References
- Stewart, E. J. Growing unculturable bacteria. Journal of Bacteriology. 194 (16), 4151-4160 (2012).
- Bomar, L., Maltz, M., Colston, S., Graf, J. Directed culturing of microorganisms using metatranscriptomics. mBio. 2 (2), 00012 (2011).
- Derrien, M., Vaughan, E. E., Plugge, C. M., de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. International Journal of Systematic and Evolutionary Microbiology. 54, 1469-1476 (2004).
- Nelson, M. C., Bomar, L., Maltz, M., Graf, J. Mucinivorans hirudinis gen. nov., sp. nov., an anaerobic, mucin-degrading bacterium isolated from the digestive tract of the medicinal leech Hirudo verbana. International Journal of Systematic and Evolutionary Microbiology. 65, 990-995 (2015).
- Scott, J. C., Klein, B. A., Duran-Pinedo, A., Hu, L., Duncan, M. J. A two-component system regulates hemin acquisition in porphyromonas gingivalis. PLoS One. 8 (9), 0073351 (2013).
- Martin, B., et al. New growth media for oral bacteria. Journal of Microbiological Methods. 153 (22), 10-13 (2018).
- Vartoukian, S. R., et al. In vitro cultivation of 'unculturable' oral bacteria, facilitated by community culture and media supplementation with siderophores. Plos One. 11 (1), 0146926 (2016).
- Strandwitz, P., et al. GABA-modulating bacteria of the human gut microbiota. Nature Microbiology. 4 (3), 396-403 (2019).
- Hug, L. A., et al. A new view of the tree of life. Nature Microbiology. 1, 16048 (2016).
- Castelle, C. J., Banfield, J. F. Major new microbial groups expand diversity and alter our understanding of the tree of life. Cell. 172 (6), 1181-1197 (2018).
- He, X., et al. Cultivation of a human-associated TM7 phylotype reveals a reduced genome and epibiotic parasitic lifestyle. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 244-249 (2015).
- Hugenholtz, P., Tyson, G., Webb, R. I., Wagner, A. M., Blackall, L. L. Investigation of candidate division TM7, a recently recognized major lineage of the domain Bacteria with no known pure-culture representatives. Applied and Environmental Microbiology. 67 (1), 411-419 (2001).
- Brinig, M., Lepp, P. Prevalence of bacteria of division TM7 in human subgingival plaque and their association with disease. Applied and Environmental Microbiology. 69 (3), 1687-1694 (2003).
- Bor, B., et al. Insights obtained by culturing saccharibacteria with their bacterial hosts. Journal of Dental Research. , 689-694 (2020).
- Bor, B., et al. Phenotypic and physiological characterization of the epibiotic interaction between TM7x and its basibiont actinomyces. Microbial Ecology. 71 (1), 243-255 (2016).
- Skopek, R. J., Liljemark, W. F., Bloomquist, C. G., Rudney, J. D. Dental plaque development on defined streptococcal surfaces. Oral Microbiology and Immunology. 8 (1), 16-23 (1993).
- Murugkar, P. P., Collins, A. J., Chen, T., Dewhirst, F. E. Isolation and cultivation of candidate phyla radiation Saccharibacteria (TM7) bacteria in coculture with bacterial hosts. Journal of Oral Microbiology. 12 (1), 1814666 (2020).
- Cross, K. L., et al. Targeted isolation and cultivation of uncultivated bacteria by reverse genomics. Nature Biotechnology. 37 (11), 1314-1321 (2019).
- Kantor, R., et al. Small genomes and sparse metabolisms of sediment-associated bacteria from four candidate phyla. MBio. 4 (5), 00708-00713 (2013).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved