Method Article
Создание стабильных бинарных культур симбиотических сахариобактерий из полости рта
* Эти авторы внесли равный вклад
В этой статье
Резюме
Мы демонстрируем метод выделения трудновоспроизводимых членов нового бактериального типа, Saccharibacteria, путем фильтрации зубного налета и совместного культивирования с бактериями-хозяевами.
Аннотация
Многие виды бактерий не могут быть культивированы в лаборатории с использованием стандартных методов, что создает значительный барьер для изучения большинства микробного разнообразия на Земле. Требуются новые подходы к культивированию этих некукультурных бактерий, чтобы исследователи могли эффективно изучать их физиологию и образ жизни, используя мощные инструменты, доступные в лаборатории. Излучение кандидата Phyla (CPR) является одной из крупнейших групп некультивированных бактерий, составляющих ~ 15% живого разнообразия на Земле. Первым изолятом этой группы был член типа Saccharibacteria, штамм'Nanosynbacter lyticus'TM7x. TM7x представляет собой необычно маленькую бактерию, которая живет как симбионт в прямом контакте с бактериальным хозяином, Schaalia odontolytica, штаммом XH001. Воспользовавшись необычно малым размером клетки и ее образом жизни в качестве симбиотического организма, мы разработали протокол для быстрого культивировать сахариобактерии из зубного налета. Этот протокол покажет, как фильтровать суспензию зубного налета через фильтр 0,2 мкм, затем концентрировать собранные клетки сахарибактерий и заражать культуру организмов-хозяев. Полученная кокультура может быть прошедшей, так как любая нормальная бактериальная культура и инфекция подтверждается ПЦР. Полученная бинарная культура может быть сохранена в лаборатории и использована для будущих экспериментов. Хотя загрязнение возможно, бинарная культура может быть очищена либо путем дальнейшей фильтрации и повторного заражения хозяина, либо путем покрытия бинарной культуры и скрининга на инфицированные колонии. Мы надеемся, что этот протокол может быть распространен на другие типы образцов и среды, что приведет к выращиванию гораздо большего количества видов в СЛР.
Введение
Культивирование новых видов бактерий и их попадание в лабораторию позволяет проводить мощные эксперименты, чтобы лучше понять их физиологию и более широкие взаимодействия в их микробном сообществе. Хотя существуют свободные от культуры методы опроса этих вопросов (например, «метаомика»), сложные взаимодействия различных микробных популяций затрудняют различение отдельных переменных и достижение значимых выводов. В то время как культивирование бактерий имеет много преимуществ, существует много потенциальных барьеров для выделения бактерии и выращивания ее в чистой культуре. Потенциальные специфические требования к росту включают рН, напряжение кислорода, витамины, факторы роста, сигнальные молекулы или даже прямой клеточный контакт для получения роста1. Тем не менее, считается, что специфические ауксотрофии являются основным сдерживающим фактором для культивирования новых видов бактерий. В стандартных составах сред отсутствуют многие питательные вещества, необходимые некультивированным бактериям, такие как специфические витамины или источники углерода. Эти недостающие молекулы могут быть ключом к физиологии некультурных бактерий и обычно обеспечиваются либо другим организмом в микробном сообществе, либо организмом-хозяином. Например, сложные углеводы, такие как муцины, могут быть предоставлены животными-хозяевами. Добавление их в жижи позволило культивировать несколько бактерий из кишечника животных, включая Akkermansia muciniphila и Mucinivorans hirudinis2,3,4. Многие патогенные бактерии развили способность использовать железо, связанное с гемином в клетках животных, включая пероральный патоген Porphyromonas gingivalis5. В лабораторных условиях рост порфиромон и других организмов, может быть стимулирован добавлением гемина6.
В последнее время многие прорывы в культивировании новых изолятов бактерий пришли через совместное культивирование, используя «питательный» организм для обеспечения специфических факторов для некуляционных бактерий, необходимых для их роста. Элегантное исследование Вартукяна и его коллег показало, что сидерофоры, молекулы, связывающие железо, продуцируемые бактериями, стимулируют рост нескольких новых пероральных изолятов. Было показано, что пиовердины, тип сидерофора, продуцируемого видамипсевдомонад, значительно облегчают рост нового вида Prevotella 7. В том же исследовании был культивирован первый пероральный изолят для типа Chloroflexi, также использующий F. nucleatum в качестве помощника для предоставления некоторого еще неизвестного соединения7. Совсем недавно бактерия из рода Ruminococcaceae была выделена с использованием Bacteroides fragilis в качестве организма-помощника8. Позже было показано, что гамма-аминомасляная кислота (ГАМК), ингибирующая нейротрансмиттер, необходима для роста на лабораторных средах. Использование питающих организмов оказалось ключевой стратегией для имитации конкретных микросред, где растут некультивируемые бактерии, будучи более эффективной, чем непрерывное переформулирование питательных сред с различными добавками в различных концентрациях.
Одна из самых больших групп некульвулированных бактерий находится в «Candidate Phyla Radiation» (CPR), монофилетической группе из нескольких потенциальных бактериальных типов9,10. На момент написания этой статьи только члены типа Saccharibacteria в слизи были успешно культивированы в лаборатории. Первый изолят, штамм'Nanosynbacter lyticus' TM7x, был выделен с использованием антибиотика стрептомицина, который, как было предсказано, обогатит некультурный TM711,12. Ключевым открытием этой работы было то, что новый изолят вырос как паразит, растущий в прямом контакте с бактериальным хозяином, Schaalia odontolytica,и микроскопия показала, что эти паразиты были ультрамалыми бактериями.
Используя эти подсказки, мы разработали метод быстрого установления бинарных кокультур сахариобактерий с их партнерами путем фильтрации зубного налета и других образцов полости рта через фильтр 0,2 мкм, сбора клеток в фильтрате путем центрифугирования и использования их для заражения культур бактерий-кандидатов-хозяев. Этот метод имеет то преимущество, что позволяет избежать обогащения культур, которые могут быть перегружены быстрорастущими организмами. Он также избегает использования антибиотиков, которые могут остановить рост либо целевых видов сахариобактерий, либо их хозяев. Используя метод, продемонстрированный здесь, мы успешно культивировали 32 изолята из типа Saccharibacteria.
протокол
При разработке этого протокола было запрошено и одобрено одобрение IRB (#14-10) и получено информированное согласие от всех субъектов.
1. Подготовка
- При работе с людьми получите необходимое одобрение IRB и информированное согласие.
- Запускайте культуры бактерий-хозяев с достаточным временем для роста до ранней стационарной фазы. Например, привить 2-5 мл триптического соевого бульона с добавлением 0,1% дрожжевого экстракта (TSBY) с Arachnia propionica и инкубировать при 37 °C в течение 24 ч.
- Сборка фильтродержателей с вытравленной гусеничной мембраной фильтра 0,2 мкм. Оберните сборку в фольгу и стерилизуйте автоклавом.
- Стерилизуйте центрифужные трубки и колпачки в сборе.
2. Получение образца бактерий полости рта
ПРИМЕЧАНИЕ: В то время как многие образцы полости рта содержат сахариактерии (например, слюну, мазки миндадин, соскобы языка), зубной налет обычно является наиболее успешным.
- Возьмите соскоб зубного налета с помощью стерильной бумажной точки, кюретки Грейси, или, если вы самостоятельно берете пробы, используйте стерильную зубочистку или наконечник пипетки. Перенесите бляшки в подходящий буфер, такой как максимальный восстановительный разбавлятель (MRD, 0,85% NaCl, 0,1% пептон) или PBS. Если образец не обработан немедленно, держите образец на льду до тех пор, пока он не будет готов к продолжению.
- Энергично повторно суспендирует зубной налет в буфере MRD, используя комбинацию вихрей и пипетки с небольшим наконечником пипетки.
- Добавьте образец повторно суспендированного бляшки в дополнительные 9 мл буфера MRD.
3. Приготовьте фильтрат из перорального образца
- Используя асептическую технику, развернить стерильный фильтр в сборе. Раскрутите четверть оборота и запрячь фильтродержатель, чтобы убедиться, что резьба правильно задействована и устройство закрыто должным образом. С помощью шприца промыть мембрану, пройдя через аппарат 10 мл буфера MRD. Неправильная сборка выявляется на этом этапе утечкой жидкости из фильтродержателя. При возникновении утечки приобретите другой стерильный фильтр в сборе и повторите этап промывки.
- Нанесите образец на промытый фильтр. Извлеките плунжер из шприца и прикрепите его к фильтрующей аппаратуре. Перелейте дисперсный стоматологический образец, теперь в 10 мл буфера MRD, в шприц и загрузите его на фильтр.
- Поместите стерильную центрифужную трубку под фильтрующим устройством, чтобы уловить фильтрат, затем приложите легкое давление к плунжеру, чтобы протолкнуть образец через фильтр.
- Повторите процедуру с еще 10 мл буфера MRD, чтобы промыть мембрану, собирая проточную часть в той же пробирке, что и отфильтрованный образец. Асептически запачкать трубку.
4. Концентрирование клеток сахариобактерий путем центрифугирования
- Сделайте ориентировочную отметку на трубке и крышке и поместите трубку в высокоскоростную центрифугу с отметкой на верхней стороне. Гранула, образованная в результате центрифугирования, обычно невидима. Маркировка поможет определить, где находится гранула клеток сахариобактерий, когда производится центрифугирование и трубка удаляется из центрифуги.
- Центрифугировать образцы при 60 000 х г в течение 1 ч при 4 °C.
ПРИМЕЧАНИЕ: Этой силы и времени достаточно, чтобы гранулировать все клетки сахариобактерий. Тем не менее, клетки сахарибактерий могут быть, по меньшей мере, частично гранулированы центрифугированием всего за 20 минут при 20 000 х г. - Осторожно извлеките трубки из центрифуги. Вылейте жидкость из трубки, держа гранулу на верхней стороне трубки.
- Повторное суспендирование обычно невидимой гранулы в 1-2 мл буфера MRD путем энергичного вихря.
5. Заражение культур-хозяев фильтратом, обогащенным сахариактериями
- Подготавливайте культуры путем алицитирования 2 мл соответствующих питательных сред (например, TSBY, BHI и т.д.) в пробирки.
- Добавьте 200 мкл ночной культуры организмов-хозяев в каждую трубку. Добавьте 100-200 мкл повторно суспендированного, отфильтрованного образца в каждую пробирку.
- Инкубировать комбинированные образцы, подходящие для организма-хозяина (например, 37 °C, в аэробной атмосфере для A. propionica).
- Пропускают клетки каждые два-три дня путем переноса 200 мкл бинарной культуры на 2 мл свежей питательной среды в новой пробирке. Если окажется, что проходные культуры не показывают роста (т. Е. Мутность / оптическая плотность культуры не увеличивается после перехода в свежие среды), сахариобактерии могут быть подавляющими или убивать весь организм-хозяин. Чтобы исправить это, добавьте 200 мкл неинфицированной культуры хозяина при прохождении клеток. Повторите не менее 5 проходов.
6. Подтвердите инфекцию с помощью ПЦР
- После 5 проходов подтверждают заражение ПЦР. Пять проходов гарантируют, что любые нерастающие клетки сахариактерий будут истощены сверх предела обнаружения с использованием 25 циклов ПЦР.
- Подготовьте мастермикс ПЦР. Предлагаемый рецепт использования заключается в следующем: для каждой необходимой трубки готовят 12,5 мкл 2x буфера ПЦР, 0,75 мкл 10 мкМ Прямой грунтовки (580F12 - AYT GGG CGT AAA GAG TTG C), 0,75 мкл 10 мкМ Обратная грунтовка (1177R13- GAC CTG ACA TCA TCC CCT TCC), 1 мкл 25 мМ MgCl2 и 9 мкл воды. Перемешивать путем вихря.
- Аликвот 24 мкл мастермикса в ПЦР-трубку 0,2 мл. Добавьте 1 мкл культуры, инфицированной сахарибактериями, к реакции ПЦР. Поместите трубку в термоциклер и выполните следующий протокол: начальная денатурация 95 °C в течение 5 мин, 25 циклов 95 °C в течение 30 с, 60 °C в течение 30 с, 72 °C в течение 30 с, окончательное удлинение при 72 °C в течение 2 мин, затем окончательная удлинение при 4 °C.
- Загрузите и запустите продукты ПЦР в 1% агарозном гелевом. Полоса из ~600 оснований будет указывать на наличие сахариобактерий.
7. Проверьте чистоту и удалите загрязняющие организмы
- Подтвердить чистоту положительных культур, покрыв кокультуру сахариобактерий питательным агаром, достаточным для роста организма-хозяина. Выполняют 10-кратное последовательное разведение культуры в стерильный буфер (например, MRD или PBS) и выкладывают 100 мкл на агаровую пластину. Выполняйте разведения таким образом, чтобы на агаре росло примерно 20-200 колоний.
- Инкубируют культуру в соответствующих условиях роста и наблюдают за загрязняющими организмами.
ПРИМЕЧАНИЕ: Колонии аксеновых сахариактерий никогда не наблюдались, поэтому на этих пластинах растет только организм-хозяин. Более одного типа колонии обычно указывает на загрязнение. В случае загрязнения культуру следует повторно отфильтровать для удаления нежелательных загрязнений и повторно привить свежему хозяину. - Иногда происходит двойная инфекция, когда два вида сахариактерий заражают одного и того же хозяина. Чтобы отделить виды сахариобактерий, повторно суспендировать отдельные колонии в 20 мкл стерильной PBS и использовать 1 мкл суспензии в реакции ПЦР для обнаружения колоний с инфекциями сахариобактерий.
- Перенесите суспензии, давшие положительный результат, в питательную среду, чтобы запустить бинарную культуру. Показатель успеха будет зависеть от титра каждого вида сахариактерий в культуре. Может потребоваться скрининг более 50 колоний, чтобы найти зараженную для размножения.
8. Хранение культур
- Вырастите бинарную культуру достаточного объема (10-50 мл) за ночь.
- Пеллетные ячейки центрифугированием (4 000 х г в течение 10 мин).
ПРИМЕЧАНИЕ: Высокоскоростное центрифугирование здесь не требуется, так как клетки сахарибактерий будут прикреплены к более крупным и тяжелым клеткам хозяина и будут гранулироваться вместе с ними. - Повторное суспендация клеток в криопротекторе. Обычно достаточно питательных сред, дополненных либо 5% ДМСО, либо 20% глицерина. Убедитесь, что организм-хозяин совместим с криопротекторными средами (например, рост A. propionica ингибируется глицерином, и замороженные запасы могут не возрождаться). Проверьте жизнеспособность неинфицированной культуры хозяина с помощью криопротектора, чтобы убедиться, что запасы могут пережить замораживание.
- Повторно суспендируют клеточную гранулу в том же объеме культуры (10-50 мл). Аликвот 0,5 мл в меченые криовиалы. Заморозить клеточные культуры при -80 °C.
Результаты
ПЦР для выявления сахариобактерий может казаться отрицательной (т.е. не видеть продукта) в культурах первоначальной инфекции из-за низкого количества симбионтов сахариобактерий. Однако после нескольких проходов должен появиться сильный продукт ПЦР, показывающий, что произошла стабильная инфекция(рисунок 1А). И наоборот, некоторые инфекции первоначально кажутся положительными при ПЦР, но уменьшаются до неопределяемых после 1-4 проходов (не показаны). Это указывает на то, что большое количество клеток сахарибактерий присутствовало в исходном фильтрате, но было разбавлено проходом, и ни одно из них не смогло войти в стабильный симбиоз с культурой хозяина. Тестирование нескольких видов хозяев с одинаковым фильтратом сахарибактерий из полости рта обычно имеет низкий уровень успеха(рисунок 1B),поскольку взаимодействие симбионта и хозяина очень специфично. Исследователь может также протестировать одного и того же хозяина с фильтратами нескольких разных субъектов. Если используется хороший организм-хозяин (например, Arachnia propionica или Schaalia odontolytica),можно ожидать успеха в 50%.
Тестирование с помощью ПЦР имеет решающее значение. Опытные исследователи пытались подтвердить инфекцию с помощью микроскопии, только чтобы сообщить о ложных срабатываниях. Клетки сахариобактерий малы и их трудно различить между везикулами или нерегулярными выпуклостями клеточной оболочки. Стабильный сигнал ПЦР через несколько проходов является ключом к подтверждению успешной инфекции.
По мере роста зараженных культур должен появляться нормальный мутный рост. По мере того, как симбиоз устанавливается, инфицированные культуры будут казаться менее мутными, чем культуры неинфицированных организмов-хозяев(рисунок 2А). В некоторых случаях может показаться, что зараженные культуры полностью перестают расти и вообще не становятся мутными. Это может быть связано с инфекцией, когда клетки сахариобактерий подавляют организм хозяина. Добавление «свежего» (неинфицированного) хозяина в эти культуры должно обеспечить достаточную популяцию хозяина для поддержки дальнейшего роста паразитов Saccharibacteria.
Чрезмерный рост или чрезмерно мутные культуры могут указывать на загрязнение либо лабораторным загрязнителем, либо другой небольшой пероральной бактерией, которая смогла пройти через фильтр 0,2 мкм. Campylobacter и Capnocytophaga spp. являются типичными пероральными загрязнителями этих экспериментов. Это может быть подтверждено путем покрытия культуры и поиска колоний, которые нетипичны для организма-хозяина с последующим секвенированием 16S рРНК. Если наблюдается загрязнение, фильтрации этих культур через фильтр 0,2 мкм обычно достаточно для удаления загрязняющих веществ. Клетки сахариактерий в фильтрате могут быть сконцентрированы центрифугированием и использованы для повторного заражения чистой культуры хозяина.
Другим способом очистки зараженной культуры является отбор зараженных колоний от покрытия зараженной культуры. Колонии инфицированных хозяев иногда могут быть идентифицированы по неправильной форме колонии по сравнению с неинфицированными колониями(рисунок 2B-D). Эти нерегулярные колонии зависят от титра сахариобактерий в бинарной культуре, и меньшая доля колоний будет казаться нерегулярной, если титр низкий. Это может облегчить идентификацию инфицированных колоний, которые можно выбрать и использовать для запуска чистой бинарной культуры. Если на покрытии из зараженной культурой сахарибактерий не видно неправильных колоний, возможно, что симбионт находится на низком титре или не вызывает колоний неправильной формы. В таком случае скрининг колоний ПЦР с нормальным внешним видом может показать заражение сахарибактериями, но с низкой скоростью (2-10% всех колоний).
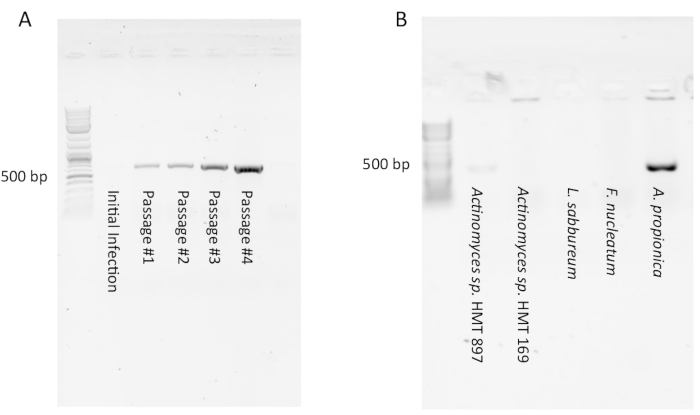
Рисунок 1:Типичные результаты ПЦР инфекций сахарибактерий культур-хозяев. (A)Продукт ПЦР, указывающий на присутствие сахарибактерий, может не появляться при первоначальной инфекции, но может появляться и становиться сильнее в последующих проходах по мере становления кокультуры. Большинствохозяев, инфицированных фильтратом, обогащенным сахарибактериями, не поддерживают свой рост из-за специфичности симбиоза. В этом примере только A. propionica был успешно инфицирован. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
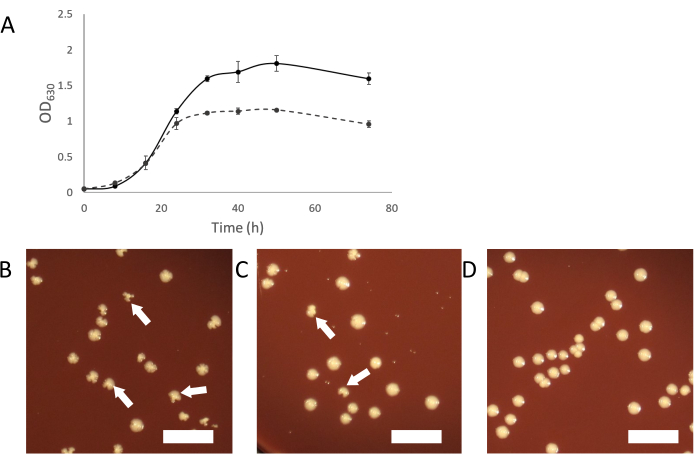
Рисунок 2:Характеристики роста зараженных культур сахарибактериями. (А) Кривые роста инфицированных и неинфицированных культур A. propionica показывают, что инфицированная культура не будет расти до той же плотности, что и неинфицированный контроль, и казаться менее мутной. (Б-Д) Покрытие кокультур может производить нерегулярные колонии, вызванные инфекциями сахарибатерии. Нерегулярные колонии будут уменьшаться пропорционально титру сахариобактерий в кокультуре. (B) Хозяин с высоким уровнем сахариактерий. (C) 10-кратные разбавленные сахариобактерии (D) Неинфицированная культура хозяина. Белые стрелки указывают на примеры неправильных колоний. Шкала = 1 см. Пожалуйста, нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
Наш метод фильтрации зубного налета и применения его к чистым культурам организмов-хозяев в значительной степени основан на более ранних наблюдениях за первыми культивирующимися сахарибактериями, штаммом'Nanosynbacter lyticus' TM7x11,14,15. Учитывая небольшой размер клеток, мы пришли к выводу, что они могут быть отделены от зубного налета с помощью фильтра и сконцентрированы центрифугированием. Во-вторых, поскольку эти организмы живут как паразиты, предоставление этим клеткам чистых культур хозяев позволит им войти в симбиоз и расти как бинарные культуры.
Одним из преимуществ этого метода является то, что он не требует культуры обогащения или селективного давления. Штамм TM7xNanosynbacter lyticus культивировали из культуры обогащения с использованием стрептомицина в качестве селективного агента, который, как показало секвенирование, будет эффективным при обогащении сахариобактерий. По случайности, хозяин'Nanosynbacter lyticus' Schaalia odontolytica,как известно, устойчив к стрептомицину16. Использование антибиотиков в качестве селективного агента может также предотвратить рост организма-хозяина, что, в свою очередь, предотвратит рост сахариобактерий.
Более серьезная проблема использования культур обогащения заключается в том, что быстрорастущие организмы быстро вытесняют организмы, представляющие интерес. В ротовой полости, например, виды Streptococcus могут быстро расти и, если сахар присутствует в питательной среде, вырабатывать достаточно кислоты для подкисления среды, дополнительно отбирая против организмов, представляющих интерес. Избегая культуры обогащения и селективных антибиотиков, наш метод обеспечивает общий подход, который может быть применен к более широкому спектру сахариобактерий и потенциальных хозяев без осложнений этих других методов.
Есть некоторые препятствия для метода, представленного здесь. Во-первых, этот метод предполагает, что сахариактерии живут в бинарной культуре. Мы не тестировали комбинации троичных или троичных культур, чтобы оценить их эффективность, но, вероятно, есть сахарибактерии, которые требуют факторов роста, которые не может обеспечить один организм-хозяин. Тестирование обширных комбинаций бактерий полости рта, которые могут поддерживать рост сахариобактерий, было бы сложной задачей. Во-вторых, метод предполагает, что все сахариобактерии достаточно малы, чтобы пройти через фильтр 0,2 мкм. Возможно, что другие сахариобактерии больше, чем считалось, и фильтр выбирает против этих организмов. Можно использовать фильтр с большим размером пор, но это рискует позволить большему количество нежелательным бактериям полости рта проникнуть в инфицированную кокультуру. Наконец, очень трудно найти виды-хозяева за пределами тех, которые уже были опубликованы. До сих пор единственными успешными хозяевами являются виды из родов Actinomyces, Schaalia, Arachnia и Cellulosimicrobium,все члены типа Actinobacteria15,17,18. Однако эти хозяева поддерживают только рост специфических сахариактерий. Чтобы культивировать больше видов сахариобактерий, необходимо исследовать гораздо больше хозяев.
Мы надеемся, что метод, представленный здесь, поможет будущим исследованиям сахариобактерий и других организмов СЛР. Метагеномное секвенирование предполагает, что эти организмы также имеют небольшие геномы и подозреваются в том, что они являются симбионтами или полагаются на местное микробное сообщество для снабжения метаболитов и других факторов, имеющих решающее значение для их выживания19. Аналогичная стратегия фильтрации может быть использована для изоляции этих организмов при условии, что они достаточно малы и что их организмы-хозяева могут быть культивированы. Методы, описанные здесь, являются первым шагом к тому, чтобы принести мощные инструменты лабораторной культуры этой большой и разнообразной группе бактерий.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Энн Таннер, Брюса Пастера, Хайке Буасверта, Сюэсонг Хе и Батбилег Бор за полезные обсуждения и за предоставление бактериальных штаммов. Мы благодарим Сьюзан Йост и Джессику Вудс за микробную техническую помощь. Исследования, представленные в этой публикации, были поддержаны Национальным институтом стоматологических и черепно-лицевых исследований Национальных институтов здравоохранения под номерами R37 DE016937 (FED), R01 DE024468 (FED) и T32 DE007327 (AJC). Содержание является исключительной ответственностью авторов и не обязательно отражает официальную точку зрения Национальных институтов здравоохранения.
Материалы
| Name | Company | Catalog Number | Comments |
| Agarose | Fisher Scientific | BP160-100 | |
| Alphaimager | Cell Biosciences | FluorChem HD2 | Or equivalent UV gel imaging system |
| Aluminum foil | Fisher Scientific | 01-213-101 | |
| Brain Heart Infusion Broth (dehydrated powder) | Becton-Dickinson | 211059 | Or other growth media suitable for target organisms |
| Centrifuge Rotor 70-Ti | Beckman Coulter | 337922 | |
| Cryovials | Fisher Scientific | 12-567-500 | |
| DMSO | Fisher Scientific | BP231-100 | |
| Electrophoresis Power Supply | Bio-Rad | 1645052 | |
| Electrophoresis Rig | Bio-Rad | 1704467 | |
| Filter Forceps | Millipore Sigma | XX6200006P | Not essential, helps ensure filters are not punctured during handling |
| Glycerol | Fisher Scientific | G33-500 | |
| GoTaq Green Mastermix | Promega | M7122 | |
| Mastercycler Pro Thermocycler | Eppendorf | 950040025 | Or equivalent thermocycler for PCR |
| MgCl2 solution 25mM | Promega | A3513 | |
| Molecular Biology grade water | Fisher Scientific | BP2819100 | |
| O2 Control InVitro Glove Box | Coy Laoratories | 031615 | If needed for microaerobic organisms |
| Optima L-100 XP High Speed Centrifuge | Beckman Coulter | 8043-30-1124 | |
| P-10 micro pipette | Gilson | F144802 | |
| P-1000 micro pipette | Gilson | F123601G | |
| P-2 micro pipette | Gilson | F144801 | |
| P-20 micro pipette | Gilson | F123600 | |
| P-200 micro pipette | Gilson | F123602G | |
| PBS | Fisher Scientific | BP399500 | |
| PCR tubes 0.2 mL | Fisher Scientific | 14-230-205 | |
| Peptone | Fisher Scientific | BP1420-500 | |
| Pipette tips - 10 μL | Fisher Scientific | 02-717-157 | |
| Pipette tips - 1000 μL | Fisher Scientific | 02-717-166 | |
| Pipette tips - 20 μL | Fisher Scientific | 02-717-161 | |
| Pipette tips - 200 μL | Fisher Scientific | 02-717-165 | |
| Polycarbonate filters - 47mm, 0.2 μm pore size | Millipore | GTTP04700 | |
| Screw-cap conical centrifuge tubes 15 mL | Falcon | 352096 | Or other tube suitable for bacterial culture |
| Sodium chloride | Fisher Scientific | BP358-1 | |
| Swin-Lok Filter - 47mm | Whatman | 4200400 | |
| SYBR Safe DNA Gel stain | ThermoFisher Scientific | S33102 | |
| Syringes - 20 mL | Fisher Scientific | 14-955-460 | |
| TAE Buffer (50x) concentrate | Fisher Scientific | P1332500 | |
| Thickwall Polycarbonate 25 x 89 mm (26.3mL capacity) centrifuge tubes with caps | Beckman Coulter | 355618 | |
| Tryptic Soy Blood Agar Plates | Northeast Laboratory Services | P1100 | Or other agar plate sufficient for growth of host organisms |
| Tryptic Soy Broth (dehydrated powder) | Becton-Dickinson | 211825 | Or other growth media suitable for target organisms |
| Vinyl Anaerobic Chamber | Coy Laboratories | 032714 | If needed for anaerobic organisms |
| Vortex mixer | Scientific Industries | SI-0236 | |
| Yeast Extract | Fisher Scientific | BP1422-500 |
Ссылки
- Stewart, E. J. Growing unculturable bacteria. Journal of Bacteriology. 194 (16), 4151-4160 (2012).
- Bomar, L., Maltz, M., Colston, S., Graf, J. Directed culturing of microorganisms using metatranscriptomics. mBio. 2 (2), 00012 (2011).
- Derrien, M., Vaughan, E. E., Plugge, C. M., de Vos, W. M. Akkermansia muciniphila gen. nov., sp. nov., a human intestinal mucin-degrading bacterium. International Journal of Systematic and Evolutionary Microbiology. 54, 1469-1476 (2004).
- Nelson, M. C., Bomar, L., Maltz, M., Graf, J. Mucinivorans hirudinis gen. nov., sp. nov., an anaerobic, mucin-degrading bacterium isolated from the digestive tract of the medicinal leech Hirudo verbana. International Journal of Systematic and Evolutionary Microbiology. 65, 990-995 (2015).
- Scott, J. C., Klein, B. A., Duran-Pinedo, A., Hu, L., Duncan, M. J. A two-component system regulates hemin acquisition in porphyromonas gingivalis. PLoS One. 8 (9), 0073351 (2013).
- Martin, B., et al. New growth media for oral bacteria. Journal of Microbiological Methods. 153 (22), 10-13 (2018).
- Vartoukian, S. R., et al. In vitro cultivation of 'unculturable' oral bacteria, facilitated by community culture and media supplementation with siderophores. Plos One. 11 (1), 0146926 (2016).
- Strandwitz, P., et al. GABA-modulating bacteria of the human gut microbiota. Nature Microbiology. 4 (3), 396-403 (2019).
- Hug, L. A., et al. A new view of the tree of life. Nature Microbiology. 1, 16048 (2016).
- Castelle, C. J., Banfield, J. F. Major new microbial groups expand diversity and alter our understanding of the tree of life. Cell. 172 (6), 1181-1197 (2018).
- He, X., et al. Cultivation of a human-associated TM7 phylotype reveals a reduced genome and epibiotic parasitic lifestyle. Proceedings of the National Academy of Sciences of the United States of America. 112 (1), 244-249 (2015).
- Hugenholtz, P., Tyson, G., Webb, R. I., Wagner, A. M., Blackall, L. L. Investigation of candidate division TM7, a recently recognized major lineage of the domain Bacteria with no known pure-culture representatives. Applied and Environmental Microbiology. 67 (1), 411-419 (2001).
- Brinig, M., Lepp, P. Prevalence of bacteria of division TM7 in human subgingival plaque and their association with disease. Applied and Environmental Microbiology. 69 (3), 1687-1694 (2003).
- Bor, B., et al. Insights obtained by culturing saccharibacteria with their bacterial hosts. Journal of Dental Research. , 689-694 (2020).
- Bor, B., et al. Phenotypic and physiological characterization of the epibiotic interaction between TM7x and its basibiont actinomyces. Microbial Ecology. 71 (1), 243-255 (2016).
- Skopek, R. J., Liljemark, W. F., Bloomquist, C. G., Rudney, J. D. Dental plaque development on defined streptococcal surfaces. Oral Microbiology and Immunology. 8 (1), 16-23 (1993).
- Murugkar, P. P., Collins, A. J., Chen, T., Dewhirst, F. E. Isolation and cultivation of candidate phyla radiation Saccharibacteria (TM7) bacteria in coculture with bacterial hosts. Journal of Oral Microbiology. 12 (1), 1814666 (2020).
- Cross, K. L., et al. Targeted isolation and cultivation of uncultivated bacteria by reverse genomics. Nature Biotechnology. 37 (11), 1314-1321 (2019).
- Kantor, R., et al. Small genomes and sparse metabolisms of sediment-associated bacteria from four candidate phyla. MBio. 4 (5), 00708-00713 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены