Method Article
בידוד ותרבית במבחנה של מקרופאגים שמקורם במח עצם לחקר הביולוגיה של NO-Redox
* These authors contributed equally
In This Article
Summary
פרוטוקול זה הוקם כדי תרבית טטרהידרוביופטרין (BH4) - ותחמוצת החנקן סינתאז (iNOS) - חסרים מקרופאגים ראשוניים של מורין כדי לחקור ביולוגיה של NO-redox. המחקר מתמקד בהפחתת זיהום פוטנציאלי של BH4 וממצאים אחרים שנמצאו בשיטות בידוד ותרבית מסורתיות אשר עשויות לבלבל את תוצאות הניסויים ואת הפרשנות של התוצאות.
Abstract
מקרופאגים מופקים מתאי אב המטופויאטיים בכל הגוף, הם מרכזיים בתהליכים דלקתיים ומשתתפים בתגובות חיסוניות מולדות ונרכשות. מחקר במבחנה של מקרופאגים יכול להתבצע על ידי תרבית ex vivo מהפריטונאום או באמצעות התמיינות של תאי אב של מח עצם מיאלואידי כדי ליצור מקרופאגים שמקורם במח העצם (BMDMs). גישה נפוצה להתמיינות מקרופאגים ממבשרים כוללת שימוש במדיה מותנית מתאי L929 (LCM). מדיה זו קלה לייצור עצמי אך סובלת מהשתנות אצווה, ומרכיביה אינם מוגדרים. באופן דומה, סרום בקר עוברי (FBS) משמש לתמיכה בגדילה אך מכיל תערובת עצומה של מולקולות לא מוגדרות שעשויות להשתנות בין אצוות. שיטות אלה אינן מתאימות לחקר הביולוגיה של תחמוצת החנקן ומנגנוני חמצון-חיזור, שכן שתיהן מכילות כמויות משמעותיות של מולקולות קטנות המפריעות למנגנוני חמצון-חיזור או רמות משלימות של קו-פקטורים, כגון טטרהידרוביופטרין (BH4), הנדרשות לייצור NO מסינתזה של תחמוצת החנקן (iNOS). בדו"ח זה, אנו מציגים פרוטוקול אופטימלי המאפשר שליטה בסביבת NO-redox על ידי הפחתת רמות הביופטרין האקסוגני תוך שמירה על תנאים המתאימים לצמיחה והתמיינות של תאים. שליטה הדוקה בהרכב המדיה התרבותית מסייעת להבטיח שכפול ניסיוני ומאפשרת פרשנות מדויקת של התוצאות. בפרוטוקול זה, BMDMs התקבלו ממודל עכבר חסר GTP ציקלוהידרולאז (GCH). תרבית של BMDMs בוצעה עם מדיה המכילה (i) LCM מותנה, או (ii) M-CSF רקומביננטי ו- GM-CSF כדי לייצר ממצאים מינימליים תוך קבלת תנאי תרבית חסרי BH4 ו- NO - ובכך אפשרה את המחקר הניתן לשחזור של ביולוגיה של NO-redox ו- immunometabolism במבחנה.
Introduction
מקרופאגים הוקמו כסוג תא מעניין במגוון רחב של מחלות ומצבים, שרבים מהם לכאורה אינם קשורים להתמקדות המסורתית שלהם בחסינות מולדת. מכיוון שהפיזיולוגיה של המקרופאגים תלויה במידה רבה ברקמה או בסביבה שבה הם מתגוררים, נוצרו שיטות ומודלים רבים כדי לחקור את תפקודם ואת המסלולים השונים המעורבים. מבחינה היסטורית, קווי תאי מקרופאג', כגון RAW264.7, שלטו בתחום, אך אלה הוחלפו בהדרגה לטובת מודלים שונים של תאים ראשוניים. לדוגמה, מקרופאגים מורין עשויים להיות מבודדים משטף פריטוניאלי לאחר טיפול עם thioglycolate. בעוד שהם מספקים מודל שימושי לחקר תאים תושבי רקמות, מקרופאגים פריטוניאליים אלה הוכחו כמדגימים תגובה מאופקת יותר לגירויים חיצוניים שונים, ובכך מגבילים את התאמתם ליישומים רבים במורד הזרם1.
כחלופה, מקרופאגים שמקורם במח עצם (BMDMs), שמקורם בתאי אב מיאלואידים במח העצם, התגלו כמודל רב ערך לחקר היבטים שונים של ביולוגיה של מקרופאגים, כולל הבשלה והפנוטיפים הקלאסיים השונים הקשורים למקרופאג'ים, M0 (נאיבי, לא מופעל), M1 (פרו-דלקתי, מופעל בדרך כלל עם LPS/IFN) ו-M2 (פרו-רזולוציה, מופעל בדרך כלל עם IL-4)2, 3. עם זאת, התמיינותם של תאי אב מיאלואידים ל-BMDMs תלויה בנוכחותו של גורם מגרה מושבת מקרופאגים (M-CSF) במדיית התרבית 4,5. זה עשוי להיות מסופק בצורה של חלבון מטוהר המוסף לתקשורת או מתוך מדיה מותנית L929 (LCM). יש לשקול את היתרונות של שימוש ב-BMDMs (עלות ויעילות) אל מול המגבלות המוצגות על ידי רגישותם לגירויים שונים (ציטוקינים, מתווכים מטבוליים ו-RNS/ROS).
נתונים קודמים מצביעים על כך שהתכנים של LCM מוגדרים בצורה גרועה ומשתנים במהותם, וכתוצאה מכך הם אינם אמינים ואינם מתאימים למגוון יישומים במורד הזרם, במיוחד אלה הנוגעים ספציפית לביולוגיה של NO או חמצון-חיזור, שכן אלה עשויים להיות מושפעים מאוד מנוכחותם של תרכובות אקסוגניות6. ככזה, פרוטוקול מפורט זה קורא לשימוש ב- DMEM מוגדר היטב: מדיית F12 עם וריאציה נמוכה של אצווה לאצווה ותוספת של מורין רקומביננטי M-CSF ו- GM-CSF (גורם מגרה מושבה גרנולוציטים-מקרופאג '). יתר על כן, סרום בקר עוברי המשמש בדרך כלל כתוסף במדיה של תרביות רקמה מספק מקור נוסף לתרכובות לא מוגדרות היטב ולשונות מובנית. לכן, יש צורך לשלוט ולייעל את השימוש בתוספים כאלה כדי להבטיח את התרבות האמינה של BMDMs. על ידי שימוש במקור מוגדר של אנדוטוקסין נמוך של FBS והבטחת רכישה של אצוות בודדות בתפזורת, תנאי התרבית מוגדרים באופן מהימן, ומובטחת יכולת שכפול. הפרוטוקול המתואר כאן הוכח כמפיק תרבית מקרופאגים מעל טוהר של 95% כאשר הוא מוערך עבור סמני פני השטח של המקרופאגים CD45 ו- CD11b על ידי ציטומטריית זרימה6.
Protocol
כל ההליכים בבעלי חיים אושרו ובוצעו בהתאם לוועדת האתיקה של אוניברסיטת אוקספורד ולחוק החיות של משרד הפנים הבריטי (הליכים מדעיים) 1986. כל ההליכים תאמו את הדירקטיבה 2010/63/EU של הפרלמנט האירופי.
1. בידוד תאי מח העצם
- להקריב עכברים מסוג בר (C57BL/6), או עכברים חסרי Gch1 (R26-CreERT2Gchfl/fl) (בני 10-16 שבועות) על ידי נקע צוואר הרחם ולאסוף את הגפיים האחוריות.
הערה: אין העדפה לאף אחד מהמינים. נקבות תואמות גיל יהיו מעט קטנות יותר ממקבילותיהן הגבריות, מה שישפיע על התשואה הראשונית של חומר ההתחלה.- רססו את העכברים ב-70% אתנול כדי להפחית את הסיכון לזיהום.
- לעשות חתך קטן בבטן עם מספריים דיסקציה כדי להסיר פרווה ועור מהגוף. מקלפים את העור כדי לחשוף את השריר על הגפיים האחוריות.
- הניחו את העכבר על בטנו ופרקו את הגפיים האחוריות על ידי הרמתו ממפרק הברך והפעלת לחץ על הירכיים. ניתן להרגיש את הנקע במפרק הירך.
- הסר את הרגליים האחוריות על ידי חיתוך זהיר דרך השריר בירך, ולהבטיח שלא ייגרם נזק לעצם הירך.
- חותכים מעל מפרק הקרסול, מסירים את כף הרגל ומנקים את כל העור שנותר מהרגל.
- מניחים את הרגליים המנותחות בצינור של 50 מ"ל עם 25 מ"ל של PBS קר כקרח (אין צורך באנטיביוטיקה) ומניחים אותו על קרח.
הערה: ניתן לנתח מספר בעלי חיים, ולשמור על הרגליים על הקרח.
- בתנאים סטריליים במכסה מנוע תרבית רקמה, יש להסיר את השרירים מהרגליים ולהסיר את קצות העצמות כדי לחשוף את מח העצם.
- מניחים את הרגליים ב-70% אתנול למשך 2 דקות כדי להפחית את הזיהום ולשטוף כל פרווה או שאריות.
- מעבירים את הרגליים לצלחת פטרי נקייה, סטרילית ובקטריולוגית. השתמשו במלקחיים ובאזמל כדי לגרד בחוזקה ובזהירות לאורך העצמות עם צד הלהב כדי להסיר את השרירים. חותכים דרך גידים כדי להקל על התהליך.
- הסר את האפיפיזה בקצה של כל עצם כדי לחשוף את מח העצם. עצם הירך נחתכת משני הקצוות, ממש בסמוך למפרקים המתאימים.
- השוקה נחתכת בחלק העליון, ממש סמוך למפרק הברך, ובתחתית ממש מעל נקודת ההצטלבות עם הפיבולה.
- שטפו את מח העצם מהעצמות עם PBS ואספו אותו בצינור סטרילי של 50 מ"ל.
- מלאו מזרק של 10 מ"ל ב-10 מ"ל של PBS והתחברו למחט של 25 גרם x 0.5 x 16 מ"מ. זה מספיק כדי לשטוף את כל העצמות מעכבר אחד.
- מכניסים את המחט לחלל המדולרי של העצם ושוטפים בעדינות את מח העצם החוצה עם 1-2 מ"ל של PBS, ומפעילים את המחט למעלה ולמטה דרך העצם כדי להבטיח שכל מח העצם ניתק.
- חזרו על הפעולה עם כל העצמות, ואספו את מח העצם הסמוק בצלחת פטרי נקייה.
- באמצעות מזרק סטרילי של 1 מ"ל, יש לפרק את מח העצם על ידי משיכת התרחיף פנימה והחוצה מהמזרק 5-10 פעמים עד שגושים כלשהם מתפרקים.
- אספו את מח העצם המפורק במזרק 1 מ"ל והעבירו אותו דרך מסננת תאים של 70 μM לתוך צינור צנטריפוגה נקי של 50 מ"ל. הניחו את מח העצם שנאסף על קרח בזמן שדגימות נוספות נאספות.
הערה: ראה ערכת פרוטוקול באיור 1 - חלק 1.
2. בחירה, הבחנה וגירוי של BMDMs
- כדי להקפיא את מח העצם לשימוש מאוחר יותר, גלולו את מח העצם על ידי צנטריפוגה ב-1000 x גרם למשך 5 דקות ובצעו החייאה ב-2 מ"ל של FBS נמוך של אנדוטוקסין המכיל 5% דימתיל סולפוקסיד (DMSO).
- צנטריפוגה את מתלה מח העצם ב 1000 x g למשך 5 דקות בטמפרטורת החדר (RT). ייווצר כדור אדום דם.
- השליכו את הסופרנאטנט.
- יש לבצע החייאה עדינה של הכדור ב-2 מ"ל של FBS נמוך אנדוטוקסין המכיל 5% DMSO ולהקפיא בטמפרטורה של -80 מעלות צלזיוס למשך הלילה לפני שתעבור לחנקן נוזלי בשלב אדים לאחסון לטווח ארוך.
- כדי להשתמש במח העצם באופן מיידי, יש ללטף את תאי הדם האדומים לפני ציפוי מח העצם.
- צנטריפוגה מתלה מח העצם ב 1000 x g במשך 5 דקות ב RT. ייווצר כדור אדום דם.
- יש לבצע החייאה של הכדור ב-3 מ"ל של 1x חיץ ליזיס של תאי דם אדומים ולדגום ב-RT למשך 5 דקות.
- הוסף 10 מ"ל של PBS וצנטריפוגה ב- 1000 x g למשך 5 דקות ב- RT. השליך את הסופרנטנט.
- צלחת את התאים לשימוש מיידי על ידי המשך משלב 2.3.5.
- להפשיר את המקרופאגים ולהפשיר ב-3 מ"ל של מדיית ציפוי לפני שהם מפילים את התאים.
- הכן DMEM: F12 המכיל 5% אנדוטוקסין FBS נמוך, 1x פניצילין / סטרפטומיצין, L- גלוטמין ו- 25 ננוגרם / מ"ל M-CSF.
הערה: ניתן להכין M-CSF ו- GM-CSF על ידי החייאה של חלבון יבש במים סטריליים המכילים 0.1% BSA סטרילי, וניתן להקפיא את האליקוטים בטמפרטורה של -80 מעלות צלזיוס לשימוש מאוחר יותר. - להפשיר את מתלי התאים הקפואים במהירות ב-37 מעלות צלזיוס.
- העבר את מתלי התא (0.5 מ"ל) לצינור נקי וסטרילי המכיל 3 מ"ל של ה- DMEM המוכן: מדיה F12.
- גלול את התאים על ידי צנטריפוגה ב 1000 x g במשך 5 דקות ב- RT. השליכו את הסופרנאטנט.
- החייאת הכדור ב-3 מ"ל של המדיה המוכנה של DMEM: F12.
- ספרו את התאים בשיטה מועדפת.
- הכן DMEM: F12 המכיל 5% אנדוטוקסין FBS נמוך, 1x פניצילין / סטרפטומיצין, L- גלוטמין ו- 25 ננוגרם / מ"ל M-CSF.
- יום 0: צלחת התאים.
- צלחת את התאים בכלי פלסטיק שאינם מצופים TC ב-DMEM: מדיה F12 המכילה 5% אנדוטוקסין FBS נמוך, 1x פניצילין/סטרפטומיצין, L-גלוטמין ו-25 ננוגרם/מ"ל M-CSF.
הערה: צפיפויות זריעה מייצגות מתוארות בטבלה 1. זוג רגליים שלם מעכבר אחד מספק 15-20 מיליון תאים מקדימים. - דגירה של התאים בטמפרטורה של 37 מעלות צלזיוס עם 5% CO2.
- צלחת את התאים בכלי פלסטיק שאינם מצופים TC ב-DMEM: מדיה F12 המכילה 5% אנדוטוקסין FBS נמוך, 1x פניצילין/סטרפטומיצין, L-גלוטמין ו-25 ננוגרם/מ"ל M-CSF.
- יום 5: להאכיל את התאים.
- הזן את התאים על ידי הוספת 50% מהנפח המקורי של DMEM: מדיה F12 המכילה 5% אנדוטוקסין FBS נמוך, 1x פניצילין / סטרפטומיצין, L-גלוטמין ו- 50 ננוגרם / מ"ל M-CSF.
- יום 6: לעורר את התאים עם GM-CSF.
- הוסיפו GM-CSF מוכן לריכוז סופי של 50 ננוגרם/מ"ל ישירות למדיה של תרביות התאים על התאים.
- החלף את המדיה ב- DMEM מוכן: F12.
- הסר את כל המדיה מהתאים.
- שטפו את התאים לזמן קצר ב-PBS שחומם מראש.
- הוסף DMEM: מדיית F12 המכילה 2% אנדוטוקסין FBS נמוך, 1x פניצילין/סטרפטומיצין, L-גלוטמין, 25 ננוגרם/מ"ל M-CSF ו-50 ננוגרם/מ"ל GM-CSF.
- הפעל את המקרופאגים לפנוטיפים M0, M1 או M2 עם הגירויים המתוארים בשלבים 2.7.5-2.7.7.
- M0 - אין צורך בגירוי. דגירה של התאים למשך הלילה במדיה.
- M1 - לעורר את התאים עם 100 ng/mL LPS ו-10 ng/mL IFNγ (ריכוזים סופיים) במהלך הלילה.
- M2 - לעורר תאים עם 100 ננוגרם/מ"ל IL-4 (ריכוז סופי) במהלך הלילה.
- יום 8: קצירת התאים.
- הסר את המדיה מהתאים (אסוף מדיה והקפא בטמפרטורה של -80 מעלות צלזיוס לבדיקות במורד הזרם).
- דגירה של התאים ב-PBS קר כקרח (50% מנפח המדיה) למשך 5 דקות.
- נתקו את התאים מהצלחת עם גירוד עדין או צנרת חוזרת ונשנית.
- גלול את התאים על ידי צנטריפוגה ב 2500 x g במשך 5 דקות ב RT. להשליך את supernatant.
- הקפיאו את כדורי התא בטמפרטורה של -80 מעלות צלזיוס לשימוש מאוחר יותר.
הערה: ראה ערכת פרוטוקול איור 1 - חלק 2.
תוצאות
לפני שהדגימו את היעילות של פרוטוקול זה במקרופאג'ים, רמות ניטריט ו-BH4 הוערכו במדיה בתוספת 10% מה-FBS המכילה 10% מ-LCM או רק רקומביננטי M-CSF ו-GM-CSF. ניטריט, למרות שנחשב במשך זמן רב כתוצר סופי של חילוף החומרים של תחמוצת החנקן, נחשב כיום לאחסון פיזיולוגי של תחמוצת החנקן, אשר ניתן למחזר בעת הצורך ולכן משמש לעתים קרובות כאינדיקטור לזמינות ביולוגית של תחמוצת החנקן7. BH4 הוא קו-פקטור חיוני של NOS לייצור NO. כפי שניתן לראות באיור 2, למדיה בתוספת 10% FBS היו רמות ניטריט דומות ללא קשר ל-M-CSF/GM-CSF או LCM. עם זאת, נצפתה שונות יותר בין אצוות LCM שונות. תצפית זו חלה גם על מדידת BH4. למעשה, אצווה אחת של LCM (אצווה #3) הייתה בעלת רמה גבוהה משמעותית של BH4 מאשר שתי האחרות (אצוות #1 ו #2). יתר על כן, אצוות LCM הכילו הרבה יותר ביופטרין מאשר מדיה בתוספת 10% FBS וציטוקינים רקומביננטיים. כמו כן נמדדה שונות משמעותית של סך הביופטרינים בין האצוות. תוצאות אלה מדגימות את החשיבות של שימוש במקור פחות משתנה של M-CSF מאשר LCM.
יתר על כן, מדיה בתוספת 10% FBS הכילה רמות גבוהות יותר באופן משמעותי של ניטריט בהשוואה למדיה המכילה 2% או 5% של FBS. ההפרש בין 10% ל-5% היה משמעותי ביותר (עמ' < 0.05) עבור BH4. עם זאת, רמות דומות של ביופטרינים כומתו. לשם השוואה, OptiMEM + 0.2% BSA היה נטול ניטריט ו- BH4, מה שהופך אותו למדיה נקייה ומתאימה מאוד. עם זאת, כפי שתואר על ידי Bailey et al., למרות ש- OptiMEM אמור לשמש רק פעם אחת במהלך הלילה בעת גירוי מקרופאגים, נצפה מוות תאי עקב רעב. DMEM: F12 בתוספת 2% מה-FBS נבחר כדי להתגבר על בעיה זו, מה שמאפשר זיהום מינימלי של ניטריט ו-BH4 תוך שהוא מכיל מספיק חומרים מזינים כדי להשיג תאים בריאים. ואכן, למרות שזוהו כמה ניטריטים, הרמות זניחות (~0.2 μM) בהשוואה למקרופאג'ים מגורה WT של LPS/IFN (30-80 μM עבור 1 x 106 תאים; הנתונים לא מוצגים).
כדי לאמת את הפרוטוקול המשופר הזה עם נתונים ניסיוניים, בידוד ואפיון של BMDMs ממודל עכברים חדש עם מחסור ב-BH4, מוצג כאן R26-CreERT2Gchfl/fl. BH4 מיוצר על ידי הגן GTP ציקלוהידרולאז I (Gch1). כפי שניתן לראות באיור 3A, מחסור ב-Gch1 מוביל לאובדן BH4 ולהיעלמות של NO וכתוצאה מכך לניטריט, ולעלייה באניון סופראוקסיד הגורם לעקה חמצונית כפי שהודגם בעבר על ידי McNeill et al.8. למרות שפרוטוקול זה כבר הוגדר היטב ומשמש לתרבית מקרופאגים אחרים עם מחסור ב-BH4 ממערכות Cre-system שונות כגון Gchfl/flT2C model 6,8, מודל R26-CreERT2Gchfl/fl הוא ייחודי מכיוון שהוא משתמש בהפעלה המותנית של מערכת Cre-ERT2 כדי להסיר את הגן Gch1 בעקבות טיפול בטמוקסיפן (איור 3B, ג). זה מאפשר נוקאאוט בנקודות זמן שונות ושימוש בבקרה פנימית בצורה של טיפול ברכב לעומת טמוקסיפן. בדוגמה זו, התאים טופלו ברכב (95% אתנול) או 0.1/1.0 μM 4-OH טמוקסיפן בימים 1 ו-3 (גם הרכב וגם מלאי הטמוקסיפן מדולל ב-1:100 במדיה לפני 0.7/7.0 μL שנוספו ל-1 מ"ל מנפח התרבית הקיים).
כפי שניתן לראות באיור 3D, חלבון GTPCH מתבטל בעקבות טיפול בטמוקסיפן בתאי R26-CreERT2Gchfl/fl, אך לא בתאי Gchfl/fl. חשוב לציין שגם תאי הבקרה R26-CreERT2Gchfl/fl וגם תאי הבקרה של Gchfl/fl עדיין מסוגלים לייצר iNOS בעקבות גירוי LPS/IFN (איור 3B,C). שינויים אלה בביטוי הגנים Gch1 והשינוי שנוצר כתוצאה מכך בחלבון GTPCH הובילו להפרעות משמעותיות ברמות BH4 תוך תאיות ולייצור מוחלש של ניטריט. כפי שניתן לראות באיור 4, BMDMs שבודדו ותרביתו מעכברי R26-CreERT2Gchfl/fl הציגו ירידה משמעותית בייצור BH4 וירידה בהצטברות ניטריטים במדיה, בהשוואה לאלה מתאי בקרה מסוג GCHfl/fl בנוכחות טמוקסיפן. באופן דומה, אותם תאים שעברו תרבית במדיית LCM הראו גם ביטוי Gch1 שבוטל; למרות שתאים אלה עדיין ייצרו כמויות משמעותיות של BH4 וגם של ניטריט בעקבות נוקאאוט של ביטוי Gch1 עם טמוקסיפן 4 OH, אולי בגלל זיהום של מדיה ו- FBS עם BH4. זה מייצג שיפור ברור של השיטה החדשה, על פני התרבות התאים במדיה המכילה תאי L.
אפיון נוסף של מודל זה אינו מדגים הבדלים משמעותיים במורפולוגיה בין BMDMs לא פעילים (M0) Gchfl/fl לבין R26-CreERT2Gchfl/fl BMDMs ביום 8 בעקבות ריכוזים שונים של טמוקסיפן. כפי שניתן לראות באיור 5, שני המודלים מציגים כמות דומה של תאים דביקים העשויים מצורה עגולה עם גפיים מוארכות, בדרך כלל התכונות הצפויות מקרופאגים לא מגירים9.
יחד, תוצאות אלה מראות כי שיטה זו של בידוד ותרבית של BMDMs מספקת אוכלוסייה טהורה של תאים המתאימים לתרבית של מקרופאגים מורין. שיטה זו מאפשרת את התרבות של מקרופאגים מורינים ללא הפרעה של תרכובות אקסוגניות הקיימות בכמה ניסוחי מדיה.
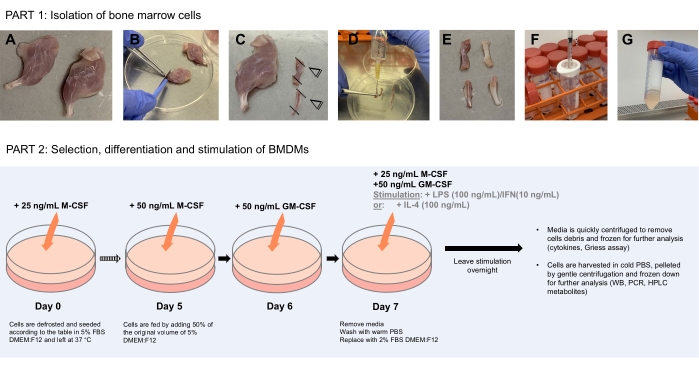
איור 1: דיאגרמה סכמטית הממחישה את בידוד תאי מח העצם (חלק 1) לבחירה, התמיינות וגירוי של BMDMs (חלק 2). (A) בתנאים סטריליים, רגליים מנותחות ממוקמות בצלחת פטרי בקטריולוגית נקייה לאחר שנשטפות ב-70% אתנול. (B) השרירים מוסרים בזהירות באמצעות מלקחיים וגירוד אזמל לאורך העצמות. (C) לאחר מכן חותכים את גפי העצמות כדי לחשוף את מח העצם. (D) מח העצם נשטף מהעצמות באמצעות מזרק 10 מ"ל מלא ב-10 מ"ל של PBS על ידי החדרת המחט ללומן העצם. (E) המחט נדרסת למעלה ולמטה דרך העצם כדי להבטיח שכל מח העצם ניתק. העצם צריכה להיראות לבנה וצלולה בשלב זה עם מח העצם המנותק שנאסף בצלחת הפטרי. (פ-ג) חזרו על הפעולה עבור כל העצמות, אספו את מח העצם המפורק במזרק 1 מ"ל, והעבירו אותו דרך מסננת תאים של 70 מיקרומטר לתוך צינור צנטריפוגה נקי של 50 מ"ל. סובבו מטה והחזירו תאים במדיה קפואה לשימוש מאוחר יותר. חלק 2 מציג את הבחירה, ההבחנה והגירוי של BMDMs אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
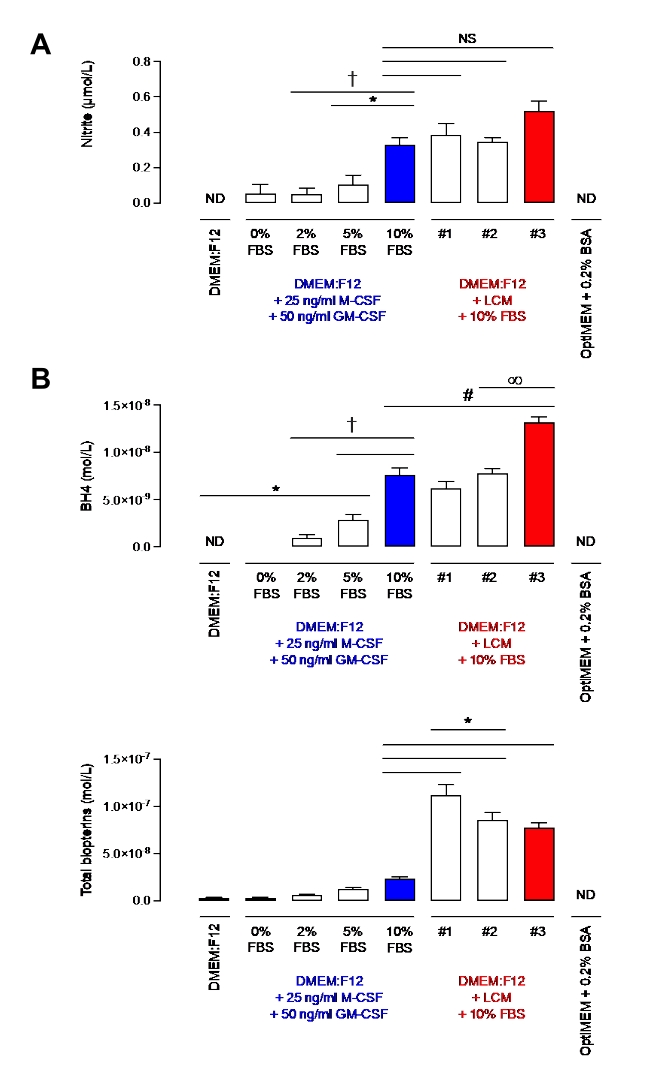
איור 2: רמות ניטריט ו-BH4 ב-DMEM: F12 + GM-CSF + M-CSF או DMEM: F12+ מדיה של תאי L. (A) רמות ניטריט במדיות שונות נמדדו בשיטת הבדיקה של גריס. (B) רמות BH4 וביופטרינים נמדדו במדיות שונות על ידי כימות HPLC באמצעות תקן BH4. הנתונים מבוטאים כממוצע (n = 3) ± SD. הנתונים נותחו באמצעות ANOVA חד-כיווני על ידי השוואות מרובות. סמלים מייצגים p < 0.05 בין קבוצות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
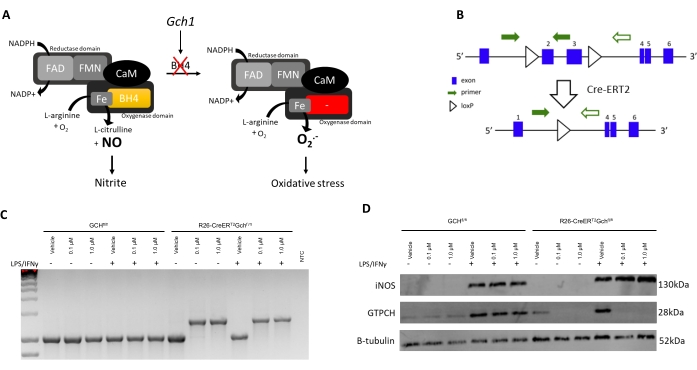
איור 3: הצגת מודל R26CreERT2. (A) סכימה הממחישה את תפקידו של BH4 כקו-פקטור NOS בביולוגיה של חמצון-חיזור. (B) שרטוט המפרט את הכריתה של האקסונים הקריטיים (2 ו-3) ב-Gch1 בשל אתרי loxP האגפים וההפעלה המותנית של Cre-ERT2 עם טמוקסיפן במודל מורין זה. (C) PCR (המייצג n = 3 בעלי חיים עצמאיים) המדגים כריתה של האקסון הקריטי כאשר BMDMs מטופלים בטמוקסיפן. עכברי WT מייצרים מוצר PCR של 1030 bp, בעוד שבנוכחות ה-Cre מיוצר מוצר של 1392 bp, המאשר כריתה של האקסונים הקריטיים. (D) אימונובלוט של iNOS, GCH ו-B-tubulin (המייצג n = 3 בעלי חיים עצמאיים). אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
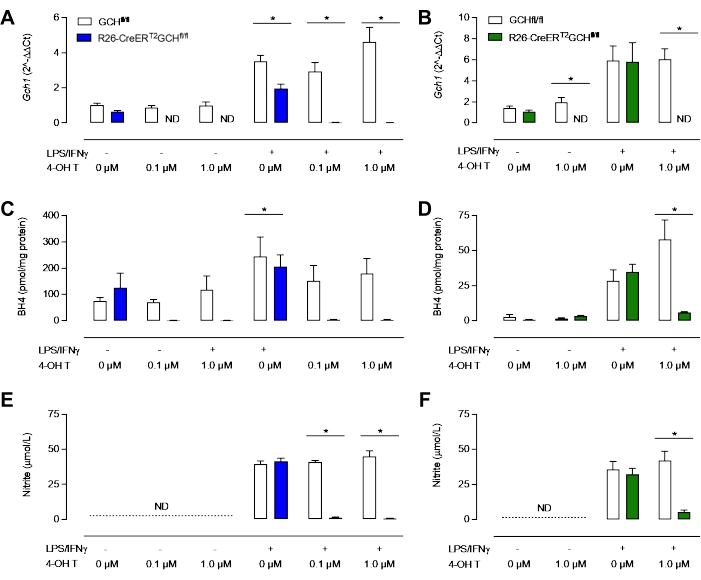
איור 4: אפיון מחסור ב-BH4 במקרופאג'ים. (א,ב) qRT-PCR מאשר אובדן ביטוי Gch1 במודל R26-CreERT2Gchfl/fl שטופל בטמוקסיפן. כחול = שיטת MCSF חדשה, ירוק = שיטת LCM קלאסית. (ג,ד) ניתוח של BH4 תוך תאי על ידי HPLC מגלה כי 0.1 μM ו 1.0 μM מספיקים כדי להפחית את רמות BH4 באופן משמעותי. (ה, ו) מדידה של ניטריט במדיה באמצעות בדיקת Griess מראה כי BMDMs לא מגורה אינם מייצרים רמות ניתנות לזיהוי של ניטריט, בעוד ש-Gchfl/fl ו-R26-CreERT2Gchfl/fl BMDMs מייצרים ניטריט בנוכחות LPS/IFNγ. באופן משמעותי, טיפול בטמוקסיפן של R26-CreERT2Gchfl/fl מפחית באופן משמעותי את רמות הניטריט ב- BMDMs מגורה. הנתונים מבוטאים כממוצע של (n = 3) ± SD. הנתונים נותחו באמצעות ANOVA חד כיווני על ידי השוואות מרובות. סמלים מייצגים p < 0.05 בין קבוצות. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.

איור 5: השוואה בין מורפולוגיה של BMDMs. תמונות שהתקבלו על ידי מיקרוסקופיה אופטית של BMDMs ביום 8 עם הטיפול השונה של טמוקסיפן. קנה המידה מצוין בתמונה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
| צלחת תרבות | נפח מדיה | צפיפות זריעה |
| 12 מנות טובות | 1 מ"ל | 500,000 תאים |
| 6 מנות טובות | 2 מ"ל | 1,000,000 תאים |
| צלחת 100 מ"מ | 10 מ"ל | 3,000,000 תאים |
| 75 ס"מ2 בקבוקונים | 15 מ"ל | 5,000,000 תאים |
טבלה 1: צפיפויות זריעה מייצגות.
Discussion
פרוטוקול תרבית BMDMs זה, שאינו חסר BMDMs, תוכנן לחקור ביולוגיה של NO-redox במקרופאגים ראשוניים באמצעות הפחתה של טטרהידרוביופטרין (BH4) וממצאים מפריעים אחרים במטרה לשפר את האמינות ויכולת השכפול של התוצאות המתקבלות ממודלים ניסיוניים אלה.
שלבים קריטיים כוללים שימוש בכלי הפלסטיק הנכונים. אבות המקרופאג' הם תאים דביקים ודביקים מאוד; לכן השימוש בצלחות שאינן מטופלות בתרבית רקמה (TC) הוא חיוני בבחירה ובבידוד שלהן מתאי אב אחרים, שאחרת היו יכולים להיצמד ולהפחית את הטוהר. ביום הקציר, ניתוק מקרופאגים מצלחות דורש PBS קר כקרח, אך שימוש ב-EDTA או אפילו בגרוטאות תאים בעדינות רבה יכול להתבצע בהתאם ליישום במורד הזרם (ניסוי בתאים ליסים לעומת תאים חיים, למשל). יש לנקוט משנה זהירות גם לגבי זיהום. בעת שטיפת מח העצם, עלול להתרחש זיהום צולב פוטנציאלי בחיידקים או בחלקיקים נגיפיים משאריות פרווה ועור. אז חיוני להיות זהירים וסטריליים ככל האפשר; מכאן שצלילת רגליים חתוכות ב-70% אתנול למשך מספר דקות מעודדת. באופן דומה, מומלץ מאוד להשתמש באנטיביוטיקה תוך כדי גידול מקרופאגים.
מגבלה נוספת של פרוטוקול זה נובעת מצפיפות ציפוי התאים ביום 0. מח עצם סמוק מכיל מגוון של תאים, אשר ניתן לספור בצורה שגויה ולכלול אותם כאבות מקרופאגים, ובכך להוביל למספר תאים כולל כוזב. כדי למנוע את השונות הבאה והפוטנציאלית, ניתן לשטוף בעדינות מקרופאגים מבודדים באמצעות PBS חם ביום 7 ולצפות אותם מחדש בצפיפות הנכונה ב-2%FBS DMEM: F12 לפחות שעה אחת לפני הגירוי כדי לאפשר היצמדות.
לבסוף, בדיקת רמות הניטריט על ידי בדיקת גריס באמצעות מדיה מקרופאגים מגודלים היא הכרחית לניתוח נתונים. בצד החיובי, בדיקה זו מהירה וזולה לביצוע.
כפי שמודגם כאן, פרוטוקול מותאם אישית זה הוא חלופה מוגדרת ומשופרת יותר לפרוטוקול הנפוץ יותר המשמש לבידוד וטיפוח מקרופאגים באמצעות מדיה מותנית של תאי L (LCM). ואכן, אחד החששות העיקריים בשימוש ב-LCM כאשר חוקרים ביולוגיה של NO-redox הוא הכמויות המשמעותיות של ביו-פטרינים שזוהו, מה שמוביל לשינויים מטבוליים פוטנציאליים10. לדוגמה, BH4 אקסוגני יכול לחדש במהירות מודלים לקויים ולפעול כגורם משותף עבור iNOS, מה שמוביל לייצור לא רצוי של תחמוצת החנקן. חיסרון נוסף של שימוש ב- LCM טמון בייצורו - LCM הוא תערובת של גורמים מעוררי מושבה, ציטוקינים ותוצרי לוואי אחרים המופרשים ישירות על ידי תאי L-929, אשר כולם יכולים להשפיע על פיזיולוגיה של מקרופאגים6. למרות ההיצע הרב שלו ב-M-CSF, החיוני להתרבות והישרדות של מקרופאגים, השונות של כל רכיב מאצווה לאצווה מגבירה את הסיכון לשונות בניסויים שונים.
כדי לטפל בשתי הבעיות, פרוטוקול חדש זה משתמש במדיית DMEM: F12 המוגדרת היטב המכילה רמות נמוכות של ביופטרינים שאליהם מתווספת כמות מבוקרת של M-CSF ו-GM-CSF מטוהרים. שני הציטוקינים מסייעים בהתמיינות ובצמיחה של מקרופאגים. M-CSF מוביל במיוחד ליצירת BMDMs מתאי אב של מח עצם על ידי הבטחת התמיינות של תאי גזע המטופויאטיים למקרופאגים11. בנוסף, GM-CSF הוכח כמגביר את ייצור הציטוקינים הדלקתיים וה-NO כאשר מוסיפים אותו לפני הגירוי, יתרון אמיתי כאשר חוקרים ביולוגיה של NO-redox12,13.
הגורם העיקרי הנוסף ששיטה חדשה זו מטפלת בו הוא זה של FBS, המשמש בדרך כלל כמקור לחומרים מזינים החיוניים לבריאות טובה ולצמיחה של תאים. בדומה ל-LCM, FBS מכיל רמות משמעותיות של ביופטרין. בעוד שהרעבה מלאה של התאים בסרום לפני הגירוי נשקלה בתחילה באמצעות OptiMEM + 0.2% BSA, מקרופאגים הראו סימני ניתוק, המעידים על ירידה בכדאיות התאים כפי שתואר על ידי Bailey et al.6. עם זאת, מכיוון שמקרופאגים הדגימו דרישה מוחלטת לסרום, נבחר האנדוטוקסין FBS האולטרה-נמוך מבית BioWest. אצוות נבדקו לביופטרינים ונבחרו מראש לפני הרכישה בתפזורת כדי להבטיח אספקה אמינה ומוגדרת היטב. כדי להרחיק לכת יותר במטרה להפחית את המקורות המזהמים של ביופטרינים, נבדקו אפוא ריכוזים נמוכים יותר של FBS. במקום להשתמש ב-10% סרום כפי שמקובל בתרבית תאים, רמת ה-FBS נשמרת ל-5% לאורך 7 ימי התמיינות מח העצם למקרופאגים ומפחיתה עוד יותר ל-2% במהלך גירוי הלילה ביום האחרון. זה מבטיח רמות זניחות של ביופטרינים שזוהו אך מספיק חומרים מזינים לבריאות טובה ולהקפדה על מקרופאגים. למרות שפרוטוקול חדש זה שעבר אופטימיזציה באמצעות M-CSF רקומביננטי מביא לסביבה מבוקרת יותר לתרבית והפעלה של מקרופאגים ראשוניים, המגבלה העיקרית היא ששיטה זו יקרה יותר משימוש בשיטת LCM.
בהתחשב בכל הגורמים הללו, שתי השיטות הושוו ישירות. חשוב לציין שהפרוטוקול החדש ששונה כאן באמצעות M-CSF רקומביננטי ו-GM-CSF הביא למערכת ניתנת לשחזור יותר שבה המדיה הייתה נטולת זיהום BH4. ההשפעות של זה היו כפולות; תאים עם מחסור ב-BH4 היו באמת חסרים BH4, מה שהביא להצטברות ניטריט מינימלית הניתנת לזיהוי במדיה בעקבות גירוי למצב M1 עם LPS. זאת בניגוד לאותם תאי BMDM בתרבית ב-LCM, שם זוהו BH4 וניטריט משמעותיים.
לסיכום, כוחה של שיטה זו טמון במאמץ של שליטה ברמות הביופטרינים על ידי הערכה יסודית של כל פרמטר שיכול להשפיע על NO ואיתות חמצון-חיזור במקרופאג'ים. בפרט, זה מבטיח יכולת שכפול וסטנדרטיזציה מקסימלית בתחום הביולוגיה של NO-redox.
Disclosures
המחברים מצהירים שאין להם אינטרסים מתחרים.
Acknowledgements
עבודה זו נתמכה על ידי מלגת הביניים של קרן הלב הבריטית שהוענקה ל- M.J.C. (FS/14/56/31049), מענקי תוכנית קרן הלב הבריטית (RG/17/10/32859 ו- RG/12/5/29576), Wellcome Trust (090532/Z/09/Z) ומרכז המחקר הביו-רפואי של אוקספורד למחקר (NIHR). המחברים רוצים גם להודות על תמיכה ממרכז BHF למצוינות במחקר, אוקספורד (RE/13/1/30181 ו-RE/18/3/34214)
Materials
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | 1mL 6% LUER syringe |
| 10 mL plastic syringe | Fisher scientific | 14955453 | |
| 6 well plate sterile non-treated | CytoOne | CC7672-7506 | Flat bottom |
| DMEM/F-12 (1:1) (1x) | Gibco, Life Technologies | 21331-020 | |
| DMSO sterile | Sigma-aldrich | D2650-100ML | |
| Easy flask 260 mL | Thermo Scientific | 156800 | |
| L-Glutamine Solution 200 mM | Sigma-aldrich | G7513-100ML | |
| Lipopolysaccharides from Escherichia coli O111:B4 | Sigma-aldrich | L4391-1MG | |
| Mutlidish 12 sterile non-treated | Thermo Scientific | 150200 | Flat bottom |
| Needle 25G, 0.5 x 16 mm | BD Microlance 3 | 300600 | |
| PBS (pH7.4, 1x) | Gibco, Life Technologies | 10010-015 | |
| Penicillin-Streptomycin | Sigma-aldrich | P0781-100ML | |
| petri dish 100 x15 mm sterile | Falcon, Corning incorporated | 351029 | |
| Recombinant murine GM-CSF | PEPROTECH | 315-03 | |
| Recombinant murine IFN-γ | PEPROTECH | 315-05 | |
| Recombinant murine M-CSF | PEPROTECH | 315-02 | |
| Scalpel n23 | Swann-Morton | 0510 | |
| Ultra-low endotoxin FBS | Biowest | S1860-500 | |
| VWR cell strainers 70 µm nylon | VWR | 732-2758 |
References
- Zajd, C. M., et al. Bone marrow-derived and elicited peritoneal macrophages are not created equal: The questions asked dictate the cell type used. Frontiers in Immunology. 11, 269 (2020).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Zhao, Y. L., et al. Comparison of the characteristics of macrophages derived from murine spleen, peritoneal cavity, and bone marrow. Journal of Zheijang University Science B. 18 (12), 1055-1063 (2017).
- Nasser, H., et al. Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages. Cell Death Discovery. 6, 63 (2020).
- Stanley, E. R., Heard, P. M. Factors regulating macrophage production and growth. Purification and some properties of the colony stimulating factor from medium conditioned by mouse L cells. Journal of Biological Chemistry. 252 (12), 4305-4312 (1977).
- Bailey, J. D., et al. Isolation and culture of murine bone marrow-derived macrophages for nitric oxide and redox biology. Nitric Oxide. 100-101, 17-29 (2020).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- McNeill, E., et al. Regulation of iNOS function and cellular redox state by macrophage Gch1 reveals specific requirements for tetrahydrobiopterin in NRF2 activation. Free Radical Biology and Medicine. 79, 206-216 (2015).
- McWhorter, F. Y., Wang, T., Nguyen, P., Chung, T., Liu, W. F. Modulation of macrophage phenotype by cell shape. Proceedings of the National Academy of Sciences of the United States of America. 110 (43), 17253-17258 (2013).
- Bailey, J. D., et al. Nitric oxide modulates metabolic remodeling in inflammatory macrophages through TCA cycle regulation and itaconate accumulation. Cell Reports. 28 (1), 218-230 (2019).
- Hamilton, T. A., Zhao, C., Pavicic, P. G., Datta, S. Myeloid colony-stimulating factors as regulators of macrophage polarization. Frontiers in Immunology. 5, 554 (2014).
- Na, Y. R., et al. GM-CSF induces inflammatory macrophages by regulating glycolysis and lipid metabolism. Journal of Immunology. 197 (10), 4101-4109 (2016).
- Sorgi, C. A., et al. GM-CSF priming drives bone marrow-derived macrophages to a pro-inflammatory pattern and downmodulates PGE2 in response to TLR2 ligands. PLoS One. 7 (7), 40523 (2012).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved