Method Article
NO-Redox生物学研究のための骨髄由来マクロファージの単離と 体外 培養
* これらの著者は同等に貢献しました
要約
このプロトコルは、NO-酸化還元生物学を研究するために、テトラヒドロビオプテリン(BH4)および誘導性一酸化窒素合成酵素(iNOS)欠損初代マウスマクロファージを培養するために確立されている。この研究は、実験結果と結果の解釈を混乱させる可能性のある従来の単離および培養方法に見られるBH4およびその他の人工物の潜在的な汚染を減らすことに焦点を当てています。
要約
マクロファージは、全身の造血前駆細胞に由来し、炎症過程の中心であり、自然免疫応答および適応免疫応答に関与する。マクロファージの インビトロ 研究は、腹膜からの エキソビボ 培養によって、または骨髄由来マクロファージ(BMDM)を形成する骨髄前駆細胞の分化を介して行うことができる。前駆体からのマクロファージ分化に対する一般的なアプローチは、L929細胞(LCM)からの馴化培地の使用を含む。このメディアは自己生産が容易ですが、バッチ変動性に悩まされ、その構成要素は未定義です。同様に、胎児ウシ血清(FBS)は成長をサポートするために使用されますが、バッチ間で異なる可能性のある未定義の分子の膨大な混合物が含まれています。これらの方法は、誘導性一酸化窒素合成酵素(iNOS)からのNOの産生に必要な酸化還元機構またはテトラヒドロビオプテリン(BH4)などの補因子の補足レベルを妨害するかなりの量の小分子を含むため、一酸化窒素生物学および酸化還元機構の研究には不十分である。この報告では、細胞の増殖および分化に適した条件を維持しながら、外因性ビオプテリンのレベルを低下させることによって、NO-酸化還元環境の制御を可能にする最適化されたプロトコルを提示する。培養培地組成の厳密な制御は、実験の再現性を確保し、結果の正確な解釈を容易にするのに役立ちます。このプロトコールにおいて、BMDMsは、GTPシクロヒドロラーゼ(GCH)−欠損マウスモデルから得られた。BMDMの培養は、(i)馴化LCM、または(ii)組換えM-CSFおよびGM-CSFのいずれかを含む培地を用いて実施し、BH4およびNO欠損培養条件を得ながら最小限のアーティファクトを産生し、したがって 、インビトロでのNO酸化還元生物学および免疫代謝の再現性のある研究を可能にした。
概要
マクロファージは、多種多様な疾患および状態において興味深い細胞型として確立されており、その多くは自然免疫に対する彼らの伝統的な焦点とは無関係に見える。マクロファージの生理学は、それらが常駐している組織または環境に大きく依存しているため、それらの機能および関連する様々な経路を研究するために多くの方法およびモデルが出現している。歴史的に、RAW264.7などのマクロファージ細胞株がこの分野を支配していましたが、これらはさまざまな初代細胞モデルに取って代わられて徐々に置き換えられてきました。例えば、マウスマクロファージは、チオグリコレートによる処理後の腹膜洗浄から単離され得る。組織常駐細胞の研究に有用なモデルを提供する一方で、これらの腹膜マクロファージは、様々な外部刺激に対してより抑制された応答を示すことが示されており、それによって、多くの下流用途に対するそれらの適合性が制限されている1。
別の方法として、骨髄中の骨髄系前駆細胞に由来する骨髄由来マクロファージ(BMDM)は、成熟およびマクロファージに関連する様々な古典的な表現型、M0(ナイーブ、非活性化)、M1(炎症促進性、通常はLPS / IFNで活性化される)およびM2(プロ分解能、通常はIL-4で活性化される)2を含むマクロファージ生物学の様々な側面を研究するための貴重なモデルとして浮上してきた。3.しかしながら、骨髄系前駆細胞のBMDMへの分化は、培養培地4、5中のマクロファージコロニー刺激因子(M−CSF)の存在に依存する。これは、培地に添加された精製タンパク質の形態で、またはL929馴化培地(LCM)から供給され得る。BMDMs(コストと効率)を使用する利点は、様々な刺激(サイトカイン、代謝中間体、およびRNS/ROS)に対する感受性によって提示される限界と比較検討されなければならない。
以前のデータは、LCMの内容が定義が不十分で本質的に可変であり、その結果、外因性化合物の存在によって大きく影響される可能性があるため、信頼性が低く、様々な下流用途、特にNOまたは酸化還元生物学に関連する用途には適さないことを示している6。したがって、この詳細なプロトコルは、明確に定義されたDMEM:バッチ間変動の少ないF12培地の使用、および組換えマウスM-CSFおよびGM-CSF(顆粒球-マクロファージコロニー刺激因子)の添加を要求する。さらに、組織培養培地中のサプリメントとして典型的に使用されるウシ胎児血清は、定義が不十分な化合物および固有の変動性のさらに別の供給源を提供する。したがって、BMDMの信頼できる培養を保証するために、そのような添加剤の使用を制御し、最適化する必要があります。FBSの定義された低エンドトキシン源を使用し、単一バッチが一括購入されることを保証することによって、培養条件が確実に定義され、再現性が保証される。本明細書に記載のプロトコールは、フローサイトメトリー6によってマクロファージ表面マーカーCD45およびCD11bについて評価した場合に95%以上の純度のマクロファージ培養物を産生することが実証されている。
プロトコル
すべての動物処置は、オックスフォード大学倫理委員会および1986年英国内務省動物(科学的手順)法に従って承認され、実施されました。すべての手順は、欧州議会の指令2010/63/EUに準拠しています。
1. 骨髄細胞の単離
- 野生型(C57BL/6)、またはGch1欠損型(R26-CreERT2Gchfl/fl)マウス(10~16週齢)を子宮頸部脱臼により屠殺し、後肢を採取する。
注:どちらの性別も優先されません。年齢が一致した雌は、雄の雌よりもわずかに小さくなり、出発物質の初期収量に影響する。- 汚染のリスクを減らすために、マウスに70%エタノールをスプレーします。
- 解剖ハサミで腹部に小さな切り傷をつけて、体から毛皮や皮膚を取り除きます。皮膚を剥がして後肢の筋肉を露出させます。
- マウスを腹部に置き、膝関節から持ち上げて腰に圧力をかけて後肢を脱臼させます。脱臼は股関節で感じることができます。
- 股関節の筋肉を慎重に切断して後肢を取り除き、大腿骨に損傷が生じないようにします。
- 足首の関節の上に切り、足を取り外し、足から残りの皮膚をきれいにします。
- 解剖した脚を25mLの氷冷PBS(抗生物質不要)を含む50mLチューブに入れ、氷の上に置きます。
注:複数の動物を解剖することができ、足は氷の上にとどまる。
- 組織培養フード内の滅菌条件下で、脚から筋肉を除去し、骨の端部を除去して骨髄を露出させる。
- 汚染を減らし、毛皮や残留物を洗い流すために、脚を70%エタノールに2分間入れます。
- 足を清潔で無菌の細菌学的ペトリ皿に移す。鉗子とメスを使って、刃の側面で骨に沿ってしっかりと慎重にこすり、筋肉を取り除きます。プロセスを容易にするために腱を切断します。
- 各骨の四肢の骨端を取り除き、骨髄を露出させる。大腿骨は、それぞれの関節のすぐ近くで、両端で切断される。
- 脛骨は、膝関節のすぐ近く、上部、および腓骨との交差点のすぐ上で切断される。
- PBSで骨から骨髄を洗い流し、50mLの滅菌チューブに集めます。
- 10 mL シリンジに 10 mL の PBS を充填し、25 G x 0.5 x 16 mm の針に取り付けます。これは、1匹のマウスからすべての骨を洗い流すのに十分です。
- 針を骨の髄腔に挿入し、1〜2mLのPBSで骨髄を静かに洗い流し、針を骨を通して上下に動かして、すべての骨髄が外れるようにします。
- すべての骨について繰り返し、洗い流された骨髄をきれいなペトリ皿に集める。
- 滅菌された1mLシリンジを使用して、塊が壊れるまで懸濁液をシリンジに5〜10回出し入れすることによって骨髄を分解する。
- 分解した骨髄を1 mLシリンジに集め、70 μMの細胞ストレーナーに通して清潔な50 mL遠沈管に入れます。採取した骨髄を氷の上に置き、さらにサンプルを採取する。
メモ: 図 1 - パート 1 のプロトコルスキームを参照してください。
2. BMDMの選択、分化、刺激
- 後で使用するために骨髄を凍結するには、1000 x g で5分間遠心分離して骨髄をペレット化し、5%ジメチルスルホキシド(DMSO)を含む2mLの低エンドトキシンFBSに再懸濁する。
- 骨髄懸濁液を1000 x g で室温(RT)で5分間遠心分離する。血まみれのペレットが形成されます。
- 上清を捨てる。
- ペレットを5%DMSOを含む2mLの低エンドトキシンFBSに穏やかに再懸濁し、-80°Cで一晩凍結してから気相液体窒素に移して長期保存する。
- 骨髄をすぐに使用するには、骨髄をメッキする前に赤血球を溶解します。
- 骨髄懸濁液を1000 x g でRTで5分間遠心分離する。血まみれのペレットが形成されます。
- ペレットを3mLの1x赤血球溶解バッファーに再懸濁し、RTで5分間インキュベートする。
- 10 mL の PBS を加え、RT で 1000 x g で 5 分間遠心分離します。
- ステップ 2.3.5 から続行して、すぐに使用できるようにセルをプレートします。
- マクロファージを解凍し、細胞をペレット化する前に3mLのプレーティング培地に再懸濁する。
- DMEMを調製する:5%低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミンおよび25ng/mL M-CSF.を含むF12。
注:M-CSFおよびGM-CSFは、乾燥タンパク質を0.1%滅菌BSAを含む滅菌水に再懸濁することによって調製することができ、アリコートは後で使用するために-80°Cで凍結することができる。 - 凍結細胞懸濁液を37°Cで速やかに解凍する。
- 細胞懸濁液(0.5 mL)を、調製したDMEM:F12培地の3 mLを含む清潔で滅菌されたチューブに移す。
- RTで5分間、1000 x g で遠心分離することにより細胞をペレット化する。
- ペレットを調製したDMEM:F12培地の3mL中に再懸濁する。
- 好ましい方法で細胞を計数する。
- DMEMを調製する:5%低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミンおよび25ng/mL M-CSF.を含むF12。
- 0日目:セルをプレートします。
- DMEM中の非TCコーティングプラスチック製品中の細胞をプレートする:5%低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミン、および25ng/mL M-CSFを含むF12培地。
注:代表的な播種密度は 表1に記載されている。1匹のマウスからの脚の完全なペアは、1500万〜2000万個の前駆細胞を提供する。 - 細胞を5%CO2と共に37°Cでインキュベートする。
- DMEM中の非TCコーティングプラスチック製品中の細胞をプレートする:5%低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミン、および25ng/mL M-CSFを含むF12培地。
- 5日目:細胞に餌をやる。
- 5%の低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミン、および50ng/mL M-CSF:50ng/mL M-CSF:50%低エンドトキシンFBSを含むF12培地に、元の容量の50%を加えて細胞に供給します。
- 6日目:GM-CSFで細胞を刺激する。
- 調製したGM-CSFを終濃度50ng/mLに細胞上の細胞培養培地に直接加える。
- メディアを準備済みの DMEM: F12 と交換します。
- セルからすべてのメディアを取り出します。
- 予め加温したPBSで細胞を短時間洗浄する。
- DMEMを追加:2%低エンドトキシンFBS、1xペニシリン/ストレプトマイシン、L-グルタミン、25ng/mL M-CSF、および50ng/mL GM-CSFを含むF12培地。
- ステップ2.7.5-2.7.7で説明されている刺激でマクロファージをM0、M1、またはM2表現型に活性化する。
- M0 - 刺激は必要ありません。細胞を培地中で一晩インキュベートする。
- M1 - 100 ng/mL LPSおよび10 ng/mL IFNγ(最終濃度)で細胞を一晩刺激する。
- M2 - 100 ng/mL の IL-4 (最終濃度) で細胞を一晩刺激します。
- 8日目:細胞を回収する。
- 細胞から培地を除去します(培地を収集し、下流アッセイのために-80°Cで凍結します)。
- 細胞を氷冷PBS(培地容量の50%)中で5分間インキュベートする。
- 穏やかな掻き取りまたは繰り返しピペッティングでプレートからセルを取り外します。
- RTで5分間、2500 x g で遠心分離することにより細胞をペレット化する。
- 後で使用するために、細胞ペレットを-80°Cで凍結する。
メモ: プロトコルスキーム 図 1 - パート 2 を参照してください。
結果
マクロファージにおけるこのプロトコールの効率を実証する前に、亜硝酸塩、およびBH4レベルを、10%のLCMまたは組換えM−CSFおよびGM−CSFのみを含むFBSの10%を添加した培地で評価した。亜硝酸塩は、一酸化窒素代謝の最終生成物として長い間考えられてきたが、現在では一酸化窒素の生理学的貯蔵とみなされており、これは必要なときにリサイクルすることができ、したがって、一酸化窒素バイオアベイラビリティの指標としてしばしば使用されている7。BH4は、NO生産のためのNOSの必須補因子である。 図2に見られるように、10%FBSを補充した培地は、M-CSF/GM-CSFまたはLCMに関係なく、同様の亜硝酸塩レベルを有していた。しかしながら、異なるLCMバッチ間でより多くの変動性は観察されなかった。この観察はBH4測定にも適用された。実際、LCMの1つのバッチ(バッチ#3)は、他の2つ(バッチ#1および#2)よりもBH4のレベルが有意に高かった。さらに、LCMバッチは、10%FBSおよび組換えサイトカインを補充した培地よりも有意に多くのビオプテリンを含んでいた。バッチ間の総ビオプテリンの有意な変動も測定した。これらの結果は、LCMよりも変動の少ないM-CSF源を使用することの重要性を示しています。
さらに、10%FBSを補充した培地は、2%または5%のFBSを含有する培地と比較して有意に高いレベルの亜硝酸塩を含んでいた。10%と5%の差はBH4について非常に有意であった(p<0.05)。しかし、同様のレベルのビオプテリンが定量化された。対照的に、OptiMEM + 0.2%BSAは亜硝酸塩およびBH4を欠いていたため、非常にクリーンで適切な媒体であった。しかしながら、Baileyらによって記載されているように、OptiMEMはマクロファージを刺激する際に一晩で1回のみ使用されることを意味するが、飢餓による細胞死は観察されなかった。DMEM:FBSの2%を補充したF12は、この問題を克服するために選択され、健康な細胞を得るために十分な栄養素を含みながら、亜硝酸塩およびBH4汚染を最小限に抑えた。実際、いくつかの亜硝酸塩が検出されているにもかかわらず、LPS/IFN刺激WTマクロファージ(1 x 106細胞で30-80 μM;データは示さず)と比較して、レベルはごくわずか(〜0.2μM )である。
実験データ、新しいBH4欠損マウスモデルからのBMDMの単離と特性評価、R26-CreERT2Gchfl/flでこの改良されたプロトコルを検証するために、ここでは紹介します。BH4はGTPシクロヒドロラーゼI(Gch1)遺伝子により産生される。図3Aに示すように、Gch1の欠乏は、BH4の喪失および結果としてのNOおよびその後の亜硝酸塩の消失をもたらし、そしてMcNeillらによって以前に実証されたように酸化ストレスを引き起こすスーパーオキシドアニオンの増加をもたらす8。このプロトコルはすでに明確に定義されており、Gch fl/fl T2Cモデル6,8などの異なるCre系からの他のBH4欠損マクロファージを培養するために使用されていますが、R26-CreER T2 Gchfl/flモデルは、Cre-ER T2系の条件付き活性化を利用してタモキシフェン治療後のGch1遺伝子を除去するため、ユニークです(図3B、これにより、さまざまな時点でのノックアウトと、車両対タモキシフェン治療の形での内部制御の使用が可能になります。この例では、細胞を、1日目および3日目にビヒクル(95%エタノール)または0.1/1.0μM 4-OHタモキシフェンのいずれかで処理した(ビヒクルおよびタモキシフェンストックの両方を、既存の培養体積の1mLに0.7/7.0μL添加する前に培地で1:100希釈)。
図3Dに見られるように、GTPCHタンパク質は、R26-CreERT2Gch fl/fl細胞ではタモキシフェン処理後に消失するが、Gch fl/fl細胞では消失しない。重要なことに、R26-CreERT2Gch fl/flおよびGchfl/fl制御細胞の両方が、LPS/IFN刺激後もiNOSを産生することができる(図3B、C)。Gch1遺伝子発現におけるこれらの変化およびGTPCHタンパク質における結果として生じる変化は、細胞内BH4レベルを有意に乱し、亜硝酸塩の産生を減弱させた。図4に示すように、R26-CreERT2Gch fl/flマウスから単離および培養されたBMDMは、タモキシフェン存在下での対照GCH fl/fl細胞からのBMDMと比較して、培地中でのBH4産生の有意な減少および亜硝酸塩蓄積の減少を示した。同様に、LCM培地で培養した同じ細胞も、消失したGch1発現を示した。これらの細胞は、おそらくBH4による培地およびFBSの汚染のために、4OHタモキシフェンによるGch1発現のノックアウト後も、依然としてかなりの量のBH4および亜硝酸塩を産生した。これは、L細胞含有培地で細胞を培養する上での新しい方法の明らかな改善を表している。
このモデルのさらなる特性評価は、異なる濃度のタモキシフェンに続く8日目における非活性化(M0)Gch fl/ flおよびR26-CreER T2Gchfl/fl BMDMとの間の形態に有意な差を示さない。 図5に示すように、両方のモデルは、細長い四肢を有する丸い形状からなる同量の接着細胞を示し、典型的には、非刺激マクロファージ9に期待される特徴を示す。
まとめると、これらの結果は、BMDMの単離および培養のこの方法が、マウスマクロファージの培養に適した純粋な細胞集団を提供することを実証する。この方法は、いくつかの培地製剤中に存在する外因性化合物の干渉なしにマウスマクロファージの培養を可能にする。
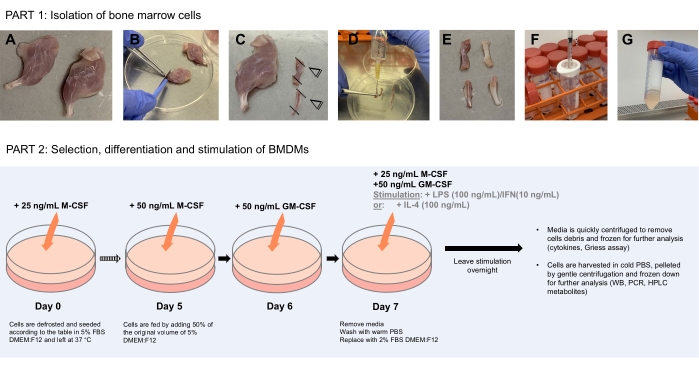
図1:骨髄細胞単離(パート1)からBMDMsの選択、分化、および刺激(パート2)を示す模式図。 (A)滅菌条件下で、解剖された脚は、70%エタノールで洗浄された後、清潔な細菌学的シャーレに入れられる。(B)骨に沿って鉗子とメスを掻きむしり、筋肉を慎重に取り除きます。(C)その後、骨の四肢を切り取り、骨髄を露出させる。(D)骨髄を骨の内腔に針を挿入することにより、10mLのPBSで満たされた10mLシリンジを用いて骨から洗い流す。(E)すべての骨髄が外れるように、針を骨を通して上下に動かす。骨は、その段階で白く透明に見えるはずで、取り除かれた骨髄はシャーレに集められます。(エフ-ジー)すべての骨について繰り返し、分解した骨髄を1mLシリンジに集め、70μmのセルストレーナーを通して清潔な50mL遠沈管に通す。スピンダウンし、後で使用するために凍結培地に細胞を再懸濁します。パート2はBMDMの選択、分化、および刺激を示しています この図の拡大版を見るにはここをクリックしてください。
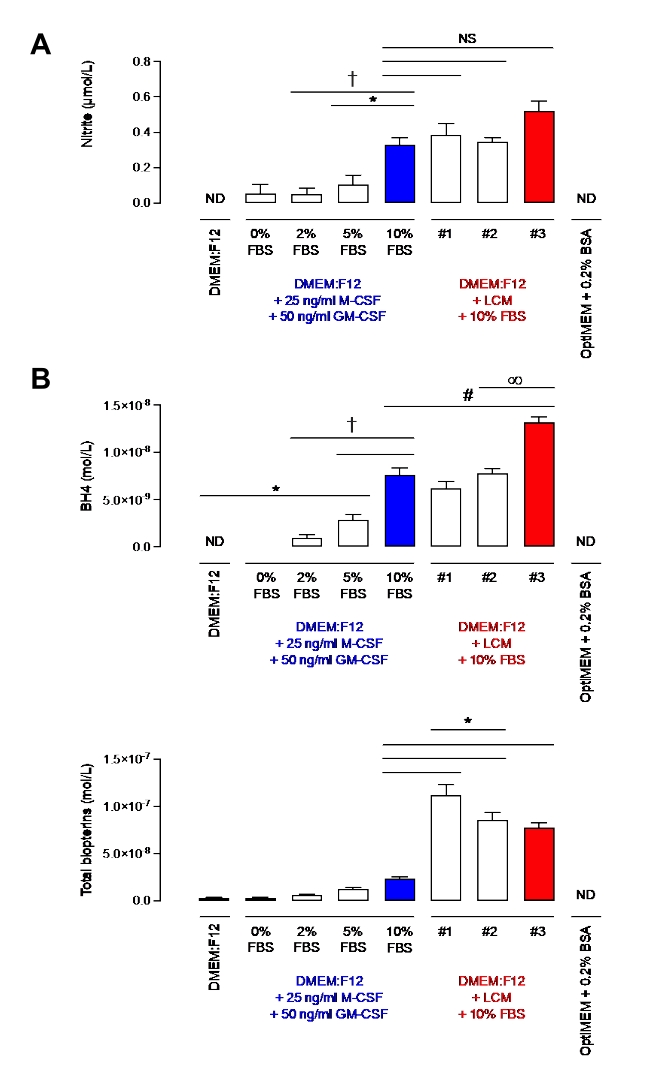
図2:DMEM中の亜硝酸塩およびBH4レベル:F12 + GM-CSF + M-CSFまたはDMEM:F12+ L細胞培地。 (A)異なる培地中の亜硝酸塩レベルは、グリースアッセイ法を用いて測定した。(b)BH4およびビオプテリンレベルを、BH4標準物質を用いたHPLC定量によって異なる培地で測定した。データはSD±平均(n=3)として表され、データは多重比較によって一元配置分散分析を用いて分析された。記号は、グループ間のp<0.05を表す。この図の拡大版を表示するには、ここをクリックしてください。
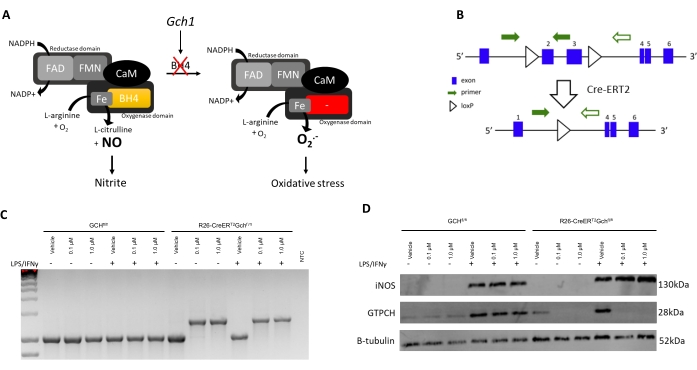
図3:R26CreERT2モデルの導入 (A)酸化還元生物学におけるNOS補因子としてのBH4の役割を示すスキーム。(B)このマウスモデルにおける隣接するloxP部位およびタモキシフェンによるCre-ERT2の条件付き活性化によるGch1における臨界エクソン(2および3)の切除を詳述した模式図。(c)BMDMsがタモキシフェンで処理された場合の重要なエクソンの切除を実証するPCR(n=3個の独立動物を表す)。WTマウスは1030 bp PCR産物を産生し、一方Creの存在下では1392 bp産物が産生され、重要なエクソンの切除を確認した。(d)iNOS、GCH、およびBチューブリンのイムノブロット(n=3個の独立動物を表す)。 この図の拡大版を表示するには、ここをクリックしてください。
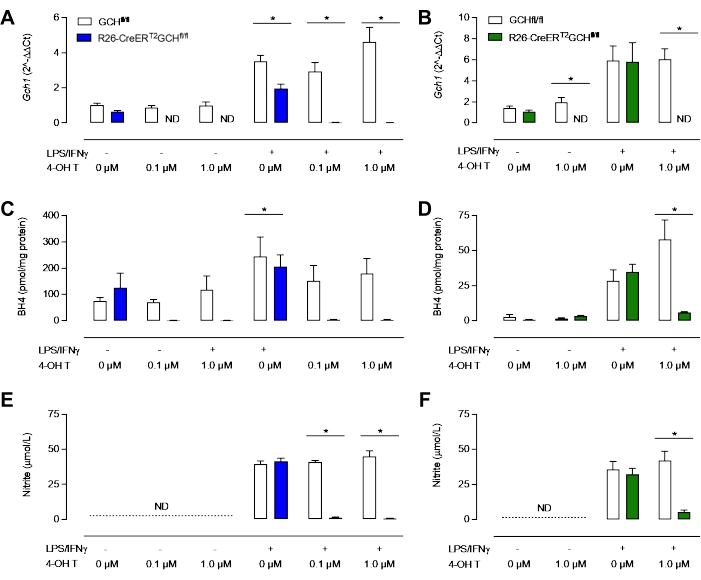
図4:マクロファージにおけるBH4欠損症の特性評価。(A,B)qRT-PCRは、タモキシフェンで処理したR26-CreERT2Gchfl/flモデルにおけるGch1発現の消失を確認する。青 = 新しい MCSF 法、緑 = 古典的な LCM 法。(C、D)HPLCによる細胞内BH4の分析は、0.1μMおよび1.0μMがBH4レベルを有意に低下させるのに十分であることを明らかにする。(E, F)Griessアッセイを用いた培地中の亜硝酸塩の測定は、非刺激BMDMが検出可能なレベルの亜硝酸塩を産生しないのに対し、Gch fl/flおよびR26-CreERT2Gch fl/fl BMDMがLPS/IFNγの存在下で亜硝酸塩を産生することを示している。有意に、R26-CreERT2Gchfl/flのタモキシフェン処理は、刺激BMDMにおける亜硝酸塩レベルを有意に低下させる。データは、(n = 3)±SDの平均として表される。記号は、グループ間のp<0.05を表す。この図の拡大版を表示するには、ここをクリックしてください。

図5:BMDMの形態の比較 タモキシフェンの様々な処置を伴う8日目のBMDMの光学顕微鏡観察によって得られた写真。スケールは画像に示されています。 この図の拡大版を表示するには、ここをクリックしてください。
| 文化料理 | メディアボリューム | シード密度 |
| 12ウェルディッシュ | 1キロリットル | 500,000 セル |
| 6ウェルディッシュ | 2キロリットル | 1,000,000 セル |
| 100 mmディッシュ | 10ミリリットル | 3,000,000 セル |
| 75 cm2 フラスコ | 15キロリットル | 5,000,000 セル |
表1:代表的な播種密度。
ディスカッション
このBH4およびNO欠損BMDMs培養プロトコルは、テトラヒドロビオプテリン(BH4)および他の干渉アーチファクトの減少を通じて、一次マクロファージにおけるNO酸化還元生物学を調査するように設計されており、これらの実験モデルから得られた結果の信頼性および再現性を高めることを目的としている。
重要な手順には、正しいプラスチック製品の使用が含まれます。マクロファージ前駆細胞は付着細胞であり、非常に粘着性がある。したがって、非組織培養(TC)処理プレートの使用は、他の前駆細胞からそれらを選択および単離する上で極めて重要であり、そうでなければ付着して純度を低下させる可能性がある。収穫日には、プレートからマクロファージを剥離するには氷冷PBSが必要ですが、EDTAを使用したり、下流の用途に応じて細胞を非常に穏やかに掻き取ったりすることもできます(例えば、溶解細胞と生細胞実験)。汚染についても特に注意が必要です。骨髄を洗い流している間、残った毛皮や皮膚からの細菌やウイルス粒子による潜在的な交差汚染が起こることがあります。その場合、できるだけ慎重かつ無菌であることが不可欠です。したがって、解剖した脚を70%エタノールで数分間急降下させることが奨励される。同様に、マクロファージを増殖させながら抗生物質を使用することを強くお勧めします。
このプロトコルの別の制限は、0日目の細胞プレーティング密度から生じる。フラッシュされた骨髄には様々な細胞が含まれており、それらは誤ってカウントされ、マクロファージ前駆細胞として含まれる可能性があり、したがって偽の総細胞数につながる。その後の潜在的な変動を避けるために、単離されたマクロファージを7日目に温かいPBSを用いて穏やかに洗い流し、刺激の少なくとも1時間前に2%FBS DMEM:F12で正しい密度で再播種して、付着を可能にすることができる。
最後に、増殖したマクロファージからの培地を用いたGriessアッセイによる亜硝酸塩レベルをチェックすることは、データを分析するために不可欠である。プラスの面では、このアッセイは迅速かつ安価に実行できます。
本明細書で実証されるように、このカスタマイズされたプロトコルは、L細胞馴化培地(LCM)を使用してマクロファージを単離および培養するために使用されるより一般的なプロトコルに対する、より定義され、改善された代替手段である。実際、酸化還元なしの生物学を研究する際にLCMを使用する主な懸念事項の1つは、かなりの量のビオプテリンが検出され、潜在的な代謝変化をもたらすことです10。例えば、外因性BH4は、欠損したモデルを迅速に補充し、iNOSの補因子として作用し、一酸化窒素の望ましくない産生をもたらす可能性がある。LCMを使用するもう一つの欠点は、その産生にある - LCMは、コロニー刺激因子、サイトカイン、およびL−929細胞によって直接分泌される他の副産物の混合物であり、これはすべてマクロファージ生理機能に影響を及ぼす可能性がある6。マクロファージの増殖と生存に不可欠なM-CSFの大量供給にもかかわらず、バッチ間の各成分の変動は、実験全体の変動のリスクを増大させる。
両方の問題に対処するために、この新しいプロトコルは、明確に定義されたDMEM:低レベルのビオプテリンを含むF12培地を使用し、それに制御された量の精製M-CSFおよびGM-CSFが添加される。両方のサイトカインは、マクロファージの分化および成長を助ける。M−CSFは、特に、造血幹細胞のマクロファージへの分化を保証することによって骨髄前駆細胞からのBMDMの生成をもたらす11。さらに、GM-CSFは、刺激前に添加すると炎症性サイトカインおよびNO産生を増強することが示されており、NO-酸化還元生物学を研究する際に真の利益となる12,13。
この新しい方法が対処するもう1つの主な要因は、通常、細胞の健康と成長に不可欠な栄養素の供給源として使用されるFBSの要因です。LCMと同様に、FBSには有意なレベルのビオプテリンが含まれています。刺激前の細胞の完全な血清飢餓は、当初、OptiMEM + 0.2% BSAを用いて検討されたが、マクロファージは剥離の徴候を示し、Baileyらによって記載されているように細胞生存率の低下を示した6。しかし、マクロファージが血清の絶対的必要量を示したため、BioWestの超低エンドトキシンFBSが選択されました。バッチはビオプテリンについてテストされ、信頼性が高く明確に定義された供給を保証するために、一括購入前に事前に選択されました。バイオプテリンの汚染源を減らすという目標をさらに進めるために、FBSの濃度の低下が試験された。細胞培養で一般的に使用される10%血清を使用する代わりに、FBSレベルは、骨髄からマクロファージへの7日間の分化を通して5%に保たれ、最終日の一晩の刺激中にさらに2%に低下する。これにより、検出されるビオプテリンのレベルはごくわずかですが、マクロファージの健康と遵守には十分な栄養素が保証されます。組換えM-CSFを用いたこの新しく最適化されたプロトコルは、初代マクロファージの培養および活性化のためのより制御された環境をもたらすが、主な制限は、この方法がLCM法を使用するよりも高価であるということである。
これらすべての要因を考慮に入れて、2つの方法を直接比較した。重要なことに、組換えM−CSFおよびGM−CSFを使用して本明細書に提示される新しく改変されたプロトコルは、培地がBH4を汚染することを欠いていた、より再現性のあるシステムをもたらした。この影響は2つありました。BH4欠損細胞はBH4を真に欠損しており、LPSによるM1状態への刺激後の培地中の検出可能な亜硝酸塩蓄積が最小限に抑えられた。これは、有意なBH4および亜硝酸塩が検出されたLCMで培養された同じBMDM細胞とは対照的であった。
結論として、この方法の強みは、マクロファージにおけるNOおよび酸化還元シグナル伝達に影響を及ぼす可能性のある各パラメータを徹底的に評価することによって、ビオプテリンレベルを制御する努力にある。特に、これはNO-酸化還元生物学分野における最大の再現性と標準化を保証します。
開示事項
著者らは、競合する利害関係を宣言していない。
謝辞
この研究は、M.J.(FS/14/56/31049)、英国心臓財団プログラム助成金(RG/17/10/32859およびRG/12/5/29576)、ウェルカム・トラスト(.C/Z/09/Z)、およびNIHリサーチ(NIHR)オックスフォード生物医学研究センターに授与された英国心臓財団中間フェローシップによって支援さ090532ました。著者らはまた、オックスフォードのBHF研究センター・オブ・リサーチ・エクセレンス(RE/13/1/30181およびRE/18/3/34214)からの支援に感謝したいと考えている。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | 1mL 6% LUER syringe |
| 10 mL plastic syringe | Fisher scientific | 14955453 | |
| 6 well plate sterile non-treated | CytoOne | CC7672-7506 | Flat bottom |
| DMEM/F-12 (1:1) (1x) | Gibco, Life Technologies | 21331-020 | |
| DMSO sterile | Sigma-aldrich | D2650-100ML | |
| Easy flask 260 mL | Thermo Scientific | 156800 | |
| L-Glutamine Solution 200 mM | Sigma-aldrich | G7513-100ML | |
| Lipopolysaccharides from Escherichia coli O111:B4 | Sigma-aldrich | L4391-1MG | |
| Mutlidish 12 sterile non-treated | Thermo Scientific | 150200 | Flat bottom |
| Needle 25G, 0.5 x 16 mm | BD Microlance 3 | 300600 | |
| PBS (pH7.4, 1x) | Gibco, Life Technologies | 10010-015 | |
| Penicillin-Streptomycin | Sigma-aldrich | P0781-100ML | |
| petri dish 100 x15 mm sterile | Falcon, Corning incorporated | 351029 | |
| Recombinant murine GM-CSF | PEPROTECH | 315-03 | |
| Recombinant murine IFN-γ | PEPROTECH | 315-05 | |
| Recombinant murine M-CSF | PEPROTECH | 315-02 | |
| Scalpel n23 | Swann-Morton | 0510 | |
| Ultra-low endotoxin FBS | Biowest | S1860-500 | |
| VWR cell strainers 70 µm nylon | VWR | 732-2758 |
参考文献
- Zajd, C. M., et al. Bone marrow-derived and elicited peritoneal macrophages are not created equal: The questions asked dictate the cell type used. Frontiers in Immunology. 11, 269 (2020).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Zhao, Y. L., et al. Comparison of the characteristics of macrophages derived from murine spleen, peritoneal cavity, and bone marrow. Journal of Zheijang University Science B. 18 (12), 1055-1063 (2017).
- Nasser, H., et al. Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages. Cell Death Discovery. 6, 63 (2020).
- Stanley, E. R., Heard, P. M. Factors regulating macrophage production and growth. Purification and some properties of the colony stimulating factor from medium conditioned by mouse L cells. Journal of Biological Chemistry. 252 (12), 4305-4312 (1977).
- Bailey, J. D., et al. Isolation and culture of murine bone marrow-derived macrophages for nitric oxide and redox biology. Nitric Oxide. 100-101, 17-29 (2020).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- McNeill, E., et al. Regulation of iNOS function and cellular redox state by macrophage Gch1 reveals specific requirements for tetrahydrobiopterin in NRF2 activation. Free Radical Biology and Medicine. 79, 206-216 (2015).
- McWhorter, F. Y., Wang, T., Nguyen, P., Chung, T., Liu, W. F. Modulation of macrophage phenotype by cell shape. Proceedings of the National Academy of Sciences of the United States of America. 110 (43), 17253-17258 (2013).
- Bailey, J. D., et al. Nitric oxide modulates metabolic remodeling in inflammatory macrophages through TCA cycle regulation and itaconate accumulation. Cell Reports. 28 (1), 218-230 (2019).
- Hamilton, T. A., Zhao, C., Pavicic, P. G., Datta, S. Myeloid colony-stimulating factors as regulators of macrophage polarization. Frontiers in Immunology. 5, 554 (2014).
- Na, Y. R., et al. GM-CSF induces inflammatory macrophages by regulating glycolysis and lipid metabolism. Journal of Immunology. 197 (10), 4101-4109 (2016).
- Sorgi, C. A., et al. GM-CSF priming drives bone marrow-derived macrophages to a pro-inflammatory pattern and downmodulates PGE2 in response to TLR2 ligands. PLoS One. 7 (7), 40523 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved