Method Article
NO-Redoks Biyolojisi Çalışması için Kemik İliği Kaynaklı Makrofajların İzolasyonu ve In vitro Kültürü
* Bu yazarlar eşit katkıda bulunmuştur
Bu Makalede
Özet
Bu protokol, NO-redoks biyolojisini incelemek için tetrahidrobiyopterin (BH4) ve indüklenebilir nitrik oksit sentaz (iNOS) eksikliği olan primer murin makrofajlarını kültürlemek için kurulmuştur. Çalışma, BH4'ün ve geleneksel izolasyon ve kültür yöntemlerinde bulunan ve deneysel sonuçları ve sonuçların yorumlanmasını karıştırabilecek diğer eserlerin potansiyel kontaminasyonunu azaltmaya odaklanmaktadır.
Özet
Makrofajlar vücuttaki hematopoetik progenitör hücrelerden türetilir, enflamatuar süreçlerin merkezindedir ve doğuştan gelen ve adaptif bağışıklık tepkilerine katılırlar. Makrofajların in vitro çalışması, peritondan ex vivo kültür veya miyeloid kemik iliği progenitör hücrelerinin kemik iliği kaynaklı makrofajlar (BMDM'ler) oluşturmak üzere farklılaştırılması yoluyla gerçekleştirilebilir. Öncüllerden makrofaj farklılaşmasına yönelik yaygın bir yaklaşım, L929 hücrelerinden (LCM) şartlandırılmış ortamların kullanılmasını içerir. Bu ortamın kendi kendine üretilmesi kolaydır, ancak parti değişkenliğinden muzdariptir ve bileşenleri tanımsızdır. Benzer şekilde, fetal sığır serumu (FBS) büyümeyi desteklemek için kullanılır, ancak partiler arasında değişebilen tanımlanmamış moleküllerin geniş bir karışımını içerir. Bu yöntemler, nitrik oksit biyolojisi ve redoks mekanizmalarının incelenmesi için yeterli değildir, çünkü her ikisi de redoks mekanizmalarına müdahale eden veya indüklenebilir nitrik oksit sentazdan (iNOS) NO'nun üretimi için gerekli olan tetrahidrobiyopterin (BH4) gibi kofaktörlerin ek seviyelerini içeren önemli miktarda küçük molekül içerir. Bu raporda, hücre büyümesi ve farklılaşması için uygun koşulları korurken, eksojen biyopterin seviyelerini azaltarak NO-redoks ortamının kontrolüne izin veren optimize edilmiş bir protokol sunuyoruz. Kültür ortamı kompozisyonunun sıkı kontrolü, deneysel tekrarlanabilirliğin sağlanmasına yardımcı olur ve sonuçların doğru yorumlanmasını kolaylaştırır. Bu protokolde, BMDM'ler GTP siklohidrolaz (GCH) eksikliği olan fare modelinden elde edildi. BMDM'lerin kültürü, BH4 ve NO-eksik kültür koşulları elde edilirken minimal artefaktlar üretmek için (i) şartlandırılmış LCM veya (ii) rekombinant M-CSF ve GM-CSF içeren ortamlarla gerçekleştirildi - böylece NO-redoks biyolojisi ve immünometabolizmanın in vitro olarak tekrarlanabilir çalışmasına izin verildi.
Giriş
Makrofajlar, çok çeşitli hastalıklarda ve koşullarda ilginç bir hücre tipi olarak kurulmuştur, birçoğu doğuştan gelen bağışıklığa geleneksel odaklanmalarıyla ilgisizdir. Makrofaj fizyolojisi, içinde bulundukları doku veya çevreye büyük ölçüde bağımlı olduğundan, işlevlerini ve ilgili çeşitli yolları incelemek için birçok yöntem ve model ortaya çıkmıştır. Tarihsel olarak, RAW264.7 gibi makrofaj hücre hatları alana hakim olmuştur, ancak bunlar yavaş yavaş çeşitli birincil hücre modelleri lehine değiştirilmiştir. Örneğin, murin makrofajları, tiyoglikolat ile tedaviyi takiben periton lavajından izole edilebilir. Dokuda yerleşik hücrelerin incelenmesi için yararlı bir model sağlarken, bu periton makrofajlarının çeşitli dış uyaranlara karşı daha bastırılmış bir yanıt gösterdikleri ve böylece birçok aşağı akış uygulaması için uygunluklarını sınırladıkları gösterilmiştir1.
Alternatif olarak, kemik iliğindeki miyeloid progenitör hücrelerden türetilen kemik iliği kaynaklı makrofajlar (BMDM'ler), olgunlaşma ve makrofajlarla ilişkili çeşitli klasik fenotipler, M0 (naif, aktive edilmemiş), M1 (pro-enflamatuar, genellikle LPS / IFN ile aktive edilir) ve M2 (pro-çözünürlük, genellikle IL-4 ile aktive edilir) dahil olmak üzere makrofaj biyolojisinin çeşitli yönlerini incelemek için değerli bir model olarak ortaya çıkmıştır. 3. Bununla birlikte, miyeloid progenitör hücrelerin BMDM'lere farklılaşması, kültür ortamında makrofaj koloni uyarıcı faktörünün (M-CSF) varlığına bağlıdır 4,5. Bu, ortama eklenen saflaştırılmış protein formunda veya L929 şartlandırılmış ortamdan (LCM) sağlanabilir. BMDM'leri kullanmanın avantajları (maliyet ve verimlilik), çeşitli uyaranlara (sitokinler, metabolik ara ürünler ve RNS / ROS) duyarlılıklarının sunduğu sınırlamalara karşı tartılmalıdır.
Önceki veriler, LCM'nin içeriğinin zayıf tanımlanmış ve özünde değişken olduğunu, bunun sonucunda çeşitli aşağı akış uygulamaları, özellikle de NO veya redoks biyolojisi ile ilgili olanlar için güvenilmez ve uygun olmadıklarını göstermektedir, çünkü bunlar eksojen bileşiklerin varlığından büyük ölçüde etkilenebilir6. Bu nedenle, bu ayrıntılı protokol iyi tanımlanmış DMEM'nin kullanılmasını gerektirir: Düşük partiden partiye varyasyona sahip F12 ortamı ve rekombinant murin M-CSF ve GM-CSF (Granülosit-makrofaj koloni-uyarıcı faktör) eklenmesi. Ayrıca, tipik olarak doku kültürü ortamında bir takviye olarak kullanılan fetal sığır serumu, kötü tanımlanmış bileşiklerin ve doğal değişkenliğin başka bir kaynağını sağlar. Bu nedenle, BMDM'lerin güvenilir kültürünü sağlamak için bu tür katkı maddelerinin kullanımını kontrol etmek ve optimize etmek gereklidir. Tanımlanmış bir düşük endotoksin FBS kaynağı kullanılarak ve tek partilerin toplu olarak satın alınmasını sağlayarak, kültür koşulları güvenilir bir şekilde tanımlanır ve tekrarlanabilirlik sağlanır. Burada açıklanan protokolün, akış sitometrisi6 ile makrofaj yüzey belirteçleri CD45 ve CD11b için değerlendirildiğinde% 95 saflığın üzerinde bir makrofaj kültürü ürettiği gösterilmiştir.
Protokol
Tüm hayvan prosedürleri, Oxford Üniversitesi etik komitesi ve İngiltere İçişleri Bakanlığı Hayvanları (Bilimsel Prosedürler) Yasası 1986 uyarınca onaylanmış ve gerçekleştirilmiştir. Tüm prosedürler Avrupa Parlamentosu'nun 2010/63/EU sayılı Direktifine uygundur.
1. Kemik iliği hücrelerinin izolasyonu
- Servikal çıkık ile vahşi tip (C57BL / 6) veya Gch1 eksikliği olan (R26-CreERT2Gch fl/ fl) fareleri (10-16 haftalık) kurban edin ve arka bacakları toplayın.
NOT: Her iki cinsiyet için de tercih yapılmaz. Yaş uyumlu dişiler, erkek meslektaşlarından biraz daha küçük olacak ve başlangıç malzemesinin ilk verimini etkileyecektir.- Kontaminasyon riskini azaltmak için farelere% 70 etanol püskürtün.
- Kürk ve cildi vücuttan çıkarmak için diseksiyon makası ile karında küçük bir kesim yapın. Arka bacaklardaki kası açığa çıkarmak için cildi soyun.
- Fareyi karnına yerleştirin ve diz ekleminden kaldırarak ve kalçalara baskı uygulayarak arka bacakları yerinden çıkarın. Çıkık kalça ekleminde hissedilebilir.
- Kalçadaki kası dikkatlice keserek arka bacakları çıkarın ve femurda herhangi bir hasar oluşmamasını sağlayın.
- Ayak bileği ekleminin üzerinde kesin, ayağı çıkarın ve kalan cildi bacaktan temizleyin.
- Disseke edilmiş bacakları 25 mL buz gibi soğuk PBS (antibiyotik gerekmez) ile 50 mL'lik bir tüpe yerleştirin ve buzun üzerine yerleştirin.
NOT: Birden fazla hayvan diseke edilebilir ve bacaklar buz üzerinde tutulabilir.
- Bir doku kültürü başlığında steril koşullar altında, kasları bacaklardan çıkarın ve kemik iliğini ortaya çıkarmak için kemiklerin uçlarını çıkarın.
- Kirlenmeyi azaltmak ve herhangi bir kürk veya kalıntıyı yıkamak için bacakları% 70 etanol içine 2 dakika boyunca yerleştirin.
- Bacakları temiz, steril, bakteriyolojik bir Petri kabına aktarın. Kasları çıkarmak için kemikleri bıçağın yan tarafıyla sıkıca ve dikkatlice kazımak için forseps ve neşter kullanın. İşlemi kolaylaştırmak için tendonları kesin.
- Kemik iliğini ortaya çıkarmak için her kemiğin ekstremitesindeki epifizi çıkarın. Femur her iki ucunda, ilgili eklemlerin hemen altında kesilir.
- Tibia üstte, diz ekleminin hemen altında ve altta fibula ile kesişme noktasının hemen üstünde kesilir.
- Kemik iliğini kemiklerden PBS ile yıkayın ve 50 mL'lik steril bir tüpte toplayın.
- 10 mL'lik bir şırıngayı 10 mL PBS ile doldurun ve 25 G x 0,5 x 16 mm'lik bir iğneye takın. Bu, tüm kemikleri bir fareden yıkamak için yeterlidir.
- İğneyi kemiğin medüller boşluğuna yerleştirin ve kemik iliğini 1-2 mL PBS ile nazikçe yıkayın, tüm kemik iliğinin yerinden çıkmasını sağlamak için iğneyi kemiğin içinden yukarı ve aşağı doğru çalıştırın.
- Tüm kemikler için tekrarlayın, kızarmış kemik iliğini temiz bir Petri kabında toplayın.
- Steril bir 1 mL şırınga kullanarak, herhangi bir topak parçalanana kadar süspansiyonu şırınganın içine ve dışına 5-10 kez çekerek kemik iliğini ayrıştırın.
- Ayrıştırılmış kemik iliğini 1 mL şırıngada toplayın ve 70 μM hücre süzgecinden temiz bir 50 mL santrifüj tüpüne geçirin. Toplanan kemik iliğini buzun üzerine yerleştirin ve daha fazla örnek alın.
NOT: Şekil 1 - Bölüm 1'deki protokol şemasına bakın.
2. BMDM'lerin seçimi, farklılaştırılması ve uyarılması
- Kemik iliğini daha sonra kullanmak üzere dondurmak için, kemik iliğini 5 dakika boyunca 1000 x g'de santrifüjleme yoluyla pelet ve% 5 Dimetil Sülfoksit (DMSO) içeren 2 mL düşük endotoksin FBS'de yeniden askıya alın.
- Kemik iliği süspansiyonunu oda sıcaklığında (RT) 5 dakika boyunca 1000 x g'de santrifüj yapın. Kan kırmızısı bir pelet oluşacaktır.
- Süper natantı atın.
- Peleti %5 DMSO içeren 2 mL'lik düşük endotoksin FBS'de nazikçe yeniden askıya alın ve uzun süreli depolama için buhar fazlı sıvı nitrojene aktarmadan önce gece boyunca -80 °C'de dondurun.
- Kemik iliğini hemen kullanmak için, kemik iliğini kaplamadan önce kırmızı kan hücrelerini lize edin.
- Kemik iliği süspansiyonunu RT'de 5 dakika boyunca 1000 x g'de santrifüj yapın. Kan kırmızısı bir pelet oluşacaktır.
- Peleti 3 mL 1x kırmızı kan hücresi lizis tamponunda yeniden askıya alın ve RT'de 5 dakika boyunca inkübe edin.
- 10 mL PBS ekleyin ve RT'de 5 dakika boyunca 1000 x g'de santrifüj yapın.
- Adım 2.3.5'ten devam ederek hücreleri hemen kullanmak üzere plakalayın.
- Makrofajların buzunu çözün ve hücreleri peletlemeden önce 3 mL kaplama ortamında yeniden askıya alın.
- DMEM'i hazırlayın:% 5 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin ve 25 ng / mL M-CSF içeren F12.
NOT: M-CSF ve GM-CSF, kurutulmuş proteinin% 0.1 steril BSA içeren steril suda yeniden askıya alınmasıyla hazırlanabilir ve alikotlar daha sonra kullanılmak üzere -80 ° C'de dondurulabilir. - Dondurulmuş hücre süspansiyonunu 37 ° C'de hızla çözün.
- Hücre süspansiyonunu (0,5 mL), hazırlanan DMEM: F12 ortamının 3 mL'sini içeren temiz, steril bir tüpe aktarın.
- RT'de 5 dakika boyunca 1000 x g'de santrifüjleme ile hücreleri pelet edin.
- Pelet, hazırlanan DMEM: F12 ortamının 3 mL'sinde yeniden askıya alın.
- Hücreleri tercih edilen bir yöntemle sayın.
- DMEM'i hazırlayın:% 5 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin ve 25 ng / mL M-CSF içeren F12.
- 0. Gün: Hücreleri plakalayın.
- DMEM'de TC kaplı olmayan plastik eşyalardaki hücreleri plakalayın: % 5 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin ve 25 ng / mL M-CSF içeren F12 ortamı.
NOT: Temsili tohumlama yoğunlukları Tablo 1'de açıklanmıştır. Bir fareden tam bir çift bacak, 15-20 milyon öncü hücre sağlar. - Hücreleri 37 ° C'de% 5 CO2 ile inkübe edin.
- DMEM'de TC kaplı olmayan plastik eşyalardaki hücreleri plakalayın: % 5 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin ve 25 ng / mL M-CSF içeren F12 ortamı.
- 5. Gün: Hücreleri besleyin.
- Orijinal DMEM hacminin% 50'sini ekleyerek hücreleri besleyin:% 5 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin ve 50 ng / mL M-CSF içeren F12 ortamı.
- 6. Gün: GM-CSF ile hücreleri uyarın.
- Hazırlanan GM-CSF'yi doğrudan hücreler üzerindeki hücre kültürü ortamına 50 ng / mL'lik bir son konsantrasyona ekleyin.
- Ortamı hazırlanmış DMEM ile değiştirin: F12.
- Tüm medyayı hücrelerden kaldırın.
- Hücreleri önceden ısıtılmış PBS'de kısaca yıkayın.
- DMEM ekleyin: % 2 düşük endotoksin FBS, 1x penisilin / streptomisin, L-glutamin, 25 ng / mL M-CSF ve 50 ng / mL GM-CSF içeren F12 ortamı.
- Makrofajları M0, M1 veya M2 fenotiplerine, adım 2.7.5-2.7.7'de açıklanan stimülasyonlarla aktive edin.
- M0 - Stimülasyon gerekmez. Hücreleri bir gecede medyada inkübe edin.
- M1 - Hücreleri gece boyunca 100 ng / mL LPS ve 10 ng / mL IFNγ (son konsantrasyonlar) ile uyarın.
- M2 - Gece boyunca 100 ng / mL IL-4 (son konsantrasyon) ile hücreleri uyarın.
- 8. Gün: Hücreleri hasat edin.
- Medyayı hücrelerden çıkarın (medyayı toplayın ve aşağı akış tahlilleri için -80 ° C'de dondurun).
- Buz gibi soğuk PBS'deki hücreleri (ortam hacminin% 50'si) 5 dakika boyunca inkübe edin.
- Hücreleri plakadan nazik kazıma veya tekrarlanan pipetleme ile ayırın.
- RT'de 5 dakika boyunca 2500 x g'de santrifüjleme ile hücreleri pelet edin.
- Daha sonra kullanmak üzere hücre peletlerini -80 °C'de dondurun.
NOT: Bkz. protokol şeması Şekil 1 - Bölüm 2.
Sonuçlar
Bu protokolün makrofajlardaki etkinliğini göstermeden önce, nitrit ve BH4 seviyeleri, LCM'nin% 10'unu veya sadece rekombinant M-CSF ve GM-CSF'yi içeren FBS'nin% 10'u ile desteklenmiş ortamlarda değerlendirildi. Nitrit, uzun süre nitrik oksit metabolizmasının bir son ürünü olarak kabul edilmesine rağmen, şimdi nitrik oksidin fizyolojik depolanması olarak kabul edilmektedir, bu da gerektiğinde geri dönüştürülebilir ve bu nedenle genellikle nitrik oksit biyoyararlanımının bir göstergesi olarak kullanılır7. BH4, NO üretimi için NOS'un önemli bir kofaktörüdür. Şekil 2'de görüldüğü gibi,% 10 FBS ile desteklenen medya, M-CSF / GM-CSF veya LCM'den bağımsız olarak benzer nitrit seviyelerine sahipti. Bununla birlikte, farklı LCM partileri arasında daha fazla değişkenlik gözlenmiştir. Bu gözlem BH4 ölçümü için de geçerlidir. Aslında, bir LCM partisi (parti #3), diğer ikisinden (parti #1 ve #2) önemli ölçüde daha yüksek bir BH4 seviyesine sahipti. Ayrıca, LCM partileri,% 10 FBS ve rekombinant sitokinlerle desteklenen ortamlardan önemli ölçüde daha fazla biyopterin içeriyordu. Toplam biyopterinlerin partiler arasındaki anlamlı değişkenliği de ölçüldü. Bu sonuçlar, LCM'den daha az değişken bir M-CSF kaynağı kullanmanın önemini göstermektedir.
Ayrıca,% 10 FBS ile desteklenen medya,% 2 veya% 5 FBS içeren ortamlara kıyasla önemli ölçüde daha yüksek nitrit seviyeleri içeriyordu. BH4 için %10 ile %5 arasındaki fark oldukça anlamlıydı (p < 0.05). Bununla birlikte, benzer biyopterin seviyeleri ölçülmüştür. Buna karşılık, OptiMEM +% 0.2 BSA, nitrit ve BH4'ten yoksundu, bu da onu çok temiz ve uygun bir ortam haline getirdi. Bununla birlikte, Bailey ve ark. tarafından tanımlandığı gibi, OptiMEM'in makrofajları uyarırken gece boyunca sadece bir kez kullanılması amaçlanmasına rağmen, açlığa bağlı hücre ölümü gözlenmiştir. DMEM: FBS'nin% 2'si ile takviye edilen F12, bu sorunun üstesinden gelmek için seçildi ve sağlıklı hücreler elde etmek için yeterli besin içerirken minimum nitrit ve BH4 kontaminasyonuna izin verdi. Gerçekten de, bazı nitritlerin tespit edilmesine rağmen, LPS / IFN uyarılmış WT makrofajlarına kıyasla seviyeler ihmal edilebilir düzeydedir (~ 0.2 μM) (1 x 106 hücre için 30-80 μM; veriler gösterilmemiştir).
Bu geliştirilmiş protokolü deneysel verilerle doğrulamak için, BMDM'lerin yeni bir BH4 eksikliği olan fare modelinden izolasyonu ve karakterizasyonu, R26-CreERT2Gch fl/ fl burada sunulmaktadır. BH4, GTP siklohidrolaz I (Gch1) geni tarafından üretilir. Şekil 3A'da gösterildiği gibi, Gch1'deki eksiklik, BH4 kaybına ve bunun sonucunda NO'nun ve daha sonra nitritin kaybolmasına ve daha önce McNeill ve ark.8 tarafından gösterildiği gibi oksidatif strese neden olan süperoksit anyonunda bir artışa yol açmaktadır. Bu protokol, Gch fl / fl T2C model6,8 gibi farklı Cre-sisteminden diğer BH4 eksikliği olan makrofajları kültürlemek için zaten iyi tanımlanmış ve kullanılmış olmasına rağmen, R26-CreER T2 Gchfl / fl modeli, tamoksifen tedavisini takiben Gch1 genini çıkarmak için Cre-ERT2sisteminin koşullu aktivasyonunu kullandığı için benzersizdir (Şekil 3B, C). Bu, çeşitli zaman noktalarında nakavt edilmesine ve iç kontrolün bir araca karşı tamoksifen tedavisi şeklinde kullanılmasına izin verir. Bu örnekte, hücreler 1. ve 3. günlerde araç (%95 Etanol) veya 0.1/1.0 μM 4-OH tamoksifen ile muamele edildi (hem araç hem de tamoksifen stoğu, mevcut kültür hacminin 1 mL'sine 0.7/7.0 μL eklenmeden önce ortamda 1:100 seyreltildi).
Şekil 3D'de görüldüğü gibi, GTPCH proteini, R26-CreERT2Gch fl / fl hücrelerinde Tamoksifen tedavisini takiben ortadan kaldırılır, ancak Gchfl / fl hücrelerinde kaldırılmaz. Önemli olarak, hem R26-CreERT2Gch fl / fl hem de Gch fl /fl kontrol hücreleri, LPS/ IFN stimülasyonunu takiben hala iNOS üretebilmektedir (Şekil 3B, C). Gch1 gen ekspresyonundaki bu değişiklikler ve bunun sonucunda GTPCH proteinindeki değişiklik, hücre içi BH4 seviyelerinin önemli ölçüde bozulmasına ve nitrit üretiminin azalmasına neden olmuştur. Şekil 4'te gösterildiği gibi, R26-CreERT2Gch fl / fl farelerinden izole edilen ve kültürlenen BMDM'ler, tamoksifen varlığında kontrol GCH fl/ fl hücrelerinden gelenlere kıyasla, BH4 üretimini önemli ölçüde azaltmış ve ortamdaki nitrit birikimini azaltmıştır. Benzer şekilde, LCM ortamında kültürlenen aynı hücreler de kaldırılmış Gch1 ekspresyonunu gösterdi; Her ne kadar bu hücreler Gch1 ekspresyonunun 4 OH tamoksifen ile nakavt edilmesinden sonra, muhtemelen BH4 ile ortam ve FBS'nin kontaminasyonu nedeniyle hem BH4 hem de nitritin önemli miktarlarda üretilmesine rağmen. Bu, hücrelerin L hücresi içeren ortamlarda kültürlenmesi üzerine yeni yöntemin açık bir gelişimini temsil eder.
Bu modelin daha ileri karakterizasyonu, farklı tamoksifen konsantrasyonlarını takiben 8. günde aktive edilmemiş (M0) Gch fl / fl ve R26-CreERT2Gchfl / fl BMDM'ler arasındaki morfolojide anlamlı bir fark göstermemektedir. Şekil 5'te gösterildiği gibi, her iki model de uzun ekstremitelere sahip yuvarlak bir şekilden yapılmış benzer miktarda yapışkan hücreyi, tipik olarak uyarılmamışmakrofajlardan beklenen özellikleri 9'u göstermektedir.
Birlikte ele alındığında, bu sonuçlar BMDM'lerin bu izolasyon ve kültür yönteminin, murin makrofajlarının kültürüne uygun saf bir hücre popülasyonu sağladığını göstermektedir. Bu yöntem, bazı ortam formülasyonlarında bulunan eksojen bileşiklerin müdahalesi olmadan murin makrofajlarının kültürüne izin verir.
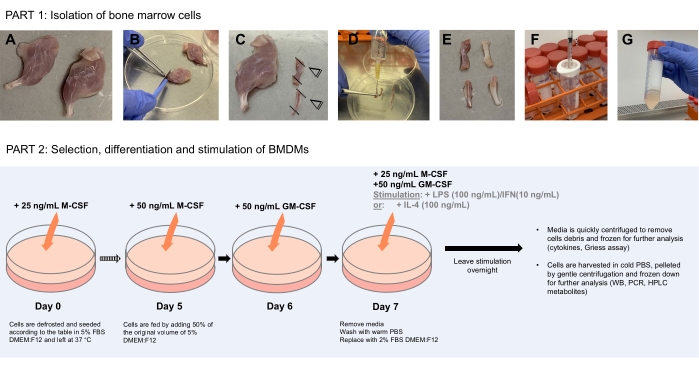
Şekil 1: BMDM'lerin seçimi, farklılaşması ve uyarılmasına kemik iliği hücrelerinin izolasyonunu (Bölüm 1) gösteren şematik diyagram (Bölüm 2). (A) Steril koşullar altında, disseke edilmiş bacaklar% 70 etanol içinde yıkandıktan sonra temiz bir bakteriyolojik petri kabına yerleştirilir. (B) Kaslar, kemikler boyunca forseps ve neşter kazıma kullanılarak dikkatlice çıkarılır. (C) Kemiklerin ekstremiteleri daha sonra kemik iliğini açığa çıkarmak için kesilir. (D) İğneyi kemiğin lümenine sokarak kemik iliği, 10 mL PBS ile doldurulmuş 10 mL'lik bir şırınga kullanılarak kemiklerden temizlenir. (E) İğne, tüm kemik iliğinin yerinden çıkmasını sağlamak için kemiğin içinden yukarı ve aşağı doğru çalıştırılır. Kemik, petri kabında toplanan yerinden çıkmış kemik iliği ile bu aşamada beyaz ve berrak görünmelidir. (F-G) Tüm kemikler için tekrarlayın, ayrıştırılmış kemik iliğini 1 mL şırıngada toplayın ve 70 μm'lik bir hücre süzgecinden temiz bir 50 mL santrifüj tüpüne geçirin. Döndürün ve daha sonra kullanmak üzere dondurucu ortamdaki hücreleri yeniden askıya alın. Bölüm 2, BMDM'lerin seçimini, farklılaşmasını ve uyarılmasını gösterir Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
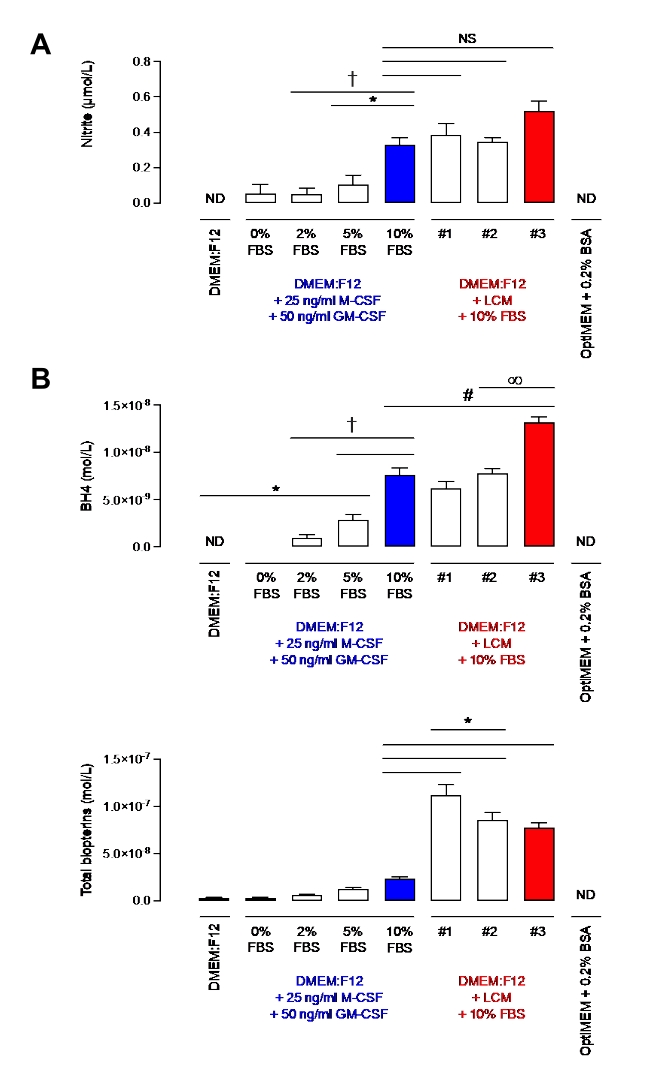
Resim 2: DMEM'deki nitrit ve BH4 seviyeleri: F12 + GM-CSF + M-CSF veya DMEM: F12 + L hücreli ortam. (A) Farklı ortamlardaki nitrit seviyeleri Griess Assay yöntemi kullanılarak ölçülmüştür. (B) BH4 ve biyopterin düzeyleri, BH4 standardı kullanılarak HPLC nicelleştirmesi ile farklı ortamlarda ölçülmüştür. Veriler ortalama (n=3) ± SD olarak ifade edilmiştir. veriler tek yönlü ANOVA kullanılarak çoklu karşılaştırmalarla analiz edilmiştir. Semboller gruplar arasında p < 0,05'i temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
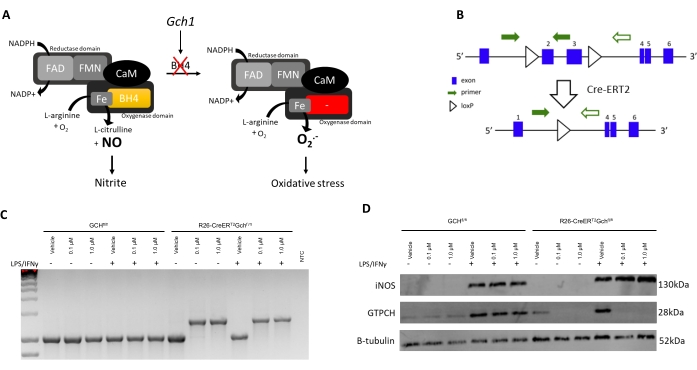
Şekil 3: R26CreERT2 modelinin tanıtımı . (A) BH4'ün redoks biyolojisinde NOS kofaktörü olarak rolünü gösteren şema. (B) Gch1'deki kritik ekzonların (2 ve 3) yandaki loxP bölgeleri nedeniyle eksizyonu ve bu murin modelinde Cre-ERT2'nin tamoksifen ile koşullu aktivasyonunu şematik olarak detaylandırmak. (C) BMDM'ler tamoksifen ile tedavi edildiğinde kritik ekzonun eksizyonunu gösteren PCR (n = 3 bağımsız hayvanın temsilcisi). WT fareleri 1030 bp'lik bir PCR ürünü üretirken, Cre'nin varlığında, kritik ekzonların eksizyonunu doğrulayan 1392 bp'lik bir ürün üretilir. (D) iNOS, GCH ve B-tübülinin immünoblotu (n = 3 bağımsız hayvanın temsilcisi). Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
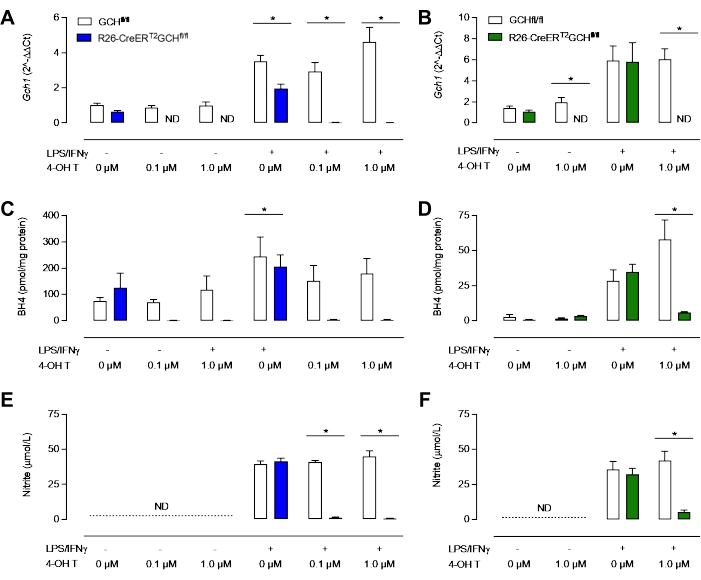
Şekil 4: Makrofajlarda BH4 eksikliğinin karakterizasyonu. (A,B) qRT-PCR, tamoksifen ile muamele edilen R26-CreERT2Gchfl / fl modelinde Gch1 ekspresyonunun kaybını doğrular. Mavi = Yeni MCSF yöntemi, Yeşil = klasik LCM yöntemi. (C,D) HPLC ile hücre içi BH4 analizi, BH4 seviyelerini önemli ölçüde azaltmak için 0.1 μM ve 1.0 μM'nin yeterli olduğunu ortaya koymaktadır. (E, F) Griess testi kullanılarak ortamdaki nitrit ölçümü, uyarılmamış BMDM'lerin tespit edilebilir nitrit seviyeleri üretmediğini, Gch fl / fl ve R26-CreERT2Gch fl /fl BMDM'lerin LPS/ IFNγ varlığında nitrit ürettiğini göstermektedir. R26-CreERT2Gch fl/ fl'nin tamoksifen tedavisi, uyarılmış BMDM'lerde nitrit seviyelerini önemli ölçüde azaltır. Veriler, (n = 3) ± SD'nin ortalaması olarak ifade edilir. Semboller gruplar arasında p < 0,05'i temsil eder. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.

Şekil 5: BMDM morfolojisinin karşılaştırılması. 8. günde BMDM'lerin optik mikroskopisi ile tamoksifenin değişen tedavisi ile elde edilen fotoğraflar. Ölçek resimde belirtilmiştir. Bu şeklin daha büyük bir versiyonunu görüntülemek için lütfen buraya tıklayın.
| Kültür Yemeği | Medya Hacmi | Tohumlama Yoğunluğu |
| 12 iyi yemek | 1 mL | 500.000 hücre |
| 6 iyi yemek | 2 mL | 1.000.000 hücre |
| 100 mm çanak | 10 mL | 3.000.000 hücre |
| 75 cm2 şişe | 15 mL | 5.000.000 hücre |
Tablo 1: Temsili tohumlama yoğunlukları.
Tartışmalar
Bu BH4- ve NO-eksik BMDM'ler kültür protokolü, bu deneysel modellerden elde edilen sonuçların güvenilirliğini ve tekrarlanabilirliğini arttırmak amacıyla, tetrahidrobiyopterin (BH4) ve diğer müdahale eden eserlerin azaltılması yoluyla birincil makrofajlarda NO-redoks biyolojisini araştırmak üzere tasarlanmıştır.
Kritik adımlar arasında doğru plastik eşyaların kullanılması yer almaktadır. Makrofaj progenitörleri yapışkan hücrelerdir ve çok yapışkandır; bu nedenle, doku dışı kültür (TC) ile muamele edilmiş plakaların kullanılması, bunların seçilmesinde ve izolasyonunda, aksi takdirde saflığı tutturabilecek ve azaltabilecek diğer progenitör hücrelerden izole edilmesinde çok önemlidir. Hasat gününde, makrofajların plakalardan ayrılması buz gibi soğuk PBS gerektirir, ancak EDTA kullanarak veya hatta hücreleri çok nazikçe kazıyarak, aşağı akış uygulamasına bağlı olarak yapılabilir (örneğin, lize karşı canlı hücreler deneyi). Kontaminasyon konusunda da özel dikkat gösterilmelidir. Kemik iliğini temizlerken, artık kürk ve deriden bakteri veya viral parçacıklarla potansiyel çapraz kontaminasyon meydana gelebilir. O zaman mümkün olduğunca dikkatli ve steril olmak önemlidir; bu nedenle disseke edilmiş bacakların birkaç dakika boyunca% 70 etanol içine daldırılması teşvik edilir. Benzer şekilde, makrofajları büyütürken antibiyotik kullanılması şiddetle tavsiye edilir.
Bu protokolün bir başka sınırlaması, 0. Gündeki hücre kaplama yoğunluğundan kaynaklanmaktadır. Kızarmış kemik iliği, yanlış sayılabilen ve makrofaj progenitörleri olarak dahil edilebilen çeşitli hücreler içerir, böylece yanlış bir toplam hücre sayısına yol açar. Sonraki ve potansiyel değişkenliği önlemek için, izole makrofajlar 7. Günde ılık PBS kullanılarak nazikçe yıkanabilir ve% 2 FBS DMEM: F12'de doğru yoğunlukta yeniden kaplanabilir.
Son olarak, nitrit seviyelerinin Griess testi ile yetişkin makrofajlardan elde edilen medyayı kullanarak kontrol edilmesi, verileri analiz etmek için zorunludur. Artı tarafta, bu tahlil hızlı ve ucuzdur.
Burada gösterildiği gibi, bu özelleştirilmiş protokol, L hücresi şartlandırılmış ortam (LCM) kullanarak makrofajları izole etmek ve yetiştirmek için kullanılan daha yaygın protokole daha tanımlanmış ve geliştirilmiş bir alternatiftir. Gerçekten de, NO-redoks biyolojisini incelerken LCM'yi kullanmanın ana endişelerinden biri, tespit edilen önemli miktarda biyopterindir ve potansiyel metabolik değişikliklere yol açmaktadır10. Örneğin, eksojen BH4, eksik modelleri hızla yenileyebilir ve iNOS için bir kofaktör görevi görerek istenmeyen nitrik oksit üretimine yol açabilir. LCM kullanmanın bir başka dezavantajı da üretiminde yatmaktadır - LCM, koloni uyarıcı faktörlerin, sitokinlerin ve doğrudan L-929 hücreleri tarafından salgılanan diğer yan ürünlerin bir karışımıdır ve bunların hepsi makrofaj fizyolojisini etkileyebilir6. Makrofajın çoğalması ve hayatta kalması için gerekli olan M-CSF'deki büyük arzına rağmen, her bileşenin partiden partiye değişimi, deneyler arasında değişkenlik riskini artırır.
Her iki sorunu da ele almak için, bu yeni protokol iyi tanımlanmış DMEM'yi kullanır: kontrollü miktarda saflaştırılmış M-CSF ve GM-CSF'nin eklendiği düşük düzeyde biyopterin içeren F12 ortamı. Her iki sitokin de makrofajların farklılaşmasına ve büyümesine yardımcı olur. M-CSF özellikle hematopoetik kök hücrelerin makrofajlara farklılaşmasını sağlayarak kemik iliği progenitör hücrelerinden BMDM'lerin üretilmesine yol açar11. Ek olarak, GM-CSF'nin, stimülasyondan önce eklendiğinde inflamatuar sitokin ve NO üretimini arttırdığı gösterilmiştir, NO-redoks biyolojisi12,13'ü incelerken gerçek bir fayda.
Bu yeni yöntemin ele aldığı diğer ana faktör, genellikle hücrelerin sağlığı ve büyümesi için gerekli olan bir besin kaynağı olarak kullanılan FBS'dir. LCM'ye benzer şekilde, FBS önemli düzeyde biyopterin içerir. Stimülasyondan önce hücrelerin tam serum açlığı başlangıçta OptiMEM +% 0.2 BSA kullanılarak düşünülürken, makrofajlar Bailey ve ark.6 tarafından tanımlandığı gibi azalmış hücre canlılığının göstergesi olan ayrılma belirtileri gösterdi. Bununla birlikte, makrofajlar serum için mutlak bir gereksinim gösterdiğinden, BioWest'ten Ultra Düşük Endotoksin FBS seçildi. Partiler biyopterinler için test edildi ve güvenilir ve iyi tanımlanmış bir tedarik sağlamak için toplu satın almadan önce önceden seçildi. Kirletici biyopterin kaynaklarını azaltma amacında daha ileri gitmek için, FBS'nin azalmış konsantrasyonları bu nedenle test edilmiştir. Hücre kültüründe yaygın olarak kullanılan% 10 serum kullanmak yerine, FBS seviyesi, kemik iliğinin makrofajlara 7 günlük farklılaşması boyunca% 5'te tutulur ve son günde gece stimülasyonu sırasında% 2'ye düşürülür. Bu, ihmal edilebilir seviyelerde biyopterin tespit edilmesini sağlar, ancak makrofajların sağlığı ve bağlılığı için yeterli besin maddesi sağlar. Rekombinant M-CSF kullanan bu yeni optimize edilmiş protokol, birincil makrofajların kültürü ve aktivasyonu için daha kontrollü bir ortamla sonuçlanmasına rağmen, ana sınırlama, bu yöntemin LCM yöntemini kullanmaktan daha pahalı olmasıdır.
Tüm bu faktörler göz önünde bulundurularak, iki yöntem daha sonra doğrudan karşılaştırıldı. Daha da önemlisi, burada rekombinant M-CSF ve GM-CSF kullanılarak sunulan yeni modifiye edilmiş protokol, ortamın BH4'ü kirletmekten yoksun olduğu daha tekrarlanabilir bir sistemle sonuçlandı. Bunun etkileri iki yönlüydü; BH4 eksikliği olan hücreler gerçekten BH4'ten yoksundu, bu da LPS ile M1 durumuna uyarıldıktan sonra ortamda minimum tespit edilebilir nitrit birikimi ile sonuçlandı. Bu, önemli BH4 ve nitritin tespit edildiği LCM'de kültürlenen aynı BMDM hücrelerinin aksineydi.
Sonuç olarak, bu yöntemin gücü, makrofajlarda NO ve redoks sinyallemesini etkileyebilecek her parametreyi iyice değerlendirerek biyopterin seviyelerini kontrol etme çabasında yatmaktadır. Özellikle, bu NO-redoks biyolojisi alanında maksimum tekrarlanabilirlik ve standardizasyon sağlar.
Açıklamalar
Yazarlar rakip çıkarlar olmadığını beyan ederler.
Teşekkürler
Bu çalışma, M.J.C.'ye verilen İngiliz Kalp Vakfı Orta Düzey Bursu (FS/14/56/31049), İngiliz Kalp Vakfı Programı hibeleri (RG/17/10/32859 ve RG/12/5/29576), Wellcome Trust (090532/Z/09/Z) ve NIH Araştırma (NIHR) Oxford Biyomedikal Araştırma Merkezi tarafından desteklenmiştir. Yazarlar ayrıca BHF Araştırma Mükemmeliyet Merkezi, Oxford'un (RE/13/1/30181 ve RE/18/3/34214) desteğini de kabul etmek ister.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | 1mL 6% LUER syringe |
| 10 mL plastic syringe | Fisher scientific | 14955453 | |
| 6 well plate sterile non-treated | CytoOne | CC7672-7506 | Flat bottom |
| DMEM/F-12 (1:1) (1x) | Gibco, Life Technologies | 21331-020 | |
| DMSO sterile | Sigma-aldrich | D2650-100ML | |
| Easy flask 260 mL | Thermo Scientific | 156800 | |
| L-Glutamine Solution 200 mM | Sigma-aldrich | G7513-100ML | |
| Lipopolysaccharides from Escherichia coli O111:B4 | Sigma-aldrich | L4391-1MG | |
| Mutlidish 12 sterile non-treated | Thermo Scientific | 150200 | Flat bottom |
| Needle 25G, 0.5 x 16 mm | BD Microlance 3 | 300600 | |
| PBS (pH7.4, 1x) | Gibco, Life Technologies | 10010-015 | |
| Penicillin-Streptomycin | Sigma-aldrich | P0781-100ML | |
| petri dish 100 x15 mm sterile | Falcon, Corning incorporated | 351029 | |
| Recombinant murine GM-CSF | PEPROTECH | 315-03 | |
| Recombinant murine IFN-γ | PEPROTECH | 315-05 | |
| Recombinant murine M-CSF | PEPROTECH | 315-02 | |
| Scalpel n23 | Swann-Morton | 0510 | |
| Ultra-low endotoxin FBS | Biowest | S1860-500 | |
| VWR cell strainers 70 µm nylon | VWR | 732-2758 |
Referanslar
- Zajd, C. M., et al. Bone marrow-derived and elicited peritoneal macrophages are not created equal: The questions asked dictate the cell type used. Frontiers in Immunology. 11, 269 (2020).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Zhao, Y. L., et al. Comparison of the characteristics of macrophages derived from murine spleen, peritoneal cavity, and bone marrow. Journal of Zheijang University Science B. 18 (12), 1055-1063 (2017).
- Nasser, H., et al. Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages. Cell Death Discovery. 6, 63 (2020).
- Stanley, E. R., Heard, P. M. Factors regulating macrophage production and growth. Purification and some properties of the colony stimulating factor from medium conditioned by mouse L cells. Journal of Biological Chemistry. 252 (12), 4305-4312 (1977).
- Bailey, J. D., et al. Isolation and culture of murine bone marrow-derived macrophages for nitric oxide and redox biology. Nitric Oxide. 100-101, 17-29 (2020).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- McNeill, E., et al. Regulation of iNOS function and cellular redox state by macrophage Gch1 reveals specific requirements for tetrahydrobiopterin in NRF2 activation. Free Radical Biology and Medicine. 79, 206-216 (2015).
- McWhorter, F. Y., Wang, T., Nguyen, P., Chung, T., Liu, W. F. Modulation of macrophage phenotype by cell shape. Proceedings of the National Academy of Sciences of the United States of America. 110 (43), 17253-17258 (2013).
- Bailey, J. D., et al. Nitric oxide modulates metabolic remodeling in inflammatory macrophages through TCA cycle regulation and itaconate accumulation. Cell Reports. 28 (1), 218-230 (2019).
- Hamilton, T. A., Zhao, C., Pavicic, P. G., Datta, S. Myeloid colony-stimulating factors as regulators of macrophage polarization. Frontiers in Immunology. 5, 554 (2014).
- Na, Y. R., et al. GM-CSF induces inflammatory macrophages by regulating glycolysis and lipid metabolism. Journal of Immunology. 197 (10), 4101-4109 (2016).
- Sorgi, C. A., et al. GM-CSF priming drives bone marrow-derived macrophages to a pro-inflammatory pattern and downmodulates PGE2 in response to TLR2 ligands. PLoS One. 7 (7), 40523 (2012).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır