Method Article
Isolamento e coltura in vitro di macrofagi derivati dal midollo osseo per lo studio della biologia NO-Redox
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo è stato stabilito per coltivare macrofagi murini primari carenti di tetraidrobiopterina (BH4) e ossido nitrico sintasi inducibile (iNOS) per studiare la biologia no-redox. Lo studio si concentra sulla riduzione della potenziale contaminazione di BH4 e di altri artefatti trovati nei metodi tradizionali di isolamento e coltura che possono confondere i risultati sperimentali e l'interpretazione dei risultati.
Abstract
I macrofagi sono derivati da cellule progenitrici ematopoietiche in tutto il corpo, sono fondamentali per i processi infiammatori e partecipano alle risposte immunitarie innate e adattative. Lo studio in vitro dei macrofagi può essere effettuato mediante coltura ex vivo dal peritoneo o attraverso la differenziazione delle cellule progenitrici del midollo osseo mieloide per formare macrofagi derivati dal midollo osseo (BMDM). Un approccio comune alla differenziazione dei macrofagi dai precursori prevede l'uso di mezzi condizionati da cellule L929 (LCM). Questo mezzo è facile da autoprodurre ma soffre di variabilità del lotto e i suoi costituenti sono indefiniti. Allo stesso modo, il siero bovino fetale (FBS) viene utilizzato per sostenere la crescita, ma contiene una vasta miscela di molecole indefinite che possono variare tra i lotti. Questi metodi non sono adeguati per lo studio della biologia dell'ossido nitrico e dei meccanismi redox in quanto entrambi contengono quantità sostanziali di piccole molecole che interferiscono con i meccanismi redox o integrano i livelli di cofattori, come la tetraidrobiopterina (BH4), necessari per la produzione di NO dall'ossido nitrico sintasi inducibile (iNOS). In questo rapporto, presentiamo un protocollo ottimizzato che consente il controllo dell'ambiente NO-redox riducendo i livelli di biopterina esogena mantenendo condizioni adatte alla crescita e alla differenziazione cellulare. Uno stretto controllo della composizione dei terreni di coltura aiuta a garantire la riproducibilità sperimentale e facilita l'interpretazione accurata dei risultati. In questo protocollo, i BMDM sono stati ottenuti da un modello murino carente di cicloidrolasi GTP (GCH). La coltura di BMDM è stata eseguita con mezzi contenenti (i) LCM condizionato o (ii) M-CSF ricombinante e GM-CSF per produrre artefatti minimi ottenendo condizioni di coltura BH4 e NO-carenti - consentendo così lo studio riproducibile della biologia NO-redox e dell'immunometabolismo in vitro.
Introduzione
I macrofagi sono stati stabiliti come un tipo di cellula interessante in un'ampia varietà di malattie e condizioni, molte apparentemente non correlate alla loro tradizionale attenzione all'immunità innata. Poiché la fisiologia dei macrofagi dipende fortemente dal tessuto o dall'ambiente in cui risiedono, sono sorti molti metodi e modelli per studiare la loro funzione e i vari percorsi coinvolti. Storicamente, le linee cellulari dei macrofagi, come RAW264.7, dominavano il campo, ma queste sono state gradualmente sostituite a favore di vari modelli cellulari primari. Ad esempio, i macrofagi murini possono essere isolati dal lavaggio peritoneale dopo il trattamento con tioglicolato. Pur fornendo un modello utile per lo studio delle cellule residenti nei tessuti, questi macrofagi peritoneali hanno dimostrato di dimostrare una risposta più sommessa a vari stimoli esterni, limitando così la loro idoneità per molte applicazioni a valle1.
In alternativa, i macrofagi derivati dal midollo osseo (BMDM), derivati da cellule progenitrici mieloidi nel midollo osseo, sono emersi come un modello prezioso per lo studio di vari aspetti della biologia dei macrofagi, tra cui la maturazione e i vari fenotipi classici associati ai macrofagi, M0 (naïve, non attivato), M1 (pro-infiammatorio, solitamente attivato con LPS/IFN) e M2 (pro-risoluzione, solitamente attivato con IL-4)2, 3. Tuttavia, la differenziazione delle cellule progenitrici mieloidi in BMDM dipende dalla presenza del fattore stimolante le colonie di macrofagi (M-CSF) nei terreni di coltura 4,5. Questo può essere fornito sotto forma di proteina purificata aggiunta al mezzo o da mezzi condizionati L929 (LCM). I vantaggi dell'utilizzo di BMDM (costo ed efficienza) devono essere valutati rispetto alle limitazioni presentate dalla loro sensibilità a vari stimoli (citochine, intermedi metabolici e RNS / ROS).
Dati precedenti indicano che i contenuti di LCM sono scarsamente definiti e intrinsecamente variabili, con il risultato che sono inaffidabili e inadatti a una varietà di applicazioni a valle, in particolare quelle specificamente relative all'NO o alla biologia redox, in quanto queste possono essere fortemente influenzate dalla presenza di composti esogeni6. Come tale, questo protocollo dettagliato richiede l'uso di DMEM ben definiti: mezzi F12 con bassa variazione da lotto a lotto e l'aggiunta di M-CSF murino ricombinante e GM-CSF (fattore stimolante le colonie di granulociti-macrofagi). Inoltre, il siero bovino fetale tipicamente utilizzato come integratore nei terreni di coltura tissutale fornisce ancora un'altra fonte di composti scarsamente definiti e variabilità intrinseca. È pertanto necessario controllare e ottimizzare l'uso di tali additivi per garantire la coltura affidabile dei BMDM. Utilizzando una fonte definita di FBS a basso contenuto di endotossine e garantendo che i singoli lotti siano acquistati all'ingrosso, le condizioni di coltura siano definite in modo affidabile e la riproducibilità sia garantita. Il protocollo qui descritto ha dimostrato di produrre una coltura di macrofagi superiore al 95% di purezza quando valutato per i marcatori di superficie dei macrofagi CD45 e CD11b mediante citometria a flusso6.
Protocollo
Tutte le procedure sugli animali sono state approvate ed eseguite in conformità con il comitato etico dell'Università di Oxford e il UK Home Office Animals (Scientific Procedures) Act 1986. Tutte le procedure sono conformi alla Direttiva 2010/63/UE del Parlamento Europeo.
1. Isolamento delle cellule del midollo osseo
- Sacrificare topi wild-type (C57BL/6) o Gch1-carenti (R26-CreERT2Gchfl/fl) (10-16 settimane) per lussazione cervicale e raccogliere gli arti posteriori.
NOTA: Non viene fatta alcuna preferenza per nessuno dei due sessi. Le femmine di pari età saranno leggermente più piccole delle loro controparti maschili, influenzando la resa iniziale del materiale di partenza.- Spruzzare i topi con etanolo al 70% per ridurre il rischio di contaminazione.
- Fai un piccolo taglio nell'addome con le forbici di dissezione per rimuovere la pelliccia e la pelle dal corpo. Staccare la pelle per esporre il muscolo sugli arti posteriori.
- Posizionare il topo sull'addome e dislocare gli arti posteriori sollevandolo dall'articolazione del ginocchio e facendo pressione sui fianchi. La lussazione può essere sentita all'articolazione dell'anca.
- Rimuovere le zampe posteriori tagliando con cura il muscolo all'anca, assicurandosi che non si verifichino danni al femore.
- Tagliare sopra l'articolazione della caviglia, rimuovere il piede e pulire la pelle rimanente dalla gamba.
- Posizionare le gambe sezionate in un tubo da 50 ml con 25 ml di PBS ghiacciato (nessun antibiotico richiesto) e metterlo sul ghiaccio.
NOTA: Più animali possono essere sezionati e le zampe tenute sul ghiaccio.
- In condizioni sterili in un cappuccio di coltura tissutale, rimuovere i muscoli dalle gambe e rimuovere le estremità delle ossa per esporre il midollo osseo.
- Posizionare le gambe in etanolo al 70% per 2 minuti per ridurre la contaminazione e lavare via qualsiasi pelliccia o residuo.
- Trasferire le gambe in una capsula di Petri pulita, sterile e batteriologica. Usa una pinza e un bisturi per raschiare saldamente e con cura lungo le ossa con il lato della lama per rimuovere i muscoli. Tagliare i tendini per facilitare il processo.
- Rimuovere l'epifisi all'estremità di ciascun osso per esporre il midollo osseo. Il femore viene tagliato ad entrambe le estremità, appena sotto le rispettive articolazioni.
- La tibia è tagliata nella parte superiore, appena sotto l'articolazione del ginocchio, e nella parte inferiore appena sopra il punto di intersezione con il perone.
- Lavare il midollo osseo dalle ossa con PBS e raccoglierlo in un tubo sterile da 50 ml.
- Riempire una siringa da 10 mL con 10 mL di PBS e collegarla a un ago da 25 G x 0,5 x 16 mm. Questo è sufficiente per lavare tutte le ossa da un topo.
- Inserire l'ago nella cavità midollare dell'osso e lavare delicatamente il midollo osseo con 1-2 ml di PBS, facendo scorrere l'ago su e giù attraverso l'osso per garantire che tutto il midollo osseo sia spostato.
- Ripetere per tutte le ossa, raccogliendo il midollo osseo arrossato in una capsula di Petri pulita.
- Utilizzando una siringa sterile da 1 mL, disaggregare il midollo osseo aspirando la sospensione dentro e fuori dalla siringa 5-10 volte fino a quando eventuali grumi non si rompono.
- Raccogliere il midollo osseo disaggregato nella siringa da 1 mL e passarlo attraverso un filtro cellulare da 70 μM in un tubo centrifugo pulito da 50 mL. Posizionare il midollo osseo raccolto sul ghiaccio mentre vengono raccolti ulteriori campioni.
NOTA: vedere schema di protocollo nella Figura 1 - Parte 1.
2. Selezione, differenziazione e stimolazione dei BMDM
- Per congelare il midollo osseo per un uso successivo, pellet il midollo osseo mediante centrifugazione a 1000 x g per 5 minuti e risospesiare in 2 ml di FBS a basso contenuto di endotossina contenente il 5% di dimetilsolfossido (DMSO).
- Centrifugare la sospensione di midollo osseo a 1000 x g per 5 minuti a temperatura ambiente (RT). Si formerà un pellet rosso sangue.
- Scartare il surnatante.
- Risospesare delicatamente il pellet in 2 ml di FBS a bassa endotossina contenente il 5% di DMSO e congelare a -80 °C durante la notte prima di trasferirlo in azoto liquido in fase vapore per lo stoccaggio a lungo termine.
- Per utilizzare immediatamente il midollo osseo, lisare i globuli rossi prima di placcare il midollo osseo.
- Centrifugare la sospensione del midollo osseo a 1000 x g per 5 minuti a RT. Si formerà un pellet rosso sangue.
- Risospesciare il pellet in 3 ml di 1x tampone di lisi dei globuli rossi e incubare a RT per 5 min.
- Aggiungere 10 ml di PBS e centrifugare a 1000 x g per 5 minuti a RT. Scartare il surnatante.
- Placcare le celle per un uso immediato continuando dal punto 2.3.5.
- Scongelare i macrofagi e risospendere in 3 ml di mezzi di placcatura prima di pellettare le cellule.
- Preparare DMEM: F12 contenente il 5% di endotossina FBS bassa, 1x penicillina / streptomicina, L-glutammina e 25 ng / mL M-CSF.
NOTA: M-CSF e GM-CSF possono essere preparati risospendendo le proteine essiccate in acqua sterile contenente lo 0,1% di BSA sterile e le aliquote possono essere congelate a -80 °C per un uso successivo. - Scongelare rapidamente la sospensione cellulare congelata a 37 °C.
- Trasferire la sospensione cellulare (0,5 mL) in un tubo pulito e sterile contenente 3 mL del supporto DMEM: F12 preparato.
- Pellet le celle mediante centrifugazione a 1000 x g per 5 minuti a RT. Scartare il surnatante.
- Risospendare il pellet in 3 ml del DMEM preparato: supporto F12.
- Contare le celle con un metodo preferito.
- Preparare DMEM: F12 contenente il 5% di endotossina FBS bassa, 1x penicillina / streptomicina, L-glutammina e 25 ng / mL M-CSF.
- Giorno 0: Placcare le cellule.
- Placcare le cellule in articoli di plastica non rivestiti con TC in DMEM: mezzi F12 contenenti il 5% di endotossina FBS a basso contenuto di endotossina, 1x penicillina / streptomicina, L-glutammina e 25 ng / mL M-CSF.
NOTA: le densità rappresentative di semina sono descritte nella Tabella 1. Un paio completo di gambe di un topo fornisce 15-20 milioni di cellule precursori. - Incubare le cellule a 37 °C con il 5% di CO2.
- Placcare le cellule in articoli di plastica non rivestiti con TC in DMEM: mezzi F12 contenenti il 5% di endotossina FBS a basso contenuto di endotossina, 1x penicillina / streptomicina, L-glutammina e 25 ng / mL M-CSF.
- Giorno 5: Nutrire le cellule.
- Nutrire le cellule aggiungendo il 50% del volume originale di DMEM: mezzi F12 contenenti il 5% di endotossina FBS a basso contenuto di endotossina, 1x penicillina / streptomicina, L-glutammina e 50 ng / mL M-CSF.
- Giorno 6: Stimolare le cellule con GM-CSF.
- Aggiungere GM-CSF preparato ad una concentrazione finale di 50 ng/mL direttamente al terreno di coltura cellulare sulle cellule.
- Sostituire il supporto con DMEM preparato: F12.
- Rimuovere tutti i supporti dalle celle.
- Lavare brevemente le cellule in PBS preriscaldato.
- Aggiungere DMEM: F12 media contenente il 2% di endotossina FBS bassa, 1x penicillina / streptomicina, L-glutammina, 25 ng / mL M-CSF e 50 ng / mL GM-CSF.
- Attivare i macrofagi ai fenotipi M0, M1 o M2 con le stimolazioni descritte nei passaggi 2.7.5-2.7.7.
- M0 - Nessuna stimolazione richiesta. Incubare le cellule durante la notte nei media.
- M1 - Stimolare le cellule con 100 ng/mL LPS e 10 ng/mL IFNγ (concentrazioni finali) durante la notte.
- M2 - Stimolare le cellule con 100 ng/mL IL-4 (concentrazione finale) durante la notte.
- Giorno 8: Raccogli le cellule.
- Rimuovere i fluidi dalle celle (raccogliere i supporti e congelare a -80 °C per i saggi a valle).
- Incubare le cellule in PBS ghiacciato (50% del volume del fluido) per 5 minuti.
- Staccare le cellule dalla piastra con raschiatura delicata o pipettaggio ripetuto.
- Pellet le celle per centrifugazione a 2500 x g per 5 minuti a RT. Scartare il surnatante.
- Congelare i pellet cellulari a -80 °C per un uso successivo.
NOTA: vedere lo schema di protocollo Figura 1 - Parte 2.
Risultati
Prima di dimostrare l'efficacia di questo protocollo nei macrofagi, i livelli di nitriti e BH4 sono stati valutati in mezzi integrati con il 10% di FBS contenente il 10% di LCM o solo M-CSF ricombinante e GM-CSF. Il nitrito, sebbene considerato per lungo tempo come un prodotto finale del metabolismo dell'ossido nitrico, è ora considerato come deposito fisiologico di ossido nitrico, che può essere riciclato quando necessario e quindi è spesso usato come indicatore della biodisponibilità dell'ossido nitrico7. BH4 è un cofattore essenziale di NOS per la produzione di NO. Come si vede nella Figura 2, i media integrati con il 10% di FBS avevano livelli di nitriti simili indipendentemente da M-CSF / GM-CSF o LCM. Tuttavia, è stata osservata una maggiore variabilità tra i diversi lotti di LCM. Questa osservazione si applicava anche alla misurazione BH4. In effetti, un lotto di LCM (lotto #3) aveva un livello significativamente più alto di BH4 rispetto agli altri due (lotti #1 e #2). Inoltre, i lotti di LCM contenevano significativamente più biotterina rispetto ai media integrati con il 10% di FBS e citochine ricombinanti. È stata inoltre misurata una significativa variabilità delle biopterine totali tra i lotti. Questi risultati dimostrano l'importanza di utilizzare una fonte meno variabile di M-CSF rispetto a LCM.
Inoltre, i media integrati con il 10% di FBS contenevano livelli significativamente più elevati di nitriti rispetto ai media contenenti il 2% o il 5% di FBS. La differenza tra il 10% e il 5% era molto significativa (p < 0,05) per BH4. Tuttavia, sono stati quantificati livelli simili di biopterine. In confronto, OptiMEM + 0,2% BSA era privo di nitrito e BH4, rendendolo un mezzo molto pulito e adatto. Tuttavia, come descritto da Bailey et al., sebbene OptiMEM sia destinato ad essere utilizzato solo una volta durante la notte durante la stimolazione dei macrofagi, è stata osservata la morte cellulare dovuta alla fame. DMEM: F12 integrato con il 2% di FBS è stato scelto per superare questo problema, consentendo una minima contaminazione da nitriti e BH4 pur contenendo nutrienti sufficienti per ottenere cellule sane. Infatti, nonostante sia stato rilevato qualche nitrito, i livelli sono trascurabili (~0,2 μM) rispetto ai macrofagi WT stimolati da LPS/IFN (30-80 μM per 1 x 106 cellule; dati non mostrati).
Per convalidare questo protocollo migliorato con dati sperimentali, l'isolamento e la caratterizzazione di BMDM da un nuovo modello murino carente di BH4, l'R26-CreERT2Gchfl / fl è presentato qui. BH4 è prodotto dal gene GTP cyclohydrolase I (Gch1). Come mostrato nella Figura 3A, la carenza di Gch1 porta alla perdita di BH4 e alla conseguente scomparsa di NO e successivamente nitrito, e ad un aumento dell'anione superossido che causa stress ossidativo, come dimostrato in precedenza da McNeill et al.8. Sebbene questo protocollo sia già stato ben definito e utilizzato per coltivare altri macrofagi carenti di BH4 da diversi sistemi Cre come il modello Gchfl/flT2C 6,8, il modello R26-CreERT2Gchfl/fl è unico in quanto utilizza l'attivazione condizionale del sistema Cre-ERT2 per rimuovere il gene Gch1 dopo il trattamento con tamoxifene (Figura 3B, C). Ciò consente il knockout in vari punti temporali e l'uso del controllo interno sotto forma di un trattamento veicolo contro tamoxifene. In questo esempio, le cellule sono state trattate con tamoxifene 4-OH da un veicolo (95% di etanolo) o 0,1/1,0 μM 4-OH nei giorni 1 e 3 (sia il veicolo che il tamoxifene diluito 1:100 nei mezzi prima di 0,7/7,0 μL aggiunto a 1 mL del volume di coltura esistente).
Come si vede nella Figura 3D, la proteina GTPCH viene abolita dopo il trattamento con Tamoxifene nelle cellule R26-CreERT2Gchfl/fl ma non in quella Gchfl/fl. È importante sottolineare che sia le cellule di controllo R26-CreERT2Gchfl/fl che Gchfl/fl sono ancora in grado di produrre iNOS dopo stimolazione LPS/IFN (Figura 3B,C). Questi cambiamenti nell'espressione genica Gch1 e la conseguente alterazione della proteina GTPCH hanno portato a livelli di BH4 intracellulari significativamente perturbati e alla produzione attenuata di nitriti. Come mostrato nella Figura 4, i BMDM isolati e coltivati da topi R26-CreERT2Gchfl/fl hanno mostrato una significativa diminuzione della produzione di BH4 e una diminuzione dell'accumulo di nitriti nei mezzi, rispetto a quelli provenienti da cellule FCHfl/fl di controllo in presenza di tamoxifene. Allo stesso modo, le stesse cellule coltivate in terreni LCM hanno anche mostrato l'espressione di Gch1 abolita; sebbene queste cellule producessero ancora quantità significative sia di BH4 che di nitrito dopo la eliminazione dell'espressione di Gch1 con 4 OH tamoxifene, probabilmente a causa della contaminazione dei mezzi e FBS con BH4. Ciò rappresenta un chiaro miglioramento del nuovo metodo, rispetto alla coltura delle cellule in mezzi contenenti cellule L.
Un'ulteriore caratterizzazione di questo modello non dimostra differenze significative nella morfologia tra I BMDM non attivati (M0) Gchfl/fl e R26-CreERT2Gchfl/fl al giorno 8 a seguito di diverse concentrazioni di tamoxifene. Come mostrato nella Figura 5, entrambi i modelli mostrano una quantità simile di cellule aderenti fatte di forma rotonda con estremità allungate, in genere le caratteristiche che ci si aspetta dai macrofagi non stimolati9.
Presi insieme, questi risultati dimostrano che questo metodo di isolamento e coltura di BMDM fornisce una popolazione pura di cellule adatte alla coltura di macrofagi murini. Questo metodo consente la coltura di macrofagi murini senza l'interferenza di composti esogeni presenti in alcune formulazioni di media.
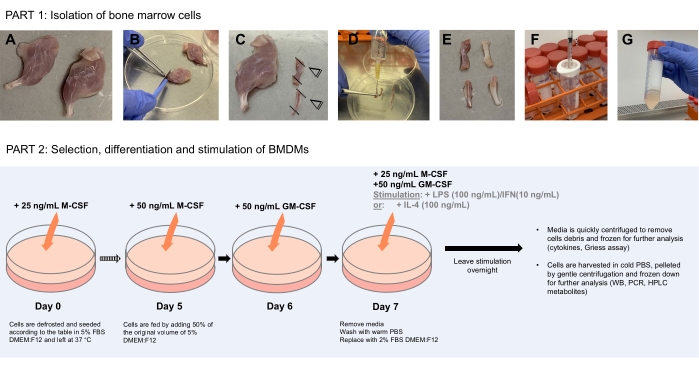
Figura 1: Diagramma schematico che illustra l'isolamento delle cellule del midollo osseo (Parte 1) per la selezione, la differenziazione e la stimolazione dei BMDM (Parte 2). (A) In condizioni sterili, le gambe sezionate vengono poste in una capsula di Petri batteriologica pulita dopo essere state lavate con etanolo al 70%. (B) I muscoli vengono accuratamente rimossi usando pinze e bisturi raschiando lungo le ossa. (C) Le estremità delle ossa vengono quindi tagliate per esporre il midollo osseo. (D) Il midollo osseo viene lavato via dalle ossa usando una siringa da 10 mL riempita con 10 mL di PBS inserendo l'ago nel lume dell'osso. (E) L'ago viene fatto scorrere su e giù attraverso l'osso per garantire che tutto il midollo osseo sia spostato. L'osso dovrebbe apparire bianco e chiaro in quella fase con il midollo osseo spostato raccolto nella capsula di Petri. (F-G) Ripetere per tutte le ossa, raccogliendo il midollo osseo disaggregato nella siringa da 1 mL e passarlo attraverso un filtro cellulare da 70 μm in un tubo centrifugo pulito da 50 mL. Spin down e risospendare le cellule nei mezzi di congelamento per un uso successivo. La parte 2 mostra la selezione, la differenziazione e la stimolazione dei BMDM Fare clic qui per visualizzare una versione più grande di questa figura.
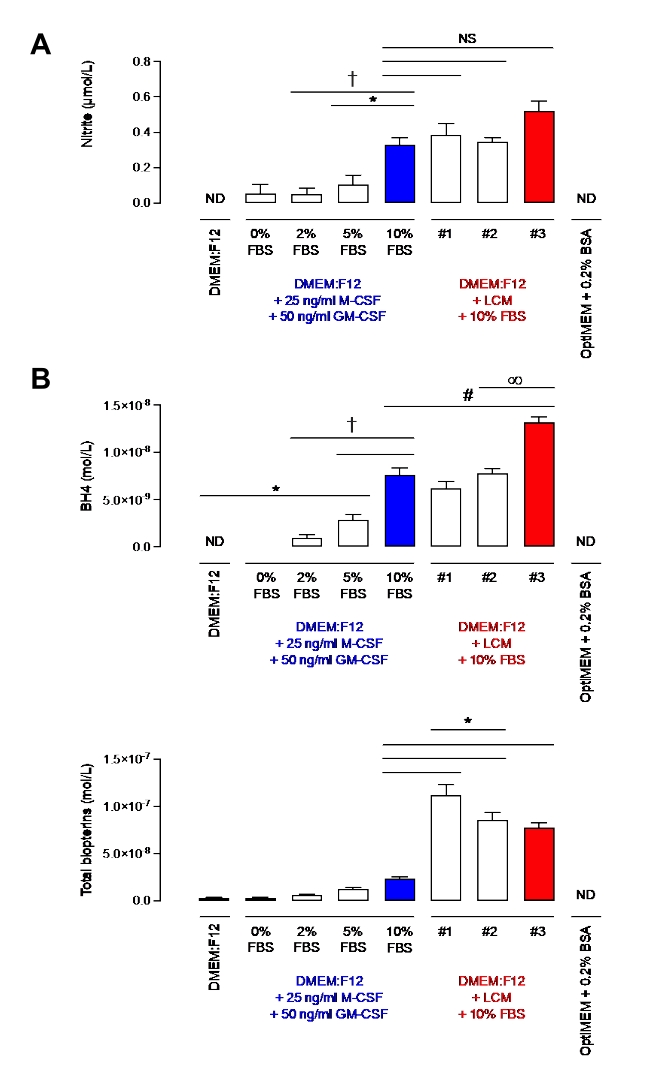
Figura 2: Livelli di nitriti e BH4 in DMEM: F12 + GM-CSF + M-CSF o DMEM: F12 + L-cell media. (A) I livelli di nitriti in diversi mezzi sono stati misurati utilizzando il metodo Griess Assay. (B) I livelli di BH4 e biopterine sono stati misurati in diversi mezzi mediante quantificazione HPLC utilizzando uno standard BH4. I dati sono espressi come media (n = 3) ± SD. I dati sono stati analizzati utilizzando ANOVA unidirezionale mediante confronti multipli. I simboli rappresentano p < 0,05 tra i gruppi. Fare clic qui per visualizzare una versione più grande di questa figura.
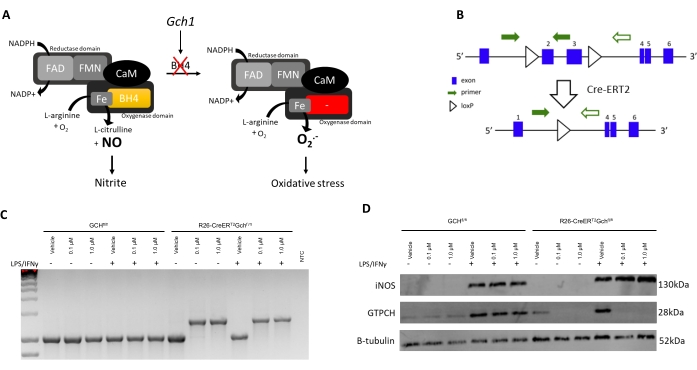
Figura 3: Introduzione al modello R26CreERT2. (A) Schema che illustra il ruolo di BH4 come cofattore NOS nella biologia redox. (B) Schema che dettaglia l'escissione degli esoni critici (2 e 3) in Gch1 a causa dei siti loxP fiancheggianti e l'attivazione condizionale di Cre-ERT2 con tamoxifene in questo modello murino. (C) PCR (rappresentativa di n = 3 animali indipendenti) che dimostra l'escissione dell'esone critico quando i BMDM sono trattati con tamoxifene. I topi WT producono un prodotto PCR da 1030 bp, mentre in presenza del Cre, viene prodotto un prodotto da 1392 bp, confermando l'escissione degli esoni critici. (D) Immunoblot di iNOS, GCH e B-tubulina (rappresentativo di n = 3 animali indipendenti). Fare clic qui per visualizzare una versione più grande di questa figura.
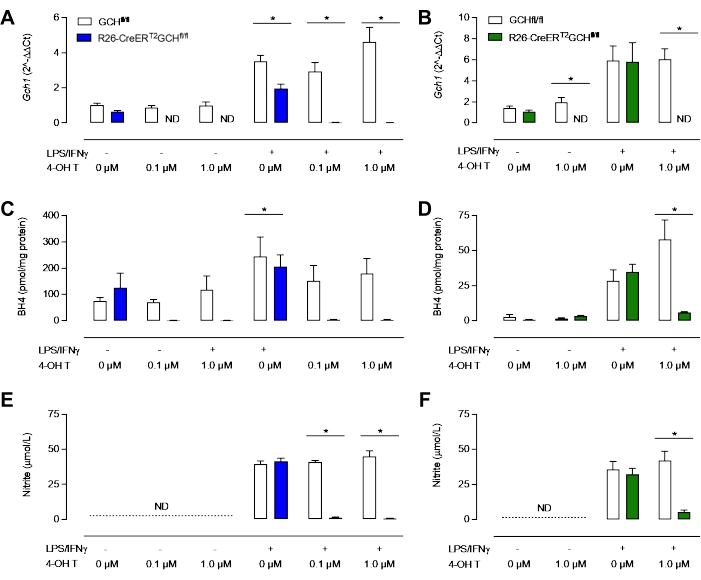
Figura 4: Caratterizzazione del deficit di BH4 nei macrofagi. (A,B) qRT-PCR conferma la perdita dell'espressione di Gch1 nel modello R26-CreERT2Gchfl/fl trattato con tamoxifene. Blu = Nuovo metodo MCSF, Verde = metodo LCM classico. (C,D) L'analisi del BH4 intracellulare mediante HPLC rivela che 0,1 μM e 1,0 μM sono sufficienti per ridurre significativamente i livelli di BH4. (E, F) La misurazione del nitrito nei mezzi utilizzando il saggio Griess mostra che i BMDM non stimolati non producono livelli rilevabili di nitrito, mentre i BMDM Gchfl/fl e R26-CreERT2Gchfl/fl producono nitrito in presenza di LPS/IFNγ. Significativamente, il trattamento con tamoxifene di R26-CreERT2Gchfl/fl riduce significativamente i livelli di nitriti nei BMDM stimolati. I dati sono espressi come media di (n = 3) ± SD. I dati sono stati analizzati utilizzando ANOVA unidirezionale mediante confronti multipli. I simboli rappresentano p < 0,05 tra i gruppi. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Confronto della morfologia dei BMDM. Foto ottenute al microscopio ottico di BMDM al giorno 8 con il trattamento variabile del tamoxifene. La scala è indicata nell'immagine. Fare clic qui per visualizzare una versione più grande di questa figura.
| Piatto della cultura | Volume multimediale | Densità di semina |
| 12 piatti di pozzo | 1 ml | 500.000 celle |
| 6 piatti di pozzo | 2 ml | 1.000.000 di celle |
| Piatto da 100 mm | 10 ml | 3.000.000 di celle |
| 75 cm2 pallone | 15 ml | 5.000.000 di celle |
Tabella 1: Densità rappresentative di semina.
Discussione
Questo protocollo di coltura BMDM carente di BH4 e NO è stato progettato per studiare la biologia NO-redox nei macrofagi primari attraverso la riduzione della tetraidrobiopterina (BH4) e di altri artefatti interferenti con l'obiettivo di migliorare l'affidabilità e la riproducibilità dei risultati ottenuti da questi modelli sperimentali.
I passaggi critici includono l'uso della ceramica di plastica corretta. I progenitori dei macrofagi sono cellule aderenti e molto appiccicose; pertanto l'uso di piastre trattate con colture non tissutali (TC) è fondamentale per selezionarle e isolarle da altre cellule progenitrici, che altrimenti potrebbero attaccarsi e ridurre la purezza. Il giorno del raccolto, il distacco dei macrofagi dalle piastre richiede PBS ghiacciato, ma l'uso di EDTA o persino la raschiatura delle cellule molto delicatamente può essere eseguita a seconda dell'applicazione a valle (esperimento di cellule lizzate rispetto a cellule vive, per esempio). Particolare attenzione dovrebbe essere prestata anche per quanto riguarda la contaminazione. Durante il lavaggio del midollo osseo, può verificarsi una potenziale contaminazione incrociata con batteri o particelle virali dalla pelliccia e dalla pelle rimanenti. È quindi essenziale essere il più attenti e sterili possibile; quindi è incoraggiato immergere le gambe sezionate al 70% di etanolo per alcuni minuti. Allo stesso modo, l'uso di antibiotici durante la crescita dei macrofagi è altamente raccomandato.
Un'altra limitazione di questo protocollo deriva dalla densità di placcatura cellulare al giorno 0. Il midollo osseo arrossato contiene una varietà di cellule, che possono essere erroneamente contate e incluse come progenitori dei macrofagi, portando così a un falso numero totale di cellule. Per evitare la successiva e potenziale variabilità, i macrofagi isolati possono essere delicatamente lavati usando PBS caldo al giorno 7 e ri-placcati alla densità corretta nel 2% FBS DMEM: F12 almeno 1 ora prima della stimolazione per consentire l'aderenza.
Infine, il controllo dei livelli di nitriti mediante il test di Griess utilizzando i media dei macrofagi cresciuti è imperativo per analizzare i dati. Tra i lati positivi, questo test è rapido ed economico da eseguire.
Come dimostrato nel presente documento, questo protocollo personalizzato è un'alternativa più definita e migliorata al protocollo più comune utilizzato per isolare e coltivare macrofagi utilizzando mezzi condizionati da cellule L (LCM). In effetti, una delle principali preoccupazioni che utilizzano LCM quando si studia la biologia NO-redox è la sua quantità significativa di biopterine rilevate, portando a potenziali cambiamenti metabolici10. Ad esempio, il BH4 esogeno può ricostituire rapidamente modelli carenti e fungere da cofattore per iNOS, portando alla produzione indesiderata di ossido nitrico. Un altro svantaggio dell'utilizzo di LCM risiede nella sua produzione: LCM è una miscela di fattori stimolanti le colonie, citochine e altri sottoprodotti secreti direttamente dalle cellule L-929, che possono influenzare la fisiologia dei macrofagi6. Nonostante la sua grande fornitura di M-CSF, essenziale per la proliferazione e la sopravvivenza dei macrofagi, la variazione di ciascun componente da lotto a lotto aumenta il rischio di variabilità tra gli esperimenti.
Per affrontare entrambi i problemi, questo nuovo protocollo utilizza il ben definito DMEM: mezzi F12 contenenti bassi livelli di biopterine a cui viene aggiunta una quantità controllata di M-CSF purificato e GM-CSF. Entrambe le citochine aiutano nella differenziazione e nella crescita dei macrofagi. M-CSF porta in particolare alla generazione di BMDM da cellule progenitrici del midollo osseo assicurando la differenziazione delle cellule staminali ematopoietiche in macrofagi11. Inoltre, GM-CSF ha dimostrato di aumentare la produzione di citochine infiammatorie e NO quando aggiunto prima della stimolazione, un vero vantaggio quando si studia la biologia NO-redox12,13.
L'altro fattore principale che questo nuovo metodo affronta è quello della FBS, solitamente utilizzata come fonte di nutrienti essenziali per la buona salute e la crescita delle cellule. Simile a LCM, FBS contiene livelli significativi di biopterina. Mentre la completa fame sierica delle cellule prima della stimolazione è stata inizialmente considerata utilizzando OptiMEM + 0,2% BSA, i macrofagi hanno mostrato segni di distacco, indicativi di diminuzione della vitalità cellulare come descritto da Bailey et al.6. Tuttavia, poiché i macrofagi hanno dimostrato un requisito assoluto per il siero, è stata selezionata l'endotossina ULTRA-bassa FBS di BioWest. I lotti sono stati testati per le biopterine e preselezionati prima dell'acquisto all'ingrosso per garantire una fornitura affidabile e ben definita. Per andare oltre nell'obiettivo di ridurre le fonti inquinanti di biopterine, sono state quindi testate concentrazioni ridotte di FBS. Invece di utilizzare il siero al 10% come comunemente usato nella coltura cellulare, il livello di FBS viene mantenuto al 5% durante la differenziazione di 7 giorni del midollo osseo in macrofagi e ulteriormente ridotto al 2% durante la stimolazione notturna dell'ultimo giorno. Ciò garantisce livelli trascurabili di biotterine rilevate ma nutrienti sufficienti per la buona salute e l'aderenza dei macrofagi. Sebbene questo protocollo recentemente ottimizzato che utilizza M-CSF ricombinante si traduca in un ambiente più controllato per la coltura e l'attivazione di macrofagi primari, la limitazione principale è che questo metodo è più costoso rispetto all'utilizzo del metodo LCM.
Prendendo in considerazione tutti questi fattori, i due metodi sono stati quindi confrontati direttamente. È importante sottolineare che il protocollo recentemente modificato presentato nel presente documento utilizzando M-CSF ricombinante e GM-CSF ha portato a un sistema più riproducibile in cui il supporto era privo di contaminazione bh4. Gli effetti di ciò furono duplici; Le cellule carenti di BH4 erano veramente prive di BH4, il che ha comportato un minimo accumulo di nitriti rilevabili nei mezzi dopo la stimolazione allo stato M1 con LPS. Ciò era in contrasto con quelle stesse cellule BMDM coltivate in LCM, dove sono stati rilevati significativi BH4 e nitriti.
Per concludere, la forza di questo metodo risiede nello sforzo di controllare i livelli di biopterine valutando a fondo ogni parametro che potrebbe influenzare la segnalazione di NO e redox nei macrofagi. In particolare, ciò garantisce la massima riproducibilità e standardizzazione nel campo della biologia NO-redox.
Divulgazioni
Gli autori non dichiarano interessi concorrenti.
Riconoscimenti
Questo lavoro è stato supportato dalla British Heart Foundation Intermediate Fellowship assegnata a M.J.C. (FS/14/56/31049), british heart foundation Programme grants (RG/17/10/32859 e RG/12/5/29576), Wellcome Trust (090532/Z/09/Z) e NIH Research (NIHR) Oxford Biomedical Research Centre. Gli autori desiderano inoltre riconoscere il sostegno del BHF Centre of Research Excellence, Oxford (RE/13/1/30181 e RE/18/3/34214)
Materiali
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | Terumo | SS+01T1 | 1mL 6% LUER syringe |
| 10 mL plastic syringe | Fisher scientific | 14955453 | |
| 6 well plate sterile non-treated | CytoOne | CC7672-7506 | Flat bottom |
| DMEM/F-12 (1:1) (1x) | Gibco, Life Technologies | 21331-020 | |
| DMSO sterile | Sigma-aldrich | D2650-100ML | |
| Easy flask 260 mL | Thermo Scientific | 156800 | |
| L-Glutamine Solution 200 mM | Sigma-aldrich | G7513-100ML | |
| Lipopolysaccharides from Escherichia coli O111:B4 | Sigma-aldrich | L4391-1MG | |
| Mutlidish 12 sterile non-treated | Thermo Scientific | 150200 | Flat bottom |
| Needle 25G, 0.5 x 16 mm | BD Microlance 3 | 300600 | |
| PBS (pH7.4, 1x) | Gibco, Life Technologies | 10010-015 | |
| Penicillin-Streptomycin | Sigma-aldrich | P0781-100ML | |
| petri dish 100 x15 mm sterile | Falcon, Corning incorporated | 351029 | |
| Recombinant murine GM-CSF | PEPROTECH | 315-03 | |
| Recombinant murine IFN-γ | PEPROTECH | 315-05 | |
| Recombinant murine M-CSF | PEPROTECH | 315-02 | |
| Scalpel n23 | Swann-Morton | 0510 | |
| Ultra-low endotoxin FBS | Biowest | S1860-500 | |
| VWR cell strainers 70 µm nylon | VWR | 732-2758 |
Riferimenti
- Zajd, C. M., et al. Bone marrow-derived and elicited peritoneal macrophages are not created equal: The questions asked dictate the cell type used. Frontiers in Immunology. 11, 269 (2020).
- Murray, P. J., et al. Macrophage activation and polarization: nomenclature and experimental guidelines. Immunity. 41 (1), 14-20 (2014).
- Zhao, Y. L., et al. Comparison of the characteristics of macrophages derived from murine spleen, peritoneal cavity, and bone marrow. Journal of Zheijang University Science B. 18 (12), 1055-1063 (2017).
- Nasser, H., et al. Establishment of bone marrow-derived M-CSF receptor-dependent self-renewing macrophages. Cell Death Discovery. 6, 63 (2020).
- Stanley, E. R., Heard, P. M. Factors regulating macrophage production and growth. Purification and some properties of the colony stimulating factor from medium conditioned by mouse L cells. Journal of Biological Chemistry. 252 (12), 4305-4312 (1977).
- Bailey, J. D., et al. Isolation and culture of murine bone marrow-derived macrophages for nitric oxide and redox biology. Nitric Oxide. 100-101, 17-29 (2020).
- Shiva, S. Nitrite: A physiological store of nitric oxide and modulator of mitochondrial function. Redox Biology. 1 (1), 40-44 (2013).
- McNeill, E., et al. Regulation of iNOS function and cellular redox state by macrophage Gch1 reveals specific requirements for tetrahydrobiopterin in NRF2 activation. Free Radical Biology and Medicine. 79, 206-216 (2015).
- McWhorter, F. Y., Wang, T., Nguyen, P., Chung, T., Liu, W. F. Modulation of macrophage phenotype by cell shape. Proceedings of the National Academy of Sciences of the United States of America. 110 (43), 17253-17258 (2013).
- Bailey, J. D., et al. Nitric oxide modulates metabolic remodeling in inflammatory macrophages through TCA cycle regulation and itaconate accumulation. Cell Reports. 28 (1), 218-230 (2019).
- Hamilton, T. A., Zhao, C., Pavicic, P. G., Datta, S. Myeloid colony-stimulating factors as regulators of macrophage polarization. Frontiers in Immunology. 5, 554 (2014).
- Na, Y. R., et al. GM-CSF induces inflammatory macrophages by regulating glycolysis and lipid metabolism. Journal of Immunology. 197 (10), 4101-4109 (2016).
- Sorgi, C. A., et al. GM-CSF priming drives bone marrow-derived macrophages to a pro-inflammatory pattern and downmodulates PGE2 in response to TLR2 ligands. PLoS One. 7 (7), 40523 (2012).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon