Method Article
רצף הכנסה טרנספוסון ככלי להבהב גורמי קולוניזציה חיידקיים בבורקהולדריה גלדיולי סימביונט של לגריה וילוסה בילס
In This Article
Summary
זוהי שיטה מותאמת לזיהוי גורמי קולוניזציה חרקים מועמדים בסימביונט מועיל Burkholderia. מארח חיפושית נגוע בספריית מוטציות אקראית שנוצרת באמצעות mutagenesis טרנספוסון, ומורכבות הספרייה לאחר קולוניזציה מושוות לשליטה גדל במבחנה.
Abstract
הסקת תפקוד הגנים על ידי מניפולציה של פעילותם היא כלי חיוני להבנת היסודות הגנטיים של רוב התהליכים הביולוגיים. ההתקדמות במיקרוביולוגיה מולקולרית ראתה את הופעתן של טכניקות מוטגנסיס מגוונות למניפולציה של גנים. ביניהם, רצף הכנסה טרנספוסון (Tn-seq) הוא כלי בעל ערך כדי להעריך בו זמנית את הפונקציונליות של גנים מועמדים רבים בצורה לא מנוטרלת. הטכניקה הייתה המפתח לזיהוי מנגנונים מולקולריים להתיישבות של פונדקאים אאוקריוטים במספר חיידקים פתוגניים וכמה סימביונים מועילים.
כאן, Tn-seq הוקמה כשיטה לזיהוי גורמי קולוניזציה בסימביונט גלדיולי של איילת לאגריה וילוסה. על ידי הטיות, Tn5 טרנספוסון בתיווך החדרה של קלטת עמידות לאנטיביוטיקה מתבצעת במקומות גנומיים אקראיים B. גלדיולי. כדי לזהות את ההשפעה של הפרעות גנטיות על היכולת של החיידקים ליישב את מארח היין, הספרייה הנוצרת B. גלדיולי טרנספוסון-מוטציה מחוסנת על ביצי היין, בעוד שליטה גדלה במבחנה במדיום תרבות נוזלית. לאחר מתן מספיק זמן להתיישבות, DNA מופק מתוך in vivo וספריות גידול במבחנה. בעקבות פרוטוקול הכנת ספריית DNA, דגימות הדנ"א מוכנות לרצף של החדרת טרנספוסון. שברי דנ"א המכילים את הקצה של ההחדרה הטרנספוסון ואת ה- DNA החיידקי האגף נבחרים, ואתרי המוטציה נקבעים על ידי רצף הרחק מקצה ההחדרה של טרנספוסון. לבסוף, על ידי ניתוח והשוואה של התדרים של כל מוטציה בין ספריות in vivo וספריות במבחנה, ניתן לחזות את החשיבות של גנים סימביונט ספציפיים במהלך קולוניזציה של חילוקיות.
Introduction
Burkholderia גלדיולי יכול לעסוק בקשר סימביוטי עם לאגריה villosa bes, משחק תפקיד חשוב בהגנה נגד אנטגוניסטים מיקרוביאליים של מארח חרקים4,5,6. נקבות האשכים מספר זנים של B. גלדיולי אביזר בלוטות מיוחדים למערכת הרבייה. על הטלת ביצים, נקבות למרוח B. תאי גלדיולי על פני הביצה שבו תרכובות מיקרוביאלית המיוצרות על ידי B. גלדיולי לעכב זיהומים על ידי פטריות אנטומופתוגניים4,6. במהלך התפתחות עוברית מאוחרת או מוקדם לאחר צוהר הזחלים, החיידקים ליישב פולשים cuticular על פני השטח של הזחלים. למרות לוקליזציה מיוחדת זו ומסלול שידור אנכי של הסימבינטים, L. villosa יכול ככל הנראה גם לרכוש B. גלדיולי אופקית מהסביבה4. יתר על כן, לפחות שלושה זנים של B. גלדיולי נמצאו בשיתוף עם L. villosa4,6. בין אלה, B. גלדיולי Lv-StA הוא היחיד כי הוא מקובל לטפח במבחנה.
ב. גלדיולי גודל הגנום של Lv-StA הוא 8.56 מגה-בתיםומכיל 7,468 גנים. איזה מהגנים האלה חשוב לחיידקי ב. גלדיולי כדי ליישב את מארח החילולי? כדי לענות על שאלה זו, השתמשנו ברצף טרנספוסון-החדרה (Tn-seq), שיטה חקרנית לזיהויגניםמיקרוביאליים חיוניים מותנים 1,2,3. ספריית מוטציות של B. גלדיולי Lv-StA נוצרה באמצעות טרנספוסון Tn5. באמצעות הטיות מתאי התורם של אשריצ'יה קולי ל- B. gladioli Lv-StA, הועברה פלסמיד pRL27 הנושא את טרנספוסון Tn5 וקסטה עמידות לאנטיביוטיקה המוקפת בחזרות הפוכות (איור 1). כך נוצרה קבוצה של מוטנטים הנושאים בנפרד שיבושים של 3,736 גנים סימביונטים (איור 2).
מאגר המוטציות הודבק על ביצי שולחן כדי לזהות את גורמי ההתיישבות, וכבקרה, גדל גם במבחנה במדיום קינגס B (KB). לאחר שאפשרו מספיק זמן להתיישבות, נאספו זחלים בקעו ונאספו להפקת דנ"א. שברי דנ"א המכילים את ההוספה טרנספוסון ואת האזור הגנומי האגף של B. גלדיולי Lv-StA נבחרו באמצעות פרוטוקול הכנת ספריית DNA שונה לרצף. קריאת עיבוד איכות ואחריו ניתוח עם DESeq2 בוצע כדי לזהות גנים ספציפיים חיוני עבור B. גלדיולי Lv-StA ליישב זחלי L. villosa כאשר מועברים דרך פני הביצה.
Protocol
1. הכנת מדיה ומאגר
- הכן לוחות מדיה אגר ו- KB ו- LB כפי שניתן בטבלה 1, ו- autoclave ב- 121 °C (70 °F), 15 פסאיי, 20 דקות.
- הוסף 50 מיקרוגרם / מ"ל מסנן קנאמיצין ו 300 μM מסנן מעוקר 2,6-חומצה דיאמינופימלית (DAP) למדיום LB autoclaved לפני culturing E.coli WM3064 + pRL27.
- הוסף 50 מיקרוגרם / מ"ל מסנן קנאמיצין לאגר KB autoclaved לשפוך צלחות הדרושות לבחירת מוצלח B. גלדיולי Lv-StA transconjugants.
- הכן 1x תמיסת מלח חוצצי פוספט (PBS) על ידי ערבוב הרכיבים הבאים: NaCl 8 g/L, KCl 0.201 g/L, Na2HPO4 1.42 גרם /L, ו KH2PO4 0.272 גרם / L. להמיס את המלחים במים מזוקקים autoclave התערובת ב 121 °C (70 °F), 15 psi, 20 דקות לפני השימוש. יש לאחסן בטמפרטורת החדר.
- הכן מאגר 2x של Bind-and-Wash על ידי המסת הרכיבים הבאים: 10 mM Tris-HCl (pH 7.5), 1 mM חומצה אתילנדיאמין טטראאצטית (EDTA) ו 2 M NaCl במים מזוקקים. מסננים-לחטא את התערובת לפני השימוש. יש לאחסן בטמפרטורת החדר.
- הכן 1x Low-TE על-ידי המסת 10 מ"מ-MM Tris-HCl (pH 8.0) ו-0.1 מ"מ EDTA במים מזוקקים כפולים. לחטא על ידי autoclaving ב 121 °C (5 °F) , 15 פסאיי, 20 דקות. יש לאחסן בטמפרטורת החדר.
2. הטיות ליצירת ספריית המוטציות של טרנספוסון
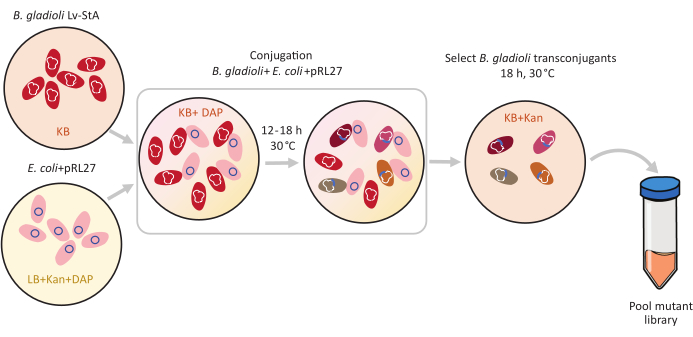
איור 1: שלבי פרוטוקול ההונאה. מקבל ההטיה Burkholderia גלדיולי Lv-StA (אדום) והתורם Escherichia coli המכיל pRL27 plasmid (ורוד) גדלים KB אגר ו LB, בהתאמה, בתוספת kanamycin ו DAP. לאחר העברה ההולכת וגואה של הפלסמיד במשך 12-18 שעות ב 30 °C (50 °F), תאי B. גלדיולי transconjugant נבחרים על KB המכילים kanamycin ומאובדים יחד. קיצורים: DAP = 2,6-חומצה דיאמינופימלית; קאן = קנאמיצין. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- תחת מכסה המנוע סטרילי, לחסן תרבות תורם טרי של Escherichia coli WM3064 + pRL27 ב 10 מ"ל של בינוני LB בתוספת kanamycin ו DAP. לחסן Burkholderia גלדיולי Lv-StA נמען תאים ב 5 מ"ל של בינוני KB. לדגור על התרבויות ב 30 °C (50 °F) לילה על שייקר ב 250 סל"ד.
- לאחר צמיחה בן לילה, צנטריפוגה 4 מ"ל של כל אחת מהתרבויות ב 9,600 × גרם במשך 6 דקות כדי גלולה את התאים. זרוק את סופר-טבעי.
- תחת מכסה המנוע סטרילי, לשטוף את תרביות התאים גלולה במדיום KB המכיל DAP ולבסוף resuspend התרבויות בנפרד ב 4 מ"ל של KB + DAP בינוני.
- בצינור 15 מ"ל טרי, לערבב 250 μL של התאים התורמים E. coli שטף עם 1 מ"ל של B. גלדיולי Lv-StA תאים נמען.
- ספוט 10 μL של תערובת תא ההטיות הזה על לוחות אגר KB המכילים DAP. אפשר לצלחת לנוח באין מפריע במכסה המנוע הסטרילי בטמפרטורת החדר למשך שעה. לאחר מכן, לדגור על הצלחות עם כתמי ההטיה ב 30 °C (50 °F) עבור 12-18 שעות.
הערה: ניתן להתאים את תקופת ההטיות בהתאם למין היעד. עם זאת, תקופת הטיות ארוכה מגבירה את הסיכון להכנסות כפולות או שילוב פלסמיד בגנום. עבור חיידקים הגדלים באיטיות, אפשרו תקופות הטיות ארוכות יותר. - לאחר הדגירה, להוסיף 2-4 מ"ל של 1x PBS לתוך הצלחות מתחת למכסה המנוע סטרילי ולהשתמש מגרד תאים כדי לשחרר את כתמי ההטיות החיידקיים הבוגרים מן agar. פיפטה, תערובת התאים הצמודים לצינורות מיקרו-פוגה של 2 מ"ל.
- גלולה התאים על ידי centrifuging ב 9,600 × גרם במשך 2 דקות. להשליך את supernatant ולשטוף את הכדור פעמיים ב 1 מ"ל של 1x PBS על ידי pipetting למעלה ולמטה. resuspend הכדור הסופי ב 1200 μL של 1x PBS. לעשות דילול לפני ציפוי אם מספר התאים בתערובת הוא מעל 1 × 104.
- מערבבים היטב ומפיצים 200 μL של תערובת התא על לוחות אגר KB גדולים (6 או יותר, במידת הצורך) בתוספת kanamycin ודגרה ב 30 °C (50 °F) לילה.
הערה: מושבות מוטציות היעד מופיעות בתוך 30 שעות על לוחות אגר סלקטיביים. בשל סמן העמידות לאנטיביוטיקה, רק מושבות שעברו מוטציה מופיעות על צלחת אגר סלקטיבית. לכן, כל המושבות צפויות להיות טרנס-כניעות מוצלחות. - לספור את המספר הכולל של מושבות transconjugant על שלוש לוחות ולהסיק כדי לחשב את המספר המשוער של מוטציות שהושגו בכל הלוחות. כדי להגדיל את הסיכויים לקבל ספרייה ייצוגית, ודא כי המספר הכולל של מושבות הוא פי כמה גבוה יותר מאשר המספר הכולל של הגנים בגנום. כדי לאשר את הצלחת ההטיות, בצע PCR המתמקד בקלטת ההכנסה באמצעות 10-20 מושבות לדוגמה, כמתואר בסעיף 3.
הערה: המטרה היא להבטיח שמספר המושבות יהיה לפחות פי 10 ממספר הגנים בכל הגנום, במקרה זה, >75,000 מוטנטים. עם זאת, בדרך כלל קשה להעריך במדויק את מספר המושבות שיתאימו לספרייה מייצגת לחלוטין. מספר הגנים הייחודיים שעברו מוטציה אינו ניכר בשלב זה, בהתחשב בכך שהשיבושים בגנים חיוניים אינם נלכדים, לעתים קרובות ישנם אתרי מוטציה שונים מרובים לאותו גן, ומוטציות הנוצרות עם טרנספונים Tn5 אינן אקראיות לחלוטין. - מתחת למכסה המנוע הסטרילי, לגרד מושבות מן הצלחות על ידי הוספת 1-2 מ"ל של 1x PBS על אגר. בריכה תערובת התאים גירד מן הצלחות לתוך צינורות 50 מ"ל. מערבולת הספרייה לערבב ביסודיות ולאחר מכן לפצל 4 מ"ל של ספריית מוטציות בריכה למספר cryotubes. הוסף 1 מ"ל של 70% גלצל לצינורות ולאחסן ב -80 °C (70 °F).
3. אלקטרופורזה PCR וג'ל כדי לאשר כניסות מוצלחות ב B. גלדיולי Lv-StA
- כדי לאשר את נוכחות ההוספה, בחר מושבות מוטציות בודדות מלוחות הבחירה בשלב 2.9 ובצע PCR המתמקד בקלטת ההכנסה באמצעות הפריימרים המפורטים בטבלה 2. הכן את תערובת המאסטר של PCR בהתאם לטבלה 3 והגדר תנאים ברכב האופניים התרמי כמתואר בטבלה 4.
- הפעל את מוצרי PCR על ג'ל אגרוז 1.6% על ידי אלקטרופורזה (250 V, 40 דקות) כדי לבדוק אם שברי ה- DNA המוגברים הם באורך הצפוי של 1580 bp.
4. זיהום בבריכת מוטציות על ביצי איילת
- שלבי כביסה בספרייה
- להפשיר aliquot של ספריית המוטציות המוכנות על קרח. צנטריפוגה ב 2,683 × g במשך 10 דקות ולהסיר את supernatant. תחת מכסה המנוע סטרילי, לשטוף את התאים עם 4 מ"ל של 1x PBS כדי להסיר כל מדיום שנותר מהתאים. resuspend התאים ב 4 מ"ל של 1x PBS.
- ספירת מספר התאים ב aliquot של הספריה באמצעות תא ספירת תאים. לדלל חלק מהספריה ל- 2 × 106 תאים/μL ב- 1x PBS.
- מערבולת הספרייה aliquot ביסודיות לערבב את הספרייה כולה הומוגנית לפני לקיחת הנפח הנדרש.
- עיקור מצמד ביצים וזיהום ב-vivo
- בחר מצמד ביצת ל. וילוסה. לספור את מספר הביצים ולהמשיך אם המצמד מכיל יותר מ 100 ביצים.
- מחטאים את כל מצמד הביצים.
- מוסיפים 200 μL של 70% אתנול בעדינות לשטוף את הביצים במשך 5 דקות. הסר את האתנול ולשטוף את הביצים פעמיים עם מים autoclaved.
- מוסיפים 200 μL של 12% אקונומיקה (NaOCl) ולשטוף בעדינות את הביצים במשך 30 s. הסר את אקונומיקה מיד לשטוף את הביצים שוב שלוש פעמים עם 200 μL של מים autoclaved.
- להדביק 2 × 106 תאים / μL של ספריית מוטציות שטף על מצמד הביצה מעוקר (2.5 μL לביצה).
- יומיים לאחר צוהר זחלי הזחלים הנגועים, לאסוף 1002 2 2 זחלים instar לכל צינור מיקרופוגה 1.5 מ"ל ולאחסן ב -80 °C (80 °F).
-
בקרת ספריית המוטציות במבחנה
- תחת מכסה המנוע הסטרילי, לחסן 250 μL של 2 × 106 תאים / μL של ספריית מוטציה שטופה ב 10 מ"ל של בינוני KB המכיל kanamycin.
- לדגור על תרבות המוטציה במבחנה ב 30 °C (50 °F) במשך 20 שעות.
הערה: חשב את משך הדגירה כך שיתאים למספר הדורות המשוער של WT B. גלדיולי Lv-StA ב vivo במהלך קולוניזציה. - לאחר הדגירה של 20 שעות, הוסף נפח שווה של 70% גלילצל לתרבות המוטציה במבחנה ולאחסן אותו ב -80 °C (70 °F).
5. סלק נגוע ומיצוי דנ"א בספריית המוטציה במבחנה
הערה: עקירות DNA בוצעו באמצעות DNA וערכת טיהור RNA על פי פרוטוקול היצרן המתואר בקצרה להלן.
- הומוגניזציה זחלים מלובד (מקסימום של 4 מ"ג לכל צינור microfuge) על ידי הוספת 1-2 מ"ל של חנקן נוזלי ריסוק עם עלה.
- להפשיר את תרביות המוטציות הגדלות במבחנה ממניות הגליצריול על הקרח. גלולה התאים על ידי centrifuging ב 9,600 × גרם במשך 10 דקות לפני תמוגה התא.
- הוסף 300 μL של פתרון תמיסת רקמות ותאים במבחנה ודגימות in vivo. מוסיפים 5 μL של 10 מ"ג / מ"ל Proteinase K, לדגור על התערובת ב 60 °C במשך 15 דקות, ולאחר מכן מניחים על קרח במשך 3-5 דקות.
- הוסיפו 150 מיקרו-אל של ריאגנט משקעים של חלבון לריסטים ולמערבולות ביסודיות. גלם את פסולת החלבון על ידי צנטריפוגה ב 9,600 × גרם במשך 10 דקות.
- מעבירים את הסופר-נט לצינור מיקרופוגה 1.5 מ"ל. הוסף 500 μL של איזופרופנול לסופרננט והפוך בעדינות את הצינורות לפחות 40 פעמים לפני הדגירה ב -20 °C (50 °F) למשך שעה אחת או לילה.
- פלט את ה- DNA המואצת על ידי צנטריפוגה ב 9,600 × גרם במשך 10 דקות. השליכו את הסופר-נט והוסיפו 70% אתנול קר כקרח לכדור הדנ"א.
- צנטריפוגה ב-≥10,000 × גרם למשך 5 דקות. להשליך את supernatant ולהשאיר את הדגימות לייבוש אוויר לפחות 1 שעה.
- resuspened ה- DNA מן במבחנה ודגימות in vivo ב 100 μL של מאגר נמוך TE.
- לאחסן את הדגימות ב -20 °C (50 °F).
6. הכנת ספריית רצף
הערה: הפרוטוקול והריגנטים להכנת ספריית DNA מותאמים ומשתנים מההוראות שסופקו על ידי יצרן ערכת הכנת ספריית ה- DNA.
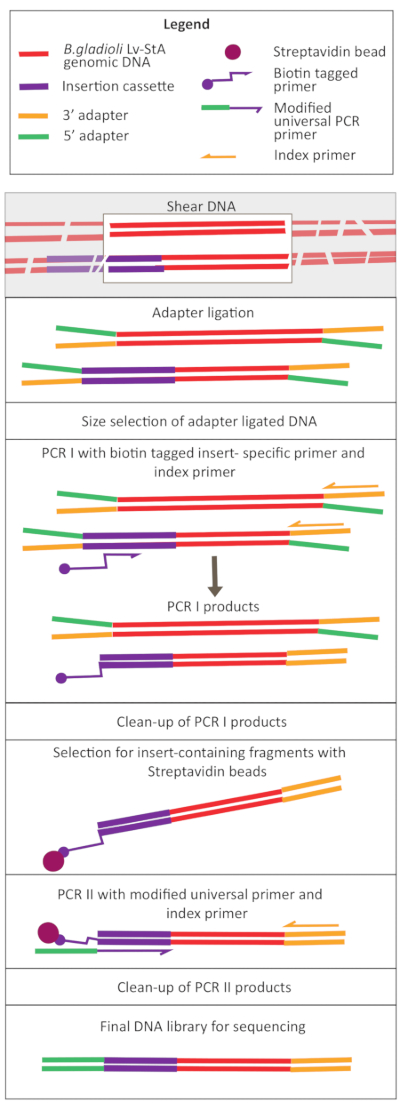
איור 2: שרטוט של שלבי הכנת ספריית הדנ"א. לאחר גזוזה וקשירת מתאם, הפרוטוקול שהשתנה כולל שלב בחירת חרוזים של סטרפטאבידין להעשרת שברי DNA המכילים את קלטת הכניסה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
- לדלל את הדגימות לריכוז 20 ננוגרם / μL ונפח של 100 μL ולשמור אותם על קרח.
- גזור ב vivo ו אין ויטרו דגימת DNA באמצעות ultrasonicator. הגדר את ultrasonicator ב 70% כוח. מערבולת את הדגימות בקצרה לגיז במשך 1 דקות 30 s.
הערה: ההגדרות עבור ultrasonicator יהיה שונה בין מכשירים. במקרה זה, גודל הקטע היה 200-400 bp, אשר מתאים לגישה זו רצף של 150 bp, זיווג-סוף (ראה שלב. 9.1). ניתן להתאים את פרמטרי הגיסה בהתאם לדרישות הנסיין. - בדוק אם ה- DNA היה גזירה לטווח הגודל הרצוי (במקרה זה, 200-400 bp). טען 5 μL של DNA unsheared ו גיזום לאחר ערבוב עם צבע טעינת ג'ל ביחס 1:1 על 1.6% agarose ג'ל לרוץ ב 250 V במשך 40 דקות(איור 3A,B).
- הכנת קצות מקטע הנדרשים עבור קשירת מתאם
- כדי 50 μL של DNA גיה, להוסיף את ריאגנטים הכנת סוף שניתנו בערכת הכנת הספרייה: 3 μL של תערובת אנזימים ו 7 μL של חיץ תגובה לערבב היטב על ידי pipetting. הגדר רוכב אופניים תרמי עם מכסה מחומם ב ≥ 75 °C (75 °F) ודגרה הדגימות במשך 30 דקות ב 20 °C (60 °F) ו 30 דקות ב 65 °C (65 °F). החזק ב 4 °C (5 °F).
- קשירת מתאם
- עבור קשירת מתאם, הוסף את ריאגנטים הבאים למוצרים של שלב ההכנה הסופית: 30 μL קשירת מאסטר מיקס, 1 μL ligation משפר, ומתאם מדולל 2.5 μL. מערבבים ביסודיות על ידי צנרת ודגרה המדגם במשך 15 דקות ב 20 °C (50 °F) ב אופניים תרמית עם המכסה מחומם כבוי.
- לאחר 15 דקות, להוסיף 3 μL של האנזים (גליקוסילסילאז DNA uracil + DNA גליקוסילאז-ליאז אנדונקולאז השמיני) (ראה טבלת החומרים). מערבבים היטב על ידי צנרת ודגרה המדגם במשך 15 דקות ב 37 °C (50 °F) באופניים תרמי עם המכסה מחומם ב ≥47 °C (77 °F).
הערה: ניתן להשהות את הפרוטוקול בשלב זה, וניתן לאחסן את הדגימות ב- -20 °C (70 °F).
- בחירת גודל של שברי DNA עם קשירת מתאם של 250 bp
- מערבולת את פתרון החרוזים המגנטיים (ראה את שולחן החומרים) ומניחיםאותו בטמפרטורת החדר במשך 30 דקות לפני השימוש.
- מוסיפים 0.3x חרוזים ל-96.5 מיקרו-אל מתערובת הדנ"א המקשר ומערבבים על ידי צנרת יסודית. לדגור על תערובת החרוזים במשך 5 דקות.
הערה: נוכחותם של מלחים ופוליאתילן גליקול בתערובת החרוזים מקלה על משקעים של שברי DNA על החרוזים. יחס נמוך של חרוזים למולקולות דנ"א מוביל לכריכה של שברי דנ"א גדולים יותר בלבד אל החרוזים. במקרה זה, שברי DNA מעל 250 bp אורך קשורים חרוזים. - מניחים את הצינורות על מעמד מגנטי כדי למשוך את החרוזים ולהסיר שברי DNA בגודל לא רצוי. תן לחרוזים להסתפק במשך 5 דקות ולאחר מכן להעביר את supernatant ברור צינור microfuge חדש (לשמור על supernatant).
- הוסיפו 0.15x של חרוזים טריים לסופר-טבעי ותערבבו על ידי צנרת היטב. לדגור על תערובת החרוזים במשך 5 דקות ולאחר מכן למקם את הצינורות על עמדה מגנטית כדי למשוך את החרוזים הקשורים לדנ"א היעד. המתן 5 דקות ולאחר מכן להשליך את supernatant (לשמור על החרוזים).
הערה: יחס זה של חרוזים ל- DNA מוביל לכריכה של שברים בגודל הרצוי של 250 bp. - עם החרוזים על הדוכן המגנטי, להוסיף 200 μL של 80% אתנול (מוכן טרי) ולחכות 30 s. פיפטה החוצה להשליך את לשטוף אתנול בזהירות מבלי להפריע החרוזים על הדוכן המגנטי. חזור על שלב זה.
- לאחר הכביסה האחרונה, להסיר עקבות של אתנול מן החרוזים ולאחר מכן לייבש את החרוזים במשך 2 דקות עד שהם נראים מבריק אבל לא מיובש לחלוטין. אין לייבש יתר על המידה את החרוזים.
- הסר את הצינורות מהמעמד המגנטי והוסף 17 μL של 10 mM Tris-HCl או TE 0.1x (TE נמוך). מערבבים על ידי צנרת ~ 10 פעמים ודגרה התערובת בטמפרטורת החדר במשך 2 דקות.
- מניחים את הצינורות בחזרה על העמדה המגנטית ולחכות 5 דקות. ברגע החרוזים התיישבו, להעביר את DNA supernatant לצינור חדש.
- PCR I להוספת תג ביוטין לרסיסי DNA המכילים את קלטת ההוספה
- הוסף תג פריימר ביוטיניל לרסיסי ה- DNA המכילים את קלטת ההכנסה Tn5 באמצעות פריימר ביוטינילאט ספציפי לטרנספוסון (טבלה 5) ובריימר אינדקס. הכן את תערובת ה- PCR הראשי בהתאם לטבלה 6 ופעל בהתאם לתנאי ה- PCR עבור רוכב האופניים התרמי המפורט בטבלה 7.
- ניקוי PCR I ללא בחירת גודל
- מערבולת 0.9x חרוזים ומניחים אותם בטמפרטורת החדר לפחות 30 דקות לפני הניקוי.
- הוסיפו חרוזים פי 0.9 למוצרי ה-PCR וערבבו היטב.
- מניחים את החרוזים על מעמד מגנטי כדי להוריד את החרוזים.
- הסר את supernatant ברור לשטוף את החרוז כבול DNA עם 200 μL של 80% אתנול מוכן טרי פעמיים.
- הסר את האתנול לאחר צעדי הכביסה ואוויר יבש החרוזים עד שהם נראים מבריק אבל לא יבש מדי.
- הוסף 32 μL של 10 mM Tris-HCl או TE 0.1X (TE נמוך) ודגר את החרוזים למשך 5 דקות. מניחים את התערובת בחזרה על העמדה המגנטית ומעבירים את supernatant לצינור microfuge טרי.
- כריכת שברי דנ"א ביוטינילים לחרוזי סטרפטאבין
- Resuspend 32 μL של חרוזים סטרפטאבידין ב 1x לאגד ולשטוף חוצץ. לשטוף את החרוזים עם המאגר שלוש פעמים בעת הצבה על מעמד מגנטי.
- הוסף 32 μL של 2x חיץ איגוד ושטיפה ו resuspend החרוזים. לכך, להוסיף 32 μL של מוצרי PCR 1 ניקה. מערבבים היטב ודגרה בטמפרטורת החדר במשך 30 דקות.
- מניחים את תערובת החרוזים-DNA על מעמד מגנטי במשך 2 דקות. פיפטה את supernatant כמו ביוטין מתויג DNA המכיל את קצה הכניסה נקשר סטרפטאבידין על החרוזים.
- לשטוף את החרוזים עם 500 μL של 1x לאגד ולשטוף חוצץ ולאחר מכן לשטוף את החרוזים עם 200 μL של נמוך TE. יש לתעד מחדש את החרוזים הקשורים לדנ"א ב-17 מיקרו-אל של ת"א נמוך.
- PCR II להוספת מתאמים למקטעים המכילים את קצה קלטת הכניסה
- הכן תערובת ראשית, כפי שמוצג בטבלה 8, באמצעות פריימרים של אינדקס ותמרים אוניברסליים של PCR המפורטים בטבלה 5. הוסף 15 μL של חרוזי סטרפטווידין הקשורים ל- DNA מהשלב הקודם לתערובת PCR. ראה טבלה 7 עבור תנאי רוכב האופניים התרמיים.
- נקה את מוצרי ה- PCR ללא בחירת גודל כפי שניתן בשלב 6.8 של פרוטוקול זה. יש לחמוק ממוצרי הדנ"א הסופיים ב-30 מיקרו-אל של מים ברמה מולקולרית.
- אחסן את הדגימות ב- -20 °C והשתמש בהן לרצף.
7. רצף וניתוח
- רצף הספריה באמצעות טכנולוגיית ריצוף תפוקה גבוהה. התאם את עומק הרצף בהתאם לגודל ספריית ההשתנות, כפי שצוין להלן. להעריך את איכות הקריאה עם FastQC7. בחר קריאות המכילות את קצה הכנסה Tn5 בקצה 5 ' של הקריאה והסר את רצף קצה הכניסה באמצעות Cutadapt8 ו/ או Trimmomatic9.
הערה: כאן, גישת רצף משויכת שימשה למיקוד 150 bp לקריאה ובסך הכל 8 קריאות Mio. כדי להשיג ערכת נתונים מייצגת, ודא שהמספר הכולל של קריאות רצפות עולה על המספר המרבי האפשרי של מוטציות בספריה, כלומר המספר המוערך הכולל של מושבות מהשלב 2.9. כהפניה, פרוטוקול זה מכוון פי 40 מגודל הספרייה המרבי האפשרי. מחקרים מוצלחים אחרים באמצעות Tn-seq למטרה דומה ריצפו מספר כולל של קריאות קרוב פי 25 של המספר בפועל של הוספות ייחודיות בספריית המוטציות המתאימה22,23. - בהתחשב בכך מוטציות בקצי הגנים אינן מפריעות מבחינה תפקודית, לקצץ 5% את שני קצות הביאורים הגנטיים של קובץ GFF הגנום הייחוס. מפה את הקריאות הקצוצות לגנום הייחוס באמצעות Bowtie210.
- חשב את מספר הוספות ממספר המיקומים הייחודיים של 5' בקובץ BAM היישור.
- באמצעות FeatureCounts11, השג את מספר הגנים של הלהיטים עבור כל דגימת שכפול.
- באמצעות חבילת DESeq212 ב RStudio, לחשב את ההבדל בשפע מוטציות בין תנאים שונים.
תוצאות
חיידקים הקשורים לפונדקאי יכולים להעסיק מספר גורמים כדי ליצור קשר, כולל אלה בתיווך הידבקות, תנועתיות, כימוטקסיס, תגובות מתח, או מובילים ספציפיים. בעוד גורמים חשובים עבור אינטראקציות פתוגן מארח דווחו עבור מספר חיידקים13,14,15,16,17,18, כולל חברים בסוג Burkholderia19,20, פחות מחקרים חקרו את המנגנונים המולקולריים המשמשים סימביונים מועילים עבור קולוניזציה21,22,23 . באמצעות רצף החדרת טרנספוסון, המטרה הייתה לזהות גורמים מולקולריים המאפשרים B. גלדיולי ליישב את L. villosa bes.
מוטגנזה בתיווך טרנספוסון בוצעה באמצעות pRL27 plasmid, הנושא טרנספוסון Tn5 וקלטת התנגדות קנאמיצין מוקף על ידי הפוך אתרים חוזרים. הפלסמיד הוכנס לתוך היעד B. תאי גלדיולי Lv-StA על ידי הטיות עם תורם פלסמיד E. coli WM3064 (כפי שמוצג באיור 1). לאחר ההטיה, תערובת ההטיה המכילה את נמען הגלדיולי B. ותאי התורם E. coli היו מצופים על לוחות אגר סלקטיביים המכילים קנאמיצין. היעדר DAP על הצלחות חיסל את התאים התורמים E. coli, ואת נוכחותו של kanamycin שנבחר עבור מוצלח B. גלדיולי Lv-StA transconjugants. הספרייה המוטנטית B. gladioli Lv-StA שהתקבלה מקציר 100,000 המושבות הטרנס-יבשתיות הוכנה לרצף באמצעות ערכת הכנת ספריית דנ"א מותאמת ובריימרים מותאמים אישית. איור 2 מדגיש את שלבי ההכנה לספריית הדנ"א. רצף הניב 4 קריאות מזווגות של מיו; 3,736 גנים מתוך 7,468 גנים ב B. גלדיולי Lv-StA שובשו.
כדי לזהות מוטנטים שהיו פגומים בהתיישבות בפונדקאי, ספריית המוטציות B. gladioli Lv-StA נדבקה בביצי היין וגדלה במבחנה במדיום KB כשליטה. גודל צוואר הבקבוק של קולוניזציה in vivo חושב לפני הניסוי. מספר ידוע של תאי B. גלדיולי Lv-StA נדבקו בביצי אשקלה, ומספר התאים המתיישבים בזחלי הכוכב הראשון שקעו זה עתה הושג על ידי ציפוי השעיה מכל זחל וספירת יחידות יוצרות מושבה לאדם. חישובים אלה נעשו כדי להבטיח שמספר התאים המתיישבים מספיק כדי להעריך את כל או אחוז גבוה של המוטנטים בספרייה על יכולתם ליישב את הפונדקאי. בנוסף, זמן הצמיחה בין אין במבחנה לבין תנאי vivo היה מנורמל בהתבסס על מספר הדורות חיידקים כדי להפוך דגימות אלה לשווה.
לאחר שהביצים בקעו, נאספו 1,296 זחלים ב-13 בריכות. התרבויות המוטנטיות במבחנה המקבילות גדלו ואוחסנו כמניות גליסול. DNA של in vivo וספריות מוטציות גדל במבחנה הוצא ופוצל ultrasonicator. איור 3 מציג את התפלגות הגודל של הדנ"א הנמרץ, שבו רוב השברים משתרעים על פני 100 עד 400 bp, כצפוי. שלב זה בוצע לאחר פרוטוקול הכנת ספריית DNA שונה לרצף. בכל שלב של הפרוטוקול, הריכוז של ה- DNA הנותר נבדק כדי לוודא כי הצעדים בוצעו כראוי כדי לעקוב אחר אובדן של DNA. בדיקת איכות (ראה טבלת החומרים) לפני הרצף העלתה כי ספריות הדנ"א הכילו שברי DNA גדולים באופן בלתי צפוי (>800 bp), והדבר היה בולט יותר בספריות in vivo. בהתחשב בקושי לייעל את קיבוץ השברים בנתיבי הרצף, היה צורך להגדיל את עומק הרצף ל-10 קריאות זיו בספריות in vivo כדי להשיג את מספר הקריאות הרצוי. ניתוח תוצאות הרצף העלה כי ממוצע של 4 Mio קורא בספריות in vivo ו 3.1 Mio קורא בספריות במבחנה הכיל את קצה Transposon בסוף 5 'של Read-1 (טבלה 9), אשר היה משביע רצון לניסוי זה. התפלגות 24,224 ההוספות הייחודיות ברחבי הגנום של B. gladioli בספרייה המקורית מוצגת באיור 4. ניתוח שנערך באמצעות DESeq2 גילה כי השפע של 271 מוטציות היה שונה באופן משמעותי בין in vivo לבין תנאי במבחנה.
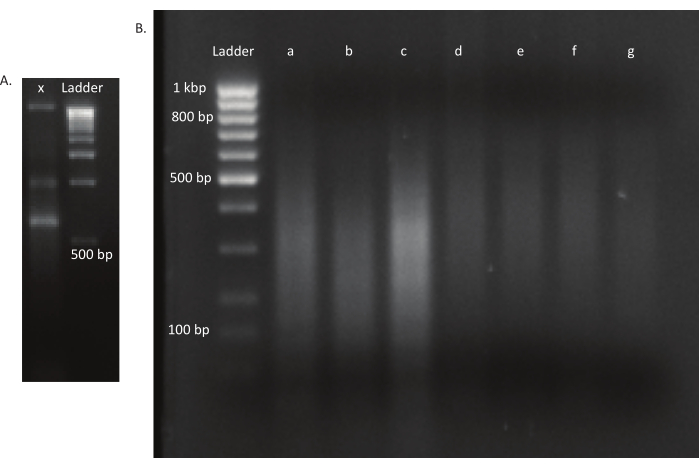
איור 3: ג'לים של מוטציה וספריות דנ"א. (א)ג'ל אגרוז עם דנ"א לא נגף של מוטציה בנתיב x וסולם של 1 kbp לקנה מידה. (ב)ג'ל עם ספריית דנ"א גיהית. גדלי הרצועה של הסולם בנתיב הראשון מסומנים בצד שמאל. שלושת הנתיבים הראשונים a, b ו- c מכילים שברי DNA גרוסים של ספריות in vivo . נתיבים d, e, f ו- g מכילים שברי דנ"א גועכים של ספריות ההחצטה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
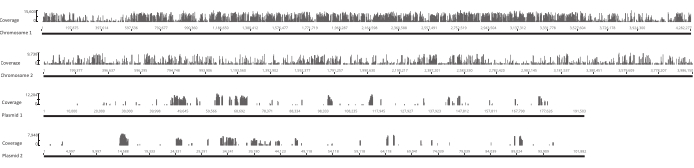
איור 4: מיקום אתרי הכנסה ייחודיים בספרייה המקורית על פני ארבעת השרידים בגנום גלדיולי Lv-StA של בורקהולדריה. כל פס לאורך ציר ה- x ממוקם באתר של הוספה. הגובה של סרגל לאורך ציר ה- y תואם למספר הקריאות המשויכות לאתר זה. שים לב כי שני כרומוזומים ושני plasmids מוצגים באורך מלא ולכן יש קשקשים שונים על ציר x. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| קינגס בי מדיום/ אגר | |
| פפטון (פולי סויה) | 20 גרם/ל' |
| K2HPO4 | 1.5 גרם/ל' |
| MgSO4.7H2O | 1.5 גרם/ל' |
| אגר | 15 גרם/ל' |
| מומס במים מזוקקים | |
| LB בינוני/אגר | |
| טריפטון | 10 גר'/ל' |
| תמצית שמרים | 5 גרם/ל' |
| NaCl | 10 גר'/ל' |
| מומס במים מזוקקים | |
טבלה 1: רכיבי מדיה.
| לא. | פריימרים | רצף | טמפרטורת חישול PCR. (°C) | |
| 1 | tpnRL17–1RC | 5'-CGTTACATCTGGCTTGTT-3' | 58.2 | |
| 2 | tpnRL13–2RC | 5'-TCGTGAAGAAGGTGTTGCTG-3' | ||
לוח 2: פריימרים כדי לאשר את הצלחת ההטיות.
| רכיב | אמצעי אחסון (μL) |
| מים מטוהרים ב-HPLC | 4.92 |
| 10x Buffer S (ספציפיות גבוהה) | 1 |
| MgCl2 (25 מ"ר) | 0.2 |
| dNTPs (2 מ"מ) | 1.2 |
| פריימר 1 (22:00/μL) | 0.8 |
| פריימר 2 (22:00/μL) | 0.8 |
| טאק (5 U/μL) | 0.08 |
| סה"כ מאסטרמיקס | 9 |
| תבנית | 1 |
טבלה 3: תמהיל מאסטר PCR כדי לאשר את ההצלחה של הטיות. קיצורים: HPLC = כרומטוגרפיה נוזלית בעלת ביצועים גבוהים; dNTPs = deoxynucleoside triphosphate.
| שלבים | טמפרטורה °C (55°F) | זמן | מחזורים |
| דנטורציה ראשונית | 95 | 3 דקות | 1 |
| דנטורציה | 95 | שנות ה-40 | |
| חישול | 58.2 | שנות ה-40 | 30 עד 35 |
| סיומת | 72 | 1-2 דקות | |
| הארכה סופית | 72 | 4 דקות | 1 |
| אחז | 4 | ∞ | |
טבלה 4: תנאי PCR כדי לאשר את הצלחת ההטיות.
| פריימרים | רצף | ת"מ °C | שימוש | מקור | |
| פריימר ביוטינילי ספציפי לטרנספוסון | 5'-ביוטין-ACAGGAACACTTAGGCTGACATG -3' | 63.5 | 6.7.1. PCR I | מנהג | |
| פריימר PCR אוניברסלי שהשתנה | 5'- אטגאטאקגאקאקאגאטק TACACTCTCTACACGACGCTC TTCCGATCTGAATTCATCGATGAT GGTTGAGATGTGT – 3' | 62 | 6.10.1. PCR II | מנהג | |
| פריימר אינדקס | עיין במדריך של היצרן | 6.7.1. PCR I &6.10.1. PCR II | NEBNext מולטיפלקס אוליגוס עבור אילומינה (פריימרים אינדקס להגדיר 1) | ||
| מתאם | עיין במדריך של היצרן | 6.5. קשירת מתאם | ערכת הכנה לספריית DNA של NEBNext אולטרה II עבור אילומינה | ||
טבלה 5: פריימרים ומתאם עבור PCR I ו- II במהלך הכנת ספריית DNA.
| תערובת PCR | (μL) |
| שברי DNA עם קשירת מתאם | 15 |
| NEBNext אולטרה II Q5 תערובת מאסטר | 25 |
| פריימר אינדקס (10 pmol / μL) | 5 |
| פריימר ביוטינילציה ספציפי טרנספוסון (10 pmol / μL) | 5 |
| סה"כ אמצעי אחסון | 50 |
טבלה 6: הכנת ספריית DNA -תמהיל מאסטר PCR I.
| שלבים | טמפרטורה | זמן | מחזורים |
| דנטורציה ראשונית | 98 °C (77 °F) | שנות ה-30 | 1 |
| דנטורציה | 98 °C (77 °F) | שנות ה-10 | 6 עד 12 |
| חישול | 65 °C (75 °F) | שנות ה-30 | |
| סיומת | 72 °C (72 °F) | שנות ה-30 | |
| הארכה סופית | 72 °C (72 °F) | 2 דקות | 1 |
| אחז | 16 °C (77 °F) | ∞ | |
טבלה 7: הכנת ספריית DNA -תנאיPCR I ו- II.
| תערובת PCR | (μL) |
| דנ"א שנבחר על-ידי חרוזים | 15 |
| NEBNext אולטרה II Q5 תערובת מאסטר | 25 |
| פריימר אינדקס | 5 |
| פריימר PCR אוניברסלי שהשתנה | 5 |
| סה"כ אמצעי אחסון | 50 |
טבלה 8: הכנת ספריית DNA -תמהיל מאסטר PCR II.
| ספריות | איניבו-1 | איניבו-2 | איניבו-3 | Invitro-1 | Invitro-2 | Invitro-3 | ספריה מקורית | |
| לא. של קריאות (PE) | 56,57,710 | 39,19,051 | 30,65,849 | 35,73,494 | 28,83,440 | 36,61,956 | 46,09,410 | |
| לא. של קריאות המכילות Tn – קצה בקצה 5' של Read-1 | 54,15,880 | 37,31,169 | 29,36,247 | 33,00,499 | 27,35,705 | 33,50,402 | 41,53,270 | |
| Bowtie2 שיעור יישור כולל (%) (לקריאה-1 בלבד) | 95.53% | 83.71% | 89.87% | 80.79% | 78.00% | 73.06% | 74.92% | |
| מספר הוספות ייחודיות | 8,539 | 4,134 | 7,183 | 18,930 | 18,421 | 20,438 | 24,224 | |
| מספר הגנים שנפגעו | 1575 | 993 | 1450 | 2793 | 2597 | 3037 | 3736 | |
טבלה 9: סיכום של פלט רצף ותדירות הכנסה של טרנספוסון לכל ספריה. קיצור: PE = קצה מזווג.
Discussion
ספריית מוטציות טרנספוסון של B. גלדיולי נוצרה כדי לזהות גורמי קולוניזציה מארחים חשובים באינטראקציה הסימביוטית בין סלק L. villosa וחיידקי B. גלדיולי. הצעדים העיקריים בפרוטוקול היו הטיות, זיהום מארח, הכנת ספריית DNA ורצף.
כמו זנים רבים של Burkholderia הם מקובלים על שינוי גנטי על ידי הטיות24,25, plasmid נושא את קלטת טרנספוסון והכנסת אנטיביוטיקה היה מצומד בהצלחה לתוך היעד B. זן גלדיולי Lv-StA מ E. coli. ניסיונות טרנספורמציה קודמים על ידי אלקטרופורציה הניבו נמוך מאוד כמעט ללא טרנספורמטים של גלדיולי B. מומלץ לייעל את טכניקת הטרנספורמציה עבור האורגניזם היעד להניב ביעילות מספר רב של טרנספורמטים.
סבב אחד של הטיות ו-40 נקודות הטיות שיבשו 3,736 גנים ב-B. גלדיולי Lv-StA. במבט לאחור, יהיה צורך בסבבים מרובים של הטיות כדי לשבש את רוב 7,468 הגנים ולקבל ספרייה רוויה. ראוי לציין, זמן הדגירה במהלך ההטיות לא הורשה לעלות על 12-18 שעות, המהווה את סוף שלב הצמיחה המעריכי של B. גלדיולי. מתן אפשרות להטיות מעבר לשלב הצמיחה המעריכי של תאי חיידקים מקטין את סיכויי ההצלחה להשיג טרנס-קונצ'וגנטים26. לכן, יש להתאים את תקופת ההטיות בהתאם לצמיחת המינים החיידקיים.
כדי לבצע בהצלחה ניסוי הכולל זיהום של ספריות מוטציות במארח, חשוב להעריך את גודל צוואר הבקבוק של אוכלוסיית החיידקים במהלך ההתיישבות ואת מגוון המוטנטים בספרייה לפני זיהום1,2,27. כהכנה לניסוי, הערכנו את המספר המינימלי של לחפשיות שיש להדביק כדי שיהיה סיכוי גבוה שכל מוטציה בספרייה תידגם ותורשה להתיישב. זמן ייצור החיידקים המשוער ב-vivo ומספר הדורות למשך הניסוי חושבו גם הם. תרבות ההחמה גדלה אז למספר דומה של דורות על ידי התאמת זמן הדגירה. לניסוי זיהום דומה אצל מארחים אחרים שאינם מודלים, היכולת לשמור על תרבות מעבדה ומקור קבוע של האורגניזמים המארחים רצויה.
בעקבות צמיחת ספריית המוטציות ב- vivo ובאיסוף במבחנה ובדגימה, בוצע פרוטוקול הכנת ספריית DNA שונה לרצף החדרת טרנספוסון. השינוי בפרוטוקול כלל עיצוב פריימרים PCR מותאמים אישית והוספת שלבי PCR לבחירה עבור שברי DNA המכילים את קלטת הכניסה. מאחר שהפרוטוקול הותאם אישית, מחזורי PCR נוספים בפרוטוקול הגבירו את הסיכון לפשטנות יתר וקבלת מקטעי מתאם-מתאם היברידיים בספריות הקצה. לפיכך, מומלץ לשלב ניקוי סופי (ללא בחירת גודל) לאחר שני PCRs, שכן הוא מסייע בהסרת שברים אלה. התפלגות הגודל של ספריות הדנ"א הייתה עדיין רחבה מהצפוי. עם זאת, הגדלת עומק הרצף סיפקה מספיק נתונים שסוננו במהלך ניתוח ביואינפורמטיקה, והשיגה תוצאות משביעות רצון.
מכיוון שמוטגנסיזה בתיווך טרנספוסון מייצרת אלפי כניסות אקראיות בניסוי אחד, ניתן ליצור ספרייה רוויה של מוטציות המכילה את כולם מלבד המוטנטים שבהם גנים החיוניים לצמיחת חיידקים שובשו. סביר להניח שלא עבדנו עם ספריית מוטציות רוויה, בהתחשב בהערכות של גנים חיוניים במחקרים אחרים על Burkholderia sp. 28,29. ספריה לא רוויה בכל זאת מסייעת לחקור גנים מועמדים שונים למחקרים נוספים באמצעות מוטגנזה ממוקדת. לפני הניסויים, חשוב גם לזכור כי כמה transposons יש אתרי יעד הכנסה ספציפיים המגבירים את שפע המוטנטים ב loci מסוימים בגנום30. טרנספונים של מרינר ידועים כמטרה לאתרי AT עבור הכנסה31, ו- Tn5 טרנספונים יש הטיה GC32,33. הכללת שלבים במהלך ניתוח ביואינפורמטיקה לזיהוי נקודות חמות עבור תוספות טרנספוסון תסייע בהערכת כל הטיית הפצה.
למרות שנוטה לכישלונות, ניסוי רצף הכנסה טרנספוסון מעוצב היטב יכול להיות כלי רב עוצמה לזיהוי גנים חשובים ומותנים רבים בחיידקים בתוך ניסוי אחד. לדוגמה, תריסר גנים בבורקהולדריה seminalis חשוב לדיכוי של נמק עלי סחלב זוהו על ידי שילוב של mutagenesis טרנספוסון וגנומיקה34. מעבר לבורקהולדריה, כמה גנים ותנועתיות ומשגרים זוהו כגורמי קולוניזציה חשובים בסימביונטים של אפיס מליפרה (דבורת הדבש)22, ובשיתוי ויבריו פישרי של אופרימנה סקולופס (דיונון בובטייל הוואי)23 באמצעות הגישה של מוטאגנסיס בהחדרת טרנספון.
כגישה חלופית, מוטגנזה טרנספוסון עשויה להיות מלווה על ידי הקרנה עבור מוטציות בודדות באמצעות מדיה סלקטיבית במקום רצף. סינון פנוטיפי או bioassays כדי לזהות ליקויים, כגון תנועתיות, ייצור של מטבוליטים משניים ביואקטיביים, או auxotrophies ספציפי, הם אפשריים. לדוגמה, הקרנה של חרקים Burkholderia (מחדש לסוג Caballeronia35) ספריית מוטציות טרנספוסון היה המפתח בזיהוי כי סימביונטים להשתמש בגנים תנועתיות להתיישבות ריפטורוס pedestris, מארח החרקים שלהם36. יתר על כן, באמצעות מוטגנסיס טרנספוסון והקרנה פנוטיפית, אשכול הגנים הביוסינתזה עבור קריויננסין מטבוליט משני ביואקטיבי זוהה Burkholderia caryophylli37. מוטציה אוקסוטרופית של Burkholderia pseudomallei זוהתה בעקבות מוטגנזה טרנספוסון והקרנה והוא מועמד אפשרי לחיסון מוחלש נגד melioidosis, מחלה מסוכנת בבני אדם ובעלי חיים38. לכן, מוטאגנזה טרנספוסון ורצף היא גישה חשובה בחקר התכונות המולקולריות של חיידקים החשובים לאינטראקציות עם המארחים שלהם בהתאמה באסוציאציות פתוגניות או הדדיות.
Disclosures
המחברים מצהירים כי אין להם ניגוד אינטרסים הנוגע למחקר.
Acknowledgements
אנו מודים לג'ונבום לי על שסיפק את זן E. coli WM3064+pRL27 להטיה והדרכה בהליך, קתרין הופמאייר על שעזרה בפתרון בעיות במהלך יצירת ספריית המוטציות, ופרופ' אנדרה רודריגז לתמיכה באיסוף חרקים ורכישת היתרים. אנו מודים גם רבקה ינקה ודאגמר קלבש על התמיכה באיסוף וגידול החרקים. אנו מודים לרשויות הברזילאיות על מתן היתרי הגישה הבאים, איסוף, וייצוא של דגימות חרקים: אישור SISBIO Nr. 45742-1, 45742-7 ו 45742-10, תהליך CNPq nº 01300.004320/2014-21 ו 01300.0013848/2017-33, IBAMA Nr. 14BR016151DF ו 20BR035212/DF). מחקר זה נתמך על ידי מימון של קרן המדע הגרמנית (DFG) מענקי מחקר FL1051/1-1 ו KA2846/6-1.
Materials
| Name | Company | Catalog Number | Comments |
| 2,6- Diaminopimelic Acid | Alfa Aesar | B22391 | For E.coli WM3064+ pRL27 |
| Agar - Agar | Roth | 5210 | |
| Agarose | Biozym | 840004 | |
| AMPure beads XP (magentic beads + polyethylene glycol + salts) | Beckman Coulter | A63880 | Size selection in step 6.6 |
| Bleach (NaOCl) 12% | Roth | 9062 | |
| Bowtie2 v.2.4.2 | Bioinfromatic tool for read mapping. Reference 10 in main manuscript. | ||
| Buffer-S | Peqlab | PEQL01-1020 | For PCRs |
| Cell scraper | Sarstedt | 83.1830 | |
| Cutadapt v.2.10 | Bioinformatic tool for removing specific adapter sequences from the reads. Reference 8 in main manuscript. | ||
| DESeq2 | RStudio package for assessing differential mutant abundance. Usually used for RNAseq analysis. Reference 12 in main manuscript. | ||
| DNA ladder 100 bp | Roth | T834.1 | |
| dNTPs | Life Technology | R0182 | PCR for confirming success of conjugation |
| EDTA, Di-Sodium salt | Roth | 8043 | |
| Epicentre MasterPure Complete DNA and RNA Purification Kit | Lucigen | MC85200 | |
| Ethidium bromide | Roth | 2218.1 | |
| FastQC v.0.11.8 | Bioinformatic tool for assessing the quality of sequencing data. Reference 7 in main manuscript. | ||
| FeatureCounts v.2.0.1 | Bioinformatic tool to obtain read counts per genomic feature. Reference 11 in main manuscript. | ||
| Glycerol | Roth | 7530 | |
| K2HPO4 | Roth | P749 | |
| Kanamycin sulfate | Serva | 26899 | |
| KCl | Merck | 4936 | |
| KH2PO4 | Roth | 3904 | |
| MgSO4.7H2O | Roth | PO27 | |
| Na2HPO4 | Roth | P030 | |
| NaCl | Merck | 6404 | |
| NEBNext Multiplex Oligos for Illumina (Index primers set 1) | New England Biolabs | E7335S | |
| NEBNext Ultra II DNA library prep kit for Illumina | New England Biolabs | E7645S | |
| Peptone (soybean) | Roth | 2365 | For Burkholderia gladioli Lv-StA KB-medium |
| peqGOLD 'Hot' Taq- DNA Polymerase | VWR | PEQL01-1020 | PCR for confirming success of conjugation |
| Petri plates - 145 x 20 mm | Roth | XH90.1 | For selecting transconjugants |
| Petri plates - 90 x 16 mm | Roth | N221.2 | |
| Qiaxcel (StarSEQ GmbH, Germany) | Quality check after DNA library preparation | ||
| Streptavidin beads | Roth | HP57.1 | |
| Taq DNA polymerase | VWR | 01-1020 | |
| Trimmomatic v.0.36 | Bioinformatic tool for trimming low quality reads and also adapter sequences. Reference 9 in main manuscript. | ||
| Tris -HCl | Roth | 9090.1 | |
| Tryptone | Roth | 2366 | For Escherichia coli WM3064+pRL27 LB medium |
| Ultrasonicator | Bandelin | GM 70 HD | For shearing |
| USER enzyme (uracil DNA glycosylase + DNA glycosylase- lyase Endonuclease VIII) | New England Biolabs | E7645S | Ligation step 6.5.2 |
| Yeast extract | Roth | 2363 |
References
- Cain, A. K., et al. A decade of advances in transposon-insertion sequencing. Nature Reviews Genetics. 21 (9), 526-540 (2020).
- Chao, M. C., Abel, S., Davis, B. M., Waldor, M. K. The design and analysis of transposon insertion sequencing experiments. Nature Reviews Microbiology. 14 (2), 119-128 (2016).
- Barquist, L., Boinett, C. J., Cain, A. K. Approaches to querying bacterial genomes with transposon-insertion sequencing. RNA Biology. 10 (7), 1161-1169 (2013).
- Flórez, L. V., et al. Antibiotic-producing symbionts dynamically transition between plant pathogenicity and insect-defensive mutualism. Nature Communications. 8 (1), 15172 (2017).
- Flórez, L. V., Kaltenpoth, M. Symbiont dynamics and strain diversity in the defensive mutualism between Lagria beetles and Burkholderia. Environmental Microbiology. 19 (9), 3674-3688 (2017).
- Flórez, L. V., et al. An antifungal polyketide associated with horizontally acquired genes supports symbiont-mediated defense in Lagria villosa beetles. Nature Communications. 9 (1), 2478 (2018).
- . FastQC A quality control tool for high throughput sequence data Available from: https://www.bioinformatics.babraham.ac.uk/projects/fastqc/ (2012)
- Martin, M. Cutadapt removes adapter sequences from high-throughput sequencing reads. EMBnet.journal. 17 (1), 10-12 (2011).
- Bolger, A. M., Lohse, M., Usadel, B. Trimmomatic: A flexible trimmer for Illumina sequence data. Bioinformatics. 30 (15), 2114-2120 (2014).
- Langmead, B., Salzberg, S. L. Fast gapped-read alignment with Bowtie 2. Nature Methods. 9 (4), 357-359 (2012).
- Liao, Y., Smyth, G. K., Shi, W. FeatureCounts: An efficient general purpose program for assigning sequence reads to genomic features. Bioinformatics. 30 (7), 923-930 (2014).
- Love, M. I., Huber, W., Anders, S. Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2. Genome Biology. 15 (12), 550 (2014).
- Gaytán, M. O., Martínez-Santos, V. I., Soto, E., González-Pedrajo, B. Type three secretion system in attaching and effacing pathogens. Frontiers in Cellular and Infection Microbiology. 6, 129 (2016).
- Hachani, A., Wood, T. E., Filloux, A. Type VI secretion and anti-host effectors. Current Opinion in Microbiology. 29, 81-93 (2016).
- Deep, A., Chaudhary, U., Gupta, V. Quorum sensing and bacterial pathogenicity: From molecules to disease. Journal of Laboratory Physicians. 3 (1), 4-11 (2011).
- Silva, A. J., Benitez, J. A. Vibrio cholerae biofilms and cholera pathogenesis. PLOS Neglected Tropical Diseases. 10 (2), 0004330 (2016).
- Navarro-Garcia, F., Ruiz-Perez, F., Cataldi, &. #. 1. 9. 3. ;., Larzábal, M. Type VI secretion system in pathogenic Escherichia coli: structure, role in virulence, and acquisition. Frontiers in Microbiology. 10, 1965 (2019).
- Ribet, D., Cossart, P. How bacterial pathogens colonize their hosts and invade deeper tissues. Microbes and Infection. 17 (3), 173-183 (2015).
- Schwarz, S., et al. Burkholderia Type VI secretion systems have distinct roles in eukaryotic and bacterial cell interactions. PLoS Pathogens. 6 (8), 1001068 (2010).
- Jones, C., et al. Kill and cure: genomic phylogeny and bioactivity of Burkholderia gladioli bacteria capable of pathogenic and beneficial lifestyles. Microbial Genomics. 7 (1), 000515 (2021).
- Takeshita, K., Kikuchi, Y. Riptortuspedestris and Burkholderia symbiont: an ideal model system for insect-microbe symbiotic associations. Research in Microbiology. 168 (3), 175-187 (2017).
- Powell, J. E., et al. Genome-wide screen identifies host colonization determinants in a bacterial gut symbiont. Proceedings of the National Academy of Sciences of the United States of America. 113 (48), 13887-13892 (2016).
- Brooks, J. F., et al. Global discovery of colonization determinants in the squid symbiont Vibrio fischeri. Proceedings of the National Academy of Sciences of the United States of America. 111 (48), 17284-17289 (2014).
- Somprasong, N., McMillan, I., Karkhoff-Schweizer, R. R., Mongkolsuk, S., Schweizer, H. P. Methods for genetic manipulation of Burkholderia gladioli pathovar cocovenenans. BMC Research Notes. 3 (308), (2010).
- Garcia, E. C. Burkholderia thailandensis: Genetic manipulation. Current Protocols in Microbiology. 45, 1-15 (2017).
- Headd, B., Bradford, S. A. The conjugation window in an Escherichia coli K-12 strain with an IncFII plasmid. Applied and Environmental Microbiology. 86 (17), 00948 (2020).
- Van Opijnen, T., Camilli, A. Transposon insertion sequencing: A new tool for systems-level analysis of microorganisms. Nature Reviews Microbiology. 11 (7), 435-442 (2013).
- Gallagher, L. A., Ramage, E., Patrapuvich, R., Weiss, E., Brittnacher, M., Manoil, C. Sequence-defined transposon mutant library of Burkholderia thailandensis. mBio. 4 (6), 00604-00613 (2013).
- Wong, Y. -. C., et al. Candidate essential genes in Burkholderia cenocepacia J2315 identified by genome-wide TraDIS. Frontiers in Microbiology. 7, 1288 (2016).
- Moule, M. G., et al. Genome-wide saturation mutagenesis of Burkholderia pseudomallei K96243 predicts essential genes and novel targets for antimicrobial development. mBio. 5 (1), 00926 (2014).
- Ding, Q., Tan, K. S. Himar1 transposon for efficient random mutagenesis in Aggregatibacter actinomycetemcomitans. Frontiers in Microbiology. 8, 1842 (2017).
- Green, B., Bouchier, C., Fairhead, C., Craig, N. L., Cormack, B. P. Insertion site preference of Mu, Tn5, and Tn7 transposons. Mobile DNA. 3, 3 (2012).
- Lodge, J. K., Weston-Hafer, K., Berg, D. E. Transposon Tn5 target specificity: Preference for insertion at G/C pairs. Genetics. 120 (3), 645-650 (1988).
- Ará Ujo, W. L., et al. Genome sequencing and transposon mutagenesis of Burkholderia seminalis TC3.4.2R3 identify genes contributing to suppression of orchid necrosis caused by B. gladioli. Molecular Plant-microbe Interactions: MPMI. 29 (6), 435-446 (2016).
- Dobritsa, A. P., Samadpour, M. Reclassification of Burkholderiainsecticola as Caballeroniainsecticola comb. nov. and reliability of conserved signature indels as molecular synapomorphies. International Journal of Systematic and Evolutionary Microbiology. 69 (7), 2057-2063 (2019).
- Ohbayashi, T., et al. Insect's intestinal organ for symbiont sorting. Proceedings of the National Academy of Sciences of the United States of America. 112 (37), 5179-5188 (2015).
- Ross, C., Scherlach, K., Kloss, F., Hertweck, C. The molecular basis of conjugated polyyne biosynthesis in phytopathogenic bacteria. Angewandte Chemie International Edition. 53 (30), 7794-7798 (2014).
- Atkins, T., et al. A mutant of Burkholderia pseudomallei, auxotrophic in the branched chain amino acid biosynthetic pathway, is attenuated and protective in a murine model of melioidosis. Infection and Immunity. 70 (9), 5290-5294 (2002).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved