A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שילוב של אורגנואידים אנושיים וטכנולוגיית איברים על שבב כדי ליצור מודל של פונקציונליות ספציפית לאזורי מעיים
In This Article
Summary
אורגנואידים במעיים שמקורם בביופסיה וטכנולוגיות של איברים על שבבים משולבים בפלטפורמה מיקרופיזיולוגית כדי לשחזר את פונקציונליות המעי הספציפית לאזור.
Abstract
רירית המעי היא מחסום פיזי וביוכימי מורכב הממלא שלל פונקציות חשובות. הוא מאפשר הובלה, ספיגה וחילוף חומרים מטבוליזם של חומרים מזינים וקסנוביוטיקה תוך שהוא מקל על קשר סימביוטי עם מיקרוביוטה ומגביל את הפלישה של מיקרואורגניזמים. אינטראקציה תפקודית בין סוגי תאים שונים לבין סביבתם הפיזית והביוכימית חיונית לביסוס ושמירה על הומאוסטזיס של רקמת מעיים. מידול האינטראקציות המורכבות הללו ופיזיולוגיה משולבת של המעיים במבחנה הוא מטרה אימתנית עם פוטנציאל לשנות את הדרך שבה מטרות טיפוליות חדשות ומועמדים לתרופות מתגלים ומתפתחים.
אורגנואידים וטכנולוגיות איבר על שבב שולבו לאחרונה כדי ליצור שבבי מעי רלוונטיים לבני אדם המתאימים לחקר ההיבטים הפונקציונליים של פיזיולוגיה של המעי ופתופיזיולוגיה של המעי במבחנה. אורגנואידים המופקים מהביופסיות של המעי הקטן (תריסריון) והמעי הגס נזרעים לתוך התא העליון של שבב איברים ולאחר מכן מתרחבים בהצלחה כחד-שכבתיים תוך שמירה על המאפיינים התאיים, המולקולריים והתפקודיים המובהקים של כל אזור מעיים. תאי אנדותל מיקרו-וסקולריים ספציפיים לרקמת המעי האנושי משולבים בתא התחתון של שבב האיבר כדי ליצור מחדש את ממשק האפיתל-אנדותל. פלטפורמה חדשנית זו מאפשרת חשיפה לומינלית לחומרים מזינים, תרופות ומיקרואורגניזמים, ומאפשרת מחקרים על הובלת מעיים, חדירות ואינטראקציות בין חיידקים מארחים.
כאן, פרוטוקול מפורט מסופק להקמת שבבי מעי המייצגים את התריסריון האנושי (שבב התריסריון) ואת המעי הגס (שבב המעי הגס), ואת התרבית הבאה שלהם תחת זרימה רציפה ועיוותים דמויי פריסטלזה. אנו מדגימים שיטות להערכת חילוף החומרים של תרופות ואינדוקציה של CYP3A4 בשבב התריסריון באמצעות משרי אב-טיפוס ומצעים. לבסוף, אנו מספקים הליך שלב אחר שלב למידול חוץ גופי של הפרעת מחסום בתיווך אינטרפרון (IFNγ) (תסמונת המעי הדולף) בשבב המעי הגס, כולל שיטות להערכת השינוי של חדירות פרה-תאית, שינויים בהפרשת ציטוקינים ופרופיל תעתיק של התאים בתוך השבב.
Introduction
המעי האנושי הוא איבר מורכב ורב משימות המסוגל להתחדשות עצמית. הוא מחולק למעי הדק והגזום. הפונקציה העיקרית של המעי הדק היא לעכל עוד יותר מזון המגיע מהקיבה, לספוג את כל החומרים המזינים ולהעביר את השאריות למעי הגס, המשחזר את המים והאלקטרוליטים. המעי הדק מחולק עוד יותר למספר אזורים נבדלים אנטומית: התריסריון, הג'ג'ונום והאלאום, שכל אחד מהם מותאם לביצוע תפקודים ספציפיים. לדוגמה, התריסריון מסייע בפירוק של הצ'ים (תוכן הקיבה) כדי לאפשר ספיגה נכונה של חומרים מזינים המערבים חלבונים, פחמימות, ויטמינים ומינרלים בג'ג'ונום. חלק פרוקסימלי זה של המעי הדק הוא גם האתר העיקרי של ספיגת תרופות מעיים ומטבוליזם, והוא מאופיין בביטוי גבוה יותר של אנזימים מטבוליזם של תרופות (למשל, CYP3A4) בהשוואה לביטוי שלהם באילאום ובמעי הגס1. בנוסף לתפקידו העיקרי בעיכול וספיגה של חומרים מזינים, המעי מהווה גם מחסום יעיל נגד תוכן לומינלי שעלול להזיק, כגון מיקרואורגניזמים פתוגניים, מטבוליטים מיקרוביאליים, אנטיגנים תזונתיים ורעלנים 2,3. ראוי לציין כי המעי הגס האנושי מאוכלס על ידי מספר רב של מיקרואורגניזמים, הרבה מעבר לזה של סך התאים בגוף האדם, המספקים יתרונות רבים לתזונה, מטבוליזם וחסינות. לכן, שמירה על שלמות המחסום הרירי שנוצר על ידי תאי אפיתל במעיים היא קריטית כדי לאפשר את הקשר הסימביוטי בין המיקרוביוטה של המעי לבין התאים המארחים על ידי הפרדתם הפיזית כדי למנוע הפעלה מיותרת של תאי מערכת החיסון2. בנוסף, מוות מתוכנת של תאי מעיים ממלא תפקיד חיוני כמנגנון הגנה עצמית המונע מתאים נגועים להתמיד או להתרבות – ובכך להפיץ פתוגנים פוטנציאליים3 – בעוד שההתחדשות העצמית המתמשכת של אפיתל המעיים כל ארבעה עד שבעה ימים מפצה על אובדן התא ומבטיחה את שלמות המחסום ואת ההומאוסטזיס של הרקמות. ליקויים בתפקודי המעי המתוארים, כולל ספיגת חומרים מזינים, שלמות מחסום או חוסר איזון במוות מתאי מעיים ובהתחדשות עצמית, עלולים לגרום להתפתחות של מגוון הפרעות במערכת העיכול, כולל תת תזונה ומחלות מעי דלקתיות (IBD)2,3.
בעבר, מודלים של בעלי חיים וקווי תאי מעיים שמקורם בסרטן שימשו לחקר התפקודים הפיזיולוגיים והפתופיזיולוגיים של רקמת המעי האנושית. עם זאת, חששות בולטים יותר ויותר לגבי יכולת התרגום של מחקר בבעלי חיים לבני אדם, שנגרמו על ידי נוכחות של פערים משמעותיים בין שני המינים, הדגישו את הצורך בשיטות חלופיות רלוונטיות לאדם4. קווי תאי המעי החוץ-גופיים הנפוצים כוללים תאי T84, Caco-2 ו-HT29. בעוד שהם מחקים היבטים מסוימים של תפקוד מחסום המעי והובלת הממברנה, הם מאופיינים בביטוי שונה של אנזימים מטבוליזם תרופתי5, קולטני פני השטח ומובילים4. בנוסף, הם חסרים ספציפיות של מקטעי מעיים ואינם מצליחים לשחזר את המורכבות של אפיתל המעי, כאשר כל מודל מכיל רק אחד מתוך חמשת סוגי תאי האפיתל הקיימים במעי6.
לאחרונה, תרביות אורגנואידים במעיים אנושיים שנוצרו מביופסיות טריות של המעי הדק והמעי הגס 7,8 או תאי גזע פלוריפוטנטיים מושרים (iPSC)9 הוצגו כמודלים ניסיוניים חלופיים עם פוטנציאל להשלים, להפחית ואולי להחליף ניסויים בבעלי חיים בעתיד. בעוד שניתן להשיג iPSCs באופן לא פולשני, הקמת אורגנואידים מ- iPSCs דורשת שימוש בפרוטוקולים מורכבים וארוכים (עם מספר שלבים ניסיוניים) ומייצרת תרביות הדומות לרקמות עובריות אנושיות. לעומת זאת, אורגנואידים שמקורם בביופסיה ניתנים להרחבה רבה, מכיוון שהם יכולים למנף את יכולת ההתחדשות האינהרנטית של רקמת המעי וניתן להעבירם ולהפיץ אותם ללא הגבלת זמן במבחנה. חשוב לציין, אורגנואידים שמקורם בביופסיה שומרים על המחלה ועל המאפיינים הספציפיים לאזורי המעיים של הרקמה הראשונית שממנה הם פותחו ומחקים את המגוון התאי של אפיתל המעיים. אורגנואידים יכולים לשמש כאווטארים ספציפיים למטופל במבחנה כדי לפענח את הביולוגיה והפתוגנזה של הפרעות שונות במערכת העיכול ולשפר את הניהול הטיפולי שלהם. אף על פי שאורגנואידים במעיים השיגו מידה מרשימה של פונקציונליות פיזיולוגית, הם עדיין לא מצליחים לשחזר את המורכבות של האיברים המקומיים בשל היעדרם של מרכיבים סטרומליים קריטיים – כולל כלי דם, רקמת חיבור, עצבים היקפיים ותאי מערכת החיסון – כמו גם גירוי מכני. פרמטרים מכניים, כגון זרימה, לחץ גזירה, מתיחה ולחץ, ידועים כמשפיעים על מורפוגנזה של רקמות והומאוסטזיס in vivo והוכחו בעבר כמשפרים את ההבשלה של תאים במבחנה 10,11,12,13. חיסרון חשוב נוסף של מערכות אורגנואידיות הוא חוסר הנגישות של הלומן, ולכן, לצד האפיתלי של האפיתל. זה מציב אתגר לחקר מנגנונים שונים הקשורים לביטוי מקוטב של מובילי יונים ותרופות, אינטראקציות בין מארח למיקרוביום ובדיקות רעילות פרמצבטית. לבסוף, תרביות אורגנואידיות סובלות משונות ניכרת בגודלן, במורפולוגיה ובתפקודן, בשל האופי הסטוכסטי של תהליך הארגון העצמי במבחנה ובחירות גורל התא. לכן, כדי לממש את מלוא הפוטנציאל של אורגנואידים במעיים במודלים של מחלות, סינון תרופות ורפואה רגנרטיבית, יש צורך לחקור אסטרטגיות חדשות המפחיתות את השונות בהתפתחות האורגנואידים, משפרות את הגישה לתא הלומינלי ומשלבות אינטראקציות חסרות בין תאים לתאים.
טכנולוגיית Organ-on-a-Chip הציגה טכניקות רבות לשילוב כוחות מכניים וזרימת נוזלים לתרביות תאי מעיים במבחנה. עם זאת, מכיוון שרוב מחקרי הוכחת ההיתכנות הראשוניים השתמשו בקווי תאים שמקורם בסרטן שלא הציגו מגוון תאי מספיק, הרלוונטיות של מערכות אלה הוטלה בספק. לאחרונה, שילבנו באופן סינרגטי אורגנואידים במעיים וטכנולוגיית איברים על שבב כדי לשלב את התכונות הטובות ביותר של כל גישה במערכת מבחנה אחת 14,15,16. שבבי המעי המתקבלים משחזרים את הארכיטקטורה הרב-תאית של אפיתל המעי, את נוכחותו של ממשק רקמת אפיתל-אנדותל ואת הכוחות המכניים של זרימת נוזלים ומתיחה, ומאפשרים חיקוי של תפקודים ברמת האיברים במבחנה. בנוסף, השימוש באורגנואידים שמקורם ברקמות ראשוניות (אותם ניתן לדגום מאזורים שונים במעי האנושי) כחומר התחלתי מגביר את הרבגוניות של מודל זה, שכן שבבים המייצגים תריסריון אנושי, ג'ג'ונום, איליאום ומעי גס יכולים להיווצר בעקבות הליכי זריעה ותרבית דומים. חשוב לציין, שבבי המעי מאפשרים הערכה בזמן אמת של: שלמות מחסום המעיים; פעילות של גבול המברשת ואנזימי חילוף החומרים של התרופה; ייצור של mucins; הפרשת ציטוקינים; ואינטראקציה של תאי מעיים עם מיקרואורגניזמים פתוגניים וקומנסליים, כפי שהודגם בדו"חות שפורסמו בעבר. יש לציין שכאשר שבבי המעי הוקמו באמצעות אורגנואידים שנוצרו מרקמה של אנשים שונים, מודלים אלה לכדו את השונות הצפויה בין התורמים בתגובות התפקודיות לתרופות וטיפולים שונים. בסך הכל, מיזוג אורגנואידים עם טכנולוגיית Organ-on-a-Chip פותח את הדלת למודלים מתקדמים יותר, מותאמים אישית ורלוונטיים ל-in vivo שיכולים לשפר את הרלוונטיות והדיוק הפיזיולוגיים של הממצאים במבחנה, כמו גם את האקסטרפולציה שלהם לבני אדם. כאן מוצג פרוטוקול מפורט להקמת שבב המעי ויישומו במחקרים על תפקודים פיזיולוגיים של שני מקטעי המעיים: תריסריון ומעי הגס. ראשית, מתוארות השיטות להערכת הפעילות של האנזים המפרק את התרופה CYP3A4 בשבב התריסריון, כמו גם את האינדוקציה שלו על ידי תרכובות אב-טיפוס כגון ריפאמפיצין וויטמין D3. שנית, השלבים הנדרשים כדי לדגום "מעי דולף" בשבב המעי הגס מתוארים בפרוטוקול, כאשר ההפרעה של מחסום האפיתל מתבצעת באמצעות ציטוקינים סימן היכר המעורבים בפתוגנזה של ה-IBD. בקצרה, אורגנואידים המופקים מביופסיות אנושיות מופצים במבחנה, נתונים לעיכול אנזימטי, ומוכנסים בערוץ העליון של השבב. בנוכחות זלוף רציף עם מדיה מועשרת בגורם גדילה הם מתפתחים למונולייר אפיתל מפגשי עם ארכיטקטורת תלת-ממד ומשטח תא אפיקלי נגיש בקלות. תא השבבים התחתון, "כלי הדם", נזרע עם תאי אנדותל מיקרו-וסקולריים המבודדים מהמעי הדק או הגס. האפיתל והאנדותל מופרדים על ידי קרום נמתח נקבובי, המאפשר את יחסי הגומלין של פרקרין בין שתי הרקמות, וכאשר הוא נתון לעיוותים מחזוריים, מחקה תנועות דמויות פריסטלזה של המעיים האנושיים. התרבית המשותפת נשמרת בתנאי הזרימה הדינמיים הנוצרים על ידי זלוף לומינלי וכלי דם עם מדיה מתאימה של תרביות תאים. לבסוף, אנו מתארים סוגים רבים של בדיקות וניתוחי נקודות קצה שניתן לבצע ישירות על השבב או מתוך שפכים שנדגמו מתרביות תאים.
Access restricted. Please log in or start a trial to view this content.
Protocol
הערה: יש לטפל בכל תרביות התאים בטכניקה אספטית מתאימה.
האורגנואידים של המעיים האנושיים שהועסקו במחקר זה התקבלו מאוניברסיטת ג'ונס הופקינס וכל השיטות בוצעו בהתאם להנחיות ולתקנות שאושרו. כל הפרוטוקולים הניסוייים אושרו על ידי מועצת הביקורת המוסדית של אוניברסיטת ג'ונס הופקינס (IRB #NA 00038329).
1. הכנת ריאגנטים של תרבית תאים
- הכינו את מדיום הגידול האורגנואידי האנושי בהתאם להוראות היצרן (טבלת חומרים) והוסיפו לו 100 מיקרוגרם/מ"ל של פרימוצין.
- הכינו את מדיום צמיחת תאי האנדותל המיקרו-וסקולריים האנושיים בהתאם להוראות היצרן (טבלת החומרים) והוסיפו תוסף עם 1:20 נפח/נפח FBS ו-50 מיקרוגרם/מ"ל במקום 100 מיקרוגרם/מ"ל של פרימוצין.
- Resuspend Y-27632 (מעכב Rho-kinase) ב-BSA סטרילי של 0.1% ב-DPBS כדי להכין תמיסת מלאי של 10 mM. Aliquot לתוך microtubes סטרילי ולאחסן ב -20 מעלות צלזיוס עד 6 חודשים.
- Resuspend CHIR99021 (מעכב GSK-3) בדימתילסולפוקסיד סטרילי (DMSO) להכנת תמיסת מלאי של 5 mM. Aliquot לתוך microtubes סטרילי ולאחסן ב -20 מעלות צלזיוס עד 6 חודשים.
- הכן את תמיסת העיכול האורגנואידית האנושית על ידי ערבוב תמיסת דיסוציאציה של אורגנואידים בנפח/נפח 1:1 (טבלת חומרים) עם תמיסת DPBS (טבלת חומרים) והשלמתה עם תמיסת מלאי של 10 מיקרומטרים של Y-27632. יש להכין ריאגנט זה טרי לכל שימוש.
2. תרבית של תאי אנדותל מיקרו-וסקולריים במעיים אנושיים (HIMECs)
- הפעילו את תרבות HIMEC (טבלת החומרים) 7 ימים לפני שתזרקו אותה על השבב. רק HIMECs במעבר 1-6 יכולים לשמש לזריעת שבבים.
- הוסף 5 מ"ל של תמיסת גורם החיבור (טבלת חומרים) לבקבוק T150; אינקובציה ב 37 °C (64 °F) למשך דקה אחת ולהשליך את הפתרון.
- הוסיפו 19 מ"ל של מדיום צמיחת תאי אנדותל שחומם מראש בטמפרטורת החדר (ראו שלב 1.2) לבקבוקון.
- להפשיר בקבוקון קפוא של HIMEC (2 מיליון תאים/בקבוקון) באמבט מים של 37 מעלות צלזיוס.
- מעבירים את תכולת הבקבוקון לתוך הבקבוקון ומטלטלים בעדינות את הבקבוקון כדי להפיץ את התאים באופן שווה. מניחים את הבקבוקון באינקובטור של 37 מעלות צלזיוס למשך הלילה כדי לאפשר לתאי האנדותל להידבק.
- החלף את המדיום ב-20 מ"ל של מדיום גדילת תאי אנדותל שחומם מראש בטמפרטורת החדר למחרת וכל 3 ימים לאחר מכן. תרביות צריכות להגיע ל-90% מהמפגש ביום קצירת התאים לניסויים בשבבים.
3. מיקרו-פבריקציה והכנת השבב
- קבל שבבים מספק מסחרי (טבלת חומרים). פרקו את הצ'יפס והניחו אותם בעריסת הצ'יפס המונחת בצלחת פטרי מרובעת (טבלת חומרים). סמן את הצד הקדמי של כל נשא שבב בתנאי הניסוי (איור 1A).
הערה: בעוד שהפרוטוקול המוצג מסתמך על שימוש בשבב ומכשור ספציפיים הזמינים מסחרית, ישנם מספר התקנים מיקרופלואידיים המוצעים באמצעות ספקים שונים, אשר עשויים להציע יתרונות חלופיים אך חסרים את היכולת לשלב מתיחה. בנוסף, microfabrication של איברים על צ'יפס יכול להתבצע "בבית" בעקבות ההליכים המתוארים Huh et al.21.
4. הפעלה וציפוי ECM של הממברנה
- הכנת פתרון ההפעלה
- הביאו את ריאגנטים ER-1 ו-ER-2 (טבלת חומרים) לטמפרטורת החדר כדי להתאים לפני השימוש. ER-1 רגיש לאור ויש לטפל בו בחושך.
- שחזרו את ER-1 ב-10 מ"ל של מגיב ER-2 כדי ליצור ריכוז סופי של 0.5 מ"ג/מ"ל ולאשר שה-ER-1 מומס לחלוטין.
- הפעלת פני השטח
- דחפו בעדינות 50 μL של תמיסת ER-1 דרך שני הערוצים של השבב (איור 1A).
- הסר כל פתרון ER-1 עודף מפני השטח של השבב באמצעות aspirator.
- בדוק את השבבים כדי לוודא שכל השבבים קיבלו את פתרון ER-1. במקרה של בועות אוויר, הציגו תמיסת ER-1 נוספת עד להסרת הבועות במלואן.
- דגירה של השבבים בתוך תא מנורת ה- UV (טבלת חומרים) למשך 15 דקות. ודא שמנורת ה- UV מוגדרת להגדרה עקבית.
- החזירו את השבבים המופעלים על ידי ER-1 לארון הבטיחות הביולוגית (BSC). שאפו לפתרון ER-1 משני הערוצים. לשטוף כל שאריות של תמיסת ER-1 עם 200 μL של ER-2.
- דחפו 200 μL של מלח עיקש בעל מאגר פוספט (DBPS) של Dulbecco סטרילי דרך הערוצים (טבלת החומרים) והשאירו את DBPS בערוצים עד לשלב הבא.
- הכנת מטריצה חוץ-תאית (ECM) וציפוי ממברנה
- הכנת פתרונות מלאי של רכיבי ECM
- בנה מחדש קולגן IV (טבלת חומרים) ופיברונקטין (טבלת חומרים) באמצעות מים סטריליים ברמת תרבית תאים (טבלת חומרים) לריכוז סופי של 1 מ"ג/מ"ל. מכינים aliquots ומאחסנים אותם בטמפרטורה של -20 מעלות צלזיוס עד לשימוש.
- הכנת תמיסת עבודה ECM לציפוי ממברנה
- הכן 1.5 מ"ל מכל פתרון ECM עבור הערוץ העליון והתחתון עבור כל 12 שבבים שיש לצפות. פתרון ECM צריך תמיד להיות מוכן רגע לפני השימוש.
- עבור הערוץ העליון, יש לערבב קולגן IV ומטריצת קרום מרתף (BMM) (BMM) (טבלת חומרים) ב-DBPS קר סטרילי ב-200 מיקרוגרם/מ"ל ו-100 מיקרוגרם/מ"ל, בהתאמה. עבור הערוץ התחתון, יש לערבב קולגן IV ופיברונקטין ב-DPBS קר סטרילי ב-200 מיקרוגרם/מ"ל ו-30 מיקרוגרם/מ"ל, בהתאמה.
- ציפוי ECM של השבבים
- שאפו את ה-DBPS משני הערוצים של השבבים והחליפו בפתרון העבודה המתאים ל-ECM עבור כל ערוץ (איור 1A).
- בדוק כל שבב כדי לוודא שהוא קיבל את פתרון הציפוי. במקרה של בועות אוויר, יש לדחוף תמיסת ציפוי נוספת עד להסרת כל הבועות במלואן.
- הוסיפו DPBS סטרילי לערש הצ'יפס והניחו את צלחת הפטרי המכילה את הצ'יפס באינקובטור של 37 מעלות צלזיוס. דגירה למשך הלילה כדי לאפשר לחלבוני ה-ECM ליצור קשרים יוניים עם קרום ה-PDMS המופעל. אם תרצה, ניתן יהיה לזרוע תאים בכל עת בין 2 שעות ליום אחד לאחר ציפוי השבבים. לחלופין, ניתן לאחסן שבבים מצופים בטמפרטורה של 4 מעלות צלזיוס במהלך הלילה, ולאחר מכן דגירה לילית בטמפרטורה של 37 מעלות צלזיוס וזריעת שבבים.
- הכנת פתרונות מלאי של רכיבי ECM
5. זריעה של תאי אנדותל מיקרו-וסקולריים במעיים (HIMECs) בערוץ התחתון של השבב
הערה: HIMECs של המעי הדק והמעי הגס נזרעים בערוץ התחתון של התריסריון ושבב המעי הגס, בהתאמה.
- הכן שבבים
- העבר את השבבים המצופים ECM ל- BSC. שאפו בעדינות לציפוי ECM משני ערוצי השבבים, ולאחר מכן שטפו את שני הערוצים עם 200 μL של מדיום גדילה אורגנואידי ואמצעי צמיחה של תאי אנדותל, בהתאמה.
- אחסנו את השבבים השטופים באינקובטור של 37 מעלות צלזיוס עד להמשך זריעת תאי האנדותל.
- לקצור את תאי האנדותל
- הביאו את בקבוקון תרבות HIMEC ל-BSC ושטפו באמצעות DPBS סטרילי.
- מוסיפים 3 מ"ל של תמיסת דיסוציאציה לבקבוק ומניחים אותה באינקובטור 37°C למשך 2 דקות כדי לאפשר ניתוק מלא של התא.
- אספו את התאים בצינור חרוטי של 15 מ"ל והוסיפו מדיית גדילה של תאי אנדותל עד שהיא מגיעה ל-10 מ"ל. דגימה 15-20 μL של תרחיף התא לספירת תאים. צנטריפוגה ב 150 x g במשך 5 דקות.
- שאפו בזהירות לסופרנאטנט והשעו מחדש את ה-HIMECs לצפיפות של 8-10 x 106 תאים/מ"ל במדיית גדילת תאי האנדותל.
- תאי אנדותל זרעים לתוך הערוץ התחתון של השבב
- הביאו את צלחת הפטרי המכילה את הצ'יפס ל-BSC והסירו בעדינות את כל המדיה מהתעלה התחתונה באמצעות פיפטה של 1,000 μL.
- הכנס 10-15 μL של מתלה HIMEC לתוך הערוץ התחתון של השבב. בדקו את השבב מיד לאחר הזריעה כדי להבטיח צפיפות זריעה אופטימלית (80%-90% מהכיסוי) והתפלגות תאים הומוגנית בתוך הערוץ (איור 1D). אם צפיפות הזריעה גבוהה או נמוכה מהצפוי או לא אחידה, שטפו את התעלה פי 2 עם 200 μL של מדיית גדילת תאי אנדותל וחזרו על הליך הזריעה.
- הפוך את צלחת פטרי מיד לאחר זריעת כל אצווה של שישה שבבים כדי לאפשר חיבור של תאי האנדותל לצד התחתון של קרום PDMS. הכניסו את צלחות הפטרי לחממה של 37 מעלות צלזיוס למשך 30 דקות עד שעה, או עד שה-HIMECs בתעלה התחתונה יתחברו לממברנה (איור 1D).
- לשטוף את השבבים
- דחפו בעדינות 200 μL של מדיית גדילת תאי אנדותל דרך פתח הערוץ התחתון כדי להסיר את כל התאים שאינם מחוברים ולחדש את החומרים המזינים במדיה.
- שטפו את התאים שלא התחברו בתעלה העליונה עם 200 μL של מדיום גדילה אורגנואידי בתוספת 5 μM CHIR999021 ו-10 μM Y-27632.
- מניחים את השבבים באינקובטור של 37 מעלות צלזיוס עד להמשך לזריעת תאי האפיתל.
6. זריעת שברי אורגנואידים בערוץ העליון של השבב
הערה: אורגנואידים המבודדים מביופסיות של אזורי מעיים שונים יכולים להיות תרבית בשבב המעי7. עקוב אחר הנהלים המתוארים בפוג'י ואחרים לבידוד קריפטות מעיים אנושיות והקמת תרביות אורגנואידיות22. כאן, אורגנואידים תריסריונים ומעי גס משמשים ליצירת התריסריון ושבבי המעי הגס, בהתאמה. בהתחשב בשונות הגבוהה בין אצווה לאצווה ותורם לתורם בהיווצרות ובצמיחה של אורגנואידים, מוצע לבצע הערכה ניסיונית של צפיפות התאים בתרבית ההשעיה האורגנואידית (פורמט צלחת 24-well) כדי להשיג את צפיפות הזריעה האופטימלית של 8 מיליון תאים/מ"ל.
- הערכת פיילוט של מספרי התאים/באר של תרבית האורגנואידים הסטטית.
הערה: הנוהל הבא הוא אך ורק לקבוע את מספר הבארות של תרבית ההשעיה האורגנואידית הנדרשת לזריעת השבב. אין להשתמש בתאים הבודדים המתקבלים עבור זריעת השבבים.- שאפו בזהירות את הסופרנטנט משלוש בארות של צלחת התרבית האורגנואידית. הוסיפו 500 μL של תמיסת דיסוציאציה של BMM קר כקרח (Table of Materials) לכל באר והשתמשו במגרד פלסטיק כדי לנתק את ה-BMM הסולובילי מהפלסטיק.
- אספו את התרחיף האורגנואידי לתוך צינור חרוטי סטרילי בעל קשירת חלבון נמוך באמצעות פיפטה קרה כקרח של 1,000 μL. דגירה על קרח במשך 60 דקות, ערבוב כל 15 דקות על ידי ניעור עדין של הצינור. צנטריפוגה ב 300 x g במשך 5 דקות ב 4 מעלות צלזיוס.
- לשאוף את supernatant ולהוסיף 2 מ"ל של טריפסין. דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 30 דקות כדי לעכל את האורגנואידים לרמת התא הבודד ולהוסיף 10 מ"ל של מדיום גדילה אורגנואידי מלא כדי לעצור את התגובה האנזימטית. צנטריפוגה ב 300 x g במשך 5 דקות ב 4 מעלות צלזיוס.
- בצעו שימוש חוזר בכדור התא ב-1 מ"ל של מדיום גדילה אורגנואידי מלא וספרו את המספר הכולל של התאים באמצעות המטוציטומטר על פי שיטות סטנדרטיות.
- הכנת שברי אורגנואידים וזריעתם בשבב
הערה: ניתן להשתמש בהליכים הבאים כדי לזרוע אורגנואידים תריסריוניים או קולוניאליים בערוץ העליון של השבב. הקמתו של מונו-שכבת אפיתל עם ציטו-ארכיטקטורה תלת-ממדית רלוונטית in vivo מותנית בנוכחות זרימה15,23 ובזריעה מוצלחת של שברי אורגנואידים.- שאפו בזהירות את המדיום ממספר הבארות של תרבית האורגנואידים הסטטית, וזה מספיק, כפי שנקבע בשלב 6.1, כדי להשיג צפיפות זריעה סופית של 8 מיליון תאים/מ"ל. הוסף 500 μL של תמיסת דיסוציאציה של BMM קר כקרח לכל באר.
- נתקו את ה-BMM הסולוביאלי מפני השטח של הבארות באמצעות מגרד פלסטיק או פיפטה של 1,000 μL. אספו את ההשעיה לצינור חרוטי בעל 15 מ"ל בעל חלבון נמוך.
- אחסנו את המתלים על קרח למשך 60 דקות, וערבבו כל 15 דקות על ידי ניעור עדין של הצינור. המשך לצנטריפוגה ב 300 x g למשך 5 דקות ב 4 מעלות צלזיוס. גלולה אורגנואידית מוגדרת היטב צריכה להיות גלויה לאחר הצנטריפוגה. אם שכבת ג'ל שקופה נצפתה מעל גלולת התא (שאריות של BMM סולוביליזציה) (איור 1B), המשיכו בשלבים הבאים.
- מערבבים את הסופרנאטנט ואת גלולת התא ומוסיפים נפח שווה של תמיסת דיסוציאציה של BMM בצינור. ערבבו ואחסנו בעדינות על קרח למשך 10 דקות נוספות, והמשיכו לצנטריפוגה ב-300 x גרם למשך 5 דקות בטמפרטורה של 4 מעלות צלזיוס.
- במידת הצורך, חזור על שלב 6.2.3.1 עד שלא יהיו שאריות BMM מתכלות.
- יש להשליך את ה-supernatant ולהחיות את הכדור האורגנואידי בתמיסת העיכול האורגנואידית (ראו שלב 1.5). השתמש בנפח מספיק של תמיסת עיכול אורגנואידית כדי להבטיח טבילה מלאה של הכדור. 2 מ"ל של תמיסה מתאימים לכ-2,400-12,000 אורגנואידים בגודל בינוני (איור 1D, לאחר זריעה). דגירה בטמפרטורה של 37 מעלות צלזיוס למשך 1-3 דקות.
- הוסף DMEM/F-12 מתקדם לצינור כדי לעצור את התגובה האנזימטית. יש להשתמש פי ארבעה מנפח תמיסת העיכול בה נעשה שימוש. צנטריפוגה ב 300 x g במשך 5 דקות ב 4 מעלות צלזיוס.
- לשאוף את הסופרנאטנט ולהחיות את כדור השברים האורגנואידים במדיום גדילה אורגנואידי שלם בתוספת 5 μM CHIR999021 ו-10 μM Y-27632 כדי להשיג 8 מיליון תאים/מ"ל. הכן 360 μL aliquots של ההשעיה בצינורות סטריליים 1.5 מ"ל קשירת חלבון נמוכה כדי למנוע את הפחתת צפיפות התא בגלל חיבור על הקירות.
- הסר את המדיום מהערוץ העליון של השבבים המצופים. הוסף 30 μL של תרחיף התא בערוץ העליון של כל שבב. דגירו את השבבים למשך הלילה באינקובטור של 37 מעלות צלזיוס כדי לאפשר לשברי האורגנואידים להיצמד לממברנה המצופה ב-ECM (איור 1D).
7. תרבית דינמית של שבב המעי - ייזום, ותחזוקה של זרימה ותנועות דמויות פריסטלזיס
- הכנה לתקשורת וגזים
- כדי לשמור על זרימה למינרית מתמדת דרך השבב, אפשרו לטמפרטורת המדיה להתאזן לטמפרטורת החדר, ולאחר מכן הכפיפו אותה לסינון מונחה ואקום למשך 10 דקות באמצעות משאבת ואקום וצינורות חרוטיים של מסנן PVDF (ניתוק מדיה).
- פרימינג של מודולים ניידים
הערה: מודולים ניידים הם מאגרים הפועלים כממשק בין השבבים לבין מודול התרבות ומאפשרים דגימה חוזרת ומינון של מדיה.- פתח את המודולים הניידים, ב- BSC, והנח אותם על מגשי מודול התרבית, שהם גורמים מכילים מיוחדים ליישור המודולים הניידים.
- הוסף 3 מ"ל של מדיום גדילה אורגנואידי מלא משוכלל מראש בתוספת 5 μM CHIR99021 ו- 10 μM Y-27632 למאגר הכניסה העליון ו- 3 מ"ל של מדיום צמיחת תאי אנדותל משויבל מראש במאגר הכניסה התחתון (איור 1C). הוסף 300 μL של אותה מדיה במאגרי היציאה המתאימים.
- הביאו את המגשים לחממה של 37 מעלות צלזיוס והחליקו אותם למודול התרבית (איור 1C). השתמש בפקדים על המסך של מודול התרבות כדי להפעיל את "מחזור ראשוני" (1 דקה אורך). כאשר שורת המצב מציינת "מוכן", מחזור הפריים הושלם. חזור על מחזור הפריים כדי לוודא שנוצרו מספיק טיפות לחיבור מוצלח של השבבים.
- ודא שכל המודולים הניידים מוכנים ויש להם טיפות מדיה גלויות.
- מבוא לזרימה
הערה: זרימה היא בדרך כלל יזומה 24 שעות לאחר זריעת שברי אורגנואידים כדי לאפשר לתאי אפיתל המעי להיצמד בחוזקה לממברנה.- שטפו את שני הערוצים של השבבים הזורעים ב-200 μL של המדיה המתאימה כדי להסיר בועות או פסולת תאים. השאירו טיפות קטנות של מדיה על היציאות לאחר הכביסה. החלק את נושאת השבבים לתוך המודול הנייד (איור 1C).
- מקם את המודולים הניידים על המגשים ולאחר מכן לתוך מודול התרבות. השתמש בפקדים על המסך של מודול התרבית כדי לתכנת את תנאי תרבית שבבי האיברים המתאימים (קצב זרימה ומתיחה).
הערה: עבור תנאי תרבית רגילים של תריסריון ושבבי המעי הגס, הגדר את קצב הזרימה ל- 30 μL/h15 ו- 60 μL/h16 בהתאמה, הן עבור הערוצים העליונים והן עבור הערוצים התחתונים. עם זאת, קצבי הזרימה עבור כל ערוץ נשלטים באופן עצמאי וניתן להגדיר אותם בין 0-1,000 μL/h. ניתן להשתמש במזרק או במשאבות פריסטלטיות, במקום במודולי תרבית המוצגים כאן, כדי להציג זרימה למינרית לשבבים מיקרופלואידיים. עם זאת, יצירת קשרים נוזליים אמינים בין שבבים ומשאבות באמצעות צינורות ומחברים עשויה להיות מאתגרת מבחינה טכנית כאשר נדרשת זלוף בו-זמני של שבבים מרובים. - התחל את "מחזור הוויסות" (באורך 2 שעות) הלוחץ על מדיית התרבות במודול ובשבב הניידים כדי למנוע גרעין של בועות האוויר. התנאים המתוכנתים יתחדשו לאחר השלמת מחזור הוויסות.
- שינוי מדיה
- הכינו מדיה טרייה לשני הערוצים וחידשו אותם כל 48 שעות על ידי הוספת 2 מ"ל של מדיום טרי למאגרי הכניסה (איור 1C).
- השהה את מודולי התרבות והבא את המגשים ל- BSC. לשאוף מדיה בכל המאגרים ולחדש עם מדיה טרייה. החזירו את המגשים והפעילו מחדש את הזרימה.
- מבוא למתיחה
הערה: אפשר לתאים לגדול ל-100% מפגש לפני השימוש בזן מחזורי. מתיחה מוצגת בדרך כלל 3 ימים לאחר הזריעה או 48 שעות לאחר תחילת התרבית הנוזלית. 2% מתח מחזורי בתדר של 0.2 או 0.15 הרץ, עבור התריסריון11 ושבב המעי הגס24 , בהתאמה, מוחל על 24 שעות ראשוניות. לאחר מכן הוא מוגדל עוד יותר ל-10% כדי שהמשך הנותר של תרבית שבבי המעי יהיה דומה מאוד לזן המחזורי שחווים תאי אפיתל במעיים in vivo (איור 1D)25. מודול התרבית יכול לתמוך ביישום של 2%-12% מתח מחזורי ותדר של עד 0.4 הרץ.- כדי להחדיר מתיחה לתרבית הנוזלית המתמשכת, השהו את מודול התרבית. באמצעות פקדים על המסך, שנה את הגדרות המתיחה ל-2% מתיחה, תדר של 0.2 או 0.15 הרץ והפעל מחדש את מודול התרבית.
- לאחר 24 שעות, חזור על שלב 7.5.1 כדי להחיל תדר של 10% מתיחה, 0.2 או 0.15 הרץ.
8. אינדוקציה של CYP450 באמצעות משרי CYP אב-טיפוס בשבב התריסריון
הערה: בדיקת האינדוקציה של ציטוכרום P450 (CYP450) מאפשרת להעריך אם תרכובת הבדיקה מגבירה את רמות ה-mRNA ו/או את הפעילות הקטליטית של אנזימי CYP450 ספציפיים. כאן, אנו מתארים את הפרוטוקול להערכת אינדוקציה של CYP3A4 על ידי תקן התעשייה והרגולטור המומלץ במבחנה משרי CYP, ריפאמפיצין (RIF) וויטמין D3 1,2-דיהידרוקסי (VD3). השיטה המוצגת עשויה לשמש לזיהוי הפוטנציאל של תרכובות בדיקה שונות כדי לגרום לאיזופורמים שונים של CYP450 ברקמת מעיים אנושית. יהיה צורך לבחור קבוצות ספציפיות של פריימרים ומצע בדיקה עבור כל איזופורם אנזים שיש להעריך.
- חשיפה למשרי CYP
- הכן פתרונות מלאי של 20 mM RIF, 100 mM VD3, ו 200 mM טסטוסטרון (טבלת חומרים) באמצעות DMSO סטרילי.
אזהרה: טסטוסטרון הוא חומר מבוקר לפי לוח זמנים III. עקוב אחר נהלים רגולטוריים במהלך הטיפול. - הכן מדיית מינון עם משרי CYP על ידי דילול פתרונות המלאי במדיום גדילה אורגנואידי מלא ובמדיום צמיחת תאי אנדותל כדי להשיג 20 μM RIF, 100 ננומול /L של VD3. הכן את בקרת הרכב על ידי דילול DMSO במדיה המתאימה כדי להשיג 0.1% של DMSO.
- השהה את מודול התרבות והבא את המגשים ל- BSC. החלף את המדיה בכל מאגרי הכניסה ב-2 מ"ל של מדיית מינון עם משרים או בקרת רכב. החזירו את המודולים הניידים בחזרה למודול התרבית והפעילו מחדש את הזרימה במהירות של 30 μL/h.
- לאחר 24 שעות, החלף את המדיה בפתרון גרימת, וחזור על שלבים 8.1.2-8.1.3. יש להכין תמיסות טיהור טריות מדי יום ולחדש אותן כל 24 שעות במהלך הניסוי, שאורכו בדרך כלל 48-72 שעות.
- הכן פתרונות מלאי של 20 mM RIF, 100 mM VD3, ו 200 mM טסטוסטרון (טבלת חומרים) באמצעות DMSO סטרילי.
- דגירה עם מצע אב טיפוס (טסטוסטרון)
- ביום הקציר, הכינו את תמיסת מצע הבדיקה של טסטוסטרון יחד עם משרי בדיקה מתאימים ב- DMEM/F12 מתקדמים כדי להניב ריכוז סופי של 200 μM. השמיטו את הוספת הסרום לתקשורת מכיוון שהדבר עלול להפריע לניתוח LCMS.
- הביאו את המגשים ל-BSC, ושאפו את מדיום המינון מכל המאגרים. יש לשטוף ולהחליף את מאגרי הכניסה העליונים והתחתונים במדיום חם של תאי DMEM/F12 בינוניים ותאי אנדותל מתקדמים, בהתאמה.
- הסר את מדיום הכביסה מהמאגרים והחלף אותו ב-1 מ"ל של תמיסת מצע בדיקה, שהוכנה בשלב 8.2.1. מכניסים את השבבים לקצב זרימה גבוה של 1,000 μL/h למשך 5 דקות ושואפים למאגרי מוצא עליונים ותחתונים כאחד. מחזירים את השבבים למודול התרבית ומדגרים למשך שעה אחת תחת הזרימה הקבועה של 300 μL/h.
- ניתוח נתונים
- איסוף דוגמאות לניתוח LCMS
- Aliquot 200 μL של תמיסת עצירה המכילה אצטוניטריל עם 0.1% חומצה פורמית בצינורות מסומנים מראש של 1.5 מ"ל ומניחים אותם על קרח. ההרכב של פתרון עצירת LCMS עשוי להשתנות בהתאם למצע שיש לנתח.
- לאחר השלמת שעה אחת של טיפול, עצרו את הזרימה והחזירו את המגשים ל-BSC. אספו 100 μL של שפכים ממאגר היציאה העליון והוסיפו אותם לצינור המתאים המכיל את תמיסת העצירה (איור 2A). מניחים את הצינורות מיד על קרח יבש. אחסן את הדגימות בטמפרטורה של -80 מעלות צלזיוס לפני שתמשיך לניתוח.
- חלץ ונתח דגימות באמצעות טכניקות HPLC או LC-MS/MS/ MS, תוך ניטור היווצרות של מטבוליט-6β-הידרוקסיטסטוסטרון (6β-OH-T). פעילות אנזים CYP יכולה לבוא לידי ביטוי כחלבון פמול/דקה/מ"ג כאשר פמול מתייחס לכמות המטבוליט (6β-OH-T) הנוצרת במהלך התגובה. תכולת החלבון הכוללת לכל שבב (חלבון; מ"ג) נקבעת על ידי ביצוע בדיקת ברדפורד המתוארת בשלב 8.3.2.

פעילות האינדוקציה המתקפלת מחושבת על ידי: פעילות CYP (מושרית) / פעילות CYP (רכב). - אם אתה אוסף דגימות לניתוח mRNA, ראה שלב 8.3.3.
- ליזיס של התאים לניתוח ביטוי חלבונים
הערה: מיצוי חלבונים מתאים על השבב מתבצע באמצעות מאגר ליזה חלבונית, בתוספת מעכבי פרוטאז ופוספטאז (טבלת חומרים). לאחר מכן מכמתים את החלבון המופק באמצעות בדיקת ברדפורד ומשמשים בניתוח במורד הזרם.- נתקו את השבבים ממודולים ניידים והניחו אותם בצלחת פטרי. לשטוף את שני הערוצים עם 200 μL של DPBS סטרילי.
- חסום את שקע הערוץ התחתון עם קצה פיפטה של מסנן 200 μL. מנקבים 50 μL של תמיסת הדיסוציאציה דרך הערוץ התחתון ודגירה במשך 2 דקות בטמפרטורת החדר.
- בדוק כדי לאשר ניתוק מלא של תאי האנדותל. פיפט למעלה ולמטה 1-2 פעמים ולהסיר את פתרון הדיסוציאציה מהערוץ. חזור על שטיפה.
- חסום את שקע הערוץ העליון עם קצה פיפטה של מסנן 200 μL. Perfuse 75 μL של מאגר תזה של חלבון דרך הערוץ העליון. השאירו את קצה הפיפטה מוכנס, כדי לחסום את כניסת הערוץ העליון ולדגום למשך 5 דקות בטמפרטורת החדר. פיפט למעלה ולמטה 5-10 פעמים ולאסוף את התא lysates בצינור 1.5 מ"ל מסומן מראש.
- חזור על שלב 8.3.2.4. עד לניתוק מוחלט של התאים. אספו את התאים באותה שפופרת של 1.5 מ"ל ואחסנו אותם בטמפרטורה של -80 מעלות צלזיוס עד לניתוח.
- הוציאו את חלק החלבון בהתאם לשיטות סטנדרטיות וכימתו את סך החלבון באמצעות מבחן ברדפורד (טבלת חומרים).
- תזה של התאים לניתוח ביטוי גנים
הערה: ניתן להשיג תזה של תאים על השבב למיצוי RNA באמצעות מאגר RNA lysis, בתוספת 0.1% 2-mercaptoethanol (טבלת חומרים). לחלופין, ניתן להשתמש במאגר RNA lysis מבוסס פנול אם נדרשות תפוקות גבוהות של RNA באיכות גבוהה המתאימה לניתוח NGS ומיקרו-מערכים.- בצע את השלבים 8.3.2.1 עד 8.3.2.2 כדי להכין שבב המעי לתזה.
- חסום את השקע של הערוץ העליון באמצעות קצה פיפטה של מסנן 200 μL. Perfuse 150 μL של מאגר RNA lysis דרך הערוץ העליון. השאירו את קצה הפיפטה מוכנס כדי לחסום את הכניסה של הערוץ העליון. דגירה למשך 2 דקות בטמפרטורת החדר. עבור lysis באמצעות מאגר RNA lysis מבוסס פנול, השתמש 350 μL של המגיב.
- פיפטה למעלה ולמטה 5-10 פעמים ולאסוף את התאים lysates בצינור 1.5 מ"ל מסומן מראש. חזור על השלב עם עוד 150 μL של מאגר RNA lysis ואסוף. אחסן את התא בטמפרטורה של -80 °C (80 °F) עד לניתוח. במקרה של ניתוח ריצוף RNA לאחר מכן, המשך עם הניתוח תוך חודש לאחר השקר.
- הוציאו סך הכל RNA מהליזאטים של התא באמצעות ערכת טיהור RNA.
- תמללו לאחור ל-cDNA באמצעות ערכת תעתיק הפוך וביצעו PCR בזמן אמת באמצעות רוכב PCR בזמן אמת והפריימרים והמאגר המתאימים. כימת את התוצאות בשיטת 2-ΔΔCt .
- איסוף דוגמאות לניתוח LCMS
9. שיבוש מחסום האפיתל באמצעות ציטוקינים פרו-דלקתיים בשבב המעי הגס
הערה: פרוטוקול זה מתאר שיבוש של מחסום אפיתל המעיים על ידי גמא אינטרפרון ציטוקינים (IFNγ)26,27,28,29. הציטוקין מינון בערוץ התחתון של שבב המעי הגס בהתחשב בביטוי הבזולטרלי של קולטן IFNγ על תאי אפיתל במעיים. הגירוי proinflammatory מוצג בשבב ביום 5 של התרבית, ברגעשאפליקציית P התייצבה מתחת ל-0.5 x 10-6 ס"מ לשנייה. משטר מינון דומה יכול לשמש עבור ציטוקינים פרו-דלקתיים אחרים וסוכנים משבשי מחסומים.
- גירוי עם IFNγ
- הכינו תמיסת מלאי של 100 מיקרוגרם/מ"ל של IFNγ (טבלת חומרים) במי תרביות תאים סטריליים. אחסן את תמיסת המלאי בטמפרטורה של -80 מעלות צלזיוס במהלך הניסוי. עבור כל ניסוי, השתמש תמיד במלאי רענן של IFNγ והימנע מיותר משלושה מחזורי הקפאה והפשרה.
- הכן תמיסת מינון IFNγ על ידי דילול תמיסת מלאי במדיום צמיחת תאי אנדותל פגוע כדי להשיג ריכוז סופי של 10-100 ננוגרם/מ"ל.
- הביאו את המגשים ל- BSC והסירו את המדיום ממאגרי הכניסה לתעלה התחתונה והחליפו אותו ב-3 מ"ל של המדיום המכיל IFNγ. רענן את מינון IFNγ מדי יום.
- הכניסו את המגשים למודול התרבית והכניסו את השבבים לקצב זרימה גבוה של 1,000 μL/h למשך 5 דקות כדי להתחיל בטיפול IFNγ. החלף את קצב הזרימה בחזרה ל- 60 μL/h והמשך את התרבית הנוזלית.
- ניתוח נתונים
- הערכת פונקציית מחסום האפיתל. החדירות הנראית לעין של האפיתל (אפליקציית P), או פונקציית המחסום, ניתנת למדידה בנקודות זמן שונות של התרבות לאחר הטיפול ב-IFNγ, במדיית השפכים של מאגרי הכניסה והיציאה של שני הערוצים. יש להוסיף את העקיבה הפלואורסצנטית למדיום הצמיחה האורגנואידית של הערוץ העליון 4 שעות לפני הערכתאפליקציית P. בדרך כלל, 3 kDa Dextran Cascade Blue משמש כמעקב פלואורסצנטי ונוסף במדיום 24 שעות לפני כן.
- השהה את מודול התרבות והבא את המגשים ל- BSC.
- תייג והכן צלחת בעלת דופן שחורה בעלת 96 בארות עם 100 μL של DPBS לכל באר. באמצעות פיפטה רב-ערוצית של 200 μL, אספו והוסיפו 50 μL של שפכים מכל המאגרים לבארות המתאימות (איור 2B).
- כדי להכין את העקומה הסטנדרטית, דיללו את המדיום המכיל 100 מיקרוגרם/מ"ל של 3 kDa dextran Cascade Blue 1:3 ב-DPBS. לאחר מכן לבצע דילולים סדרתיים באמצעות דילול משולש של מדיום גדילת תאי אנדותל ב-DPBS.
- קרא את הפלואורסצנציה בעירור של 375 ננומטר ופליטת 420 ננומטר באמצעות קורא לוחות. השתמש בערכי OD שנמדדו כדי לחשב חדירות לכאורה (אפליקציית P) באופן הבא:
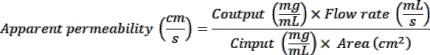
- צביעה אימונופלואורסצנטית של תאים על השבב
- שטפו באמצעות 200 μL של DPBS עבור כל ערוץ, שלוש פעמים.
- Perfuse 200 μL של הפתרון המקבע (4% PFA ב- DPBS) בכל ערוץ. דגירה למשך 15 דקות בטמפרטורת החדר.
- חזור על שלב הכביסה 9.2.2.1. בשלב זה, ניתן לאחסן שבבים שטופים עד 7 ימים בטמפרטורה של 4 מעלות צלזיוס.
- יש לחלחל לתאים באמצעות 200 μL של תמיסת חדירה (0.1% Triton-X 100 בסרום חמור רגיל (NDS) ב-10% ב-DPBS) עבור כל ערוץ. דגירה למשך 30 דקות בטמפרטורת החדר. חזור על שלב הכביסה 9.2.2.1.
- חסום את התאים על השבב באמצעות 200 μL של תמיסת חסימה (10% NDS ב- DPBS) עבור כל ערוץ. דגירה למשך שעה אחת בטמפרטורת החדר.
- דיללו את הנוגדנים העיקריים בתמיסת נוגדנים (5% NDS ב-DPBS) באופן הבא: אנטי-זונולה אוקלודנס 1 (ZO-1) (1:100, סמן צומת הדוק אפיתל), אנטי-אוקקלודין (1:100, סמן צומת הדוק אפיתל), אנטי-קלאודין 4 (1:100, סמן צומת הדוק אפיתל), אנטי-E-cadherin (1:100, סמן צמתים של דבקים אפיתליאליים (טבלת חומרים). מנקבים 200 μL של תמיסת הנוגדן העיקרית דרך כל תעלה ודגירה למשך הלילה בטמפרטורה של 4 מעלות צלזיוס. חזור על שלב הכביסה 9.2.2.1.
- דילול הנוגדנים המשניים בתמיסת הנוגדנים (1:300, 5% NDS ב-DPBS). יש לחדור 200 μL של תמיסה זו דרך כל תעלה ולדגום במשך 2 שעות בטמפרטורת החדר. חזור על שלב הכביסה 9.2.2.1. אם תרצה, phalloidin, סמן cytoskeletal, ניתן להוסיף לתמיסת הנוגדן המשני.
- הכן תמיסת 50 מיקרוגרם/מ"ל של 4′,6-דיאמידינו-2-פנילינדול (DAPI) ב-DPBS והשתמש בה כדי להחדיר 200 μL דרך כל ערוץ. דגירה בטמפרטורת החדר למשך 15 דקות. חזור על שלב הכביסה. בשלב זה, ניתן לאחסן שבבים מוכתמים עד 14 יום בטמפרטורה של 4 מעלות צלזיוס.
- הערכה של מחשוף קספאזה 3
- לבודד ולכמת את הכמות הכוללת של חלבון של תאי אפיתל כמתואר בשלב 8.3.2. השמיטו את שלב הכביסה 8.3.2.1. דיללו את הדגימות עם DPBS לריכוז סופי של 400 מיקרוגרם/מ"ל.
- לכמת את הרמות של קספאזה 3 הכוללת והמבודדת באמצעות ערכת זיהוי קספאזה 3 בהתאם לפרוטוקול היצרן.
- הערכה של הפרשת ציטוקינים פרו-דלקתיים
- השתמש בשפכים שנאספו מהשקע של שני הערוצים של שבב המעי הגס כדי לכמת ציטוקינים פרו-דלקתיים מופרשים בשלב חריף, בהתאם לפרוטוקולים שסופקו על ידי היצרן. בצע דילול של פי 5 עבור ערכת פגיעה בכלי דם V-PLEX 2 ודילול כפול עבור V-PLEX Human Proinflammatory Panel II.
- הערכת פונקציית מחסום האפיתל. החדירות הנראית לעין של האפיתל (אפליקציית P), או פונקציית המחסום, ניתנת למדידה בנקודות זמן שונות של התרבות לאחר הטיפול ב-IFNγ, במדיית השפכים של מאגרי הכניסה והיציאה של שני הערוצים. יש להוסיף את העקיבה הפלואורסצנטית למדיום הצמיחה האורגנואידית של הערוץ העליון 4 שעות לפני הערכתאפליקציית P. בדרך כלל, 3 kDa Dextran Cascade Blue משמש כמעקב פלואורסצנטי ונוסף במדיום 24 שעות לפני כן.
Access restricted. Please log in or start a trial to view this content.
תוצאות
איור 1D מסכם את ציר הזמן של תרבית שבבי המעי וממחיש את תאי האנדותל והאורגנואידים במעיים לפני ואחרי הזריעה על השבב. יתר על כן, הוא מדגים את ההבדלים המורפולוגיים המובהקים בין התריסריון לבין שבבי המעי הגס, המודגשים על ידי נוכחותן של התצורות דמויות הווילי בשבב התריסריון ומייצגו?...
Access restricted. Please log in or start a trial to view this content.
Discussion
השילוב של טכנולוגיית איבר על שבב ואורגנואידים במעיים טומן בחובו הבטחה למידול מדויק של פיזיולוגיה של המעי האנושי ופתופיזיולוגיה. כאן אנו מספקים פרוטוקול פשוט וחזק שלב אחר שלב (המתואר באיור 1) לביסוס שבב המעי המכיל שבב מעיים דק או קולוני שמקורו בביופסיה ותאי אנדותל מיקרו-וס?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
גאורי קולקארני, אתנסיה אפוסטולו, לורנה יוארט, קרולינה לוצ'סי ומגדלנה קסנדרה הן עובדות נוכחיות או לשעבר של Emulate Inc. ועשויות להחזיק בהון עצמי. Emulate Inc. היא החברה המייצרת את התקני שבבי האיברים ופרסמה פטנטים רלוונטיים לעבודה האמורה במאמר זה.
Acknowledgements
אנו מודים לפרופסור מארק דונוביץ' על שסיפק את האורגנואידים שמקורם בביופסיית מעיים ולברט קלייר על תכנון האיורים המדעיים של מודול השבב, הנייד והתרבית. כל שאר האיורים המדעיים נוצרו באמצעות BioRender.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| small intestine Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE15 | 0.5 cells M/ml ; cryopreserved |
| colon Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE16 | 0.5 cells M/ml ; cryopreserved |
| Biopsy-derived Human Duodenal Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Biopsy-derived Human Colonic Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Zoë CM-1™ Culture Module | Emulate Inc. | - | Culture module |
| Orb-HM1™ Hub Module | Emulate Inc. | - | 5% CO2, vacuum stretch, and power supply |
| Chip-S1™ Stretchable Chip | Emulate Inc. | - | Organ-Chip |
| Pod™ Portable Modules | Emulate Inc. | - | Portable module |
| UV Light Box | Emulate Inc. | - | - |
| Chip Cradle | Emulate Inc. | - | 1 per square culture dish |
| Steriflip®-HV Filters | EMD Millipore | SE1M003M00 | 0.45 μm PVDF filter |
| Square Cell Culture Dish (120 x 120 mm) | VWR | 82051-068 | - |
| Handheld vacuum aspirator | Corning | 4930 | - |
| Aspirating pipettes | Corning / Falcon | 357558 | 2 mL, polystyrene, individually wrapped |
| Aspirating tips | - | Sterile (autoclaved) | |
| Serological pipettes | - | 2 mL, 5 mL, 10 mL, and 25 mL low endotoxin, sterile | |
| Pipette | P20, P200, P1000 and standard multichannel | ||
| Pipette tips | P20, P200, and P1000. | ||
| Conical tubes (Protein LoBind® Tubes) | Eppendorf | 0030122216; 0030122240 | 15 mL, 50 mL tubes |
| Eppendorf Tubes® lo-bind | Eppendorf | 022431081 | 1.5 mL tubes |
| 96 wells black walled plate | - | - | for epithelial permeability analysis |
| Microscope (with camera) | - | - | For bright-field imaging |
| Water bath (or beads) | - | - | Set to 37°C |
| Vacuum set-up | - | - | Minimum pressure: -70 kPa |
| Cell scrapers | Biotium | 220033 | |
| T75 flasks | BD Falcon | 353136 | Cell culture flask |
| Emulate Reagent-1 (ER-1) | Emulate Inc. | - | Chip coating solution |
| Emulate Reagent-2 (ER-2) | Emulate Inc. | - | Chip coating solution |
| Dulbecco’s PBS (DPBS) | Corning | 21-031-CV | 1X |
| Cell Culture Grade Water | Corning | MT25055CV | |
| Trypan blue | Sigma | 93595 | For cell counting |
| TryplE Express | ThermoFisher Scientific | 12604013 | Organoids dissociation and endothelium cells detachment solution |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634028 | Medium |
| IntestiCult™ Organoid Growth Medium (Human) | Stem Cell technologies | 06010 | Organoid Growth Medium |
| Endothelial Cell Growth Medium MV 2 | Promocell | C-22121 | Endothelial medium |
| Fetal bovine serum (FBS) | Sigma | F4135 | Serum |
| Primocin™ | InvivoGen | ANT-PM-1 | antimicrobial agent |
| Attachment Factor™ | Cell Systems | 4Z0-210 | coating solution for flask |
| Matrigel - Growth Factor Reduced | Corning | 356231 | Solubilized basement membrane matrix |
| Collagen IV | Sigma | C5533 | ECM component |
| Fibronectin | Corning | 356008 | ECM component |
| Y-27632 | Stem Cell technologies | 72304 | organoid media supplement |
| CHIR99021 | Reprocell | 04-0004-10 | organoid media supplement |
| Cell Recovery Solution | Corning | 354253 | Basement mebrane matrix dissociationsolution |
| Bovine Serum Albumin (BSA) | Sigma | A9576 | 30%, Sterile |
| Cell Culture Grade Water | Corning | MT25055CV | Sterile, Water |
| DMSO | Sigma | D2650 | solvent |
| 3KDa Dextran Cascade Blue | Invitrogen | D7132 | 10 mg powder |
| Rifampicin (RIF) | Sigma | Cat# R3501 | CYP inducer |
| Testosterone hydrate | Sigma | T1500 | CYP substrate |
| 1,25-dihyroxy Vitamin D3 (VD3) | Sigma | Cat# D1530 | CYP inducer |
| Acetonitrile with 0.1% (v/v) Formic acid | Sigma | 159002 | LCMS stop solution |
| IFNγ | Peprotech | 300-02 | |
| 4% Paraformaldehyde (PFA) | EMS | 157-4 | Fixative |
| Triton-X 100 | Sigma | T8787 | |
| Normal Donkey Serum (NDS) | Sigma | 566460 | |
| anti-Occludin | ThermoFisher Scientific | 33-1500 | tight junctions marker |
| anti-Claudin 4 | ThermoFisher Scientific | 36-4800 | tight junctions marker |
| anti-E-cadherin | Abcam | ab1416 | epithelial adherens junctions marker |
| anti-VE-cadherin | Abcam | ab33168 | endothelial adherent junctions marker |
| anti- Zonula Occludens 1 (ZO-1) | Thermo Fischer | 339194 | tight junctions marker |
| DAPI | ThermoFisher Scientific | 62248 | nuclear stain |
| 2-mercaptoethanol | Sigma | M6250 | |
| PureLink RNA Mini Kit | Invitrogen | 12183020 | RNA lysis, isolation and purification kit |
| SuperScript™ IV VILO™ Master Mix | Invitrogen | 11756050 | reverse transcriptase kit |
| TaqMan™ Fast Advanced Master Mix | Applied Biosystems | 4444557 | qPCR reagent |
| QuantStudio™ 5 Real-Time PCR System | Applied Biosystems | A28573 | Real-time PCR cycler |
| 18S primer | ThermoFisher Scientific | Hs99999901_s1 | Eukaryotic 18S rRNA |
| CYP3A4 primer | ThermoFisher Scientific | Hs00604506_m1 | Cytochrome family 3 subfamily A member 4 |
| Pierce™ Coomassie Plus (Bradford) Assay Kit | ThermoFisher Scientific | 23236 | Protein quantification kit |
| MSD Tris lysis buffer | Meso Scale Diagnostics | R60TX-3 | Protein lysis buffer |
| Cleaved/Total Caspase-3 Whole Cell Lysate Kit | Meso Scale Diagnostics | K15140D | Caspase 3 detection kit |
| V-PLEX Vascular Injury Panel 2 Human Kit | Meso Scale Diagnostics | K15198D | |
| V-PLEX Human Proinflammatory Panel II (4-Plex) | Meso Scale Diagnostics | K15053D | |
| Zeiss LSM 880 | Zeiss | - | Confocal microscope |
| Zeiss LD plan-Neofluar 20x/0.40 Korr M27 | Zeiss | - | 20X long-distance objective lenses |
| Zeiss AXIOvert.A1 | Zeiss | - | Brightfield microscope |
| Zeiss LD A-Plan 10X/0.25 Ph1 | Zeiss | - | 10X objective lenses |
References
- Fritz, A., et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors: An intra-subject analysis. Basic and Clinical Pharmacology and Toxicology. 124 (3), 245-255 (2019).
- Okumura, R., Takeda, K. Maintenance of intestinal homeostasis by mucosal barriers. Inflammation and Regeneration. 38 (1), 1-8 (2018).
- Delgado, M. E., Grabinger, T., Brunner, T. Cell death at the intestinal epithelial front line. FEBS Journal. 283 (14), 2701-2719 (2016).
- Mestas, J., Hughes, C. C. W. Of mice and not men: Differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Yu, H., et al. The contributions of human mini-intestines to the study of intestinal physiology and pathophysiology. Annual Review of Physiology. 79, 291-312 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Durel, J. F., Nerurkar, N. L. Mechanobiology of vertebrate gut morphogenesis. Current Opinion in Genetics and Development. 63, 45-52 (2020).
- Gayer, C. P., Basson, M. D. The effects of mechanical forces on intestinal physiology and pathology. Cellular Signalling. 21 (8), 1237-1244 (2009).
- Xu, Y., et al. Mechanical stimulation activates Piezo1 to promote mucin2 expression in goblet cells. Journal of Gastroenterology and Hepatology (Australia). 36 (11), 3127-3139 (2021).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS One. 8 (7), 68761(2013).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Kasendra, M., et al. Duodenum intestine-chip for preclinical drug assessment in a human relevant model. eLife. 9, 50135(2020).
- Apostolou, A., et al. A novel microphysiological colon platform to decipher mechanisms driving human intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology. 12 (5), 1719-1741 (2021).
- Jalili-Firoozinezhad, S., et al. Author correction: A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 583(2019).
- Yin, J., et al. Fluid shear stress enhances differentiation of jejunal human enteroids in Intestine-Chip. American Journal of Physiology-Gastrointestinal and Liver Physiology. 320 (3), 258-271 (2021).
- Sontheimer-Phelps, A., et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43(2019).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Sarna, S. K. Colonic motility: From bench side to bedside. Morgan & Claypool Life Sciences. , San Rafael (CA). (2010).
- Basson, M. D. Paradigms for mechanical signal transduction in the intestinal epithelium - category: Molecular, cell, and developmental biology. Digestion. 68 (4), 217-225 (2003).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. The American Journal of Pathology. 166 (2), 409-419 (2005).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-Catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Madara, J. L., Stafford, J. Interferon-γ directly affects barrier function of cultured intestinal epithelial monolayers. Journal of Clinical Investigation. 83 (2), 724-727 (1989).
- Bruewer, M., et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. The Journal of Immunology. 171 (11), 6164-6172 (2003).
- Jones, S. C., et al. Adhesion molecules in inflammatory bowel disease. Gut. 36 (5), 724-730 (1995).
- Uhlar, C. M., Whitehead, A. S. Serum amyloid A, the major vertebrate acute-phase reactant. European Journal of Biochemistry. 265 (2), 501-523 (1999).
- Pérez-González, C., Ceada, G., Matejčić, M., Trepat, X. Digesting the mechanobiology of the intestinal epithelium. Current Opinion in Genetics & Development. 72, 82-90 (2022).
- In, J., et al. Enterohemorrhagic escherichia coli reduces mucus and intermicrovillar bridges in human stem cell-derived colonoids. Cellular and Molecular Gastroenterology and Hepatology. 2 (1), 48-62 (2016).
- Grassart, A., et al. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host and Microbe. 26 (3), 435-444 (2019).
- Kerns, S. J., et al. Human immunocompetent organ-on-chip platforms allow safety profiling of tumor-targeted t-cell bispecific antibodies. eLife. 10, 67106(2021).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Ingber, D. E. Reverse engineering human pathophysiology with organs-on-chips. Cell. 164 (6), 1105-1109 (2016).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved