É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Combinando organoides humanos e tecnologia organ-on-a-chip para modelar funcionalidade específica da região intestinal
Neste Artigo
Resumo
Organoides intestinais derivados da biópsia e tecnologias de órgãos em chips são combinados em uma plataforma microfisiológica para recapitular a funcionalidade intestinal específica da região.
Resumo
A mucosa intestinal é uma barreira física e bioquímica complexa que cumpre uma miríade de funções importantes. Permite o transporte, absorção e metabolismo de nutrientes e xenobióticos, facilitando uma relação simbiótica com a microbiota e restringindo a invasão de microrganismos. A interação funcional entre vários tipos celulares e seu ambiente físico e bioquímico é vital para estabelecer e manter a homeostase do tecido intestinal. Modelar essas interações complexas e a fisiologia intestinal integrada in vitro é um objetivo formidável com o potencial de transformar a forma como novos alvos terapêuticos e candidatos a medicamentos são descobertos e desenvolvidos.
Organoides e tecnologias organoides e organ-on-a-chip foram recentemente combinados para gerar chips intestinais relevantes para o homem adequados para estudar os aspectos funcionais da fisiologia intestinal e da fisiopatologia in vitro. Organoides derivados das biópsias do intestino delgado (duodeno) e intestino grosso são semeados no compartimento superior de um chip de órgão e, em seguida, expandem com sucesso como monocamadas, preservando as características celulares, moleculares e funcionais distintas de cada região intestinal. Células microvasculares microvasculares específicas do intestino humano são incorporadas no compartimento inferior do chip de órgão para recriar a interface epitelial-endotelial. Esta nova plataforma facilita a exposição luminal a nutrientes, drogas e microrganismos, permitindo estudos de transporte intestinal, permeabilidade e interações hospedeiro-micróbio.
Aqui, um protocolo detalhado é fornecido para o estabelecimento de chips de intestino representando o duodeno humano (chip duodeno) e cólon (chip de cólon), e sua cultura subsequente sob fluxo contínuo e deformações semelhantes à peristalse. Demonstramos métodos para avaliar o metabolismo de drogas e indução CYP3A4 no chip duodeno usando indutores e substratos prototípicos. Por fim, fornecemos um procedimento passo-a-passo para a modelagem in vitro de interferon gama (IFNγ)-mediado ruptura de barreira (síndrome do intestino vazado) em um chip de cólon, incluindo métodos para avaliar a alteração da permeabilidade paracelular, alterações na secreção de citocinas e perfil transcriômico das células dentro do chip.
Introdução
O intestino humano é um órgão complexo e multitarefa capaz de auto-regeneração. É dividido em intestino delgado e grande. A função primária do intestino delgado é digerir ainda mais os alimentos provenientes do estômago, absorver todos os nutrientes e passar o resíduo para o intestino grosso, que recupera a água e os eletrólitos. O intestino delgado é ainda dividido em múltiplas regiões anatomicamente distintas: o duodeno, jejunum e íleo, cada um dos quais é adaptado para executar funções específicas. Por exemplo, o duodeno ajuda a quebrar o chyme (conteúdo estomacal) para permitir a absorção adequada de nutrientes envolvendo proteínas, carboidratos, vitaminas e minerais no jejunum. Esta parte proximal do intestino delgado também é o principal local de absorção e metabolismo de drogas intestinais, e é caracterizada pela maior expressão de enzimas metabolizadoras de drogas (por exemplo, CYP3A4) em comparação com sua expressão no íleo e cólon1. Além de seu papel principal na digestão e absorção de nutrientes, o intestino também é uma barreira eficaz contra conteúdos luminosos potencialmente prejudiciais, como microrganismos patogênicos, metabólitos microbianos, antígenos dietéticos e toxinas 2,3. Vale ressaltar que o cólon humano é habitado por um grande número de microrganismos, muito superior ao total de células do corpo humano, que proporcionam muitos benefícios à nutrição, metabolismo e imunidade. Portanto, a manutenção da integridade da barreira mucosa formada pelas células epiteliais intestinais é fundamental para permitir a relação simbiótica entre a microbiota intestinal e as células hospedeiras, separando-as fisicamente para evitar a ativação desnecessária das células imunes2. Além disso, a morte celular intestinal programada desempenha um papel essencial como um mecanismo de autoproteção que impede que as células infectadas persistam ou se proliferem — assim, disseminando potenciais patógenos3 — enquanto a auto-renovação contínua do epitélio intestinal a cada quatro ou sete dias compensa a perda celular que garante a integridade da barreira e a homeostase tecidual. Os prejuízos das funções intestinais descritas, incluindo absorção de nutrientes, integridade da barreira ou desequilíbrio na morte celular intestinal e autocon renovação, podem resultar no desenvolvimento de uma série de distúrbios gastrointestinais, incluindo desnutrição e doença inflamatória intestinal (DII)2,3.
Anteriormente, modelos animais e linhas de células intestinais derivadas do câncer foram utilizadas para estudar as funções fisiológicas e fisiodicosiológicas do tecido intestinal humano. No entanto, preocupações cada vez mais proeminentes sobre a tradução da pesquisa animal para os seres humanos, causada pela presença de disparidades significativas entre as duas espécies, destacaram a necessidade de métodos alternativos relevantes para o serhumano 4. As linhas de células intestinais in vitro comumente usadas incluem células T84, Caco-2 e HT29. Enquanto imitam certos aspectos da função da barreira intestinal e do transporte de membranas, eles são caracterizados por uma expressão alterada de enzimas metabolizantes de drogas5, receptores superficiais e transportadores4. Além disso, não possuem especificidade do segmento intestinal e não conseguem recapitular a complexidade do epitélio intestinal, com cada modelo contendo apenas um dos cinco tipos de células epiteliais presentes no intestino6.
Recentemente, culturas organoides intestinais humanas estabelecidas a partir de biópsias frescas do intestino delgado e do cólon 7,8 ou células-tronco pluripotentes induzidas (iPSC)9 foram introduzidas como modelos experimentais alternativos com potencial para complementar, reduzir e talvez substituir a experimentação animal no futuro. Embora os iPSCs possam ser obtidos de forma não invasiva, estabelecer organoides a partir de iPSCs requer o uso de protocolos complexos e demorados (com várias etapas experimentais) e gera culturas semelhantes ao tecido fetal humano. Em contraste, organoides derivados da biópsia são altamente escaláveis, pois podem aproveitar a capacidade de renovação inerente do tecido intestinal e podem ser indefinidamente passagemdos e propagados in vitro. É importante ressaltar que os organoides derivados da biópsia mantêm a doença e as características específicas da região intestinal do tecido primário do qual foram desenvolvidos e emulam a diversidade celular do epitélio intestinal. Organoides podem ser usados como avatares específicos do paciente in vitro para desvendar a biologia e a patogênese de vários distúrbios gastrointestinais e melhorar seu manejo terapêutico. Embora os organoides intestinais tenham alcançado um grau impressionante de funcionalidade fisiológica, eles ainda não conseguem reproduzir a complexidade dos órgãos nativos devido à falta de componentes estrômicos críticos — incluindo vasos sanguíneos, tecido conjuntivo, nervos periféricos e células imunes — bem como estimulação mecânica. Parâmetros mecânicos, como fluxo, estresse de cisalhamento, estiramento e pressão, são conhecidos por influenciar morfênese tecidual e homeostase in vivo e foram previamente mostrados para melhorar a maturação de células in vitro 10,11,12,13. Uma desvantagem importante adicional dos sistemas organoides é a inacessibilidade do lúmen e, portanto, para o lado apical do epitélio. Isso representa um desafio para investigar vários mecanismos associados à expressão polarizada de transportadores de íons e medicamentos, interações hospedeiro-microbioma e testes de toxicidade farmacêutica. Por fim, as culturas organoides sofrem de considerável variabilidade no tamanho, morfologia e função, devido à natureza estocástica do processo de auto-organização in vitro e escolhas de destino celular. Portanto, para perceber todo o potencial dos organoides intestinais na modelagem da doença, rastreamento de medicamentos e medicina regenerativa, é necessário explorar novas estratégias que reduzam a variabilidade no desenvolvimento organoide, melhorem o acesso ao compartimento luminal e incorporem interações células-células ausentes.
A tecnologia Organ-on-a-Chip introduziu muitas técnicas para a incorporação de forças mecânicas e fluxo de fluidos para culturas de células intestinais in vitro. No entanto, como a maioria dos estudos iniciais de prova de conceito tem usado linhas celulares derivadas do câncer que não apresentaram diversidade celular suficiente, a relevância desses sistemas tem sido questionada. Recentemente, combinamos sinergicamente organoides intestinais e tecnologia organ-on-a-chip para incorporar as melhores características de cada abordagem em um sistema in vitro 14,15,16. O intestino-chip resultante recapitula a arquitetura multicelular do epitélio intestinal, a presença da interface do tecido epitelial-endotelial, e as forças mecânicas de fluxo e estiramento de fluidos, permitindo a emulação das funções de nível de órgão in vitro. Além disso, o uso de organoides derivados do tecido primário (que podem ser amostrados de diferentes regiões do intestino humano) como material inicial aumenta a versatilidade deste modelo, pois chips representando duodeno humano, jejunum, ileum e cólon podem ser estabelecidos após procedimentos semelhantes de semeadura e cultura. É importante ressaltar que os intestino-chips permitem a avaliação em tempo real da integridade da barreira intestinal; atividade da borda da escova e enzimas de metabolismo de drogas; produção de mucinas; secreção de citocinas; e interação de células intestinais com microrganismos patogênicos e commensais, como demonstrado nos relatórios publicados anteriormente. Notavelmente, quando os chips do intestino foram estabelecidos utilizando organoides gerados a partir do tecido de diferentes indivíduos, esses modelos capturaram a variabilidade inter-doadora esperada nas respostas funcionais a vários medicamentos e tratamentos. Ao todo, a fusão de organoides com a tecnologia Organ-on-a-Chip abre as portas para modelos mais avançados, personalizados e relevantes que possam melhorar a relevância fisiológica e a precisão dos achados in vitro, bem como sua extrapolação para os seres humanos. Aqui, é apresentado um protocolo detalhado para o estabelecimento do chip intestinal e sua aplicação nos estudos das funções fisiológicas dos dois segmentos intestinais: duodeno e cólon. Em primeiro lugar, são descritos os métodos para avaliar a atividade da enzima metabolizadora cyp3A4 no chip duodeno, bem como sua indução por compostos prototípicos como rifampicina e vitamina D3. Em segundo lugar, as etapas necessárias para modelar o "intestino vazão" no chip de cólon são descritas no protocolo, com a interrupção da barreira epitelial sendo realizada usando citocinas marcantes implicadas na patogênese do IBD. Resumidamente, organoides derivados de biópsias humanas são propagados in vitro, submetidos à digestão enzimática, e introduzidos no canal superior do chip. Na presença de perfusão contínua com mídia enriquecida com fator de crescimento, eles se desenvolvem em uma monocamada epitelial confluente com arquitetura 3D e uma superfície celular apical facilmente acessível. O compartimento de chip "vascular" inferior é semeado com células endoteliais microvasculares isoladas do intestino delgado ou grande. O epitélio e o endotélio são separados por uma membrana porosa elástica, que facilita as interações paracrinas entre os dois tecidos e, quando submetidas a deformações cíclicas, emula movimentos semelhantes à peristalse do intestino humano. A cocultura é mantida sob as condições dinâmicas de fluxo geradas pela perfusão luminal e vascular com meios de cultura celular adequados. Finalmente, descrevemos inúmeros tipos de ensaios e análises de ponto final que podem ser realizadas diretamente no chip ou a partir de efluentes de cultura celular amostrada.
Access restricted. Please log in or start a trial to view this content.
Protocolo
NOTA: Todas as culturas celulares devem ser manuseadas usando uma técnica asséptica adequada.
Os organoides intestinais humanos empregados neste estudo foram obtidos pela Universidade Johns Hopkins e todos os métodos foram realizados de acordo com as diretrizes e regulamentos aprovados. Todos os protocolos experimentais foram aprovados pelo Johns Hopkins University Institutional Review Board (IRB #NA 00038329).
1. Preparação dos reagentes da cultura celular
- Prepare o meio de crescimento organoide humano seguindo as instruções do fabricante (Tabela de Materiais) e suplementá-lo com 100 μg/mL de primocina.
- Prepare o meio de crescimento da célula endotelial microvascular humana seguindo as instruções do fabricante (Tabela de Materiais) e complemente com 1:20 vol/vol FBS e 50 μg/ml em vez de 100 μg/ml de primocina.
- Resuspend Y-27632 (Inibidor de Rho-kinase) em Estéril 0,1% BSA em DPBS para preparar uma solução de estoque de 10 mM. Alíquota em microtubos estéreis e armazenar a -20 °C por até 6 meses.
- Resuspend CHIR99021 (Inibidor GSK-3) em dimetilsulfoxida estéril (DMSO) para preparar uma solução de estoque de 5 mM. Alíquota em microtubos estéreis e armazenar a -20 °C por até 6 meses.
- Prepare a solução de digestão organoide humana misturando uma solução de dissociação organoides de 1:1 vol/vol (Tabela de Materiais) com solução DPBS (Tabela de Materiais) e complementando-a com uma solução de estoque de 10 μM de Y-27632. Este reagente deve ser fresco para cada uso.
2. Cultura das Células Endoteliais Microvasculares Intestinais Humanas (HIMECs)
- Inicie a cultura HIMEC (Tabela de Materiais) 7 dias antes de semeá-la no chip. Apenas HIMECs na passagem 1-6 podem ser usados para semeadura de chips.
- Adicionar 5 mL da solução do fator de fixação (Tabela de Materiais) a um frasco T150; incubar a 37 °C por 1 min e descartar a solução.
- Adicione 19 mL de crescimento celular endotelial pré-aquecido à temperatura ambiente (ver passo 1.2) ao frasco.
- Descongele um frasco congelado de HIMEC (2 milhões de células/frasco) em um banho de água de 37°C.
- Transfira o conteúdo do frasco para o frasco e balance suavemente o frasco para distribuir as células uniformemente. Coloque o frasco em uma incubadora de 37 °C durante a noite para permitir que as células endoteliais aderam.
- Substitua o meio por 20 mL de crescimento celular endotelial pré-aquecido à temperatura ambiente no dia seguinte e a cada 3 dias depois. As culturas devem atingir 90% da confluência no dia da colheita celular para experimentos com chips.
3. Microfabricação e preparação do chip
- Obter chips de um fornecedor comercial (Tabela de Materiais). Desempacotar as lascas e posicioná-las no berço do chip colocado em uma placa de Petri quadrada (Tabela de Materiais). Rotule o lado frontal de cada porta-chips com as condições experimentais (Figura 1A).
NOTA: Embora o protocolo apresentado dependa do uso de um chip e instrumentação comercialmente disponíveis especificamente, existem vários dispositivos microfluidos oferecidos por meio de diferentes fornecedores, que podem oferecer vantagens alternativas, mas não têm a capacidade de incorporar alongamento. Além disso, a microfabricação dos Órgãos-on-Chips pode ser realizada "em casa" seguindo os procedimentos descritos em Huh et al.21.
4. Ativação e revestimento ECM da membrana
- Preparação da solução de ativação
- Leve os reagentes ER-1 e ER-2 (Tabela de Materiais) à temperatura ambiente para equilibrar antes do uso. O ER-1 é sensível à luz e deve ser manuseado no escuro.
- Reconstituir o ER-1 em 10 mL de reagente ER-2 para fazer uma concentração final de 0,5 mg/mL e confirmar que o ER-1 está completamente dissolvido.
- Ativação de superfície
- Empurre suavemente 50 μL da solução ER-1 através de ambos os canais do chip (Figura 1A).
- Remova qualquer solução ER-1 em excesso da superfície do chip usando um aspirador.
- Inspecione os chips para ter certeza de que todos os chips receberam a solução ER-1. No caso de bolhas de ar, introduza mais solução ER-1 até que as bolhas sejam totalmente removidas.
- Incubar os chips dentro da câmara de lâmpada UV (Tabela de Materiais) por 15 minutos. Confirme se a lâmpada UV está definida para a configuração Consistente.
- Leve os chips ativados ER-1 de volta ao gabinete de biossegurança (BSC). Aspire a solução ER-1 de ambos os canais. Lave qualquer resíduo da solução ER-1 com 200 μL de ER-2.
- Empurre 200 μL de salina estéril tamponada de fosfato (DBPS) através dos canais (Tabela de Materiais) e deixe o DBPS nos canais até o próximo passo.
- Preparação de matriz extracelular (ECM) e revestimento de membrana
- Elaboração de soluções de estoque de componentes ECM
- Reconstituir colágeno IV (Tabela de Materiais) e fibronectina (Tabela de Materiais) utilizando água de grau de cultura celular estéril (Tabela de Materiais) para uma concentração final de 1 mg/mL. Prepare as alíquotas e armazene-as a -20°C até usar.
- Preparação da solução de trabalho ECM para revestimento de membrana
- Prepare 1,5 mL de cada solução ECM para o canal superior e inferior para cada 12 chips a serem revestidos. A solução ECM deve estar sempre preparada antes do uso.
- Para o canal superior, misture colágeno IV e matriz de membrana de porão solubilizada (BMM) (Tabela de Materiais) em DBPS frio estéril a 200 μg/mL e 100 μg/mL, respectivamente. Para o canal inferior, misture colágeno IV e fibronectina em DPBS frio estéril a 200 μg/mL e 30 μg/mL, respectivamente.
- Revestimento ECM dos chips
- Aspire o DBPS de ambos os canais dos chips e substitua pela solução de trabalho ECM apropriada para cada canal (Figura 1A).
- Inspecione cada chip para garantir que ele recebeu a solução de revestimento. No caso de bolhas de ar, passe por mais solução de revestimento até que todas as bolhas sejam totalmente removidas.
- Adicione DPBS estéreis ao berço do chip e coloque a placa de Petri contendo as lascas em uma incubadora de 37 °C. Incubar durante a noite para permitir que as proteínas ECM formem ligações iônicas com a membrana PDMS ativada. Se desejar, as células podem ser semeadas a qualquer momento entre 2h e 1 dia após o revestimento dos chips. Alternativamente, os chips revestidos podem ser armazenados a 4°C durante a noite, seguidos de incubação durante a noite a 37°C e semeadura de chip.
- Elaboração de soluções de estoque de componentes ECM
5. Semeadura de Células Endoteliais Microvasculares Intestinais (HIMECs) no canal inferior do chip
NOTA: Pequenos HIMECs intestinais e colonicos são semeados no canal inferior do duodeno e chip de cólon, respectivamente.
- Preparar chips
- Transfira os chips revestidos de ECM para o BSC. Aspire suavemente o revestimento ECM de ambos os canais dos chips e, em seguida, lave ambos os canais com 200 μL de crescimento organoide médio e meio de crescimento celular endotelial, respectivamente.
- Armazene os chips lavados em uma incubadora de 37°C até prosseguir com a semeadura de células endoteliais.
- Colher as células endoteliais
- Leve o frasco de cultura HIMEC para o BSC e lave usando DPBS estéreis.
- Adicione 3 mL de solução de dissociação ao frasco e coloque-o na incubadora de 37°C por 2 min para permitir o descolamento completo das células.
- Colete as células em um tubo cônico de 15 mL e adicione mídia de crescimento celular endotelial até atingir 10 mL. Amostra 15-20 μL da suspensão celular para contagem celular. Centrifugar a 150 x g por 5 min.
- Aspire cuidadosamente o supernasciente e suspenda os HIMECs a uma densidade de 8-10 x 106 células/mL em mídia de crescimento celular endotelial.
- Células endoteliais de sementes no canal inferior do chip
- Leve a placa de Petri contendo as lascas para o BSC e remova suavemente toda a mídia do canal inferior usando uma pipeta de 1.000 μL.
- Introduza 10-15 μL da suspensão HIMEC no canal inferior do chip. Inspecione o chip logo após a semeadura para garantir a densidade ideal de semeadura (80%-90% de cobertura) e a distribuição celular homogênea dentro do canal (Figura 1D). Se a densidade de semeadura for maior ou menor do que o esperado ou desigual, lave o canal 2x com 200 μL de mídia de crescimento celular endotelial e repita o procedimento de semeadura.
- Inverta a placa de Petri imediatamente após a semeadura de cada lote de seis chips para permitir o apego da célula endotelial ao lado inferior da membrana PDMS. Coloque as placas de Petri na incubadora de 37°C por 30 minutos a 1 h, ou até que os HIMECs no canal inferior tenham ligado à membrana (Figura 1D).
- Lave as fichas
- Empurre suavemente 200 μL de mídia de crescimento de células endoteliais através da entrada do canal inferior para remover quaisquer células nãoectadas e repor os nutrientes na mídia.
- Lave as células que não se anexaram no canal superior com 200 μL de meio de crescimento organoide suplementado com 5 μM CHIR99021 e 10 μM Y-27632.
- Coloque os chips na incubadora de 37°C até seguir para a semeadura da célula epitelial.
6. Semeadura de fragmentos organoides no canal superior do chip
NOTA: Organoides isolados de biópsias de várias regiões intestinais podem ser cultivados no chipdo intestino 7. Siga os procedimentos descritos em Fujii et al. para o isolamento das criptas intestinais humanas e o estabelecimento de culturas organoides22. Aqui, organoides duodenais e colonicos são usados para gerar as lascas de duodeno e cólon, respectivamente. Dada a alta variabilidade em lote a lote e de doador para doador na formação e crescimento organoide, sugere-se realizar uma avaliação piloto da densidade celular na cultura de suspensão organoide (formato de placa de 24 poços) para alcançar a densidade ideal de semeadura de 8 milhões de células/mL.
- Avaliação piloto dos números celulares/bem da cultura organoide estática.
NOTA: O procedimento a seguir é apenas para determinar o número de poços de cultura de suspensão organoide necessária para a semeadura do chip. As células únicas resultantes não devem ser utilizadas para a semeadura do chip.- Aspire cuidadosamente o supernaente de três poços da placa de cultura organoide. Adicione 500 μL de solução de dissociação BMM gelada (Tabela de Materiais) a cada poço e use um raspador de plástico para separar o BMM solubilizado do plástico.
- Colete a suspensão organoide em um tubo cônico de baixa proteína estéril usando uma pipeta de 1.000 μL gelada. Incubar no gelo por 60 minutos, misturando a cada 15 minutos sacudindo suavemente o tubo. Centrifugar a 300 x g por 5 min a 4°C.
- Aspire o supernatante e adicione 2 mL de Trypsin. Incubar a 37°C por 30 minutos para digerir os organoides ao nível de célula única e adicionar 10 mL de meio de crescimento organoide completo para parar a reação enzimática. Centrifugar a 300 x g por 5 min a 4°C.
- Resuspend a pelota celular em 1 mL de meio de crescimento organoide completo e conte o número total de células usando um hematócito de acordo com os métodos padrão.
- Preparação de fragmentos organoides e sua semeadura no chip
NOTA: Os seguintes procedimentos podem ser usados para semear organoides duodenais ou colonicos no canal superior do chip. O estabelecimento de uma monocamada epitelial com citoarquitetura 3D relevante in vivo depende da presença de fluxo15,23 e de semeadura bem sucedida de fragmentos organoides.- Aspire cuidadosamente o meio a partir do número de poços da cultura organoide estática, o que é suficiente, conforme determinado na etapa 6.1, para alcançar a densidade final de semeadura de 8 milhões de células/mL. Adicione 500 μL de solução de dissociação BMM gelada a cada poço.
- Retire o BMM solubilizado da superfície dos poços usando um raspador de plástico ou 1.000 μL pipeta. Colete a suspensão em um tubo cônico de ligação de baixa proteína de 15 mL.
- Guarde a suspensão no gelo por 60 minutos, misturando a cada 15 minutos sacudindo suavemente o tubo. Prossiga para centrifugação a 300 x g para 5 min a 4°C. Uma pelota organoide bem definida deve ser visível após a centrifugação. Se uma camada de gel transparente for observada acima da pelota celular (resíduos de BMM solubilizada) (Figura 1B), proceda com as seguintes etapas.
- Misture a pelota supernacante e a célula e adicione um volume igual de solução de dissociação de BMM no tubo. Misture suavemente e armazene no gelo por mais 10 minutos, e prossiga para centrifugação a 300 x g por 5 min a 4°C.
- Se necessário, repita o passo 6.2.3.1 até que não haja resíduos de BMM solubilizados.
- Descarte o supernatante e resuspenque a pelota organoide com solução de digestão organoide (ver passo 1.5). Use um volume suficiente de solução de digestão organoide para garantir a submersão completa da pelota. 2 mL de solução é apropriado para aproximadamente 2.400-12.000 organoides de médio porte (Figura 1D, Pós-Semeadura). Incubar a 37°C por 1-3 min.
- Adicione DMEM/F-12 avançados ao tubo para parar a reação enzimática. Use quatro vezes o volume da solução de digestão utilizada. Centrifugar a 300 x g por 5 min a 4°C.
- Aspire o supernasal e resuspende os fragmentos organoides em um meio completo de crescimento organoide suplementado com 5 μM CHIR99021 e 10 μM Y-27632 para alcançar 8 milhões de células/mL. Prepare 360 μL alíquotas da suspensão em tubos de ligação de baixa proteína estéril de 1,5 mL para evitar a redução da densidade celular devido à fixação nas paredes.
- Remova o meio do canal superior dos chips revestidos. Adicione 30 μL de suspensão celular no canal superior de cada chip. Incubar os chips durante a noite em uma incubadora de 37°C para permitir que os fragmentos organoides aderam à membrana revestida de ECM (Figura 1D).
7. Cultura dinâmica do chip intestinal - iniciação e manutenção de movimentos semelhantes a fluxo e peristalse
- Preparação e desgaseamento da mídia
- Para manter o fluxo constante de laminar através do chip, permita que a temperatura da mídia se equilibre à temperatura ambiente e, em seguida, submê-la à filtragem movida a vácuo por 10 minutos usando uma bomba de vácuo e tubos cônicos do filtro PVDF (desgassagem de mídia).
- Priming de módulos portáteis
NOTA: Módulos portáteis são reservatórios que atuam como uma interface entre os chips e o módulo de cultura permitindo a repetição da amostragem e dosagem de mídia.- Abra os módulos portáteis, no BSC, e coloque-os nas bandejas do módulo de cultura, que são recipientes especializados para o alinhamento dos módulos portáteis.
- Adicione 3 mL de meio de crescimento organoide completo pré-equilibrado complementado com 5 μM CHIR99021 e 10 μM Y-27632 ao reservatório superior da entrada e 3 mL de meio de crescimento de células endoteliais pré-equilibradas no reservatório de entrada inferior (Figura 1C). Adicione 300 μL da mesma mídia nos respectivos reservatórios de saída.
- Leve as bandejas para a incubadora de 37°C e deslize-as para o módulo de cultura (Figura 1C). Use controles na tela do módulo de cultura para executar o "Ciclo Prime" (1 min de comprimento). Quando a barra de status indicar "Pronto", o Ciclo Prime é concluído. Repita o Ciclo Prime para garantir que gotículas suficientes tenham se formado para conectar com sucesso os chips.
- Certifique-se de que todos os módulos portáteis estejam preparados e tenham gotículas de mídia visíveis.
- Introdução do fluxo
NOTA: O fluxo é tipicamente iniciado 24 horas após a semeadura de fragmentos organoides para permitir que as células epiteliais intestinais se conectem firmemente à membrana.- Lave ambos os canais dos chips semeados com 200 μL da respectiva mídia para remover quaisquer bolhas ou detritos celulares. Deixe pequenas gotículas de mídia nas portas após a lavagem. Deslize o porta-chips para o módulo portátil (Figura 1C).
- Coloque os módulos portáteis nas bandejas e, em seguida, no módulo de cultura. Use os controles na tela do módulo de cultura para programar as condições adequadas de cultura do chip de órgão (taxa de fluxo e alongamento).
NOTA: Para condições padrão de cultura de duodenum e chip de cólon, defina a taxa de fluxo para 30 μL/h15 e 60 μL/h16 , respectivamente, tanto para os canais superior quanto inferior. No entanto, as taxas de fluxo para cada canal são controladas independentemente e podem ser definidas entre 0-1.000 μL/h. Podem seringas ou bombas peristálticas, em vez de módulos de cultura apresentados aqui, para introduzir fluxo laminar em chips microfluídicos. No entanto, o estabelecimento de conexões fluidas confiáveis entre chips e bombas usando tubos e conectores pode ser tecnicamente desafiador quando a perfusão simultânea de vários chips é necessária. - Inicie o "Ciclo de Regulação" (2h de comprimento) que pressuriza a mídia de cultura em módulo portátil e chip para evitar a nucleação das bolhas de ar. As condições programadas serão retomadas após a conclusão do Ciclo de Regulação.
- Mudança de mídia
- Prepare novas mídias para ambos os canais e reabastecê-los a cada 48 h adicionando 2 mL de meio fresco aos reservatórios de entrada (Figura 1C).
- Pausa os módulos de cultura e leve as bandejas para bsc. Aspirar mídia em todos os reservatórios e reabastecer com mídia fresca. Traga as bandejas de volta e reinicie o fluxo.
- Introdução de alongamento
NOTA: Permita que as células cresçam até 100% de confluência antes da aplicação da cepa cíclica. O alongamento é tipicamente introduzido 3 dias após a semeadura ou 48 horas após o início da cultura fluidica. 2% de cepa cíclica na frequência de 0,2 ou 0,15 Hz, para o duodeno11 e o chip intestinal do cólon24 , respectivamente, é aplicada para as 24 h iniciais. Em seguida, aumenta-se ainda mais para 10% durante o restante da cultura do chip intestinal para se assemelhar à cepa cíclica experimentada pelas células epiteliais in vivo (Figura 1D)25. O módulo de cultura pode suportar a aplicação de 2%-12% de cepa cíclica e frequência de até 0,4 Hz.- Para introduzir o alongamento à cultura fluidica contínua, pausa o módulo cultural. Usando controles na tela, altere as configurações de alongamento para 2% de elasticidade, frequência de 0,2 ou 0,15 Hz e reinicie o módulo de cultura.
- Após 24h, repita a etapa 7.5.1 para aplicar um trecho de 10%, 0,2 ou 0,15 Hz de frequência.
8. Indução CYP450 usando indutores de CYP prototípicos no chip duodeno
NOTA: O ensaio de indução cytocromo P450 (CYP450) permite avaliar se o composto de ensaio aumenta os níveis de mRNA e/ou atividade catalítica de enzimas CYP450 específicas. Aqui, descrevemos o protocolo para avaliação da indução CYP3A4 pelo padrão e regulador da indústria recomendado in vitro CYP in vitro , Rifampicina (RIF) e 1,2-dihidroxy vitamina D3 (VD3). O método apresentado pode ser usado para identificar o potencial de vários compostos de teste para induzir diferentes isoformas de CYP450 no tecido intestinal humano. Conjuntos específicos de primers e substrato de sonda precisarão ser selecionados para cada isoforme enzimáceo a ser avaliado.
- Exposição a Indutores CYP
- Prepare soluções de estoque de 20 mM RIF, 100 mM VD3 e 200 mM testosterona (Tabela de Materiais) utilizando DMSO estéril.
ATENÇÃO: A testosterona é uma substância controlada pelo Programa III. Siga os procedimentos regulatórios durante o manuseio. - Prepare a dosagem de mídia com indutores CYP diluindo as soluções de estoque em meio de crescimento organoide completo médio e meio de crescimento endotelial para atingir 20 μM RIF, 100 nmol/L de VD3. Prepare o controle do veículo diluindo o DMSO nas respectivas mídias para alcançar 0,1% do DMSO.
- Pausar o módulo de cultura e levar as bandejas para BSC. Substitua a mídia em todos os reservatórios de entrada por 2 mL de mídia de dosagem por indutores ou controle de veículos. Retorne os módulos portáteis de volta ao módulo de cultura e reinicie o fluxo a 30 μL/h.
- Após 24h, substitua a mídia por solução indutora e repita as etapas 8.1.2-8.1.3. As soluções indutoras devem ser preparadas diariamente e reabastecidas a cada 24 horas ao longo do experimento, que normalmente tem 48-72 h de comprimento.
- Prepare soluções de estoque de 20 mM RIF, 100 mM VD3 e 200 mM testosterona (Tabela de Materiais) utilizando DMSO estéril.
- Incubação com um substrato prototípico (Testosterona)
- No dia da colheita, prepare a solução de substrato da sonda de testosterona juntamente com os indutores correspondentes em DMEM/F12 avançados para produzir uma concentração final de 200 μM. Omitir a adição do soro à mídia, pois isso pode interferir na análise LCMS.
- Leve as bandejas para bsc, e aspire o meio de dosagem de todos os reservatórios. Lave e substitua os reservatórios de entrada superior e inferior por meio de crescimento de células médias e endoteliais avançadas aquecidas, respectivamente.
- Retire o meio de lavagem dos reservatórios e substitua-o por 1 mL de solução de substrato da sonda, preparada na etapa 8.2.1. Perfunda os chips a uma alta vazão de 1.000 μL/h por 5 min e aspire tanto os reservatórios de saída superior quanto inferior. Devolva os chips ao módulo de cultura e incubar por 1h sob o fluxo constante de 300 μL/h.
- Análise de dados
- Coleta de amostras para análise de LCMS
- Aliquot 200 μL de solução stop contendo Acetonitrila com ácido fórmico de 0,1% em tubos pré-rotulados de 1,5 mL e colocá-los no gelo. A composição da solução de parada LCMS pode variar de acordo com o substrato que precisa ser analisado.
- Após 1h de tratamento estiver completo, pare o fluxo e leve as bandejas de volta ao BSC. Colete 100 μL de efluente do reservatório superior e adicione-o ao tubo correspondente contendo a solução stop (Figura 2A). Coloque os tubos imediatamente em gelo seco. Armazene as amostras a -80°C antes de prosseguir com a análise.
- Extrair e analisar amostras utilizando técnicas HPLC ou LC-MS/MS, monitorando a formação de metabólito-6β-hidroxitestosterona (6β-OH-T). A atividade enzimática CYP pode ser expressa como proteína pmol/min/mg onde o pmol refere-se à quantidade de metabólito (6β-OH-T) formada durante a reação. O teor total de proteína por chip (proteína; mg) é determinado pela realização de um ensaio de Bradford descrito na etapa 8.3.2.

A atividade de indução de dobra é calculada por: atividade CYP (induzida) / atividade CYP (veículo). - Se coletar amostras para análise de mRNA, consulte o passo 8.3.3.
- Lise das células para análise de expressão proteica
NOTA: A extração de proteínas de células on-chip é realizada utilizando-se um tampão de proteína, suplementado com inibidores de protease e fosfatase (Tabela de Materiais). A proteína extraída é então quantificada usando o ensaio de Bradford e usada na análise a jusante.- Retire os chips de módulos portáteis e coloque-os em uma placa de Petri. Lave os dois canais com 200 μL de DPBS estéreis.
- Bloqueie a saída inferior do canal com uma ponta de pipeta de filtro de 200 μL. Perfuse 50 μL da solução de dissociação através do canal inferior e incubar por 2 min a temperatura ambiente.
- Inspecione para confirmar o descolamento completo das células endoteliais. Pipeta para cima e para baixo 1-2 vezes e remover a solução de dissociação do canal. Repita a lavagem.
- Bloqueie a saída superior do canal com uma ponta de pipeta de filtro de 200 μL. Perfuse 75 μL de tampão de proteína lysis através do canal superior. Deixe a ponta da pipeta inserida, para bloquear a entrada do canal superior e incubar por 5 minutos em temperatura ambiente. Pipeta para cima e para baixo 5-10 vezes e coletar os licosatos celulares em um tubo pré-rotulado de 1,5 mL.
- Repita o passo 8.3.2.4. até que o descolamento completo das células seja observado. Colete as células no mesmo tubo de 1,5 mL e armazene-as a -80 °C até a análise.
- Extrair a fração de proteína de acordo com os métodos padrão e quantificar a proteína total usando o ensaio de Bradford (Tabela de Materiais).
- Lise das células para análise de expressão genética
NOTA: A lise celular on-chip para extração de RNA pode ser obtida usando um tampão de RNA lise, suplementado com 0,1% de 2 mercaptoetanol (Tabela de Materiais). Alternativamente, um tampão de RNA à base de fenol pode ser usado se forem necessários altos rendimentos de RNA de alta qualidade adequados para análise de NGS e microarrays.- Siga os passos 8.3.2.1 a 8.3.2.2 para preparar o chip intestinal para a lise.
- Bloqueie a saída do canal superior usando uma ponta de pipeta de filtro de 200 μL. Perfuse 150 μL de tampão de RNA lysis através do canal superior. Deixe a ponta da pipeta inserida para bloquear a entrada do canal superior. Incubar por 2 minutos em temperatura ambiente. Para obter uma lise à base de fenol, use 350 μL do reagente.
- Pipeta para cima e para baixo 5-10 vezes e coletar os lises celulares em um tubo pré-rotulado de 1,5 mL. Repita a etapa com mais 150 μL de tampão de RNA e colete. Armazene as células a -80 °C até a análise. No caso de análise subsequente de sequenciamento de RNA, proceda com a análise no prazo de 1 mês de pós-lising.
- Extrair RNA total dos lises celulares usando um kit de purificação de RNA.
- Transcreva inversa em cDNA usando um kit de transcriptase reversa e realize pcr em tempo real usando um ciclor PCR em tempo real e os primers e buffer apropriados. Quantifique os resultados usando o método 2-ΔΔCt .
- Coleta de amostras para análise de LCMS
9. Interrupção da barreira epitelial usando citocinas proinflamatórias no chip de cólon
NOTA: Este protocolo descreve a interrupção da barreira epitelial intestinal pelo citocina interferon gama (IFNγ)26,27,28,29. A citocina é dosada no canal inferior do chip de cólon dada a expressão basolateral do receptor IFNγ em células epiteliais intestinais. O estímulo proinflamatório é introduzido no chip no dia 5 da cultura, assim que oaplicativo P foi estabilizado abaixo de 0,5 x 10-6 cm/s. Um regime de dosagem semelhante pode ser usado para outras citocinas proinflamatórias e agentes disruptivos de barreira.
- Estimulação com IFNγ
- Prepare uma solução de 100 μg/mL de estoque de IFNγ (Tabela de Materiais) em água de cultura celular estéril. Armazene a solução de estoque a -80°C ao longo do experimento. Para cada experimento, use sempre um estoque fresco de IFNγ e evite mais de três ciclos de congelamento e degelo.
- Prepare a solução de dosagem IFNγ diluindo a solução de estoque no meio de crescimento de células endoteliais desgaseadas para alcançar uma concentração final de 10-100 ng/mL.
- Leve as bandejas para bsc e remova o meio dos reservatórios de entrada do canal inferior e substitua-o por 3 mL do ifnγ contendo meio. Atualize o meio de dosagem IFNγ diariamente.
- Coloque as bandejas no módulo de cultura e perfunda os chips a uma alta taxa de fluxo de 1.000 μL/h por 5 minutos para iniciar o tratamento IFNγ. Mude a taxa de fluxo de volta para 60 μL/h e continue a cultura fluida.
- Análise de dados
- Avaliação da função da barreira epitelial. A permeabilidade aparente epitelial (aplicativo P), ou função de barreira, pode ser medida em vários pontos de tempo da cultura pós-tratamento com IFNγ, na mídia efluente dos reservatórios de entrada e saída de ambos os canais. O rastreador fluorescente deve ser adicionado ao meio de crescimento organoide do canal superior 4h antes da avaliação doaplicativo P. Normalmente, 3 kDa Dextran Cascade Blue é usado como rastreador fluorescente e é adicionado no médio 24 h antes.
- Pausa o módulo de cultura e leve as bandejas para o BSC.
- Rotule e prepare uma placa de parede preta de 96 poços com 100 μL de DPBS por poço. Utilizando uma pipeta multicanal de 200 μL, colete e adicione 50 μL de efluente de todos os reservatórios aos respectivos poços (Figura 2B).
- Para preparar a curva padrão, diluir o meio contendo 100 μg/mL de 3 kDa dextran Cascade Azul 1:3 em DPBS. Posteriormente, realizam diluições seriais usando uma diluição tripla do meio de crescimento celular endotelial em DPBS.
- Leia a fluorescência em excitação de 375 nm e emissão de 420 nm usando um leitor de placas. Use os valores OD medidos para calcular a permeabilidade aparente (aplicativo P) da seguinte forma:
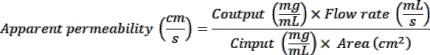
- Coloração de imunofluorescência de células no chip
- Lave usando 200 μL de DPBS para cada canal, três vezes.
- Perfuse 200 μL da solução fixativa (4% PFA em DPBS) em cada canal. Incubar por 15 minutos em temperatura ambiente.
- Repita a etapa de lavagem 9.2.2.1. Nesta fase, os chips lavados podem ser armazenados por até 7 dias a 4°C.
- Permeabilize as células utilizando 200 μL de solução de permeabilização (0,1% Triton-X 100 em 10% de soro de burro normal (NDS) em DPBS) para cada canal. Incubar por 30 minutos à temperatura ambiente. Repita a etapa de lavagem 9.2.2.1.
- Bloqueie as células no chip usando 200 μL de solução de bloqueio (10% NDS em DPBS) para cada canal. Incubar por 1h à temperatura ambiente.
- Diluir os anticorpos primários na solução de anticorpos (5% NDS em DPBS) da seguinte forma: anti-Zonula Occludens 1 (ZO-1) (1:100, marcador de junção apertada epitelial), anti-Occludin (1:100, marcador de junção apertada epitelial), anti-Claudin 4 (1:100, marcador de junção apertada epitelial), anti-E-cadherin (1:100, marcador de junções epiteliais (Tabela de Materiais). Perfuse 200 μL da solução de anticorpos primários através de cada canal e incubar durante a noite a 4 °C. Repita a etapa de lavagem 9.2.2.1.
- Diluir os anticorpos secundários na solução de anticorpos (1:300, 5% NDS em DPBS). Perfuse 200 μL desta solução através de cada canal e incubar por 2 h em temperatura ambiente. Repita a etapa de lavagem 9.2.2.1. Se desejar, a falooidina, um marcador citoesquelético, pode ser adicionada à solução de anticorpos secundários.
- Prepare uma solução de 50 μg/mL de 4′,6-diamidino-2-fenilômado (DAPI) em DPBS e use-a para perfundir 200 μL por cada canal. Incubar em temperatura ambiente por 15 minutos. Repita a etapa de lavagem. Neste ponto, os chips manchados podem ser armazenados por até 14 dias a 4°C.
- Avaliação do decote Caspase 3
- Isole e quantifique a quantidade total de proteína das células epiteliais, conforme descrito na etapa 8.3.2. Omitir a etapa de lavagem 8.3.2.1. Diluir as amostras com DPBS para uma concentração final de 400 μg/mL.
- Quantifique os níveis de caspase total e cravada 3 usando o kit de detecção caspase 3 seguindo o protocolo do fabricante.
- Avaliação da secreção de citocinas proinflamatórias
- Use os efluentes coletados da tomada de ambos os canais do chip de cólon para quantificar citocinas proinflamatórias de fase aguda secretadas, seguindo protocolos fornecidos pelo fabricante. Realize uma diluição de 5 vezes para o V-PLEX Vascular Injury Panel 2 Human Kit e uma diluição de duas vezes para o Painel Proinflamatório Humano V-PLEX II.
- Avaliação da função da barreira epitelial. A permeabilidade aparente epitelial (aplicativo P), ou função de barreira, pode ser medida em vários pontos de tempo da cultura pós-tratamento com IFNγ, na mídia efluente dos reservatórios de entrada e saída de ambos os canais. O rastreador fluorescente deve ser adicionado ao meio de crescimento organoide do canal superior 4h antes da avaliação doaplicativo P. Normalmente, 3 kDa Dextran Cascade Blue é usado como rastreador fluorescente e é adicionado no médio 24 h antes.
Access restricted. Please log in or start a trial to view this content.
Resultados
A Figura 1D resume a linha do tempo da cultura do chip intestinal e ilustra as células endoteliais intestinais e organoides antes e depois de semear o chip. Além disso, demonstra as distintas diferenças morfológicas entre o duodeno e os chips de cólon, destacados pela presença das formações semelhantes a villi no chip duodeno e representativa da pequena arquitetura intestinal.
Figura 3A,B demonstram as respost...
Access restricted. Please log in or start a trial to view this content.
Discussão
A combinação de tecnologia organ-on-a-chip e organoides intestinais promete modelagem precisa da fisiologia intestinal humana e da fisiopatologia. Aqui, fornecemos um protocolo passo a passo simples e robusto (delineado na Figura 1) para o estabelecimento do chip intestinal contendo epitélio intestinal pequeno ou colonico derivado da biópsia e células endoteliais microvasculares intestinais co-cultivadas em um dispositivo microfluido. Esta simulação baseada em chip do intestino humano...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Gauri Kulkarni, Athanasia Apostolou, Lorna Ewart, Carolina Lucchesi e Magdalena Kasendra são atuais ou ex-funcionários da Emulate Inc. e podem deter capital próprio. A Emulate Inc. é a empresa que fabrica os dispositivos de chip de órgão e publicou patentes relevantes para o trabalho declarado neste artigo.
Agradecimentos
Agradecemos ao Professor Mark Donowitz por fornecer os organoides derivados da biópsia intestinal e Brett Clair por projetar as ilustrações científicas do chip, módulo portátil e cultural. Todas as outras ilustrações científicas foram geradas usando o BioRender.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| small intestine Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE15 | 0.5 cells M/ml ; cryopreserved |
| colon Human Intestinal Microvascular Endothelial Cells | AlphaBioRegen | ALHE16 | 0.5 cells M/ml ; cryopreserved |
| Biopsy-derived Human Duodenal Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Biopsy-derived Human Colonic Organoids | John Hopkin's University | - | The organoids were provided by Professor Mark Donowitz (Institutional Review Board Number: NA_00038329). |
| Zoë CM-1™ Culture Module | Emulate Inc. | - | Culture module |
| Orb-HM1™ Hub Module | Emulate Inc. | - | 5% CO2, vacuum stretch, and power supply |
| Chip-S1™ Stretchable Chip | Emulate Inc. | - | Organ-Chip |
| Pod™ Portable Modules | Emulate Inc. | - | Portable module |
| UV Light Box | Emulate Inc. | - | - |
| Chip Cradle | Emulate Inc. | - | 1 per square culture dish |
| Steriflip®-HV Filters | EMD Millipore | SE1M003M00 | 0.45 μm PVDF filter |
| Square Cell Culture Dish (120 x 120 mm) | VWR | 82051-068 | - |
| Handheld vacuum aspirator | Corning | 4930 | - |
| Aspirating pipettes | Corning / Falcon | 357558 | 2 mL, polystyrene, individually wrapped |
| Aspirating tips | - | Sterile (autoclaved) | |
| Serological pipettes | - | 2 mL, 5 mL, 10 mL, and 25 mL low endotoxin, sterile | |
| Pipette | P20, P200, P1000 and standard multichannel | ||
| Pipette tips | P20, P200, and P1000. | ||
| Conical tubes (Protein LoBind® Tubes) | Eppendorf | 0030122216; 0030122240 | 15 mL, 50 mL tubes |
| Eppendorf Tubes® lo-bind | Eppendorf | 022431081 | 1.5 mL tubes |
| 96 wells black walled plate | - | - | for epithelial permeability analysis |
| Microscope (with camera) | - | - | For bright-field imaging |
| Water bath (or beads) | - | - | Set to 37°C |
| Vacuum set-up | - | - | Minimum pressure: -70 kPa |
| Cell scrapers | Biotium | 220033 | |
| T75 flasks | BD Falcon | 353136 | Cell culture flask |
| Emulate Reagent-1 (ER-1) | Emulate Inc. | - | Chip coating solution |
| Emulate Reagent-2 (ER-2) | Emulate Inc. | - | Chip coating solution |
| Dulbecco’s PBS (DPBS) | Corning | 21-031-CV | 1X |
| Cell Culture Grade Water | Corning | MT25055CV | |
| Trypan blue | Sigma | 93595 | For cell counting |
| TryplE Express | ThermoFisher Scientific | 12604013 | Organoids dissociation and endothelium cells detachment solution |
| Advanced DMEM/F12 | ThermoFisher Scientific | 12634028 | Medium |
| IntestiCult™ Organoid Growth Medium (Human) | Stem Cell technologies | 06010 | Organoid Growth Medium |
| Endothelial Cell Growth Medium MV 2 | Promocell | C-22121 | Endothelial medium |
| Fetal bovine serum (FBS) | Sigma | F4135 | Serum |
| Primocin™ | InvivoGen | ANT-PM-1 | antimicrobial agent |
| Attachment Factor™ | Cell Systems | 4Z0-210 | coating solution for flask |
| Matrigel - Growth Factor Reduced | Corning | 356231 | Solubilized basement membrane matrix |
| Collagen IV | Sigma | C5533 | ECM component |
| Fibronectin | Corning | 356008 | ECM component |
| Y-27632 | Stem Cell technologies | 72304 | organoid media supplement |
| CHIR99021 | Reprocell | 04-0004-10 | organoid media supplement |
| Cell Recovery Solution | Corning | 354253 | Basement mebrane matrix dissociationsolution |
| Bovine Serum Albumin (BSA) | Sigma | A9576 | 30%, Sterile |
| Cell Culture Grade Water | Corning | MT25055CV | Sterile, Water |
| DMSO | Sigma | D2650 | solvent |
| 3KDa Dextran Cascade Blue | Invitrogen | D7132 | 10 mg powder |
| Rifampicin (RIF) | Sigma | Cat# R3501 | CYP inducer |
| Testosterone hydrate | Sigma | T1500 | CYP substrate |
| 1,25-dihyroxy Vitamin D3 (VD3) | Sigma | Cat# D1530 | CYP inducer |
| Acetonitrile with 0.1% (v/v) Formic acid | Sigma | 159002 | LCMS stop solution |
| IFNγ | Peprotech | 300-02 | |
| 4% Paraformaldehyde (PFA) | EMS | 157-4 | Fixative |
| Triton-X 100 | Sigma | T8787 | |
| Normal Donkey Serum (NDS) | Sigma | 566460 | |
| anti-Occludin | ThermoFisher Scientific | 33-1500 | tight junctions marker |
| anti-Claudin 4 | ThermoFisher Scientific | 36-4800 | tight junctions marker |
| anti-E-cadherin | Abcam | ab1416 | epithelial adherens junctions marker |
| anti-VE-cadherin | Abcam | ab33168 | endothelial adherent junctions marker |
| anti- Zonula Occludens 1 (ZO-1) | Thermo Fischer | 339194 | tight junctions marker |
| DAPI | ThermoFisher Scientific | 62248 | nuclear stain |
| 2-mercaptoethanol | Sigma | M6250 | |
| PureLink RNA Mini Kit | Invitrogen | 12183020 | RNA lysis, isolation and purification kit |
| SuperScript™ IV VILO™ Master Mix | Invitrogen | 11756050 | reverse transcriptase kit |
| TaqMan™ Fast Advanced Master Mix | Applied Biosystems | 4444557 | qPCR reagent |
| QuantStudio™ 5 Real-Time PCR System | Applied Biosystems | A28573 | Real-time PCR cycler |
| 18S primer | ThermoFisher Scientific | Hs99999901_s1 | Eukaryotic 18S rRNA |
| CYP3A4 primer | ThermoFisher Scientific | Hs00604506_m1 | Cytochrome family 3 subfamily A member 4 |
| Pierce™ Coomassie Plus (Bradford) Assay Kit | ThermoFisher Scientific | 23236 | Protein quantification kit |
| MSD Tris lysis buffer | Meso Scale Diagnostics | R60TX-3 | Protein lysis buffer |
| Cleaved/Total Caspase-3 Whole Cell Lysate Kit | Meso Scale Diagnostics | K15140D | Caspase 3 detection kit |
| V-PLEX Vascular Injury Panel 2 Human Kit | Meso Scale Diagnostics | K15198D | |
| V-PLEX Human Proinflammatory Panel II (4-Plex) | Meso Scale Diagnostics | K15053D | |
| Zeiss LSM 880 | Zeiss | - | Confocal microscope |
| Zeiss LD plan-Neofluar 20x/0.40 Korr M27 | Zeiss | - | 20X long-distance objective lenses |
| Zeiss AXIOvert.A1 | Zeiss | - | Brightfield microscope |
| Zeiss LD A-Plan 10X/0.25 Ph1 | Zeiss | - | 10X objective lenses |
Referências
- Fritz, A., et al. Expression of clinically relevant drug-metabolizing enzymes along the human intestine and their correlation to drug transporters and nuclear receptors: An intra-subject analysis. Basic and Clinical Pharmacology and Toxicology. 124 (3), 245-255 (2019).
- Okumura, R., Takeda, K. Maintenance of intestinal homeostasis by mucosal barriers. Inflammation and Regeneration. 38 (1), 1-8 (2018).
- Delgado, M. E., Grabinger, T., Brunner, T. Cell death at the intestinal epithelial front line. FEBS Journal. 283 (14), 2701-2719 (2016).
- Mestas, J., Hughes, C. C. W. Of mice and not men: Differences between mouse and human immunology. The Journal of Immunology. 172 (5), 2731-2738 (2004).
- Sun, H., Chow, E. C. Y., Liu, S., Du, Y., Pang, K. S. The Caco-2 cell monolayer: Usefulness and limitations. Expert Opinion on Drug Metabolism and Toxicology. 4 (4), 395-411 (2008).
- Yu, H., et al. The contributions of human mini-intestines to the study of intestinal physiology and pathophysiology. Annual Review of Physiology. 79, 291-312 (2017).
- Sato, T., et al. Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche. Nature. 459 (7244), 262-265 (2009).
- Sato, T., et al. Long-term expansion of epithelial organoids from human colon, adenoma, adenocarcinoma, and Barrett’s epithelium. Gastroenterology. 141 (5), 1762-1772 (2011).
- Spence, J. R., et al. Directed differentiation of human pluripotent stem cells into intestinal tissue in vitro. Nature. 470 (7332), 105-110 (2011).
- Durel, J. F., Nerurkar, N. L. Mechanobiology of vertebrate gut morphogenesis. Current Opinion in Genetics and Development. 63, 45-52 (2020).
- Gayer, C. P., Basson, M. D. The effects of mechanical forces on intestinal physiology and pathology. Cellular Signalling. 21 (8), 1237-1244 (2009).
- Xu, Y., et al. Mechanical stimulation activates Piezo1 to promote mucin2 expression in goblet cells. Journal of Gastroenterology and Hepatology (Australia). 36 (11), 3127-3139 (2021).
- Navabi, N., McGuckin, M. A., Lindén, S. K. Gastrointestinal cell lines form polarized epithelia with an adherent mucus layer when cultured in semi-wet interfaces with mechanical stimulation. PLoS One. 8 (7), 68761(2013).
- Kasendra, M., et al. Development of a primary human Small Intestine-on-a-Chip using biopsy-derived organoids. Scientific Reports. 8 (1), 1-14 (2018).
- Kasendra, M., et al. Duodenum intestine-chip for preclinical drug assessment in a human relevant model. eLife. 9, 50135(2020).
- Apostolou, A., et al. A novel microphysiological colon platform to decipher mechanisms driving human intestinal permeability. Cellular and Molecular Gastroenterology and Hepatology. 12 (5), 1719-1741 (2021).
- Jalili-Firoozinezhad, S., et al. Author correction: A complex human gut microbiome cultured in an anaerobic intestine-on-a-chip. Nature Biomedical Engineering. 3 (7), 583(2019).
- Yin, J., et al. Fluid shear stress enhances differentiation of jejunal human enteroids in Intestine-Chip. American Journal of Physiology-Gastrointestinal and Liver Physiology. 320 (3), 258-271 (2021).
- Sontheimer-Phelps, A., et al. Human colon-on-a-chip enables continuous in vitro analysis of colon mucus layer accumulation and physiology. Cellular and Molecular Gastroenterology and Hepatology. 9 (3), 507-526 (2020).
- Tovaglieri, A., et al. Species-specific enhancement of enterohemorrhagic E. coli pathogenesis mediated by microbiome metabolites. Microbiome. 7 (1), 43(2019).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135-2157 (2013).
- Fujii, M., Matano, M., Nanki, K., Sato, T. Efficient genetic engineering of human intestinal organoids using electroporation. Nature Protocols. 10 (10), 1474-1485 (2015).
- Kim, H. J., Huh, D., Hamilton, G., Ingber, D. E. Human gut-on-a-chip inhabited by microbial flora that experiences intestinal peristalsis-like motions and flow. Lab on a Chip. 12 (12), 2165-2174 (2012).
- Sarna, S. K. Colonic motility: From bench side to bedside. Morgan & Claypool Life Sciences. , San Rafael (CA). (2010).
- Basson, M. D. Paradigms for mechanical signal transduction in the intestinal epithelium - category: Molecular, cell, and developmental biology. Digestion. 68 (4), 217-225 (2003).
- Wang, F., et al. Interferon-gamma and tumor necrosis factor-alpha synergize to induce intestinal epithelial barrier dysfunction by up-regulating myosin light chain kinase expression. The American Journal of Pathology. 166 (2), 409-419 (2005).
- Nava, P., et al. Interferon-γ regulates intestinal epithelial homeostasis through converging β-Catenin signaling pathways. Immunity. 32 (3), 392-402 (2010).
- Madara, J. L., Stafford, J. Interferon-γ directly affects barrier function of cultured intestinal epithelial monolayers. Journal of Clinical Investigation. 83 (2), 724-727 (1989).
- Bruewer, M., et al. Proinflammatory cytokines disrupt epithelial barrier function by apoptosis-independent mechanisms. The Journal of Immunology. 171 (11), 6164-6172 (2003).
- Jones, S. C., et al. Adhesion molecules in inflammatory bowel disease. Gut. 36 (5), 724-730 (1995).
- Uhlar, C. M., Whitehead, A. S. Serum amyloid A, the major vertebrate acute-phase reactant. European Journal of Biochemistry. 265 (2), 501-523 (1999).
- Pérez-González, C., Ceada, G., Matejčić, M., Trepat, X. Digesting the mechanobiology of the intestinal epithelium. Current Opinion in Genetics & Development. 72, 82-90 (2022).
- In, J., et al. Enterohemorrhagic escherichia coli reduces mucus and intermicrovillar bridges in human stem cell-derived colonoids. Cellular and Molecular Gastroenterology and Hepatology. 2 (1), 48-62 (2016).
- Grassart, A., et al. Bioengineered human organ-on-chip reveals intestinal microenvironment and mechanical forces impacting shigella infection. Cell Host and Microbe. 26 (3), 435-444 (2019).
- Kerns, S. J., et al. Human immunocompetent organ-on-chip platforms allow safety profiling of tumor-targeted t-cell bispecific antibodies. eLife. 10, 67106(2021).
- Bhatia, S. N., Ingber, D. E. Microfluidic organs-on-chips. Nature Biotechnology. 32 (8), 760-772 (2014).
- Ingber, D. E. Reverse engineering human pathophysiology with organs-on-chips. Cell. 164 (6), 1105-1109 (2016).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados