A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
בידוד וכימות של נגיף אפשטיין-בר מקו תאי P3HR1
In This Article
Summary
פרוטוקול זה מאפשר בידוד של חלקיקי נגיף אפשטיין-בר מקו תאי P3HR1 אנושיים עם גרימת מחזור ליטי נגיפי עם פורבול 12-מיריסטאט 13-אצטט. דנ"א מופק לאחר מכן מהתכשיר הנגיפי ונתון ל-PCR בזמן אמת כדי לכמת את ריכוז החלקיקים הנגיפיים.
Abstract
נגיף אפשטיין-בר (באנגלית: Epstein-Barr virus או EBV), המוגדר רשמית כנגיף ההרפס האנושי 4 (HHV-4), הוא נגיף הגידול האנושי המבודד הראשון. כמעט 90-95% מהאוכלוסייה הבוגרת בעולם נגועה ב-EBV. עם ההתקדמות האחרונה בביולוגיה מולקולרית ואימונולוגיה, היישום של מודלים ניסיוניים במבחנה וב- in vivo סיפק תובנה עמוקה ומשמעותית על הפתוגנזה של EBV במחלות רבות, כמו גם על גידולים הקשורים ל- EBV. מטרת מאמר ניסוי חזותי זה היא לספק סקירה כללית של בידוד חלקיקים נגיפיים EBV מתאים של קו התאים P3HR1, ולאחר מכן כימות של ההכנה הנגיפית. תאי P3HR1, שבודדו במקור מלימפומה של בורקיט אנושי, יכולים לייצר נגיף P3HR1, שהוא זן EBV מסוג 2. ניתן לשרות את המחזור הליטי של EBV בתאי P3HR1 אלה על ידי טיפול בפורבול 12-מיריסטאט 13-אצטט (PMA), המניב חלקיקים נגיפיים EBV.
באמצעות פרוטוקול זה לבידוד חלקיקי EBV, תאי P3HR1 עוברים תרבית במשך 5 ימים בטמפרטורה של 37 מעלות צלזיוס ו-5% CO2 בתווך RPMI-1640 שלם המכיל 35 ננוגרם/מ"ל PMA. לאחר מכן, מדיום התרבית הוא צנטריפוגה במהירות של 120 x g במשך 8 דקות כדי לזרוק את התאים. לאחר מכן, הסופר-נאטנט המכיל את הנגיף נאסף ומסתובב מטה במהירות של 16,000 x g למשך 90 דקות כדי לזרוק את חלקיקי ה-EBV. לאחר מכן הכדור הנגיפי עובר החייאה במדיום RPMI-1640 שלם. לאחר מכן מתבצע מיצוי דנ"א ו-PCR כמותי בזמן אמת כדי להעריך את ריכוז חלקיקי ה-EBV בתכשיר.
Introduction
נגיף אפשטיין-בר (EBV) הוא נגיף הגידול האנושי הראשון שבודד1. EBV, המכונה באופן רשמי וירוס ההרפס האנושי 4 (HHV-4)2, הוא חלק מתת-משפחת נגיפי ההרפס גמא של משפחת נגיפי ההרפס והוא אב הטיפוס של הסוג לימפוקריפטווירוס לימפוקריפטווירוס. כמעט 90-95% מהאוכלוסייה הבוגרת בעולם נגועה בנגיף3. ברוב המקרים, זיהום ראשוני מתרחש בתוך 3 השנים הראשונות של החיים והוא אסימפטומטי, עם זאת, אם זיהום מתרחשת מאוחר יותר במהלך גיל ההתבגרות, זה עלול לעורר מחלה המכונה mononucleosis זיהומיות4. EBV מסוגל להדביק תאי B במנוחה ולגרום להם להפוך ללימפובלסטים מסוג B מתרבים שבהם הנגיף מבסס ומתחזק מצב נגוע סמוי5. EBV יכול לפעול מחדש בכל עת ובכך להוביל לזיהומים חוזרים6.
במהלך 50 השנים האחרונות, הקשר בין וירוסים מסוימים לבין התפתחות של ממאירויות אנושיות הפך ברור יותר ויותר, וכיום ההערכה היא כי 15% עד 20% מכלל סוגי הסרטן האנושיים קשורים לזיהומים ויראליים7. נגיפי ההרפס, כולל EBV, הם חלק מהדוגמאות הנחקרות ביותר לסוגים אלה של וירוסים סרטניים8. למעשה, EBV יכול לגרום לסוגים רבים של ממאירויות אנושיות, כגון לימפומה Burkitt (BL), לימפומה הודג'קין (HL), לימפומה מפוזרת של תאי B גדולים, ומחלות לימפופרוליפרטיביות אצל מארחים מדוכאי חיסון 9,10. EBV הוכח גם כקשור להתפתחות מחלות אוטואימוניות מערכתיות. כמה דוגמאות להפרעות אוטואימוניות אלה הן דלקת מפרקים שגרונית (RA), פולימיוסיטיס-דרמטומיוסיטיס (PM-DM), זאבת אדמנתית מערכתית (SLE), מחלת רקמת חיבור מעורבת (MCTD) ותסמונת סיוגרן (SS)11. EBV קשור גם להתפתחות מחלות מעי דלקתיות (IBD)12.
רבות מהמחלות האלה ניתנות למחקר או למודל באמצעות תרבית תאים, עכברים או אורגניזמים אחרים הנגועים ב-EBV. לכן יש צורך בחלקיקי EBV כדי להדביק תאים או אורגניזמים, בין אם במבחנה או במודלים in vivo 13,14,15,16, ומכאן הצורך לפתח טכניקה המאפשרת בידוד של חלקיקים נגיפיים בעלות נמוכה. הפרוטוקול המתואר כאן מספק קווים מנחים לדרך קלה לבודד באופן אמין חלקיקי EBV מקו תאים נגיש יחסית ולכמת את החלקיקים באמצעות PCR בזמן אמת, שהוא חסכוני וזמין לרוב המעבדות. זאת בהשוואה למספר שיטות אחרות שתוארו לבודד EBV מקווי תאים שונים17,18,19,20.
P3HR-1 הוא קו תאי BL שגדל בתרחיף ונגוע באופן סמוי בזן EBV מסוג 2. קו תאים זה הוא יצרן EBV וניתן לגרום לו לייצר חלקיקים נגיפיים. מטרתו של כתב יד זה היא להציג שיטה המאפשרת בידוד של חלקיקי EBV מקו התאים P3HR-1, ולאחר מכן כימות של המלאי הנגיפי שיכול לשמש מאוחר יותר הן למודלים ניסיוניים במבחנה והן ב- in vivo EBV.
Protocol
הערה: EBV צריך להיחשב כחומר בעל פוטנציאל ביולוגי, ולכן יש לטפל בו תחת בלימת Biosafety רמה 2 ומעלה. יש ללבוש מעיל מעבדה כמו גם כפפות. אם קיים פוטנציאל לחשיפה להתזות, יש לשקול גם הגנה על העיניים. ההליך הבא צריך להתבצע בקבינט בטיחות ביולוגית.
1. ספירת תאי P3HR1
- צנטריפוגה והחייאה של תאים
- העבר את מתלה התא מצלחת תרבית בקוטר 100 מ"מ (או בקבוקון T-25) של תרבית תאים מתמשכת מסוג P3HR1 בטמפרטורה של 80% לצינור חרוטי של 15 מ"ל. צפיפות הזריעה של תאי P3HR-1 היא 1 x 106 תאים למ"ל. יש לשמור על מדיום תרבית RPMI שלם (79% מדיום תרבית RPMI, סרום בקר עוברי 20%, אנטיביוטיקה Pen-Strep 1%) בטמפרטורה של 37°C ו-5% CO2, ולעבור כל 3-4 ימים.
- צנטריפוגה למשך 8 דקות ב 120 x גרם. לאחר צנטריפוגה, להשליך את supernatant, להשעות את כדור התא ב 1 מ"ל של מדיום תרבית RPMI מלאה, ומערבבים היטב (פתרון זה ייקרא השעיה A).
- הכנת תרחיף התאים לספירה
- הכן תרחיף תא מדולל B על ידי ערבוב 2 μL של תרחיף תא A עם 8 μL של מדיום תרבית. יש להוסיף 10 μL של 0.4% טריפן כחול לתרחיף B כדי לקבל את התרחיף C. מערבבים היטב את התכשיר על ידי פיפטציה עדינה.
- ספירת תאים באמצעות המוציטומטר
- הניחו כיסוי זכוכית על ההמוציטומטר והעמיסו 10 μL של תרחיף C. הניחו את ההמוציטומטר מתחת למיקרוסקופ אור וספרו את מספר התאים שאינם מוכתמים בכחול בכל אחד מארבעת הרבעים של תא ההמוציטומטר באמצעות מטרת המיקרוסקופ 40x (איור 1).
- טריפאן כחול מכתים תאים מתים בכחול; אל תספור תאים אלה, וגם לא תאים שנוגעים באף אחד מהגבולות העליונים, התחתונים, הימניים או השמאליים של כל רביע המוציטומטר.
- חשב את ריכוז התאים למ"ל באמצעות הנוסחה הבאה:
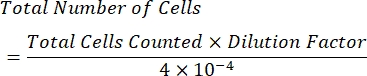
הערה: מספר הרבעים שנספרו הוא ארבעה, ו-10-4 מ"ל הוא נפח הריבועים בהמוציטומטר. ארבעת הרבעים שיש לספור מיוצגים בירוק באיור 1. סך כל התאים הנספרים בנוסחה הוא סכום מספר התאים ברבעים 1, 2, 3 ו- 4. יש לספור תאים המיוצגים בכחול באיור 1 , בעוד שאין לספור תאים באדום מאחר שהם נוגעים בגבולות העליונים, הימניים, התחתונים או השמאליים של הרבע.
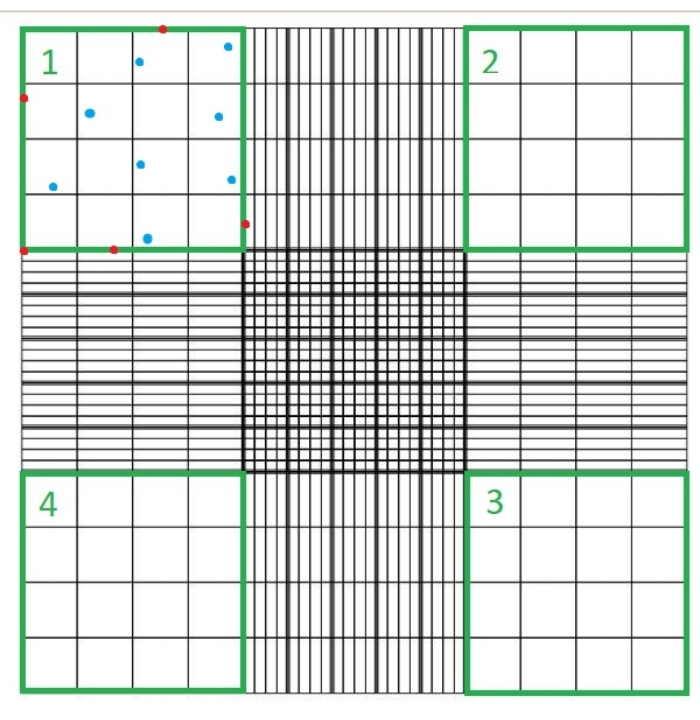
איור 1: ספירת תאים באמצעות תא המוציטומטר. ארבעה רבעים נספרים באמצעות מיקרוסקופ אור; רבעים אלה מיוצגים בירוק. סך כל התאים שנספרו בנוסחה המצוינת בשלב 1.3.3 של הפרוטוקול המתואר כאן הוא סכום מספר התאים ברבעים 1, 2, 3 ו-4. יש לספור תאים המסומנים בכחול, בעוד שאין לספור תאים באדום מכיוון שהם נוגעים בגבולות העליונים, הימניים, התחתונים או השמאליים של הרביע אנא לחץ כאן כדי להציג גרסה גדולה יותר של נתון זה.
2. הכנת הצלחת לתרבות
- מניחים נפח של תרחיף תא A בצינור חרוטי של 15 מ"ל. אמצעי האחסון הנדרש תלוי בספירת התאים. התאם את עוצמת הקול כך שמספר התאים יהיה בערך 2.2 x 106 תאים עבור צלחת תרבית של 100 מ"מ.
- הוסף 5 מ"ל של מדיום תרבות שלם לצינור ולאחר מכן להעביר את התוכן של הצינור לצלחת תרבית 100 מ"מ. הוסף 80 μL של דימתיל סולפוקסיד (DMSO) לצלחת התרבית.
הערה: DMSO רגיש לאור, ולכן יש לאחסן אותו במיכל עמיד לאור או לכסות אותו בחומר אטום כמו רדיד אלומיניום. - יש להוסיף 350 μL של 1 מ"ג/מ"ל פורבול 12-מיריסטאט 13-אצטט (PMA) לצינור. הריכוז הסופי של PMA צריך להיות 35 ng/mL, וזה של DMSO צריך להיות 0.08%.
אזהרה: PMA הוא רעיל, קורוזיבי ומסרטן, ולכן יש לטפל בו בזהירות רבה. PMA הוא רגיש לאור, ולכן יש לאחסן אותו במיכל עמיד לאור או לכסות אותו בחומר אטום כמו רדיד אלומיניום. - הוסף 4.27 מ"ל של מדיום תרבות, כך נפח הכולל הוא 10 מ"ל. מערבבים את תוכן הצינור על ידי הטיה, ולאחר מכן מעבירים את התוכן לצלחת תרבית של 100 מ"מ. השאירו את הצלחת באינקובטור של תרבית תאים למשך 5 ימים בטמפרטורה של 37 מעלות צלזיוס, 5% CO2.
3. אינדוקציה ובידוד של חלקיקי נגיף אפשטיין-בר
- לאחר 5 ימים באינקובטור, צנטריפוגה את התוכן של הצלחת ב 120 x גרם במשך 8 דקות כדי לזרוק את התאים. לאסוף את supernatant ללא תאים, המכיל וירוס, ולהשליך את כדור התא.
- צנטריפוגה של סופרנאטנט ב 16,000 x גרם במשך 90 דקות ב 4 מעלות צלזיוס כדי לזרוק את חלקיקי הנגיף. יש להשליך את ה-supernatant ולהשהות את גלולת הנגיף ב-5 מ"ל של מדיום תרבית.
הערה: ניתן להשתמש בתמיסת מלח עם אגירת פוספט (PBS) כדי להשהות את גלולת הנגיף במקום במדיום תרבית. - Aliquot את ההשעיה הנגיפית המתקבלת לתוך 20 צינורות, כל אחד מכיל 250 μL של ההשעיה הנגיפית. יש לאחסן את המתלים בטמפרטורה של -80°C.
4. מיצוי דנ"א מחלקיקים נגיפיים
אזהרה: יש לנקוט משנה זהירות בעת טיפול בפנול, שכן הוא רעיל וקורוזיבי ובעל יכולת לגרום לכוויות קשות. פנול רגיש לאור ומתחמצן במגע עם אור או אוויר. אחסנו אותו במיכל עמיד לאור או לחילופין כסו את צינור הפנול בחומר אטום כמו רדיד אלומיניום.
- הפרדת חלבונים מדנ"א
- הוסף 500 μL של פנול רווי TrisCl לאחד מצינורות 250 μL. מוסיפים 100 μL של מים (כדי להגדיל את נפח הפאזה המיימית) ומערבבים היטב כדי לקבל תחליב ורוד. צנטריפוגה למשך 15 דקות ב 9650 x גרם.
- משקעי דנ"א
- לאסוף את supernatant (שקוף, פאזה מימית) ולהעביר אותו לצינור microcentrifuge חדש 1.5 מ"ל.
- הוסיפו כמות שוות ערך ל-1/10 מנפח הנתרן אצטט הקר של הסופר-נטנט (3 M, pH 5.2) וערבבו על ידי פיפטינג למעלה ולמטה. הוסיפו 1 מיקרון של 20 מ"ג/מ"ל גליקוגן וערבבו בפיפטציה.
הערה: שלב זה הוא אופציונלי, אך תוספת הגליקוגן משפרת את משקעי הדנ"א ומקלה על הדמיית גלולת הדנ"א. - הוסיפו פי שלושה מנפח ה-supernatant של 100% אתנול קר. יש לאחסן בטמפרטורה של -80°C למשך הלילה.
הערה: ניתן לעצור את ההליך כאן כדי לחדש אותו במועד מאוחר יותר. ניתן לאחסן את הדגימה בטמפרטורה של -80 מעלות צלזיוס למשך שעה, או לחילופין למשך הלילה. אחסון לילה משפר את משקעי הדנ"א ולכן מומלץ.
- בידוד הדנ"א הנגיפי
- למחרת, צנטריפוגה ב 9650 x גרם במשך 15 דקות ב 4 מעלות צלזיוס ולהשליך את supernatant כדי לקבל גלולת DNA.
- לשטוף את הכדור שלוש פעמים עם 1 מ"ל של קור 70% אתנול, צנטריפוגה ב 9650 x גרם במשך 15 דקות, ולהשליך את supernatant.
- יש לייבש את הכדור באוויר במשך כ-10 דקות. יש להשעות את הכדור ב-10-50 מיקרון של מים מזוקקים נטולי נוקלאז (תלוי בגודל גלולת הדנ"א).
- אחסן את הדגימות בטמפרטורה של -20 °C לעיבוד מאוחר יותר או ב- 4 °C למשך הלילה כדי להבטיח פירוק DNA מרבי ואחריו אחסון ב- -20 °C. לחלופין, המשך ישירות לשלב 5.
5. בדיקת ריכוז וטוהר הדנ"א
- לאחר ניקוי הכן של מיקרוספקטרופוטומטר עם מגב משימה עדין, טען 1 μL של הכנת ה- DNA.
- שימו לב לריכוז הדנ"א בדגימה. בדוק את יחסי הספיגה ב- וגם
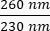 ב-
ב- 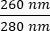 . דנ"א ייספג ב-260 ננומטר, חלבונים ב-280 ננומטר, וחומרים אורגניים כמו פנול ייספגו ב-230 ננומטר. יחס של 1.8-2 נחשב מספיק עבור PCR בזמן אמת.
. דנ"א ייספג ב-260 ננומטר, חלבונים ב-280 ננומטר, וחומרים אורגניים כמו פנול ייספגו ב-230 ננומטר. יחס של 1.8-2 נחשב מספיק עבור PCR בזמן אמת.
6. כימות על ידי תגובת שרשרת פולימראז בזמן אמת
- הכנת תערובות תגובת PCR
- יש להניח 5 μL של תערובת PCR ירוקה בזמן אמת של SYBR בצינורות PCR של 0.2 מ"ל. הוסף לכל צינור 1 μL של 7.5 pmol/μL פריימר קדמי ו-1 μL של 7.5 pmol/μL פריימר הפוך. רצף פריימר קדימה: 5'-CCCTAGTGGTTTCGGACACA-3'; רצף פריימר הפוך: 5'-ACTTGCAAATGCTCTAGGGGG-3'. הגן המוגבר כדי לקבוע את מספר עותק הגנום של EBV הוא הגן RNA 2 קטן (EBER-2) של נגיף אפשטיין-בר .
- לאחד הצינורות, הוסיפו 2 μL של מים נטולי נוקלאז ו-1 μL של דנ"א נגיפי משלב 4. הנפח הכולל של תערובת התגובה הוא 10 μL.
הערה: בהתאם לריכוז הדנ"א בדגימה, ייתכן שיהיה צורך בשלב דילול. יש לציין את גורם הדילול F והוא ישולב בנוסחה בשלב 6.3. - הכן צינורות אחרים שישמשו כתקנים עם מספרי העתקי גנום ידועים של EBV (1000, 2000, 5000, 10,000 ו- 54,000 עותקים).
- הפעל את תערובות ה-PCR החל משלב הפעלה ראשוני ב-95°C למשך 5 דקות, ולאחר מכן 40 מחזורים ב-95°C ו-58°C (חישול) למשך 15 שניות ו-30 שניות, בהתאמה.
- צור עקומת תקן qPCR על ידי התוויית ערכי ה- Ct של התקנים כנגד היומן של מספר עותקי הגנום של EBV לכל צינור סטנדרטי. באמצעות משוואת העלילה העקומה הסטנדרטית, לגזור את מספר עותקי הגנום של EBV בצינור ה-PCR המכיל את הדנ"א הנגיפי המושרה. לאחר מכן, השתמש בנוסחה הבאה כדי לחשב את הריכוז של הכנה ויראלית המושרה:

כאשר X הוא מספר עותקי הגנום של EBV הנגזרים מהעקומה הסטנדרטית ו-F הוא גורם הדילול המשמש להגדרת הדנ"א המשמש לתגובת PCR.
7. בדיקת פעילות ביולוגית/הדבקה של החלקיקים הנגיפיים
- העבר תאי BC-3 מצלחת תרבית של 100 מ"מ בטמפרטורה של 80% לצינור חרוטי של 15 מ"ל. צפיפות הזריעה של תאי P3HR-1 היא 1 x 106 תאים למ"ל. יש לשמור על מדיום תרבית RPMI שלם (79% מדיום תרבית RPMI, סרום בקר עוברי 20%, אנטיביוטיקה Pen-Strep 1%) בטמפרטורה של 37°C ו-5% CO2, ולעבור כל 3-4 ימים.
- ספירת תאי BC-3 באותו אופן שבו נספרו תאי P3HR-1 בשלב 1. לצלחת של 96 בארות, יש להוסיף 10 תאיםשל 5 BC-3 לכל באר. השתמש בשלוש, שש, תשע או 12 בארות כדי להבטיח את משמעות התוצאות ולמזער שגיאות.
- הוסף נפח של מלאי ויראלי לכל באר, בהתאם לריכוז התכשיר הנגיפי שנקבע בשלב 6.3. משרד הפנים יכול להשתנות, ואופטימיזציה של פרוטוקול זה תחשוף את MOI הטוב ביותר לזיהום (מומלץ טווח MOI של 2-50). ודא שהנפח הכולל של התערובת הקיימת בכל באר הוא 250 μL.
- כדי לקבוע את הנפח הנדרש, יש לדעת את ריכוז המניה הנגיפית, ולבחור MOI. לדוגמה, אם MOI הוא 2, אז מספר החלקיקים הנגיפיים שנוספו צריך להיות כפול ממספר התאים. חשב את נפח V של המניה הנגיפית הנדרשת באמצעות הנוסחה:
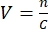 , כאשר n הוא מספר החלקיקים הנגיפיים הדרושים, ו- C הריכוז הידוע של המניה הנגיפית
, כאשר n הוא מספר החלקיקים הנגיפיים הדרושים, ו- C הריכוז הידוע של המניה הנגיפית
- כדי לקבוע את הנפח הנדרש, יש לדעת את ריכוז המניה הנגיפית, ולבחור MOI. לדוגמה, אם MOI הוא 2, אז מספר החלקיקים הנגיפיים שנוספו צריך להיות כפול ממספר התאים. חשב את נפח V של המניה הנגיפית הנדרשת באמצעות הנוסחה:
- לדגור את התוכן של צלחת 96 באר במשך 5 ימים. לאחר 5 ימים, להעביר את התוכן של כל באר לצינור 1.5 מ"ל.
- צנטריפוגה של הצינורות ב 120 x g במשך 8 דקות כדי להפריד את התאים מן המדיום תרבית המכיל וירוס. הכפיפו את כדורי התא, כמו גם את הסופרנאטים, למיצוי דנ"א ולאחר מכן לכימות PCR בזמן אמת כדי לבדוק את נוכחותם של גנומים נגיפיים בכל שבר, ובכך להעריך את ההדבקה של החלקיקים הנגיפיים.
תוצאות
מטרת הליך זה היא לבודד חלקיקי EBV בתרחיף עם טיטר ויראלי ידוע, שיכול לשמש לאחר מכן למודל זיהום EBV. לכן, יש חשיבות עליונה להשתמש בריכוזים אופטימליים של הריאגנטים השונים כדי להשיג את תפוקת ה- EBV הגבוהה ביותר מתוך ההליך.
ניסוי אופטימיזציה נערך כדי לקבוע את הריכוזים של PMA ו-DMSO שיניבו ...
Discussion
ייצור חלקיקי EBV נחוץ להבנת הביולוגיה של נגיף זה, כמו גם המחלות הקשורות אליו. כאן תיארנו את הייצור של חלקיקים אלה מקו התאים P3HR-1. קו תאים זה אינו הקו היחיד של יצרני EBV; למעשה, חלקיקי EBV בודדו גם מתאי B95-821,22 וכן מקו תאי ראג'י18,19. מחזור ...
Disclosures
המחברים מצהירים על היעדר ניגוד עניינים.
Acknowledgements
המימון לעבודה זו נתמך על ידי מענקים למיון מקרן המחקר אסמר, המועצה הלאומית הלבנונית למחקר מדעי (L-CNRS) ותוכנית הפרקטיקה הרפואית (MPP) באוניברסיטה האמריקאית בביירות.
Materials
| Name | Company | Catalog Number | Comments |
| 0.2 mL thin-walled PCR tubes | Thermo Scientific | AB0620 | Should be autoclaved before use |
| 0.2-10 µL Microvolume Filter Tips | Corning | 4807 | Should be autoclaved before use |
| 0.5-10 µL Pipette | BrandTech | 704770 | |
| 10 mL Disposable Serological Pipette | Corning | 4488 | |
| 1000 µL Filtered Pipette Tips | QSP | TF-112-1000-Q | |
| 100-1000 µL Pipette | Eppendorf | 3123000063 | |
| 100x20 mm Cuture Plates | Sarstedt | 83.1802 | |
| 10-100 µL Pipette | BrandTech | 704774 | |
| 15 mL Conical Tubes | Corning | 430791 | |
| 200 µL Filtered Pipette Tips | QSP | TF-108-200-Q | |
| 20-200 µL Pipette | Eppendorf | 3123000055 | |
| 50 mL Conical Tubes | Corning | 430828 | |
| CFX96 Real-Time C-1000 Thermal Cycler | Bio-Rad | 184-1000 | |
| DMSO | Amresco | 0231 | |
| DNase/RNase Free Water | Zymo Research | W1001-1 | |
| EBER Primers | Macrogen | N/A | Custom Made Primers |
| EBV DNA Control (Standards) | Vircell | MBC065 | |
| Ethanol (Laboratory Reagent Grade) | Fischer Chemical | E/0600DF/17 | |
| Fetal Bovine Serum | Sigma | F9665 | |
| Fresco 21 MicroCentrifuge | Thermo Scientific | 10651805 | |
| Glycogen Solution | Qiagen | 158930 | |
| Hemocytometer | BOECO | BOE 01 | |
| Inverted Light Microscope | Zeiss | Axiovert 25 | |
| iTaq Universal SYBR Green Supermix | Bio-Rad | 172-5121 | |
| Microcentrifuge Tube | Costar (Corning) | 3621 | Should be autoclaved before use |
| P3HR-1 Cell Line | ATCC | HTB-62 | |
| Penicillin-Streptomycin Solution | Biowest | L0022 | |
| Phenol | VWR | 20599.297 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma-Aldrich | P8139 | |
| Pipette Filler | Thermo Scientific | 9501 | |
| Precision Wipes | Kimtech | 7552 | |
| RPMI-1640 Culture Medium | Sigma | R7388 | |
| SL 16R Centrifuge | Thermo Scientific | 75004030 | |
| Sodium Acetate | Riedel-de Haën (Honeywell) | 25022 | |
| Spectrophotomer | DeNovix | DS-11 | |
| Tris-HCl | Sigma | T-3253 | |
| Trypan Blue Solution | Sigma | T8154 | |
| Water Jacketed CO2 Incubator | Thermo Scientific | 4121 |
References
- Epstein, M. A., Achong, B. G., Barr, Y. M. Virus particles in cultured lymphoblasts from Burkitt's lymphoma. Lancet. 1 (7335), 702-703 (1964).
- Sample, J., et al. Epstein-Barr virus types 1 and 2 differ in their EBNA-3A, EBNA-3B, and EBNA-3C genes. Journal of Virology. 64 (9), 4084-4092 (1990).
- Chang, M. S., Kim, W. H. Epstein-Barr virus in human malignancy: a special reference to Epstein-Barr virus associated gastric carcinoma. Cancer Research and Treatment. 37 (5), 257-267 (2005).
- Manet, E., Schwab, M. . Encyclopedia of Cancer. , 1602-1607 (2017).
- Babcock, G. J., Decker, L. L., Volk, M., Thorley-Lawson, D. A. EBV persistence in memory B cells in vivo. Immunity. 9 (3), 395-404 (1998).
- Khan, G., Miyashita, E. M., Yang, B., Babcock, G. J., Thorley-Lawson, D. A. Is EBV persistence in vivo a model for B cell homeostasis. Immunity. 5 (2), 173-179 (1996).
- Jha, H. C., Banerjee, S., Robertson, E. S. The role of gammaherpesviruses in cancer pathogenesis. Pathogens. 5 (1), 18 (2016).
- El-Sharkawy, A., Al Zaidan, L., Malki, A. Epstein-Barr virus-associated malignancies: roles of viral oncoproteins in carcinogenesis. Frontiers in Oncology. 8, 265 (2018).
- Vereide, D., Sugden, B. Insights into the evolution of lymphomas induced by Epstein-Barr virus. Advances in Cancer Research. 108, 1-19 (2010).
- Vereide, D. T., Sugden, B. Lymphomas differ in their dependence on Epstein-Barr virus. Blood. 117 (6), 1977-1985 (2011).
- Houen, G., Trier, N. H. Epstein-Barr virus and systemic autoimmune diseases. Frontiers in Immunology. 11, 587380 (2020).
- Ortiz, A. N., et al. Impact of Epstein-Barr virus infection on inflammatory bowel disease (IBD) clinical outcomes. Revista Espanola de Enfermedades Digestivas. 114 (5), 259-265 (2021).
- Caplazi, P., et al. Mouse models of rheumatoid arthritis. Veterinary Pathology. 52 (5), 819-826 (2015).
- Kiesler, P., Fuss, I. J., Strober, W. Experimental models of inflammatory bowel diseases. Cellular and Molecular Gastroenterology and Hepatology. 1 (2), 154-170 (2015).
- Warde, N. Experimental arthritis: EBV induces arthritis in mice. Nature Reviews Rheumatology. 7 (12), 683 (2011).
- Jog, N. R., James, J. A. Epstein Barr virus and autoimmune responses in systemic lupus erythematosus. Frontiers in Immunology. 11, 623944 (2020).
- Shimizu, N., Yoshiyama, H., Takada, K. Clonal propagation of Epstein-Barr virus (EBV) recombinants in EBV-negative Akata cells. Journal of Virology. 70 (10), 7260-7263 (1996).
- Hsu, C. H., et al. Induction of Epstein-Barr virus (EBV) reactivation in Raji cells by doxorubicin and cisplatin. Anticancer Research. 22, 4065-4071 (2002).
- Nutter, L. M., Grill, S. P., Li, J. S., Tan, R. S., Cheng, Y. C. Induction of virus enzymes by phorbol esters and n-butyrate in Epstein-Barr virus genome-carrying Raji cells. Cancer Research. 47 (16), 4407-4412 (1987).
- Fresen, K. O., Cho, M. S., zur Hausen, H. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Glaser, R., Tarr, K. L., Dangel, A. W. The transforming prototype of Epstein-Barr virus (B95-8) is also a lytic virus. International Journal of Cancer. 44 (1), 95-100 (1989).
- Sairenji, T., et al. Inhibition of Epstein-Barr virus (EBV) release from P3HR-1 and B95-8 cell lines by monoclonal antibodies to EBV membrane antigen gp350/220. Journal of Virology. 62 (8), 2614-2621 (1988).
- Savage, A., et al. An assessment of the population of cotton-top tamarins (Saguinus oedipus) and their habitat in Colombia. PLoS one. 11 (12), 0168324 (2016).
- Kallin, B., Klein, G. Epstein-Barr virus carried by raji cells: a mutant in early functions. Intervirology. 19 (1), 47-51 (1983).
- Fresen, K. O., Cho, M. S., Hausen, H. Z. Recovery of transforming EBV from non-producer cells after superinfection with non-transforming P3HR-1 EBV. International Journal of Cancer. 22 (4), 378-383 (1978).
- Bounaadja, L., Piret, J., Goyette, N., Boivin, G. Evaluation of Epstein-Barr virus, human herpesvirus 6 (HHV-6), and HHV-8 antiviral drug susceptibilities by use of real-time-PCR-based assays. Journal of Clinical Microbiology. 51 (4), 1244-1246 (2013).
- Buelow, D., et al. Comparative evaluation of four real-time PCR methods for the quantitative detection of Epstein-Barr virus from whole blood specimens. Journal of Molecular Diagnostics. 18 (4), 527-534 (2016).
- Wu, D. Y., Kalpana, G. V., Goff, S. P., Schubach, W. H. Epstein-Barr virus nuclear protein 2 (EBNA2) binds to a component of the human SNF-SWI complex, hSNF5/Ini1. Journal of Virology. 70 (9), 6020-6028 (1996).
- Li, C., et al. EBNA2-deleted Epstein-Barr virus (EBV) isolate, P3HR1, causes Hodgkin-like lymphomas and diffuse large B cell lymphomas with type II and Wp-restricted latency types in humanized mice. PLoS Pathogens. 16 (6), 1008590 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved