Method Article
נוירומודולציית אולטרסאונד ממוקדת של תרביות עצביות במבחנה אנושית במערכי מיקרואלקטרודות מרובות בארות
In This Article
Summary
כאן, אנו מציגים פרוטוקול לשימוש במערכת תפוקה גבוהה המאפשרת ניטור וכימות של ההשפעות הנוירומודולטוריות של אולטרסאונד ממוקד על נוירונים פלוריפוטנטיים של תאי גזע (HiPSC) המושרים על ידי בני אדם.
Abstract
ההשפעות הנוירומודולטוריות של אולטרסאונד ממוקד (FUS) הודגמו במודלים של בעלי חיים, ו- FUS שימש בהצלחה לטיפול בהפרעות תנועה ופסיכיאטריות בבני אדם. עם זאת, למרות ההצלחה של FUS, המנגנון העומד בבסיס השפעותיו על תאי עצב נותר לא מובן, מה שהופך את אופטימיזציה של הטיפול על ידי כוונון פרמטרים של FUS לקשה. כדי להתמודד עם הפער הזה בידע, חקרנו תאי עצב אנושיים במבחנה באמצעות תאי עצב שגודלו בתרבית מתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם (HiPSCs). השימוש ב-HiPSCs מאפשר לחקור התנהגויות עצביות ספציפיות לבני אדם הן במצבים פיזיולוגיים והן במצבים פתולוגיים. דוח זה מציג פרוטוקול לשימוש במערכת בעלת תפוקה גבוהה המאפשרת ניטור וכימות של ההשפעות הנוירומודולטוריות של FUS על תאי עצב HiPSC. על ידי שינוי הפרמטרים של FUS ומניפולציה של נוירוני HiPSC באמצעות שינויים פרמצבטיים וגנטיים, חוקרים יכולים להעריך את התגובות העצביות ולהבהיר את ההשפעות הנוירו-מודולטוריות של FUS על נוירוני HiPSC. למחקר זה עשויות להיות השלכות משמעותיות על פיתוח טיפולים בטוחים ויעילים מבוססי FUS למגוון הפרעות נוירולוגיות ופסיכיאטריות.
Introduction
אולטרסאונד ממוקד (FUS) הוא מודל נוירומודולציה מבטיח המאפשר גירוי לא פולשני בעומקים של סנטימטר עם רזולוציה תת-מילימטרית 1,2,3. למרות חוזקות אלה, ההשפעה הקלינית של FUS מוגבלת, בין היתר בשל חוסר ידע לגבי מנגנון הפעולה שלה. ללא בסיס תיאורטי מוצק, חוקרים וקלינאים נתקלים בקשיים בהתאמת הטיפול לצרכים הספציפיים של מטופלים בודדים בתנאים משתנים. תיאוריה בולטת שהוצעה על ידי Yoo et al.4 מציעה כי תעלות יונים רגישות מכנו אחראיות להפעלת נוירונים. עם זאת, תיאוריה זו אינה מצליחה להסביר את הפעלת FUS בנוירונים במוח האדם, אשר חסרים ערוצים אלה5. עמימות זו מגבילה את השימוש ב- FUS במרפאה, מכיוון שהיא מונעת כוונון של פרמטרים של FUS כדי לייעל את תוצאות הטיפול.
מחקרים קשורים קודמים השתמשו במגוון גישות כדי לחקור את המנגנונים הפיזיולוגיים העומדים בבסיס FUS ולקבוע את פרמטרי הגירוי האופטימליים. שלב מכריע בתהליך זה כרוך בניטור תגובות עצביות כמשוב, אשר ניתן להשיג באמצעות שיטות הכוללות ניטור שער יונים, כגון דימות יוני סידן4, הדמיה אופטית1 ורישום אלקטרופיזיולוגי ex vivo (למשל, אלקטרומיוגרפיה6 או אלקטרופיזיולוגיה של עצב העור7). עם זאת, רוב המחקרים הללו משתמשים בנוירונים לא אנושיים או בגישות in vivo, אשר יכולות להציג שונות נוספת עקב בקרות תת-אופטימליות. לעומת זאת, שימוש באלקטרודות למדידת אותות עצביים בתאי גזע פלוריפוטנטיים המושרים על ידי בני אדם במבחנה (HiPSC) מציע מדידות רגישות יותר ושליטה רבה יותר בסביבת הניסוי. בעבודה זו פותחה מערכת במבחנה באמצעות מערכי מיקרו-אלקטרודות (MEAs) כדי למדוד את התגובות החשמליות של תאי עצב HiPSC בעקבות גירוי FUS, כפי שמוצג באיור 1. מערכת זו מאפשרת לחוקרים בקהילה לנטר תגובות עצביות כאשר משנים את פרמטרי האולטרסאונד (למשל, תדירות, אורך פרץ, עוצמה). בנוסף, מערכת זו מאפשרת רמה גבוהה של שליטה ברגישות העצבית לגירויים פיזיים (למשל, טמפרטורה, לחץ וקוויטציה)8,9, שכן ניתן לתפעל את פונקציונליות תעלת היונים של תאי העצב באופן גנטי ופרמצבטי (למשל, שימוש בגדוליניום לעיכוב תעלות יונים)10,11,12. שליטה זו ברמה המולקולרית עשויה לעזור להבהיר את המנגנונים מאחורי ההשפעות הנוירומודולטוריות של FUS.
Protocol
1. הכנת חומרים
- שאפו את מדיום התרבית, והשתמשו בו כדי למלא באר אחת בצלחת תרבית נוירונים בת 24 בארות עם MEA מוטבע (איור 2A). תרבית ולגרום לנוירונים בעקבות הפרוטוקול שפורסם על ידי Taga et al.13.
- עקרו את ממשק הפרפילם, את הגומייה ואת חרוט FUS עם קרום הגומי שלו תוך שימוש באתנול 70% למשך 10 דקות, והניחו אותם במכסה האדים להרכבה מאוחרת יותר.
- דגה 300 מ"ל של מים deionized ו 50 מ"ל של ג'ל צימוד. צנטריפוגו את המים והג'ל ב 160 x גרם במשך 5 דקות כדי למנוע גרימת cavitation בתוך תווך הצימוד.
הערה: המקור המקורי של HiPSCs הוא מקווי תאים GM01582 ו-CIPS. בממוצע, צפיפות של 5 x 104 נוירונים מוטוריים ו 2.5 x 104 אסטרוציטים לכל באר ניתן להשיג14.
2. חיבור והתקנה של ציוד היקפי
- הצמידו את חרוט ה-FUS למתמר באמצעות ברגים, ואטמו את החרוט בקרום גומי גמיש במכסה מנוע סטרילי מאוורר. מלאו את החרוט במים שעברו דה-גזים ודה-יוניזציה (DG-DI) משלב 1.3, והבטיחו היעדר בועות בקונוס כדי למנוע קוויטציה.
- השתמשו במוט מושחל מותאם אישית כדי לאבטח את המחזיק המודפס בתלת-ממד למסגרת (איור 2B). מקם את המסגרת כך שראש מתמר FUS יהיה מעל הבאר שתעורר.
- השתמש בגומייה כדי לאבטח את הפרפילם מעל הבאר על צלחת MEA בעלת 24 בארות המכילה את המדיום ואת HiPSCs.
- הכן את מערכת FUS על ידי חיבור אלקטרוניקה של מנהל ההתקן העורפי של מתמר האולטרסאונד, במקרה זה, פלט הכוח של המתמר (TPO; איור 3A), לשקע חשמל של 100-240 וולט (איור 3B, חיבור 6) וחיבור הרשת התואמת ל-TPO ולמתמר FUS (איור 3B, חיבור 1 וחיבור 2, בהתאמה). רשת ההתאמה מבטיחה צימוד חשמלי יעיל בין המתמר ל-TPO.
- חבר את מערכת MEA לשקע חשמל (100-240 וולט) (איור 3B, חיבור 5). חבר את יציאת סנכרון מערכת MEA ל- TPO (איור 3B, חיבור 3). חיבור זה יסנכרן את איסוף הנתונים על ידי מערכת MEA עם גירוי FUS.
- הניחו את צלחת MEA בעלת 24 הקידוחים במערכת MEA, והסירו את המכסה כדי לאפשר מגע ישיר בין המתמר לבאר. הניחו את המתמר 5-10 מ"מ מעל לוח הבאר כדי לפנות מקום לג'ל הצימוד נטול הגזים, כמתואר בשלב 3.2 (איור 3A ואיור 2B).
3. גירוי ורכישת אות עצבי
- הגדר את פרמטרי FUS בלוח הבקרה של TPO (טבלה 1).
- מרחו את ג'ל הצימוד על גבי הפרפילם, והורידו את מתמר FUS לתוך ג'ל הצימוד, כדי להבטיח מגע עם הג'ל עם מינימום בועות אוויר (איור 2A).
- התחל את הקלטת מערכת MEA על ידי לחיצה על התחלה כפתור בממשק המשתמש.
- התחילו את הסוניקציה של FUS על-ידי לחיצה על הכפתור הימני התחתון ב-TPO (איור 3A, תווית 7), והמתינו לפחות 5 דקות בין כל סבב של סוניקציה כדי לאפשר לתאי העצב לחזור למצב בסיסי.
- השתמשו בפעימת ההדק שנוצרת על-ידי מערכת FUS כדי ליישר את רצף הגירוי של FUS לרישום MEA (איור 3B, חיבור 3).
4. עיבוד וניתוח נתונים
- העבר את הנתונים ממערכת MEA למחשב באמצעות חיבור USB (איור 3B, חיבור 4). התחל זאת על ידי לחיצה על החלונית Experiment Set-Up . לאחר מכן, בחר את סוג הנתונים שברצונך להקליט. במקרה זה, מומלץ קוצים גולמיים. לבסוף, תן שם לקובץ ובחר את המיקום הרצוי בתוך כונן הדיסקים כדי להשלים את ההעברה.
הערה: ניתן לבצע את השלבים הבאים על-ידי הפעלת קובץ ה- Script של Python שפורסם ב- https://github.com/Rxliang/FUSNeuromod. - קרא את הנתונים מכל אחת מ-16 האלקטרודות.
- החל מסנן פס פס של Butterworth עם רוחב פס של 5 הרץ עד 3 קילוהרץ בסדר גודל של 8 Butterworth.
הערה: כדי למטב ערכים אלה, חיוני לקחת בחשבון את קצב הירי של התאים הספציפיים ואת מספר התאים המעורבים. על ידי הכפלת 2 ערכים אלה, ניתן להעריך את קצב הירי הכולל של אוכלוסיית התאים בניסוי. - החל מסנן גאוס עם σ = 3 כדי להחליק את האות.
הערה: ניתן למטב את הפרמטר בהתבסס על הערכים המומלצים ממערכת MEA, מכיוון שהחלקה מוגזמת עלולה לגרום לעיוות נתונים לאחר הרכישה, והחלקה מועטה מדי תגרום לרעש לא רצוי. - הגדר סף כדי לזהות את הקוצים הפוטנציאליים כפי 5 מסטיית התקן של האות המוחלק על ידי גאוס.
- חשב את קצב הירי על ידי חלוקת מספר הדוקרנים הרשומים בחלון של 50 מילישניות על פני כל 16 הערוצים לאורך החלון (כלומר, 50 מילישניות). הסט את החלון לאורך האות לפריים הבא, וחזור על חישוב קצב הירי (איור משלים 1).
- נתח את האות על ידי קריאת זמן הסוניקציה של FUS מהנתונים המועברים בהתבסס על השינוי בקצב הירי המשויך ל- FUS.
5. ניקוי צלחות MEA מרובות בארות ושימוש חוזר
- לאחר השלמת הניסויים, השתמש פיפטה כדי להסיר בזהירות את המדיום מן הבארות בצלחת מרובת בארות, תוך הקפדה על הימנעות משטח האלקטרודה.
- הוסף 2 מ"ל מים DG-DI לכל באר. שאפו וחזרו על הפעולה פעם אחת.
- כדי לעקור תאים ופסולת, הוסף תערובת של 1 גרם של חומר ניקוי אנזימטי Terg-A-Zyme עם 10 מ"ל של מים סטריליים DG-DI (0.3 מ"ל לכל באר) לצלחת. השאירו אותו לדגור למשך הלילה בטמפרטורת החדר (RT).
- למחרת, להסיר את הפתרון מן הבארות, ולשטוף אותם עם 1 מ"ל של מים סטריליים DG-DI.
- דוגרים על הצלחת מרובת הבארות במשך 5-7 דקות, ושואפים לכך. חזור על שלב זה 5 פעמים.
- הוסף 0.5 מ"ל מים סטריליים DG-DI לכל באר. רשום את קו הבסיס של הצלחת מרובת הקידוחים המנוקה כדי לוודא שצלחת MEA נקייה. לוח נקי צריך להציג דפוסי רעש גאוסיאניים עם ערכי עוצמה נמוכים.
- אחסנו את הצלחת מרובת הבארות המנוקות בטמפרטורה של 4°C עד שהיא מוכנה לשימוש חוזר. החליפו את המים שבהם מאוחסנים MEAs לפחות פעם בחודש.
תוצאות
לסיכום, אנו מציגים פרוטוקול המאפשר ניטור נוירומודולציה FUS במבחנה באמצעות תאי עצב שגודלו בתרבית מתאי HiPSC. פלטפורמת המערכת הכוללת לגירוי תאי עצב הנגרמים על-ידי HiPSC ולרישום התגובות החשמליות התואמות לניתוח מתוארת באיור 1. המחקר הזה מתמקד בגירוי FUS של תאי עצב וברישום התגובות החשמליות במערכת MEA, כפי שמוצג באיור 2. המרכיבים ההיקפיים של מערכות FUS ו-MEA והקשרים ביניהם מתוארים באיור 3.
אפיון נקודת המוקד מתבצע לפני הניסויים העצביים כדי להבטיח שתחתית הבאר מכוסה במלואה על ידי מוקד FUS. יש לבצע הדמיה של נקודת המוקד ביריעות תרמוכרומיות, כפי שמוצג באיור 4, כדי להעריך את מערכת FUS. לאחר אפיון נקודת המוקד, יש לבצע את השלבים שלאחר העיבוד, כולל סינון, סף וחישוב קצב הירי, ואלה מסוכמים באיור 5 ובאיור 6. צעדים אלה חיוניים כדי לאחזר אותות שימושיים על ידי סינון רעש מהסביבה, ובכך, כדי לקבל תובנה לגבי השינויים בפעילות העצבית הנגרמת על ידי FUS. תרשימי הרסטר באיור 6A-B מראים את הקוצים שזוהו בכל ערוץ. מכיוון שכל תחתית הבאר נמצאת בנקודת המוקד של מתמר FUS, צפוי שה-FUS ישנה את קצב הירי בכל האלקטרודות. שינוי זה בקצב הירי מודגם בתרשים קצב הירי המוצג באיור 6C, אשר מראה כי פרמטרי הגירוי שנבחרו הביאו לעלייה בקצב הירי העצבי. באופן ספציפי, קצב הירי לפני FUS (כלומר, קו הבסיס) היה 140 הרץ ± 116.7 הרץ, בעוד שקצב הירי שלאחר FUS היה 786 הרץ ± 419.4 הרץ עם FUS גל רציף. נוסף על כך, איור 6C מראה כיצד שינוי הפרמטרים של FUS (למשל, שימוש ב-FUS של גל פולסים במקום בגל רציף) יכול לשנות את גודל השינוי בקצב הירי, כמו גם לשנות את משך הזמן לפני שתאי העצב חוזרים למצב הבסיסי שלהם. אולטרסאונד ממוקד בעוצמה נמוכה (LIFU) אינו גורם להתחממות משמעותית של תרביות, במיוחד בהשוואה לאולטרסאונד ממוקד בעוצמה גבוהה, המתכוון להשיג נגע תרמי. היעדר שינוי טמפרטורה בעל השפעה קלינית נתמך על-ידי חישובים תיאורטיים וסימולציות (איור משלים 2). אפילו במקרים קיצוניים של פרמטרי FUS ניסיוניים המפורטים בטבלה 1, ניתן היה לראות רק עלייה מינימלית בטמפרטורה של כ-0.04 מעלות צלזיוס.
השימוש בתרשים קצב ירי מאפשר לכמת את ההשפעות הנוירומודולטוריות של FUS וניתן להשתמש בו כדי להבדיל בין תגובות מעוררות ומעכבות. יתרון משמעותי של צלחת MEA מרובת בארות הוא שניתן לעשות בה שימוש חוזר מספר פעמים כדי לחקור מצבים עצביים משתנים ופרמטרים של גירוי באופן בתפוקה גבוהה.
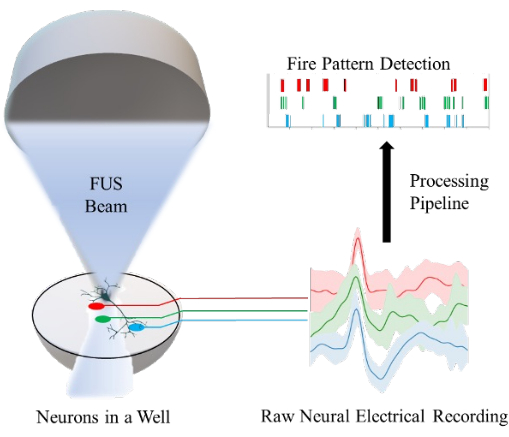
איור 1: סקירה כללית של פלטפורמת in vitro עבור נוירומודולציה של נוירונים בבאר באמצעות אולטרסאונד ממוקד (FUS) ומדידת הפעילות העצבית שלהם באמצעות מערך מיקרואלקטרודות. כל אלקטרודה (קווים אדומים, ירוקים וכחולים) מתעדת מאוכלוסיית תאי עצב בתוך באר אחת. צינור עיבוד מיושם כדי להמיר את הרישומים החשמליים העצביים הגולמיים לזיהוי דפוסי ירי עצביים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 2: נוירומודולציה FUS עם מערך מיקרואלקטרודות רב-באר (MEA). (A) סכמטי של ההתקנה עבור נוירומודולציה FUS עם MEA מרובה בארות. הגלים האקוסטיים הנוצרים על ידי מתמר FUS מתפשטים דרך חרוט FUS מלא במים נטולי גז ומצומדים באמצעות ג'ל אולטרסאונד. הפרפילם מאובטח לבאר באמצעות גומייה למניעת זיהום. לוחית MEA שולחת הקלטות חשמליות מתאי העצב למערכת MEA. (B) תצלום של מתמר FUS על הלוח הרב-באר הכלול במערכת MEA. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.

איור 3: הגדרת פלטפורמת מבחנה . (A) חזית מערך פלטפורמת המבחנה . פלט הכוח של המתמר (TPO; משמאל) משמש לתכנות הפרמטרים של FUS. מערכת MEA (מימין) רושמת פעילות חשמלית מתאי העצב בלוח הבאר, אשר עוברים נוירומודולציה על ידי מתמר FUS. (B) החלק האחורי של מערך פלטפורמת המבחנה עם חיבורים מהרשת התואמת (1) ל-TPO ו-(2) למתמר. (3) החיבור ממערכת MEA ל-TPO מסנכרן את איסוף הנתונים. (4) החיבור ממערכת MEA למחשב לצורך העברת נתונים. (5) חיבור החשמל למערכת MEA. (6) חיבור החשמל למערכת FUS. (7) כפתור הסוניקציה. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
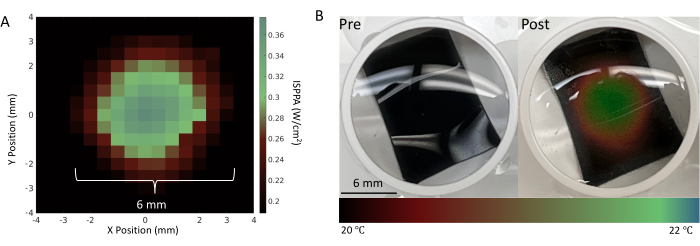
איור 4: אפיון מתמר FUS. (A) מפת לחץ של נקודת המוקד באמצעות פרמטרי FUS המפורטים בטבלה 1 הנמדדת במערכת משרעת15. (B) לפני ואחרי סוניקציה של יריעה תרמוכרומית הממוקמת בתחתית באר באמצעות מערך הניסוי שמוצג באיור 3. היריעה התרמוכרומית משנה את צבעה בתגובה לשינויי טמפרטורה, מה שמספק אימות חזותי של גירוי מוצלח במיקום הנוירונים. עוצמת הדופק המרחבית-שיא המקסימלית (ISPPA) של 30 W/cm2 וסוניקציה רציפה של 3 דקות הותאמו כדי לשנות את הטמפרטורה המקומית באופן דרסטי להדמיה טובה יותר של נקודת מוקד כזו. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
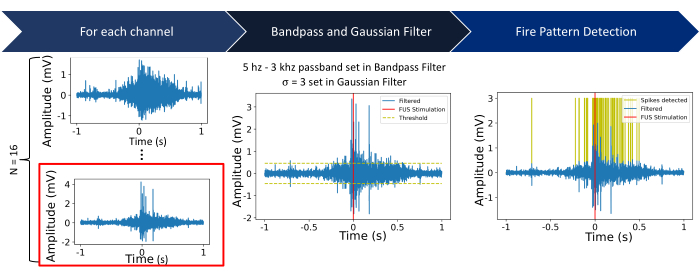
איור 5: צינור עיבוד. שלב 1: הקלטות חשמליות גולמיות נלכדות מ- N = 16 ערוצים. השלבים העתידיים מציגים את התהליך באמצעות ערוץ 16 (מסומן באדום). שלב 2: עבור כל ערוץ, מופעל מסנן פסים של Butterworth (פסים של 5 הרץ עד 3 קילוהרץ), ואחריו מסנן גאוס (σ = 3). סף נקבע כפי חמישה מסטיית התקן של האות בתוך חלון של 2 שניות שמרכזו בתחילת הסוניקציה. שלב 3: אותות מעל או מתחת לסף מאופיינים כקוצים. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
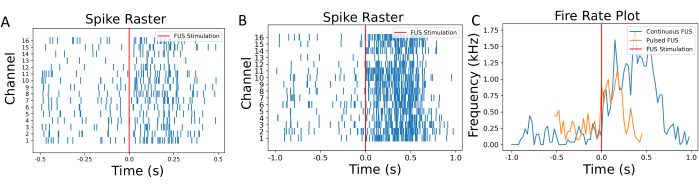
איור 6: תרשימי רסטר וקצב ירי. (A) תרשים רסטר של הקוצים שזוהו בכל ערוץ כפונקציה של זמן הסוניקציה. הזמן של גירוי FUS מבואר באמצעות קו אדום. (B) תרשים רסטר של תאי עצב תחת הגדרות FUS שונות עם FUS רציף לצורך השוואה. (ג) קצב הירי חושב באמצעות חלון הזזה של 50 אלפיות השנייה. קצבי הירי הממוצעים לפני ואחרי FUS היו 140 הרץ ו-786 הרץ, בהתאמה. עם FUS פועם, קצבי הירי הממוצעים היו 230 הרץ ו-540 הרץ. הפעלה קצרה יותר ושינוי קצב נמוך יותר נצפו כנגרמים על ידי קבוצה זו של גירוי FUS משתנה. תהליך חישוב קצב הירי מפורט בתרשים משלים 1. אנא לחץ כאן כדי להציג גרסה גדולה יותר של איור זה.
| פרמטר | ערך |
| הספק מרבי/Ch. | 1.200 ואט |
| Pבפועל | 0.749 ואט/ערוץ. |
| אניSPPA | 10.79 ואט/ס"מ2 |
| אניSPTA | 0.05 ואט/ס"מ2 |
| אורך פרץ | 0.100 מטר/שניה |
| תדירות | 250.00 קילו-הרץ |
| מוקד | 39.800 מ"מ |
| תקופה | 20.000 מטר/שניה |
| טיימר | 60,000 שניות |
טבלה 1: פרמטרים של אולטרסאונד ממוקד (FUS) שנקבעו ב-TPO עבור המחקר המוצג באיור 4.
תרשים משלים 1: עיבוד מחלקת הרסטר לקצב הירי. שלב 1: ספור את הקוצים בין כל הערוצים כדי לקבל את מספר הספירה בתוך חלון הזזה נתון. הערה: כאן נבחר חלון הזזה גדול יותר (מוגדר ל-0.1 שניות) להמחשה טובה יותר. שלב 2: המר את הדוקרנים לכל אורך חלון לקוצים לשנייה (לדוגמה, כאן, הכפל את הספירה ב- 10 כדי להמיר להרץ [Hz], ולאחר מכן חלק ב- 1,000 כדי לקבל את הערך בקיל-הרץ [kHz]). שלב 3: עקומת קצב הירי שנרכשה כתוצאה מכך. ערכת כלים בקוד פתוח, יחד עם נתונים שנדגמו, זמינה ב- GitHub (https://github.com/Rxliang/FUSNeuromod). אנא לחץ כאן כדי להוריד קובץ זה.
איור משלים 2: פרופיל טמפרטורת התוצאה של סימולציית גלי K של LIFU16. בהתבסס על מפת העוצמה האקוסטית המוצגת באיור 4, תוצאת סימולציית גלי K מציעה עליית טמפרטורה מקסימלית של 0.04 מעלות צלזיוס באזור המרכז של אזור המוקד (רדיוס: 2 מ"מ) תוך שימוש במקרה הקיצוני של פרמטרי FUS הניסיוניים המפורטים בטבלה 1. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
כתב יד זה מתאר שיטה חדשנית שניתן להשתמש בה כדי לרשום פעילות עצבית ב- HiPSCs במהלך נוירומודולציה FUS. פרוטוקול זה ניתן להכללה למתמרי FUS שונים ולמערכות MEA. כדי לשכפל את התוצאות שנצפו עם הפרוטוקול המתואר, על החוקר לוודא שנקודת המוקד של המתמר גדולה מהשטח של תחתית באר MEA. יתר על כן, אם נעשה שימוש בקווי תאים עצביים שונים, יש לכוונן את פרמטרי המסנן לתגובת התדר הצפויה עבור התאים בתוך הבאר. אם לא ניתן להשיג תוצאות מייצגות, יש לשקול לשנות את הפרמטרים הנ"ל (למשל, אורך הפרץ, העוצמה, מחזור העבודה וכו ').
למרות שעבודה זו הדגימה עלייה בקצב הירי בעקבות גירוי FUS, יש לאסוף נתונים נוספים כדי להדגים את החזרתיות של ממצא זה לפני הסקת מסקנות כלשהן. פרוטוקול זה יורש את המגבלות של מערכות MEA, אשר בדרך כלל יש חולשות הנובעות מהקלטת האות זרם מיקרואלקטרודה ישיר. למרות שמגע ישיר עם תא העצב מספק רגישות טובה יותר, הוא עשוי לשנות את התא ולהשפיע על דיוק המדידה. יתר על כן, בשל גודלן הקטן של הבארות, המערכת שלנו אינה כוללת רקמה היקפית, אשר עשויה גם לשחק תפקיד נוירומודולציה17. הדבר עשוי להגביל את תחולת המסקנות שהוסקו ממערך זה לסביבות in vivo . כדי לחקור תגובות רשת מורכבות יותר, יש לתכנן מערכת MEA בעלת צפיפות ערוצים גבוהה יותר כדי לשפר את רגישותה18. זוהו מספר כיוונים עתידיים למערכת מוצעת זו, כולל שימוש בגנטרי תלת-ממדי כדי להחזיק את המתמר ולהבטיח מיקום מדויק19. שיפורים נוספים יכולים להתבצע בנוגע לאלגוריתם שלאחר העיבוד, כולל שימוש באלגוריתם מיון ספייקינג20 כדי לסווג נוירונים בודדים. תהליך זה יועיל להתרת התגובות של תאי עצב מרובי יחידות במחקרים עתידיים על מנגנוני FUS. והכי חשוב, חיוני לשלב שיטות גירוי נוספות, כגון גירויים כימיים, חשמליים ואופטיים, כדי להבהיר את המנגנונים העומדים בבסיסם. שיטות אלה יכולות לשנות תכונות והתנהגויות עצביות, כגון על ידי עיכוב תעלות יונים ספציפיות15 או שינוי מאפייני הממברנה21. על ידי אפנון הגורמים העיקריים בתוך מסלול האיתות המשוער, חוקרים יכולים לזהות את התרומות של כל גורם בסביבות מבוקרות, ובסופו של דבר, לשפוך אור על האינטראקציות המורכבות במשחק.
גירוי חשמלי22 היא אחת הטכניקות המבוססות ביותר עבור נוירומודולציה, עם היסטוריה ארוכה של יישומים מוצלחים במסגרות קליניות ומחקריות. לעומת זאת, FUS ואופטוגנטיקה23 הן שיטות חדשות יחסית שזוכות לתשומת לב בשנים האחרונות. היתרונות העיקריים של FUS הם חוסר הפולשנות שלו ויכולתו לעורר נוירונים בעומקים שעשויים להיות קשים להגיע אליהם עם טכניקות אחרות, כולל גירוי חשמלי ואופטוגנטיקה. עם זאת, בדומה לאופטוגנטיקה24, ל-FUS יש כמה מגבלות הקשורות למידול התפשטות הגלים ולתגובות העצביות הקשורות. לכידת המורכבות של התכונות האקוסטיות ההטרוגניות של הרקמה in vivo יכולה להיות מאתגרת, מה שמוביל לאי ודאות בשדה הלחץ, וכתוצאה מכך, בתגובות העצביות. קושי זה במידול מדויק של מאפיינים אלה מהווה אתגר בעת אופטימיזציה של הטכניקה עבור יישומים ספציפיים בעולם האמיתי. המורכבויות המובנות מדגישות את חשיבותן של מערכות חוץ גופיות כמו זו שבמחקר זה, שכן הן מאפשרות מחקר ישיר של תגובות בתנאי עוצמה אקוסטית מבוקרת.
לסיכום, מערכת זו מספקת פלטפורמה במבחנה בעלת תפוקה גבוהה לחקר ההשפעות הנוירו-מודולטוריות של FUS על נוירונים אנושיים. באמצעות מערכת זו, ניתן לחקור את מנגנוני הפעולה של FUS על ידי מדידת התגובות החשמליות של תאי עצב אנושיים כאשר הם נחשפים לרמות וסוגים שונים של גירוי בסביבה מבוקרת. לכן, הוא מציע כלי משלים רב ערך למודלים של בני אדם ובעלי חיים הנפוצים בתחום.
Disclosures
המחברים מצהירים כי המחקר נערך בהיעדר קשרים מסחריים או פיננסיים שיכולים להתפרש כניגוד עניינים פוטנציאלי. אמיר מנבצ'י מלמד ומייעץ עבור BK Medical (GE Healthcare) ו-Neurosonics Medical והוא ממציא של מספר טכנולוגיות FUS הממתינות לפטנט. בטי טיילר קיבלה מימון מחקר מה-NIH והיא בעלים משותפת של Accelerating Combination Therapies (כולל מניות או אופציות). Ashvattha Therapeutics Inc. רשמה את אחד הפטנטים שלה והיא בעלת מניות עבור Peabody Pharmaceuticals.
Acknowledgements
אמיר מנבצ'י וניטיש תאקור מודים על תמיכת מימון מהסוכנות לפרויקטי מחקר מתקדמים של ההגנה, DARPA, חוזה פרס: N660012024075. בנוסף, אמיר מנבצ'י מודה על תמיכת מימון מתוכנית חוקרי המחקר הקליני (KL2) של מכון ג'ונס הופקינס למחקר קליני ותרגומי (ICTR), המנוהלת על ידי המרכז הלאומי לקידום מדעי התרגום (NCATS), המכונים הלאומיים לבריאות (NIH). ניטיש תאקור מודה במימון תמיכה מהמכונים הלאומיים לבריאות (NIH): R01 HL139158-01A1 ו- R01 HL071568-15.
Materials
| Name | Company | Catalog Number | Comments |
| MEA System | Axion Biosystem Inc. | Maestro Edge | Sampling Rate: 11500 Hz |
| MEA Plate | Axion Biosystem Inc. | CytoView MEA | Electrode and Well: 16 electrodes in 24 wells |
| Well plate Interface | Amcor Inc. | Parafilm PM996; P7793 | Thickness: 127 µm |
| CO2 Tank and Regulator for culture | AirGas Inc./ Harris Inc. | 9296NC | Concentration: 5% |
| Culture Media | ThermoFisher Inc. | Laminin; 23017-015 | Concentration: 1 µg/mL |
| HiPSC Neurons | Peprotech | CIPS and GM01582 Derived; 450-10 | Concentration: 10 ng/mL (Refer Taga et al [2021]13) |
| Transducer | Sonic Concepts Inc. | CTX250; 008 | Center Frequency: 250 kHz |
| Matching Network | Sonic Concepts Inc. | CTX250; NFS102v2 | Impedance: 50 Ω |
| Transducer Power Output (TPO) | Sonic Concepts Inc. | Version 4.1; 020 | Frequency: From 250 kHz to 2.5 MHz |
| Membrane | McMaster Inc. | Silicone Rubber; 5542N115 | Thickness: 0.0127 cm |
| Coupling Gel | Parker Laboratory Inc. | Aquasonic 100; B08DDWG GXB | Viscosity: 130,000–185,000 cops |
| Connection to Probe holder | McMaster Inc. | Steal Threaded Rod; 90322A661 | Length: 1–1/2" Long |
| Centrifuge | ThermoFisher Inc. | Sorvall Legend X1R; 75004261 | Max acceleration: 10–25,830 x g |
| Hydrophone | Sonic Concepts Inc. | Y-104; 009 | Range: 50 kHz–1.9 MHz |
| Water Tank | Sonic Concepts Inc. | WT | Size: 30 cm x 30 cm x 30 cm |
| Water Conditioning Unit | Sonic Concepts Inc. | WCU; SN006 | Flow Velocity: 50 mL/s maximum |
| Oscilloscope | Rohde-Schwarz Inc. | RTC1002 | Sampling rate: Up to 50 MHz |
| Stage | Sonic Concepts Inc. | MicroStage; 2 | Accuracy: 1 µm |
| Thermochromic sheet | TIPTEMP Inc. | Liquid Crystal Sheet; TLCSEN337 | Range: 22–24 °C |
| Computer | Microsoft Surface | Surface Pro | CPU i5 1035G4: 3.7 GHz |
| Data Transfer Software | Mathworks Inc. | MATLAB | Version 2021b |
| Processing Software | Python Software Foundation | Python | Version 3.7.10 |
References
- Kamimura, H. A. S., Conti, A., Toschi, N., Konofagou, E. E. Ultrasound neuromodulation: Mechanisms and the potential of multimodal stimulation for neuronal function assessment. Frontiers in Physics. 8, 150 (2020).
- Manbachi, A., Kempski, K. M., Curry, E. J. . The Abundant Promise of Ultrasound in Neurosurgery: A Broad Overview and Thoughts on Ethical Paths to Realizing Its Benefits. , (2022).
- . Handbook for Clinical Ultrasound.Beginner's Guide to Fundamental Physics & Medical Ultrasound Applications. Audible Available from: https://www.audible.com/pd/Handbook-for-Clinical-Ultrasound-Audiobook/B0983XJY83 (2021)
- Yoo, S., Mittelstein, D. R., Hurt, R. C., Lacroix, J., Shapiro, M. G. Focused ultrasound excites cortical neurons via mechanosensitive calcium accumulation and ion channel amplification. Nature Communications. 13 (1), 493 (2022).
- Szczot, M., Nickolls, A. R., Lam, R. M., Chesler, A. T. The form and function of PIEZO2. Annual Review of Biochemistry. 90, 507-534 (2021).
- Kim, H., et al. Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 12 (2), 251-255 (2019).
- Hoffman, B. U., et al. Focused ultrasound excites action potentials in mammalian peripheral neurons in part through the mechanically gated ion channel PIEZO2. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), e2115821119 (2022).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13 (12), 867-878 (2012).
- Collins, M. N., Legon, W., Mesce, K. A. The inhibitory thermal effects of focused ultrasound on an identified, single motoneuron. eNeuro. 8 (2), (2021).
- Chalfie, M. Neurosensory mechanotransduction. Nature Reviews. Molecular Cell Biology. 10 (1), 44-52 (2009).
- Launay, P., et al. TRPM4 Is a Ca2+-activated nonselective cation channel mediating cell membrane depolarization. Cell. 109 (3), 397-407 (2002).
- Cain, S. M., Snutch, T. P. Contributions of T-type calcium channel isoforms to neuronal firing. Channels. 4 (6), 475-482 (2010).
- Taga, A., et al. Establishment of an electrophysiological platform for modeling ALS with regionally-specific human pluripotent stem cell-derived astrocytes and neurons. Journal of Visualized Experiments. (174), e62726 (2021).
- Taga, A., et al. Role of human-induced pluripotent stem cell-derived spinal cord astrocytes in the functional maturation of motor neurons in a multielectrode array system. Stem Cells Translational Medicine. 8 (12), 1272-1285 (2019).
- Manuel, T. J., et al. Ultrasound neuromodulation depends on pulse repetition frequency and can modulate inhibitory effects of TTX. Scientific Reports. 10 (1), 15347 (2020).
- Treeby, B. E., Cox, B. T. k-wave: Matlab toolbox for the simulation and reconstruction of photoacoustic wave fields. J. Biomed. Opt. 15 (2), 021314 (2010).
- Akhtar, K., et al. Noninvasive peripheral focused ultrasound neuromodulation of the celiac plexus ameliorates symptoms in a rat model of inflammatory bowel disease. Experimental Physiology. 106 (4), 1038-1060 (2021).
- Smirnova, L., et al. Organoid intelligence (OI): The new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science. 1, 1017235 (2023).
- Saccher, M., et al. Focused ultrasound neuromodulation on a multi-well MEA. Bioelectronic Medicine. 8 (1), 2 (2022).
- Yger, P., et al. A spike sorting toolbox for up to thousands of electrodes validated with ground truth recordings in vitro and in vivo. eLife. 7, e34518 (2018).
- Babakhanian, M., et al. Effects of low intensity focused ultrasound on liposomes containing channel proteins. Scientific Reports. 8, 17250 (2018).
- Liang, R., et al. Designing an Accurate Benchtop Characterization Device: An acoustic measurement platform for localizing and implementing therapeutic ultrasound devices and equipment (amplitude). 2022 Design of Medical Devices Conference. , (2022).
- Ko, H., Yoon, S. -. P. Optogenetic neuromodulation with gamma oscillation as a new strategy for Alzheimer disease: A narrative review. Journal of Yeungnam Medical Science. 39 (4), 269-277 (2022).
- White, M., Mackay, M., Whittaker, R. G. Taking optogenetics into the human brain: Opportunities and challenges in clinical trial design. Open Access Journal of Clinical Trials. 2020, 33-41 (2020).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved