Method Article
マルチウェル微小電極アレイにおけるヒト in vitro 神経培養の集束超音波ニューロモジュレーション
要約
ここでは、ヒト誘導多能性幹細胞(HiPSC)ニューロンに対する集束超音波の神経調節効果のモニタリングと定量化を可能にするハイスループットシステムを使用するためのプロトコルを紹介します。
要約
集束超音波(FUS)の神経調節効果は動物モデルで実証されており、FUSはヒトの運動障害や精神障害の治療に使用されています。しかし、FUSの成功にもかかわらず、ニューロンに対する効果の根底にあるメカニズムは十分に理解されておらず、FUSパラメータの調整による治療の最適化を困難にしています。この知識のギャップを埋めるために、ヒト人工多能性幹細胞(HiPSC)から培養した神経細胞を用いて、 in vitro でヒトの神経細胞を研究しました。ヒトiPS細胞を用いることで、生理学的状態と病理学的状態の両方におけるヒト特異的な神経細胞の挙動を研究することができます。本報告では、HiPS細胞ニューロンに対するFUSの神経調節効果のモニタリングと定量化を可能にするハイスループットシステムを使用するためのプロトコルを提示する。FUSのパラメータを変化させ、薬剤や遺伝子の改変によってHiPS細胞の神経細胞を操作することで、研究者は神経応答を評価し、HiPS細胞の神経細胞に対するFUSの神経調節効果を解明することができます。この研究は、さまざまな神経疾患や精神疾患に対する安全で効果的なFUSベースの治療法の開発に大きな影響を与える可能性があります。
概要
集束超音波(FUS)は、サブミリメートルの分解能1,2,3でセンチメートルレベルの深さでの非侵襲的刺激を可能にする有望な神経調節モダリティです。これらの長所にもかかわらず、FUSの臨床的影響は、その作用機序に関する知識の欠如が一因であり、限定的である。確固たる理論的基盤がなければ、研究者や臨床医は、さまざまな条件下で個々の患者の特定のニーズを満たすように治療法を調整することが困難になります。Yooらが提唱した著名な理論4は、機械感受性イオンチャネルがニューロンの活性化に関与していることを示唆しています。しかし、この理論では、これらのチャネルを欠くヒト脳ニューロンにおけるFUSの活性化を説明できない5。この曖昧さは、治療結果を最適化するためのFUSパラメータの調整を妨げるため、臨床でのFUSの利用を制限します。
これまでの関連研究では、FUSを支える生理学的メカニズムを調査し、最適な刺激パラメータを決定するために、さまざまなアプローチが採用されています。このプロセスにおける重要なステップは、フィードバックとしてのニューロン応答のモニタリングであり、これは、カルシウムイオンイメージング4、光学イメージング1、およびex vivo電気生理学的記録(例えば、筋電図6または皮膚神経電気生理学7)などのイオンゲートモニタリングを含む方法によって達成することができる。しかし、これらの研究のほとんどは、ヒト以外のニューロンやin vivoアプローチを使用しているため、コントロールが最適ではないために、さらなるばらつきが生じる可能性があります。対照的に、電極を使用してin vitroヒト人工多能性幹細胞(HiPSC)ニューロンの神経シグナルを測定すると、より高感度な測定が可能になり、実験環境をより詳細に制御できます。本研究では、図1に示すように、微小電極アレイ(MEA)を用いて、FUS刺激後のHiPS細胞ニューロンの電気的応答を測定するin vitroシステムを開発しました。このシステムにより、コミュニティの研究者は、超音波パラメータ(周波数、バースト長、強度など)を変化させたときにニューロンの応答を監視できます。さらに、このシステムは、ニューロンのイオンチャネル機能を遺伝的および薬学的に操作できるため、物理的刺激(温度、圧力、キャビテーションなど)に対するニューロンの感受性を高度に制御することを可能にします8,9(例:イオンチャネルを阻害するためにガドリニウムを使用する)10,11,12。.この分子レベルの制御は、FUSの神経調節効果の背後にあるメカニズムの解明に役立つ可能性があります。
プロトコル
1. 資料の準備
- 培地を吸引し、それを使用して、MEAが埋め込まれた24ウェルニューロン培養プレートのシングルウェルを充填します(図2A)。Taga et al.13によって公開されたプロトコルに従ってニューロンを培養し、誘導します。
- パラフィルム界面、輪ゴムバンド、およびFUSコーンをゴム膜で70%エタノールを使用して10分間滅菌し、後で組み立てるためにドラフトに入れます。
- 300 mLの脱イオン水と50 mLのカップリングゲルを脱気します。カップリング媒体内のキャビテーションを誘発しないように、水とゲルを160 x g で5分間遠心分離します。
注:HiPS細胞の原産地は、GM01582細胞株およびCIPS細胞株です。平均して、ウェルあたり5 x 104 の運動ニューロンと2.5 x 104 のアストロサイトの密度を達成できます14。
2.周辺機器の接続とセットアップ
- ネジを使用してFUSコーンをトランスデューサーに固定し、換気された滅菌フード内の柔軟なゴム膜でコーンを密封します。ステップ1.3の脱気および脱イオン(DG-DI)水でコーンを満たし、キャビテーションを避けるためにコーン内に気泡がないことを確認します。
- カスタマイズされたネジ付きロッドを使用して、3Dプリントされたホルダーをフレームに固定します(図2B)。FUSトランスデューサーのヘッドが刺激されるウェルの上に来るようにフレームを配置します。
- 輪ゴムを使用して、培地とHiPS細胞を含む24ウェルMEAプレートのウェル上にパラフィルムを固定します。
- 超音波トランスデューサのバックエンドドライバエレクトロニクス(この場合はトランスデューサ電力出力(TPO; 図3A)、100〜240Vの電源コンセント(図3B、接続6)に接続し、マッチングネットワークをTPOおよびFUSトランスデューサ(図3B、それぞれ接続1および接続2)に接続します。マッチングネットワークにより、トランスデューサとTPO間の効率的な電気的結合が保証されます。
- MEAシステムを電源コンセント(100〜240 V)に接続します(図3B、接続5)。MEAシステム同期ポートをTPOに接続します(図3B、接続3)。この接続により、MEAシステムによるデータ収集がFUS刺激と同期されます。
- 24ウェルMEAプレートをMEAシステムに配置し、蓋を取り外して、探触子とウェルが直接接触できるようにします。ステップ5(図3.2 および 図2B)で説明したように、トランスデューサーをウェルプレートの上に10〜3.2 mm置き、脱気したカップリングゲルのためのスペースを確保します。
3. 刺激と神経信号の獲得
- TPOコントロールパネル(表1)でFUSパラメータを設定します。
- パラフィルムの上にカップリングゲルを塗布し、FUSトランスデューサーをカップリングゲルに下げて、気泡を最小限に抑えてゲルに接触させます(図2A)。
- ユーザーインターフェースの 「開始 」ボタンをクリックして、MEAシステムの記録を開始します。
- TPOの右下のボタンを押してFUS超音波処理を開始し(図3A、ラベル7)、超音波処理の各ラウンドの間に少なくとも5分間待って、ニューロンがベースライン状態に戻るようにします。
- FUSシステムによって生成されたトリガーパルスを使用して、FUS刺激シーケンスをMEA記録に合わせます(図3B、接続3)。
4. データ処理と分析
- USB接続を使用して、MEAシステムからコンピュータにデータを転送します(図3B、接続4)。まず、 実験 設定パネルをクリックします。次に、記録するデータタイプを選択します。この場合、生のスパイクが推奨されます。最後に、ファイルに名前を付け、ディスクドライブ内の目的の場所を選択して転送を完了します。
注: 次の手順は、リリースされた Python スクリプトを https://github.com/Rxliang/FUSNeuromod で実行することで実行できます。 - 16個の電極のそれぞれからデータを読み取ります。
- 帯域幅が 5 Hz から 3 kHz のバターワース次数が 8 のバタワース バンドパス フィルターを適用します。
注:これらの値を最適化するには、特定のセルの発火率と関連するセルの数を考慮することが重要です。これら2つの値を掛け合わせることで、実験における細胞集団の全体的な発火率を推定することができます。 - σ = 3 のガウス フィルターを適用して信号を平滑化します。
注:このパラメータは、過度の平滑化は集録後のデータの歪みを引き起こす可能性があり、平滑化が少なすぎると不要なノイズが発生するため、MEAシステムの推奨値に基づいて最適化できます。 - 潜在的なスパイクを検出するしきい値を、ガウス平滑化信号の標準偏差の 5 倍として設定します。
- 発火率を計算するには、16 チャネルすべてにわたって 50 ミリ秒のウィンドウに登録されたスパイクの数をウィンドウの長さ (つまり、50 ミリ秒) で割ります。信号に沿ってウィンドウを次のフレームにシフトし、発火率の計算を繰り返します(補足図1)。
- FUSに関連する発火率の変化に基づいて、転送されたデータからFUS超音波処理時間を読み取ることにより、信号を解析する。
5. マルチウェルMEAプレートの洗浄と再利用
- 実験が完了したら、ピペットを使用して、電極表面に注意しながら、マルチウェルプレートのウェルから培地を慎重に除去します。
- ウェルごとに2 mLのDG-DI水を追加します。吸引し、1回繰り返します。
- 細胞や破片を取り除くには、1 gの酵素界面活性剤Terg-A-Zymeと10 mLの滅菌DG-DI水(ウェルあたり0.3 mL)の混合物をプレートに加えます。室温(RT)で一晩インキュベートします。
- 翌日、ウェルから溶液を取り出し、1 mLの滅菌DG-DI水ですすいでください。
- マルチウェルプレートを5〜7分間インキュベートし、吸引します。この手順を 5 回繰り返します。
- ウェルあたり0.5 mLの滅菌DG-DI水を加えます。洗浄したマルチウェルプレートのベースラインを記録して、MEAプレートが洗浄されていることを検証します。洗浄されたプレートは、強度値が低いガウスノイズパターンを示すはずです。
- 洗浄したマルチウェルプレートは、再び使用する準備ができるまで4°Cで保管してください。MEAが保管されている水は、少なくとも月に一度は交換してください。
結果
要約すると、HiPS細胞から培養したニューロンを使用してin vitro FUSニューロモデュレーションモニタリングを可能にするプロトコルを提示します。HiPS細胞誘導ニューロンを刺激し、それに対応する電気的応答を記録して解析するためのシステム全体のプラットフォームを 図1に示します。本研究では、 図2に示すように、ニューロンのFUS刺激とMEAシステムにおける電気的応答の記録に焦点を当てています。FUSおよびMEAシステムの周辺部品とその接続を 図3に示します。
焦点の特性評価は、ニューロン実験の前に行われ、ウェルの底がFUS焦点で完全に覆われていることを確認します。図4に示すように、サーモクロミックシート上の焦点の可視化は、FUSシステムを評価するために実行する必要があります。焦点スポットの特性評価に続いて、フィルタリング、閾値処理、発火率の計算などの後処理ステップを実行する必要があり、これらを図5と図6にまとめます。これらのステップは、環境からノイズをフィルタリングして有用な信号を取得し、FUSによって引き起こされるニューロン活動の変化に関する洞察を得るために不可欠です。図6A-Bのラスタープロットは、各チャンネルで検出されたスパイクを示しています。ウェルの底全体がFUSトランスデューサの焦点内にあるため、FUSはすべての電極の発火率を変更することが期待されます。この発火率の変化は、図6Cに示す発火率プロットで視覚化されており、選択された刺激パラメータがニューロンの発火率の増加をもたらしたことを示しています。具体的には、FUS前(ベースライン)の発火率は140Hz±116.7Hzであったのに対し、FUS後の発火率は連続波FUSで786Hz±419.4Hzであった。さらに、図6Cは、FUSパラメータを変更する(例えば、連続波の代わりにパルス波FUSを使用する)ことで、発火率の変化の大きさが変わり、ニューロンがベースライン状態に戻るまでの時間が変化することを示しています。低強度焦点式超音波(LIFU)は、特に熱病変を達成することを目的とした高強度焦点式超音波と比較した場合、培養物の著しい温暖化を引き起こさない。臨床的に影響のある温度変化がないことは、理論計算とシミュレーションによって裏付けられています(補足図2)。表1にリストされている実験的FUSパラメータの極端なケースでも、約0.04°Cの最小限の温度上昇しか観察できませんでした。
発火率プロットの使用により、FUSの神経調節効果の定量化が可能になり、興奮性応答と抑制性応答を区別するために使用できます。マルチウェルMEAプレートの大きな利点は、さまざまなニューロンの状態や刺激パラメータをハイスループットで研究するために複数回再利用できることです。
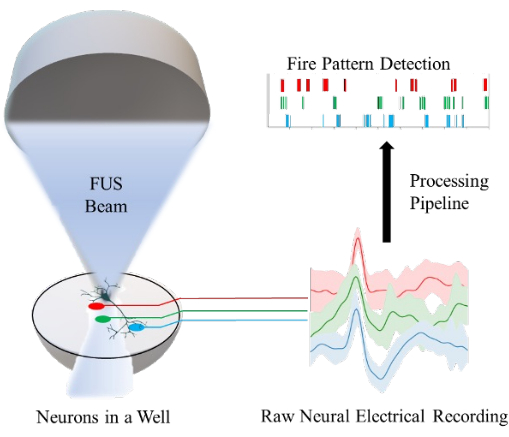
図1:ウェル内のニューロンの集束超音波(FUS)ニューロモデュレーションと、微小電極アレイを使用したニューロン活動の測定のための in vitro プラットフォームの概要。 各電極(赤、緑、青の線)は、1つのウェル内のニューロンの集団から記録します。処理パイプラインは、生のニューロンの電気的記録をニューロンの発火パターンの検出に変換するために実装されます。 この図の拡大版をご覧になるには、ここをクリックしてください。

図2:マルチウェル微小電極アレイ(MEA)によるFUSニューロモデュレーション。 (A)マルチウェルMEAによるFUSニューロモデュレーションのセットアップの概略図。FUSトランスデューサによって生成された音波は、脱気水で満たされたFUSコーンを伝搬し、超音波ゲルを使用して結合されます。パラフィルムは輪ゴムでウェルに固定され、コンタミネーションを防止します。MEAプレートは、ニューロンからMEAシステムに電気的記録を送信します。(B)MEAシステムに含まれるマルチウェルプレート上のFUSトランスデューサの写真。 この図の拡大版をご覧になるには、ここをクリックしてください。

図3: In vitro プラットフォームのセットアップ。 (A) in vitro プラットフォームセットアップの前面。トランスデューサの電力出力(TPO、左)は、FUSパラメータのプログラムに使用されます。MEAシステム(右)は、FUSトランスデューサによってニューロモジュレートされたウェルプレート内のニューロンからの電気的活動を記録します。(B)マッチングネットワーク(1)からTPOへ、および(2)トランスデューサへの接続を備えた in vitro プラットフォームセットアップの背面。(3)MEAシステムからTPOへの接続により、データ収集が同期されます。(4)データ転送のためのMEAシステムからコンピューターへの接続。(5)MEAシステムへの電源接続。(6)FUSシステムへの電源接続。(7)超音波処理ボタン。 この図の拡大版をご覧になるには、ここをクリックしてください。
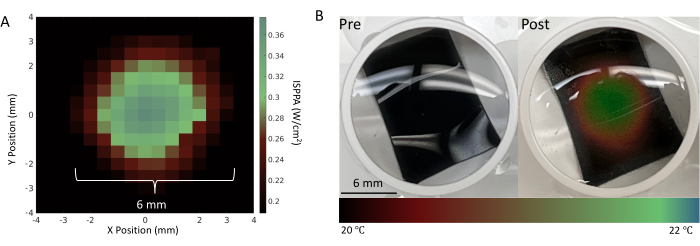
図4:FUSトランスデューサの特性評価。 (a)振幅システム15によって測定された表1に詳述されたFUSパラメータを用いた焦点の圧力マップ。(B)図3に示す実験セットアップを使用して、ウェルの底に置かれたサーモクロミックシートの超音波処理前および超音波処理後。サーモクロミックシートは温度変化に反応して色が変化するため、ニューロンの位置で刺激が成功したことを視覚的に確認することができます。30W/cm2の最大空間ピークパルス平均強度(ISPPA)および3分間の連続超音波処理を調整して、局所温度を大幅に変化させ、そのような焦点をよりよく視覚化した。この図の拡大版をご覧になるには、ここをクリックしてください。
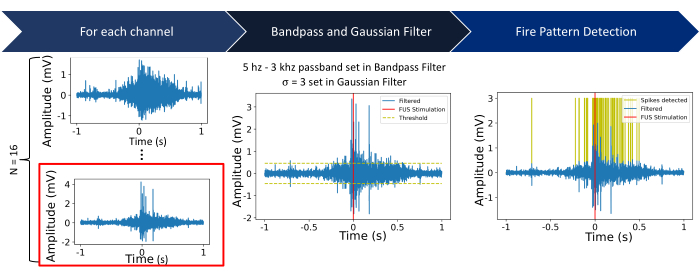
図5:処理パイプライン ステップ1:生の電気録音は、N = 16チャンネルからキャプチャされます。以降の手順では、チャネル 16 (赤で囲まれた部分) を使用したプロセスを示します。ステップ2:各チャンネルにバターワースバンドパスフィルタ(5 Hz〜3 kHzバンドパス)を適用し、その後にガウスフィルタ(σ = 3)を適用します。閾値は、超音波処理の開始を中心とする2秒のウィンドウ内の信号の標準偏差の5倍として設定される。ステップ3:スレッショルドを上回ったり下回ったりする信号は、スパイクとして特徴付けられます。 この図の拡大版をご覧になるには、ここをクリックしてください。
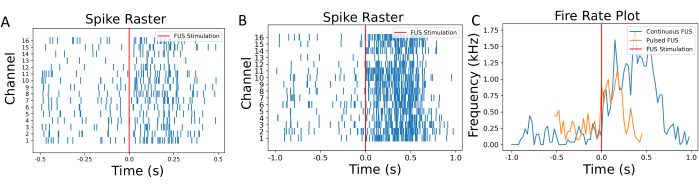
図6:ラスターと発火率のプロット。 (A)超音波処理時間の関数として各チャネルで検出されたスパイクのラスタープロット。FUS刺激の時間は、赤い線で注釈が付けられています。(B)比較のために、異なるFUS設定の下でのニューロンのラスタープロット。(C)発火速度は、50msのスライディングウィンドウを使用して計算しました。FUSニューロモデュレーション前と後の平均発火率は、それぞれ140Hzと786Hzでした。パルスFUSでは、平均発火速度は230Hzと540Hzでした。活性化が短く、速度変化が少ないことが、この一連のさまざまなFUS刺激によって誘発されることが観察されました。発火率を計算するプロセスは、 補足図1に詳述されています。 この図の拡大版をご覧になるには、ここをクリックしてください。
| パラメーター | 価値 |
| 最大出力/チャンネル | 1.200ワット |
| P実際 | 0.749 W /チャネル。 |
| 私はSPPAの | 10.79 W/cm2 |
| 私はSPTAの | 0.05 W/cm2 |
| バースト長(Burst Length) | 0.100ミリ秒 |
| 周波数 | 250.00 kHzの |
| 焦点 | 39.800ミリメートル |
| 時代 | 20.000ミリ秒 |
| タイマー | 60.000秒 |
表1: 図4に示す研究のためにTPOに設定された集束超音波(FUS)パラメータ。
補足図1:ラスタープロットから発火率への処理。 ステップ1:すべてのチャネルのスパイクをカウントして、特定のスライディングウィンドウ内のカウント数を取得します。注: ここでは、説明しやすいように、より大きなスライディング ウィンドウ(0.1 秒に設定)を選択しました。ステップ2:ウィンドウ長あたりのスパイクを毎秒のスパイクに変換します(たとえば、ここでは、カウントに10を掛けてヘルツ[Hz]に変換し、次に1,000で割ってキロヘルツ[kHz]単位の値を取得します)。ステップ3:結果として取得された発火率曲線。オープンソースのツールキットとサンプルデータは、GitHub(https://github.com/Rxliang/FUSNeuromod)で入手できます。 このファイルをダウンロードするには、ここをクリックしてください。
補足図2:LIFU16のK波シミュレーション結果温度プロファイル。図4に示した音響インテンシティマップに基づき、表1に挙げた実験的FUSパラメータの極端なケースを用いて、K波シミュレーションの結果は、焦点ゾーン(半径:2mm)の中心領域内で最大0.04°Cの温度上昇を示唆しています。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
この論文では、FUSニューロモジュレーション中のHiPS細胞のニューロン活動を記録するために使用できる新しい方法について説明しています。このプロトコルは、さまざまなFUSトランスデューサやMEAシステムに一般化できます。記載されたプロトコルで観察された結果を再現するには、研究者はトランスデューサーの焦点がMEAウェルの底部の面積よりも大きいことを確認する必要があります。さらに、異なる神経細胞株を使用する場合は、フィルターパラメータをウェル内の細胞の予想される周波数応答に調整する必要があります。代表的な結果が得られない場合は、前述のパラメータ(バースト長、強度、デューティサイクルなど)の変更を検討する必要があります。
この研究は、FUS刺激後の発火率の増加を実証したが、結論を出す前に、この発見の再現性を実証するために、より多くのデータを収集する必要がある。このプロトコルは、通常、微小電極電流信号の直接記録に起因する弱点を持つMEAシステムの制限を受け継いでいます。ニューロンに直接触れると感度は向上しますが、細胞が変化し、測定精度に影響を与える可能性があります。さらに、ウェルのサイズが小さいため、我々のシステムには末梢組織が含まれておらず、これも神経調節に関与している可能性がある17。これにより、このセットアップから導き出された結論の in vivo 環境への適用が制限される可能性があります。より複雑なネットワーク応答を研究するには、より高チャネル密度のMEAシステムを設計して感度を向上させる必要があります18。この提案されたシステムのためのいくつかの将来の方向性が特定されており、その中には、トランスデューサを保持し、正確な配置を確実にするための3Dガントリーの使用が含まれる19。個々のニューロンを分類するためにスパイクソーティングアルゴリズム20 を利用することを含む、後処理アルゴリズムに関してさらなる改善がなされ得る。このプロセスは、FUSのメカニズムに関する将来の研究において、マルチユニットニューロンの応答を解きほぐすのに有益です。最も重要なことは、そのメカニズムを解明するために、化学的刺激、電気的刺激、光学的刺激などの刺激のモダリティを追加することが不可欠です。これらの方法は、特異的イオンチャネル15 を阻害したり、膜特性21を修飾したりするなどして、ニューロンの特性および挙動を変化させることができる。仮説を立てたシグナル伝達経路内の主要な因子を調節することにより、研究者は制御された環境における各因子の寄与を特定し、最終的には複雑な相互作用に光を当てることができます。
電気刺激22 は、神経調節のための最も確立された技術の1つであり、臨床および研究の現場での応用に成功した長い歴史があります。対照的に、FUSとオプトジェネティクス23 は、近年注目を集めている比較的新しいモダリティです。FUSの主な利点は、その非侵襲性と、電気刺激やオプトジェネティクスなどの他の技術では到達が困難な深さのニューロンを刺激する能力です。ただし、オプトジェネティクス24と同様に、FUSには、波の伝播と関連するニューロン応答のモデル化に関連するいくつかの制限があります。生体 内で 組織の不均一な音響特性の複雑さを捉えることは困難な場合があり、圧力場、ひいてはニューロンの応答に不確実性をもたらします。これらの特性を正確にモデル化することの難しさは、特定の現実世界のアプリケーション向けに技術を最適化する際の課題となります。本質的な複雑さは、制御された音響強度条件下での応答の直接的な研究を可能にするため、この研究のような in vitro システムの重要性を強調しています。
結論として、このシステムは、ヒトニューロンに対するFUSの神経調節効果を研究するためのハイスループットな in vitro プラットフォームを提供します。このシステムでは、制御された環境でさまざまなレベルと種類の刺激にさらされたときのヒトニューロンからの電気的応答を測定することにより、FUSの作用機序を調べることができます。したがって、この分野で一般的に使用されるヒトおよび動物モデルに貴重な補助ツールを提供します。
開示事項
著者らは、この研究は、潜在的な利益相反と解釈される可能性のある商業的または金銭的関係がない状態で実施されたと宣言しています。Amir Manbachiは、BK Medical(GE Healthcare)とNeurosonics Medicalで教鞭を執り、コンサルティングを行っており、特許出願中の多くのFUS技術の発明者でもあります。ベティ・タイラーはNIHから研究資金を受けており、Accelerating Combination Therapies(エクイティまたはオプションを含む)の共同所有者です。Ashvattha Therapeutics Inc.は、彼女の特許の1つをライセンス供与しており、彼女はPeabody Pharmaceuticalsの株主です。
謝辞
Amir Manbachi と Nitish Thakor は、国防高等研究計画局 (DARPA N660012024075) からの資金援助に感謝しています。さらに、アミール・マンバチは、米国国立衛生研究所(NIH)の国立トランスレーショナルサイエンス推進センター(NCATS)が運営するジョンズ・ホプキンス大学臨床トランスレーショナルリサーチ研究所(ICTR)の臨床研究奨学生プログラム(KL2)からの資金援助に感謝しています。Nitish Thakorは、米国国立衛生研究所(NIH)からの資金援助(R01 HL139158-01A1およびR01 HL071568-15)に感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| MEA System | Axion Biosystem Inc. | Maestro Edge | Sampling Rate: 11500 Hz |
| MEA Plate | Axion Biosystem Inc. | CytoView MEA | Electrode and Well: 16 electrodes in 24 wells |
| Well plate Interface | Amcor Inc. | Parafilm PM996; P7793 | Thickness: 127 µm |
| CO2 Tank and Regulator for culture | AirGas Inc./ Harris Inc. | 9296NC | Concentration: 5% |
| Culture Media | ThermoFisher Inc. | Laminin; 23017-015 | Concentration: 1 µg/mL |
| HiPSC Neurons | Peprotech | CIPS and GM01582 Derived; 450-10 | Concentration: 10 ng/mL (Refer Taga et al [2021]13) |
| Transducer | Sonic Concepts Inc. | CTX250; 008 | Center Frequency: 250 kHz |
| Matching Network | Sonic Concepts Inc. | CTX250; NFS102v2 | Impedance: 50 Ω |
| Transducer Power Output (TPO) | Sonic Concepts Inc. | Version 4.1; 020 | Frequency: From 250 kHz to 2.5 MHz |
| Membrane | McMaster Inc. | Silicone Rubber; 5542N115 | Thickness: 0.0127 cm |
| Coupling Gel | Parker Laboratory Inc. | Aquasonic 100; B08DDWG GXB | Viscosity: 130,000–185,000 cops |
| Connection to Probe holder | McMaster Inc. | Steal Threaded Rod; 90322A661 | Length: 1–1/2" Long |
| Centrifuge | ThermoFisher Inc. | Sorvall Legend X1R; 75004261 | Max acceleration: 10–25,830 x g |
| Hydrophone | Sonic Concepts Inc. | Y-104; 009 | Range: 50 kHz–1.9 MHz |
| Water Tank | Sonic Concepts Inc. | WT | Size: 30 cm x 30 cm x 30 cm |
| Water Conditioning Unit | Sonic Concepts Inc. | WCU; SN006 | Flow Velocity: 50 mL/s maximum |
| Oscilloscope | Rohde-Schwarz Inc. | RTC1002 | Sampling rate: Up to 50 MHz |
| Stage | Sonic Concepts Inc. | MicroStage; 2 | Accuracy: 1 µm |
| Thermochromic sheet | TIPTEMP Inc. | Liquid Crystal Sheet; TLCSEN337 | Range: 22–24 °C |
| Computer | Microsoft Surface | Surface Pro | CPU i5 1035G4: 3.7 GHz |
| Data Transfer Software | Mathworks Inc. | MATLAB | Version 2021b |
| Processing Software | Python Software Foundation | Python | Version 3.7.10 |
参考文献
- Kamimura, H. A. S., Conti, A., Toschi, N., Konofagou, E. E. Ultrasound neuromodulation: Mechanisms and the potential of multimodal stimulation for neuronal function assessment. Frontiers in Physics. 8, 150 (2020).
- Manbachi, A., Kempski, K. M., Curry, E. J. . The Abundant Promise of Ultrasound in Neurosurgery: A Broad Overview and Thoughts on Ethical Paths to Realizing Its Benefits. , (2022).
- . Handbook for Clinical Ultrasound.Beginner's Guide to Fundamental Physics & Medical Ultrasound Applications. Audible Available from: https://www.audible.com/pd/Handbook-for-Clinical-Ultrasound-Audiobook/B0983XJY83 (2021)
- Yoo, S., Mittelstein, D. R., Hurt, R. C., Lacroix, J., Shapiro, M. G. Focused ultrasound excites cortical neurons via mechanosensitive calcium accumulation and ion channel amplification. Nature Communications. 13 (1), 493 (2022).
- Szczot, M., Nickolls, A. R., Lam, R. M., Chesler, A. T. The form and function of PIEZO2. Annual Review of Biochemistry. 90, 507-534 (2021).
- Kim, H., et al. Miniature ultrasound ring array transducers for transcranial ultrasound neuromodulation of freely-moving small animals. Brain Stimulation: Basic, Translational, and Clinical Research in Neuromodulation. 12 (2), 251-255 (2019).
- Hoffman, B. U., et al. Focused ultrasound excites action potentials in mammalian peripheral neurons in part through the mechanically gated ion channel PIEZO2. Proceedings of the National Academy of Sciences of the United States of America. 119 (21), e2115821119 (2022).
- Tyler, W. J. The mechanobiology of brain function. Nature Reviews Neuroscience. 13 (12), 867-878 (2012).
- Collins, M. N., Legon, W., Mesce, K. A. The inhibitory thermal effects of focused ultrasound on an identified, single motoneuron. eNeuro. 8 (2), (2021).
- Chalfie, M. Neurosensory mechanotransduction. Nature Reviews. Molecular Cell Biology. 10 (1), 44-52 (2009).
- Launay, P., et al. TRPM4 Is a Ca2+-activated nonselective cation channel mediating cell membrane depolarization. Cell. 109 (3), 397-407 (2002).
- Cain, S. M., Snutch, T. P. Contributions of T-type calcium channel isoforms to neuronal firing. Channels. 4 (6), 475-482 (2010).
- Taga, A., et al. Establishment of an electrophysiological platform for modeling ALS with regionally-specific human pluripotent stem cell-derived astrocytes and neurons. Journal of Visualized Experiments. (174), e62726 (2021).
- Taga, A., et al. Role of human-induced pluripotent stem cell-derived spinal cord astrocytes in the functional maturation of motor neurons in a multielectrode array system. Stem Cells Translational Medicine. 8 (12), 1272-1285 (2019).
- Manuel, T. J., et al. Ultrasound neuromodulation depends on pulse repetition frequency and can modulate inhibitory effects of TTX. Scientific Reports. 10 (1), 15347 (2020).
- Treeby, B. E., Cox, B. T. k-wave: Matlab toolbox for the simulation and reconstruction of photoacoustic wave fields. J. Biomed. Opt. 15 (2), 021314 (2010).
- Akhtar, K., et al. Noninvasive peripheral focused ultrasound neuromodulation of the celiac plexus ameliorates symptoms in a rat model of inflammatory bowel disease. Experimental Physiology. 106 (4), 1038-1060 (2021).
- Smirnova, L., et al. Organoid intelligence (OI): The new frontier in biocomputing and intelligence-in-a-dish. Frontiers in Science. 1, 1017235 (2023).
- Saccher, M., et al. Focused ultrasound neuromodulation on a multi-well MEA. Bioelectronic Medicine. 8 (1), 2 (2022).
- Yger, P., et al. A spike sorting toolbox for up to thousands of electrodes validated with ground truth recordings in vitro and in vivo. eLife. 7, e34518 (2018).
- Babakhanian, M., et al. Effects of low intensity focused ultrasound on liposomes containing channel proteins. Scientific Reports. 8, 17250 (2018).
- Liang, R., et al. Designing an Accurate Benchtop Characterization Device: An acoustic measurement platform for localizing and implementing therapeutic ultrasound devices and equipment (amplitude). 2022 Design of Medical Devices Conference. , (2022).
- Ko, H., Yoon, S. -. P. Optogenetic neuromodulation with gamma oscillation as a new strategy for Alzheimer disease: A narrative review. Journal of Yeungnam Medical Science. 39 (4), 269-277 (2022).
- White, M., Mackay, M., Whittaker, R. G. Taking optogenetics into the human brain: Opportunities and challenges in clinical trial design. Open Access Journal of Clinical Trials. 2020, 33-41 (2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved