È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Caricamento di merci su Kinesin Navette Powered molecolare
In questo articolo
Riepilogo
Navette molecolari costituiti da microtubuli funzionalizzati scivolando sulla superficie aderito chinesina proteine motore può servire come sistema di trasporto su scala nanometrica. Qui, l'assemblaggio di un sistema di navetta tipico è descritto.
Abstract
Le cellule hanno sviluppato sofisticate macchine molecolari, come chinesina proteine motrici e filamenti di microtubuli, al sostegno attivo di trasporto intracellulare di carico. Mentre kinesins coda dominio si lega ad una varietà di carichi, domini testa kinesins utilizzare l'energia chimica immagazzinata nelle molecole di ATP per passo lungo il reticolo microtubuli. Il lungo e rigido microtubuli fungono da piste per lunghe distanze di trasporto intracellulare.
Questi motori e filamenti possono anche essere impiegati in microfabbricazione ambienti sintetici come componenti di navette molecolari 1. In un progetto di uso frequente, i motori chinesina sono ancorati alla superficie della pista con la coda, e microtubuli funzionalizzate servire come elementi costitutivi di trasporto merci, che sono spinti da questi motori. Queste navette possono essere caricati con il carico utilizzando il legame forte e selettiva tra biotina e streptavidina. I componenti chiave (tubulina biotinilato, streptavidina, e carico biotinilato) sono disponibili in commercio.
Sulla base del classico saggio motilità invertita 2, la costruzione di navette molecolari è dettagliata qui. Chinesina proteine motrici sono assorbiti da una superficie coperte con caseina; microtubuli sono polimerizzati da tubulina biotinilato, ha aderito al chinesina e successivamente rivestito con streptavidina marcata con rodamina. La concentrazione di ATP è mantenuto a concentrazione subsaturating di raggiungere una velocità ottimale microtubulo scorrimento per il carico merci 3. Infine, biotinilato marcato con fluoresceina nanosfere vengono aggiunti come merce. Nanosfere allegare ai microtubuli a causa di collisioni tra microtubuli volo a vela e nanosfere aderire alla superficie.
Il protocollo può essere facilmente modificato per caricare una varietà di carichi come il DNA biotinilato 4, 5 o quantum dots una vasta gamma di antigeni tramite anticorpi biotinilati 4-6.
Protocollo
1.) Tamponi e reagenti
Queste soluzioni dovrebbero essere preparate in anticipo e conservato in aliquote comodamente dimensioni. Una aliquota dovrebbe contenere soluzione sufficiente per un tipico esperimento e una nuova aliquota dovrebbe essere utilizzato per ogni dosaggio motilità. Le condizioni di conservazione e le dimensioni aliquota tipici sono menzionati anche i seguenti protocolli.
1. BRB80 tampone, (80 TUBI mM, 1 mM MgCl 2, 1 mM EGTA in deionizzata distillata (gg) l'acqua, pH regolato a 6,9 con KOH)
- Portare a 100 mL di soluzione madre di 0,5 M EGTA in acqua gg. Regolare il pH a 7,0 con 2 M NaOH.
- Portare a 100 mL di soluzione madre 1 M MgCl 2 in acqua gg. Autoclave la soluzione.
- Aggiungere 24,2 g di TUBI e 3,1 g pellet KOH in circa 800 ml di acqua dd e mescolare per sciogliere. Regolare il pH a 6,9 con 1 M soluzione di KOH. Aggiungere 2 ml di soluzione 0,5 M EGTA magazzino e 1 ml di 1 M MgCl 2 soluzione madre. Portare il volume a 1000 ml con acqua dd.
- Aliquota in 50 mL tubi falco e congelare a -20 ° C per un uso futuro. Il tubo BRB80 attualmente in uso può essere conservato a 4 ° C oa temperatura ambiente.
2. Cloruro di magnesio, MgCl 2 (100 mM in acqua gg)
- Diluire in acqua dd per ottenere una concentrazione finale di 100 mm.
- Aliquota (10 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro
3. Guanosina-5'-trifosfato, sale disodico, GTP (25 mM gg acqua, pH regolato a 7 da NaOH)
- Pesare e si sciolgono in acqua dd e regolare il pH a 7 per soluzione 2 M di NaOH.
- Verificare la concentrazione di misurare l'assorbanza UV a 260 nm. (Utilizzare un coefficiente di estinzione di 11,7 x 103 M -1 cm -1).
- Aliquota (10 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
4. Dimetil solfossido, DMSO
- Aliquota (10 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
5. Taxol (1 mM in DMSO)
- Pesare e si dissolvono in DMSO sotto cappa d'aspirazione a raggiungere una concentrazione finale di 1 mm.
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
6. D-(+)-glucosio, (2 M in acqua gg)
- Pesare e si sciolgono in acqua dd per ottenere una concentrazione finale di 2 M.
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
7. Glucosio ossidasi, (2 mg / ml in BRB80)
- Sciogliere in BRB80 per ottenere una concentrazione finale di 2 mg / ml.
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
8. Ditiotreitolo, DTT (1 M gg acqua)
- Sciogliere in acqua gg sotto cappa d'aspirazione a raggiungere una concentrazione finale di 1 M.
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
9. Catalasi, (0,8 mg / ml in BRB80)
- Sciogliere in BRB80 in almeno 2 fasi per ottenere una concentrazione finale di 0,8 mg / ml. Determinare la concentrazione in ogni fase di misurare l'assorbanza UV a 276 nm e 406 nm (Utilizzare un coefficiente di estinzione di 3,1 x 10 5 M -1 cm -1 a 276 nm e 2,2 x 10 5 M -1 cm -1 a 406 nm e l'equazione A = cL).
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
10. Adenosina-5'-trifosfato, ATP (100 mM a 100mM MgCl 2)
- Preparare una soluzione stock di mM MgCl 100 2 gg in acqua. Pesare polvere secca e si dissolvono in questa soluzione, per ottenere una concentrazione finale di 100 mm.
- Verificare la concentrazione di misurare l'assorbanza UV a 260 nm. (Utilizzare un coefficiente di estinzione di 15,4 x 10 3 M -1 cm -1).
- Aliquota (20 volumi mL) in provette da 0,5 ml microcentrifuga e conservare a -20 ° C per un uso futuro.
11. Caseina soluzione (20 mg / mL caseina in BRB80)
- Aggiungere circa 3 g di caseina e 30 ml di acqua gg in un tubo da 50 ml falco. Vortex per circa 1 ora fino a quando la soluzione si sviluppa consistenza densa.
- Centrifugare a 15000 g per circa 30 minuti. Filtrare il surnatante con 0,5 micron e 0,2 micron filtri per siringa.
- Determinare la concentrazione del supernatante di misurare l'assorbanza UV a 280 nm (Utilizzare un coefficiente di estinzione di 0,67 centimetri ml mg -1 -1). Diluirlo a 20 mg / ml in BRB80.
- Aliquota (20 volumi mL) inper tubi da microcentrifuga da 0,5 ml e conservare a -20 ° C per un uso futuro.
2.) Soluzioni standard
Questi sono preparati il giorno dell'esperimento e deve essere eliminata dopo l'esperimento è finito. Preparare 1 ml di ciascuna.
1. BRB80CS0.5
- Soluzione diluita di caseina in BRB80 ad una concentrazione finale di 0,5 mg / ml e memorizzare sul ghiaccio. Questa soluzione viene introdotto nella cella di flusso prima di chinesina e aiuta a mantenere l'attività dopo chinesina superficie di adsorbimento.
2. BRB80CA
- Preparare 0,2 mg / ml caseina e 1 mM ATP in BRB80 e memorizzare sul ghiaccio. Chinesina è ulteriormente diluita utilizzando questa soluzione prima introduzione nella cella di flusso.
3. BRB80T
- Soluzione diluita di taxolo in BRB80 ad una concentrazione finale di 10 mM e conservare a temperatura ambiente. Questa soluzione viene utilizzata per stabilizzare i microtubuli.
4. BRB80CT
- Preparare 10 taxolo mM e 0,2 mg / ml di caseina in BRB80 e conservare a temperatura ambiente. Questo è utilizzato per preparare ulteriormente il Antifade e soluzioni microtubuli.
5. BRB80AF
- Preparare 20 mM D-glucosio, 20 mg / ml glucosio ossidasi, 8 mg / mL catalasi, 10 mM DTT, e 20 mM ATP in BRB80CT e conservare a temperatura ambiente. Questa soluzione viene utilizzata per diluire streptavidina e nanosfere e "lavare via" la streptavidina in eccesso nella cella di flusso. La velocità chinesina può essere controllata regolando la concentrazione di ATP in questa soluzione.
3.) Kinesin Preparazione
- Esprimere una chinesina costruire costituito dalla wild-type, full-length catena Drosophila melanogaster chinesina pesanti e un C-terminale His-tag in Escherichia coli e purificare con un Ni-NTA colonna, come descritto al punto 6.
- Fai aliquote (10 L ciascuno) in tubi da microcentrifuga da 0,5 ml e conservare a -80 ° C per un uso futuro. La concentrazione di chinesina attivi in queste aliquote è di circa 200 nM 7.
- Per un tipico esperimento, diluire la soluzione chinesina 20 volte in BRB80CA. Etichettare il KIN20 soluzione e memorizzare sul ghiaccio.
4.) Microtubuli Preparazione
- In un tubo da microcentrifuga 0,5 ml, preparare 25 ml di soluzione di crescita: 4 mM MgCl 2, 1 mM GTP e 5% DMSO (v / v) in BRB80 buffer.
- Aggiungere 6,25 ml di questa soluzione per un'aliquota di 20 mg di liofilizzato tubulina biotinilato.
- Vortex, poi posto in un bagno di calore a 37 ° C per 30 minuti per polimerizzare. Diluire 100-volte in BRB80T vortice e delicatamente. Etichettare il MT100 soluzione e conservare a temperatura ambiente.
- Fai una diluizione di 10 volte MT100 in BRB80AF. Etichettare il MT1000 soluzione.
5.) Streptavidina e Nanosphere Solution
Preparare AlexaFluor568 streptavidina marcata ad una concentrazione di 100 nM in BRB80AF. Etichettarla STV100 e memorizzare sul ghiaccio. Allo stesso modo, diluire nanosfere 5000 volte in soluzione BRB80AF. Etichettarla NS5000 e memorizzare sul ghiaccio.
6.) Flusso costruzione cellulare
Costruire una cella di flusso utilizzando due coprioggetto di vetro separate da nastro biadesivo. Questa cella di flusso è di circa 2 cm di lunghezza, 1 cm di larghezza e 100 micron alto, e ha un volume di circa 20 l. Le soluzioni sono introdotti nella cella di flusso da un lato con una pipetta e fuori malvagio dall'altro utilizzando carta da filtro.
7.) Assemblea Saggio invertito
Superficie del vetro viene prima rivestita con la caseina che consente chinesina di mantenere la sua funzionalità su adsorbimento. Dopo kinesina è assorbito, microtubuli sono introdotti, che sono detenuti da cinesina. I microtubuli sono poi rivestiti con streptavidina fluorescenti. Dopo aver lavato i streptavidina eccesso, biotinilato polistirolo fluoresceina nanosfere (40 nm di diametro) vengono introdotti. Superficie nanosfere adsorbito stazionario si scontrano con i microtubuli in movimento e vengono caricate su di loro (Figura 1).
L'ordine del flusso di soluzioni e di tempo concesso prima dell'introduzione della soluzione successiva sono elencati di seguito.
- BRB80CS0.5, a 5 minuti
- KIN20, a 5 minuti
- MT1000, a 5 minuti
- STV100, a 5 minuti
- BRB80AF, 3x
- NS5000
8.) Microscopia
Montare la cella di flusso sul palco subito dopo l'introduzione del microscopio nanosfere. In questo esperimento, un TE2000-U Eclipse microscopio a fluorescenza (Nikon, Melville, NY) dotata di un obiettivo olio 100X (NA 1,45), una X-Cite 120 lampada (EXFO, Ontario, Canada) e un ixon EMCCD fotocamera (ANDOR, South Windsor, CT) è stato utilizzato. Un filtro FITC cubo (# 48001) e un cubo TRITC filtro (# 48002, Tecnologie Chroma, Rockingham, VT) sono stati utilizzati per nanosfere immagine e microtubuli respectivamente sulla superficie inferiore di celle di flusso. Il tempo di esposizione è stato 0.2s, mentre il tempo tra le esposizioni è stato 2 s.
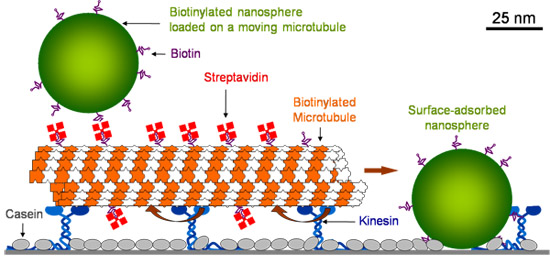
Figura 1. Schema del navette molecolari.
Discussione
Con piccole modifiche, questo protocollo è stato usato con successo da una varietà di gruppi di assemblare chinesina-microtubuli saggi motilità base. DTT 10 mM nella soluzione motilità finale può essere sostituito con lo 0,5% β-mercaptoetanolo. Soluzioni standard (BRB80AF, KIN20 e MT1000) più di 2 ore di vita non deve utilizzare. Qualsiasi soluzione contenente microtubuli taxolo e soprattutto non devono mai essere posti su ghiaccio. L'eccessiva esposizione della cella di flusso ai risultati UV luce di eccitaz...
Divulgazioni
Riconoscimenti
Siamo fortemente indebitati a Jonathon Howard, il cui gruppo ha sviluppato il protocollo di base per un test di volo a vela motilità che è stato successivamente adattato da noi. Il sostegno finanziario NSF concedere DMR0645023 Si ringrazia.
Materiali
| Name | Company | Catalog Number | Comments |
| Adenosine-5’-triphosphate (ATP) | Invitrogen | A1049 | |
| Biotin tubulin | Cytoskeleton, Inc. | T333 | |
| Casein | Sigma-Aldrich | C-0376 | |
| Catalase | Sigma-Aldrich | C-9322 | |
| D-(+)-Glucose | Sigma-Aldrich | G-7528 | |
| Dimethylsulfoxide (DMSO) | Sigma-Aldrich | D-8779 | |
| Dithiotreitol (DTT) | Bio-Rad | 161-0610 | |
| Ethylene glycol-bis(2-amin–thylether)-N,N,N′,N′-tetraacetic acid (EGTA) | Sigma-Aldrich | E-4378 | |
| FluoSpheres Biotinylated microspheres, 40 nm, yellow-green fluorescent (505/515) | Invitrogen | F-8766 | |
| Glucose oxidase | Sigma-Aldrich | G-7016 | |
| Guanosine-5’-triphosphate (GTP) | Roche Group | 106399 | |
| Magnesium Chloride (MgCl2) | Sigma-Aldrich | 63069 | |
| Paclitaxel (Taxol) | Sigma-Aldrich | T1912 | |
| 1,4-Piperazinediethanesulfonic acid, Piperazine-1,4-bis(2-ethanesulfonic acid), Piperazine-N,N′-bis(2-ethanesulfonic acid) (PIPES) | Sigma-Aldrich | P-6757 | |
| Potassium hydroxide (KOH) | Sigma-Aldrich | P-6310 | |
| Sodium hydroxide (NaOH) | Sigma-Aldrich | 480878 | |
| Streptavidin Alexa Fluor 568 conjugate | Invitrogen | S11226 |
Riferimenti
- Agarwal, A., Hess, H. Biomolecular motors at the intersection of nanotechnology and polymer science. Progress in Polymer Science. 35 (1-2), 252-252 (2010).
- Howard, J., Hunt, A. J., Baek, S. Assay of microtubule movement driven by single kinesin molecules. Methods Cell Biol. 39, 137-137 (1993).
- Agarwal, A., Katira, P., Hess, H. Millisecond curing time of a molecular adhesive causes velocity-dependent cargo-loading of molecular shuttles. Nano Lett. 9 (3), 1170-1170 (2009).
- Diez, S., Reuther, C., Dinu, C., Seidel, R., Mertig, M., Pompe, W., Howard, J. Stretching and Transporting DNA Molecules Using Motor Proteins. Nano Lett. 3 (9), 1251-1251 (2003).
- Bachand, G. D., Rivera, S. B., Boal, A. K., Gaudioso, J., Liu, J., Bunker, B. C. Assembly and transport of nanocrystal CdSe quantum dot nanocomposites using microtubules and kinesin motor proteins. Nano Lett. 4 (5), 817-817 (2004).
- Coy, D. L., Wagenbach, M., Howard, J. Kinesin takes one 8-nm step for each ATP that it hydrolyzes. J. Biol. Chem. 274 (6), 3667-3667 (1999).
- Katira, P., Agarwal, A., Fischer, T., Chen, H. -. Y., Jiang, X., Lahann, J., Hess, H. Quantifying the performance of protein-resisting surfaces at ultra-low protein coverages using kinesin motor proteins as probes. Advanced Materials. 19, 3171-3171 (2007).
- Vigers, G. P. A., Coue, M., McIntosh, J. R. Fluorescent Microtubules Break Up Under Illumination. J. Cell Biol. 107, 1011-1011 (1988).
- Brunner, C., Hess, H., Ernst, K. -. H., Vogel, V. Lifetime of biomolecules in hybrid nanodevices. Nanotechnology. 15 (10), S540-S540 (2004).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon