Method Article
Mappatura ottico dei potenziali d'azione e transitori Calcio nel Cuore mouse
In questo articolo
Riepilogo
In questo documento i dettagli della procedura di dissezione, la configurazione strumentale, e delle condizioni sperimentali durante la mappatura ottica del potenziale transmembrana (Vm) e calcio intracellulare transitoria (CAT) in intatti Langendorff isolato perfuso cuori mouse.
Abstract
Il cuore del mouse è un modello importante per gli studi cardiovascolare a causa dell'esistenza di tecnologie a basso costo per l'ingegneria genetica in questa specie. Cardiovascolare fenotipizzazione fisiologica del cuore mouse può essere fatto facilmente utilizzando l'imaging di fluorescenza utilizzando varie sonde per il potenziale transmembrana (V m), transienti di calcio (CAT), e altri parametri. Accoppiamento eccitazione-contrazione è caratterizzato da dinamiche di calcio intracellulare del potenziale d'azione e, quindi, è di fondamentale importanza per mappare sia m V e CAT contemporaneamente dalla stessa posizione sul cuore 1-4. Simultanea mappatura ottica da Langendorff perfusi cuori mouse ha il potenziale per chiarire i meccanismi alla base dell'insufficienza cardiaca, aritmie, malattie metaboliche, e di altre malattie cardiache. Visualizzazione di attivazione, velocità di conduzione, la durata del potenziale d'azione, e altri parametri a una miriade di siti non possono essere raggiunti da indagini a livello cellulare, ma è ben risolto con la mappatura ottica 1,5,6. In questo articolo presentiamo l'installazione della strumentazione e delle condizioni sperimentali per la mappatura simultanea ottica di V m e Cat nei cuori del mouse ad alta risoluzione spazio-temporale con state-of-the-art della tecnologia di imaging CMOS. Coerenti registrazioni ottiche ottenute con questo metodo che illustrano la mappatura simultanea ottico dei cuori del mouse Langendorff perfusi è fattibile e affidabile.
Protocollo
1. Preparazione avanzata delle soluzioni madre
- Preparare due soluzioni stock di soluzione di Tyrode (16x) in anticipo in acqua deionizzata e conservarli a 4 ° C:
- Magazzino I (119,872 g / L di NaCl, 3,056 g / L CaCl 2 (2H 2 O), 5,6 g / L di KCl, 2,6274 g / L NaH 2 PO 4, 3,408 g / L MgCl 2 (6H 2 O), (Fisher scientifico, Fair Lawn, New Jersey));
- Magazzino II (26,88 g / L NaHCO3, (Fisher Scientific, Fair Lawn, New Jersey)).
- Preparare soluzioni di coloranti fluorescenti. Per evitare congelamenti e scongelamenti ripetuti, memorizziamo 30 aliquote da ml di entrambi i coloranti a -20 ° C, sufficiente per un esperimento:
- Voltaggio-sensibile colorante RH237 (Invitrogen, Carlsbad, CA) soluzione madre, 1,25 mg / ml soluzione in dimetilsolfossido (DMSO, Sigma, St. Louis, MO);
- Calcio indicatore Rhod-02:00 (Invitrogen, Carlsbad, CA) soluzione madre, 1 mg / mL di soluzione in DMSO.
- Preparare eccitazione-contrazione blebbistatin soluzione disaccoppiatore magazzino (Bioscience Tocris, St. Louis, MO, 2 mg / mL di soluzione in DMSO) in anticipo e conservare il blebbistatin sciolto a 4 ° C.
2. Preparare le soluzioni di perfusione e sperimentale 7
- Appena preparare la soluzione di Tyrode 2L (128.2mM NaCl, 1.3mm CaCl 2 (2H 2 O), 4,7 mm KCl, 1,05 mm MgCl 2 (6H 2 O), 1.19mM NaH 2 PO 4, 20 mM NaHCO 3, 11.1mM D-glucosio in acqua deionizzata, pH = 7,35 ± 0,05). Se la soluzione viene attualmente usato per fare 2L di soluzione di Tyrode (sufficiente per un esperimento) prendere 1750 ml di acqua deionizzata e mescolare in 125 ml di Stock I, 125 ml di Stock II e 4g di glucosio.
- Accendere i due pompe dei sistemi di perfusione. Impostare la pompa peristaltica (Peri-Star, WPI, Sarasota, Stati Uniti) che viene utilizzato per la perfusione retrograda a 40 ml / min. Impostare l'altra pompa peristaltica (Cole-Parmer Masterflex Pompa Peristalic L / S, Cole-Parmer Instrument Company, Vernon Hills, Illinois) che viene utilizzato per superfusione e di restituire il perfusato al serbatoio tenendo a 80 ml / min.
- Lavare il sistema di perfusione con etanolo al 70% per 30 min e poi con 2 litri di acqua deionizzata.
- Una volta che tutta l'acqua deionizzata è evacuata dalla camera, far circolare la soluzione del Tyrode e passare attraverso un filtro a 5 micron (Millipore, Billerica, MA, USA). Scaldare il perfusato a +37 ° C con una camicia d'acqua e circolatore (ThermoNESLAB EX7, Newtown, USA) e ossigenare il perfusato facendo gorgogliare O 2 / CO 2 (95% / 5%) del gas nella soluzione. Monitorare il pH della soluzione con un pH-metro (Oakton Instruments, Vernon Hills, IL) e regolare la velocità di O 2 / CO 2 bolle di mantenere il pH a 7,35 ± 0,05. Continua il monitoraggio del pH e temperatura durante l'esperimento.
- L'apparecchio a doppia mappatura ottico è costituito da due MICAM Ultima-L telecamere CMOS (SciMedia, Costa Mesa, CA) che hanno un alto spaziale (100x100 pixel, 230 ± 20 micron per pixel) e temporale (1.000-3.000 fotogrammi / sec) risoluzione. Fissare un filtro passa-banda (590 ± 15 nm, Thorlabs, Newton, New Jersey) davanti alla telecamera calcio designato immagini, mentre, un filtro passa-lungo (> 700 nm, Thorlabs, Newton, New Jersey) deve essere posizionato in davanti alla telecamera tensione designato imaging. Le telecamere sono disposti perpendicolarmente l'uno all'altro da titolare, che contiene uno specchio dicroico (635 nm di taglio, Omega Optical, Brattleboro, VT). Immediatamente sotto il supporto dual camera c'è un obiettivo (Nikon NIKKOR 55 millimetri 1:1,4 235052), che focalizza la luce di emissione che viene dal cuore sullo specchio dicroico. La distanza di lavoro è di circa 3cm.
La luce di eccitazione è generata da una lampada alogena (Newport Oriel Instruments, Stratford, CT; SciMedia, Costa Mesa, CA) ed è passato attraverso un filtro di calore, otturatore e filtro passa-banda (520 ± 45 nm). La guida di luce flessibile dirige il passa-banda luce filtrata sulla preparazione, e un otturatore è usato per garantire che la preparazione è esposto alla luce solo durante l'acquisizione di immagini al fine di evitare photobleaching dei coloranti. - Preparare Ag / AgCl 2 elettrodi per la stimolazione e sensing in anticipo e installarli nella camera prima di mettere il cuore. Assicurarsi che gli amplificatori e filtri vengono regolate a livelli adeguati.
3. Raccolto il cuore del mouse, cannulate, e impostare la perfusione Langendorff
- Anestetizzare il mouse con ketamina / xylazina (ketamin, 80mg/kg di peso corporeo; xylazina, 10 mg / kg di peso corporeo) ed eparina (100 unità) mediante iniezione intraperitoneale. Assicurare un adeguato livello di anestesia dalla mancanza di riflesso il dolore.
- Dopo una metà sternale incisione, rimuovere velocemente il cuore e lavarlo in ossigenata (95% O 2, 5% CO 2), a temperatura costante (37 ± 1 ° C) Tyrode la soluzione.
- Utilizzando un microscopio da dissezione, Identificare rapidamente l'aorta e fare un taglio netto tra l'aorta ascendente sotto l'arteria succlavia destra. Un breve tratto di aorta viene poi attaccato ad una misura da 21 gauge cannula con una punta svasata. 4-0 nero-sutura di seta intrecciata (Surgical Corporation Specialità, Reading, PA) viene utilizzata per fissare il cuore sulla cannula. Dopo incannulazione, il cuore è retrogrado e superfused perfuso con la soluzione di Tyrode. Il tasso di perfusione retrograda viene regolato nel range di 2-5 mL / min per mantenere la pressione aortica tra i 60 e 80 mmHg (trasduttore di pressione, World strumenti di precisione Inc (WPI), Sarasota, Stati Uniti d'America; Ponte Amplificatore TBM4M, WPI, Sarasota, USA).
- Dopo che il cuore è cannulata, polmone, timo, e tessuto adiposo vengono poi sezionati e rimossi.
- Il cuore isolato è appuntato (Strumenti di scienze arti) al vertice al fondo della camera di perfusione (patinata Sylgard) per evitare flusso indotta movimento. Le appendici atriale destra e sinistra sono anche allungati e appuntato (Strumenti Scienza Fine, Inc, Foster City, CA) al fondo della camera, che offre massima area di superficie per misurazioni ottiche degli atri.
Molto importante! Un tubo di silicone viene inserita nel ventricolo sinistro attraverso le vene polmonari e fissato dalla sutura di seta al vicino tessuto connettivo. Questa soluzione evita la congestione e l'acidificazione del perfusato intrappolati nel ventricolo sinistro, che è particolarmente importante dopo la soppressione delle contrazioni del ventricolo con una eccitazione-contrazione disaccoppiatore (vedi parte 4 punto 19). - Un elettrodo di misura è posto sulla superficie del cuore di condurre la stimolazione stimoli, che viene generato dal Maestro-8 (AMP Instruments Ltd, Gerusalemme, Israele) o PowerLab 26T (AD Instruments, Sydney, Australia).
- Un bicchiere piccolo coperchio è fissato sulla superficie della soluzione sul cuore per ridurre artefatti da movimento dalla soluzione vibrante.
- Focalizzare la luce di eccitazione sul cuore. Inoltre, regolare la distanza tra l'apparato doppia fotocamera e il cuore in modo che la risoluzione massima si ottiene.
- Spegnere tutte le luci in sala e cominciare le registrazioni elettrica usando PowerLab 26T.
4. Tensione a vuoto e tinture di calcio sensibili e eccitazione-contrazione disaccoppiatore
- Warm-up 0.6 ml di blebbistatin. Mescolare 0,5 ml di blebbistatin con il perfusato nel serbatoio azienda. Diluire il restante 0,1 mL di blebbistatin in 1 ml di soluzione Tyrode e iniettare lentamente (in un periodo di 20 minuti) attraverso una porta di droga vicino alla cannula. Osservare come blebbistatin riduce gradualmente la artefatti da movimento.
- Diluire 30 ml di tensione sensibili colorante RH237 soluzione madre in soluzione 1 ml Tyrode e iniettare lentamente oltre 5-7 minuti nella porta di iniezione stesso blebbistatin.
- 30 microlitri di calcio indicatore Rhod-2 1:01 AM è mescolato con Pluronic F127 (Invitrogen, Carlsbad, CA, 20% soluzione in DMSO) e poi diluito in 1 mL di soluzione Tyrode e lentamente applicato su 5-10 min attraverso la porta stessa iniezione .
- Attendere 5-10 minuti per blebbistatin e tinture per raggiungere la membrana cellulare e citosol. Continuare con il protocollo quando il movimento è completamente soppresso.
- Monitorare costantemente le registrazioni ECG sopra l'intera procedura per garantire la normale funzione elettrica del cuore.
- Iniziare le registrazioni del segnale fluorescente SciMedia utilizzando il software personalizzato (SciMedia, Costa Mesa, CA).
5. Rappresentante dei risultati:

Figura 1. Impostazione sperimentale per la perfusione, registrazioni elettrici e la mappatura ottica.
EM = emissioni; Lp = longpass
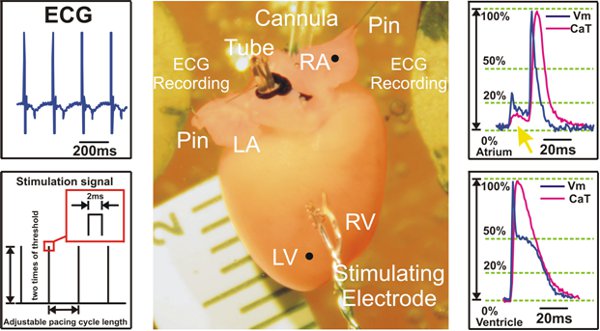
Figura 2. Preparazione sperimentale ed esempi segnale registrato durante la stimolazione ventricolare. A sinistra: segnali ECG sono raccolti direttamente presso Ag / AgCl 2 elettrodi disco (in alto) e un esempio di S1S1 protocollo di stimolazione è mostrato (in basso). Centro: preparazione del mouse Langendorff cuore. A destra: Rappresentante potenziali d'azione ottica e segnali di calcio transitori da atri (Top) e ventricoli (basso) sono mostrati. La freccia gialla (Top) punti alla dispersione segnale fluorescente proveniente dal ventricoli, che si vede nelle registrazioni atriale.
LV = ventricolo sinistro; RV = ventricolo destro; LA = atrio sinistro; RA = atrio destro
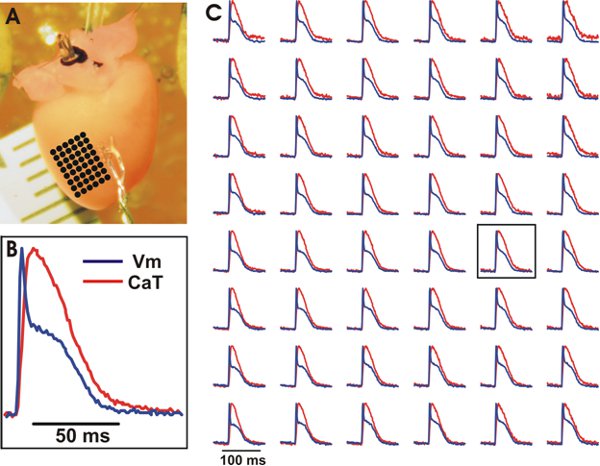
Figura 3. Rappresentante registrazioni ottiche di V m e Cat dai ventricoli di un cuore selvaggio del mouse tipo. A. La preparazione sperimentale con una serie di punti equidistanti segnata da punti neri il cui ottica registrazioni può essere visto in (C). B. Esempio di tracciamento V m ed il gatto da una posizione centrale sulla matrice (vedi box in (C)). C. V m (blu) e CAT (rosso) dalla serie di punti equidistanti. Segnali sono stati cestinate 3x3.
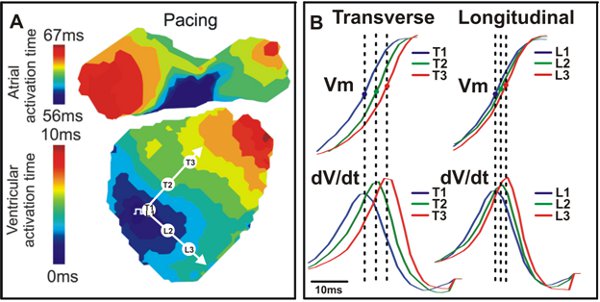
Figura 4. Mappa di attivazione e conduzione. R. Un esempio di attivazione mappa di un cuore selvaggio del mouse di tipo trasversale con (T) e longitudinale (L) le direzioni indicate dalle frecce bianche. B. V segnali m (in alto) e dV / dt (basso) corrispondenti ai tre punti di vista in A (T1, T2, T3, L1, L2, L3).
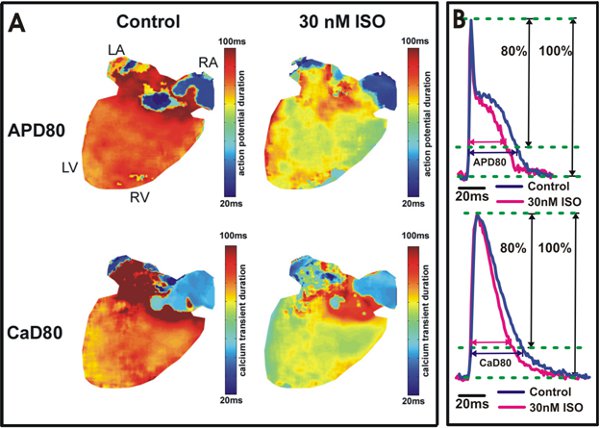
Figura 5. Potenziale d'azione e l'analisi della durata di calcio transitori. Durata del potenziale d'azione A. ripolarizzazione a 80% (APD80) e la durata transitoria calcio a 80% relax (CAD80) le mappe sono indicate da un cuore in condizioni di controllo (sinistra) e dopo 30 applicazioni nM isoproterenolo (Destra). Il colore giallo / verde nei ventricoli (a destra) indica isoproterenolo accorciato APD80 e CAD80. B. Esempio di tracciati APD80 e CAD80 dai ventricoli del mouse di tipo selvatico (Top) e atri (in basso).
Discussione
In questo esperimento abbiamo modificato il metodo di perfusione Langendorff con l'aggiunta di un piccolo tubo di silicone, che è fondamentale soprattutto dopo la soppressione delle contrazioni del ventricolo con una eccitazione-contrazione disaccoppiatore. Il tubo di silicone viene usato per prevenire la congestione soluzione, l'acidificazione della soluzione di perfusione, e lo sviluppo di ischemia del ventricolo sinistro. Il cuore del mouse è molto sensibile alla ipotermia, quindi, variazioni di temperatura in tutto il cuore artificiale a causa delle differenze durata del potenziale d'azione. Di conseguenza, un sistema di riscaldamento è stato implementato nella camera di perfusione al fine di mantenere una temperatura costante di 37 ° C durante l'intero dell'esperimento 8. Dal momento che un modello Langendorff non conserva innervazione del cuore, bisogna considerare l'aggiunta di neurotrasmettitori al perfusato al fine di indagare fisiologico tono simpatico e parasimpatico 9. Oltre perfusione retrograda, l'aggiunta di superfusione del cuore aiuta a mantenere adeguati parametri ambientali quali pH e temperatura. In questo metodo, il cuore Langendorff perfuso era collocato orizzontalmente. Una verticale di impostazione perfusione Langendorff può essere utilizzato anche 10, ma può provocare meccanica cardiaca leggermente diverso 11. In aggiunta alle telecamere CMOS, rivelatori alternativa sono anche disponibili e possono essere applicati per mappare V m e Cat contemporaneamente 12.
Applicazione delle telecamere CMOS ad alta risoluzione spazio-temporale garantisce l'accuratezza delle registrazioni, tuttavia, i segnali ottici non sono la mappatura da una singola cellula. Piuttosto, ogni segnale fluorescente viene da centinaia o migliaia di cellule, a seconda di ingrandimento ottico. La fluorescenza ventricolare molto più grande può distorcere i segnali atriale di dispersione ottica, quindi, un'attenta interpretazione dei segnali registrati otticamente è richiesto. Un altro limite della preparazione del mouse è la distorsione del segnale e rumore indotto dalla curvatura della superficie a causa delle ridotte dimensioni del cuore 13. Misure di velocità di conduzione può essere alterato non solo dalla curvatura del cuore del mouse ma anche dalla polarità degli elettrodi e gli elettrodi virtuale. Per ottenere una precisione di velocità di conduzione, anisotropia attivazione e le mappe della ripolarizzazione, corretta messa a fuoco della fotocamera sulla superficie del cuore è essenziale.
In questo metodo, in tempo reale le registrazioni ECG possono integrare l'indagine ottica di elettrofisiologia cardiaca. Voltaggio-sensibile colorante (RH237) e l'indicatore di calcio (Rhod-2) sono utilizzati nel protocollo a causa della loro rapida risposta, eccitazione simili, e spettri di emissione distinti 3,7. Ci sono combinazioni alternative di coloranti che possono essere utilizzati per misurare V m e CAT diversi RH237 e Rhod-2:00 3. Un romanzo di tensione-sensibili colorante, PGHI, con un grande Stoke shift (> 200 nm) è stato trovato per permettere una migliore m V e segnali gatto perché della separazione maggiore delle lunghezze d'onda di emissione tra PGHI e Rhod-2:00 14. Futuri miglioramenti possono concentrarsi su esplorare nuove sonde fluorescenti, lo sviluppo di rivelatori di imaging, e migliorato il software di elaborazione delle immagini. Più alta risoluzione e nuove modalità di imaging ottico per la mappatura 3D ottica sono importanti anche le direzioni future della mappatura ottica 5.
Divulgazioni
Nessun conflitto di interessi dichiarati.
Riconoscimenti
NIH concede R01 HL085369.
Materiali
| Name | Company | Catalog Number | Comments |
| Chimico | Azienda | Numero di catalogo | |
| NaCl | Fisher Scientific, Fair Lawn, New Jersey | S271-1 | |
| CaCl 2 (2H 2 O) | Fisher Scientific, Fair Lawn, New Jersey | C79-500 | |
| KCl | Fisher Scientific, Fair Lawn, New Jersey | S217-500 | |
| MgCl 2 (6H 2 O) | Fisher Scientific, Fair Lawn, New Jersey | M33-500 | |
| NaH 2 PO 4 (H 2 O) | Fisher Scientific, Fair Lawn, New Jersey | S369-500 | |
| NaHCO 3 | Fisher Scientific, Fair Lawn, New Jersey | S233-3 | |
| D-glucosio | Fisher Scientific, Fair Lawn, New Jersey | D16-1 | |
| Blebbistatin | Bioscience Tocris, Ellisville, MO | 1760 | |
| RH237 | Invitrogen, Carlsbad, CA | S1109 | |
| Rhod, 02:00 | Invitrogen, Carlsbad, CA | R1244 | |
| Pluronic F127 | Invitrogen, Carlsbad, CA | P3000MP | |
| Dimetilsolfossido (DMSO) | Sigma, St. Louis, MO | D2650 |
Riferimenti
- Efimov, I. R., Rendt, J. M., Salama, G. Optical maps of intracellular [Ca2+]i transients and action-potentials from the surface of perfused guinea-pig hearts. Circulation. 90, 1-1 (1994).
- Efimov, I. R. Optical mapping of repolarization and refractoriness from intact hearts. Circulation. 90, 1469-1480 (1994).
- Choi, B. R., Salama, G. Simultaneous maps of optical action potentials and calcium transients in guinea-pig hearts: mechanisms underlying concordant alternans. J Physiol. 529, 171-188 (2000).
- Pruvot, E. J. Role of calcium cycling versus restitution in the mechanism of repolarization alternans. Circ Res. 94, 1083-1090 (2004).
- Efimov, I. R., Nikolski, V. P., Salama, G. Optical imaging of the heart. Circ Res. 95, 21-33 (2004).
- Fast, V. G., Dhein, S., Delmoar, M. Recording action potential using voltage sensitive dyes. Practical methods in cardiovascular research. , 233-255 (2005).
- Glukhov, A. V. Differential K(ATP) channel pharmacology in intact mouse heart. J Mol Cell Cardiol. , (2009).
- Baker, L. C. Enhanced dispersion of repolarization and refractoriness in transgenic mouse hearts promotes reentrant ventricular tachycardia. Circ Res. 86, 396-407 (2000).
- Sutherland, F. J., Hearse, D. J. The isolated blood and perfusion fluid perfused heart. Pharmacol Res. 41, 613-627 (2000).
- Efimov, I. R. Virtual electrode polarization in the far field: implications for external defibrillation. Am J Physiol Heart Circ Physiol. 279, 1055-1070 (2000).
- Hammouda, M., Kinosita, R. The coronary circulation in the isolated heart. J Physiol. 61, 615-628 (1926).
- Salama, G., Hwang, S. M. Simultaneous optical mapping of intracellular free calcium and action potentials from Langendorff perfused hearts. Curr Protoc Cytom. 12, 17-17 (2009).
- Lou, Q. Quantitative panoramic imaging of epicardial electrical activity. Ann Biomed Eng. 36, 1649-1658 (2008).
- Salama, G. Properties of new, long-wavelength, voltage-sensitive dyes in the heart. J Membr Biol. 208, 125-140 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon