Method Article
Purificazione non-cromatografico di polipeptidi di elastina ricombinante simili e le loro fusioni con Peptidi e Proteine da
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Polipeptidi di elastina-come sono biopolimeri stimolo-sensibile con applicazioni che vanno dalla purificazione della proteina ricombinante per la consegna della droga. Questo protocollo descrive la purificazione e caratterizzazione di polipeptidi elastina-simili e loro peptidi o proteine fusioni da Escherichia coli usando il loro comportamento di transizione di fase temperatura della soluzione critica inferiore come una semplice alternativa alla cromatografia.
Abstract
Polipeptidi di elastina-come sono biopolimeri ripetitivi che mostrano un comportamento di transizione di fase temperatura della soluzione bassa critica, unimers solubili esistente di sotto di una temperatura caratteristica di transizione e aggregando in coacervates micron scala sopra la loro temperatura di transizione. Il disegno di polipeptidi elastina simile a livello genetico consente un controllo preciso della loro sequenza e lunghezza, che impone loro proprietà termiche. Polipeptidi elastina-simili sono utilizzati in un'ampia varietà di applicazioni, tra cui biosensori, ingegneria dei tessuti, e la somministrazione di farmaci, in cui la temperatura di transizione e l'architettura biopolimero del PEL possono essere sintonizzati per l'applicazione specifica di interesse. Inoltre, la soluzione comportamento di transizione di fase temperatura critica inferiore di polipeptidi elastina-like consente loro purificazione dal loro risposta termica, tali che la loro coacervation selettiva e resolubilization consente la rimozione di contaminanti sia solubile e insolubiles seguente espressione in Escherichia coli. Questo approccio può essere utilizzato per la purificazione da sola o come strumento per la purificazione di peptidi o proteine fusioni dove peptidi ricombinanti o proteine geneticamente allegata alla tag polipeptidiche elastina simile può essere purificato senza cromatografia polipeptidi elastina-like. Questo protocollo descrive la purificazione di polipeptidi elastina-simili e loro peptidi o proteine fusioni e discute tecniche di caratterizzazione di base per valutare il comportamento termico di prodotti polipeptidici puri elastina-like.
Introduzione
Polipeptidi di elastina-like (PEL) sono biopolimeri composti del VPGXG pentapeptide ripetuta dove X, il residuo ospite, è un qualsiasi amminoacido tranne la prolina. PEL mostra la temperatura della soluzione critica inferiore (LCST) comportamento transizione di fase, tale che una soluzione omogenea PEL separerà in due fasi dopo riscaldamento al suo LCST, che viene comunemente chiamata la temperatura di transizione inversa (T t) nella letteratura PEL 1. Le due fasi sono composti da una fase molto diluita globulo PEL e una ricca fase di sedimentazione PEL. I ricchi sedimenti ELP è formata in un breve lasso di tempo sulla aggregazione delle catene ELP in particelle micron di dimensioni che in seguito si coagulano. Questo comportamento si verifica in un intervallo di pochi gradi Celsius ed è tipicamente reversibili, come una soluzione omogenea viene recuperato al ritorno a una temperatura inferiore alla T t.
PEL sono tipicamente sintetizzate in Escherichia coli (E. coli) froM un gene artificiale che viene ligato nel plasmide di espressione. Questo plasmide è poi trasformato in un E. linea cellulare coli che è ottimale per l'espressione della proteina. Abbiamo usato esclusivamente il sistema vettore T7-lac pET per l'espressione di una grande varietà di PEL in E. coli, anche se altri sistemi di espressione in lievito 2-4, 5 funghi, piante e 6-8 sono stati utilizzati anche da altri ricercatori. Un certo numero di approcci esistono per costruire geneticamente geni ELP ripetitivi, inclusi legatura ricorsiva direzionale (RDL) 9, ricorsivo legatura direzionale da plasmide ricostruzione (Pre-RDL) 10, e si sovrappongono l'estensione di rotolamento del cerchio di amplificazione (OERCA) 11. La capacità di progettare PEL a livello genetico offre l'opportunità di utilizzare tecniche di DNA ricombinante per creare PEL con una varietà di architetture (ad esempio, monoblocchi, diblocks, triblocks, ecc), che può essere ulteriormente aggiunto con funzionalepeptidi e proteine. Controllo a livello genetico assicura anche che ogni ELP si esprime con l'esatta lunghezza e la composizione dettata dal suo modello plasmide genetica, fornendo prodotti di biopolimeri perfettamente monodispersi.
Le proprietà termiche di ciascuna PEL dipendono da parametri intrinseci al biopolimero come il suo peso molecolare (MW) e sequenza, così come i fattori estrinseci compresa la sua concentrazione nella soluzione e la presenza di altre cosolutes, come sali. La lunghezza del PEL 12 e la sua composizione residuo ospite 1, 13, 14 sono due parametri ortogonali nel disegno ELP che possono essere utilizzati per controllare il t T, in cui i residui idrofobici classificazioni e lunghezze di catena provocano inferiore T t s, mentre idrofilo residui degli ospiti e lunghezze a catena corta producono una maggior T t s. Concentrazione ELP è inversamente proporzionale alla t T, dove le soluzioni di grconcentrazione mangiatore ELP hanno minore T t s 12. Il tipo e la concentrazione di sali influenzano anche la t PEL T, dove l'effetto dei sali segue la serie Hofmeister 15. Kosmotropic anioni (Cl - e superiore sulla serie Hofmeister) abbassano la ELP T t e concentrazione salina crescente aumenta questo effetto. Questi parametri intrinseci ed estrinseci possono essere sintonizzati avere comportamento termico ad una temperatura bersaglio che è richiesta per una specifica applicazione di un ELP.
Il comportamento stimolo-sensibile di PEL è utile per una vasta gamma di applicazioni, tra cui biosensing il 16 il 17 il 18 ingegneria tissutale e la consegna della droga il 19 il 20. Inoltre, quando PEL sono fusi a peptidi o proteine a livello genetico, il PEL può servire come un semplice tag purificazione di fornire un metodo lotto poco costoso per la purificazione di pep ricombinantemaree o proteine che non richiede cromatografia 21. Modifica del processo di purificazione assicura che l'attività del peptide o proteina fusa alla PEL viene mantenuta. Peptide o proteina PEL fusioni possono essere purificati per applicazioni in cui il tag PEL è utile 22, 23 o, in alternativa, quando è richiesto il peptide libero o proteina, un sito di riconoscimento di proteasi può essere inserito tra il peptide o proteina e ELP. La rimozione del tag ELP può essere ottenuto mediante digestione con proteasi libero o un ELP fusion proteasi, qualora quest'ultima preveda la facilità supplementare di trasformazione di una fase finale di ELP depurazione può separare l'ELP tag e proteasi ELP fusione dal peptide di destinazione o proteine in un unico passaggio 24, 25. Il protocollo che segue descrive la procedura di purificazione per PEL e peptidi o proteine ELP fusioni per mezzo di loro proprietà termiche e discute le tecniche di base per la caratterizzazionela risposta termica dei prodotti ELP.
Protocollo
1. ELP Expression
- Seminare 3 ml di media Terrific Broth sterili con uno stock DMSO o piastra di agar colonia di E. coli adatto per l'espressione proteica contenente il plasmide PEL-codifica desiderata sotto il controllo del promotore T7-lac. Aggiungere l'antibiotico appropriato e incubare a 37 ° C per una notte (O / N) con continua agitazione a 200 rpm.
- Aggiungere 1 ml di coltura O / N a 1 L di Terrific Broth mezzi sterili in una beuta 4-L. Aggiungere l'antibiotico appropriato e incubare a 37 ° C per 24 ore con agitazione continua a 200 rpm. NOTA: L'espressione iniziale "perde" visto con il promotore T7-lac è sufficiente per l'espressione elevato livello di molti PEL se la cultura viene incubata per 24 ore. Tuttavia, un approccio più convenzionale può essere utilizzato, in cui l'espressione della proteina è ulteriormente indotta dall'aggiunta di 0,2-1 mM isopropil-beta-D-thiogalactoside (IPTG) quando la densità ottica della coltura raggiunga 0,6.
- Trasferire la cultura dal pallone a 4 L per una bottiglia centrifuga 1-L e centrifugare a 4 ° C per 15 min a 2.000 x g.
- Scartare il surnatante. NOTA: Se più di 1 L di cultura è cresciuta possono essere condensati aggiungendo un altro litro di coltura al pellet e ripetendo il punto 1.3. Fino a 2 L di coltura può essere condensato in un unico pellet di cellule.
- Risospendere il pellet in tampone fosfato salino (PBS), acqua, o altro buffer desiderato per raggiungere i 45 ml di sospensione cellulare e trasferire in una provetta da 50 ml.
2 ELP purificazione:. Fasi preliminari e primo turno di Inverse Transition Ciclismo
- Sonicare il pellet risospeso per un totale di 9 min in cicli di 10 sec 'on' e 20 sec 'off' ad una potenza di uscita di 85 W, mantenendo il campione in ghiaccio. Brevemente consentire il campione raffreddare su ghiaccio e poi ripetere il ciclo 9 min più di una volta. NOTA: Se l'ELP è previsto per avere un bassissimo T t l'intervallo di 'off' possono essere aumentata fino a 40 secondi per evitare il riscaldamento della soluzione sopra la T t.
- Trasferire il lisato a 50 ml rotondo tubo da centrifuga inferiore.
- Aggiungere 2 ml di 10% (w / v) polietileneimmina (PEI) per ogni litro di cultura e agitare per mescolare. NOTA: PEI è un polimero carico positivamente che aiuta nella condensazione dei contaminanti genetiche carica negativa. Non eseguire questo passaggio se il ELP si carica negativa, come il PEI può condensare e rimuovere il prodotto ELP.
- Centrifugare a 4 ° C per 10 min a 16.000 x g.
- Trasferire il surnatante in un ambiente pulito 50 ml rotondo tubo da centrifuga inferiore e scartare il pellet.
- Facoltativo "bake out" step: incubare il campione a 60 ° C per 10 minuti per denaturare contaminanti proteici e poi trasferire a 4 ° C o al ghiaccio fino PEL è completamente resolubilized. Centrifugare il campione a 4 ° C per 10 min a 16.000 x g. Trasferire il surnatante in una clEAN 50 ml rotonde tubo da centrifuga inferiore e scartare il pellet. NOTA: Non eseguire questo passaggio se un peptide o proteina è fuso al ELP e si prevede di denaturare nella condizione di calore elevato. Ciò può causare la transizione PEL diventi calore irreversibile o possono distruggere l'attività della porzione fusa.
- Indurre la transizione PEL con l'aggiunta di NaCl cristallino (non superiore a 3 M). In alternativa, sodio citrato (non superiore a 0,3 M) può essere utilizzato per PEL che hanno una maggiore T s t o bassa resa. NOTA: La soluzione deve girare torbida una volta che il sale si è disciolto, che indica la separazione di fase di PEL dalla soluzione. PEL molto idrofili ad alto T t s possono richiedere un certo grado di riscaldamento, in combinazione con l'aggiunta di sale, per indurre la separazione di fase del PEL in questa induzione preliminare della transizione PEL.
- Centrifugare a temperatue ambiente (RT) per 10 min a 16.000 xg (spin caldo). NOTA: pellet ELP dovrebbe be osservato, la cui dimensione dipende dalla resa espressione del PEL. Questo pellet ELP può apparire opaco, ma dopo il raffreddamento apparirà traslucido e può essere di colore marrone. Il pellet ELP diventerà più incolore come proventi di depurazione e contaminanti vengono rimossi.
- Eliminare il supernatante e aggiungere 1-5 ml di tampone desiderato al pellet. Risospendere il pellet pipettando o ponendo il tubo di ruotare a 4 ° C. NOTA: Il volume di tampone dipenderà dalle dimensioni del pellet ELP, pertanto la resa di espressione ELP, dove deve essere aggiunta una quantità sufficiente di tampone per consentire resolubilization del pellet PEL. PEL ad alto tenore di cisteina beneficio dalla purificazione in acqua con Tris 10 mM (2-carbossietil) fosfina cloridrato (TCEP-HCl) a pH 7 per eliminare interazioni disolfuro con proteine contaminanti. PEL ad alto contenuto di carica beneficiare di depurazione a pH regolato per neutralizzare la loro carica e ridurre electrostatic interazioni con proteine contaminanti.
- Trasferire la soluzione risospeso ELP in aliquote da 1 ml in provette da microcentrifuga 1,5 ml puliti.
- Centrifugare a 4 ° C per 10 min a 16.000 xg (spin freddo). Deve essere osservata una piccola pallina di contaminanti insolubili.
- Trasferire il surnatante in una provetta pulita e scartare il pellet.
. 3 ELP Purificazione: turni successivi di Inverse transizione bicicletta
- Indurre la transizione ELP con calore e / o l'aggiunta di NaCl. I campioni possono essere incubati su un blocco di calore o in un bagno di acqua per 15 minuti a una temperatura superiore alla T t. Se, tuttavia, il PEL è fuso ad una proteina (precludendo l'uso di calore) o se PEL ha un alto t T che non può essere raggiunta con calore da solo, una soluzione 5 M di NaCl può essere aggiunto goccia a goccia per indurre l' transizione ELP. NOTA: La soluzione dovrebbe diventare torbida, che indica la separazione di fase di ELP dalla soluzione.
- Centrifugare per 10 minuti a 16.000 xg (spin caldo). Se il calore è stato utilizzato nel passaggio 3.1, eseguire questa fase di centrifugazione a temperatura superiore a quella che era necessaria per indurre la transizione PEL. Se solo NaCl è stato utilizzato nel passaggio 3.1, eseguire questa fase di centrifugazione a temperatura ambiente. NOTA: Un pellet ELP deve osservare.
- Eliminare il supernatante, aggiungere 500-750 microlitri di tampone desiderato, e risospendere il pellet pipettando o ponendo il tubo di ruotare a 4 ° C.
- Centrifugare a 4 ° C per 10 min a 16.000 xg (spin freddo). Deve essere osservata una piccola pallina di contaminanti insolubili.
- Trasferire il surnatante in una provetta pulita e scartare il pellet.
- Ripetere i passaggi 3,1-3,5 fino a quando non pellet contaminante si osserva durante la fase 3.4.
4. Post-Processing depurazione (opzionale)
- Se lo si desidera, Dializzare campione contro un tampone adatto per eliminare il sale in eccesso dalla soluzione PEL purificata. NOTA: PEL essere liofilizzati devono esseredializzato contro DDH 2 OO / N a 4 ° C.
- Se lo si desidera, liofilizzare l'ELP per l'archiviazione a lungo termine mediante congelamento della soluzione a -80 ° C per 30 minuti prima di liofilizzazione O / N. NOTA: Liofilizzazione non deve essere usato per PEL con proteine annesse.
- Se lo si desidera, recuperare peptide libero o proteine da un peptide o una proteina di fusione PEL rimuovendo il tag ELP:
- Digerire il peptide o proteina di fusione con proteasi PEL biotinilato (come raccomandato dal fornitore proteasi) o con una fusione proteasi PEL corrispondente al sito proteasi geneticamente progettato tra il peptide o proteina e ELP.
- Se necessario, rimuovere la proteasi biotinilato con perline streptavidina-modificato (come raccomandato dal fornitore proteasi).
- Indurre il passaggio del PEL spaccati e / o proteasi ELP la fusione con l'aggiunta goccia a goccia di una soluzione 5 M di NaCl.
- Centrifugare a RT per 10 minuti a 16.000 x g. NOTA: Un pellet ELP deve osservare.
- Raccogliere il surnatante e scartare il pellet ELP. Dializzare il supernatante contro un buffer desiderato o utilizzare un filtro centrifugo effettuare uno scambio di buffer per eliminare la concentrazione di sale dal peptide puro o soluzione proteica.
- Confermare la scissione completa del peptide libero o proteine dal tag ELP da sodio dodecil solfato elettroforesi su gel di poliacrilammide (SDS-PAGE).
5 Caratterizzazione:. SDS-PAGE
- Preparare i campioni ELP per SDS-PAGE mescolando 10 ml di ELP diluito in acqua con 10 ml di tampone campione contenente 2-mercaptoetanolo. NOTA: 40 mcg di ELP è spesso sufficiente per valutare le dimensioni e la purezza del prodotto ELP.
- Incubare il campione a 100 ° C per 2 minuti e quindi caricare su gel di poliacrilamide insieme con una scala di proteine di dimensioni appropriate.
- Attivare il gel a 180 V finché il colorante si avvicina al fondo del gel (circa 45 min).
- Colorare ilgel con una soluzione 0,5 M CuCl 2 per 5 min, mentre a dondolo. NOTA: PEL genere non sono visualizzati con blu brillante Coomassie macchia, come alcune sequenze PEL non interagiscono con questo colorante. Coomassie blu brillante interagisce prevalentemente con residui di arginina e interagisce debolmente con altri residui di base-istidina e-lisina e aromatici residui-triptofano, tirosina, fenilalanina e 26. Così PEL e peptide o proteina PEL fusioni possono essere colorati con blu brillante Coomassie solo se la loro sequenza primaria comprende un numero sufficiente di questi residui specifici.
- Verificare che la MW della banda PEL corrisponde a quella del MW teorico previsto dal gene ELP e che nessuna banda contaminanti estranei sono presenti. NOTA: Alcuni PEL migrano con un apparente MW fino al 20% superiore al loro MW previsto 9, 27.
6 Caratterizzazione:. Matrix-assisted laser di desorbimento /ionizzazione Time-of-Flight Spettrometria di Massa (MALDI-TOF-MS)
- Preparare una soluzione in acetonitrile PEL acquosa al 50% contenente 0,1% di acido trifluoroacetico per ottenere una concentrazione PEL di circa 25 pM. NOTA: Questa soluzione dovrebbe essere libero di sale, in modo ELP deve essere dializzato contro H 2 O seguente purificazione.
- Preparare una soluzione di matrice di acido sinapinic saturo in acetonitrile acquosa al 50% contenente 0,1% di acido trifluoroacetico.
- Aggiungere 1 ml di soluzione ELP a 9 microlitri della soluzione di matrice per ottenere una concentrazione PEL di circa 2,5 pmol / ml. NOTA: Questa miscela può essere ulteriormente diluita con soluzione di matrice per ottimizzare il segnale MALDI-TOF.
- Deposito 1-2 ml di miscela di ELP-matrix su una lastra di metallo MALDI e lasciare il posto asciugare completamente.
- Ottenere 5-10 spettri con MALDI-TOF per determinare la massa di addebitare il rapporto (m / z), del ELP e dedurre la sua MW misurato.
7. Characterization: Turbidimetria e Dynamic Light Scattering programmate temperatura
- Determinare la T t del PEL mediante turbidimetria temperatura programmata:
- Preparare una serie di diluizioni (esempio, 5-100 mM) di soluzioni PEL nel buffer desiderato.
- Utilizzando un UV-Vis spettrofotometro a temperatura controllata, misurare la densità ottica (DO) a 350 nm in un intervallo di temperature (ad esempio 20-80 ° C) ad una velocità di riscaldamento di 1 ° C / min. NOTA: Se nessun aumento OD si vede la T t può superare il limite superiore di temperatura dello strumento. L'apparente T t può essere ridotta mediante l'aggiunta di NaCl. Inizia a 1 M NaCl e aumentare a passi di 0,5 M fino a quando viene rilevata la transizione PEL all'interno di un intervallo di temperatura misurabile.
- Verificare reversibilità della transizione PEL misurando la diminuzione OD nello stesso intervallo di temperatura ad una velocità di raffreddamento di 1 ° C / min.
- Determinare la T t dell'homopolimero PEL identificando il punto di flesso del profilo torbidità (OD tracciata in funzione della temperatura). NOTA: Questa temperatura può essere facilmente definito dalla derivata della curva OD, dove la temperatura corrispondente al massimo del derivato è definito come il T t. ELP architetture più complesse vengono visualizzati i profili di torbidità più complessi e devono essere ulteriormente analizzati come descritto nella sezione 7.2.
- Caratterizzazione supplementare di PEL che visualizzano più complesse proprietà termiche (ad esempio, copolimeri ELP diblock che si auto-assemblano in micelle sferiche) si ottiene dispersione della luce dinamica (DLS):
- Preparare una soluzione ELP nel buffer desiderato e passare il campione attraverso un filtro con una dimensione dei pori 20-450 nm. NOTA: La scelta del filtro dimensione dei pori dipenderà dalla presenza, dimensione e stabilità di qualsiasi assembly PEL in soluzione. La più piccola dimensione dei pori del filtro fattibile è preferito per eliminare i contaminanti, qualipolvere, che diminuiscono la qualità delle misure DLS. Un filtro più grande dimensione dei pori deve essere utilizzato quando la resistenza significativa si sperimenta quando si passa una soluzione ELP attraverso le dimensioni del filtro pori più piccoli.
- Misurare il raggio idrodinamico (R H) in un intervallo di temperature che corrisponde ad una regione di interesse individuato nel profilo torbidità. NOTA: unimers ELP in genere hanno un R H <10 nm, le assemblee di nanoparticelle hanno una R H ~ 20-100 nm, e inerti hanno un R H> 500 nm. Ogni incremento R H dovrebbe corrispondere ad un aumento della densità ottica a 350 nm misurata mediante spettrofotometria UV-Vis in funzione della temperatura, che è proporzionale alla dimensione della particella.
Risultati
Qui descriviamo risultati rappresentativi per la purificazione e la caratterizzazione di un omopolimero ELP e un copolimero a due blocchi ELP. In seguito 24 h di espressione in E. coli, cellule vengono raccolte per centrifugazione e lisate per sonicazione. Tipicamente, un sottile cambiamento di colore si verifica dopo sonicazione, confermando la lisi cellulare sufficiente (Figura 1A). Dopo l'aggiunta di PEI, componenti genomici e detriti cellulari vengono raccolte per centrifugazione, separando una grande pellet di contaminanti insolubili dalla PEL solubile nel supernatante (Figura 1B). ELP viene ulteriormente purificato mediante passaggio inverso bicicletta (ITC), che sfrutta il comportamento LCST per separare il PEL da contaminanti solubili e insolubili (Figura 2) 28. La transizione di fase del PEL è innescata con l'aggiunta di calore e / o sale. Risultati centrifugazione nella formazione di un pellet sul fondo della provetta che consiste di un PELnd alcuni contaminanti insolubili (Figura 1C). Questo passo-definito uno spin-scarta contaminanti solubili calde nel surnatante, mentre il pellet ELP viene mantenuto e risospeso in tampone a freddo. Il resolubilized ELP è centrifugato di nuovo a 4 ° C. Questo passo-definito un freddo spin-rigetti il pellet di contaminanti insolubili, mentre il surnatante contenente ELP solubile viene mantenuta. Ripetendo il ciclo di alternanza giri calde e fredde aumenta la purezza del PEL, ma a costo di diminuire leggermente resa, come residuo PEL viene persa durante ogni turno ITC in provette da centrifuga e sulle punte delle pipette.
Purificazione di successo di PEL e peptidi o proteine PEL fusioni è confermata mediante SDS-PAGE. Piccole aliquote rilevati durante il processo di purificazione dimostrano purificazione progressiva PEL dalla E. lisato coli. ELP è iperespresso nel greggio E. coli lisato e contaminanti diminuiscono spiritoh cicli successivi di ITC (Figura 3). Purificata ELP appare come una singola banda vicino al MW teorico previsto.
Il ELP T t è caratterizzata da turbidimetria temperatura programmata. Il profilo torbidità di un omopolimero PEL presenta un unico forte aumento OD a 350 nm (circa 2,0 unità di sopra di base per una concentrazione di 25 mM PEL) (Figura 4A). Raffreddamento scansioni torbidità confermano la natura reversibile della transizione PEL come OD ritorna allo stato iniziale quando si abbassa la temperatura sotto la T t (Figura 4B). ELP copolimeri a due blocchi presentano un profilo torbidità più complessa, rispetto a omopolimero PEL. La OD tipicamente primo aumenta di 0,1-0,5 unità sopra il basale, dopo di che le OD aumenta bruscamente a 2,0 unità sopra basale (Figura 5A). DLS misure forniscono informazioni sulla variazione di R H rispetto alla temperatura, co rroborating le informazioni acquisite dal profilo torbidità (Figura 5B).

Figura 1. Preliminare di purificazione ELP. Dopo 24 ore di espressione, E. coli cellule vengono raccolte per centrifugazione e risospese in PBS. A) Le cellule sono lisate mediante sonicazione, che è accompagnato da un sottile cambiamento di colore tale che il lisato scurisce dopo sonicazione. B) Dopo l'aggiunta di PEI a condensare contaminanti DNA, il lisato è centrifugato e una grande pellet di detriti insolubile è separato dal PEL solubile nel supernatante. C) La transizione PEL è indotta con l'aggiunta di calore e / o sale e forme centrifugazione un pellet traslucido PEL.ank "> Cliccate qui per vedere una versione più grande di questa figura.
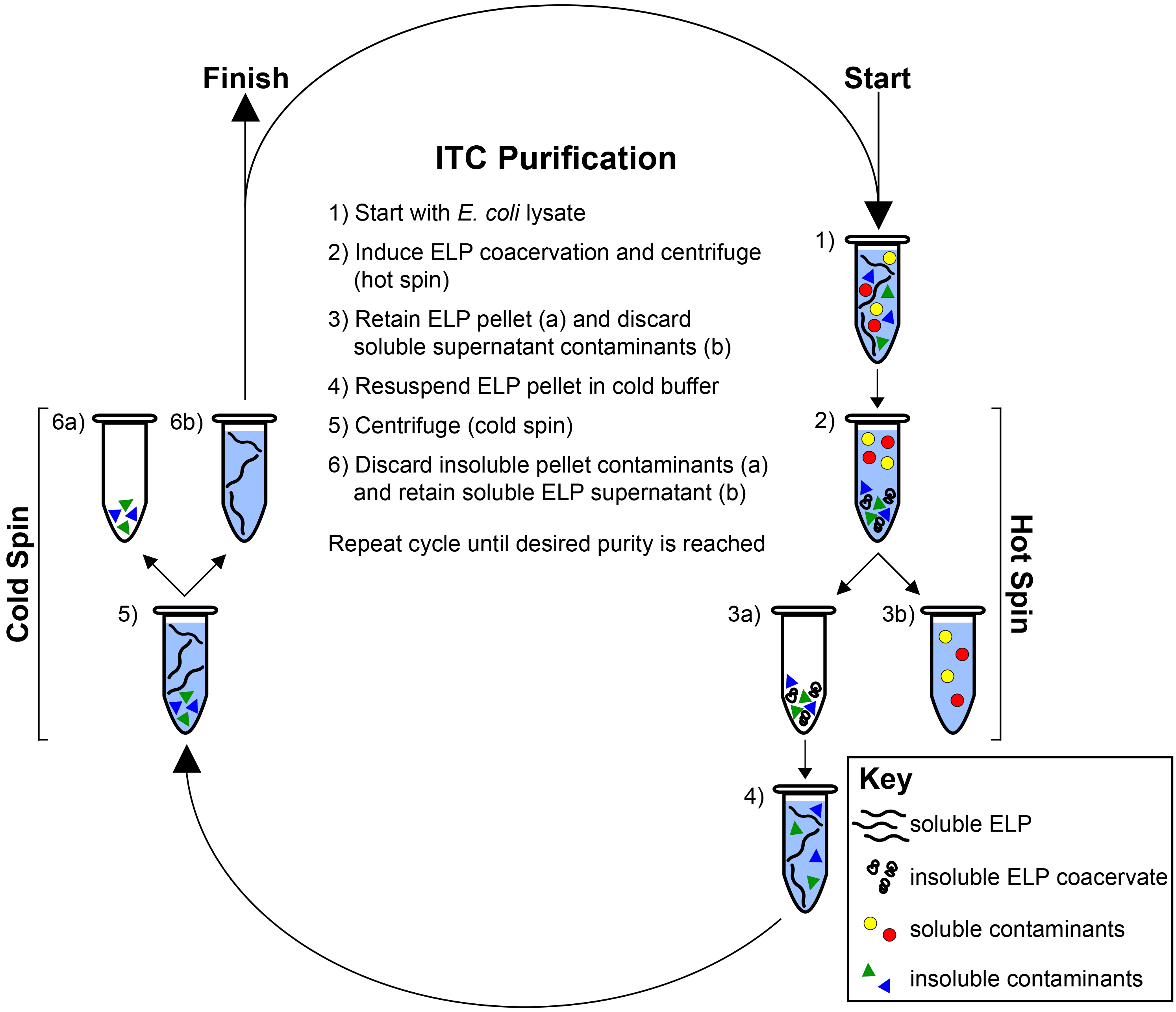
Figura 2. Inverse transizione ciclismo. ELP viene purificato mediante suo comportamento LCST da contaminanti solubili e insolubili. A partire dalla ELP-ricco lisato (1) transizione ELP è indotta con l'aggiunta di calore e / o sale e del PEL è separato mediante centrifugazione (centrifuga caldo) (2). Il pellet PEL viene mantenuto (3a), mentre il supernatante contenente contaminanti solubili viene scartato (3b). Il PEL viene risospeso in tampone freddo (4) e centrifugato di nuovo a 4 ° C (spin freddo) (5). Il pellet contenente contaminanti insolubili viene scartato (6a) mentre il supernatante contenente PEL solubile viene mantenuto (6b). Cicli alternati giri calde e fredde vengono ripetuti fino al raggiungimento della purezza desiderata, come determinato conSDS-PAGE. cliccate qui per vedere una versione più grande di questa figura.
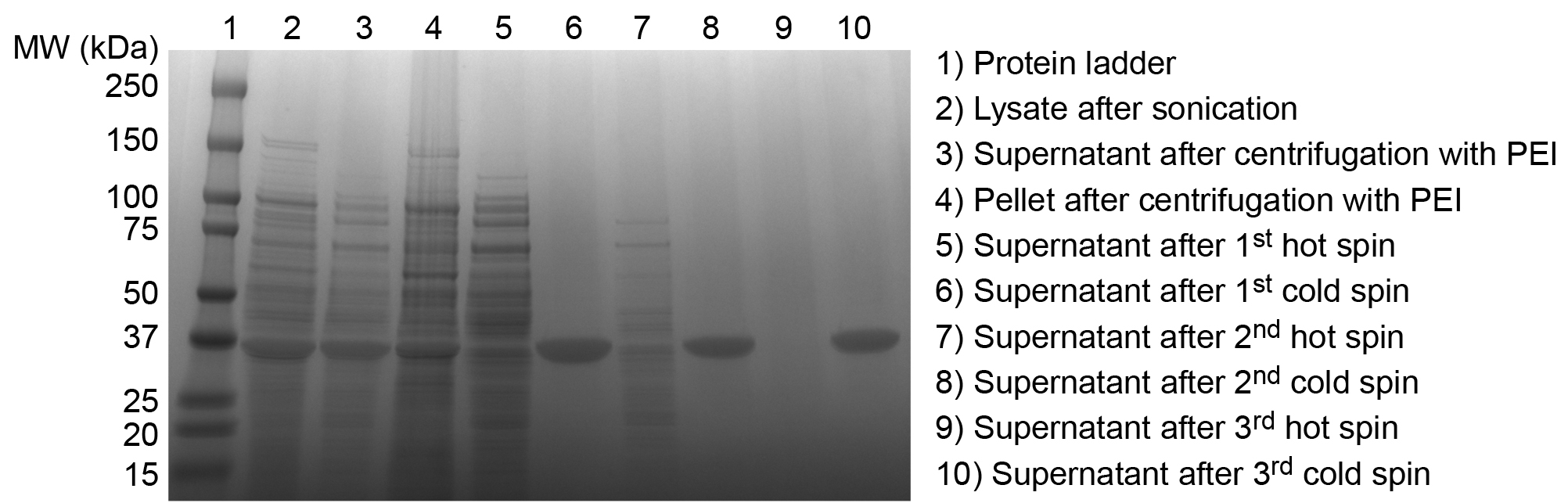
Figura 3. Analisi SDS-PAGE di depurazione prodotti PEL. Purificazione di successo di un PEL è confermata mediante SDS-PAGE. Iperespresso ELP è evidente nel greggio E. lisato coli dopo sonicazione (2). Dopo l'aggiunta di PEI e centrifugazione PEL solubile è sostanzialmente mantenuto nel supernatante (3), anche se alcuni PEL è perso nel pellet scartato di contaminanti insolubili (4). Surnatante seguente prima rotazione calda contiene livelli significativi di contaminanti solubili (5). Surnatante seguente prima rotazione freddo indica una buona separazione delle PEL da contaminanti insolubili (6). Ulteriori cicli di caldo (7) e Cvecchio rotazioni (8) rimuovere contaminanti solubili e insolubili residue, rispettivamente, fino a caldo (9) e di spin freddo (10) surnatanti finali mostrano nessuna banda contaminanti estranei, confermando purezza soddisfacente del prodotto PEL. Questo omopolimero ELP, con una sequenza di SKGPG-(VGVPG) 80-Y, ha un peso molecolare previsto di 33,37 kDa. cliccate qui per vedere una versione più grande di questa figura.
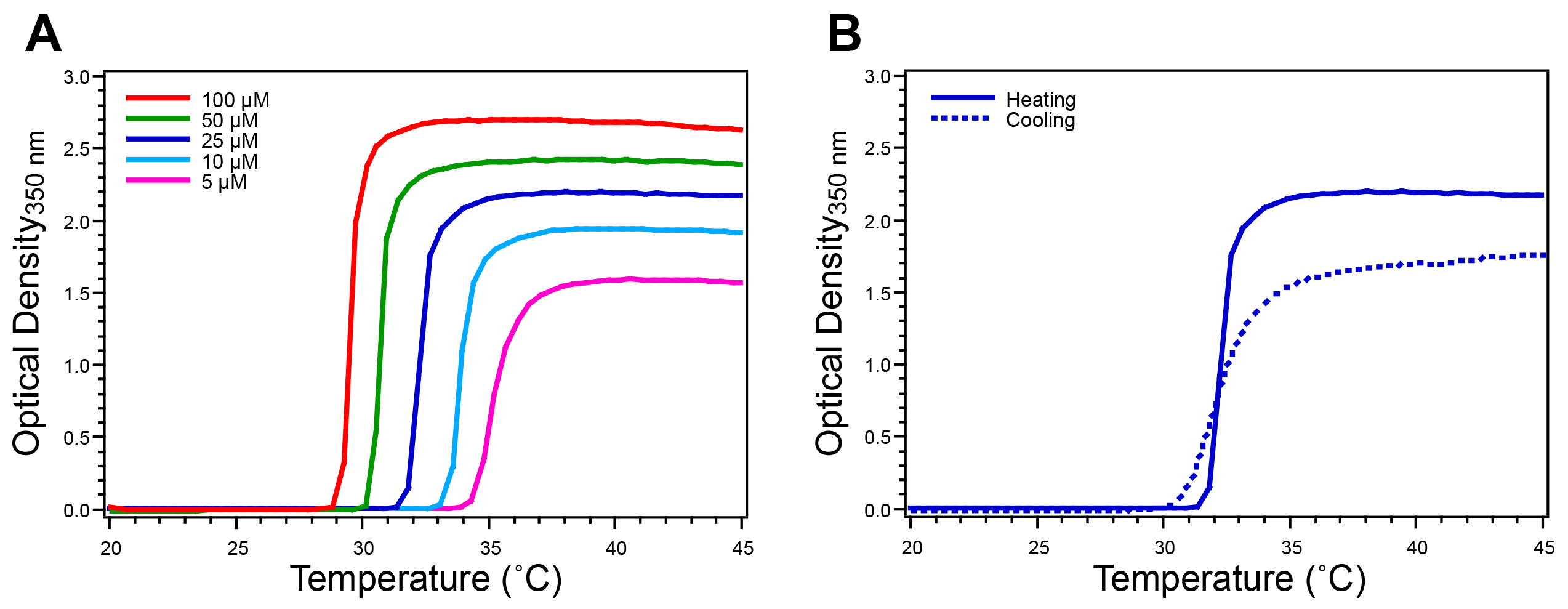
Figura 4. Caratterizzazione di PEL omopolimero mediante turbidimetria a temperatura programmata. Il PEL T t è determinata monitorando la densità ottica a 350 nm, aumentando la temperatura ad una velocità di 1 ° C / min. A) omopolimeri PEL mostra un singolo forte aumento OD che defines loro T t ad una data concentrazione. B) La reversibilità della transizione PEL è verificata monitorando la densità ottica a 350 nm di una soluzione 25 μ M riducendo la temperatura, dove la reversibilità è confermato dal ritorno del OD al basale. Questo omopolimero ELP ha la sequenza SKGPG-(VGVPG) 80-Y. cliccate qui per vedere una versione più grande di questa figura.
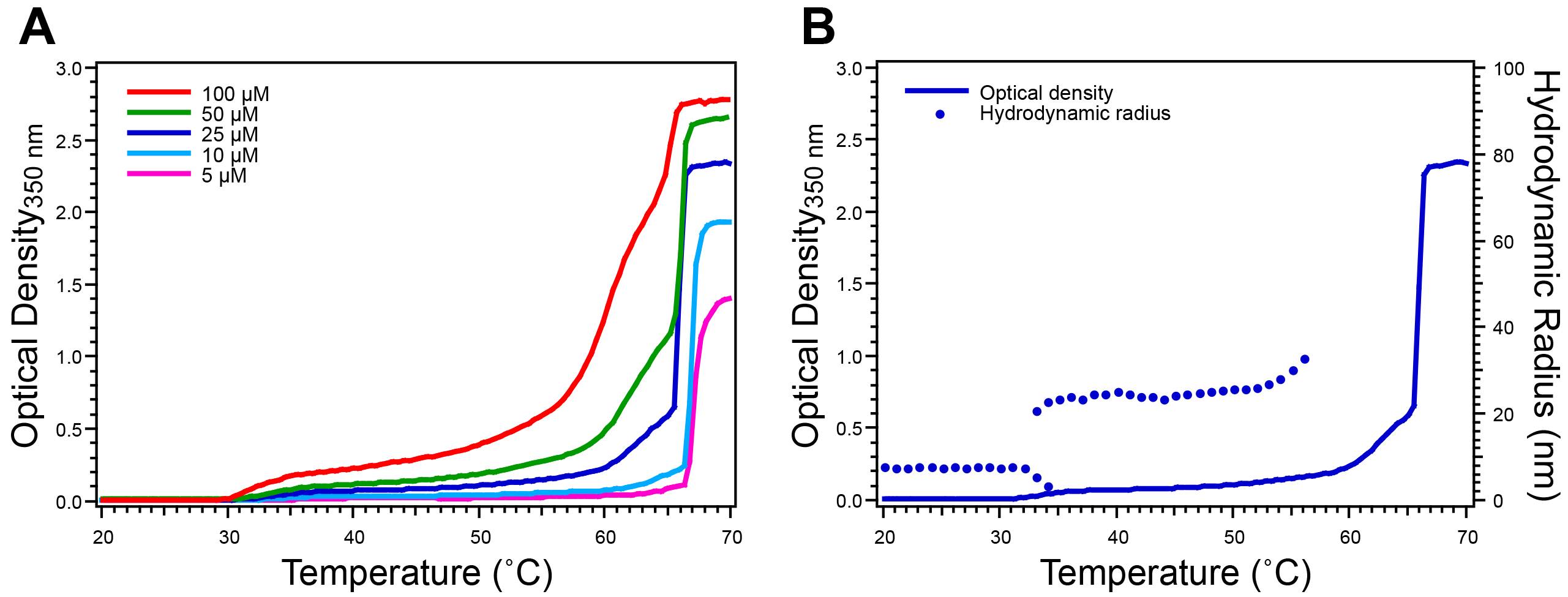
Figura 5. Caratterizzazione di ELP copolimero a due blocchi da turbidimetria temperatura programmata e la dispersione della luce dinamica. PEL che subiscono nano-scala di auto-assemblaggio, come ELP copolimeri a due blocchi che si auto-assemblano in micelle sferiche, presentano profili di torbidità più complesse. A) moderato aumento OD indica il passaggio da unimers a micelle, prima di un rapido aumento OD che indica completa aggregazione PEL in aggregati micron scala B) DLS. misurazioni confermano il comportamento dedotto dal profilo torbidità di soluzione al 25 pM fornendo informazioni sulla variazione di R H rispetto alla temperatura. Qui il Unimer ELP ha una R H ~ 8 nm e micelle ha una R H ~ 25 nm. Questo copolimero diblock ELP ha la sequenza GCGWPG-(VGVPG) 60 - (AGVPGGGVPG) 30-PGGS. cliccate qui per vedere una versione più grande di questa figura.
Discussione
PEL offrono un mezzo poco costoso e privo di cromatografia di purificazione dallo sfruttamento del loro comportamento fase di stimolo-reattiva. Questo approccio sfrutta il comportamento LCST di PEL e peptidi o proteine PEL fusioni per eliminare contaminanti solubili e insolubili dopo espressione PEL geneticamente codificati in E. coli. Questa facilità di purificazione può essere usato per produrre PEL per una varietà di applicazioni, o può essere sfruttata per la purificazione di peptidi o proteine ricombinanti in cui PEL può agire come un tag purificazione che può essere rimosso con il trattamento post-purificazione.
ELP depurazione comporta passaggi preliminari per Lyse E. coli e rimuovere i detriti cellulari genomica e insolubile dal lisato grezzo cultura (Figura 1), seguita dalla rimozione di contaminanti solubili e insolubili residue da ITC (Figura 2). La centrifugazione dopo innescando la transizione ELP dal addizione di calore o sale separa il PEL da contaminanti solubili nel surnatante, in un passo definito uno spin caldo. Dopo resolubilizing PEL, la soluzione viene centrifugata nuovamente ad una temperatura inferiore alla T t per rimuovere il pellet contaminante insolubile, in un passo definito uno spin freddo. Alternando giri calde e fredde migliora la purezza della soluzione PEL ad ogni ciclo, ad un piccolo costo per produrre. Rendimenti di depurazione variano a seconda del t ELP T, la lunghezza e peptidi o proteine fuse. In genere, questo protocollo produce 100 mg di ELP purificato per litro di E. cultura coli, tuttavia rendimenti può raggiungere fino a 500 mg / L. La purezza finale del prodotto PEL è confermata mediante SDS-PAGE (Figura 3). Il MW del purificato ELP deve corrispondere strettamente con la MW teorica codificata dal gene ELP. Tuttavia, alcuni PEL migrano in SDS-PAGE con un apparente MW fino al 20% superiore al loro MW previsto per il 9, 27. Analisi più precisa del ELPMW può essere ottenuto mediante MALDI-TOF-MS, che può anche fornire ulteriori informazioni sulla purezza del prodotto PEL di tecniche analitiche ortogonali quali la cromatografia liquida ad alta prestazione (HPLC).
Dopo la purificazione, l'ELP T t è misurato mediante turbidimetria temperatura programmata. Tale tecnica monitora l'OD di una soluzione PEL quando la temperatura è aumentata. Il T t è dipendente dalla concentrazione quindi è consigliabile a caratterizzare una serie di concentrazioni rilevanti per l'applicazione prevista della ELP. Per PEL omopolimeri il profilo torbidità presenta un unico forte aumento che corrisponde alla transizione PEL da Unimer aggregati micron scala (Figura 4A). Il T t è definita come la temperatura corrispondente al punto di inflessione nel profilo torbidità, determinato con precisione come il massimo della derivata prima della OD rispetto alla temperatura. La reversibilità dellaPEL transizione di fase è confermato da una diminuzione OD al basale come la temperatura viene abbassata al di sotto della T t (Figura 4B). Il profilo di torbidità con l'aumento e la diminuzione rampe di temperatura varia in ampiezza e cinetica dovuta alla composizione di coacervates ELP e isteresi variabile di ELP resolubilization. Peptide o proteina PEL fusioni mostrano un comportamento simile LCST in questo modo, dove il peptide o proteina fusa alla PEL colpisce il T t. Per le proteine PEL fusioni transizione è reversibile sotto della temperatura di fusione della proteina. Mentre turbidimetria a temperatura programmata è un metodo eccellente per la caratterizzazione termica iniziale dei prodotti PEL, tecniche alternative, come la calorimetria differenziale a scansione (DSC), può anche essere usato per misurare il PEL T t.
PEL con più complessi comportamenti termici architetture mostre più complicati che possono anche essere caratterizzati da temperature progratorbidimetria MMED. ELP copolimeri a due blocchi, per esempio, presentano un profilo torbidità caratteristica corrispondente alla loro auto-assemblaggio provocato dalla temperatura in micelle sferiche alla loro temperatura micellizzazione critica. Per tali copolimeri a due blocchi PEL OD tipicamente prima aumenta 0.1-0.5 unità sopra basale indicano la transizione da unimers a micelle, dopo che un forte aumento OD (fino a 2,0 unità rispetto ai valori basali) ad una temperatura superiore indica la formazione di micron scala aggregati (Figura 5A). Ulteriori informazioni sulle strutture ELP auto-assemblati temperatura-triggered si ottiene con DLS, una tecnica che misura la R H di assemblee ELP in soluzione. Cambiamenti nella R H accordo stretto contatto con i cambiamenti in OD misurati con torbidimetria (Figura 5B). Unimers ELP tipicamente esibiscono una R H <10 nm, mentre le assemblee nanoparticelle presentano una R H ~ 20-100 nm e aggregati mostrano una R H > 500 nm. Altre informazioni sui ELP nanoparticelle auto-assemblati, come numero di aggregazione e morfologia, può essere ottenuta mediante diffusione di luce statica o criogenico microscopia elettronica a trasmissione 17, 23, 29.
A causa della modulabilità delle proprietà termiche PEL, una gamma di T t s è ottenuta con vari disegni ELP. È importante tenere presente che l'intrinseca T t influenzerà l'ottimizzazione del protocollo di purificazione per ogni ELP, dove molto alte o basse T t s richiederà più modifiche al presente protocollo standard. PEL con temperature estremamente elevate di transizione possono non essere adatti per la purificazione con questo approccio. Se il disegno di nuove PEL e peptide o proteina PEL fusioni può compromettere la risposta termica del PEL, una semplice etichetta istidina può essere incluso per la purificazione mediante cromatografia di affinità alternativa metallo immobilizzato. Inoltre,caratteristiche della sequenza ELP possono richiedere la modifica di questo protocollo, se il residuo ospite paga. Manipolazione del pH buffer può essere utilizzato come metodo per cambiare la carica complessiva del PEL nel tentativo di eliminare le interazioni elettrostatiche con contaminanti 17. Inoltre, questo protocollo è appropriato per la circostanza speciale di fusioni ELP con peptidi e proteine quando vengono adottate misure adeguate per garantire il processo di depurazione non perturba l'attività della porzione fusa. Note di tutto il protocollo su tali modifiche servono a dirigere la purificazione di PEL, che possono presentare queste sfide rispetto a T t, carica, o preoccupazioni di fusione.
La purificazione del PEL attraverso il loro comportamento LCST presenta un approccio semplice e senza cromatografia per purificare la maggioranza di PEL e peptide o proteina PEL fusioni espressa in E. coli. Il protocollo riassunte qui consente di depurazione of PEL in un solo giorno con attrezzature che è comune alla maggior parte dei laboratori di biologia. La facilità di purificazione del PEL e le loro fusioni sarà, speriamo, favorire una varietà sempre crescente di progetti ELP per nuove applicazioni nella scienza dei materiali, biotecnologie e medicina.
Divulgazioni
Gli autori non hanno concorrenti interessi finanziari da dichiarare.
Riconoscimenti
Questo lavoro è stato supportato dal NSF Research Triangle MRSEC (DMR-1.121.107).
Materiali
| Name | Company | Catalog Number | Comments |
| pET-24a(+) pET-25b(+) | Novagen | 69749-3 69753-3 | T7-lac expression vectors with resistance to kanamycin (pET-24) or ampicillin (pET-25). |
| Ultra BL21 (DE3) competent cells | Edge BioSystems | 45363 | Competent E. coli for recombinant protein expression. |
| Terrific Broth (TB) Dry Powder Growth Media | MO BIO Laboratories | 12105 | Media is reconstituted in DI H2O and autoclaved before use. |
| Isopropyl-beta-D-thiogalactoside (IPTG) | Gold Biotechnology | I2481C | IPTG is reconstituted in DI H2O, sterile filtered, and added to cultures to induce enhanced expression. |
| Phosphate buffered saline (PBS) tablet | Calbiochem | 524650 | These PBS tablets, when dissolved in 1 L of DI H2O, yield a 10 mM phosphate buffer with 140 mM NaCl, and 3 mM KCl with a pH of 7.4 at 25 °C. |
| Polyethyleneimine (PEI) Solution (~50% w/v) | MP Biomedicals | 195444 | PEI is prepared as a 10% (w/v) solution in deionized H2O. |
| Nalgene Oak Ridge high-speed centrifuge tubes, 50 ml | Thermo Scientific | 3138-0050 | These round-bottom tubes withstand high-speed centrifugation of 30-50 ml. |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP-HCl) | Thermo Scientific | 20491 | A stock solution of TCEP-HCl is prepared at 100 mM in DI H2O and adjusted to pH 7.0. For ELPs with a high cysteine content the stock solution of this reducing agent is added to the ELP pellet to reach 10 mM in H2O. |
| Ready Gel Tris-HCl gel, 4-20% linear gradient polyacrylamide gel, 10 well, 30 μl | Bio-Rad Laboratories | 161-1105 | These linear gradient gels offer good visualization of ELPs with a range of MWs. |
| Cupric chloride dihydrate (CuCl2·2H2O) | Fisher Scientific | C454-500 | A filtered 0.5 M solution is prepared for negative staining of Tris-HCl polyacrylamide gels. |
| Anotop 10 syringe filter: 0.02 μm 0.1 μm 0.2 μm | Whatman | 6809-1002 6809-1012 6809-1022 | These 10-mm diameter syringe filters allow preparation of small volumes for DLS measurements. |
| Millex-HV filter: 0.45 μm | EMD Millipore | SLHVX13NK | These 13-mm diameter syringe filters allow preparation of small volumes of solutions with large nanoparticle assemblies for DLS measurements. |
Riferimenti
- Urry, D. W. Physical Chemistry of Biological Free Energy Transduction As Demonstrated by Elastic Protein-Based Polymers. J. Phys. Chem. B. 101, 11007-11028 (1997).
- Sallach, R. E., Conticello, V. P., Chaikof, E. L. Expression of a recombinant elastin-like protein in pichia pastoris. Biotechnology progress. 25, 1810-1818 (2009).
- Schipperus, R., Teeuwen, R. L., Werten, M. W., Eggink, G., de Wolf, F. A. Secreted production of an elastin-like polypeptide by Pichia pastoris. Appl Microbiol Biotechnol. 85, 293-301 (2009).
- Schipperus, R., Eggink, G., de Wolf, F. A. Secretion of elastin-like polypeptides with different transition temperatures by Pichia pastoris. Biotechnology progress. 28, 242-247 (2012).
- Herzog, R. W., Singh, N. K., Urry, D. W., Daniell, H. Expression of a synthetic protein-based polymer (elastomer) gene in Aspergillus nidulans. Appl Microbiol Biotechnol. 47, 368-372 (1997).
- Conley, A. J., Joensuu, J. J., Jevnikar, A. M., Menassa, R., Brandle, J. E. Optimization of elastin-like polypeptide fusions for expression and purification of recombinant proteins in plants. Biotechnology and bioengineering. 103, 562-573 (2009).
- Conrad, U., et al. ELPylated anti-human TNF therapeutic single-domain antibodies for prevention of lethal septic shock. Plant biotechnology journal. 9, 22-31 (2011).
- Kaldis, A., et al. High-level production of human interleukin-10 fusions in tobacco cell suspension cultures. Plant biotechnology journal. 11, 535-545 (2013).
- Meyer, D. E., Chilkoti, A. Genetically encoded synthesis of protein-based polymers with precisely specified molecular weight and sequence by recursive directional ligation: examples from the elastin-like polypeptide system. Biomacromolecules. 3, 357-367 (2002).
- McDaniel, J. R., Mackay, J. A., Quiroz, F. G., Chilkoti, A. Recursive directional ligation by plasmid reconstruction allows rapid and seamless cloning of oligomeric genes. Biomacromolecules. 11, 944-952 (2010).
- Amiram, M., Quiroz, F. G., Callahan, D. J., Chilkoti, A. A highly parallel method for synthesizing DNA repeats enables the discovery of 'smart' protein polymers. Nat Mater. 10, 141-148 (2011).
- Meyer, D. E., Chilkoti, A. Quantification of the effects of chain length and concentration on the thermal behavior of elastin-like polypeptides. Biomacromolecules. 5, 846-851 (2004).
- Urry, D. W., et al. Temperature of Polypeptide Inverse Temperature Transition Depends on Mean Residue Hydrophobicity. Journal of the American Chemical Society. 113, 4346-4348 (1991).
- Urry, D. W. The change in Gibbs free energy for hydrophobic association - Derivation and evaluation by means of inverse temperature transitions. Chem Phys Lett. 399, 177-183 (2004).
- Cho, Y., et al. Effects of Hofmeister anions on the phase transition temperature of elastin-like polypeptides. The journal of physical chemistry. B. 112, 13765-13771 (2008).
- Kim, B., Chilkoti, A. Allosteric actuation of inverse phase transition of a stimulus-responsive fusion polypeptide by ligand binding. J Am Chem Soc. 130, 17867-17873 (2008).
- Hassouneh, W., Nunalee, M. L., Shelton, M. C., Chilkoti, A. Calcium binding peptide motifs from calmodulin confer divalent ion selectivity to elastin-like polypeptides. Biomacromolecules. 14, 2347-2353 (2013).
- Nettles, D. L., Chilkoti, A., Setton, L. A. Applications of elastin-like polypeptides in tissue engineering. Adv Drug Deliv Rev. 62, 1479-1485 (2010).
- MacEwan, S. R., Chilkoti, A. Elastin-like polypeptides: biomedical applications of tunable biopolymers. Biopolymers. 94, 60-77 (2010).
- McDaniel, J. R., Callahan, D. J., Chilkoti, A. Drug delivery to solid tumors by elastin-like polypeptides. Adv Drug Deliv Rev. 62, 1456-1467 (2010).
- Hassouneh, W., Christensen, T., Chilkoti, A. Elastin-like polypeptides as a purification tag for recombinant proteins. Curr Protoc Protein Sci. , (2010).
- Shamji, M. F., et al. Development and characterization of a fusion protein between thermally responsive elastin-like polypeptide and interleukin-1 receptor antagonist: sustained release of a local antiinflammatory therapeutic. Arthritis Rheum. 56, 3650-3661 (2007).
- Hassouneh, W., et al. Unexpected multivalent display of proteins by temperature triggered self-assembly of elastin-like polypeptide block copolymers. Biomacromolecules. 13, 1598-1605 (2012).
- Lan, D. M., et al. An improved nonchromatographic method for the purification of recombinant proteins using elastin-like polypeptide-tagged proteases. Analytical Biochemistry. 415, 200-202 (2011).
- Bellucci, J. J., Amiram, M., Bhattacharyya, J., McCafferty, D., Chilkoti, A. Three-in-one chromatography-free purification, tag removal, and site-specific modification of recombinant fusion proteins using sortase A and elastin-like polypeptides. Angewandte Chemie. 52, 3703-3708 (2013).
- Compton, S. J., Jones, C. G. Mechanism of dye response and interference in the Bradford protein assay. Anal Biochem. 151, 369-374 (1985).
- McPherson, D. T., Xu, J., Urry, D. W. Product purification by reversible phase transition following Escherichia coli expression of genes encoding up to 251 repeats of the elastomeric pentapeptide GVGVP. Protein expression and purification. 7, 51-57 (1996).
- Meyer, D. E., Chilkoti, A. Purification of recombinant proteins by fusion with thermally-responsive polypeptides. Nat Biotechnol. 17, 1112-1115 (1999).
- McDaniel, J. R., et al. Self-assembly of thermally responsive nanoparticles of a genetically encoded peptide polymer by drug conjugation. Angewandte Chemie. 52, 1683-1687 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon