Method Article
Combinazione di Microstereolithography e Electrospinning per la Produzione di Membrane Equipaggiato con nicchie per la rigenerazione della cornea
In questo articolo
Riepilogo
Riportiamo una tecnica per la realizzazione di micropockets all'interno membrane elettrofilate in cui studiare il comportamento delle cellule. In particolare, si descrive una combinazione di microstereolithography e elettrofilatura per la produzione di PLGA (Poly (lattide-co-glicolico)) dispositivi biomateriale corneali dotati microfeatures.
Abstract
Problemi corneali colpiscono milioni di persone in tutto il mondo riducendo la loro qualità di vita in modo significativo. Malattia corneale può essere causata da malattie come l'aniridia o sindrome di Steven Johnson, nonché da fattori esterni come le ustioni chimiche o radiazioni. I trattamenti attuali sono (i) l'uso di innesti corneali e (ii) l'uso di cellule staminali espanso in laboratorio e consegnato su supporti (per esempio, membrana amniotica); questi trattamenti sono relativamente di successo, ma purtroppo possono fallire dopo 3-5 anni. Vi è la necessità di progettare e realizzare nuovi dispositivi biomateriale corneale in grado di imitare in dettaglio l'ambiente fisiologico in cui le cellule staminali risiedono nella cornea. Cellule staminali limbari si trovano nel limbus (zona circolare tra cornea e sclera) in nicchie specifiche conosciute come le palizzate di Vogt. In questo lavoro abbiamo sviluppato una nuova tecnologia di piattaforma che combina due tecniche di produzione all'avanguardia (microstereolithography e electrospinnzione) per la fabbricazione di membrane corneali che imitano una certa misura limbus. Le nostre membrane contengono micropockets artificiali che mirano a fornire le cellule con una protezione come il Palisades di Vogt fare l'occhio.
Introduzione
La cornea, il più esterno del tessuto avascolare centrale dell'occhio, è uno dei più importanti tessuti coinvolti nella visione 1. Ci sono diversi tipi di cellule che mantengono la funzione della cornea. Lo strato superiore più esterno della cornea si compone di cellule epiteliali che possono essere di circa 5-7 strati di spessore 2. Questo strato impedisce invasione batterica nella cornea 3 e permette l'ingresso di ossigeno 4. E 'stato riportato che le cellule staminali dell'epitelio corneale trovano in nicchie o cripte (con dimensioni di 120-150 micron) alla regione periferica della cornea conosciuta come limbus 5,6. Come le cellule staminali si dividono, le cellule figlie noto anche come celle di amplificazione transitori viaggiare fuori delle nicchie e la divisione continua le cellule si muovono centripeto verso l'interno e verso l'alto con conseguente cellule terminalmente differenziate in corrispondenza della zona corneale centrale 7,8. Queste cellule sono normalmente spazzati via con un batter d'occhio exposing nuove cellule sotto 9.
Oltre ad essere la posizione delle cellule staminali epiteliali, limbus gioca anche un ruolo nel mantenere la congiuntiva vascolarizzato dalla regione cornea 10. Danni al limbus potrebbe essere causato da ustioni termiche / chimiche, radiazioni e anche malattie genetiche 10. Quando questo accade, la barriera limbus è ripartito permettendo alle cellule congiuntivali per spostare sulla cornea, vascolarizzante la regione, causando dolore e cecità, in alcuni casi. La condizione è nota come deficit di cellule staminali limbari (LSCD) 10.
Diversi substrati naturali sono stati segnalati come possibili vettori di cellule staminali per aiutare nella rigenerazione della cornea. Ad esempio, le membrane a base di collagene sono stati utilizzati da Dravida et al. 11 e Rama e collaboratori 12 hanno riportato l'uso di fibrina in uno studio con 112 pazienti. Attualmente però il metodo più comunemente usato di trattamentoè quello di utilizzare la membrana amniotica umana da una banca di tessuti e cellule epiteliali limbari cultura sulla sua superficie 13,14. Dopo un monostrato è formata, la membrana amniotica è incollato cella rivolta verso l'alto sulla cornea danneggiata che ha tutte le cellule congiuntivali e tessuto cicatriziale chirurgicamente rimosso da esso prima di questo trapianto di cellule 14. La membrana amniotica degrada nel giro di settimane o mesi lasciando le cellule epiteliali attaccate alla zona denudato per rigenerare l'epitelio 15,16. Questa tecnica ha avuto successo nel ripristinare la visione ma ci sono ancora alcune questioni pratiche che restringono la sua capillare diffusione clinicamente. Poiché la membrana amniotica è tessuto umano ha bisogno di sottoporsi a screening utilizzando buone procedure bancarie tessuto prima di essere utilizzato per il trapianto di cellule su pazienti. Questo lo screening riduce solo il rischio di trasmissione di malattie, ma non può eliminare completamente 17. Oltre a questo ci sono state segnalazioni di variabilità nel prestazioni della membrana amniotica a causa della variazione dei donatori tra 18,19 e diversi metodi di lavorazione 19,20. Accanto al piccolo rischio di trasmissione della malattia vi è l'obbligo per i centri chirurgici di avere accesso alle banche dei tessuti ben gestite, non sono disponibili a tutti.
Sebbene la membrana amniotica è relativamente efficace, è necessario per lo sviluppo di nuove alternative sintetiche biodegradabili carrier cella per il trattamento della malattia corneale. Vettori sintetici potrebbero eliminare la necessità di procedure bancarie, nonché eliminando il piccolo rischio di trasmissione di malattie e di variabilità inter-donatore. In questo senso, materiali come polietilene glicole 21,22 e 23,24 PLGA sono stati studiati.
Nello sviluppo di una alternativa di sintesi alla membrana amniotica umana vi è anche la possibilità di progettare in esso caratteristiche desiderabili per aiutare spera la sopravvivenza delle cellule in coltura. Il inclusion di microfeatures all'interno di dispositivi di biomateriali per il controllo specifico del comportamento delle cellule è un settore emergente di interesse. Molti autori hanno riportato il lavoro verso lo sviluppo di cellule staminali artificiali nicchie 25-30. Questo gruppo ha recentemente segnalato la creazione di un PEGDA limbo artificiale microfabbricazione fibronectina-biofunctionalized per la consegna delle cellule epiteliali limbari 22 e una metodologia per la realizzazione di membrane biodegradabili elettrofilate contenenti tasche microfabbricati per il sostegno delle cellule epiteliali limbari 31.
Lo scopo di questo lavoro è quello di sviluppare una nuova tecnologia di produzione per lo sviluppo di dispositivi biomateriali contenenti microfeatures che imitano in misura i microambienti in cui le cellule staminali risiedono nel corpo. Abbiamo sviluppato una tecnica che combina microstereolithography e elettrofilatura che permette la realizzazione di membrane microstrutturate biodegradabili che mostrano Great potenziale per le applicazioni di rigenerazione dei tessuti.
È importante notare che, sebbene in questo lavoro questa tecnica è stata applicata alla fabbricazione di anelli per la rigenerazione della cornea, la tecnologia può essere applicata alla fabbricazione di dispositivi per la rigenerazione di una vasta gamma di tessuti epiteliali, ad esempio, la pelle, orale epiteli mucosa, intestino, delle vie respiratorie, e della vescica. In particolare, in questo studio abbiamo sviluppato una membrana biodegradabile sintetico che funziona in modo simile alla membrana amniotica per fornire cellule alla cornea. Questa membrana contiene micropockets di circa 300 micron (più grandi delle cripte limbari dei Pallisades di Vogt (circa 150 micron)). Infine, abbiamo stabilito un protocollo di confezionamento che consente queste membrane devono essere conservati a -20 ° C per più di 6 mesi senza mostrare alcun segno di rottura.
Protocollo
Etica Dichiarazione: Gli occhi utilizzate in questo studio sono stati utilizzati secondo la Dichiarazione sulla politica di trasparenza per la ricerca degli animali:
1 Fabbricazione di PLGA biodegradabili Membrane Dotato di Micropockets
- I ponteggi anello sono stati creati da una combinazione di microstereolithography e electrospinning tecniche 31. In sostanza, il processo può essere riassunto in due parti (i) la creazione di modelli PEGDA da microstereolithography e (ii) elettrospinning sui modelli per la riproduzione della struttura PEGDA sottostante (in questo caso un anello microfabbricazione). Queste due fasi sono descritte in dettaglio di seguito (figure 1 e 2).
- Realizzazione di modelli PEGDA da microstereolithography (microSL)
- Realizzare gli anelli utilizzando un modello 2 strati, con il primo strato (L1) essendo la base della struttura e il secondo strato (L2) presentando 6 micropockets con Morphologi cavalloes in una gamma di dimensioni 300-500 micron. La fabbricazione di anelli PEGDA è stato recentemente descritto da questo gruppo 22.
- Crea L1 disegnando un cerchio 1,2 centimetri nero utilizzando qualsiasi programma di disegno adatto.
- Creare L2 allo stesso modo, ma comprendono 8 strutture a forma di ferro di cavallo 0,5 x 0,35 millimetri bianco. Distribuire i piccoli ferri di cavallo bianchi all'interno della struttura cerchio nero.
- Salva L1 e L2 in formato JPEG.
- In un flacone di vetro scuro, mescolare polietilenglicole diacrilato (PEGDA, Mn = 250 g / mol) con 1% w / w canforochinone, un fotoiniziatore, su un agitatore magnetico per 20 min.
- Espandere il raggio laser del microstereolithography set-up utilizzando una disposizione lente telescopica e poi proiettarla su un dispositivo digitale multimirror computer programmabile (starter kit DMD-UV abilitato). NOTA: La DMD riflette l'immagine (in questo caso un anello) su uno specchio attraverso una lente del tubo lunghezza focale di 10 cm. L'immagine viene poi diretto dal silver-coaspecchio ted in un flacone contenente il polimero photocurable (PEGDA).
- Regolare e pulire accuratamente l'ottica del microstereolithography impostato.
- Mettere 300 microlitri della miscela PEGDA in un pozzetto di una piastra di coltura tissutale 12 pozzetti. Assicurarsi che i pozzetti sono pre-rivestite con Teflon o altro materiale antiaderente per una facile rimozione della struttura dopo il trattamento.
- Accendere il laser blu (MBL-III 473 nm; 150 mW) e caricare L1 nel software ALP3-base già installati sul PC. Irradiare il primo strato per 60 sec. NOTA: ALP3-base è un'interfaccia USB che consente il collegamento tra il PC e il dispositivo micromirror digitale.
- Aggiungere al pozzo 250 microlitri più del PEGDA, caricare L2 come descritto sopra e irradiare L2 per 60 sec.
- Rimuovere il polimero polimerizzato e lavare l'anello con isopropanolo O / N.
- Realizzare gli anelli utilizzando un modello 2 strati, con il primo strato (L1) essendo la base della struttura e il secondo strato (L2) presentando 6 micropockets con Morphologi cavalloes in una gamma di dimensioni 300-500 micron. La fabbricazione di anelli PEGDA è stato recentemente descritto da questo gruppo 22.
- Fabbricazione di Biodegradabile PLGA membrane utilizzando elettrofilatura
NOTA: Gli anelli PEGDA sono stati utilizzati come modellos su cui PLGA è stato elettrofilate con il PLGA riprodurre la topografia sottostante in quanto è filata su questi modelli. Dopo la filatura, il foglio di PLGA polimero è stato sfogliato dal collettore. La membrana finale PLGA non conteneva gli anelli PEGDA che erano stati lasciati attaccato al collettore metallico.- Distribuire gli anelli PEGDA su un foglio di alluminio elettrolitico (12 cm x 20 cm) per la creazione di un collettore electrospinning statica.
- Fissare gli anelli con nastro di carbonio conduttivo. NOTA: Questi anelli, una volta formati possono essere ri-utilizzati come modelli per electrospinning.
- Preparare la soluzione di polimero per la filatura. Sciogliere PLGA (50/50 DL-lattide (52 mol%): glicolide (48 mol%), 44 kg / mol) in diclorometano (DCM) a 20% w / w concentrazione.
- Mescolare O / N prima dell'uso.
- Siringhe Place 4 insulina (blunt ended, aghi di 0,8 centimetri di diametro interno) su una pompa a siringa. NOTA: Quattro siringhe garantita più rapida elettrofilatura che lavorare con una sola siringa.
- Caricare 2,5 ml di soluzione di PLGA in ogni siringa.
- Electrospin utilizzando una portata / min 30 ml e tensioni da 12 a 15 kV. Lasciare una distanza tra gli aghi e il collettore di 15 cm.
- Electrospin per 1 ora e 30 minuti e, infine, buccia attentamente il foglio elettrofilate PLGA dal collettore sostenere gli anelli PEGDA.
- Tagliare i ponteggi elettrofilate in 22 circoli mm di diametro con un foro circolare pugno e lasciando la struttura ad anello posizionato al centro.
- Realizzazione di modelli PEGDA da microstereolithography (microSL)
Stoccaggio 2. a lungo termine di PLGA microfabbricati Membrane
Nota: Gli anelli PLGA sono stati fabbricati e sterilizzati da società esterne accreditate; campioni sono stati irradiati con un intervallo di dose esterna di 25-40 KGy.
- Montare la membrana in un piccolo contenitore (scatola di Petri in plastica) e metterlo in una busta di grado medico.
- Usare carta da filtro per creare piccoli sacchetti filtro per gli essiccanti. To creare le borse, piegare la carta da filtro (125 mm di diametro) e tagliare il semicerchio conseguente a metà; quindi sigillare le estremità insieme con del nastro.
- Riempire tre sacchetti di carta da filtro con 1 g di silice arancione, cobalto (II) cloruro, e rame (II) solfato, rispettivamente.
- Mettere i tre sacchi di essiccante all'interno del sacchetto di grado medico con la membrana elettrofilate.
- Aggiungere alla borsa un indicatore di umidità sei posto schede disponibile in commercio per rilevare qualsiasi accumulo di umidità durante il periodo di stoccaggio.
- Usare una macchina per saldatura a caldo per aspirare e sigillare il sacchetto.
- Invia le membrane anello ad una società esterna per la γ-irradiazione.
- Conservare γ-irradiati membrane PLGA in un'ampia gamma di temperature da -20 ° C a +37 ° C in ambiente umido all'interno di un incubatore al 5% di CO 2.
- Stoccaggio Post, esaminare l'indicatore di umidità per confermare che il livello di umidità è al di sotto del 30%.
- Use microscopia elettronica a scansione (SEM) per valutare l'integrità della fibra.
3 Isolamento di limbare Espianti
Coniglio espianti limbari sono stati isolati da occhi di coniglio (ottenuti da una fattoria dove i conigli sono allevati per il consumo).
- Disinfettare gli occhi di coniglio con soluzione antisettica (3%).
- Pulire gli occhi eliminando qualsiasi tessuto in eccesso che circonda la cornea.
- Separare regione limbare (identificata come un'area circolare sottile tra la cornea (trasparente) e la sclera (bianco)) dal resto della cornea utilizzando un microscopio di dissezione.
- Tagliare a spicchi (lunghi circa 1,5 cm) sotto il microscopio dissezione.
- Disinfettare i segmenti limbari in soluzione antisettica 1,5% per 1 min.
- Tagliare i segmenti limbari in piccoli pezzi (100-500 micron) con una lama di bisturi.
- Conservare i piccoli pezzi di tessuto in coltura (DMEM + Glutamax: Ham's F12 (1: 1), siero fetale bovino al 10%, 1 U / ml pennaicillin, 100 mg / ml di streptomicina, 2,5 mg / ml di amfotericina, 10 ng / ml di EGF, e 5 mg / ml di insulina) a 37 ° C e 5% di CO 2 fino al momento dell'uso (non più di 60 min).
4. conseguenza di celle da limbare Espianti
Coniglio espianti limbari sono stati collocati su entrambi membrane microfabbricati appena filate e membrane che erano e immagazzinati per 6 mesi a -20 ° C sottovuoto.
- Rivestire le scaffold anello con 15 ml di colla di fibrina (miscela 1: 1 di fibrinogeno da plasma umano ad una concentrazione di 18,75 mg / ml di trombina e dal plasma umano ad una concentrazione di 2,5 U / ml) usando un raschietto cellulare per la distribuzione di fibrina in modo uniforme.
- Posizionare gli espianti di tessuto direttamente sulle micropockets PLGA utilizzando un ago da 25 G e un microscopio da dissezione.
- Aggiungi terreni di coltura di cellule molto delicatamente per evitare di staccare gli espianti.
- Modificare i media ogni 3 giorni (ricetta dei media descritto nella sezione 3.7) e kPEE in coltura per 2 settimane in un incubatore umidificato a 37 ° C e 5% di CO 2.
- Fissare i campioni con 3,7% di formaldeide tamponata per 10 minuti seguito da 3 lavaggi con PBS.
- Controcolorare da incubazione a 1 mg / ml di 4 ', 6-diamidino-2-fenilindolo (DAPI) o ioduro di propidio (PI) per 10 min a RT.
- Lavare 3 volte in PBS e conservare i campioni coperti con un foglio.
- Immagine i campioni utilizzando un microscopio a fluorescenza a lunghezze d'onda di 543 nm e 800 nm (due fotoni).
Impostazione 5.-up coniglio ferito Modelli Cornea 3D
- Pulire e disinfettare gli occhi di coniglio come descritto sopra.
- Ferita gli occhi di coniglio immergendole in idrossido di ammonio 0,14% per 5 min.
- Sciacquare gli occhi in PBS e raschiare l'epitelio con un coltello sclerotome.
- Tagliare e isolare il pulsante cornea-sclerale rimuovere qualsiasi tessuto rimanente.
- Posizionare le cornee lato epiteliale verso il basso sullauna tazza sterile e riempire con il 0,5% agar made in DMEM.
- Una volta impostato, mettere le cornee lato epiteliale alto, in piccole capsule di Petri e aggiungere mezzi di coltura (ricetta descritta in precedenza) fino alla zona limbare. NOTA: Non coprire l'intera cornea; mantenere la coltura dell'organo all'interfaccia aria-liquido.
6 Isolamento di limbari espianti e l'inclusione di Ring Ponteggi in Coniglio modelli Cornea 3D
- Rivestire le membrane ad anello con 15 ml di colla di fibrina (miscela 1: 1 di fibrinogeno ad una concentrazione di 18,75 mg / ml di trombina e ad una concentrazione di 2,5 U / ml) .Use un raschietto cellulare come sopra descritto.
- Posizionare gli espianti di tessuto direttamente sulle micropockets PLGA utilizzando un ago da 25 G e un microscopio da dissezione.
- Posizionare gli anelli con gli espianti di tessuto sulle cornee denudati con espianti rivolti verso l'alto e in condizioni di interfaccia aria-liquido. (Queste condizioni sono state precedentemente descritte 22).
- Mantenere i modelli di coltura d'organo per4 settimane in un incubatore umidificato a 37 ° C e 5% di CO 2 modificando i media ogni 2 giorni.
7 Valutazione della cornea Rigenerazione e cellule staminali manutenzione
- Dopo 4 settimane, riparare le cornee con 3,7% di formaldeide.
- Elaborare le cornee per istologia convenzionale per la produzione di 6 micron sezioni in paraffina.
- Colorare con ematossilina ed eosina (H & E).
- Per immunocitochimica, sparaffinatura sezioni in xilene (3min) e reidratare in 100% di etanolo (1 min), il 70% di etanolo (1 min), e acqua distillata (2 min).
- Delineare le sezioni usando una penna Dako per delimitare piccole aree ed evitare l'uso eccessivo di anticorpi.
- Trattare le aree delineate con tripsina 0,05% (100 ml) per 20 min (37 ° C).
- Lavare accuratamente con PBS e aggiungere 100 ml di siero del 10% di capra (blocco) per 1 ora.
- Incubare i campioni con 100 ml di topo anticorpo monoclonale cytokeratin 3 (CK3) e 100 ml di p63 nel siero O / N 1% di capra a 4 ° C.
- Lavare con PBS e trattare con 100 ml di biotinilato anticorpo anti-topo secondario (1: 1.000 nel 1% di siero di capra) per 1 ora a temperatura ambiente.
- Aggiungere 100 ml di FITC-streptavidina (1: siero di capra 100 in 1%) per 30 min a RT.
- Trattare i campioni con DAPI come descritto sopra.
- Immagine i campioni utilizzando un microscopio a fluorescenza a lunghezze d'onda di 800 nm (a due fotoni) e 488 nm.
Risultati
Anelli elettrofilate microfabbricati sono stati prodotti utilizzando una combinazione di microstereolithography e elettrofilatura (figure 1 e 2). PEGDA anelli di diverse dimensioni sono stati fabbricati usando microstereolithography (Figura 3); questa tecnica permette alle strutture di fabbricazione dell'ordine di centimetri e l'inserimento simultaneo di microfeatures. In questo caso, anelli di diametri che vanno 1,2-1,6 cm contenenti micropockets di 350-500 micron, sono state realizzate (Figura 4).
In termini di produzione, sterilizzazione e confezionamento di materiali per uso futuro clinico è stato accertato che il confezionamento sottovuoto in sacchetti di grado medico ha migliorato significativamente la capacità di raggiungere una conservazione a lungo termine delle membrane PLGA (Figura 5); l'utilizzo di un sacchetto di grado medico (PET / stagnola / LDPE) con spessore di 0,12 mm Facci permesso di raggiungere una più lunga conservazione. Questo è stato studiato con l'invio membrAnes ai nostri collaboratori in India e le membrane sono stati conservati per un periodo di mesi a -20 ° C, a temperatura ambiente ed a 37 ° C in condizioni umide (volutamente un incubatore umido). Figura 5 mostra che utilizzando le condizioni deliberatamente provocatorie di conservazione a 37 ° C in condizioni di umidità, le membrane erano solo stabile per circa 1 mese in condizioni di sottovuoto non confezionato, ma ottiene 3 mesi di immagazzinaggio in condizioni di sottovuoto (Figura 5 e Tabella 1).
La tabella 1 mostra il miglioramento delle condizioni di conservazione che possono essere raggiunti anche in condizioni selezionate di essere favorevole alla assorbimento di acqua e fibre gonfiore se si presta attenzione alla scelta del sacchetto utilizzato.
Gli anelli supportati escrescenza cellulare da espianti limbari in condizioni diverse (i) anelli appena fatte e (ii) anelli conservati per 6 mesi (Figura 6). Trasferimento cellulare è stato raggiunto dopo 4 settimane quando placing le membrane PLGA sui modelli 3D feriti. Le cellule cresciute fuori dalle espianti tissutali poste sulle membrane creando un nuovo epitelio sulle cornee precedentemente denudati (Figura 7). Positivi (cornee senza alcun trattamento) e controlli negativi (cornee) feriti sono stati mantenuti in coltura per gli stessi periodi di tempo. I controlli negativi hanno confermato l'assenza di formazione di un nuovo epitelio in assenza di cellule aggiunte. Immunocitochimica dimostrato che le cellule che crescono fuori dalle espianti erano cellule epiteliali corneali da quando erano positive per il marcatore corneale differenziazione CK3 (Figura 7E).

Figura 1 Schema di microstereolithography istituito per la creazione di anelli PEGDA.
her.within-page = "always"> 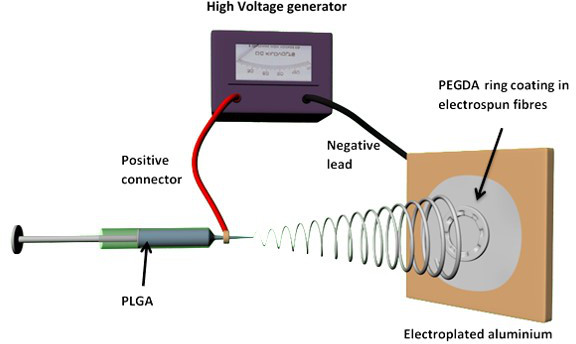
Figura 2 Schema del processo elettrospinning utilizzando anelli PEGDA microfabbricati come modelli.

Figura 3 (A) mostra un esempio di un collettore statico (foglio di alluminio elettrolitico con anelli PEGDA) per la filatura delle membrane PLGA microfabbricati. (B) e (E) mostra diverse stuoie elettrofilate stati sbucciati da collettori statici. (C) mostra Modelli PEGDA di diverse dimensioni evidenziando la versatilità di utilizzo microstereolithography per la realizzazione della superficie sottostante. (D) mostra un PLGA microfabbricati replica./files/ftp_upload/51826/51826fig3highres.jpg "target =" _blank "> Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4 Immagine SEM di un anello PEGDA con microfeature cavallo (A); alto ingrandimento Immagine SEM di una tasca microfabbricazione (B). Contrasto di fase immagine di un anello PLGA con un microfeature ferro di cavallo (C); immagine alto ingrandimento contrasto di fase di una tasca microfabbricazione (D). Cliccate qui per vedere una versione più grande di questa figura.

Figura 5 Effetto della temperatura e del tempo di stoccaggio del vuoto e non confezionato sottovuoto PLGA (50/50) membrane (44 kg / mol) con anelli micro-fabbricato più di 6 mesi. integrità della membrana è stato segnato come fibre intatte (+++), qualche fibra gonfiore (++), la fusione della fibra (+) o senza fibre intatte (-). Immagini SEM e tre disidratanti (arancione silicio, cobalto (II) cloruro, e rame (II) solfato) non mostrano variazioni di integrità o di umidità fibra. Cliccate qui per vedere una versione più grande di questa figura.

Figura 6 immagini che mostrano fluorescenza conseguenza di LEC da espianti limbari su appena fatte anelli PLGA biodegradabili (A, B) e sul ring dopo 6 mesi di conservazione a -20° C (C, D). Immagini (A) e (B) corrispondono a cellule colorate con DAPI (blu) e ioduro di propidio (rosso), rispettivamente. Immagine b è una vista ortogonale da un confocale z-stack di un espianto posto su una tasca microfabbricazione. Immagini (C) e (D) mostrano positività per p63 (verde). Cliccate qui per vedere una versione più grande di questa figura.

Figura 7 (A) mostra un coniglio ferito modello cornea con un anello scaffold e tessuti espianti posti sul ponteggio precedentemente rivestito con colla di fibrina (B) e (C) sono controlli positivi e negativi.; il controllo positivo è un fresco rabbino . t cornea e il controllo negativo una cornea dove l'epitelio è stato volutamente rimosso (il controllo negativo è stato anche colto per 4 settimane) (D) è un H & E l'immagine di un tessuto ingegnerizzato cornea dopo 4 settimane in coltura; la figura mostra il nuovo epitelio multistrato formata dalle cellule che escono dagli espianti posti sulle nicchie (E) è un'immagine che mostra immunocitochimica escrescenza cellulare da un espianto limbare.; nuclei sono colorati con DAPI (blu) e le cellule mostrano positività per citocheratina 3, un marker di differenziazione corneale (verde). Cliccate qui per vedere una versione più grande di questa figura.
| PLGA (50/50) | |||||||
| Giorno 0 | Mese 1 | Mese 2 | Mese 3 | Mese 4 | Mese 5 | Mese 6 | |
| Non sottovuoto | +++ | - | - | - | - | - | - |
| Vacuumed (Bag A) (PE, PA Composite) Spessore: 0,14 millimetri | +++ | + | - | - | - | - | |
| Vacuumed (Bag B) (PET / Foil / LDPE) Spessore: 0,75 millimetri | +++ | +++ | +++ | + | - | - | - |
Tabella 1 Effetto di sacchetti di vuoto e di stoccaggio diversa integrità del PLGA (50/50) membrane (44 kg / mol) hanno esaminato più di 6 mesi di conservazione. Integrità della membrana è stato segnato come fibre intatte (+++), alcune fibre gonfiore (++), fusione della fibra (+) o senza fibre intatte (-).
Discussione
Questo studio descrive (a) una tecnica per la realizzazione di membrane elettrofilate contenente microfeatures al loro interno e (b) come preparare tali membrane per l'uso clinico da imballaggio di vuoto, raggi gamma e lo stoccaggio poi prima dell'uso. In questa particolare applicazione che abbiamo sviluppato membrane PLGA contenenti micropockets che imitano le caratteristiche fisiche delle nicchie di cellule staminali limbari. Gli obiettivi di questo studio sono: (i) per descrivere i metodi per fornire ai lettori le conoscenze necessarie per progettare e fabbricare scaffold contenenti microfeatures per la ricerca sul contributo di nicchie di cellule staminali per la rigenerazione dei tessuti e (ii) di fornire al lettore una migliore comprensione di come memorizzare ponteggi elettrofilate per lunghi periodi di tempo.
In termini di applicazione clinica, la memorizzazione delle membrane ad anello è di fondamentale importanza. In questo lavoro, la degradazione dell'anello è stato studiato in un periodo di 6 mesi. Degradazione delmembrane è guidato da idrolisi così semplicemente mantenendo le membrane di umidità-libera il processo viene fermato. Blackwood et al. Riferito che variando il rapporto di PLA di PGA, la degradazione della membrana cambia 32. Questo studio ha anche dimostrato che aumentando la quantità di PGA, il tasso di degradazione delle membrane elettrofilate aumentato in vivo 22. Qui è stato dimostrato che con sottovuoto membrane insieme ad alcuni essiccante e irradiante e la loro memorizzazione a bassa temperatura per 6 mesi, non vi è alcun cambiamento nella integrità e la degradazione della fibra. Allo stato attuale, a 6 mesi è quanto abbiamo studiato con queste membrane contenenti micropockets ma i dati di archiviazione per 1 anno è stato segnalato su membrane elettrofilate pianura a -20 ° C e 22 ora abbiamo dati inediti per la loro conservazione a -20 ° C per 2 anni senza alcun segno di degrado. Così per la conservazione a lungo termine sarebbe consigliabile asciugare conservare a -206; C ma è possibile conservarli a RT anche in India per almeno 6 mesi (possibilmente molto più lungo). L'inclusione di un indicatore di umidità dà un mezzo semplice per verificare che l'imballaggio ha mantenuto le membrane secche nel qual caso sarà in forma per lo scopo.
Trasferimento di cellule da questi anelli a modelli cornea 3D è stato mostrato durante il posizionamento espianti limbari entro i micropockets. Questo gruppo ha recentemente riportato il trasferimento di cellule su un modello in vitro di coniglio cornea mettendo espianti su membrane piane PLGA (membrane senza strutture ad anello) 24. Utilizzando il presente ponteggi microfabbricati trasferimento di cellule è stato fatto un passo ulteriore, come possiamo ora individuare specificamente espianti di tessuto all'interno delle microfeatures. La possibilità di collocare gli espianti direttamente all'interno delle nicchie consente inoltre al chirurgo di utilizzare le membrane direttamente in sala chirurgica evitando la necessità di una camera sterile per espandere prima le cellule staminali limbari. Anche se questo pezzo di work è stata focalizzata sullo sviluppo di dispositivi per la malattia corneale, questa tecnologia microfabbricazione può essere applicata anche per lo sviluppo di dispositivi per molte altre applicazioni. I lavori futuri esplorerà la realizzazione di costrutti per la rigenerazione di altri tessuti come la pelle e ossa.
Mentre la progettazione e la fabbricazione iniziale delle microstrutture PEGDA può richiedere molto tempo, una volta fabbricato le strutture possono essere riutilizzati più volte senza degradazione. Pertanto, la successiva realizzazione di membrane biodegradabili PLGA microstrutturata da elettrospinning può essere effettuata ad una velocità paragonabile alla produzione di strisciamento ('non strutturati') membrane dopo il montaggio del collettore. Anche se in questo lavoro abbiamo utilizzato microstereolithography per la fabbricazione degli stampi, potrebbero essere utilizzati anche altri metodi di fabbricazione come il 3D-stampa o stampaggio a iniezione. Di conseguenza, lo stampo sottostante potrebbe essere realizzato con altri polimeri o metalli invece di PEGDA. Come tale questa tecnica è molto versatile e ricercatori può facilmente adattare il metodo per soddisfare i propri bisogni e le strutture.
La casa in-microstereolithography set-up utilizzato in questo studio non consentirà la preparazione di costrutti con le caratteristiche sotto 30μm; questa non è una limitazione di applicazione corneale qui descritto ma potrebbe essere fondamentale nella progettazione di altri modelli. In tal caso altre tecniche come 2 fotone polimerizzazione (2PP) potrebbe essere di interesse ma la tecnica elettrofilatura potrebbe non consentire la riproduzione delle strutture su scala sub-micron (questo è attualmente in fase di studio da parte del nostro gruppo).
Passaggi critici all'interno del processo di fabbricazione sono (i) Evitare l'overcuring dei modelli PEGDA che possono essere controllati da tempo e quantità di fotoiniziatore regolazione. (Ii) Controllo condizioni electrospinning quali la temperatura e l'umidità. (Iii) Memorizzazione adeguatamente il electrospumembrane anello n utilizzando sottovuoto e disidratanti.
In sintesi, ponendo espianti tissutali limbus nei microfeatures della membrana abbiamo dimostrato escrescenza cella da espianti su settori di nicchia, trasferimento cella su una cornea di coniglio ferito e successiva riepitelizzazione della cornea. La degradazione delle membrane conservati a temperature diverse è stato anche studiato e un protocollo di imballaggio che permette una conservazione a lungo termine delle membrane è stata sviluppata, quest'ultimo essendo essenziale nello sviluppo di membrane per uso clinico.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
We gratefully acknowledge funding from the Wellcome Trust Affordable Healthcare for India and an EPSRC Landscape Fellowship for Ilida Ortega as well as contributions from The Electrospinning Company Ltd.
Materiali
| Name | Company | Catalog Number | Comments |
| Poly (lactic-co-glycolic acid) | Purac | PDLG5004 | |
| Dichloromethane | Sigma Aldrich Or Fisher | 270997 Or D/1850/17 | >99.8% contains 50-150 ppm amylene stabilizer |
| Digital Micromirror Device (DMD) Discovery 1100 Controller Board & Starter Kit | Texas Instruments | 1076N732 (UV) | |
| 473 nm Laser | Laser 2000 | MBL-III | 150 mW |
| Poly (ethylene glycol) diacrylate | Sigma Aldrich | 475629 | Mn = 250 g/mol, 500 ml |
| DEMEM + Glutamax | Fisher | 12077549 | |
| Ham’s F12 | Labtech biosera | LMH1236/500 | |
| Fetal Bovine Serum | Labtech biosera | FB-1090/50 | |
| EGF | R&D | 236-EG-200 | |
| Insulin | Sigma Aldrich | 91077C-1G | |
| Amphotericin | Sigma Aldrich | A2942-100ml | |
| Penicillin/streptomycin | Sigma Aldrich | P0781-100ml | |
| DAPI | Sigma Aldrich | 32670 | |
| Propidium iodide | Sigma Aldrich | P4864 | |
| Thrombin | Sigma Aldrich | T9326 | |
| Fibrinogen | Sigma Aldrich | F3879 | |
| p63 | Sigma Aldrich | P3737 | |
| CK3 | Merck Millipore | CLB218 | |
| Hematoxylin | SLS | HHS16-500ML | |
| Eosin | Sigma Aldrich | HT110232-1L | |
| Medical grade bag (PET/Foil/LDPE) Peelable pouch | Riverside Medical Ltd. Derby, UK | Foil laminate PET/Foil/LDPE, (12,7,50) | |
| Gamma- irradiation (Sterilization) | Applied Sterilisation Technologies (Synergy Health Laboratory Services (SHLS), Abergavenny UK) - external dose range of 25-40 KGy | ||
| Silica gel orange | Sigma Aldrich | 10087 | |
| Cobalt (II) chloride | Sigma Aldrich | 232696 | |
| Copper (II) sulfate | Sigma-Aldrich | C-1297 | |
| Six spot humidity indicator card | SCC, USA | 6HIC200 | |
| Vacuum heat seal machine | Andrew James UK Ltd, Bowburn, UK | VS518 | |
| Andrew James Vacuum Sealer rolls 28 cm x 40 meter rolls | Andrew James UK Ltd, Bowburn, UK | BR2805 | |
| Scanning Electron Microscope (SEM) | Philips/FEI XL-20 SEM | ||
| Confocal Microscope | Zeiss LSM 510 META | ||
| Videne Antiseptic Solution | Ecolab, Swindon, UK | 3% |
Riferimenti
- Ambati, B. K., et al. Corneal avascularity is due to soluble VEGF receptor-1. Nature. 443, 993-997 (2006).
- Reinach, P., Capó-Aponte, J., Mergler, S., Pokorny, K. Ophthalmic Diseases And Drug DeliveryOphthalmology Research. Ch 2, Ocular Transporters. Tombran-Tin, J., Barnstable, C. J. 2, Humana Press. 17-46 (2008).
- Kinoshita, S., et al. Characteristics of the Human Ocular Surface Epithelium. Progress in Retinal and Eye Research. 20, 639-673 (2001).
- Fatt, I., Bieber, M. T. The steady-state distribution of oxygen and carbon dioxide in the in vivo cornea: I. The open eye in air and the closed eye. Experimental Eye Research. 7, 103-112 (1968).
- Shortt, A. J., et al. Characterization of the Limbal Epithelial Stem Cell Niche: Novel Imaging Techniques Permit In Vivo Observation and Targeted Biopsy of Limbal Epithelial Stem Cells. STEM CELLS. 25, 1402-1409 (2007).
- Dua, H. S., Shanmuganathan, V. A., Powell-Richards, A. O., Tighe, P. J., Joseph, A. Limbal epithelial crypts: a novel anatomical structure and a putative limbal stem cell niche. British Journal of Ophthalmology. 89, 529-532 (2005).
- Thoft, R. A., Friend, J. The X, Y, Z hypothesis of corneal epithelial maintenance. Investigative Ophthalmolog., & Visual Science. 24, 1442-1443 (1983).
- Lehrer, M. S., Sun, T. T., Lavker, R. M. Strategies of epithelial repair: modulation of stem cell and transit amplifying cell proliferation. Journal of Cell Science. 111, 2867-2875 (1998).
- Djalilian, A., et al. Down-regulation of Notch signaling during corneal epithelial proliferation. Molecular Vision. 14, 1041-1049 (2008).
- Dua, H. S., Azuara-Blanco, A. Limbal Stem Cells of the Corneal Epithelium. Survey of Ophthalmology. Survey. 44, 415-425 (2000).
- Dravida, S., et al. A biomimetic scaffold for culturing limbal stem cells: a promising alternative for clinical transplantation. Journal of tissue engineering and regenerative medicine. 2, 263-271 (2008).
- Rama, P., et al. Limbal Stem-Cell Therapy and Long-Term Corneal Regeneration. New England Journal of Medicine. 363, 147-155 (2010).
- Koizumi, N., Inatomi, T., Suzuki, T., Sotozono, C., Kinoshita, S. Cultivated corneal epithelial stem cell transplantation in ocular surface disorders. Ophthalmology. 108, 1569-1574 (2001).
- Fatima, A., et al. Technique of cultivating limbal derived corneal epithelium on human amniotic membrane for clinical transplantation. Journal of Postgraduate Medicine. 52, 257-261 (2006).
- Nubile, M., et al. Amniotic membrane transplantation for the management of corneal epithelial defects: an in vivo confocal microscopic study. British Journal of Ophthalmology. 92, 54-60 (2008).
- Nubile, M., et al. In Vivo Analysis of Stromal Integration of Multilayer Amniotic Membrane Transplantation in Corneal Ulcers. American Journal of Ophthalmology. 151, 809-822 (2011).
- Dua, H. S. Amniotic membrane transplantation. British Journal of Ophthalmology. 83, 748-752 (1999).
- Gicquel, J., et al. Epidermal Growth Factor Variations in Amniotic Membrane Used for Ex Vivo Tissue Constructs. Tissue Engineering Part A. 15, 1919-1927 (2009).
- Connon, C. J., et al. The variation in transparency of amniotic membrane used in ocular surface regeneration. British Journal of Ophthalmology. 94, 1057-1061 (2010).
- Hopkinson, A., McIntosh, R. S., Tighe, P. J., James, D. K., Dua, H. S. Amniotic Membrane for Ocular Surface Reconstruction: Donor Variations and the Effect of Handling on TGF-β Content. Investigative Ophthalmolog., & Visual Science. 47, 4316-4322 (2006).
- Sitalakshmi, G., et al. Ex Vivo Cultivation of Corneal Limbal Epithelial Cells in a Thermoreversible Polymer (Mebiol Gel) and Their Transplantation in Rabbits: An Animal Model. Tissue Engineering Part A. 15, 407-415 (2008).
- Ortega, I., Deshpande, P., Gill, A. A., MacNeil, S., Claeyssens, F. Development of a microfabricated artificial limbus with micropockets for cell delivery to the cornea. Biofabrication. 5, (2013).
- Deshpande, P., et al. Using poly(lactide-co-glycolide) electrospun scaffolds to deliver cultured epithelial cells to the cornea. Regenerative Medicine. 5, 395-401 (2010).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34, 5088-5106 (2013).
- Wheeldon, I., Ahari, A. F., Khademhosseini, A. Microengineering Hydrogels for Stem Cell Bioengineering and Tissue Regeneration. Charlottesv Va. 15, 440-448 (2010).
- Moeller, H. C., Mian, M. K., Shrivastava, S., Chung, B. G., Khademhosseini, A. A microwell array system for stem cell culture. Biomaterials. 29, 752-763 (2008).
- Fisher, O. Z., Khademhosseini, A., Langer, R., Peppas, N. A. Bioinspired Materials for Controlling Stem Cell Fate. Accounts Chem. Res. 43, 419-428 (2010).
- Raimondi, M. T., et al. Three-dimensional structural niches engineered via two-photon laser polymerization promote stem cell homing. Acta Biomaterialia. 9, 4579-4584 (2013).
- Gobaa, S., et al. Artificial niche microarrays for probing single stem cell fate in high throughput. Nat Meth. 8, 949-955 (2011).
- Truckenmüller, R., et al. Fabrication of cell container arrays with overlaid surface topographies. Biomedical Microdevices. 14, 95-107 (2012).
- Ortega, Í, Ryan, A. J., Deshpande, P., MacNeil, S., Claeyssens, F. Combined microfabrication and electrospinning to produce 3-D architectures for corneal repair. Acta Biomaterialia. 9, 5511-5520 (2013).
- Blackwood, K. A., et al. Development of biodegradable electrospun scaffolds for dermal replacement. Biomaterials. 29, 3091-3104 (2008).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon