Method Article
Identificazione di ossido di metallo nanoparticelle in campioni istologici da avanzato Mapping Darkfield Microscopy e iperspettrale
In questo articolo
Riepilogo
Enhanced darkfield microscopy and hyperspectral imaging with spectral mapping enable screening, localization, and identification of nanoscale materials in histological samples with improved speed and accuracy over traditional methods. The goal of this paper is to provide methods for darkfield imaging and hyperspectral mapping of metal oxide nanoparticles in histological samples.
Abstract
Nanomaterials are increasingly prevalent throughout industry, manufacturing, and biomedical research. The need for tools and techniques that aid in the identification, localization, and characterization of nanoscale materials in biological samples is on the rise. Currently available methods, such as electron microscopy, tend to be resource-intensive, making their use prohibitive for much of the research community. Enhanced darkfield microscopy complemented with a hyperspectral imaging system may provide a solution to this bottleneck by enabling rapid and less expensive characterization of nanoparticles in histological samples. This method allows for high-contrast nanoscale imaging as well as nanomaterial identification. For this technique, histological tissue samples are prepared as they would be for light-based microscopy. First, positive control samples are analyzed to generate the reference spectra that will enable the detection of a material of interest in the sample. Negative controls without the material of interest are also analyzed in order to improve specificity (reduce false positives). Samples can then be imaged and analyzed using methods and software for hyperspectral microscopy or matched against these reference spectra in order to provide maps of the location of materials of interest in a sample. The technique is particularly well-suited for materials with highly unique reflectance spectra, such as noble metals, but is also applicable to other materials, such as semi-metallic oxides. This technique provides information that is difficult to acquire from histological samples without the use of electron microscopy techniques, which may provide higher sensitivity and resolution, but are vastly more resource-intensive and time-consuming than light microscopy.
Introduzione
Come nanomateriali sono sempre più utilizzati in una varietà di settori e applicazioni, vi è la necessità per nanoscala di imaging e caratterizzazione metodi che sono più rapidi, economico e conveniente di modalità tradizionali, come la microscopia elettronica. Per visualizzare nanoparticelle (NP) interazioni con le cellule, i tessuti e sistemi viventi, sono state impiegate molte tecniche ottiche, tra cui contrasto interferenziale differenziale (DIC) Microscopia 1 e approcci sul campo evanescenti, come riflessione interna totale (TIR) o Vicino- microscopia a scansione campo ottico (NSOM) 2,3. Tuttavia, questi sono approcci analitici di fascia alta, fuori dalla portata della maggior parte dei laboratori non specializzati 4. La microscopia elettronica, compreso microscopia elettronica a trasmissione (TEM), è stato utilizzato anche per studiare l'interazione con le cellule NP 5,6,7,8. Angolo alto anulare campo oscuro (HAADF) microscopia elettronica a scansione trasmissione è stato utilizzato per studiare l'interazione di NPcon i virus 9. La microscopia confocale è un'altra tecnica popolare usato per studiare le interazioni NP-cellula 10.
Negli ultimi anni, l'imaging iperspettrale (HSI) tecniche basate campo scuro-sono stati utilizzati come strumento di analisi promettente per lo studio nanoparticelle in matrici biologiche 11. Sistemi HSI generano una rappresentazione tridimensionale di dati spaziali e spettrali, noto come un ipercubo o DataCube 12. La mappa spaziale di variazione spettrale viene utilizzato per l'identificazione dei materiali. Profili spettrali di materiali noti possono essere generati e utilizzati come librerie di riferimento per il confronto con campioni sconosciuti. Uno dei principali vantaggi con sistemi HSI è la sua capacità di combinare l'imaging con spettroscopia, così da stabilire la posizione e distribuzione delle NP sconosciuti in vivo o ex vivo e collegandoli a un'altra particella di riferimento noto, composizione simile.
Ci sono diversi vantaggi dil'utilizzo di sistemi HSI su tecniche di imaging convenzionali: è richiesta una minima preparazione del campione; preparazione del campione è in genere non distruttivo in natura; l'acquisizione delle immagini e l'analisi è più veloce; la tecnica è conveniente 13; e la distribuzione spaziale e l'analisi di composti di composizione mista e / o in matrici complesse è più facilmente realizzabile 14.
Per ricerche nanomateriali coinvolgono campioni preziosi, una delle considerazioni più importanti è la disponibilità di un metodo di imaging non distruttivo, che consente la possibilità di esaminare ripetutamente campioni di uno o più metodi. Ripetuti o più analisi possono desiderare di sviluppare set di dati globali che non sarebbero disponibili da un unico metodo. A questo proposito, studiando le sue proprietà ottiche è il modo più sicuro per analizzare il campione. Utilizzando un microscopio potenziato darkfield (EDFM) e sistema HSI per studiare la risposta ottica del campione - cioè Reflectance, ma anche di assorbanza e trasmittanza - l'identificazione e la caratterizzazione caratteristica può essere effettuata 15. I potenziali endpoint caratterizzazione includono una valutazione della dimensione relativa e la forma di nanoparticelle o agglomerati e distribuzione di nanoparticelle all'interno di un campione.
In questo articolo, descriviamo metodi di mappatura specificamente per le nanoparticelle di ossido di metallo nel tessuto post mortem utilizzando un sistema HSI basato su un algoritmo partita pixel spettrale indicato come un mappatore angolo spettrale (SAM). Abbiamo scelto questa particolare applicazione, perché ha il potenziale per integrare attuale e futuro nella ricerca nanotossicologia vivo, in cui i modelli animali sono utilizzati per valutare le implicazioni sulla salute dell'esposizione ai nanomateriali ingegnerizzati. L'applicazione di questo metodo potrebbe anche informare ricerca di somministrazione di farmaci su scala nanometrica che utilizza modelli di tessuto o animali. In particolare, l'assorbimento di nanoparticelle, distribuzione, metabolismo e l'escrezione tutto organs e tessuti possono essere indagati con questo sistema. Un'ampia varietà di applicazioni sono in fase di studio per l'uso nella ricerca biomedica 11.
Questo metodo potrebbe essere utilizzato per la valutazione di diversi campioni biologici (ad esempio vari tipi di tessuti, campioni di lavaggio broncoalveolare, e strisci di sangue), che sono stati esposti alle nanoparticelle di una varietà di composizioni elementari 16-19. Inoltre, questo metodo è utile per studiare nanoparticelle biodistribuzione in vivo e in vitro, che è pertinente per studi drug delivery nanoscala 11. Oltre campioni biologici, EDFM e HSI possono essere utilizzati per valutare nanoparticelle in campioni ambientali, come acqua di scarico 20. Valutazione dell'esposizione professionale può essere facilitata mediante l'uso di questa tecnica e, in quanto può essere utilizzato per valutare l'efficacia dei dispositivi di protezione individuale per la prevenzione di penetrazione delle nanoparticelle. Inoltre, la ricerca team sta attualmente sviluppando un EDFM simile e il protocollo HSI per la valutazione dei campioni dei media filtranti di nanoparticelle raccolti da valutazioni di esposizione professionale. Mentre preparazione di questi diversi tipi di campioni per EDFM e HSI può variare, è importante che siano preparati in modo tale che essi possono essere facilmente visualizzate dal sistema ottico. In genere, il campione deve essere preparato come se fosse essere visualizzato tramite la microscopia in campo chiaro tradizionale. Ci sono diversi sistemi di imaging iperspettrale disponibili in commercio 11.
Protocollo
Protocolli di animali sono stati approvati dalla cura degli animali istituzionale e del Comitato uso a collaborare istituzione degli investigatori, Stony Brook University. Un elenco di materiali e attrezzature utilizzate per questo lavoro specifici sono disponibili in Tabella 1.
1. Preparazione del campione di tessuti
- Preparare tessuti animali esposti al metallo nanoparticelle di ossido per la colorazione istologica o immunoistochimica secondo metodi descritti in precedenza 21-23.
2. Imaging
- L'inizializzazione del microscopio
NOTA: Per questo studio, un microscopio grado di ricerca è stato utilizzato, dotato di una sorgente di luce campo scuro ad alte prestazioni, di controllo XY motorizzato fase, 14-bit fotocamera iperspettrale di profondità, e più lenti dell'obiettivo (aria 10X, aria 40X, 100X immersione in olio) . Il sistema utilizzato qui ha una risoluzione spaziale 64 nm a 100X (immersione in olio) ingrandimento. Il condensatore utilizzato per questa borchiay ha sia Koehler e critiche funzioni di illuminazione e si concentra una luce altamente collimata ad angoli obliqui sul campione.- Collegare e accendere la sorgente luminosa, XY controllore palco, camera ottica (per l'imaging campo scuro), fotocamera iperspettrale, e il computer. Impostare la sorgente di luce di alimentazione 75%; alzare la fase di massima altezza; collegare la guida di luce al condensatore per l'imaging potenziato campo scuro o al collimatore sul retro del microscopio per l'imaging campo chiaro riflessa.
NOTA: Impostando la sorgente di luce di energia del 75%, vi è sufficiente, l'illuminazione uniforme di tutti i pixel all'interno del campo visivo che valorizza più opaco pixel, pur consentendo di contrasto tra opachi e luminosi pixel. - Sollevare il condensatore di posizione di lavoro. Applicare 3-5 gocce di tipo A olio per immersione sul condensatore ottico con attenzione, evitando la formazione di eventuali bolle. Eliminare l'olio e riapplicare, se bolle dovrebbero costituire.
- Posizionare la slitta on per il palco. Lentamente sollevare il condensatore finché l'olio di immersione a contatto con la slitta. Questo sarà visibile attraverso l'anello rapidamente illuminandosi di illuminazione dove l'olio entra in contatto con la slitta.
- Collegare e accendere la sorgente luminosa, XY controllore palco, camera ottica (per l'imaging campo scuro), fotocamera iperspettrale, e il computer. Impostare la sorgente di luce di alimentazione 75%; alzare la fase di massima altezza; collegare la guida di luce al condensatore per l'imaging potenziato campo scuro o al collimatore sul retro del microscopio per l'imaging campo chiaro riflessa.
- Mettere l'obiettivo 10X a posto. Mettere a fuoco e allineare il condensatore esaminando attraverso gli oculari.
- Spostare il palco su e giù con la manopola di messa a fuoco dell'obiettivo di massima fino a quando la luminosità è massimizzata.
- Spostare il condensatore concentrarsi su e giù con la manopola di regolazione del condensatore fino a quando si trova la massima luminosità. Tentare di creare il punto centrale più luminoso possibile nel campo visivo.
- Regolare le manopole di allineamento del condensatore se necessario per centrare il punto luminoso, se necessario.
- Utilizzare la multa manopola del fuoco obiettivo di portare il punto luminoso a fuoco. Quando si cambia obiettivi per ottenere un ingrandimento diversa, regolare nuovamente il piano di messa a fuoco. Quando si utilizza l'obiettivo 100X, applicare una goccia di olio di immersione sul vetrino di migliorare the immagine ed evitare danni alla lente obiettiva.
- Catturare le immagini
- Utilizzare regolatore fase di trovare una regione di interesse. Questa regione sarà determinato dalle esigenze dell'esperimento. Un tipico indicatore sarà alto contrasto con le regioni circostanti, come le aree soffuse con nanoparticelle di ossido di metallo spesso appaiono più luminoso di zone senza di loro.
- Portare la regione a fuoco utilizzando la manopola di multa obiettivo di messa a fuoco, la regolazione della messa a fuoco, se necessario, per equilibrare l'illuminazione condensatore. Raggiungere una regione ad alto contrasto, ben definita all'interno del campo visivo.
- Determinare quali immagini (per la telecamera ottico) o datacubes (per la fotocamera iperspettrale) verrà catturato, e in quale sequenza. In genere, immagini ottiche sono ottenute con un obiettivo 10X aria, l'aria obiettivo 40X e 100X obiettivo ad immersione e un corrispondente DataCube HSI con un obiettivo ad immersione 100X.
- Aprire il software di imaging ottico. Clicca su "Impostazioni &# 8221; nella barra dei menu. Selezionare il pulsante "Cattura immagine per evento cattura". Selezionare il formato immagine memorizzata (TIFF è stato utilizzato per questo esperimento); assegnare un nome di file; individuare e selezionare una cartella di immagini memorizzate; mantenere timelapse di default; fai clic su "OK".
- Selezionare le impostazioni di esposizione che creano l'immagine massimo contrasto nel menu "Exposure" (per questo studio, un livello di 0,0%, il guadagno di 3,0 dB, e otturatore di 35 ms sono stati utilizzati).
- Catturare l'immagine facendo clic sul pulsante "Immagine" nella barra dei menu. Cattura diverse immagini campo scuro a basso ingrandimento in aggiunta a quelli ad alto ingrandimento cambiando gli obiettivi del microscopio, al fine di fornire un contesto.
NOTA: cattura immagini ottiche allo stesso ingrandimento eventuali datacubes da scattare con la fotocamera iperspettrale, come queste immagini ottiche tendono ad avere un campo visivo più ampio e migliore aspetto estetico per dopo ispezione visiva. È essenziale che qualsiasi DATACUBE che verrà successivamente analizzati spettralmente uso ingrandimento costante, in quanto è possibile che cambiando l'obiettivo altererà gli spettri di trasmissione delle ottiche microscopio, cambiando gli spettri catturata, e riducendo così la precisione del mappatore dell'angolo spettrale (SAM). Se una DataCube viene confrontato con un altro DataCube ottenuto con un obiettivo diverso, la funzione SAM potrebbe non funzionare.
- Selezionare il rivelatore di immagine della fotocamera iperspettrale reindirizzando la manopola fonte di luce sul microscopio alla fotocamera iperspettrale. Se la luce è diretta verso la fotocamera iperspettrale, nessuna immagine verrà mostrata nel software della fotocamera ottica. Ridurre al minimo ma non chiudere la finestra del software di imaging ottico, come uno può avere bisogno come specificato al punto 2.4.4.
- Catturare Datacubes
- Aprire il software di imaging iperspettrale per l'acquisizione di datacubes HSI. Assicurarsi che la guida di luce è diretto alla fotocamera iperspettrale.
- Aperto "HypMicroscopio erspectral "nella barra del menu e selezionare" Controlli HSI microscopio ".
- Impostare l'ingrandimento dell'obiettivo e il percorso di salvataggio. Assicurati di nominare tutte le immagini ei file tipicamente così non si verifica alcun sovrascrittura. Cambiare la cattura zona in impostazioni regolando il campo visivo o numero di linee (720 linee per usare questo studio), con una notevole quantità di tempo aggiuntivo necessario per rilevare aree più grandi. Infine, impostare il tempo di esposizione (0.25 sec per questo studio). Lascia tutto il resto di default, e fare clic su "Anteprima HSI" per visualizzare l'immagine.
Nota: Il grafico intensità che appare mostra il DataCube HSI che sarà registrato in asse orizzontale. L'asse verticale rappresenta le lunghezze d'onda dello spettro che verrà catturata nel DataCube HSI. Posizionando il cursore in qualsiasi posizione sul grafico intensità corrispondente ad una lunghezza d'onda spettrale provoca le intensità di tutti i punti attraverso l'immagine, a quella lunghezza d'onda, per essere mostrato. - FOCUS basa sulla questa anteprima regolando la messa a fuoco fine obiettivo di affinare le vette di questa immagine. Se questo è troppo difficile, la lunghezza focale della fotocamera ottico è abbastanza simile, in modo da caricare il software di imaging ottico e spostare la barra di scorrimento per la camera ottica, messa a fuoco, e poi tornare al software di imaging iperspettrale e riportare la barra di scorrimento alla fotocamera iperspettrale .
- Regolare l'intensità di questa anteprima regolando la luminosità fonte, messa a fuoco del condensatore, o annullando l'anteprima per regolare il tempo di esposizione. Quest'ultima produce i risultati migliori, ma è aumentato il tempo di esposizione può richiedere più tempo per immagine. L'obiettivo è che i picchi più significativi di essere sufficientemente grande, ma non superiore alla massima intensità per il rivelatore; qui, la gamma ideale è compreso tra 1.000 e 16.000 unità.
- Fai clic su "cattura". Il microscopio chiederà di prendere una immagine corrente scura. Reindirizzare la barra di scorrimento superiore o apertura (con attenzione, in modo da non disturbare l'allineamentoe messa a fuoco di una qualsiasi delle altre ottiche), e fare clic su "OK". Ripristinare la barra di scorrimento o l'apertura nella posizione corretta e fare clic su "OK" quando richiesto di immagine visualizzata. Imaging può richiedere fino a 30 minuti, anche se i tempi di circa 5 minuti sono più tipici. Tempi di esposizione più lunghi portano a tempi di imaging più lunghi. Un indicatore di avanzamento è presente. Fare attenzione a non disturbare fisicamente il campo prima che l'indicatore di avanzamento completa.
- Osservare quattro nuove finestre con i nomi: "Lista bande disponibili", "# 1zoom", "# 1scroll" e "# 1 fascia RGB". Massimizzare la finestra "banda # 1RGB" come questo è il DataCube per tutti i riferimenti futuri.
- Fare clic destro il DataCube e salvarlo come TIFF e fai clic su "OK". Se l'imaging finito; mettere da parte tutti i campioni; pulire tutte le superfici esposte del petrolio con il 70% di isopropanolo in acqua; aumentare fase alla massima altezza; inferiore condensatore altezza minima e premere in posizione non operativa; chiusoverso il basso o scollegare la sorgente di luce, regolatore palco, e le telecamere.
3. Creazione di riferimento biblioteche spettrali
- Selezione di Riferimento Spectra
- Selezionare un controllo positivo che è noto per contenere il materiale di interesse contenuto nella stessa matrice come i campioni sperimentali, poiché HSI profili spettrali sono matrice-dipendente.
- Per questo studio, usare pelle suina iniettato con alte dosi di metallo nanoparticelle di ossido di come controlli positivi per il confronto con il tessuto cutaneo suina sperimentale da uno studio sull'esposizione di attualità. I profili spettrali delle nanoparticelle di ossido di metallo in sospensione sono state generate e esaminate risultando essere un controllo positivo inadeguate per le campioni sperimentali istologici causa delle diverse matrici.
- Ottenere un DataCube dal controllo positivo come descritto al punto 2.4., Si utilizza la fotocamera iperspettrale.
- Prestare particolare attenzione quando setalla zio l'intensità, in quanto questo è il principale parametro con cui il filtro antiparticolato interna identificherà i materiali. Eventuali intensità al di sopra del punto di saturazione del rivelatore (qui, 16.000 unità), si tradurrà in dati non validi (vedere il passaggio 2.4.5.).
- Fare clic destro nella finestra dell'immagine, e di sinistra fare clic su "spettro Z-profilo". Apparirà una finestra spettrale Profilo pop-up. Sinistra cliccare sul pixel di interesse sul DataCube, in particolare quelli più brillanti o quelli che possono essere tranquillamente identificato come rappresentante il materiale di interesse. Osservare la finestra Profilo spettrale che mostra lo spettro associato. Prendere nota particolare del loro valore minimo e massimo e che la lunghezza d'onda corrispondente ad esso.
- Durante il rilievo il campione di controllo positivo, indagine facendo clic sulle regioni di interesse che sono molto luminose rispetto al tessuto circostante, in particolare quelli con particelle facilmente identificabili. Queste particelle sono più probabilmente il materIALS di interesse, in particolare nel caso di metalli.
- Utilizzare lo strumento "filtro antiparticolato" nel menu "Analisi delle particelle" per identificare le particelle presenti nel DataCube. Nella nuova finestra pop-up, osservare il "Max spettrale deve superare". Questo sarà determinata dalle osservazioni al punto 3.1.3. Impostare questo valore in modo che sia superiore pixel di sfondo, ma inferiori ai materiali di interesse. Il "Valido Dati Max" è l'intensità massima (qui, 16.000 unità).
- Lasciare gli altri parametri di default, ma escludere gli oggetti in base alla dimensione regolando la casella "Dimensioni Threshold". Invia questa dati sia a questo punto, o dopo l'esecuzione dell'analisi. Per questo esperimento, utilizzare i seguenti parametri: Spectral Max deve superare: 5.000; Valida dati Max: 16.000; Dimensioni Soglia (pixel): 400. Una volta impostati tutti i parametri, fare clic su "OK".
- Osservare il grafico risultante con i dettagli diparticelle rilevate entro la soglia di intensità indicata; questi dati possono essere esportati. Se la lunghezza d'onda caratteristica massima riflettanza del materiale di interesse è noto, selezionare quelle particelle che hanno un valore simile "Max WL"; in caso contrario, fai clic su "Seleziona tutto". Quindi fare clic su "Esporta"; "Per spettrale Library". Scegliere un nome di file quindi fare clic su "OK".
- Selezionare un controllo positivo che è noto per contenere il materiale di interesse contenuto nella stessa matrice come i campioni sperimentali, poiché HSI profili spettrali sono matrice-dipendente.
- Rimuovere Falsi positivi Spectra
- Selezionare un campione che servirà come controllo negativo. Tale campione deve essere stato preparato e trattato allo stesso modo come tutti i campioni sperimentali salvo che l'assenza di nanoparticelle simili o identici al materiale di interesse è garantita.
NOTA: E 'importante che la matrice del controllo negativo è la stessa matrice dei campioni sperimentali, come HSI profili spettrali sono matrice-dipendente. Per questo studio, abbiamo utilizzato la pelle suina che non è stato esposto ai nanomateriali di ossidi metallici come negativocontrolli. - Ottenere alcuni datacubes dal controllo negativo come descritto al punto 2.4.7, utilizzare la fotocamera iperspettrale. Almeno uno è richiesto, ma più può essere catturato per aumentare la selettività (questo è particolarmente importante nel caso in cui qualche contaminante può essere negli spettri di riferimento).
- Utilizzare il software di imaging iperspettrale per filtrare la libreria spettrale raccolto nella fase 3.1 (controllo positivo) contro l'DataCube acquisita al passo 3.2.2 (controlli negativi) in serie, come indicato nei seguenti passi:
NOTA: Salva il risultato, biblioteca spettrale filtrato in un file separato, e utilizzare come biblioteca spettrale di riferimento per il materiale di interesse.- Fare clic su "Filtro libreria spettrale" sotto il menu Analysis, che si trova sulla barra degli strumenti principale del programma. Fare clic su "Apri"; "Nuovo File" e selezionare la libreria spettrale creata nel passaggio 3.1. per il controllo positivo del file di input. Fai clic su "OK".
- Per l'efonte ESTERNA, selezionare "Immagine" sotto la casella di dati spettrali. Mantenere le impostazioni predefinite sotto la casella di parametri di elaborazione. Selezionare un Nome Uscita Per filtrata Library (questo dovrebbe essere diverso da quello originale, o la biblioteca spettrale crudo raccolto andranno persi). Fai clic su "OK".
- Fare clic su "Apri"; "Nuovo File" e selezionare il primo DataCube acquisita al passo 3.2.2 per il controllo negativo, quando viene richiesto di selezionare un'immagine di origine.
NOTA: Il software analizzerà la libreria spettrale e rimuovere ogni spettro che corrisponde a uno spettro del DataCube controllo negativo. Rimozione del fondo da criteri di selezione riduce così il potenziale per falsi positivi. Una sintesi sarà disponibile quando questo è fatto (nota che questa sintesi non viene salvata automaticamente). - Se il filtro aggiuntivo si desidera, ripetere dal punto 3.2.3.1, ad eccezione di: passo 3.2.3.2, selezionare l'ultima biblioteca spettrale filtrato creato (risultante dopo il punto 3.2.3.3 co.mpletes); al punto 3.2.3.3, selezionare la successiva DataCube dal punto 3.2.2.
NOTA: Correzione e normalizzante per lo spettro di luce può essere necessario se i campioni disperdono una notevole quantità di luce (ad esempio, i nanotubi di carbonio) e / o se spettri di zero rimane quando si filtrano una libreria spettrale controllo positivo contro un controllo negativo. Queste circostanze non sorgono per il nostro studio e quindi questa correzione non è stata effettuata.
- Selezionare un campione che servirà come controllo negativo. Tale campione deve essere stato preparato e trattato allo stesso modo come tutti i campioni sperimentali salvo che l'assenza di nanoparticelle simili o identici al materiale di interesse è garantita.
Analisi 4. Immagine
- Mappatura Angolo Spectral
- Aprire il "Spectral Angle Mapper" (SAM) dal menu spettrale, sottomenu metodi di mappatura, utilizzando il software di imaging iperspettrale una volta che tutte le datacubes sperimentali sono state acquisite seguendo passo 2.4. L'angolo mappatore spettrale confronta spettri analizzando geometricamente le variazioni di intensità in funzione della lunghezza d'onda (cioè, compara due spettri normalizzando loro intensità e confrontando gli angoli riRICHIESTO per tracciare il grafico di ogni spettri) 24.
- Con il DataCube aperto, selezionare il nome del DataCube sperimentale nella finestra pop-up e fare clic su "OK". Se non sono elencate i nomi dei file, fare clic su "Apri"; "Nuovo file", scegliere il DataCube sperimentale, quindi fare clic su "OK".
- Osservare una nuova finestra pop-up chiamata endmember Collezione: SAM. Fare clic su "Importa" nella barra dei menu, quindi selezionare "da Spectral file Library". Una finestra pop-up apparirà denominata Spectral file di input Biblioteca. Aprire la biblioteca spettrale di riferimento che è stato creato nel passaggio 3.2.3. e fai clic su "OK". Osservare una nuova finestra pop-up chiamato "Input Spectral Library".
- Fare clic su "Seleziona Tutto"; fai clic su "OK" a destra clicca su "Colore" e selezionare "Applica colori predefiniti a tutti". Fai clic su "Seleziona tutto", seguito da "Applica" e quindi scegliere il nome del file di output di und Fare clic su "OK". La Spectral Angle Mapper avrà pochi secondi per analizzare e salvare i dati.
- Aprire il DataCube nel software di imaging iperspettrale. Selezionare "classificazione" nel menu Overlay della finestra dell'immagine, quindi individuare il nome del file e fare clic su "OK". L'utente può ora sovrapporre qualsiasi spettro dalla biblioteca per vedere dove mappati nell'immagine.
- Selezionare l'opzione "Unisci classi" dal menu Opzioni nella "strumento di classe interattiva" ha aperto il menu Overlay nella finestra dell'immagine, se una combinazione di colori unificato si desidera, ad esempio per facilitare l'analisi da altri software (come descritto nel punto 4.2 .).
- Evidenziare tutte le classificazioni di combinare (in genere, tutto tranne "non classificati" in "classi di fondersi in base" lista), e selezionare un singolo spettro dalla lista "classe di base", poi cliccare su "OK". Quel colore sarà ora Represent tutti gli spettri selezionati.
- Fare clic sul colore selezionato e tutti gli spettri di corrispondenza verrà mostrato in quel colore.
- Per ottenere un'immagine dicromatico che mostrerà gli spettri di corrispondenza su uno sfondo nero, cIick sulla scatola di colori "non classificati", che è nero di default. Osservare un'immagine dichromatic. Questo passaggio può essere invertito cliccando nuovamente sulla casella colori "non classificati".
- Tasto destro del mouse per salvare l'immagine come TIFF, comprese le eventuali sovrapposizioni attualmente attivo.
NOTA: Per il futuro l'elaborazione delle immagini, verrà utilizzata un'immagine dichromatic. - Selezionare "Class distribuzione" dal menu Opzioni nella finestra "Interactive Classe Tool" per acquisire le statistiche di mappatura. Questi dati rappresentano il numero di pixel sono stati mappati (non classificati) e quanti sono stati identificati come il materiale di interesse. Si noti che il numero di pixel non corrisponde al numero di particelle mappati. Queste informazioni non sono r automaticamenteecorded.
- Analisi delle particelle in iperspettrale mappato Immagini
- Aprite le immagini in software NIH ImageJ.
- Utilizzare il menu Immagine, Regola sottomenu la funzione, "Threshold". Selezionare i parametri che differenziano le particelle di interesse da parte di tutti gli altri materiali. Utilizzare i seguenti parametri di soglia per questo studio: Metodo soglia predefinita, il colore rosso, lo spazio colore HSB, controllato sfondo scuro casella di controllo, caselle di controllo passaggio controllato per tonalità, la saturazione e la luminosità.
NOTA: Questo può variare notevolmente da caso a caso. Quando si analizza un DataCube mappata, questo può essere semplificata unificando tutte le classi relative a un singolo colore e colore sovrapposizione che con tutti i colori classificati prima di generare l'immagine (passi 4.1.4 a 4.1.8). - Utilizza il menu Analizza, "Analizza particelle" la funzione che consente di recuperare le informazioni per l'area, media, valore minimo e massimo. Per questo studio, utilizzare i parametri qui: dimensioni 0-infinito, circolarità0-1, spettacolo niente, controllato casella visualizzare i risultati.
- Per l'analisi statistica, esportare questi dati in un altro programma software che consente il confronto statistico con il numero e la dimensione delle particelle situate in campioni di controllo simili. Si consiglia di utilizzare un foglio di calcolo per l'analisi dei dati di ImageJ. I dati visualizzati nella tabella dei risultati dopo il punto 4.2.4 devono essere copiati in un foglio di calcolo. La funzione MAX può essere utilizzato sulla prima colonna (senza titolo) per determinare il numero di particelle, mentre la funzione MEDIA può essere utilizzato su colonna Area per determinare la dimensione media di una particella. In futuro, la validazione sperimentale sarà perseguita a indagare su questa funzione nella determinazione della dimensione media contro uno standard stabilito per il dimensionamento (ad esempio, TEM).
Risultati
Microscopia Hyperspectral è utile per la sua capacità di identificare i materiali in un modo simile a spettrofotometria. Come indicato nella Figura 1, ogni materiale ha diversi spettri caratteristici ed una forma complessiva della sua riflettanza, che è unica. Inoltre, la Figura 1 illustra la natura della matrice-dipendente dei profili spettrali: i profili spettrali per ciascuna delle tre ossidi metallici in campioni istologici (pannello superiore) sono diversi dai profili spettrali per ciascuna delle tre ossidi metallici in sospensione acquosa ( pannello inferiore). Mappando i profili spettrali caratteristici per campioni sconosciuti nella stessa matrice, la tecnica è utile per determinare la presenza o l'assenza di un materiale, e può anche confrontare semi-quantitativamente quantità relative di materiale in campioni.
Le librerie di riferimento spettrali creati da campioni di pelle di controllo positivo sono appropriati per la mappatura a sperimentalecampioni di pelle. Come si vede nella figura 2, le biblioteche di spettri di riferimento map bene ai corrispondenti controlli positivi e non mappano i corrispondenti controlli negativi.
Il vantaggio più significativo della tecnica è la sua capacità di rilevare bassi livelli di materiali di interesse in campioni, nonché per distinguerli dai contaminanti. . Per esempio, i singoli nanotubi possono essere osservati nei polmoni durante l'inalazione di dosi di 40 mg in un 20-30 g rat 25. Figura 3 dimostra in campioni istologici di pelle: mentre alcune particelle sono prontamente evidenti nell'immagine ottica darkfield (colonna 2), altri vengono rilevati utilizzando l'imaging iperspettrale (colonna 3) che potrebbe essere stato perso con il microscopio a campo chiaro (colonna 1) o altri metodi. L'uso di campo oscuro HSI serve anche a migliorare la specificità sopra semplice microscopio campo chiaro. Queste immagini possono poi essere oggetto di forme più quantitative di analisi, nl'analisi delle particelle otably via ImageJ.
Microscopia a campo scuro migliorata ha diverse applicazioni, anche in assenza di immagini iperspettrale. Il primo è la sua capacità di generare di alta qualità, immagini ad alto contrasto. Ciò è dimostrato dal figura 3, in cui le particelle di interesse sono facilmente identificabili rispetto alle loro controparti brightfield. Queste immagini possono anche essere oggetto di analisi quantitativa delle particelle, ma in assenza di mappatura iperspettrale, cautela è necessaria per evitare di confondere una particella contaminante da una particella di interesse.
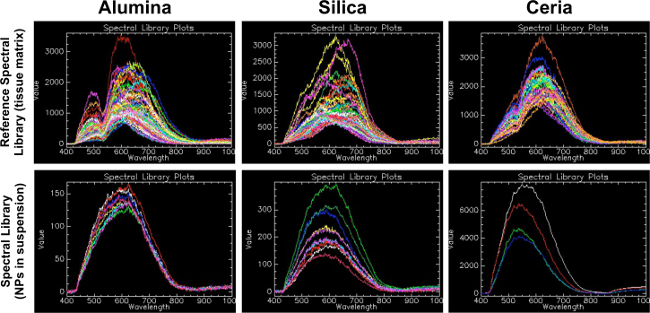
Librerie Figura 1. Riferimento spettrali (matrice di tessuto) rispetto alle biblioteche spettrali (nanoparticelle in sospensione). Questo dato dimostra l'importanza di generare una biblioteca di riferimento spettrale da nanomaterials di interesse nella stessa matrice come campioni sperimentali. La prima riga mostra la libreria spettrale di riferimento (RSL) per ogni materiale in questo studio (allumina, silice e ossido di cerio). Clicca qui per vedere una versione più grande di questa figura.
Questo RSL è stato creato con il metodo descritto in questo protocollo, dove i campioni di tessuto di controllo positivo sono stati filtrati contro campioni di tessuto di controllo negativo. La seconda riga mostra librerie spettrali (SL) creati dalle nanoparticelle di interesse in sospensione liquida su un vetrino. Per allumina, un picco bimodale a lunghezze d'onda di 500 e 650 è stato trovato nel RSL, mentre un picco più curva e meno distintivo è stato visto in allumina NP sospensione SL a circa 600. Per silice, un picco a una lunghezza d'onda di circa 650 era presente nel RSL, mentre un picco più curva e meno distintivo è stato visto nella sospensione di silice NP SL a around 600. Per Ceria, un picco bimodale è stato trovato a lunghezze d'onda di 520 e 620 nel RSL, mentre un picco di meno distintivo è stato visto nel Ceria NP sospensione SL a circa 560. Ciò suggerisce che la matrice in cui le nanoparticelle sono incorporati crea un cambiamento negli spettri che può essere considerevole quando si selezionano i comandi per creare la SL per esperimento come specifica.
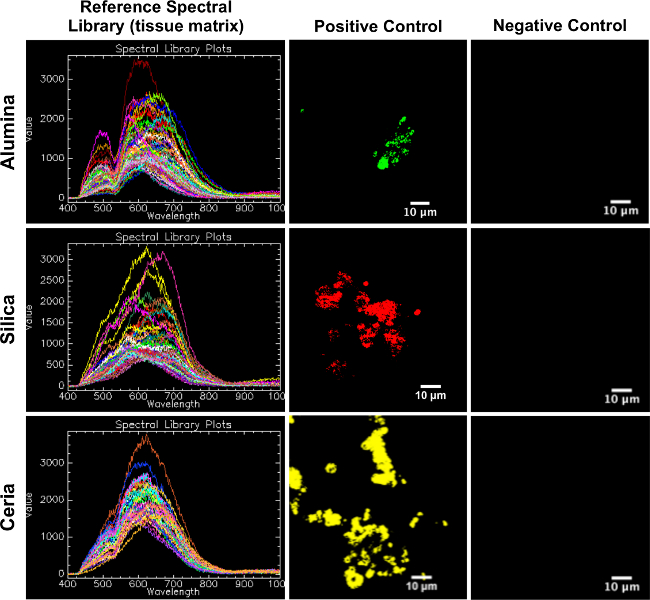
Figura 2. Riferimento librerie spettrali (matrice di tessuto) mappati sul controllo positivo e il controllo negativo tessuto cutaneo suina. Questa cifra serve come conferma dei RSL in modo appropriato per la mappatura di campioni sperimentali, dal fatto che ogni RSL (colonna di sinistra) mappa bene al suo corrispondente controllo positivo (colonna centrale), e non la mappa della sua corrispondente controllo negativo (colonna di destra). Si prega di clicca here per vedere una versione più grande di questa figura.
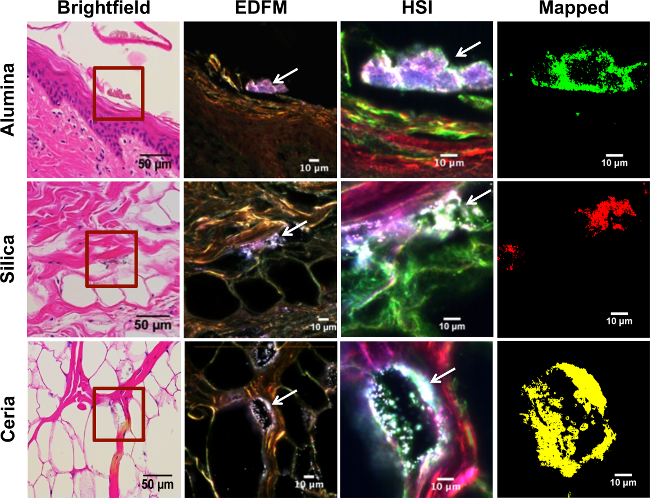
Figura 3. iperspettrale mappatura sperimentale tessuto cutaneo suina esposta alle nanoparticelle di ossido di metallo. Le righe da cima a fondo corrispondono a diversi strati della pelle, da superficiale a strato più profondo: epidermide, derma e tessuto sottocutaneo, rispettivamente. La prima riga mostra lo strato corneo dell'epidermide da un campione di pelle che è stato esposto a NP allumina in sospensione; la seconda fila è stato esposto alla silice NP in sospensione; e la terza fila di Ceria NP in sospensione. Ciascuna colonna rappresenta la stessa zona della pelle ripreso con tecniche diverse. La prima colonna corrisponde alla microscopia in campo chiaro (40X mag .; scala bar = 50 micron), dove è stato amplificato l'area racchiusa in un quadrato rosso (100X mag; barra della scala = 10 micron) con una maggiore microscopia in campo oscuro (FESM) nella seconda colonna, dove frecce bianche sono indicando l'alto contrasto NP. La terza colonna è stato ottenuto con una fotocamera iperspettrale (HSI), che mostra gli stessi NP ad alto contrasto (frecce bianche). Immagini EDFM e HSI sono state prese a ingrandimento 100X; barra della scala = 10 micron. La quarta colonna mostra l'immagine HSI mappata contro il rispettivo RSL per ciascun gruppo di esposizione, dove NP allumina sono mostrati in verde, le NP di silice in rosso, e ceria NP in giallo, rispettivamente. Clicca qui per vedere una versione più grande di questa figura.
Discussione
Per i campioni di tessuto che sono stati sottoposti a colorazione istologica convenzionale, l'identificazione e l'analisi di metalli nanoparticelle di ossido possono essere realizzati attraverso una combinazione di EDFM, mappatura HSI, e tecniche di analisi di immagine. Mentre vi è la flessibilità nella preparazione dei campioni per l'esame istologico o immunoistochimica (ad esempio, utilizzando tessuti fissati o congelati; tipo di macchia), è importante che i campioni sono sezionate ad uno spessore di 5-10 micron per la visualizzazione ottimale. I campioni utilizzati qui sono stati fissati in formalina e incluso in paraffina prima di sezionamento con un microtomo rotativo di 6 micron di spessore, montati su vetrini per microscopio, macchiato con ematossilina eosina e coprioggetto. Tessuti della pelle suina da un cutaneo collaborazione ex vivo penetrazione di tossicologia sono stati utilizzati per questo studio. I tessuti sono stati esposti a nanoparticelle di ossido di metallo (allumina, silice, cerio) in sospensioni acquose. Rilevazione della regione (s) di interesse (eleme alto contrastonti) con EDFM è un primo passo importante che facilita la successiva mappatura e l'analisi HSI. Campioni di controllo positivi e negativi devono essere esposte e analizzati in primo luogo per creare una libreria spettrale per riferimento. Gli spettri raccolti dal controllo positivo sono esportati in una libreria spettrale controllo positivo. Quindi, tutti gli spettri dalle immagini di controllo negativo sono sottratti dalla biblioteca spettrale del controllo positivo per migliorare la specificità (ridurre i falsi positivi). La libreria spettrale filtrato risultante è considerato il RSL che serve per l'analisi di materiali di interesse. Tutti i campioni di tessuto subiscono lo stesso processo di imaging e vengono mappate contro il RSL. L'immagine risultante conterrà solo le aree con elementi di interesse su uno sfondo nero. Questa immagine potrebbe quindi essere analizzato con ImageJ utilizzando le sue funzioni di soglia e di analisi di particelle per ottenere l'area di particelle mappati per campo. I dati numerici ottenuti da ImageJ può essere esportazionecato di un foglio di calcolo per ulteriori analisi.
È importante considerare che come campioni biologici sono intrinsecamente diversi l'uno dall'altro, e metodi di colorazione possono influenzare visualizzazione tramite EDFM e HSI, le impostazioni di esposizione devono essere determinati conformemente a quanto produce la migliore immagine ad alto contrasto per un tipo specifico di campione. Sebbene la riduzione di falsi positivi può essere raggiunto attraverso la filtrazione di librerie spettrali, è fondamentale avere controlli negativi affidabili che hanno evitato la contaminazione con l'elemento di interesse, come spettri corrispondente a tale contaminazione potrebbe potenzialmente essere filtrata dalla libreria spettrale del controllo positivo , aumentando i tassi di falsi negativi. Inoltre, la gamma di intensità spettro che è rilevabile con il software di imaging iperspettrale non può superare il limite del software particolare (per questo studio, cioè 16.000 unità): aree con un elevato numero di particelle accumulate che producono spintensità ectral superiori al limite di intensità sono lasciati fuori della biblioteca spettrale, a causa del rischio di aumentare il numero di falsi negativi.
Mentre il sistema HSI conferisce molti vantaggi rispetto ai metodi tradizionali, ci sono alcuni svantaggi e limitazioni da considerare. Una è che la grande quantità di dati ottici raccolti possono richiedere potenza di calcolo notevole. Un altro è che HSI può essere ad alta intensità di tempo, in particolare nelle fasi iniziali, quando si creano librerie spettrali di riferimento. Inoltre, il tempo di imaging può richiedere diversi minuti per l'acquisizione di immagini, il che rende più lento di semplice di imaging in campo oscuro; tuttavia, è ancora più veloce di eseguire la preparazione del campione e la visualizzazione al microscopio elettronico. Inoltre, i sistemi complessi possono comportare molteplici spettri caratteristici, che richiedono lo sviluppo di controlli altamente specializzati e rendono la creazione di librerie di riferimento, universali standardizzate difficili 26. Infine, la tecnologiarisultati nique a risoluzione inferiore rispetto alle tecniche probe- o microscopia elettronica, come la microscopia a forza atomica o microscopia elettronica a trasmissione, che possono risolvere i singoli atomi. Risoluzione di questa tecnica è limitata a causa della sua natura fotonica, che impedisce di essere uno strumento di alta precisione per misurare dimensioni delle particelle a livello nanometrico o per localizzare con precisione materiali ad un livello sub-micron. Mentre la tecnica può essere in grado di individuare particelle entro certi compartimenti o organelli cellulari maggiore di 1 micron (come nuclei delle cellule), organelli piccole o caratteristiche sono difficili da visualizzare accuratamente con questo metodo. Da notare anche, data la sua risoluzione spaziale, questo metodo non può distinguere tra singole nanoparticelle e agglomerati 11.
Altre considerazioni includono: alcuni materiali (come i metalli nobili) hanno molto più elevata riflettanza e profili spettrali distinti, che possono renderli più facilmente analyze e mappa spettralmente con questo strumento. Altri, come gli ossidi metallici semi-esaminati in questo studio e nanomateriali a base di carbonio 24, 27, può essere più difficile a causa della loro composizione elementare, la forma e seconda matrice. In due studi di inalazione murini di Mercer et al., Un sistema simile a quello impiegato in questo studio è stato usato al fine di individuare i nanotubi di carbonio nei polmoni e negli organi secondari in base al loro notevolmente alto contrasto con i tessuti circostanti. Tuttavia, la mappatura iperspettrale non è stata dimostrata in uno studio, probabilmente perché la forma unica di fibre di carbonio era un tratto sufficiente per l'identificazione. Un'altra considerazione riguarda specificamente ai tessuti: dal deposito di nanoparticelle di interesse di organi specifici attraverso normali processi biofisici è imprevedibile (e spesso si oggetto di studio), la determinazione di un controllo positivo applicabile può essere difficile e richiede la considerazione di come la generazione del controllo mIRITTO influenzare lo stato di un materiale di interesse. Ad esempio, se una libreria spettrale è creata da nanoparticelle cristalline di interesse, può essere difficile per mappare la libreria di quelle stesse nanoparticelle in tessuti o cellule a causa di cambiamenti negli spettri derivanti da alterazione della particella (ad esempio, per effetto del cambiamento pH, la dissoluzione, agglomerato, legame con le proteine) e il microambiente generale o matrice. Infine, la tecnica è limitata nella sua natura semi-quantitativa: può essere solo quantitativa come altre tecniche di microscopia bidimensionale di risoluzione simile, che significa che non può essere facilmente utilizzato per eseguire operazioni quali caratterizzano onere organo totale di un materiale.
Nel complesso, EDFM e HSI offre numerosi vantaggi rispetto alle tecniche di imaging nanomaterial e caratterizzazione convenzionali, quali TEM, HAADF e DIC. EDFM / HSI permette per l'acquisizione e l'analisi delle immagini più veloce, che consente di risparmiare tempo e costi rispetto a più conven intensivaTecniche nali. Inoltre, la preparazione del campione per EDFM / HSI è tipicamente sia minima e non distruttivo, che consente di risparmiare tempo e permette anche per analisi più flessibile di un dato campione in quanto può essere utilizzato per altre tecniche. Inoltre, HSI è versatile, consentendo analisi dei materiali nanoscala di molte composizioni e in una varietà di matrici. Il team di ricerca sta lavorando per perfezionare il metodo descritto qui per altri materiali e tipi di campione, compresa una valutazione approfondita della specificità della tecnologia. Un passo successivo critico sotto inchiesta da parte del gruppo di ricerca è la convalida di queste tecniche contro gold standard tradizionali (ad esempio, Raman, TEM, SEM) per i materiali e tipi di tessuto di interesse.
Divulgazioni
The authors have nothing to disclose.
Riconoscimenti
The authors thank Günter Oberdörster, DVM, PhD and Alison Elder, PhD (University of Rochester) and Mary Frame, PhD (Stony Brook University) for animal research collaborations resulting in tissue samples for analysis. Additionally, the authors thank: Christina Rotondi (Albany Medical College Histology Core); Rani Sellers, DVM, PhD and Barbara Cannella, PhD (Albert Einstein College of Medicine Histology and Comparative Pathology Facility); Leonardo Bezerra and Ahlam Abuawad (Brenner research team members); and Leslie Krauss, Byron Cheatham and Elyse Johnson (CytoViva). This work was supported in part by CDC-NIOSH grant OH-009990-01A1 and the NanoHealth and Safety Center, New York State, awarded to S.B.
Materiali
| Name | Company | Catalog Number | Comments |
| CytoViva 150 Unit (condenser) | CytoViva (Auburn, AL) | mounted to Olympus BX43 microscope | |
| Olympus BX43 Microscope - Analyzer Slot - HSI with 10x and 40x air objectives and 100X oil immersion objective | obtained through CytoViva (Auburn, AL) | for use with CytoViva 150 Unit condenser | |
| Dagexcel-M Digital Firewire Camera - Cooled; includes Exponent 7 software | obtained through CytoViva (Auburn, AL) | enhanced darkfield camera and software | |
| CytoViva Hyperspectral Imaging System 1.4; includes Pixelfly hyperspectral camera, XY stage controller, ENVI hyperspectral imaging software | obtained through CytoViva (Auburn, AL) | hyperspectral camera and software | |
| cleanroom cleaned glass microscope slides (glass B slides) | Schott NEXTERION | 1025087 | reduced debris and artifacts compared to conventional glass microscope slides for optimal imaging |
| cleanroom cleaned glass microscope coverslips (#1.0; 22 mm x 22 mm x 1.45 mm) | Schott NEXTERION | custom | reduced debris and artifacts compared to conventional glass coverslips for optimal imaging |
| type A microscopy immersion oil | Fisher Scientific | 12368B | multiple suppliers |
| 70% isopropanol in water | multiple suppliers | ||
| ImageJ software | National Institutes of Health (NIH) | free open-source software online download | |
| metal oxide nanoparticles | supplied to the research team by industrial partners | alumina, silica, and ceria nanoparticles in aqueous suspensions. Due to a Non-Disclosure Agreement between the authors and industry partners, further product information cannot be disclosed. |
Riferimenti
- Sun, W., et al. Endocytosis of a single mesoporous silica nanoparticle into a human lung cancer cell observed by differential interference contrast microscopy. Anal Bioanal Che. 391 (6), 2119-2125 (2008).
- Anselme, K., et al. The interaction of cells and bacteria with surfaces structured at the nanometre scale. Acta Biomate. 6 (10), 3824-3846 (2010).
- Anshup, A., et al. Growth of gold nanoparticles in human cells. Langmui. 21 (25), 11562-11567 (2005).
- Weinkauf, H., et al. Enhanced dark field microscopy for rapid artifact free detection of nanoparticle binding to Candida albicans cells and hyphae. Biotechnol. 4 (6), 871-879 (2009).
- Sondi, I., et al. Silver nanoparticles as antimicrobial agent: a case study on E coli as a model for Gram negative bacteria. J Colloid Interface Sc. 275 (1), 177-182 (2004).
- Berry, C. C. Possible exploitation of magnetic nanoparticle cell interaction for biomedical applications. J Mater Chem. 15 (5), 543-547 (2005).
- Chithrani, B. D., et al. Elucidating the mechanism of cellular uptake and removal of protein coated gold nanoparticles of different sizes and shapes. Nano Lett. 7 (6), 1542-1550 (2007).
- Chithrani, B. D., et al. Determining the size and shape dependence of gold nanoparticle uptake into mammalian cells. Nano Lett. 6 (4), 662-668 (2006).
- Elechiguerra, J. L., et al. Interaction of silver nanoparticles with HIV 1. J Nanobiotechnol. 3 (6), 1-10 (2005).
- Carlson, C., et al. Unique cellular interaction of silver nanoparticles size dependent generation of reactive oxygen species. J Phys Chem. 112 (43), 13608-13619 (2008).
- Roth, G. A., et al. Hyperspectral microscopy as an analytical tool for nanomaterials. WIREs Nanomed Nanobiotechnol In Press. , (2015).
- Williams, P., et al. Maize kernel hardness classification by near infrared (NIR) hyperspectral imaging and multivariate data analysis. Anal Chim Act. 653 (2), 121-130 (2009).
- Ziph Schatzberg, L. Hyperspectral imaging enables industrial applications. Industrial Photonic. , (2014).
- Sun, D. W. . Hyperspectral imaging for food quality analysis and contro. , (2010).
- ElMasry, G., et al. Hyperspectral imaging for nondestructive determination of some quality attributes for strawberry. J Food En. 81 (1), 98-107 (2007).
- Mortimer, M., et al. Potential of hyperspectral imaging microscopy for semi quantitative analysis of nanoparticle uptake by protozoa. Environ Sci Techno. 48, 8760-8767 (2014).
- Sarlo, K., et al. Tissue distribution of 20 nm 100 nm and 1000 nm fluorescent polystyrene latex nanospheres following acute systemic or acute and repeat airway exposure in the rat. Toxico. 263, 117-126 (2009).
- Husain, M., et al. Pulmonary instillation of low doses of titanium dioxide nanoparticles in mice leads to particle retention and gene expression changes in the absence of inflammation. Toxicol Appl Pharmacol. 269, 250-262 (2013).
- Meyer, J. N., et al. Intracellular uptake and associated toxicity of silver nanoparticles in Caenorhabditis elegan. Aquatic Toxicol. 100, 140-150 (2010).
- Badireddy, A. R., et al. characterization and abundance of engineered nanoparticles in complex waters by hyperspectral imagery with enhanced darkfield microscopy. Environ Sci Technol. 46 (18), 10081-10088 (2012).
- Dettmeyer, R. F. . Staining techniques and microscopy Forensic histopathology fundamentals and perspectives. , 370 (2011).
- Titford, M. Progress in the development of microscopical techniques for diagnostic pathology. J Histotechnol. 32 (1), 9-19 (2009).
- Kumar, G. L. . Special stains and H&E. , (2014).
- Manolakis, D., et al. Hyperspectral image processing for automatic target detection applications. Lincoln Laboratory Journal. 14 (1), 79-116 (2003).
- Mercer, R. R., et al. Pulmonary fibrotic response to aspiration of multi walled carbon nanotubes. Part Fibre Toxicol. 8 (1), 21 (2011).
- Kim, M. S., et al. Hyperspectral reflectance and fluorescence imaging system for food quality and safety. T Am Soc Ag En. 44 (3), 721-730 (2001).
- Mercer, R. R., et al. Extrapulmonary transport of MWCNT following inhalation exposure. Part Fibre Toxico. 10 (1), 38 (2013).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon