Method Article
Un magnetica microperla occlusione modello per indurre ipertensione oculare-Dependent Glaucoma nei topi
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Qui, presentiamo un protocollo per indurre ipertensione oculare nell'occhio murino che provoca la perdita di cellule gangliari retiniche come osservato nel glaucoma. microsfere magnetiche vengono iniettati nella camera anteriore e attratti l'angolo iridocorneale utilizzando un magnete per bloccare il deflusso dell'umore acqueo.
Abstract
L'uso di modelli di roditori di glaucoma è stato essenziale per comprendere i meccanismi molecolari che sono alla base della fisiopatologia di questa malattia neurodegenerativa multifattoriale. Con l'avvento di numerose linee di topi transgenici, vi è un crescente interesse in modelli murini inducibili di ipertensione oculare. Qui, presentiamo un modello di occlusione di glaucoma basato sull'iniezione di microsfere magnetiche nella camera anteriore dell'occhio utilizzando un microago modificato con uno smusso sfaccettata. Le microsfere magnetiche sono attratti l'angolo iridocorneale utilizzando un magnete palmare per bloccare il drenaggio dell'umore acqueo dalla camera anteriore. Questa perturbazione in acquose dinamica determina una elevazione costante della pressione intraoculare, che successivamente porta alla perdita di cellule gangliari retiniche, come osservato in pazienti affetti da glaucoma umani. Il modello di occlusione microperla presentato in questo manoscritto è semplice rispetto ad altri modelli inducibili di glaucoma e anche altamenteefficace e riproducibile. È importante sottolineare che le modifiche presentate qui riducono al minimo i problemi più comuni che spesso sorgono nei modelli di occlusione. In primo luogo, l'uso di un microago vetro molato impedisce il riflusso di microsfere e assicura che minimo danno si verifica alla cornea durante l'iniezione, riducendo così gli effetti di pregiudizio connessi. In secondo luogo, l'uso di microsfere magnetiche garantisce la possibilità di ottenere la maggior parte delle perline all'angolo iridocorneale, riducendo il numero di perline galleggianti nella camera anteriore evitando il contatto con altre strutture (ad es., Iride, cristallino). Infine, l'uso di un magnete palmare consente flessibilità durante la manipolazione del piccolo occhio mouse per dirigere efficacemente le microsfere magnetiche e assicurarsi che c'è poca reflusso delle microsfere dall'occhio quando il microago viene ritirata. In sintesi, il modello murino di occlusione microperla qui presentata è un potente strumento di indagine per studiare i cambiamenti neurodegenerativi che si verificano durante l'insorgenza e la progressione della Glaucoma.
Introduzione
Il glaucoma è una malattia progressiva e irreversibile accecante che interesserà le stime, 80 milioni di persone in tutto il mondo entro il 2020 1. In pazienti affetti da glaucoma, perdita della vista è causata dalla morte selettiva delle cellule gangliari della retina (RGCs), i neuroni di output che trasmettono informazioni visive dal retina al cervello. Il glaucoma è una malattia neurodegenerativa legata all'età con molti fattori di rischio di cui il più comune è l'elevata pressione intraoculare (IOP). Infatti, IOP è l'unico fattore di rischio modificabile nel glaucoma e trattamenti attuali si concentrano esclusivamente sulla gestione della pressione oculare. Tuttavia, molteplici fattori genetici, cellulari e ambientali influenzano l'insorgenza e la progressione della malattia. Pertanto, la comprensione dei vari meccanismi che alla fine contribuiscono alla morte neuronale è essenziale per sviluppare trattamenti efficaci per il glaucoma.
I modelli animali di glaucoma sono essenziali per studiare le malattie fisiopatologia e di identificare e testareterapeutica promettente. La crescente disponibilità di linee di topi transgenici compresi i ceppi knockout condizionali e topi portatori traccianti fluorescenti geneticamente codificati ha spinto la necessità di modelli murini glaucoma inducibile. Diversi modelli di roditori di glaucoma sono stati sviluppati nel corso degli anni (recensiti a 2,3). In molti di questi modelli, il glaucoma è indotta interrompendo dinamiche nell'umore acqueo, con conseguente aumento della IOP. Modelli occlusione, in cui microsfere o altre sostanze vengono iniettate nella camera anteriore dell'occhio per bloccare il drenaggio acquosa, hanno guadagnato popolarità negli ultimi anni in parte grazie alla loro relativa facilità di aumentare IOP 4-14.
Il modello microbead occlusione del glaucoma, prima effettuata in primati 12, conigli 8, e ratti 4,9,11, è stato recentemente adattato per l'uso in topi 5,6,10. In questi studi, l'iniezione intracameral di microsfere di polistirolo, da solo o incombinazione con un materiale viscoelastico, ha provocato IOP elevazione che porta alla successiva morte 6,10 RGC. Tuttavia, reflusso quando l'ago viene ritirato dall'occhio e sloggiare di microsfere dall'angolo iridocorneale sono i problemi più comuni che si presentano durante la procedura. Per minimizzare questi inconvenienti, i magneti sono stati utilizzati per ottenere microsfere magnetiche all'angolo iridocorneale dell'occhio 4,9.
Il protocollo qui descritto è una procedura modificata sulla base di studi precedenti 9,10 che utilizza microsfere magnetiche e un magnete palmare atta ad occhio mouse (Figura 1). Diversi importanti modifiche sono state introdotte nel nostro protocollo per garantire aumento IOP efficace e riproducibile in topi. In primo luogo, l'iniezione di microsfere viene fatto utilizzando un microago vetro preparato con cura con uno smusso sfaccettato. Le superfici lisce conseguenti del microago così come la sua punta affilata assicura che danno minimo èinflitto come perfora la cornea. L'uso di questo microago vetro comporta anche un maggiore controllo quando la punta microago entra nella camera anteriore, riducendo così il rischio di danneggiare le strutture circostanti, come l'iride e la lente. Inoltre, la piccola lesione corneale iniezione facilita autoriparazione e riduce gli effetti di pregiudizio relativi indesiderati.
In secondo luogo, l'iniezione di microsfere magnetiche e l'uso di un magnete palmare consentono un controllo preciso per attirare i talloni verso l'angolo iridocorneale nell'occhio piccolo topo. microsfere magnetiche che sono 4,5 micron di diametro sono stati utilizzati perché questa dimensione microperla non intasare l'apertura microneedle preparata e, soprattutto, una volta iniettato, queste microsfere hanno bloccato efficacemente il drenaggio dell'umor acqueo. Questo approccio non solo riduce il reflusso delle microsfere iniettati, ma assicura anche che un numero massimo di microsfere accumula nella zona di destinazione di bloccare efficacemente il drenaggio dell'umore acqueo. Furthermore, questa strategia riduce anche il numero di perline galleggianti nella camera anteriore evitando il contatto con altre strutture, come l'iride e la lente, e il passaggio impedendo alla camera posteriore. Collettivamente, queste modifiche assicurano che la chirurgia iniezione microbead viene eseguita con relativa facilità e in modo tempestivo conseguente induzione altamente riproducibile, efficace e costante di ipertensione oculare nei topi.
Protocollo
La seguente procedura è stata eseguita in conformità con le linee guida del Consiglio Canadese cura degli animali per l'utilizzo di animali sperimentali e la dichiarazione per l'uso di animali in oftalmica e ricerca visiva dalla Associazione per la Ricerca e la Visione e Ophthalmology (ARVO).
1. Preparazione del Microneedle per anteriore Intracameral iniezione
- Con un estrattore, generare un microago da un capillare di vetro borosilicato
- Al microscopio, utilizzare una lama affilata per creare attenzione un'apertura sulla punta del microago. L'apertura risultante dovrebbe avere una forma ellittica con un maggiore e minore diametro asse di circa 190 micron e 70 micron rispettivamente. Misurare l'area del preparato apertura microago mediante primi acquisizione delle immagini con un righello posto sotto il microscopio seguita da quantificazione utilizzando software di analisi di immagine.
- Nel sistema micropipetta bisellatura, posizionare il microago a 20 degree l'angolo rispetto alla piastra di smussatura modo che l'apertura microago sta toccando la piastra. Bevel per circa 10 minuti fino a quando i bordi sono piatta e liscia. Aggiungere qualche goccia di acqua distillata per aiutare nel processo.
- Ruotare il microago per smussare i due lembi che circondano l'apertura fino a quando la punta è affilata.
- Pulire tutti i detriti e l'acqua dall'apertura punta microago utilizzando un spolverino di aerosol.
- Esaminare attentamente il microago finito sotto un microscopio. microaghi Eliminare con fratture per ridurre al minimo il rischio di rottura del microago durante l'intervento chirurgico.
- Sterilizzare il microago risciacquando prima con etanolo, quindi con soluzione salina bilanciata sterile (BSS).
2. Preparazione della soluzione microperla magnetica
Nota: Le microsfere magnetiche utilizzati in questo studio sono rivestite con gruppi epossidici. Per evitare eventuali effetti negativi, come aggregazione delle perline e interazioni molecolari indesiderati, questi gruppi epossidici devonoprima essere rimossi dalle microsfere prima di procedere con la chirurgia iniezione.
- La rimozione di resina epossidica gruppi da biglie magnetiche
- Preparare una soluzione di 0,02 M di idrossido di sodio (NaOH, MW 39,997 g / mol) in 10x tampone Tris (MW 121.14 g / mol).
- Agitare delicatamente lo stock di soluzione microperla magnetico (4,5 micron di diametro, 4 x 10 8 perline / ml) fino a quando le perle sono uniformemente sospese in soluzione.
- pipettare rapidamente 1 ml di soluzione perla magnetica in 50 ml di 0,02 M NaOH in 10x tampone Tris.
- Ruotare per 24 ore a temperatura ambiente per rimuovere i gruppi epossidici dalle perline.
- Raccogliere le perline assicurando un magnete al fondo della provetta. Orientare il tubo orizzontalmente per garantire che tutte le perle sono attratti dal magnete. Ruotare per un ulteriore 4 ore a temperatura ambiente.
- Con una micropipetta, rimuovere con attenzione il surnatante senza disturbare il pellet di perline.
- Agitare delicatamente il pellet in 50 ml di 10x Tris buffer fino a quando le perle sono ben sospese.
- Ripetere i punti 2.1.4 a 2.1.6.
- Concentrazione e Risospensione di microperle magnetici in soluzione sterile salina bilanciata
Nota: È necessario concentrare lo stock di soluzione branello magnetico sterile soluzione salina bilanciata (BSS) per raggiungere una concentrazione finale di 1,6 x 10 6 perline / ml in modo che 2,4 x 10 6 sfere possono essere iniettati nella camera anteriore in un volume finale di 1,5 ml, che è appropriato per l'occhio piccolo topo.
- Lavare le perline in 5 ml di acqua ultra-pura di laboratorio di grado vortex delicatamente per 2 minuti.
- Raccogliere le perline da essi attirando al fondo della provetta con un magnete.
- Con una micropipetta, rimuovere con attenzione l'acqua senza disturbare il pellet di perline.
- Ripetere i passaggi più 2.2.1 a 2.2.3 per tre volte.
- In una cappa a flusso laminare, lavare le perline con 500 ml di BSS per pipetting su e giù. Eseguire i passaggi rimanenti in questa sezione in condizioni sterili in una cappa a flusso laminare.
- Raccogliere le perline da essi attirando al fondo della provetta con un magnete.
- Con una micropipetta, rimuovere con attenzione il BSS senza disturbare il pellet di perline.
- Ripetere i passaggi più 2.2.5 a 2.2.7 per tre volte.
- Risospendere pipettando le perline su e giù in 250 ml di BSS.
- Assicurarsi che la soluzione tallone è ben omogeneizzato. Poi, Aliquotare rapidamente 25 ml di sospensione in sterili provette da 0,5 ml. La concentrazione finale della soluzione madre perla è di 1,6 x 10 6 perline / ml.
- Conservare a 4 ° C.
3. L'induzione di ipertensione oculare
Nota: La sezione 3 è una operazione due persone. Nel caso in cui una particolare azione deve essere eseguita da una persona specifica, la persona appropriata viene identificata. In generale, Person 1 gestisce il mouse sotto il microscopio, mentre Persona 2 è responsible per manipolare la pompa microsiringa. La durata totale della procedura chirurgica deve essere inferiore a 10 min (punti 3.9 3.17).
- Eseguire le procedure in adulti C57BL 6 topi /. Topi Casa in un ambiente standard con accesso a cibo e acqua ad libitum. In questo lavoro, usare femminile C57BL 6 topi / tra i 3 ei 4,5 mesi di età. Tuttavia, questo protocollo può essere adattato ai maschi e topi di età diverse, così come altri ceppi di topi, compresi topi transgenici e knockout.
- Misurare IOP basale nei topi svegli prima dell'iniezione anestesia e microperla utilizzando un tonometro rimbalzo calibrato. Applicare una goccia di proparacaina cloridrato sulla cornea.
- frenare delicatamente il mouse tenendo premuto il pelle tra le orecchie. Posizionare il mouse sul banco in modo che l'animale è comodo e gli occhi sono accessibili. Tenere il tonometro perpendicolarmente alla superficie corneale e prendere almeno tre serie di dieci letture consecutive per occhio per ottenere unmedia IOP. La misurazione della pressione intraoculare nei topi svegli si preferisce bypassare gli effetti narcotizzanti relative su IOP. In alternativa, IOP può essere misurata in topi anestetizzati dopo passo 3.4.
- Preparare una miscela cocktail anestesia magazzino del mouse composto da 20 mg / ml di ketamina, 2 mg / ml xilazina, e 0,4 mg / ml acepromazina.
- Indurre anestesia nel topo per somministrazione intraperitoneale di miscela cocktail (1 ml / g di peso corporeo). L'uso di un cocktail anestetico iniettabile è preferito rispetto anestetici gas (ad esempio, isoflurano) perché permette flessibilità nel maneggiare la testa mouse come l'animale non è collegato ad una maschera di inalazione. Inoltre, il periodo di recupero più necessario con un anestetico iniettabile assicura che microsfere depositano l'angolo iridocorneale non staccare di nuovo nella camera anteriore.
- Somministrare 0,05 mg per kg di peso corporeo di buprenorfina per via sottocutanea.
- Trattare l'occhio con un ey tropicamidee scendere a indurre la dilatazione della pupilla. A causa delle piccole dimensioni della camera anteriore murino, la pupilla deve essere dilatata per visualizzare facilmente il posizionamento e l'avanzamento del microago durante l'iniezione.
- Applicare unguento topico sull'occhio controlaterale (non operati) per evitare l'essiccamento della cornea durante la procedura.
- Attaccare un microago pulita al gruppo di iniezione della pompa microsiringa. Sostituire il microago dopo ogni operazione per evitare la contaminazione incrociata degli animali.
- Persona 1: Trasferire il mouse anestetizzati alla piattaforma operativa. Al microscopio, assicurarsi che la pupilla è completamente dilatata e che i muscoli oculari sono rilassato in modo che non vi è movimento dell'occhio. L'assenza di movimenti oculari garantisce stabilità durante l'iniezione. Pulire delicatamente il calo tropicamide occhio dall'occhio utilizzando tamponi assorbenti.
- Persona 2: Mescolare la soluzione microbead magnetica pipettando su e giù.
- Utilizzando la pompa microsiringa, caricare immediatamente il MICRoneedle (preparato nella sezione 1) con 1,5 ml di soluzione microbead magnetica omogeneizzati (2,4 x 10 6 perline). Assicurarsi che le bolle d'aria sono assenti sulla punta del microago. Dopo il microago è caricato, effettuare passi 3.12 al 3.13 rapidamente possibile in modo che la soluzione microbead magnetica rimane in una sospensione omogenea.
- Posizionare il microago caricato in un angolo di 45 °, posizionato anteriormente rispetto al limbus. Persona 1: sostenere l'occhio con pinze di plastica. Assicurarsi che l'angolo tra il microago e le pinzette di plastica è di circa 90 °.
- Persona 2: Con il microago caricato, forare delicatamente la cornea in modo che la punta del microago entra nella camera anteriore. Assicurarsi che il microago caricata rimane ad un angolo di 45 ° rispetto alla limbus durante la foratura. Evitare qualsiasi contatto con l'obiettivo o l'iride. Assicurarsi che il microago non entra nella camera posteriore. Persona 1: continuare a sostenere l'occhiocon pinze di plastica.
- Persona 1: Senza muovere la testa mouse, posizionare il magnete accanto l'occhio, opposta alla punta microago, per ottenere le perline magnetiche nella camera anteriore e minimizzare il contatto delle perline con la superficie interna della cornea. Persona 2: Utilizzando la pompa microsiringa, iniettare 1,5 ml di soluzione tallone magnetica nella camera anteriore. La soluzione microbead viene iniettato in un periodo di 15 a 30 sec. Persona 1: continuare a tenere il magnete opposta alla punta microago durante tutta la durata dell'iniezione.
- Persona 2: Una volta che il volume pieno di perline è stato iniettato, ritirare lentamente il microago dall'occhio. Persona 1: Per evitare il reflusso delle microsfere, continuano ad ottenere le perline magnetiche verso la camera anteriore tenendo il magnete accanto all'occhio per altri 30 a 60 sec.
- Persona 1: Utilizzando il magnete, ottenere le perline per l'angolo iridocorneale. Assicurarsi che le perle formano un anello uniformemente distribuitointorno alla circonferenza della camera anteriore. Durante questa fase, evitare di attrarre perline alla cornea in quanto hanno la tendenza ad aderire alla superficie interna della cornea su contatto.
- Trattare l'occhio operato con un collirio antibiotico per ridurre al minimo il rischio di infezione.
- Lasciare che il mouse per recuperare su un blocco di calore fino a quando completamente sveglio (~ 3 a 4 ore). Posizionare il mouse in modo che l'occhio operato sia rivolto verso l'alto. Questo posizionamento impedisce l'accumulo delle perline iniettati alla superficie interna della cornea gravitazionale. Inoltre, questa posizione si riduce il potenziale di infezione dell'occhio operato non sarà in contatto con qualsiasi biancheria e / o altri materiali che possono essere presenti nella gabbia. Nel caso in cui un animale mostra segni di sofferenza, somministrare dosi supplementari di buprenorfina come necessario.
- Lasciare i topi per recuperare dalla procedura per almeno 2 giorni prima di eseguire misurazioni IOP. Misurare IOP come descritto al punto 3.2. Monitor IOP almeno una volta alla settimana o più frequentemente, se necessario, e allo stesso tempo del giorno per minimizzare le fluttuazioni circadiani correlati.
- Per le misurazioni IOP, usare l'occhio controlaterale dal mouse operato come controllo interno. In alternativa, utilizzare le misurazioni da intatte, non gestite controlli come ingenui o topi sham-operati.
4. Valutazione della gangliari della retina cellule Soma e Axon sopravvivenza
- Profumato topi sottoposti a ipertensione oculare mediante iniezione intracardial 0,1 M tampone fosfato (PBS) immediatamente seguito da ghiacciata 4% paraformaldeide (PFA).
- Profumato intatti i topi, non opera come descritto al punto 4.1 e li usa come controlli illeso. L'uso di occhi controlaterali da topi operati non è raccomandata per valutare la sopravvivenza RGC perché i cambiamenti negli occhi controlaterale seguenti lesioni sono state riportate 15,16 e possono confondere l'interpretazione dei dati. In alternativa, utilizzare sham-operati occhi iniettati con 1.5 Ml di BSS come controlli.
- Utilizzando microscissors, accuratamente tagliare il tessuto connettivo intorno agli occhi per isolarlo dal cavità oculare. Separare il nervo ottico dall'occhio tagliandolo a livello della testa del nervo ottico.
- Utilizzando un ago G 30, un foro nella cornea per consentire la penetrazione della soluzione fissativo nell'occhio. Inserire l'occhio in 4% PFA e incubare per 1 ora a 4 ° C per il fissaggio aggiuntivo.
- Posizionare il nervo ottico in una soluzione contenente 2% PFA e 2,5% glutaraldeide in 0,1 M di sodio cacodilato (MW: 214 g / mol) e incubare O / N a 4 ° C per il fissaggio aggiuntivo.
5. retine Quantificazione del RGC Soma densità su Flat-montati
Nota: La seguente procedura è adattato da un protocollo da Nadal-Nicolas et al 17 e delinea la quantificazione di RGCs utilizzando un anticorpo contro il homeobox / POE 3A proteina dominio specifico del cervello (Brn3a) sulla retina piatti-monti.. meth AlternativeODS per RGCs etichettatura può essere utilizzato anche compreso immunoistochimica con un anticorpo contro la proteina RNA-binding con splicing multipla (RBPMS) o marcatura retrograda con Fluorogold o DII.
- Sotto un microscopio da dissezione, rimuovere la parte anteriore dell'occhio facendo un'incisione lungo tutta limbus fino cornea stacca facilmente. Rimuovere la cornea e la lente. staccare con cautela la retina dall'occhio mediante tagli lungo la serrata e del nervo ottico.
- Preparare una retina piana montaggio facendo quattro piccole incisioni equidistanti dalla periferia della retina verso il nervo ottico per delineare chiaramente i quattro quadranti della retina. Usando una piccola spazzola, rimuovere delicatamente ogni residuo vetroso dalla retina. La rimozione di quanto vitreo possibile è fondamentale per ottenere un segnale immunoistochimica pulito e forte.
- Trasferire accuratamente la retina ad una piastra di coltura di fondo 48 pozzetti piatto contenente 0,5% Triton X-100 in PBS in modo che la retina èlibero di fluttuare. Assicurarsi che lo strato di cellule gangliari sia rivolto verso l'alto.
- Posizionare la piastra di coltura a -70 ° C per 15 min. Dopo lo scongelamento le retine, ulteriormente permeabilize mediante lavaggio due volte in fresco 2% Triton X-100 in PBS.
- Diluire l'anticorpo Brn3a 0,3 - 0,5 mg / ml con PBS contenente 2% Triton X-100 e 2% di siero normale asino. Incubare la retina nella soluzione di anticorpo primario Brn3a agitando delicatamente O / N a 4 ° C. Le retine devono essere completamente immersi in 150 a 200 ml di soluzione in ogni momento.
- Diluire il asino anti-IgG di capra anticorpo secondario di 2 mg / ml con PBS contenente 2% Triton X-100 e incubare retina in questa soluzione per 2 ore a temperatura ambiente agitando delicatamente. La retina deve essere completamente immerso nella soluzione di anticorpi in ogni momento. Coprire la piastra di coltura con un foglio di alluminio per le rimanenti misure per prevenire photobleaching.
- Utilizzando un pennello, trasferire accuratamente la retina a una diapositiva in modo che il tessuto risulta più piatta posbile. asciugare all'aria per 10 minuti. Montare usando anti-sbiadimento mezzo di montaggio.
- Esaminare le retiniche flat-monta sotto un microscopio a fluorescenza. Quantificare il numero di Brn3a RGCs positivi in tre aree non sovrapposte per quadrante della retina, come descritto. 18
6. Quantificazione del RGC assoni sul nervo ottico sezioni trasversali
- Raccogliere il nervo ottico dal punto 4.5 e incubare nel 2% tetrossido di osmio (OSO 4, MW 254,23 g / mol) per 2 ore.
Attenzione: A causa della sua elevata tossicità, tetrossido di osmio dovrebbe essere gestita in una cappa aspirante con abbigliamento adeguato laboratorio. - Disidratare il nervo ottico immergendolo in concentrazioni crescenti di etanolo (50%, 70%, 90%, 95% e 100%) per 15 minuti ciascuno.
- Preparare la resina epossidica con la seguente ricetta: 15.72 ml Incorpora-812, 6,45 ml Dodecenyl succinica, 7,83 ml Nadic metile anidride, 0,45 ml DMP-30.
- Sequenziale incubare il nervo ottico nelle soluzioni compostodei seguenti rapporti di resina epossidica a ossido di propilene (MW 58.08 g / mol): 0: 1, 1: 1, 0.75: 0,25 e 1: 0. Il nervo ottico è incubato in ogni soluzione a temperatura ambiente per una / N periodo O.
- Incubare nervi ottici incorporati nei 100 di resina epossidica% (ultimo passo da 6.4) a 60 ° C per un ulteriore 48 ore.
- Genera semi-sottile ottica sezioni trasversali del nervo (0,75 micron) utilizzando un microtomo.
- Stain sezioni trasversali del nervo ottico con 1% toluidina blu.
- Quantificare gli assoni RGC in cinque aree non sovrapposte di ogni sezione del nervo ottico come descritto 19.
Risultati
L'iniezione di microsfere magnetiche nella camera anteriore di topi adulti descritte in questo protocollo comportato una elevazione robusto e riproducibile di IOP. Una settimana dopo la procedura, IOP è aumentato da 10 ± 0,6 mm Hg (media ± SEM), la IOP media al basale negli occhi controlaterale, a 19 ± 0.5 mmHg negli occhi ipertesi (t di Student-test; *** p <0.001, n = 12, Tabella 1, Figura 2). IOP stabilizzato dopo e rimasta elevata a una media di 20 mm Hg per almeno 6 settimane, il time-point lungo esaminati in questo studio. La IOP picco media negli occhi microperla-iniettato a 2, 3, e 6 settimane dopo l'intervento era di 25 mm Hg. La stragrande maggioranza dei topi trattati sviluppato sostenuta IOP elevata, pertanto questo protocollo non richiede una seconda iniezione di microsfere.
Per valutare il tempo-corso di perdita di RGC in questo modello, RGC soma eranoprima quantificata mediante immunocolorazione con Brn3a, un marcatore specifico per RGC 17. Il numero di cellule Brn3a-positive è stato quantificato sulla retina piatto montato a 1, 2, 3 e 6 settimane dopo l'induzione di ipertensione oculare. Anche se un aumento significativo della pressione intraoculare è stata rilevata fin da 1 settimana dopo l'iniezione microperla, nessuna perdita significativa di RGC soma è stato osservato entro le prime 2 settimane di procedura (Figura 3). Sostanziale morte RGC (22%), tuttavia, era evidente a 3 settimane (2.430 ± 67 RGCs / mm 2, media ± SEM, n = 12) e 6 settimane (2.350 ± 74 RGCs / mm 2, n = 10) post- induzione di ipertensione oculare, rispetto agli occhi di controllo intatti da topi non trattate a (3.141 ± 49 RGCs / mm 2, n = 23) (ANOVA, p <0.001).
Erettile e la degenerazione degli assoni RGC è una caratteristica cardinale di glaucoma. Pertanto, la perdita assonale è stata esaminata a 3 e 6 settimane dopo l'iniezione microperla daquantificazione degli assoni RGC nel nervo ottico sezioni colorate con blu di toluidina (Figura 4). Una sostanziale perdita di assoni RGC (25%) è stata osservata a 3 settimane (28,401 ± 702 assoni / nervo, media ± SEM, n = 5) e 6 settimane (29.426 ± 948 assoni / nervo, n = 6) dopo l'iniezione di microsfere rispetto ai nervi ottici intatti da occhi non-gestito (39.467 ± 137 assoni / nervo, n = 4) (ANOVA, p <0.001). Collettivamente, questi dati dimostrano che l'iniezione di microsfere magnetiche nella camera del mouse anteriore porta a riproducibili e sostenuta elevazione IOP che si traduce in RGC soma e assone degenerazione.
| Ora dopo l'intervento chirurgico OHT | N | Pressione intraoculare media (mmHg) ± SEM | Peak IOP (mmHg) | ||||
| controlaterale | Glaucoma | difference | controlaterale | Glaucoma | |||
| 1 settimana | 12 | 10 ± 0.4 | 19 ± 0.5 | 9 ± 0,6 | 12 ± 0.4 | 22 ± 0,6 | |
| 2 settimane | 13 | 11 ± 0.5 | 20 ± 0.8 | 9 ± 0,5 | 12 ± 0.9 | 25 ± 0.7 | |
| 3 settimane | 10 | 11 ± 0.8 | 20 ± 0.7 | 10 ± 0.9 | 13 ± 0.2 | 25 ± 0.9 | |
| 6 settimane | 12 | 12 ± 0.5 | 20 ± 0,6 | 9 ± 0,7 | 13 ± 0.5 | 24 ± 0,6 | |
Tabella 1. Elevazione della pressione intraoculare nel murino magnetico microperla Occlusiil modello. In femminile sveglio C57 BL / 6 topi, IOP è stata misurata con un tonometro rimbalzo calibrato. occhi Operated visualizzati un aumento della IOP rilevato ad una settimana di post-intervento chirurgico che è rimasta elevata per almeno sei settimane dopo la procedura.
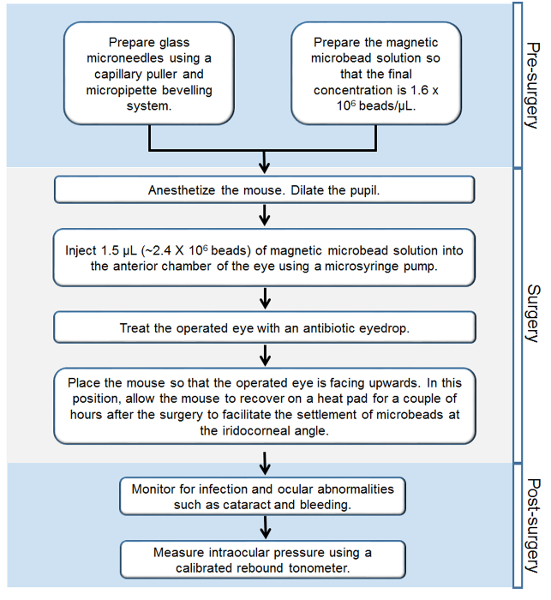
Figura 1. Flusso di lavoro delle fasi del Murine magnetico microperla occlusione modello di glaucoma. Step-by-scaletta di tutte le procedure eseguite prima, durante e dopo l'intervento chirurgico. Si prega di cliccare qui per vedere una versione più grande di questa figura.
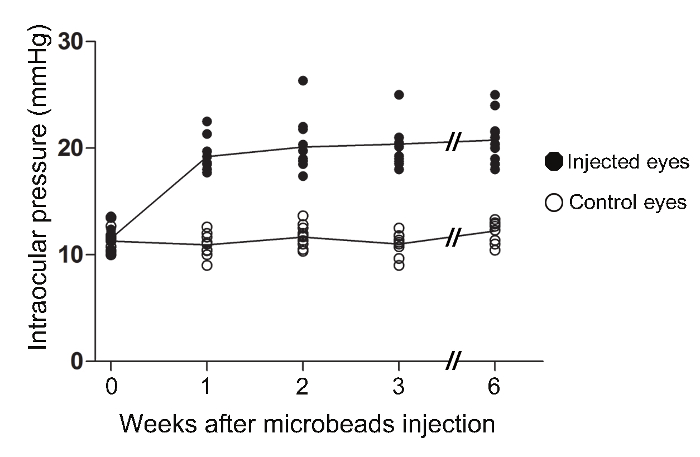
Figura 2. Aumento della pressione intraoculare nel modello murino magnetico microperla occlusione. In svegliofemminile C57 BL / 6 topi, IOP è stata misurata con un tonometro rimbalzo calibrato. I IOP di occhi microperla-iniettati erano significativamente elevati ad una settimana post-chirurgia (ANOVA, p <0.001). I IOP sono rimasti significativamente elevati rispetto all'occhio controlaterale di topi iniettati per almeno 6 settimane (ANOVA, p <0.001). (Intact: n = 12, 1 settimana: n = 12, 2 settimane: n = 13, 3 settimane: n = 10, a 6 settimane: n = 12). Si prega di cliccare qui per vedere una versione più grande di questa figura.
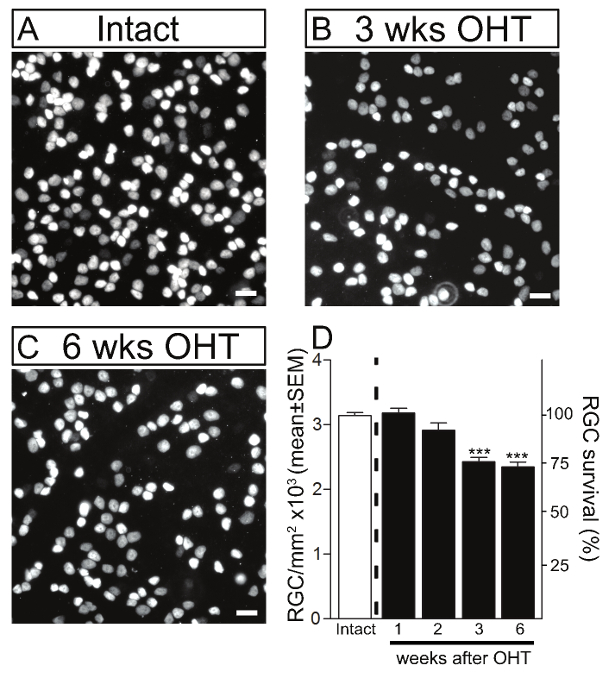
Figura 3. gangliari della retina cellule morte negli murini magnetici microperla occlusione del modello. RGCs sono stati visualizzati mediante immunocolorazione di retine piatto montato utilizzando Brn3a in retine intatte di controllo (A) e retine glaucomatosi a 3 e 6 settimane dopo l'iniezione microperla per indurreipertensione oculare (OHT) (B, C). Barre di scala: 20 micron. (D) L'analisi quantitativa ha confermato che l'iniezione microperla portato a una significativa perdita soma RGC a 3 e 6 settimane dopo la procedura di confronto per controllare gli occhi. La densità di RGC soma in intatto, C57 non glaucomatosa topi / BL6 è indicato come riferimento (barre bianche, 100% di sopravvivenza). I valori sono espressi come media ± SEM (Intact: n = 23, 1 settimana: n = 6, 2 settimane: n = 6, 3 settimane: n = 12, 6 settimane: n = 10, ANOVA, *** p < 0,001). clicca qui per vedere una versione più grande di questa figura.

Figura 4. assonale degenerazione nei murini assoni magnetica microperla occlusione modello. RGC sono stati visualizzati dalla colorazione del nervo ottico sezioni con il blu di toluidina inControllo intatto (A) e retine glaucomatosi a 3 e 6 settimane dopo l'iniezione microperla per indurre ipertensione oculare (OHT) (B, C). Barre di scala: 10 micron. (D) L'analisi quantitativa ha confermato che l'iniezione microperla portato a una significativa perdita di assoni RGC a 3 e 6 settimane dopo la procedura di confronto per controllare gli occhi. La densità degli assoni RGC in intatto, C57 non glaucomatosa topi / BL6 è indicato come riferimento (barre bianche, 100% di sopravvivenza). I valori sono espressi come media ± SEM (Intact: n = 4; 3 settimane: n = 5, 6 settimane: n = 6, ANOVA, *** p <0.001). Si prega di cliccare qui per vedere una versione più grande di questa figura .
Discussione
La tecnica video presentato qui fornisce dettagliate istruzioni passo-passo su come eseguire l'iniezione intracameral di microsfere magnetiche per indurre in modo efficace e riproducibile IOP elevazione nei topi. Questa procedura si traduce in aumento della pressione intraoculare sostenuto che non necessita di ulteriori iniezioni e promuove rilevabile soma RGC e la perdita di assoni entro le prime 3 settimane di ipertensione oculare induction.Elevated IOP è un importante fattore di rischio per lo sviluppo di glaucoma negli esseri umani. Pertanto, questa è una murino oculare modello di glaucoma ipertensione-dipendente prezioso che ha il potenziale per una vasta gamma di applicazioni.
Un inconveniente comune associato con l'iniezione di microsfere nella camera anteriore riferisce a tallone reflusso attraverso il sito di iniezione quando l'ago viene ritirato, il che si traduce spesso in solo parziale ostruzione acquosa e una maggiore variabilità. Per risolvere questo problema, sono state attuate diverse modifiche importanti. Firs t, l'accurata preparazione di un ambiente pulito, microago vetro tagliente di smusso sfaccettato è essenziale per l'iniezione di successo delle microsfere. Un microago adeguatamente preparato consente penetrazione controllata e liscia della cornea con una minima applicazione di pressione alla superficie oculare delicata. La piccola puntura corneale impedisce il riflusso di microsfere. Inoltre, la multa microneedle riduce il rischio di danneggiare strutture vicine, come l'iride e la lente, che potrebbe tradursi in infiammazione correlati non-malattia. In secondo luogo, l'applicazione di un magnete palmare per aree oculari strategiche durante e dopo l'iniezione è un altro aspetto critico di questa tecnica. Durante l'iniezione, il magnete viene utilizzato per disegnare le microsfere magnetiche alla camera prevenire il reflusso anterior delle microsfere quando il microago viene ritirata. Dopo l'iniezione, il magnete viene poi utilizzato per indirizzare le microsfere all'angolazione iridocorneale di bloccare deflusso dell'umore acqueo.
tenda "> Un altro problema spesso incontrate nei modelli di occlusione microperla è che le iniezioni ripetute perline sono spesso necessari per raggiungere sostenuta IOP elevazione 10,11. Questo potrebbe essere il risultato di microperle sloggiare dal punto di vista iridocorneale con il tempo. La combinazione di un magnete palmare, come descritto sopra, e il posizionamento del mouse postoperatorio migliora notevolmente il risultato. l'uso di anestetici iniettabili, che consentono flessibilità per spostare la testa durante la procedura e richiedono un periodo di recupero più lungo post-operatorio, è favorito. posizionamento dello mouse con l'occhio operato rivolta verso l'alto per un paio d'ore dopo l'intervento contribuisce alla composizione di microsfere con l'angolo iridocorneale e diminuisce il rischio di sloggiare indietro nella camera anteriore.Garantire che il numero di perline iniettato è relativamente costante è un altro passo fondamentale per ridurre al minimo le variazioni inter-animale. Dal momento che le microsfere depositano presso il Bottom del tubo, è necessario omogeneizzare pienamente la soluzione microbead e prelevare il volume appropriato nel microago in modo tempestivo. L'iniezione di un minor numero di perline nella camera anteriore potrebbe causare il blocco incompleta delle strutture di drenaggio dell'umore acqueo, che è suscettibile di provocare scarsa o variabile elevazione IOP. Da segnalare, anche se il fine ultimo di iniezione microperla è quello di elevare la IOP, si deve usare cautela quando le misurazioni IOP da topi svegli sono superiori ai valori di picco riportati in questo studio (~ 25 mmHg). Estremamente elevati IOP aumentano il rischio di danno ischemico e possono anche causare dolore all'animale. L'elevazione della IOP dovrebbe essere considerata come uno dei molti fattori per valutare il successo della chirurgia. Come tale, il risultato della procedura deve essere misurata sulla base di diversi parametri tra cui elevazione IOP, morte soma RGC, e perdita di assoni.
Anche se il protocollo qui descritto si traduce nella maggior microsfere successoly sedimentazione all'angolo, un potenziale limitazione di questo modello è che quelle gocce che rimangono galleggianti in camera anteriore potrebbero interferire con l'imaging della retina vivo attraverso la cornea, così come saggi elettrofisiologiche e comportamentali che richiedono efficace passaggio della luce. Un altro aspetto importante da considerare quando si utilizza questo modello dell'occlusione microperla è che il grado di elevazione IOP e successiva degenerazione RGC varia con l'età e background genetico del mouse operato [4]. Pertanto, l'estensione della IOP elevazione e la timeline di RGC degenerazione dovranno essere determinati per ogni specifica linea di topo transgenico e / o fascia di età.
Una caratteristica di questo modello è che i risultati IOP elevata in un graduale perdita della morte RGC durante le prime tre settimane dopo l'iniezione microperla, e significativa la morte RGC è accertata in 3 settimane dopo la procedura. Pertanto, questo modello consente l'esame delle modifiche precoci e / o sottili che si verificano in questa disease, prima di Overt RGC soma e la perdita di assoni. Un significativo aumento nella morte RGC non è stata osservata tra 3 e 6 settimane dopo l'induzione di ipertensione oculare. Infatti, RGC soma e assone perdita rimasto stabile a ~ 22 - 25% tra 3 e 6 settimane a dispetto di successo e sostenuta IOP elevazione questi punti temporali. Una durata più lunga di sostenuta IOP può essere richiesto per ulteriore perdita RGC a verificarsi in C57BL / 6 topi, che sembrano essere più resistente ai danni RGC rispetto ad altri ceppi di topi. 5 modifiche aggiuntive al protocollo presentato qui, tra cui la regolazione della dimensione del tallone e ulteriori iniezioni, potrebbero essere necessari per studiare la perdita di RGC in momenti successivi. Pertanto, il nostro protocollo è ideale per studi si sono concentrati sui primi cambiamenti fisiopatologici che correlano con modesto neurodegenerazione RGC che sono rilevanti per insorgenza e la progressione precoce nel glaucoma umana.
Divulgazioni
The authors declare that they have no competing financial interests.
Riconoscimenti
The authors wish to thank Drs. David Calkins (Vanderbilt University) and James Morgan (Cardiff University) for sharing their expertise and for helpful advice towards developing this procedure. This study was supported by grants from the Canadian Institutes of Health Research (A.D.P.). Y.A.I. and N.B. are the recipients of postdoctoral fellowships from the Fonds de recherche du Québec-Santé (FRQS). N.B. was awarded a H.H. Jasper scholarship from the Groupe de Recherche sur le Système Nerveux Central (GRSNC). A.D.P. is a Chercheur Boursier National FRQS.
Materiali
| Name | Company | Catalog Number | Comments |
| Puller | Narishige | PC-10 | |
| Thin Wall Glass Capillaries | World Precision Instruments | TW150F-4 | Capillary has an outer diameter of 1.5 mm and inner diameter of 1.12 mm |
| Stereo Microscope | Zeiss | MZ9.5 | Zoom factor range of 2.5 to 6.0. Microscope used for needle-making and the micro-bead injection surgery. |
| Footswitch | Linemaster | T-91-SE | |
| Stainless Steel Blade | Feather | No. 11 | |
| Microelectrode Beveler | Science Products | BV-10 | |
| Aerosol Duster | Fisher | 23-022-523 | |
| Sodium Hydroxide | Fisher Scientific | BP359-500 | |
| Tris Base | Fisher Scientific | BP152-1 | |
| Vortex | Fisher Scientific | 12-812 | |
| Dynabeads M-450 Epoxy | Life Technologies | 14011 | Magnetic beads are 4.5 µm in diameter. Stock solution is at a concentration of 4 x 108 beads/mL. Store at 4°C. |
| Mini-Tube Rotators | Fisher Scientific | 05-450-127 | |
| 3 Handheld Magnets | Geomag | 0.45 Tesla. Magnet used for microbead preparation and microbead injection surgery. | |
| 25 mL serological pipet | Costar | 4489 | |
| Pipet | Drummond | 4-000-101 | |
| Biological Containment Hood | Biostad | 377355 | |
| Balanced salt solution (BSS) | Alcon | 0065-0800-25 | |
| P1000 Micropipet | Gilson | F123602 | |
| Microtube 1.5 mL | Sarstedt | 72.690 | |
| P200 Micropipet | Gilson | F123601 | |
| 0.2 mL PCR tube | Sarstedt | 72737.002 | |
| Ketamine | Controlled substance | ||
| Xylazine | Bayer Healthcare | ||
| Acepromazine | Vetoquinol | ||
| U-100 Insulin Syringe | Becton Dickinson and Company | 329461 | |
| Balance | Ohaus | CS 200 | |
| Buprenorphine | Controlled substance | ||
| Tropicamide ophthalmic solution | Alcon | 0998-0355-15 | 1% Mydriacyl |
| Manual Microsyringe Pump with Digital Display | World Precision Instruments | DMP | |
| Manual Micromanipulator | World Precision Instruments | M3301R | |
| Platform | Fisher Scientific | 14-673-52 | 8 x 8 inch |
| Absorbent swabs | Kettenbach | 30601 | |
| P20 Micropipet | Gilson | F123600 | |
| Plastic forcep | Euroband | 1001 | Ensure forcep is plastic and has a flat surface to avoid damaging the eye |
| Fluoroquinolone ophthalmic solution | Alcon | Vigamox | |
| Heating pad | Sunbeam | E12107-834 | |
| Tonometer | iCare | TV02 | TONOLAB rebound tonometer |
| Paraformaldehyde, Para | Fisher Scientific | T353-500 | |
| Dissection tools | |||
| Small brush | |||
| Glutaraldehyde solution | Sigma-Aldrich | G7651 | |
| Sodium Cacodylate, tryhydrate | Canemco and Marivec | 124-65-2 | |
| Brn-3a antibody (C-20) | Santa Cruz Biotechnology | sc-31984 | |
| Tissue Culture Plate, 48 well | Falcon | 353078 | |
| Triton X-100 | Fisher Scientific | BP151-500 | |
| Donkey Serum | Sigma-Aldrich | D9663 | |
| Donkey anti-Goat IgG (H+L) Secondary Antibody, Alexa Fluor 594 conjugate | Life Technologies | A-11058 | |
| Aluminum foil | |||
| Microscope Slides | Fisher Scientific | 12-550-15 | |
| Slow fade Gold antifade reagent | Life Technologies | S36936 | |
| Cover Glass | Fisher Scientific | 12-548-5E | |
| Osmium tetroxide 2% aqueous solution | Electron Microscopy Sciences | 3294949 | |
| Embed-812 | Electron Microscopy Sciences | 14900 | |
| Dodecenyl succinic anhydride | Electron Microscopy Sciences | 13710 | |
| Nadic methyl anhydride | Electron Microscopy Sciences | 19000 | |
| DMP-30 | Electron Microscopy Sciences | 13600 | |
| Propylene oxide | Sigma-Aldrich | 110205-1L | |
| Embedding mold-Dykstra | Electron Microscopy Sciences | 70907 | |
| Porter-Blum ultra-microtome | Sorvall | MT-2 | |
| Toluidine blue O (Certified Biological Stain) | Fisher-Scientific | T161-25 |
Riferimenti
- Quigley, H. A., Broman, A. T. The number of people with glaucoma worldwide in 2010 and 2020. Br J Ophthalmol. 90, 262-267 (2006).
- Bouhenni, R. A., Dunmire, J., Sewell, A., Edward, D. P. Animal models of glaucoma. J Biomed Biotechnol. 2012, 692609 (2012).
- Morrison, J. C., Cepurna Ying Guo, W. O., Johnson, E. C. Pathophysiology of human glaucomatous optic nerve damage: insights from rodent models of glaucoma. Exp Eye Res. 93, 156-164 (2011).
- Bunker, S., et al. Experimental glaucoma induced by ocular injection of magnetic microspheres. J Vis Exp. , (2015).
- Cone, F. E., Gelman, S. E., Son, J. L., Pease, M. E., Quigley, H. A. Differential susceptibility to experimental glaucoma among 3 mouse strains using bead and viscoelastic injection. Exp Eye Res. 91, 415-424 (2010).
- Cone, F. E., et al. The effects of anesthesia, mouse strain and age on intraocular pressure and an improved murine model of experimental glaucoma. Exp Eye Res. 99, 27-35 (2012).
- El-Danaf, R. N., Huberman, A. D. Characteristic patterns of dendritic remodeling in early-stage glaucoma: evidence from genetically identified retinal ganglion cell types. Neuroscience. 35, 2329-2343 (2015).
- Ngumah, Q. C., Buchthal, S. D., Dacheux, R. F. Longitudinal non-invasive proton NMR spectroscopy measurement of vitreous lactate in a rabbit model of ocular hypertension. Exp Eye Res. 83, 390-400 (2006).
- Samsel, P. A., Kisiswa, L., Erichsen, J. T., Cross, S. D., Morgan, J. E. A novel method for the induction of experimental glaucoma using magnetic microspheres. Invest Ophthalmol Vis Sci. 52, 1671-1675 (2011).
- Sappington, R. M., Carlson, B. J., Crish, S. D., Calkins, D. J. The microbead occlusion model: a paradigm for induced ocular hypertension in rats and mice. Invest Ophthalmol Vis Sci. 51, 207-216 (2010).
- Urcola, J. H., Hernandez, M., Vecino, E. Three experimental glaucoma models in rats: comparison of the effects of intraocular pressure elevation on retinal ganglion cell size and death. Exp Eye Res. 83, 429-437 (2006).
- Weber, A. J., Zelenak, D. Experimental glaucoma in the primate induced by latex microspheres. J neuroscience meth. 111, 39-48 (2001).
- Ho, L. C., et al. In vivo assessment of aqueous humor dynamics upon chronic ocular hypertension and hypotensive drug treatment using gadolinium-enhanced MRI. Invest Ophthalmol Vis Sci. 55, 3747-3757 (2014).
- Yang, Q., et al. Microbead-induced ocular hypertensive mouse model for screening and testing of aqueous production suppressants for glaucoma. Invest Ophthalmol Vis Sci. 53, 3733-3741 (2012).
- Gallego, B. I., et al. IOP induces upregulation of GFAP and MHC-II and microglia reactivity in mice retina contralateral to experimental glaucoma. J neuroinflammation. 9, 92 (2012).
- Rojas, B., et al. Microglia in mouse retina contralateral to experimental glaucoma exhibit multiple signs of activation in all retinal layers. J neuroinflammation. 11, 133 (2014).
- Nadal-Nicolas, F. M., et al. Brn3a as a marker of retinal ganglion cells: qualitative and quantitative time course studies in naive and optic nerve-injured retinas. Invest Ophthalmol Vis Sci. 50, 3860-3868 (2009).
- Morquette, B., et al. REDD2-mediated inhibition of mTOR promotes dendrite retraction induced by axonal injury. Cell Death Differ. 22, 612-625 (2015).
- Almasieh, M., Zhou, Y., Kelly, M. E., Casanova, C., Di Polo, A. Structural and functional neuroprotection in glaucoma: role of galantamine-mediated activation of muscarinic acetylcholine receptors. Cell Death Dis. 1, 27 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon