Method Article
Bioingegneria dei microrganismi del midollo osseo umano nel mouse e la loro visualizzazione mediante imaging live
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Viene presentato un metodo per creare e vivere immagini diverse nicchie di midollo osseo umanizzato nei topi. Sulla base della nicchia di supporto creata da cellule mesenchimali umane, l'aggiunta di cellule endoteliali umane induce la formazione di vasi umani, mentre l'aggiunta di rhBMP-2 induce la formazione di tessuto osseo chimerico maturo umano-mouse.
Abstract
Le cellule staminali ematopoietiche umane (HSCs) si trovano nella nicchia del midollo osseo (BM), una complessa rete multifattoriale di componenti che producono citochine, fattori di crescita e matrice extracellulare. La capacità di HSCs di rimanere in silenzio, di rinnovarsi o di differenziarsi e di acquisire mutazioni e di diventare maligne dipende dalle complesse interazioni che stabiliscono con diversi componenti stromali. Per osservare la crosstalk tra HSC umani e la nicchia umana BM in condizioni fisiologiche e patologiche, abbiamo progettato un protocollo per modellare e rappresentare in modo ectopicamente una nicchia BM humanizzata in topi immunodeficienti. Mostriamo che l'impiego di diversi componenti cellulari consente la formazione di strutture umanizzate e l'opportunità di sostenere l'impegno a lungo termine dell'immaginazione ematopoietica umana. Utilizzando la microscopia a due fotoni, possiamo visualizzare queste strutture in situ alla risoluzione delle singole cellule, fornendo un potente strumento nuovo per la caratterizzazione funzionale del BM umanoMicroambiente e il suo ruolo nella regolazione dell'ematopoiesi normale e maligna.
Introduzione
Le decisioni delle cellule di fato osservate nei compartimenti delle cellule staminali sono strettamente regolate da fattori intrinseci ed estrinseci. In particolare, è ora ampiamente riconosciuto che il microambiente BM svolge un ruolo fondamentale nel controllare l'interruttore in HSC da una quiescenza ad uno stato attivo, così come nel loro processo di auto-rinnovo o di differenziazione della destanza 1 . Inoltre, recenti risultati mostrano che malignità ematologiche influenzano la funzione del microambiente BM, indicando l'esistenza di una crosta attiva tra i due compartimenti 2 , 3 , 4 , 5 , 6 . Nonostante i recenti progressi, rimangono molte domande chiave su come l'attività di specifici componenti BM-niche contribuisca al comportamento HSC e alla trasformazione maligna.
Il microambiente di BM è altamente eterogeneo Miscela enea e complessa di molti tipi di cellule differenti, ciascuna con funzioni specializzate. L'abbondante componente endoteliale (EC) e vascolare regola il fatturato dei nutrienti e dei metaboliti, l'ingresso e l'uscita di diverse cellule da e verso BM e diverse funzioni HSC 7 , 8 . Le cellule stromali mesenchimali (MSC), una popolazione eterogenea di cellule staminali indifferenziate e progenitori impegnati attraverso tre differenti linee (ad es. Osteogeniche, condrogeniche, adipogeniche), sono un'altra componente fondamentale della nicchia BM. Questi MSC localizzano sia nelle aree centrali della BM che in prossimità della regione endosteale. Essi possono essere associati a strutture vascolari e sono implicati nella regolazione della funzione HSC 9 , 10 , 11 , 12 , 13 ,"> 14 , 15 .
Molte testimonianze suggeriscono che i HSC risiedono in vari siti definiti all'interno del midollo e che la loro funzione potrebbe dipendere dalla loro precisa localizzazione. La maggior parte delle conoscenze attuali riguardanti le HSC e la loro interazione con il microambiente BM deriva da studi murini 1 . L'uso di modelli xenograft ha esteso questa conoscenza a HSCs normali e maligni umani, inserendo nel BM murino di topi immunodeficienti 16 , 17 , 18 , 19 , 20 . Anche se questo rappresenta un modello valido, presenta ancora molte sfide, come la necessità di condizionare il mouse destinatario nella maggior parte dei casi per consentire l'individuazione e l'inserimento di HSC umano o la barriera tra specie e la sua influenza poco capita sulle interazioni delle cellule cellulari e funzioni.
L'uso di anticorpi neutralizzanti e topi geneticamente modificati, insieme a xenotrapianto, è stato strumentale per evidenziare la complessa dialogo che i HSC umani stabiliscono con i loro microambienti. L'introduzione e lo sviluppo della microscopia confocale intravitale a due fotoni ha spostato questi studi un passo in avanti, consentendo l'imaging diretto, ad alta risoluzione e dinamica del midollo osseo 19 , 20 , 21 , 22 e fornisce un potente strumento per la funzionalità Caratterizzazione del microambiente BM e il suo ruolo nella regolazione della funzione HSC. Al fine di aggirare alcuni dei problemi che emergono nei modelli classici di xenotrapianto, è stato messo in evidenza il concetto di ingegneria di una struttura BM umanizzata. La fusione di biomateriali e concetti di impianto cellulare, i rapporti hanno dimostrato la fattibilità di imitare l'osso umano mArrow microambiente nelle regioni eterotopiche 23 , 24 , 25 , 26 , 27 . Questo apre la possibilità di utilizzare la bioingegneria nei modelli del mouse per studiare l'ematopoiesi umana normale e maligna 28 , 29 , 30 , 31 , 32 , 33 , 34 , 35 , 36 , 37 , 38 , 39 , tumorigenesis e metastasi 40 , 41 , 42 , 43 , 44 .
Sulla base di precedenti esperienze in ingegneria dei tessuti ossei e in vivo 19 , 22 , 45 , 46 , 47 , 48 , 49 , 50 , 51 , 52 , descriviamo un protocollo per i bio-ingegneri e gli organotipi umani del tessuto umano. Queste strutture sono originarie dell'impianto di cellule stromali derivate da umani BM in basi a collagene innestate sottocutanea in topi immunodeficienti. In una precedente relazione abbiamo dimostrato che i MSC umani assicurano la formazione di un microambiente umano adeguato per l'assunzione di cellule ematopoietiche umane 45 . Inoltre, qui descriviamo come il coimpianto di altri componenti cellulari umani BMCome le cellule endoteliali umane (hEC) e / o le citochine importanti per la formazione dell'osso ( es., HBMP2), collaborano con gli hMSC per generare differenti microambienti umani, che possono essere immaginati in situ in situ .
Protocollo
Tutti gli esperimenti sugli animali sono stati eseguiti in base al PPL 70/8904, approvato dal Regno Unito Home Office e in conformità con le linee guida Cancer Research UK. L'uso del sangue del cordone ombroso umano (UCB) e dei campioni primari di leucemia mieloide acuta umana (AML) è stato approvato dal Comitato Etico di East London dopo aver ricevuto il consenso ed è stato eseguito in conformità alla Dichiarazione di Helsinki.
1. Impianti biotecnologici a base di collagene con cellule ematopoietiche e stromali umane
NOTA: L'intero protocollo deve essere eseguito in condizioni sterili e con materiale sterile. Il mezzo di coltura cellulare 1 corrisponde al mezzo hMSC (MEM-α, P / S e 10% hMSC-FBS); Il mezzo di coltura cellulare 2 corrisponde al mezzo EC (M199, 20% FBS, P / S, 10mM HEPES, 50μg / mL eparina, 2mM glutammina e 50μg / mL ECGS) e il mezzo di coltura cellulare 3 corrisponde al mezzo cellulare ematopoietico (H5100 E P / S).
- Preparare il sangue del cordone ombelicale mCellule ononucleari (CB-MNCs) o primari AML (midollo osseo o MNCs periferici periferici) utilizzando un gradiente di densità Ficoll-Paque, secondo protocolli ben consolidati 53 .
- Per AML, esaurire le cellule T utilizzando l'anticorpo OKT.3. Incubare 4 μg di OKT.3 per 1 x 10 6 AML MNCs per 30 minuti a temperatura ambiente prima di lavare le cellule in PBS. Se necessario, criopreservi i MNC in FBS con 10% DMSO a 2 x 10 8 cellule per ml.
- Preparare culture hMSC (coltura media 1) e EC (culture medium 2). Plate hMSC cellule (vedi tabella dei materiali ) su flasks di coltura di cellule regolari nel mezzo hMSC. Plate ECs (vedi tabella dei materiali ) sulle superfici rivestite con collagene 1 nella media CE.
- Al 85-90% di confluenza cellulare rimuovere il mezzo, lavare due volte con PBS e aggiungere la soluzione di trysina-EDTA (20 μL per cm 2 ).
- Dopo 5 minuti, controllare che le celle siano staccate. Recuperare le celle diluendo 1:3 con mezzo di coltura cellulare. Centrifugare a 300 xg per 5 min e ri-sospendere nel medesimo corrispondente per ogni tipo di cellula e contare le cellule utilizzando una camera Neubauer.
- Utilizzare le cellule a 2 x 10 giugno - 10 luglio cellule per mL. Se entrambi i tipi di celle devono essere utilizzati insieme, mescolare le sospensioni hMSC e EC in un rapporto 1: 1.
- Trasferire la sospensione cellulare in una siringa per insulina.
- Utilizzando un bisturi, tagliare la scaffold iniziale (20 mm x 60 mm x 7 mm) della spugna sterilizzata di gelatina ( es. Gelfoam) in 24 pezzi di dimensioni simili (6,6 mm x 7,5 mm x 7 mm, figura 1A e B ).
- Ricostituire gli scaffolds di gelatina per immersione in PBS (5 min).
- Uno per uno, mettere delicatamente i ponteggi su un tessuto sterile per rimuovere l'eccesso di PBS. Trasferire le impalcature ad un pozzetto di una piastra da 24 pozzetti (superficie ultra-bassa allegato) e usare la siringa per iniettare 50 ml contenenti 10 5 - 10 6 cellule (hMSC alUno o in combinazione con hEC; Figura 1C ).
- Ripetere il passo 1.7 con ogni impalcatura fino a quando tutti i ponteggi richiesti vengono seminati con le cellule stromali.
- Incubare per 1 h all'interno di un incubatore di coltura cellulare (37 ° C e CO 2 5%).
- Riempire ogni pozzetto con 3 ml di mezzo di coltura cellulare 1 ( figura 1D ) e restituire gli scaffolds ad un incubatore di colture di cellule (37 ° C e CO 2 5%) per l'incubazione di notte. Utilizzare il mezzo di coltura delle cellule 2 se si usano gli ECs negli scaffolds.
- Scongelare CB-MNC e isolare le loro cellule CD34 + seguendo un appropriato protocollo del kit di sezione CD34 + . Sospendere le celle CD34 + selezionate nel mezzo 3 e conteggiarle in una camera Neubauer.
NOTA: Qui le cellule sono state utilizzate ad una concentrazione di 2 x 10 6 cellule per ml.- Se si utilizzano campioni primari derivati dal paziente AML, scongelare le cellule, diluirle 1:10 in FBS, centrifugarle per 5 min a 300xg, risospendere le cellule in PBS-2% FBS, aggiungere CD3 anticorpo anti-umano (di 2 - 4 g per 10 6 cellule), e incubare a temperatura ambiente per 30 min. Centrifugare per 5 min a 300 xg e risospendere in mezzo di cellule ematopoietiche integrato con citochine (20 ng / mL fattore stimolante della colonia granulocitaria (G-CSF), 20 ng / mL IL-3 e 20 ng / mL trombopoietina (TPO) .
- Ripetere i punti 1.7 - 1.9, ma in questo caso sementi 1 x 10 5 cellule ematopoietiche umane invece di componenti stromali, come sopra.
- Riempire il pozzetto con 3 ml di terreno di coltura 3 ( figura 1D ) e restituire gli scaffolds ad un incubatore di coltura di cellule (37 ° C e CO 2 5%) per incubazione per overnight. Utilizzare un mescolamento 1: 1 di supporti di coltura delle cellule 2 e 3 Se ECs sono utilizzati negli scaffolds.
- Solo per i basamenti portanti morfogenetici delle proteine-2 (rhBMP-2) dell'osso umano ricombinante, mettiamo delicatamente gli scaffali uno per uno su un tessuto sterile per rimuovere l'eccesso di PBS. Trasferire i ponteggi a un pozzetto di una piastra a 96 pozzetti ( figura 1E ) e aggiungere 5 μl di rhBMP-2, coprendo accuratamente l'impalcatura.
- Aggiungere 20 μl di trombina seguita da 20 μL di fibrinogeno, coprendo accuratamente l'impalcatura ogni volta ( Figura 1F ). Ripetere la procedura per ogni impalcatura fino a quando tutti i pontili richiesti vengono trattati e quindi incubare per 5-10 minuti a 37 ° C. Controllare se la coagulazione è stata formata correttamente.
2. Impianto chirurgico di impalcature biotecnologiche
NOTA: Qui sono stati utilizzati sia maschi che femmine, topi NSG da 6 a 12 settimane. Poiché gli animali sono immunodeficienti, tutte le procedure devono essere eseguite in condizioni sterili. Le fasi 2.10 - 2.13 sono correlate alle strategie di sopravvivenza e alle cure post-chirurgiche.
- 60 - 120 minuti prima della chirurgia, somministrare sottocutanea il farmaco del dolore (carprofen, 5 mg / kg di peso corporeo / mouse).
- Indurre l'anestesia in una camera con 0,5% isoflurano e 2 L / min O 2 . I topi dovrebbero essere monitorati continuamente durante la procedura. Trasferisci l'animale all'area chirurgica in posizione predestinata per avere un accesso facile alla schiena. Conservare l'animale sotto anestesia utilizzando un cono a naso che fornisce 1,5% isoflurano e 2 L / min O 2 . Tenere il mouse sotto anestesia durante la procedura chirurgica e controllare frequentemente lo stato animale.
- Mentre è sotto anestesia, utilizzare un gel oftalmico sugli occhi del topo per prevenire la secchezza e mantenere il topo a 37 ° C.
- Rasare l'area chirurgica sul retro del mouse usando un trimmer elettrico. Per sterilizzare la pelle, immergere una punta di cotone in clorexidina diluita (diluito 1:10 in PBS) e utilizzare questa punta per pulire la superficie della pelle. Ripetere due volte questa procedura.
- Utilizzando pinze sterili e bisturi (o forbici), eseguire una incisione anteriore-posteriore da 0,5 a 0,7 cm dalla pelle. Utilizzare la pinza inseritaSotto il tessuto sottocutaneo per fare una tasca.
- Inserire il ponteggio sottocutanea, assicurandosi che sia posizionato all'interno della tasca ( Figura 1G e H ). Chiudere l'incisione con colla chirurgica ( Figura 1I e J ).
- Per il trattamento del dolore post-chirurgico, somministrare sottocutanea buprenorfina (0,1 mg / kg di peso corporeo).
- Durante il recupero, posizionare l'animale al suo fianco in una gabbia pre-riscaldata e monitorare il recupero fino al comportamento normale.
- Diluire il farmaco del dolore in acqua (carprofen, 0,1 mg / ml d'acqua) e fornire agli animali come acqua potabile per 4 giorni dopo l'intervento chirurgico.
- Controllare frequentemente l'animale e la ferita durante il periodo post-operatorio a 48 ore per eventuali effetti negativi.
3. Trattamenti del mouse, eutanasia e recupero di campioni per l'imaging
NOTA: L'analisi degli scaffold è eseguita tra8 e 24 settimane dopo l'impianto.
- 60 minuti prima dell'immagine, mantenere il topo implantato caldo in una scatola di riscaldamento a 37 ° C e somministrare per via intramuscolare 100 μL di immunoglobulina umana per bloccare siti non specificati.
- 30 minuti prima dell'immagine, somministrare per via endovenosa 10 μg (per mouse) di anticorpi specifici per etichettare le cellule di interesse.
- 5 minuti prima dell'immagine, somministrare per via endovenosa 15 μL (diluito in 100 μl di PBS) di 655-nm fluoroforo-etichettato, agente di pooling del vascello (655-VPA) per visualizzare strutture vascolari.
- Eutanizzare il mouse attraverso la dislocazione cervicale.
- Utilizzando forbici affilate, eseguire un'incisione della pelle longitudinale sulla parte posteriore del mouse, vicino al sito di impianto originale.
- Con l'aiuto di pinzette e forbici, separare la pelle dalla tasca sottocutanea dove è stato impiantato il ponteggio.
- Tenere il ponteggio con le pinzette e estrarlo delicatamente dalla pelle tagliando la membrana residua aTessuto che circonda lo scaffale con forbici. Vedere gli esempi di scaffold da recuperare in Figura 2 .
- Fissare il ponteggio con colla adesiva ad azione rapida a una piastra di imaging (un piatto da 35 mm x 10 mm Petri) e riempire con soluzione salina (PBS) a temperatura ambiente.
- Per i ponteggi BMP, prima di riempire la piastra con PBS, utilizzare un microdrillo chirurgico per sottile la superficie ossea sotto un microscopio microchirurgico; Questo consente la visualizzazione di fluoroforo e la cattura di immagini ad alta risoluzione. Utilizzare le bave da 1,2 o 1,6 mm, a seconda della dimensione dello scaffold.
NOTA: L'utente si renderà conto di quanto si deve eseguire in funzione dello spessore dell'osso. In generale, poiché i basamenti BMP sono vascolarizzati, l'osso cambia leggermente il colore e diventa più rosso quando si avvicina allo spessore corretto per l'imaging. - Inserire la piastra sullo stadio del microscopio confocale.
4. Live-Imaging utilizzando microscopio a due fotoniopy
NOTA: quando si utilizzano rivelatori non descritti (NDD), utilizzare sempre il cursore NDD per l'imaging per dirigere la fluorescenza all'IDD. La configurazione del microscopio è fornita in Figura 3 .
- Accendere il microscopio e il computer, avviare il software facendo clic su "Avvia sistema" e passare alla modalità "Acquisizione".
- Seleziona la casella "Mostra strumenti manuali". Nel menu "Laser" passare "acceso" il laser a due fotoni e lasciarlo riscaldarsi e stabilizzarlo.
- Nel menu "Imaging Setup", attivare contemporaneamente "Channel Mode" e "Switch track every Frame". Nel menu "Percorso leggero", selezionare "Non disciolto" "e" Allineatore principale principale MBS 760+ ". Selezionare per attivare i quattro NDD e impostare la configurazione come illustrato in Figura 3 .
NOTA: con questa configurazione, il segnale di collagene dalle strutture ossee (secOnd generazione armonica, SHG) viene raccolta a 380 - 485 nm, cellule endoteliali umane FITC-hCD31 + e cellule ematopoietiche umane AF488-hCD45 + a 500-550 nm e 655-VPA a 640-690 nm. - Nel menu "Canali", impostare la "lunghezza d'onda laser" a 890 nm e la potenza al 50%. Impostare "Gain (Master)" a 500-600, "Offset digitale" a 0 e "Gain digitale" a 15 per ogni canale. Regolare questi valori una volta che l'acquisizione è iniziata.
- In modalità "Acquisizione", impostare i parametri necessari per ottenere immagini ad alta risoluzione senza danneggiare il tessuto e sbiancare i fluorofori. Impostare "Modalità di scansione" su "Frame", "Frame Size" a "x512 y512," Line Step "a 1," Velocità "a 9," Numero di media "a 8," Profondità del bit " Modo "a" linea "," Direzione "a" bidirezionale "e" Metodo "per" significare ".
- Impostare "Zo"Om "a 1 per la scansione iniziale dell'immagine e aumentare se necessario per concentrarsi su particolari aree.
- Posizionare la lastra contenente l'impalcatura sullo stadio del microscopio sotto l'obiettivo di immersione ad acqua di 20X e 1,0 NA e abbassare l'obiettivo fino a toccare la soluzione salina. Impostare l'obiettivo dell'obiettivo sullo scaffold utilizzando gli oculari del microscopio, utilizzando una lampada come sorgente luminosa.
- Attivare il menu "Z-stack", selezionare la funzione "First / Last" e impostare l'intervallo desiderato tra due fette sub-sequenziali ( ad esempio, Z-stack da 2 μm). Tenere gli intervalli costanti all'interno dello stack Z.
- Selezionare "Live" per acquisire una scansione dal vivo del campione e regolare "Digital Gain" e "Offset digitale" per un'esposizione ottimale. Per visualizzare contemporaneamente più canali, seleziona la funzione "Split".
- Nel menu "Stage", mentre in modalità "Live", scansionate l'immagine e le regioni "Mark" di interEst (ROI), come la localizzazione delle cellule ematopoietiche umane e delle strutture vascolari. Quando la scansione del campione è completa, passare al primo ROI per avviare l'imaging.
- In modalità "Live", impostare la parte superiore e inferiore dello stack Z in 3D che circonda l'area di interesse utilizzando le funzioni "Impostare prima" e "Impostare ultimo". Una volta terminata, impostare il centro, "C." Avviare l'acquisizione del ROI con il pulsante "start experiment". Vedere esempi di immagini in Figura 4 , Figura 5 e Figura 6 .
- Una volta che l'acquisizione è completa, salvare l'immagine nella cartella designata. Passare al ROI successivo e ripetere il passaggio 4.10. Una volta completato l'esperimento, rimuovere la piastra di imaging dal microscopio, staccare attentamente il campione dalla piastra e pulire qualsiasi colla residua.
- Preparare il campione per la tecnica di analisi successiva.
5. Processin del campioneG per Istologia e Immunostaining
NOTA: i campioni vengono elaborati secondo il protocollo descritto nelle tecniche di laboratorio generali di JoVE 54 che descrivono i processi di fissazione, incorporazione e sezionamento dei campioni. I campioni di formazione delle ossa devono essere trattati per 7 giorni in un agente decalcificante basato su EDTA tra i processi di fissazione e di incorporazione. La soluzione di bloccaggio / permeabilizzazione è di 10 mM PBS pH 7,4 tampone con 1% Triton X-100, 1% albumina bovina serba (BSA) e 10% normale siero di capra (NGS).
- Mettere le fette in xilene per 10 min.), Xilene per 5 minuti, etanolo al 100% per 5 minuti, etanolo al 70% per 5 minuti, etanolo al 50% per 5 minuti e H 2 O per 5 minuti.
- Trasferire le fette in una soluzione di lavoro antigene a base di citrato.
- Fare bollire le fette per 15 minuti e lasciarli raffreddare a temperatura ambiente.
- Lavare le fette in soluzione 10 mM di PBS pH 7.4 con 1% di Triton X-100 (5 min, 3 volte).
- Trasferisci il samScorrere alla soluzione di bloccaggio / permeabilizzazione e incubare per 30 min.
- Aggiungere anticorpo primario diluito nella soluzione di blocco / permeabilizzazione e incubare per una notte a 4 ° C.
- Lavare le fette in soluzione 10 mM di PBS pH 7.4 con 1% di Triton X-100 (5 min, 3 volte).
- Aggiungere un anticorpo secondario diluito nella soluzione di blocco / permeabilizzazione per 1 h al buio a temperatura ambiente.
- Lavare con H 2 O (5 min, 3 volte).
- Per ridurre la fluorescenza di fondo, immergere le fette nella soluzione di lavoro nero Sudan per 10 minuti, al buio e a temperatura ambiente.
- Lavare le fette in H 2 O (5 min, 3 volte).
- Montare le fette usando un mezzo di montaggio fluorescente con DAPI (0,5 μg / mL).
- Conservare le fette a 4 ° C e verificare che il supporto di montaggio sia asciutto prima di condurre immagini a fluorescenza. Vedere immagini di esempio nella Figura 7 .
Risultati
Nella figura 1 sono mostrate immagini rappresentative dei processi di semilavorazione e di impianto di scaffold. Nella figura 1C , notare che le cellule vengono iniettate direttamente nel ponteggio. Nella figura 1G , notare che un'incisione è fatta nella parte posteriore del mouse, dove viene creata la tasca sottocutanea e viene impianto il ponteggio. La figura 2 mostra la morfologia lorda di diversi pontili impiantati in topi NSG e recuperati dopo 8 settimane. Si noti la leggera vascolarizzazione negli scaffold semplificati hMSC ( Figura 2A ). La co-radiante di ECs umane con gli hMSC nello scaffold consente la formazione di vasculature più rilevanti negli scaffolds ( Figura 2B ). Infine, la presenza di rhBMP-2 induce la formazione di ossa. Gli scaffoldi recuperati sono più grandi in questo caso e sono costituiti daTessuto duro, simile all'osso.
La Figura 3 mostra l'impostazione della configurazione del canale sul microscopio per l'imaging in tempo reale con NDD (dettagli nella leggenda della figura). La Figura 4 e il Video 1 mostrano le cellule ematopoietiche umane in strutture impregnate con hMSC. Gli scaffali sono stati esplorati 8 settimane dopo l'impianto e dopo l'inoculazione endovenosa di AF488-hCD45 e 655-VPA. Questa procedura consente la visualizzazione di cellule ematopoietiche umane impiantate e la struttura vascolare mediante microscopia confocale a due fotoni. In questo caso, le immagini mostrano vasi sanguigni (655-VPA) negli scaffolds e l'impegno a lungo termine di cellule ematopoietiche umane (AF488-hCD45) nel parenchima del ponteggio. La Figura 5 e il Video 2 corrispondono a impalcature umane seminate con hECs e hMSCs. 8 settimane dopo l'intervento chirurgico, le scaffolds sono state esplorate dopo l'intravenoInoculazione dell'anticorpo FITC-hCD31 e 655-VPA, e le immagini sono state acquisite con un microscopio confocale a due fotoni, come detto in precedenza. Le immagini mostrano la partecipazione di hECs alla formazione di navi nella scaffold, con conseguente vascolarizzazione chimerica murino-umana.
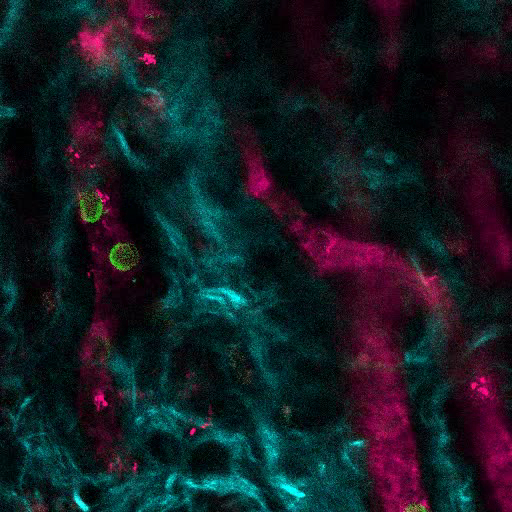
La figura 6A mostra i dati rappresentativi dell'approccio utilizzato per stimolare la formazione dell'osso negli scaffali MSC. Simile alle figure precedenti, 8 settimane dopo l'impianto, è stata eseguita l'inoculazione endovenosa di 655-VPA, sono stati recuperati scaffold e le immagini sono state acquisite con microscopia confocale a due fotoni. Gli scaffoldi stimolati da rhBMP-2 inducono la formazione di tessuti ossee che possono essere visualizzati a causa dello SHG (colore ciano nelle immagini) fornito dal calcio nell'osso. Le immagini fornite mostrano anche la formazione di cavità e tessuto endosteo vascolarizzato, che assomigliano molto al tessuto endosteo BM. Nella figura 6B e Video 3 , hECs sono stati co-impiantati con hMSCs. I ponteggi sono stati recuperati dopo l'inoculazione endovenosa dell'anticorpo FITC-hCD31 e 655-VPA e le immagini microscopiche confocalizzate a due fotoni mostrano la partecipazione di hECs alla neovascolarizzazione in un basamento formando osso.
La Figura 7 mostra immagini rappresentative dell'istologia, una procedura eseguita per corroborare i risultati precedentemente descritti. Le immagini immunofluorescenti mostrano vascolarizzazione del topo, hECs, hMSCs e cellule ematopoietiche umane tracciate a lungo termine nelle strutture dello scaffold. Gli scaffali recuperati dai topi sono stati fissati e utilizzati per l'immunofluorescenza. Nelle rastrelliere che formano ossa di rhBMP-2 ( figura 7D- F ), nota la morfologia del tessuto, somigliante al midollo osseo maturo con il tessuto adiposo. In questo scaffold che forma osso, mostriamo che hMSCs sono fibroblasti, che indicerebbero tCappello contribuiscono al tessuto appena formato come cellule stromali. Mostriamo anche l'espressione di marcatore adipocitario umano, che indica che hMSC contribuiscono anche alla formazione del tessuto adiposo.
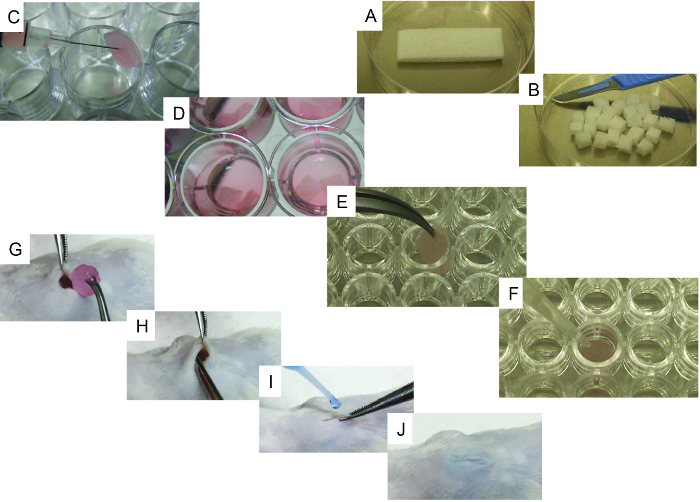
Figura 1. Immagini rappresentative dei processi di semina e di impianto. A) Struttura iniziale e il suo metodo di taglio con un bisturi. B) 24 pezzi ottenuti dallo scaffold iniziale. C) Metodo di coltivazione di celle di sasso utilizzando una siringa. D) Telai a base di cellule con supporto di coltura pronto per essere impiantato. EF) Fasi specifiche per i pontili per formare ossa: E) il ponteggio viene trasferito su una piastra a 96 pozzetti, in U e F) immagine rappresentativa del metodo utilizzato per aggiungere rhBMP2, trombina e fibrinogeno allo scaffold. GJ) Surgi G) ferita creata nell'impianto di pelle e impalcatura, H) metodo di impianto e IJ) procedura di chiusura della ferita con colla chirurgica. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2. Scaffolds diversi prelevati dai topi. Immagini rappresentative di ponteggi MSC (a sinistra), scaffolds MSC + EC (medio) e scaffolds MSC + EC + BMP (a destra). Clicca qui per visualizzare una versione più grande di questa figura.
4 / 55914fig3.jpg "/>
Figura 3. Configurazione del canale. Viene mostrata l'impostazione del filtro del microscopio. A) Esistono quattro moduli di rivelazione NDD: nel primo modulo ci sono due cubi di filtri; Il secondo e il terzo modulo hanno un cubo di filtro ciascuno; E l'ultimo modulo non ha cubo (non utilizzato). Il primo tubo fotomoltiplicatore (PMT) è per il canale lontano rosso (640 - 690 nm), riflettendo le lunghezze d'onda inferiori; I seguenti sono 380 - 485 nm, 500 - 550 nm e 555 - 625 nm (l'ordine è sempre dalle lunghezze d'onda più basse e più alte). B) Le emissioni di fluoroforo rilevabili con le configurazioni di cui sopra (colore codificato). Clicca qui per visualizzare una versione più grande di questa figura.
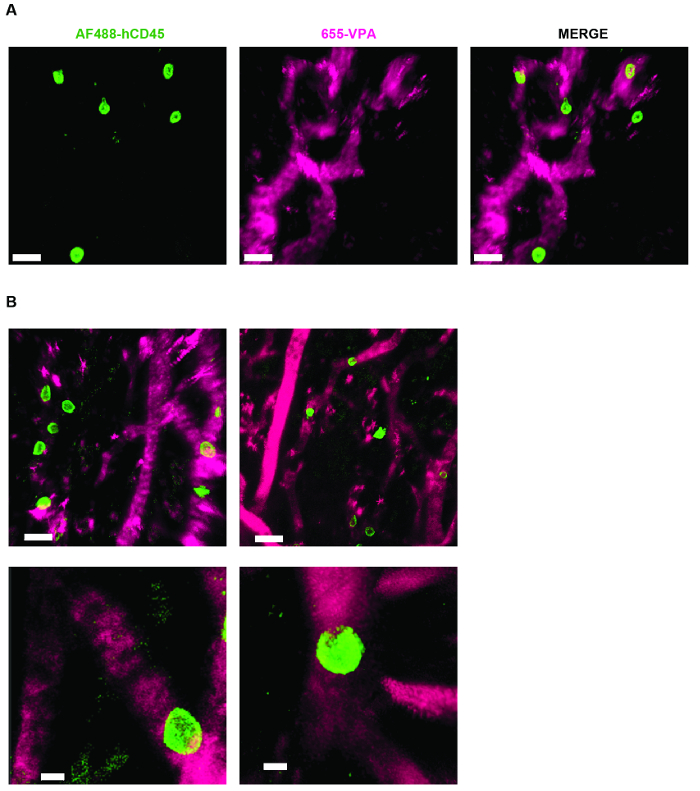
Figura 4. Impalcatura MSC S Permettere per la formazione di una nicchia per le cellule ematopoietiche umane. A) e B) ricostruzioni 3D di Z-stack prese dopo esplante, dopo inoculazione endovenosa con AF488-hCD45 (verde), per etichettare le cellule ematopoietiche umane e 655-VPA (magenta) m per etichettare la vascolarizzazione. Le barre di scala rappresentano 20 μm in A e B (pannelli superiori) e 5 μm in B (pannelli inferiori). Clicca qui per visualizzare una versione più grande di questa figura.
Video 1. Gli scaffali MSC consentono la formazione di una nicchia per le cellule ematopoietiche umane . Ricostruzione 3D di cellule ematopoietiche umane (AF488-hCD45) associate alla vasculatura (655-VPA) nello scaffold MSC (strutture collagene: SHG, cyan). Ogni stack misura 140 x 140 μm.Ef = "http://ecsource.jove.com/files/ftp_upload/55914/55914video1.mov" target = "_ blank"> Si prega di cliccare qui per visualizzare questo video. (Fare clic con il pulsante destro del mouse per scaricare.)
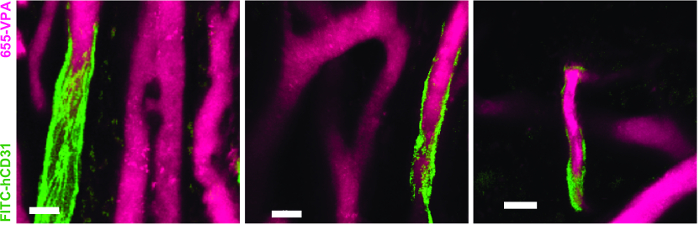
Figura 5. ECs umane partecipano alla formazione di navi humanizzate in ponteggi MSC. Ricostruzione 3D della vasculatura (655-VPA) fiancheggiata da EC di origine umana (FITC-hCD31) negli scaffold MSC + EC. Le barre di scala rappresentano 20 μm. Clicca qui per visualizzare una versione più grande di questa figura.
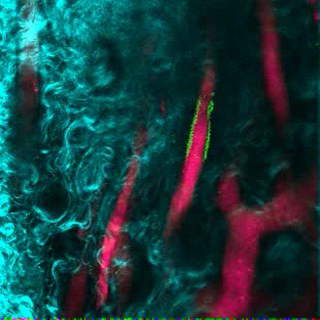
Video 2. ECs umane partecipano alla formazione di navi humanizzate in ponteggi MSC. Ricostruzione 3D di EC EC umane (FITC-hCD31) rivestimento della va Scultura (655-VPA) negli scaffold MSC + EC. Ogni stack misura 240 x 240 μm. Clicca qui per visualizzare questo video. (Fare clic con il pulsante destro del mouse per scaricare.)
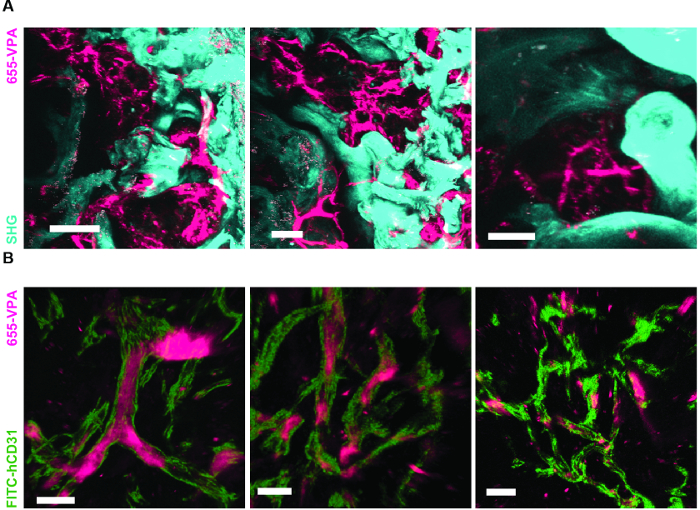
Figura 6. Gli impalcature portanti rhBMP-2 hanno superfici ossei e vasculature humanizzate simile al midollo osseo. A) Ricostruzione 3D di scaffolds MSC + BMP che mostrano la formazione di strutture ossee (SHG-cyan) e vasculature (655-VPA). Le barre di scala rappresentano 100 μm (a sinistra), 70 μm (medio) e 50 μm (a destra). B) Ricostruzione 3D di scaffold MSC + EC + BMP che mostrano vasi humanizzati (655-VPA) fiancheggiati da ECs umane (FITC-hCD31). Le barre di scala rappresentano 50 μm (a sinistra) e 30 μm (medio e destro).14 / 55914fig6large.jpg "target =" _ blank "> Fare clic qui per visualizzare una versione più grande di questa figura.
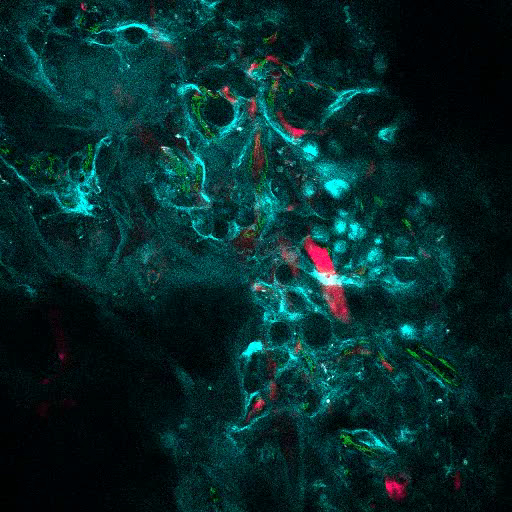
Video 3. I rulli di supporto rhBMP-2 hanno le superfici ossee e la vasculatura humanizzata simile al midollo osseo. Ricostruzione 3D di impalcature MSC + VERA + BMP (osso: SHG, vasi: 655-VPA, ECs umani: FITC-hCD31). Ogni stack misura 600 x 600 μm. Clicca qui per visualizzare questo video. (Fare clic con il pulsante destro del mouse per scaricare.)
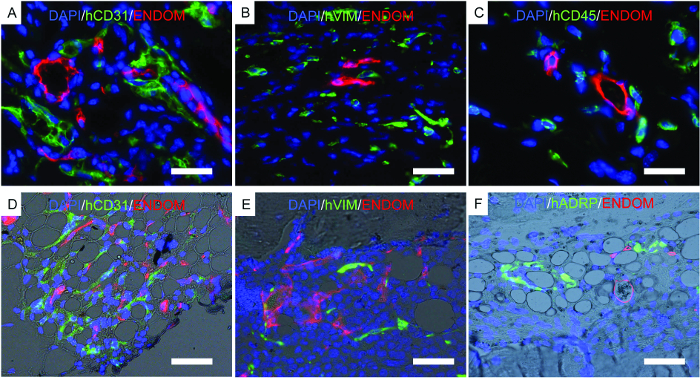
Figura 7. Immagini rappresentative dell'immunofluorescenza eseguite su ponteggi fissi. AF) Studi di immunofluorescenza eseguiti per individuare le cellule umane impiantate iN scaffolds. AC) Telai implantati con hECs, hMSCs e hHSCs. DF) Impastanti di forma ossea impiantati con hECs, hMSCs e hHSCs. I canali di colore sono i seguenti: AD) EC (hCD31) e struttura vascolare del mouse (endomucina, ENDOM), BE) hMSC (hVimentin, hVIM) e cellule vascolari del mouse (endomucina, ENDOM), C) cellule ematopoietiche umane (hCD45) E vascolarizzazione del mouse (endomucina, ENDOM) e F) proteina legata all'illuminazione adiposa umana (hADRP) e vasculatura del topo (endomucina, ENDOM). Le barre di scala rappresentano 10 μm (A e C), 20 μm (B e E) e 40 (D e F) μm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Significato nel rispetto dei metodi esistenti:
In questo protocollo abbiamo descritto un metodo per generare diversi microambienti umanizzati nei topi e per visualizzare la loro architettura mediante microscopia e istologia a due fotoni. I dati rappresentativi forniti mostrano la fattibilità dell'approccio, utilizzando diverse cellule stromali per ingegnare tessuti umanizzati. Il protocollo ha applicazioni specifiche per lo studio delle cellule ematopoietiche umane e delle cellule derivate da nicchie di midollo osseo in condizioni normali e patologiche. Queste applicazioni includono lo studio dell'evoluzione clonale, la screening di farmaci e la stretta interazione tra HSC umani e componenti stromali. Nel campo emergente dell'ingegneria tissutale sono stati proposti diversi approcci alternativi. Approcci di nota includono lo sviluppo di strutture BM umanizzate 3D in vitro 55 , 56 , 57 ,S = "xref"> 58 , 59 , 60 , 61 , 62 , 63 e l'innesto ortotopico di scaffold BM humanizzati nei topi 64 . Il nostro approccio ha il vantaggio di combinare sia la complessità del sistema in vivo con l'agevole accessibilità anatomica del graft di tessuti umani.
Modifiche e risoluzione dei problemi:
Una fonte di variabilità in questo protocollo può essere trovata nella selezione delle cellule utilizzate per seminare gli scaffolds. Nel nostro lavoro abbiamo utilizzato hMSC derivanti da BM. Tuttavia, le cellule mesenchimali possono essere ottenute da diversi tessuti, che possono mostrare proprietà distintive a seconda dell'origine. Pertanto, può essere considerato l'uso di hMSC derivato da diversi organi. Tuttavia, la loro capacità di formare tessuto osseo in vivo deve essere testata prima dell'uso in questo pQuesto protocollo utilizza una fonte di cellule endoteliali umane commercialmente disponibili ( ovvero HUVEC E4ORF1-transduced). Recentemente, l'uso di cellule endoteliali specifiche per organi per scopi diversi è stato riportato 65 , 66 . Inoltre, l'utilizzo di HEC primari derivati dalla BM potrebbe rappresentare un interessante miglioramento del protocollo. Pertanto, l'uso di differenti fonti di cellule endoteliali può produrre diversi risultati in vivo .
Abbiamo utilizzato topi riceventi immunocompromessi NSG per favorire l'impianto di scaffoldi umanizzati e per evitare il rigetto dei tessuti. Non escludiamo la possibilità di utilizzare questo protocollo per ingegnare tessuti di midollo osseo ectopici in altri ceppi del mouse. Infatti, rhBMP-2 può indurre la formazione di ossa in diversi modelli mammiferi 47 , 48 , 49 , 50 , 52 . Tuttavia, le differenze nella vitalità cellulare e nel trapianto a lungo termine saranno probabilmente osservate usando differenti ceppi / modelli.
La tempistica del recupero dello scaffale può anche essere flessibile, a seconda dello scopo finale dell'esperimento. Nel protocollo presentato, recuperiamo i campioni a 8 - 12 settimane dopo l'impianto per valutare l'assunzione ematopoietica a lungo termine. Per studiare i primi passi della formazione nicana del BM umano ( ad es., Formazione di tessuto osteocondrale 47 o sviluppo vascolare) possono essere scelti diversi punti temporali.
La tecnica live-imaging descritta in questo protocollo è indicata per l'imaging a breve termine di esplanti. L'uso di una camera equilibrata per mantenere la temperatura fisiologica, la tensione dell'ossigeno e la concentrazione di CO 2 dovrebbero essere considerati nei casi di imaging a lungo termine, come per studiare i comportamenti della motilità.
Critical StEps nel protocollo:
Tra le sfide legate al protocollo, mettiamo in evidenza le competenze tecniche necessarie per alcuni passaggi. Le cellule mesenchimali e endoteliali dovrebbero essere utilizzate a numeri di passaggio bassi; In caso contrario, non saranno in grado di sostenere in vivo l' assunzione di cellule ematopoietiche umane o di partecipare alla de novo vascolarizzazione e alla formazione dell'osso in vivo . Raccomandiamo l'utilizzo di hMSC e HECs nei passaggi da 1 a 5. La preparazione dello scaffale e le fasi di coltivazione delle cellule necessitano di conoscenze fondamentali sulla cultura cellulare e sulla conoscenza delle proprietà delle celle specifiche utilizzate nella procedura. Il protocollo chirurgico è abbastanza semplice ma richiede una certa pratica. La manutenzione di un ambiente asettico per evitare la contaminazione degli scaffold impiantati in topi immunodeficienti è fondamentale per garantire il successo dell'esperimento. L'esplante del campione e l'imaging in diretta richiedono la pratica chirurgica (specialmente per l'uso del microdrillo) e la conoscenza dellaMicroscopio. Infine, l'elaborazione del campione e l'istologia richiedono conoscenze di base delle tecniche da utilizzare.
Limitazioni della tecnica:
L'approccio descritto permette di visualizzare le cellule ematopoietiche umane vive che seminano un microambiente di midollo osseo umanizzato, con cellule endoteliali umane che creano strutture vascolari e cellule mesenchimali che creano spazio osseo / midollo osseo. Poiché il tessuto è formato in vivo , l'impalcatura finale progettata sarà ancora chimerica (umana e murina). Questo problema dovrebbe essere preso in considerazione, in quanto il tessuto chimico non può completamente imitare la complessità e l'ambiente del midollo osseo umano.
I ponteggi impiantati hanno una dimensione limitata (abbiamo provato un massimo di 6,6 x 7,5 x 7 mm) e quindi sono in grado di ospitare un numero limitato di cellule per xenotrapianto. Il numero assoluto di celle recuperate sarà anche limitato; Quindi, il numero di impalcature impiantate dovrebbeEssere calcolato in funzione del numero di celle richieste per l'esperimento.
L'applicazione di imaging descritta è particolarmente utile per osservare grandi aree di tessuto vivo a profondità di 150-200 μm dalla superficie senza interrompere l'architettura e danneggiare le cellule. Pertanto, non consente la visualizzazione di tutta l'impalcatura. Se è necessaria una completa scansione del tessuto, approcci standard di immunofluorescenza sarebbero più appropriati.
Applicazioni future:
La direzione futura di questo modello bioengineered sarebbe aumentare la complessità delle componenti umane nel tessuto. Le conoscenze e la caratterizzazione della nicchia umana del BM sono state avanzate negli ultimi anni 67 e il protocollo descritto potrebbe essere una piattaforma interessante per studiare la funzione di questi nuovi componenti cellulari e fattori solubili, nonché il loro ruolo nel sostegno di normali / maligniAnt HSCs.
Inoltre, la tecnica di imaging fornisce il potenziale per l'imaging intravitale degli scaffold in studi longitudinali, che richiederebbero miglioramenti tecnici nell'immagazzinamento dei ponteggi in topi vivi, anestetizzati, con recupero post-chirurgico. Questo approccio richiederebbe ulteriori passi ed è attualmente sotto inchiesta in laboratorio.
Divulgazioni
Gli autori non hanno niente da rivelare.
Riconoscimenti
Ringraziamo il personale delle strutture centrali dell'Istituto Francis Crick (Studio di Ricerca Biologica, In Vivo Imaging e Istopatologia Sperimentale) e Yolanda Saavedra-Torres e Mercedes Sanchez-Garzon, i veterinari di Crick e LRI rispettivamente per il loro prezioso aiuto. Siamo grati al Dr. W. Gray per aver letto in modo critico il manoscritto. DP è stato sostenuto da una borsa di ricerca non clinica dell'EHA. Questo lavoro è stato sostenuto da The Francis Crick Institute, che riceve il suo fondamento fondamentale da Cancer Research UK (FC001045), dal Regno Unito Medical Research Council (FC001045) e dalla Welcome Trust (FC001045).
Materiali
| Name | Company | Catalog Number | Comments |
| Ficoll-Paque | Ge Healthcare | 17-1440-03 | |
| Cd34 positive selection Kit | Stemcell | 18056 | Store a 4°C. |
| Magnet | Stemcell | 18000 | |
| Anti-human CD3 antibody, clone OKT-3 | Bioxcell | BE0001-2 | Store at 4°C. Used for T cell depletion in primary AML samples. |
| Cytokines (IL3, G-CSF, and TPO) | PeproTech | 200-03, 300-23 and 300-18 | For doing the stock: Dilute each one of the cytokines in 100 μL of water and mix them. Add 200 μL, do alicuots of 45 μL and Store at -20 °C. |
| DMSO | Sigma | D4540 | |
| FBS | Life technologies | 10270106 | Heat-inactivate at 56 °C during 30 min, do aliquots and freeze down. Warm in 37 °C water bath before use. |
| MEM-α | Invitrogen | 32571-028 | Store at 4 °C. Warm in 37 °C water bath before use. |
| Myelocult H5100 | corning | 5100 | Store at 4 °C. Warm in 37 °C water bath before use. |
| 199 | Gibco | 41150-020 | Store at 4 °C. Warm in 37 °C water bath before use. |
| hMSC-FBS, Heat-inactivated | Gibco | 12662-029 | Store at -20 °C. Warm in 37 °C water bath before use. |
| P/S | Sigma-Aldrich | P0781 | Store at -20 °C. Warm in 37 °C water bath before use. |
| ECGS | Millipore | 02-102 | Dilute in culture media and use 0.22 mm filter. |
| HEPES | Sigma-Aldrich | S1558-50ML | Store at 4 °C. |
| Heparin | Sigma-Aldrich | H3149 | Store at 4 °C. |
| Glutamine | Gibco | 25030 | Store at -20 °C. |
| Collagen 1 coated cell culture plate | corning | 354505 | |
| Trypsin-EDTA solution | Thermo-Fisher | 25200056 | Store at -20 °C. Warm in 37 °C water bath before use. |
| hMSC | Lonza | PT-2501 | Alternatively, hMSCs we also kindly provided by Dr. Dosquet (University Paris Diderot, Paris) from human bone marrow obtained during orthopaedic surgery under ethical approval 10-038 from IRB00006477. |
| VeraVec HUVEC endothelial cells | Angiocrine bioscience | hVera101 | Alternatively, other human endothelial cell source may be used. |
| Human hematopoietic cells | Umbilical Cord blood or primary Acute Myeloid Leukemia (AML) samples were obtained from the Royal London Hospital (London, UK) after informed consent and protocol of use was approved by the East London Ethical Committee and carried out in accordance with the Declaration of Helsinki. | ||
| Gelfoam, Size 12 - 7mm | Pfizer | 00009-0315-08 | Alternative supplier: Febelco |
| PBS | Thermo-Fisher | 10010023 | |
| Surgical material | Multiple | Sterile forceps, tweezers and sharp scissors. | |
| Sterile tissues | Heat-sterilize paper tissues. | ||
| 1 mL Syringe with needle of 25G | Terumo | SS+01H25161 | |
| Ultra Low Attachment Multiple Well Plates | Corning | 3473 or 3471 | |
| BMP2 | Noricum | rhBMP-2 | Dilute at 5 mg/mL in acetic acid 50 mM and store at 4 °C. |
| Thrombin | Sigma | T8885 | Dilute in CaCl2 2%, 500 mL per vial, and store at 4 °C. |
| Fibrinogen | Sigma | F3879 | Dilute at 4 mg/100 mL in PBS. Store at -20 °C. Warm before use. |
| Tissue-culture dishes 35 mm x 10 mm | Falcon | 353001 | |
| U-Botton 96 well plate | Falcon | 353077 | |
| NSG mice | The Jackson Laboratory | 5557 | NSG mice were a kind gift from Dr Leonard Shultz (The Jackson Laboratory). |
| Chlorhexidine | G9 | Dilute 1:10 before use | |
| Carprofen | Pfizer | Rimadyl | 5 mg/kg of mouse |
| Buprenorphine | Alstoe | Vetergesic | 0.1 mg/kg of mouse body weight |
| Isoflurane | Abbott | B506 | Induction of anaesthesia 2%, maintenance 1% |
| Trimmer | Wella | Contura HS61 | |
| Surgical glue | 3M | Vetbond | |
| carbomer (polyacrylic acid) as Ophthalmic gel | Novartis | Viscotears Liquid Gel | |
| Human Normal Immunoglobulin | Gammaplex | 10g vial | 100 mL/mouse intravenously, 30 min before infusion of specific antibody. |
| NT-QTracker | Invitrogen | Q21021MP | Vessel-pooling agent. Administrate 15 mL/mouse intravenously 5 min before imaging. |
| AF488-hCD45 | Biolegend | 304017 | 100 mL/mouse intravenously, 30 min before imaging. |
| FITC-hCD31 | BD Pharmigen | 555445 | 100 mL/mouse intravenously, 30 min before imaging. |
| Super glue | Loctite | Super Glue | |
| Micro-Drill Kit | IDEAL - Fisher Scientific | NC9010016 | |
| Microsurgical microscope | No specific brand/company is adviced. | ||
| LSM 710 NLO | Zeiss | Upright confocal microscope with motorized stage, two-photon laser and 20X 1.0 NA water immersion lens. Alternatively, a microscope with similar specifications could be used. | |
| MaiTai “High Performance” fully automated 1-box 517 mode-locked Ti:Sapphire laser with DeepSee dispersion compensation | Spectra-Physics | ||
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| Ethanol | Sigma-Aldrich | 32294 | |
| Osteosoft | Millipore | 1.01728.1000 | |
| Polysine slices | Thermo scientific | J2800AMNZ | |
| Antigen unmasking solution | Vector | H-3300 | Store at 4 °C. Dilute 1:100 in H2O for working solution. |
| Triton 100x | Sigma-Aldrich | T9284 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A96470 | Store at 4 °C. |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | Store at 4 °C. |
| Endomucin Antibody | Santa Cruz | sc-65495 | Store at 4 °C. |
| hVimentin antibody | Santa Cruz | sc-6260 | Store at 4 °C. |
| hCD31 antibody | DAKO | M0823 | Store at 4 °C. |
| hCD45 antibody | DAKO | M0701 | Store at 4 °C. |
| ADRP (Perilipin2) | antibodies-online | ABIN283918 | Store at 4 °C. |
| Goat anti mouse secondary antibodies | Invitrogen | A11029 or A11005 | Store at 4 °C. |
| Goat anti Rabbit secondary antibodies | Invitrogen | A11037 or A11008 | Store at 4 °C. |
| Goat anti Rat secondary antibodies | Invitrogen | A11007 or A21247 | Store at 4 °C. |
| Sudan Black | Sigma | S2380 | Prepare a stock of 1% sudan black in ethanol 70%. Store at RT. Prepare working solution of 0.1% sudan black in ethanol 70% and filter using filter-paper before use. |
| DAPI | Sigma | D8417 | Prepare stock in H20 at 100 mg/mg. Store at 4 °C. |
| Fluorescent mounting media | Dako | S3023 | Add DAPI before use (1:400 from DAPI stock). |
| Cover glass | VWR | 631-0147 |
Riferimenti
- Hoggatt, J., Kfoury, Y., Scadden, D. T. Hematopoietic Stem Cell Niche in Health and Disease. Annu Rev Pathol. 11, 555-581 (2016).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Zhang, B., et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 21 (4), 577-592 (2012).
- Schepers, K., et al. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cell. 13 (3), 285-299 (2013).
- Krause, D. S., et al. Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med. 19 (11), 1513-1517 (2013).
- Mendez-Ferrer, S., Scadden, D. T., Sanchez-Aguilera, A. Bone marrow stem cells: current and emerging concepts. Ann N Y Acad Sci. 1335, 32-44 (2015).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Ding, L., Morrison, S. J. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 495 (7440), 231-235 (2013).
- Kunisaki, Y., et al. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. 502 (7473), 637-643 (2013).
- Pinho, S., et al. PDGFRalpha and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J Exp Med. 210 (7), 1351-1367 (2013).
- Mizoguchi, T., et al. Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development. Dev Cell. 29 (3), 340-349 (2014).
- Zhou, P., Wang, Y., Li, D., Hu, S. Y., Chen, G. H. Therapeutic efficacy of mixed hematopoietic stem cell transplantation for pediatric hematologic diseases. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 22 (2), 434-439 (2014).
- Sugiyama, T., Kohara, H., Noda, M., Nagasawa, T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity. 25 (6), 977-988 (2006).
- Tzeng, Y. S., et al. Loss of Cxcl12/Sdf-1 in adult mice decreases the quiescent state of hematopoietic stem/progenitor cells and alters the pattern of hematopoietic regeneration after myelosuppression. Blood. 117 (2), 429-439 (2011).
- Pearce, D. J., et al. AML engraftment in the NOD/SCID assay reflects the outcome of AML: implications for our understanding of the heterogeneity of AML. Blood. 107 (3), 1166-1173 (2006).
- Sanchez, P. V., et al. A robust xenotransplantation model for acute myeloid leukemia. Leukemia. 23 (11), 2109-2117 (2009).
- Uzan, B., et al. Interleukin-18 produced by bone marrow-derived stromal cells supports T-cell acute leukaemia progression. EMBO Mol Med. 6 (6), 821-834 (2014).
- Foster, K., et al. Different Motile Behaviors of Human Hematopoietic Stem versus Progenitor Cells at the Osteoblastic Niche. Stem Cell Reports. 5 (5), 690-701 (2015).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Holzapfel, B. M., Wagner, F., Thibaudeau, L., Levesque, J. P., Hutmacher, D. W. Concise review: humanized models of tumor immunology in the 21st century: convergence of cancer research and tissue engineering. Stem Cells. 33 (6), 1696-1704 (2015).
- Scotti, C., et al. Engineering of a functional bone organ through endochondral ossification. Proc Natl Acad Sci USA. 110 (10), 3997-4002 (2013).
- Scotti, C., et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci USA. 107 (16), 7251-7256 (2010).
- Kuznetsov, S. A., et al. Single-colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res. 12 (9), 1335-1347 (1997).
- Bianco, P., Robey, P. G. Skeletal stem cells. Development. 142 (6), 1023-1027 (2015).
- Vaiselbuh, S. R., Edelman, M., Lipton, J. M., Liu, J. M. Ectopic human mesenchymal stem cell-coated scaffolds in NOD/SCID mice: an in vivo model of the leukemia niche. Tissue Eng Part C Methods. 16 (6), 1523-1531 (2010).
- Groen, R. W., et al. Reconstructing the human hematopoietic niche in immunodeficient mice: opportunities for studying primary multiple myeloma. Blood. 120 (3), e9-e16 (2012).
- Chen, Y., et al. Human extramedullary bone marrow in mice: a novel in vivo model of genetically controlled hematopoietic microenvironment. Blood. 119 (21), 4971-4980 (2012).
- Reinisch, A., et al. A humanized bone marrow ossicle xenotransplantation model enables improved engraftment of healthy and leukemic human hematopoietic cells. Nat Med. 22 (7), 812-821 (2016).
- Sontakke, P., et al. Modeling BCR-ABL and MLL-AF9 leukemia in a human bone marrow-like scaffold-based xenograft model. Leukemia. 30 (10), 2064-2073 (2016).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Antonelli, A., et al. Establishing human leukemia xenograft mouse models by implanting human bone marrow-like scaffold-based niches. Blood. 128 (25), 2949-2959 (2016).
- Holzapfel, B. M., et al. Tissue engineered humanized bone supports human hematopoiesis in vivo. Biomaterials. 61, 103-114 (2015).
- Reinisch, A., et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation. Blood. 125 (2), 249-260 (2015).
- Lee, J., et al. Implantable microenvironments to attract hematopoietic stem/cancer cells. Proc Natl Acad Sci USA. 109 (48), 19638-19643 (2012).
- Lee, J., Heckl, D., Parekkadan, B. Multiple genetically engineered humanized microenvironments in a single mouse. Biomater Res. 20 (19), 1-13 (2016).
- Ho, M. S., Medcalf, R. L., Livesey, S. A., Traianedes, K. The dynamics of adult haematopoiesis in the bone and bone marrow environment. Br J Haematol. 170 (4), 472-486 (2015).
- Bersani, F., et al. Bioengineered implantable scaffolds as a tool to study stromal-derived factors in metastatic cancer models. Cancer Res. 74 (24), 7229-7238 (2014).
- Thibaudeau, L., et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies. Cancer Metastasis Rev. 33 (2-3), 721-735 (2014).
- Holzapfel, B. M., et al. Species-specific homing mechanisms of human prostate cancer metastasis in tissue engineered bone. Biomaterials. 35 (13), 4108-4115 (2014).
- Thibaudeau, L., Holzapfel, B. M., Hutmacher, D. W. Humanized mice models for primary bone tumor and bone metastasis research. Cell Cycle. 14 (14), 2191-2192 (2015).
- Thibaudeau, L., et al. A tissue-engineered humanized xenograft model of human breast cancer metastasis to bone. Dis Model Mech. 7 (2), 299-309 (2014).
- Abarrategi, A., Foster, K., Hamilton, A., Mian, S., Passaro, D., Gribben, J., Mufti, G., Bonnet, D. Versatile humanized niche model enables study of normal and malignant human hematopoiesis. J Clin Invest. 127 (2), (2017).
- Abarrategi, A., et al. In vivo ectopic implantation model to assess human mesenchymal progenitor cell potential. Stem Cell Rev. 9 (6), 833-846 (2013).
- Rubio, R., et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells. 32 (5), 1136-1148 (2014).
- Abarrategi, A., et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomaterials. 29 (1), 94-102 (2008).
- Abarrategi, A., et al. Gene expression profile on chitosan/rhBMP-2 films: A novel osteoinductive coating for implantable materials. Acta Biomater. 5 (7), 2633-2646 (2009).
- Abarrategi, A., et al. Biological properties of solid free form designed ceramic scaffolds with BMP-2: in vitro and in vivo evaluation. PLoS One. 7 (3), e34117(2012).
- Abarrategi, A., et al. Chitosan scaffolds for osteochondral tissue regeneration. J Biomed Mater Res A. 95 (4), 1132-1141 (2010).
- Abarrategi, A., et al. Improvement of porous beta-TCP scaffolds with rhBMP-2 chitosan carrier film for bone tissue application. Tissue Eng Part A. 14 (8), 1305-1319 (2008).
- Prasain, N., Meador, J. L., Yoder, M. C. Phenotypic and functional characterization of endothelial colony forming cells derived from human umbilical cord blood. J Vis Exp. (62), (2012).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. J Vis Exp. , (2016).
- Hong, J. K., Yun, J., Kim, H., Kwon, S. Three-dimensional culture of mesenchymal stem cells. Tissue Eng Regen Med. 12 (4), 211-221 (2015).
- Bara, J. J., et al. Three-dimensional culture and characterization of mononuclear cells from human bone marrow. Cytotherapy. 17 (4), 458-472 (2015).
- Dong, H. W., Qin, S., Rafailovich, M., Ma, Y. Developing an Optimal Biofunctional Scaffold for Hematopoietic Stem Cell Quiescent Maintenance and Expansion. N Am J Med Sci. 8 (2), (2015).
- Raic, A., Rodling, L., Kalbacher, H., Lee-Thedieck, C. Biomimetic macroporous PEG hydrogels as 3D scaffolds for the multiplication of human hematopoietic stem and progenitor cells. Biomaterials. 35 (3), 929-940 (2014).
- Miyoshi, H., Morita, M., Ohshima, N., Sato, C. Expansion of mouse hematopoietic progenitor cells in three-dimensional cocultures on frozen-thawed stromal cell layers formed within porous scaffolds. Exp Hematol. 43 (2), 115-124 (2015).
- Cuddihy, M. J., Wang, Y., Machi, C., Bahng, J. H., Kotov, N. A. Replication of bone marrow differentiation niche: comparative evaluation of different three-dimensional matrices. Small. 9 (7), 1008-1015 (2013).
- Sharma, M. B., Limaye, L. S., Kale, V. P. Mimicking the functional hematopoietic stem cell niche in vitro: recapitulation of marrow physiology by hydrogel-based three-dimensional cultures of mesenchymal stromal cells. Haematologica. 97 (5), 651-660 (2012).
- Leisten, I., et al. 3D co-culture of hematopoietic stem and progenitor cells and mesenchymal stem cells in collagen scaffolds as a model of the hematopoietic niche. Biomaterials. 33 (6), 1736-1747 (2012).
- Ferreira, M. S., et al. Cord blood-hematopoietic stem cell expansion in 3D fibrin scaffolds with stromal support. Biomaterials. 33 (29), 6987-6997 (2012).
- Baldwin, J. G., et al. Periosteum tissue engineering in an orthotopic in vivo platform. Biomaterials. 121, 193-204 (2017).
- Rafii, S., Butler, J. M., Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature. 529 (7586), 316-325 (2016).
- Seandel, M., et al. Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene. Proc Natl Acad Sci USA. 105 (49), 19288-19293 (2008).
- Medyouf, H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications. Blood. 129 (12), 1617-1626 (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon