Method Article
마우스의 인간 골수 미세 환경의 생체 공학 및 실시간 영상화에 의한 시각화
요약
생쥐에서 다른 인간화 된 골수 틈새를 만들고 살아있는 방법이 제시됩니다. human mesenchymal cells에 의해 만들어지는지지 적 틈새를 기반으로, 인간 내피 세포의 첨가는 인간 혈관의 형성을 유도하는 반면, rhBMP-2의 첨가는 인간 - 마우스 키메라 성숙한 뼈 조직의 형성을 유도한다.
초록
인간 조혈 줄기 세포 (HSC)는 골수 (BM) 틈새에 존재하며, 골수 (cytokines), 성장 인자 및 세포 외 기질을 생산하는 복잡한 요소입니다. HSC가 정지 상태, 자체 갱신 또는 분화 상태를 유지하고 돌연변이를 획득하고 악성이 될 수있는 능력은 다른 간질 성분으로 확립 된 복잡한 상호 작용에 달려 있습니다. 생리 학적 및 병리학 적 조건에서 사람의 HSC와 사람의 BM 틈새 사이의 누화를 관찰하기 위해 우리는 면역 결핍 마우스에서 인간의 BM 틈새를 대칭 적으로 모델링하고 이미지화하기위한 프로토콜을 설계했습니다. 우리는 다른 세포 구성 요소의 사용이 인간화 된 구조의 형성과 장기적인 인간 조혈 생존을 유지할 수있는 기회를 제공한다는 것을 보여줍니다. 2 광자 현미경을 사용하여 인간 BM의 기능적 특성 분석을위한 강력하고 새로운 도구를 제공하여 단일 셀 분해능 으로 현장 에서 이러한 구조 를 실시간으로 이미지화 할 수 있습니다미세 환경과 정상 및 악성 조혈 조절에있어 그 역할.
서문
줄기 세포 구획에서 관찰 된 세포 운명 결정은 내재적 요인과 외인성 요인 모두에 의해 엄격히 규제됩니다. 특히, 지금은 널리 BM 미세 환경이 자신의 자기 갱신 또는 분화의 운명 결정 (1)에서뿐만 아니라, 활성 상태로 대기에서 조혈 모세포의 스위치를 제어에 근본적인 역할을 인정 받고 있습니다. 또한 최근 연구 결과에 따르면 혈액 학적 악성 종양이 BM 미세 환경의 기능에 영향을 미치므로 두 구획 2 , 3 , 4 , 5 , 6 사이의 활성 크로스 토크가 있음을 나타냅니다. 최근의 진보에도 불구하고 특정 BM 틈새 요소의 활동이 HSC 행동 및 악성 형질 전환에 어떻게 기여하는지에 대한 많은 주요 질문이 남아 있습니다.
BM의 미세 환경은 고도로 헤테로이다. 다양하고 다양한 세포 유형의 풍부하고 복잡한 혼합물. 각 세포는 특수 기능을 갖추고 있습니다. 풍부한 내피 (EC)와 혈관 성분은 영양소와 대사 산물의 회전율, BM으로 들어가고 나오는 다른 세포의 유입과 유출, 그리고 몇몇 HSC 기능을 조절합니다 7 , 8 . 간세포 간질 세포 (MSCs)는 세 가지 다른 계통 ( 즉, 골 형성, 연골 형성, 지방 형성)을 통해 이루어진 미분의 줄기 세포와 전구 세포의 이종 집단으로, BM 틈새의 또 다른 기본 요소이다. 이 MSCs는 BM의 중앙 영역과 골밀도 영역에 근접하여 위치합니다. 혈관 구조와 관련이있을 수 있으며 HSC 기능의 조절에 관여합니다 9 , 10 , 11 , 12 , 13 ,"14 , 15 .
많은보고에 의하면 HSC는 골수 내 다양한 부위에 존재하며 그 기능은 정확한 국소화에 달려 있다고합니다. HSCs와 BM 미세 환경과의 상호 작용에 관한 현재 지식의 대부분은 쥐 연구 1 에서 파생됩니다. 이종 이식 모델의 사용은 인간의 정상 및 악성 HSC에 대한 지식을 확장시켜 면역 결핍 성 마우스의 BM 생쥐 16 , 17 , 18 , 19 , 20 에 이식했습니다. 이것이 유효한 모델이지만, 인간 마우스의 HSC 유도 및 생식 또는 종간 장벽과 세포 - 세포 상호 작용에 대한 잘 알려지지 않은 영향을 고려하여 대부분의 경우 수령 마우스를 컨디셔닝해야 할 필요성과 같은 많은 과제를 여전히 나타냅니다. 기능.
중화 항체와 유전자 변형 마우스의 사용은 이종 이식과 함께 인간의 조혈 줄기 세포가 그들의 미세 환경으로 확립하는 복잡한 대화를 강조하는데 중요하다. intravital 2 광자 공 촛점 현미경의 도입과 개발은 이러한 연구를 한 단계 발전시켜 골수 19 , 20 , 21 , 22 의 직접, 고해상도 및 동적 이미징을 가능하게하고 기능적으로 강력한 도구를 제공합니다 BM 미세 환경의 특성 및 HSC 기능 조절에 미치는 역할 고전적 이종 이식 모델에서 발생하는 문제의 일부를 회피하기 위해 인간화 된 BM 구조를 조작하는 개념이 전면에 제기되었습니다. 생체 적합 물질과 세포 이식 개념의 융합으로 인간의 뼈를 모방하는 가능성이 나타났다.heterotopic 지역에서 화살표 microenvironment 23 , 24 , 25 , 26 , 27 . 이는 조혈 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 종양 및 전이 40, 41, 42, 인간의 정상 및 악성 연구를 마우스 모델에서 생체 공학의 사용 가능성을 연다 , 43 , 44 .
뼈 조직 공학 및 생체 내 이미징에 이전 경험을 바탕으로 19 , 22 , 45 , 46 , 47 , 48 , 49 , 50 , 51 , 52 , 우리는 생체 공학 및 라이브 이미지 organotypic 인간의 BM 조직 프로토콜을 설명합니다. 이러한 구조는 인간의 BM 유래 간질 세포를 면역 결핍 마우스에 피하 이식 된 콜라겐 기반 인공 지지체에 이식 한 것에서 유래한다. 이전 보고서에서, 우리는 인간 중간 엽 줄기 세포는 인간의 조혈 세포 (45)의 생착에 적합한 인간 미세 환경의 형성을 보장 있음을 보여 주었다. 또한, 여기에 다른 인간 BM 세포 성분의 동시 주입 (co-implantation)인간 내피 세포 (hEC) 및 / 또는 뼈 형성에 중요한 사이토 카인 ( 예 : hBMP2)은 hMSC와 협력하여 현장에서 라이브 이미지 로 만들 수있는 다양한 인간화 미세 환경을 생성합니다.
프로토콜
모든 동물 실험은 UK Home Office가 승인하고 Cancer Research UK 지침에 따라 PPL 70/8904 하에서 수행되었습니다. 인간 탯줄 혈액 (UCB)과 초기 인간 급성 골수성 백혈병 (AML) 샘플의 사용은 동의를받은 후 동 런던 윤리위원회의 승인을 얻었으며 헬싱키 선언에 따라 수행되었습니다.
1. 인간 조혈 세포와 간질 세포를 가진 생물 공학 콜라겐 기반 비계
참고 : 전체 프로토콜은 멸균 상태와 멸균 물질로 수행해야합니다. 세포 배양 배지 1은 hMSC 배지 (MEM-α, P / S 및 10 % hMSC-FBS)에 상응한다. 세포 배양 배지 2는 EC 배지 (M199, 20 % FBS, P / S, 10mM HEPES, 50㎍ / mL 헤파린, 2mM 글루타민 및 50㎍ / mL ECGS)에 대응하고, 배양 배지 3은 조혈 세포 배지 (H5100 및 P / S).
- 제대혈 준비 m(CB-MNCs) 또는 1 차 AML (골수 또는 말초 혈 MNCs)을 Ficoll-Paque 밀도 구배를 사용하여 잘 확립 된 프로토콜 53
- AML의 경우 OKT.3 항체를 사용하여 T 세포를 고갈시킵니다. PBS에서 세포를 씻기 전에 실온에서 30 분 동안 1 X 10 6 AML 다국적 기업에 대한 OKT.3 4 μg을 품어. 필요한 경우, 용액에 2 × 108 세포에 10 % FBS와 함께 DMSO에 다국적를 cryopreserve.
- hMSC (배양 배지 1) 및 EC (배양 배지 2) 세포 배양 물을 준비하십시오. hMSC 배지의 일반 세포 배양 플라스크상의 플레이트 hMSC 세포 ( 재료 표 참조). EC 매체의 콜라겐 1 코팅 표면에 대한 플레이트 EC ( 재료 표 참조).
- 85 %에서 90 % 세포의 합류에, 배지를 제거 PBS로 두 번 세척하고, 트립신 EDTA 용액 (2 cm 당 20 μL)을 추가한다.
- 5 분 후 세포가 분리되었는지 확인하십시오. 1 :3 세포 배양 배지. 5 분 300 XG에서 원심 분리기 및 각 세포 유형에 해당하는 매체에 다시 일시 중지하고 Neubauer 챔버를 사용하여 셀을 계산합니다.
- mL 당 2 x 10 6 - 10 7 세포에서 세포를 사용하십시오. 두 세포 유형을 함께 사용해야하는 경우 hMSC 및 EC 현탁액을 1 : 1 비율로 섞으십시오.
- 세포 현탁액을 인슐린 주사기로 옮깁니다.
- 메스를 사용하여 멸균 된 젤라틴 스폰지 ( 예 : gelfoam) 초기 발판 (20mm x 60mm x 7mm)을 유사한 크기 (6.6mm x 7.5mm x 7mm, 그림 1A 및 B )의 24 개로 자릅니다.
- PBS (5 분)에 침지하여 젤라틴 발판을 재구성.
- 하나씩, 부드럽게 여분의 PBS를 제거하기 위해 살균 조직에 비계를 넣어. 스캐 폴드를 24 잘 접시 (초저 첨부 표면)의 한 우물에 전송하고 주사기를 사용하여 10 5 - 10 6 세포를 포함하는 50 μL를 주사 (hMSC 알하나 또는 hEC와의 조합; 도 1c ).
- 필요한 모든 발판에 stromal 세포가 뿌려 질 때까지 각 발판으로 1.7 단계를 반복합니다.
- 세포 배양 배양기 (37 ° C와 CO 2 5 %)에서 1 시간 동안 품어 낸다.
- 각각의 우물을 3 mL의 세포 배양 배지 1 ( 그림 1D )로 채우고 배양 배양기 (37 ° C 및 CO 2 5 %)로 배양액을 하룻밤 배양합니다. EC가 비계에 사용되는 경우 세포 배양 배지 2를 사용하십시오.
- CB-MNC를 해동하고 적절한 CD34 + 섹션 키트 프로토콜에 따라 CD34 + 세포를 분리하십시오. 선택한 CD34 + 세포를 3 번 매체에 일시 중지하고 Neubauer 챔버에서 센다.
참고 : 여기서 세포는 mL 당 2 x 106 세포의 농도로 사용되었습니다.- AML 환자 유래 1 차 샘플을 사용하는 경우 세포를 해동하고 FBS에서 1:10으로 희석하고 300에서 5 분간 원심 분리한다PBS로 2 % FBS에 세포를 resuspend, 안티 - 인간 CD3 항체 (10 6 세포 당 2 - 4 μg)를 추가하고, 30 분 실온에서 품어. 300 xg에서 5 분간 원심 분리하고 cytokines (20 NG / ML granulocyte - 콜로니 자극 인자 (G - CSF), 20 NG / ML IL - 3, 20 ng / ML thrombopoietin (TPO)) 보충 조혈 세포 배지에 resuspend .
- 위의 1.7 - 1.9 단계를 반복하지만,이 경우에는 간질 성분 대신 인간의 조혈 세포 1 x 10 5 개를 시드하십시오.
- 하룻밤 배양을위한 세포 배양 배지 3 ( 그림 1D ) 3 ML과 세포 배양 배양기 (37 ° C와 CO 2 5 %)로 비계를 반환로 우물을 채우십시오. EC가 스캐 폴드에 사용되는 경우 세포 배양 배지 2와 3의 1 : 1 혼합을 사용하십시오.
- 재조합 인간 뼈 형태 형성 단백질 -2 (rhBMP-2) 운반체 비계에 대해서만 과도한 P를 제거하기 위해 멸균 조직에 비계를 하나씩 부드럽게 넣습니다BS. 스캐 폴드를 U - 바닥, 96 - 웰 플레이트 ( 그림 1E ) 중 하나의 우물로 옮기고 발판을 완전히 덮는 rhBMP-2 5 μL를 첨가하십시오.
- 20 μL의 트롬빈과 20 μL의 피브리노겐을 첨가하고 매회 스캐 폴드를 덮으십시오 ( 그림 1F ). 필요한 모든 비계가 처리 될 때까지 각 비계에 대해 절차를 반복 한 다음 37 ° C에서 5 ~ 10 분 동안 배양하십시오. 응고가 성공적으로 이루어 졌는지 확인하십시오.
2. 생물 공학 스캐 폴드의 외과 적 이식
참고 : 여기에는 남성 또는 여성, 6-12 주된 NSG 생쥐가 사용되었습니다. 동물은 면역 결핍 상태이므로 모든 절차는 무균 상태에서 수행해야합니다. 단계 2.10 - 2.13은 생존 전략 및 수술 후 치료와 관련이 있습니다.
- 수술 60 - 120 분 전에 통증 약물 (carprofen, 5 mg / kg bodyweight / mouse)을 피하 투여.
- 0.5 % isoflurane과 2 L / min O 2 가있는 챔버에서 마취를 유도하십시오. 수술 중 마우스를 지속적으로 모니터링해야합니다. 뒤쪽에 쉽게 접근 할 수 있도록 동물을 외과 수술 부위로 옮깁니다. 1.5 % isoflurane과 2 L / min O 2를 공급하는 코 콘을 사용하여 마취하에 동물을 유지하십시오. 수술 과정에서 마우스를 마취 상태로 유지하고 동물 상태를 자주 확인하십시오.
- 그것이 마취하에있는 동안 마우스 눈에 안과 젤을 사용하여 건조를 방지하고 마우스를 37 ° C에 유지하십시오.
- 전기 트리머를 사용하여 마우스 뒤쪽의 수술 부위를 면도하십시오. 피부를 멸균하려면, 희석 된 clorexidine (PBS로 1:10으로 희석)에 면봉을 담그고이 팁을 사용하여 피부 표면을 닦으십시오. 이 절차를 두 번 반복하십시오.
- 살균 포셉과 메스 (또는 가위)를 사용하여 0.5 - 0.7cm 전후 피부의 완전 절개를하십시오. 삽입 된 집게를 사용하십시오.피하 조직 아래서 주머니를 만든다.
- 스캐 폴드를 피하에 삽입하고 포켓 안에 깊숙히 위치 시키십시오 ( 그림 1G 및 H ). 외과 용 접착제로 절개를 닫으십시오 ( 그림 1I 및 J ).
- 수술 후 통증을 치료하기 위해 buprenorphine (0.1 mg / kg bodyweight)을 피하 투여하십시오.
- 회복 중에는 동물을 옆으로 눕혀 예열 된 케이지에 놓고 정상적인 행동이 관찰 될 때까지 회복을 모니터하십시오.
- 진통제를 물 (carprofen, 0.1 mg / mL 물)에 희석하여 수술 후 4 일 동안 동물에게 식수로 제공하십시오.
- 가능한 불리한 영향에 대해 수술 후 48 시간 동안 동물과 상처를 자주 확인하십시오.
3. 마우스 트리트먼트, 안락사 및 이미징을위한 샘플 검색
참고 : 스캐 폴드의 분석은이식 후 8 주 및 24 주.
- 이미징 전에 60 분, 이식 마우스를 37 ° C의 가열 상자에 따뜻하게 유지하고 비특이적 사이트를 차단하기 위해 100 μL의 인간 면역 글로불린을 정맥 주사하십시오.
- 촬영 30 분 전에 관심 세포를 표지하기 위해 특정 항체 10 μg (정맥 투여)을 정맥 주사하십시오.
- 영상 5 분 전에 혈관 구조를 시각화하기 위해 655-nm fluorophore로 표지 된 혈관 조영제 (655-VPA) 15 μL (PBS 100 μL로 희석)을 정맥 투여하십시오.
- 자궁 경관 탈구를 통해 마우스를 안락사하십시오.
- 날카로운 가위를 사용하여 원래의 이식 부위 근처에서 마우스 뒤쪽에 피부 절개를하십시오.
- 핀셋과 가위의 도움으로 조심스럽게 스카프드가 이식 된 피하 포켓에서 피부를 분리하십시오.
- 족집게를 족집게로 잡고 잔여 막을 절단하여 피부에서 부드럽게 체외로 제거하십시오.가위를 사용하여 비계를 둘러싼 조직. 그림 2 에서 복구 할 스캐 폴드 예제를 참조하십시오.
- 이미징 플레이트 (35mm x 10mm 페트리 접시)에 신속하게 작동 접착제 접착제로 발판을 고정하고 상온에서 식염수 (PBS)로 채 웁니다.
- BMP 인공 지지체의 경우, PBS로 플레이트를 채우기 전에 수술 용 마이크로 드릴을 사용하여 미세 수술 현미경으로 뼈 표면을 얇게 만듭니다. 이것은 fluorophore 시각화 및 고해상도 이미지 캡처를 허용합니다. 스캐 폴드의 크기에 따라 1.2 또는 1.6mm 버를 사용하십시오.
참고 : 사용자는 뼈의 두께에 따라 얼마나 드릴 드릴해야하는지 알 수 있습니다. 일반적으로 BMP 인공 지지체가 혈관이 형성되면서 뼈는 색이 약간 변하고 이미징을위한 정확한 두께에 가까워 질수록 더 붉은 색을 띠게됩니다. - 공 촛점 현미경의 무대에 플레이트를 삽입합니다.
4. 2 광자 현미경을 이용한 라이브 영상오피
참고 : NDD (non-descanned detector)를 사용할 때는 NDD 슬라이더를 사용하여 형광을 NDD로 유도합니다. 현미경 구성은 그림 3에 나와 있습니다.
- 현미경과 컴퓨터를 켜고 "Start System"을 클릭하여 소프트웨어를 시작한 다음 "Acquisition"모드로 이동하십시오.
- "수동 도구 표시"상자를 선택하십시오. "레이저"메뉴에서 2 광자 레이저를 켜고 따뜻하게하고 안정화시킵니다.
- "이미징 설정"메뉴에서 "채널 모드"와 "모든 프레임 추적 전환"을 동시에 활성화하십시오. "Light Path"메뉴에서 "Non Descanned"및 "Main Beam Splitter MBS 760+"을 선택하십시오. 네 개의 NDD를 활성화하고 그림 3 과 같이 구성을 설정하십시오.
참고 :이 구성을 사용하면 뼈 구조에서 콜라겐 신호 (초SHG)은 380-548 nm, FITC-hCD31 + 인간 내피 세포 및 AF488-hCD45 + 인간 조혈 세포에서 500-550 nm, 655-VPA는 640-690 nm에서 수집된다. - "채널"메뉴에서 "레이저 파장"을 890 nm로 설정하고 전원을 50 %로 설정하십시오. "Gain (Master)"을 500-600으로, "Digital Offset"을 0으로, "Digital Gain"을 각 채널에 대해 15로 설정하십시오. 획득이 시작되면이 값을 조정하십시오.
- "Acquisition Mode"에서 조직을 손상 시키거나 형광체를 표백하지 않고 고해상도 이미지를 얻기 위해 필요한 매개 변수를 설정하십시오. "Scan Mode"를 "Frame", "Frame Size"를 "x512 y512", Line Step "1", "Speed"를 9, "Averaging number"를 8, "Bit Depth"를 "8 Bit" 모드 "를"줄 ","방향 "을"양방향 "으로,"방법 "을"의미 "로 설정합니다.
- "Zo"설정이미지의 초기 스캔을 위해 "om"을 1로 설정하고, 필요하다면 특정 영역에 초점을 맞추기 위해 증가시킵니다.
- 20X, 1.0 NA 물 침지 렌즈 아래의 현미경 스테이지에 발판을 포함하는 플레이트를 놓고 식염수가 닿을 때까지 렌즈를 낮추십시오. 광원으로 램프를 사용하여 현미경 eyepieces를 사용하여 발판에 렌즈의 초점을 설정합니다.
- "Z- 스택"메뉴를 활성화하고 "처음 / 마지막"기능을 선택하고 두 개의 하위 순차 슬라이스 ( 예 : 2-μm Z 스택) 사이의 필요한 간격을 설정하십시오. 간격을 Z- 스택 내에서 일정하게 유지하십시오.
- "라이브"를 선택하여 샘플의 라이브 스캔 이미지를 만들고 최적의 노출을 위해 "디지털 게인"및 "디지털 오프셋"을 조정하십시오. 동시에 여러 채널을 시각화하려면 "Split"기능을 선택하십시오.
- "무대"메뉴에서 "라이브"모드에서 이미지를 스캔하고 중간의 "마크"영역(hematopoietic cells) 및 혈관 구조 (vascular structures)의 위치와 같은 (ROI) 추정치 (est)를 포함한다. 샘플 스캔이 완료되면 첫 번째 ROI로 이동하여 이미징을 시작합니다.
- "라이브"모드에서 "첫 번째 설정"및 "마지막 설정"기능을 사용하여 관심 영역을 둘러싼 3D Z 스택의 위아래를 설정합니다. 끝나면 센터 "C"를 설정하십시오. '실험 시작'버튼을 사용하여 ROI 획득을 시작하십시오. 그림 4 , 그림 5 및 그림 6 의 이미지 예제를 참조하십시오.
- 수집이 완료되면 지정된 폴더에 이미지를 저장하십시오. 다음 ROI로 이동하고 4.10 단계를 반복하십시오. 실험이 완료되면 현미경에서 이미징 플레이트를 제거하고 조심스럽게 플레이트에서 샘플을 분리하고 남아있는 접착제를 청소하십시오.
- 다음 분석 기법을위한 샘플을 준비하십시오.
5. 샘플 공정g 조직학 및 면역 염색
참고 : 시료는 시료 고정, 삽입 및 절단 과정을 설명하는 JoVE 일반 실험 기술 54에 설명 된 프로토콜에 따라 처리됩니다. 뼈 형성 시료는 고정 및 삽입 공정 사이에서 EDTA 기반 탈검제로 7 일 동안 처리해야합니다. 차단 / permeabilization 솔루션은 1 % 트리톤 X - 100, 1 % 소 혈청 알부민 (BSA), 10 % 일반 염소 혈청 (NGS)와 10 MM PBS pH 7.4 버퍼입니다.
- 5 분, 5 분, 50 % 에탄올 및 5 분 동안 H 2 O 5 분간, 70 % 에탄올에 대해 5 분, 100 % 에탄올)을 10 분 동안 크실렌 크실렌 조각을 넣어.
- 슬라이스를 작업 용액을 가리는 구연산염 기반 항원으로 옮깁니다.
- 슬라이스를 15 분 동안 삶아 실온으로 식힌다.
- 1 % 트리톤 X - 100 (5 분, 3 회)와 10 MM PBS 산도 7.4 솔루션에서 조각을 씻으십시오.
- 샘 전송차단 / permeabilization 솔루션 ples 및 30 분 품어.
- blocking / permeabilization 용액으로 희석 한 1 차 항체를 첨가하고 4 ° C에서 밤새 배양하십시오.
- 1 % 트리톤 X - 100 (5 분, 3 회)와 10 MM PBS 산도 7.4 솔루션에서 조각을 씻으십시오.
- 실온에서 어두운 곳에서 blocking / permeabilization solution으로 희석 한 2 차 항체를 1 시간 동안 첨가한다.
- H 2 O (5 분, 3 회)로 세척한다.
- 배경 형광을 줄이려면 어둠과 실내 온도에서 10 분간 수단 블랙 작동 용액에 조각을 담그십시오.
- H 2 O (5 분, 3 회)로 씻는다.
- DAPI (0.5 μg / ML)와 형광 장착 매체를 사용하여 조각을 탑재합니다.
- 4 ° C에 조각을 보관하고 형광 이미징을 수행하기 전에 장착 매체가 건조한 지 확인하십시오. 그림 7의 예제 이미지를 참조하십시오.
결과
그림 1 은 스캐 폴드 세포 파종 및 주입 과정의 대표적인 이미지를 보여줍니다. 그림 1C 에서 세포가 발판에 직접 주입됩니다. 그림 1G에서 , 마우스의 뒤쪽에 절개가 생겼고, 거기서 피하 포켓이 만들어지고 발판이 이식되었다는 것을 유의하십시오. 그림 2 는 NSG 마우스에 이식하고 8 주 후에 회수 한 서로 다른 발판의 총 형태를 보여줍니다. hMSC가 배양 된 인공 지지체 (scaffolds)에서 약간의 혈관 형성을 관찰하십시오 ( 그림 2A ). 비계에 hMSCs와 인간 ECs의 공동 시딩은 비계 ( 그림 2B )에서 더 관련성이 vasculature의 형성을 허용합니다. 마지막으로, rhBMP-2의 존재는 뼈 형성을 유도합니다. 검색된 스캐 폴드는이 경우 더 크며,뼈 - 닮은 경조직.
그림 3 은 NDD로 라이브 이미징을위한 현미경의 채널 구성 설정을 보여줍니다 (그림 범례의 세부 사항). 그림 4 와 비디오 1 은 hMSC 코팅 발판의 인간 조혈 세포를 보여줍니다. 인공 지지체는 이식 후 8 주 및 AF488-hCD45 항체 및 655-VPA의 정맥 내 접종 후 외식되었다. 이 절차는 2 광자 공 촛점 현미경으로 이식 된 인간 조혈 세포와 혈관 구조를 시각화합니다. 이 경우, 이미지는 발판에서 혈관 (655-VPA)을 보여 주며 발판 실질에서 인간 조혈 세포 (AF488-hCD45)의 장기적인 이식을 보여줍니다. 그림 5 와 비디오 2 는 hECs와 hMSCs가 뿌리 박힌 인간 발판에 해당합니다. 수술 8 주 후, 인공 고관절 전 치환술을 시행 하였다FITC-hCD31 항체와 655-VPA를 접종하고 이전에 언급 한 바와 같이 2 광자 공 촛점 현미경을 사용하여 영상을 얻었다. 이미지는 scaffold에서 혈관 형성에 hEC가 참여하여 murine-human chimeric vasculature가 생성되었음을 보여줍니다.
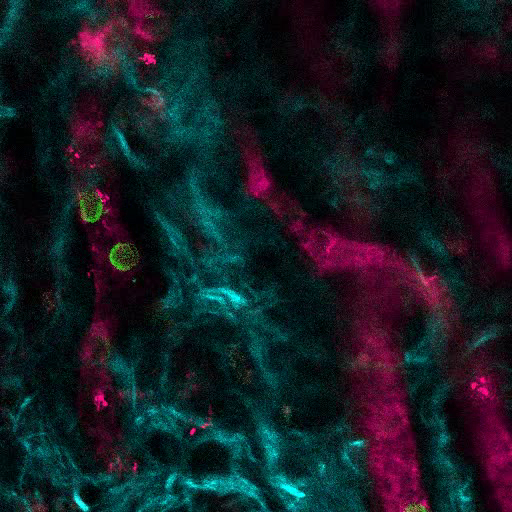
그림 6A 는 MSC 발판에서 뼈 형성을 자극하는 데 사용 된 접근의 대표적인 데이터를 보여줍니다. 이전의 수치와 유사하게, 이식 8 주 후에, 655-VPA의 정맥 접종이 수행되고, 스캐 폴드가 검색되고, 이미지가 2 광자 공 초점 현미경으로 획득되었다. rhBMP-2로 자극 된 인공 지지체는 뼈의 칼슘에 의해 제공되는 SHG (이미지의 청록 색)로 인해 시각화 될 수있는 뼈 조직의 형성을 유도합니다. 제공된 이미지는 또한 BM 내강 조직과 매우 흡사 한 충치 및 혈관 내 골밀도 조직을 보여줍니다. 도 6B 및 Video 3 에서 hECC를 hMSC와 함께 이식했습니다. 스캐 폴드는 FITC-hCD31 항체와 655-VPA의 정맥 내 접종 후 회수되었으며, 2 광자 공 초점 현미경 이미지는 뼈 형성 비계에서 신생 혈관 형성에 hECs의 참여를 보여준다.
그림 7 은 조직학의 대표 이미지, 이전에 설명한 결과를 뒷받침하기 위해 수행 된 절차를 보여줍니다. 면역 형광 이미지는 발판 구조에서 마우스 혈관계, hECs, hMSC 및 장기 이식 인간 조혈 세포를 보여줍니다. 생쥐에서 추출한 스캐 폴드를 고정하여 면역 형광 검사에 사용했습니다. rhBMP-2 운반체 뼈 형성 비계 ( 그림 7D - F )에서 지방 조직과 성숙한 골수와 닮은 조직의 형태를 주목하십시오. 이 뼈 형성 비계에서, 우리는 hMSC가 섬유 아세포 인 것을 보여 주며, 이는 t그들은 간질 세포로서 새로 형성된 조직에 기여한다. 우리는 또한 hMSCs가 또한 지방 조직 형성에 기여한다는 것을 나타내는 인간 지방 세포 마커 발현을 보여준다.
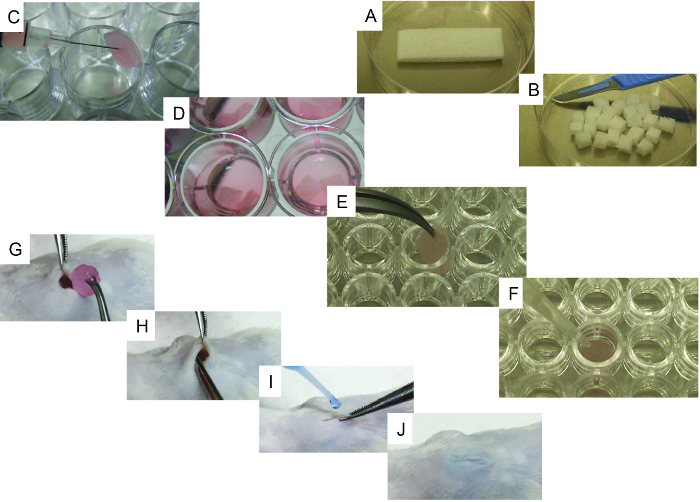
그림 1. 세포 파종 및 이식 과정의 대표 이미지. A) 초기 발판과 그 메스를 사용하여 절단 방법. B) 초기 발판에서 얻은 24 조각. C) 주사기를 이용한 스캐 폴드 세포 파종 방법. D) 배양 배지가있는 세포 배양 된 인공 지지대. EF) 뼈 형성 비계에 대한 특정 단계 : E) 비계가 96- 웰, U- 바닥 판으로 옮겨지고, F) rhBMP2, 트롬빈 및 피브리노겐을 비계에 첨가하는 방법의 대표 이미지. GJ) Surgi G) 피부 및 인공 지지체의 이식에서 생성 된 상처, H) 이식 방법, IJ) 외과 용 접착제를 이용한 상처 봉합 절차. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2. 마우스에서 가져온 다른 비계. MSC 발판 (왼쪽), MSC + EC 발판 (중간) 및 MSC + EC + BMP 발판 (오른쪽)의 대표 이미지. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4 / 55914fig3.jpg "/>
그림 3. 채널 구성. 현미경 필터 설정이 표시됩니다. A) 네 개의 NDD 검출기 모듈이 있습니다. 첫 번째 모듈에는 두 개의 필터 큐브가 있습니다. 제 2 및 제 3 모듈은 각각 하나의 필터 큐브를 가지며; 마지막 모듈에는 큐브가 없습니다 (사용되지 않음). 첫 번째 광전자 증 배관 (PMT)은 원적외선 채널 (640 ~ 690 nm) 용으로 낮은 파장을 반영합니다. 다음은 380 - 485 nm, 500 - 550 nm 및 555 - 625 nm입니다 (순서는 항상 낮은 파장에서 높은 파장까지입니다). B) 형광체 방출은 위의 구성 (색으로 구분됨)으로 감지 할 수 있습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
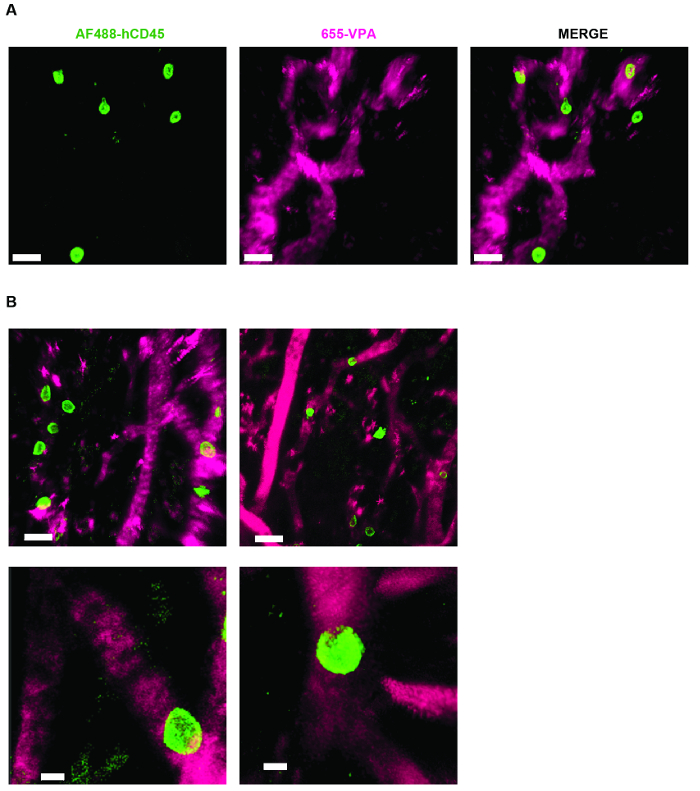
그림 4. MSC 스캐 폴드 인간 조혈 세포에 대한 틈새 형성을 허용한다. A) 및 B) 인간 조혈 세포를 표지하기 위해 AF488-hCD45 (녹색), 및 혈관계를 표지하기 위해 655-VPA (마젠타)를 정맥 내 접종 한 후, 이식 후 취한 Z- 스택의 3D 재구성. 스케일 바는 A와 B (상부 패널)에서 20 μm, B (하부 패널)에서 5 μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
비디오 1. MSC 스캐 폴드는 인간 조혈 세포를위한 틈새 형성을 가능하게합니다 . MSC 스캐 폴드 (콜라겐 구조 : SHG, 시안)에서 혈관 구조 (655-VPA)와 관련된 인간 조혈 세포 (AF488-hCD45)의 3D 재건. 각 스택은 140 x 140 μm 크기입니다.ef = "http://ecsource.jove.com/files/ftp_upload/55914/55914video1.mov"target = "_ blank">이 비디오를 보려면 여기를 클릭하십시오. (마우스 오른쪽 버튼을 클릭하여 다운로드하십시오.)
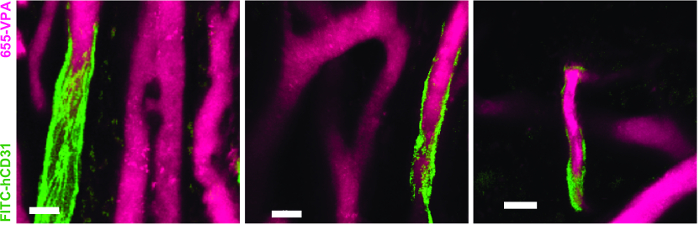
도표 5. 인간적인 EC는 MSC 비계에 인간화 한 배의 대형에 참가합니다. MSC + EC 비계에서 인간 기원의 EC (FITC-hCD31)가 줄 지어 서 혈관 구조 (655-VPA)의 3D 재건. 스케일 바는 20 μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
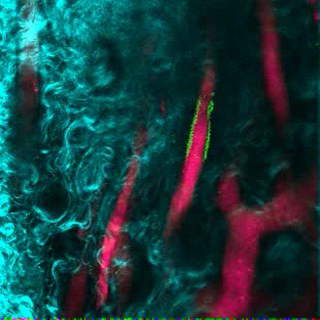
비디오 2. 인간 EC는 MSC 스캐 폴드에 인간화 된 혈관 형성에 참여합니다. 인간의 EC (FITC-hCD31)의 3D 재구성 Sculature (655-VPA)는 MSC + EC 비계에 존재한다. 각 스택은 240 x 240 μm 크기입니다. 이 비디오를 보려면 여기를 클릭하십시오. (마우스 오른쪽 버튼을 클릭하여 다운로드하십시오.)
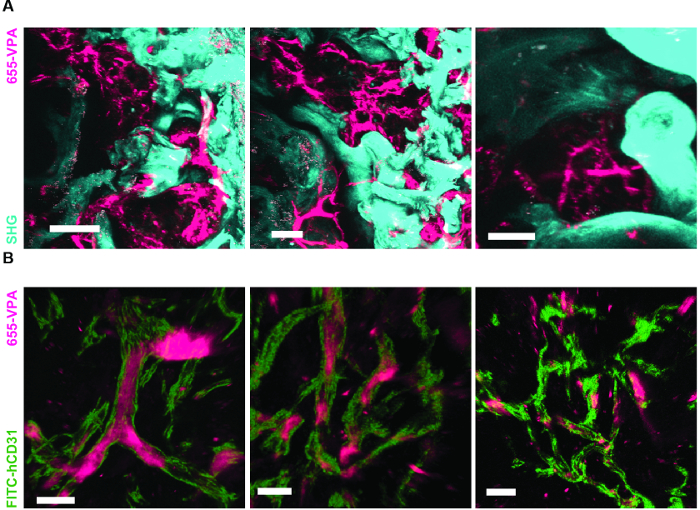
rhBMP-2 Carrier Scaffolds는 Bone Marrow와 유사한 Bone Surfaces와 Humanized Vasculature를 가지고 있습니다. A) 골 구조 (SHG - 시안)와 혈관 구조 (655 - VPA)의 형성을 보여주는 MSC + BMP 발판의 3D 재건. 스케일 막대는 100 μm (왼쪽), 70 μm (중간) 및 50 μm (오른쪽)를 나타냅니다. B) 인간 EC (FITC-hCD31)가 줄 지어있는 인간화 혈관 (655-VPA)을 보여주는 MSC + EC + BMP 지지체의 3D 재건. 스케일 바는 50 μm (왼쪽)와 30 μm (중간 및 오른쪽)를 나타냅니다.14 / 55914fig6large.jpg "target ="_ blank ">이 그림의 확대 버전을 보려면 여기를 클릭하십시오.
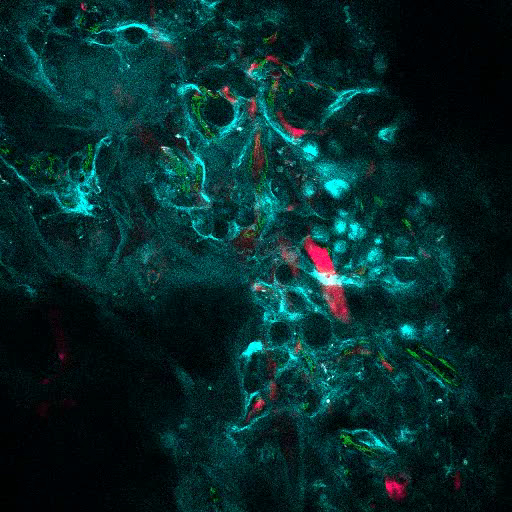
비디오 3. rhBMP-2 Carrier Scaffolds는 Bone Marrow와 유사한 Bone Surfaces와 Humanized Vasculature를 가지고 있습니다. MSC + VERA + BMP 스캐 폴드 (뼈 : SHG, 혈관 : 655-VPA, 인간 EC : FITC-hCD31)의 3D 재건. 각 스택은 600 x 600 μm를 측정합니다. 이 비디오를 보려면 여기를 클릭하십시오. (마우스 오른쪽 버튼을 클릭하여 다운로드하십시오.)
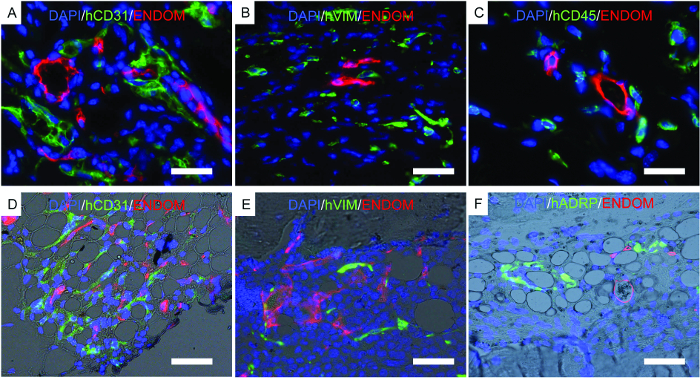
그림 7. 고정 된 비계에 수행 된 Immunofluorescence의 대표 이미지. AF) 이식 된 인간 세포를 찾기 위해 수행 된 면역 형광 연구n 발판. AC) hECs, hMSC 및 hHSC로 이식 된 지지대. DF) hECs, hMSC 및 hHSC로 이식 된 골 형성 비계. 다음 컬러 채널은 :) 중배엽 줄기 세포 (hVimentin, hVIM) 및 마우스의 혈관 세포 (endomucin, ENDOM), C) 인간 조혈 세포 AD) 인간 EC (hCD31) 및 마우스의 혈관 구조 (endomucin, ENDOM)는, BE (hCD45) 및 마우스 혈관 구조 (endomucin, ENDOM), F) 인간 지방 분화 관련 단백질 (hADRP) 및 마우스 혈관 구조 (endomucin, ENDOM)를 포함한다. 스케일 바는 10 μm (A와 C), 20 μm (B와 E), 40 (D와 F) μm를 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
기존 방법에 대한 의의 :
이 프로토콜에서는 마우스에서 다른 인간화 된 미세 환경을 생성하고 2 광자 현미경 및 조직학을 통해 구조를 시각화하는 방법을 설명했습니다. 제공된 대표 데이터는 인간화 된 조직을 조작하기 위해 다른 기질 세포를 사용하여 접근법의 실현 가능성을 보여줍니다. 프로토콜은 정상 및 병리학 조건에서 인간 조혈 세포 및 골수 틈새 파생 세포의 연구에 특정 응용 프로그램을 가지고 있습니다. 이러한 응용 프로그램에는 clonal 진화, 약물 스크리닝, 인간 HSC와 간질 구성 요소 간의 누화에 대한 연구가 포함됩니다. 신흥 조직 공학 분야에서 몇 가지 대안이 제안되었다. 주목해야 할 것은 in vitro에서 의 3D 인간화 된 BM 구조의 개발이다. 55 , 56 , 57 ,58 , 59 , 60 , 61 , 62 , 63 및 생쥐에서 인간화 된 BM 인공 지지체의 orthotopic 이식 64 . 우리의 접근 방식은 생체 내 시스템의 복잡성과 인간화 된 조직 이식편의 쉬운 해부학 적 접근성을 결합하는 이점이 있습니다.
수정 및 문제 해결 :
이 프로토콜의 가변성의 근원은 스캐 폴드를 시드하는 데 사용되는 세포의 선택에서 찾을 수 있습니다. 우리 연구에서 BM 유래 hMSCs를 사용했습니다. 그러나 간엽 세포는 여러 조직에서 얻을 수 있으며, 기원에 따라 특이한 성질을 나타낼 수 있습니다. 따라서 다른 기관에서 유래 된 hMSCs의 사용을 고려할 수 있습니다. 그러나, 생체 내에서 뼈 조직을 형성하는 능력은이 p에서 사용하기 전에 검사해야합니다이 프로토콜은 상업적으로 이용 가능한 인간 내피 세포 공급원 ( 즉, E4ORF1- 형질 전환 된 HUVEC)을 사용합니다. 최근, 다양한 목적으로 특정 기관의 내피 세포의 사용, (66) (65)에보고되었다. 또한, BM에서 유래 한 1 차 hECs의 사용은 프로토콜에 대한 흥미로운 개선을 나타낼 수있다. 따라서, 내피 세포의 상이한 공급원의 사용은 생체 내 결과가 상이 할 수있다.
우리는 인간화 된 인공 지지체의 이식을 선호하고 조직 거부를 피하기 위해 NSG 면역 저하 수용 마우스를 사용했다. 우리는 다른 마우스 변종에서 이소성 골수 조직을 조작하기 위해이 프로토콜을 사용할 가능성을 배제하지 않습니다. 실제로, rhBMP-2는 다른 포유류 모델 47 , 48 , 49 , 50 에서 골 형성을 유도 할 수있다 , 52 . 그러나 세포 생존력과 장기 이식의 차이는 다른 균주 / 모델을 사용하여 관찰 될 수 있습니다.
스캐 폴드 회복 시점은 실험의 최종 목적에 따라 유연 할 수 있습니다. 제시된 프로토콜에서 우리는 장기간 조혈 생장을 평가하기 위해 이식 후 8-12 주에 샘플을 회수합니다. 인간의 BM 틈새 형성 ( 예 : osteochondral tissue formation 47 또는 혈관 발달)의 초기 단계를 연구하기 위해 다른 시점을 선택할 수 있습니다.
우리가이 프로토콜에서 설명한 라이브 이미징 기술은 explants의 단기 이미징에 표시됩니다. 생리적 온도, 산소 장력 및 CO 2 농도를 유지하기위한 평형화 챔버의 사용은 운동 동작을 연구하기 위해 같은 장기 영상의 경우에 고려되어야한다.
크리티컬 스트리트프로토콜 내의 eps :
프로토콜과 관련된 과제 중 몇 가지 단계에 필요한 기술적 인 기술을 강조합니다. 중간 엽 줄기 세포와 내피 세포는 낮은 세포 수로 사용되어야한다. 그렇지 않으면 생체 내에서 인간 조혈 세포 이식을 지원하거나 생체 내 에서 신생 혈관 및 뼈 형성 에 참여할 수 없습니다. 인공 지지체 준비 및 세포 파종 단계는 기본적인 세포 배양 기술과 절차에 사용 된 특정 세포의 특성에 대한 지식이 필요합니다. 수술 프로토콜은 매우 간단하지만 연습이 필요합니다. 면역 결핍 마우스에서 이식 된 인공 지지체의 오염을 피하기 위해 무균 환경을 유지하는 것이 실험의 성공을 보장하는 데 중요합니다. 샘플 explant 및 라이브 이미징 수술 연습 (특히 microdrill의 사용)과 지식이 필요합니다현미경 시스템. 마지막으로, 표본 처리 및 조직학은 사용될 기술에 대한 기본 지식을 필요로합니다.
기술의 한계 :
우리가 기술 한 접근법은 사람의 내피 세포가 뼈 / 골수 공간을 형성하는 혈관 구조 및 중간 엽 세포를 형성하면서, 인간화 된 골수 미세 환경을 파종 한 살아있는 인간 조혈 세포의 시각화를 가능하게합니다. 조직이 생체 내 에서 형성됨 에 따라, 최종 조작 된 비계는 여전히 키메라 (인간 및 쥐) 일 것이다. 이 문제는 키메라 조직이 사람의 골수의 복잡성과 환경을 완전히 모방하지 않기 때문에 고려되어야합니다.
이식 된 지지대는 크기가 제한되어 있으므로 (최대 6.6 x 7.5 x 7 mm 시도) 이종 이식을 위해 제한된 수의 세포를 접종 할 수 있습니다. 회수 된 세포의 절대 개수도 제한됩니다. 따라서, 이식 된 인공 지지체의 수는실험에 필요한 세포 수의 함수로 계산됩니다.
우리가 묘사 한 영상 응용은 특히 건축물을 파괴하거나 세포를 손상시키지 않으면 서 150-200 μm의 깊이에서 살아있는 조직의 넓은 영역을 관찰하는데 유용합니다. 따라서, 그것은 전체 발판의 시각화를 허용하지 않습니다. 조직을 완전히 스캔해야한다면 표준적인 면역 형광법이 더 적절할 것입니다.
미래의 응용 분야 :
이 생체 공학 모델의 미래 방향은 조직에서 인체 구성 요소의 복잡성을 증가시키는 것입니다. 인간 BM 틈새의 지식과 특성은 최근 몇 년 동안 진행되어 왔고 , 기술 된 프로토콜은이 새로운 세포 구성 요소와 용해성 인자의 기능뿐만 아니라 정상 / 악성지지에 대한 역할을 연구하는 흥미로운 플랫폼이 될 수있다.개미 HSC.
또한, 이미징 기술은 수술 후 회복과 생체 마취 생쥐의 발판을 이미징에 기술적 개선을 필요로 종단 연구에서 발판의 intravital 이미징을위한 잠재력을 제공합니다. 이 접근법은 추가 단계가 필요하며 현재 실험실에서 조사 중입니다.
공개
저자는 공개 할 것이 없습니다.
감사의 말
귀중한 도움을 얻기 위해 Francis Crick Institute (생물학 연구 시설, 생체 내 이미징 및 실험 조직 병리학)의 핵심 시설 및 Yolanda Saavedra-Torres 및 Mercedes Sanchez-Garzon (Crick 및 LRI의 수의사)에게 감사드립니다. 비판적으로 원고를 읽으면서 Dr. W. Gray에게 감사드립니다. DP는 EHA의 비 임상 연구 펠로우쉽에 의해 지원되었다. 이 연구는 Cancer Research UK (FC001045), UK Medical Research Council (FC001045) 및 Welcome Trust (FC001045)의 핵심 기금을받는 Francis Crick Institute의 지원을 받았다.
자료
| Name | Company | Catalog Number | Comments |
| Ficoll-Paque | Ge Healthcare | 17-1440-03 | |
| Cd34 positive selection Kit | Stemcell | 18056 | Store a 4°C. |
| Magnet | Stemcell | 18000 | |
| Anti-human CD3 antibody, clone OKT-3 | Bioxcell | BE0001-2 | Store at 4°C. Used for T cell depletion in primary AML samples. |
| Cytokines (IL3, G-CSF, and TPO) | PeproTech | 200-03, 300-23 and 300-18 | For doing the stock: Dilute each one of the cytokines in 100 μL of water and mix them. Add 200 μL, do alicuots of 45 μL and Store at -20 °C. |
| DMSO | Sigma | D4540 | |
| FBS | Life technologies | 10270106 | Heat-inactivate at 56 °C during 30 min, do aliquots and freeze down. Warm in 37 °C water bath before use. |
| MEM-α | Invitrogen | 32571-028 | Store at 4 °C. Warm in 37 °C water bath before use. |
| Myelocult H5100 | corning | 5100 | Store at 4 °C. Warm in 37 °C water bath before use. |
| 199 | Gibco | 41150-020 | Store at 4 °C. Warm in 37 °C water bath before use. |
| hMSC-FBS, Heat-inactivated | Gibco | 12662-029 | Store at -20 °C. Warm in 37 °C water bath before use. |
| P/S | Sigma-Aldrich | P0781 | Store at -20 °C. Warm in 37 °C water bath before use. |
| ECGS | Millipore | 02-102 | Dilute in culture media and use 0.22 mm filter. |
| HEPES | Sigma-Aldrich | S1558-50ML | Store at 4 °C. |
| Heparin | Sigma-Aldrich | H3149 | Store at 4 °C. |
| Glutamine | Gibco | 25030 | Store at -20 °C. |
| Collagen 1 coated cell culture plate | corning | 354505 | |
| Trypsin-EDTA solution | Thermo-Fisher | 25200056 | Store at -20 °C. Warm in 37 °C water bath before use. |
| hMSC | Lonza | PT-2501 | Alternatively, hMSCs we also kindly provided by Dr. Dosquet (University Paris Diderot, Paris) from human bone marrow obtained during orthopaedic surgery under ethical approval 10-038 from IRB00006477. |
| VeraVec HUVEC endothelial cells | Angiocrine bioscience | hVera101 | Alternatively, other human endothelial cell source may be used. |
| Human hematopoietic cells | Umbilical Cord blood or primary Acute Myeloid Leukemia (AML) samples were obtained from the Royal London Hospital (London, UK) after informed consent and protocol of use was approved by the East London Ethical Committee and carried out in accordance with the Declaration of Helsinki. | ||
| Gelfoam, Size 12 - 7mm | Pfizer | 00009-0315-08 | Alternative supplier: Febelco |
| PBS | Thermo-Fisher | 10010023 | |
| Surgical material | Multiple | Sterile forceps, tweezers and sharp scissors. | |
| Sterile tissues | Heat-sterilize paper tissues. | ||
| 1 mL Syringe with needle of 25G | Terumo | SS+01H25161 | |
| Ultra Low Attachment Multiple Well Plates | Corning | 3473 or 3471 | |
| BMP2 | Noricum | rhBMP-2 | Dilute at 5 mg/mL in acetic acid 50 mM and store at 4 °C. |
| Thrombin | Sigma | T8885 | Dilute in CaCl2 2%, 500 mL per vial, and store at 4 °C. |
| Fibrinogen | Sigma | F3879 | Dilute at 4 mg/100 mL in PBS. Store at -20 °C. Warm before use. |
| Tissue-culture dishes 35 mm x 10 mm | Falcon | 353001 | |
| U-Botton 96 well plate | Falcon | 353077 | |
| NSG mice | The Jackson Laboratory | 5557 | NSG mice were a kind gift from Dr Leonard Shultz (The Jackson Laboratory). |
| Chlorhexidine | G9 | Dilute 1:10 before use | |
| Carprofen | Pfizer | Rimadyl | 5 mg/kg of mouse |
| Buprenorphine | Alstoe | Vetergesic | 0.1 mg/kg of mouse body weight |
| Isoflurane | Abbott | B506 | Induction of anaesthesia 2%, maintenance 1% |
| Trimmer | Wella | Contura HS61 | |
| Surgical glue | 3M | Vetbond | |
| carbomer (polyacrylic acid) as Ophthalmic gel | Novartis | Viscotears Liquid Gel | |
| Human Normal Immunoglobulin | Gammaplex | 10g vial | 100 mL/mouse intravenously, 30 min before infusion of specific antibody. |
| NT-QTracker | Invitrogen | Q21021MP | Vessel-pooling agent. Administrate 15 mL/mouse intravenously 5 min before imaging. |
| AF488-hCD45 | Biolegend | 304017 | 100 mL/mouse intravenously, 30 min before imaging. |
| FITC-hCD31 | BD Pharmigen | 555445 | 100 mL/mouse intravenously, 30 min before imaging. |
| Super glue | Loctite | Super Glue | |
| Micro-Drill Kit | IDEAL - Fisher Scientific | NC9010016 | |
| Microsurgical microscope | No specific brand/company is adviced. | ||
| LSM 710 NLO | Zeiss | Upright confocal microscope with motorized stage, two-photon laser and 20X 1.0 NA water immersion lens. Alternatively, a microscope with similar specifications could be used. | |
| MaiTai “High Performance” fully automated 1-box 517 mode-locked Ti:Sapphire laser with DeepSee dispersion compensation | Spectra-Physics | ||
| Formalin solution, neutral buffered, 10% | Sigma-Aldrich | HT501128 | |
| Ethanol | Sigma-Aldrich | 32294 | |
| Osteosoft | Millipore | 1.01728.1000 | |
| Polysine slices | Thermo scientific | J2800AMNZ | |
| Antigen unmasking solution | Vector | H-3300 | Store at 4 °C. Dilute 1:100 in H2O for working solution. |
| Triton 100x | Sigma-Aldrich | T9284 | |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A96470 | Store at 4 °C. |
| Normal Goat serum (NGS) | Sigma-Aldrich | G9023 | Store at 4 °C. |
| Endomucin Antibody | Santa Cruz | sc-65495 | Store at 4 °C. |
| hVimentin antibody | Santa Cruz | sc-6260 | Store at 4 °C. |
| hCD31 antibody | DAKO | M0823 | Store at 4 °C. |
| hCD45 antibody | DAKO | M0701 | Store at 4 °C. |
| ADRP (Perilipin2) | antibodies-online | ABIN283918 | Store at 4 °C. |
| Goat anti mouse secondary antibodies | Invitrogen | A11029 or A11005 | Store at 4 °C. |
| Goat anti Rabbit secondary antibodies | Invitrogen | A11037 or A11008 | Store at 4 °C. |
| Goat anti Rat secondary antibodies | Invitrogen | A11007 or A21247 | Store at 4 °C. |
| Sudan Black | Sigma | S2380 | Prepare a stock of 1% sudan black in ethanol 70%. Store at RT. Prepare working solution of 0.1% sudan black in ethanol 70% and filter using filter-paper before use. |
| DAPI | Sigma | D8417 | Prepare stock in H20 at 100 mg/mg. Store at 4 °C. |
| Fluorescent mounting media | Dako | S3023 | Add DAPI before use (1:400 from DAPI stock). |
| Cover glass | VWR | 631-0147 |
참고문헌
- Hoggatt, J., Kfoury, Y., Scadden, D. T. Hematopoietic Stem Cell Niche in Health and Disease. Annu Rev Pathol. 11, 555-581 (2016).
- Hanoun, M., et al. Acute myelogenous leukemia-induced sympathetic neuropathy promotes malignancy in an altered hematopoietic stem cell niche. Cell Stem Cell. 15 (3), 365-375 (2014).
- Frisch, B. J., et al. Functional inhibition of osteoblastic cells in an in vivo mouse model of myeloid leukemia. Blood. 119 (2), 540-550 (2012).
- Zhang, B., et al. Altered microenvironmental regulation of leukemic and normal stem cells in chronic myelogenous leukemia. Cancer Cell. 21 (4), 577-592 (2012).
- Schepers, K., et al. Myeloproliferative neoplasia remodels the endosteal bone marrow niche into a self-reinforcing leukemic niche. Cell Stem Cell. 13 (3), 285-299 (2013).
- Krause, D. S., et al. Differential regulation of myeloid leukemias by the bone marrow microenvironment. Nat Med. 19 (11), 1513-1517 (2013).
- Mendez-Ferrer, S., Scadden, D. T., Sanchez-Aguilera, A. Bone marrow stem cells: current and emerging concepts. Ann N Y Acad Sci. 1335, 32-44 (2015).
- Boulais, P. E., Frenette, P. S. Making sense of hematopoietic stem cell niches. Blood. 125 (17), 2621-2629 (2015).
- Ding, L., Morrison, S. J. Haematopoietic stem cells and early lymphoid progenitors occupy distinct bone marrow niches. Nature. 495 (7440), 231-235 (2013).
- Kunisaki, Y., et al. Arteriolar niches maintain haematopoietic stem cell quiescence. Nature. 502 (7473), 637-643 (2013).
- Pinho, S., et al. PDGFRalpha and CD51 mark human nestin+ sphere-forming mesenchymal stem cells capable of hematopoietic progenitor cell expansion. J Exp Med. 210 (7), 1351-1367 (2013).
- Mizoguchi, T., et al. Osterix marks distinct waves of primitive and definitive stromal progenitors during bone marrow development. Dev Cell. 29 (3), 340-349 (2014).
- Zhou, P., Wang, Y., Li, D., Hu, S. Y., Chen, G. H. Therapeutic efficacy of mixed hematopoietic stem cell transplantation for pediatric hematologic diseases. Zhongguo Shi Yan Xue Ye Xue Za Zhi. 22 (2), 434-439 (2014).
- Sugiyama, T., Kohara, H., Noda, M., Nagasawa, T. Maintenance of the hematopoietic stem cell pool by CXCL12-CXCR4 chemokine signaling in bone marrow stromal cell niches. Immunity. 25 (6), 977-988 (2006).
- Tzeng, Y. S., et al. Loss of Cxcl12/Sdf-1 in adult mice decreases the quiescent state of hematopoietic stem/progenitor cells and alters the pattern of hematopoietic regeneration after myelosuppression. Blood. 117 (2), 429-439 (2011).
- Pearce, D. J., et al. AML engraftment in the NOD/SCID assay reflects the outcome of AML: implications for our understanding of the heterogeneity of AML. Blood. 107 (3), 1166-1173 (2006).
- Sanchez, P. V., et al. A robust xenotransplantation model for acute myeloid leukemia. Leukemia. 23 (11), 2109-2117 (2009).
- Uzan, B., et al. Interleukin-18 produced by bone marrow-derived stromal cells supports T-cell acute leukaemia progression. EMBO Mol Med. 6 (6), 821-834 (2014).
- Foster, K., et al. Different Motile Behaviors of Human Hematopoietic Stem versus Progenitor Cells at the Osteoblastic Niche. Stem Cell Reports. 5 (5), 690-701 (2015).
- Hawkins, E. D., et al. T-cell acute leukaemia exhibits dynamic interactions with bone marrow microenvironments. Nature. 538 (7626), 518-522 (2016).
- Lo Celso, C., et al. Live-animal tracking of individual haematopoietic stem/progenitor cells in their niche. Nature. 457 (7225), 92-96 (2009).
- Lassailly, F., Foster, K., Lopez-Onieva, L., Currie, E., Bonnet, D. Multimodal imaging reveals structural and functional heterogeneity in different bone marrow compartments: functional implications on hematopoietic stem cells. Blood. 122 (10), 1730-1740 (2013).
- Holzapfel, B. M., Wagner, F., Thibaudeau, L., Levesque, J. P., Hutmacher, D. W. Concise review: humanized models of tumor immunology in the 21st century: convergence of cancer research and tissue engineering. Stem Cells. 33 (6), 1696-1704 (2015).
- Scotti, C., et al. Engineering of a functional bone organ through endochondral ossification. Proc Natl Acad Sci USA. 110 (10), 3997-4002 (2013).
- Scotti, C., et al. Recapitulation of endochondral bone formation using human adult mesenchymal stem cells as a paradigm for developmental engineering. Proc Natl Acad Sci USA. 107 (16), 7251-7256 (2010).
- Kuznetsov, S. A., et al. Single-colony derived strains of human marrow stromal fibroblasts form bone after transplantation in vivo. J Bone Miner Res. 12 (9), 1335-1347 (1997).
- Bianco, P., Robey, P. G. Skeletal stem cells. Development. 142 (6), 1023-1027 (2015).
- Vaiselbuh, S. R., Edelman, M., Lipton, J. M., Liu, J. M. Ectopic human mesenchymal stem cell-coated scaffolds in NOD/SCID mice: an in vivo model of the leukemia niche. Tissue Eng Part C Methods. 16 (6), 1523-1531 (2010).
- Groen, R. W., et al. Reconstructing the human hematopoietic niche in immunodeficient mice: opportunities for studying primary multiple myeloma. Blood. 120 (3), e9-e16 (2012).
- Chen, Y., et al. Human extramedullary bone marrow in mice: a novel in vivo model of genetically controlled hematopoietic microenvironment. Blood. 119 (21), 4971-4980 (2012).
- Reinisch, A., et al. A humanized bone marrow ossicle xenotransplantation model enables improved engraftment of healthy and leukemic human hematopoietic cells. Nat Med. 22 (7), 812-821 (2016).
- Sontakke, P., et al. Modeling BCR-ABL and MLL-AF9 leukemia in a human bone marrow-like scaffold-based xenograft model. Leukemia. 30 (10), 2064-2073 (2016).
- Theocharides, A. P., Rongvaux, A., Fritsch, K., Flavell, R. A., Manz, M. G. Humanized hemato-lymphoid system mice. Haematologica. 101 (1), 5-19 (2016).
- Antonelli, A., et al. Establishing human leukemia xenograft mouse models by implanting human bone marrow-like scaffold-based niches. Blood. 128 (25), 2949-2959 (2016).
- Holzapfel, B. M., et al. Tissue engineered humanized bone supports human hematopoiesis in vivo. Biomaterials. 61, 103-114 (2015).
- Reinisch, A., et al. Epigenetic and in vivo comparison of diverse MSC sources reveals an endochondral signature for human hematopoietic niche formation. Blood. 125 (2), 249-260 (2015).
- Lee, J., et al. Implantable microenvironments to attract hematopoietic stem/cancer cells. Proc Natl Acad Sci USA. 109 (48), 19638-19643 (2012).
- Lee, J., Heckl, D., Parekkadan, B. Multiple genetically engineered humanized microenvironments in a single mouse. Biomater Res. 20 (19), 1-13 (2016).
- Ho, M. S., Medcalf, R. L., Livesey, S. A., Traianedes, K. The dynamics of adult haematopoiesis in the bone and bone marrow environment. Br J Haematol. 170 (4), 472-486 (2015).
- Bersani, F., et al. Bioengineered implantable scaffolds as a tool to study stromal-derived factors in metastatic cancer models. Cancer Res. 74 (24), 7229-7238 (2014).
- Thibaudeau, L., et al. Mimicking breast cancer-induced bone metastasis in vivo: current transplantation models and advanced humanized strategies. Cancer Metastasis Rev. 33 (2-3), 721-735 (2014).
- Holzapfel, B. M., et al. Species-specific homing mechanisms of human prostate cancer metastasis in tissue engineered bone. Biomaterials. 35 (13), 4108-4115 (2014).
- Thibaudeau, L., Holzapfel, B. M., Hutmacher, D. W. Humanized mice models for primary bone tumor and bone metastasis research. Cell Cycle. 14 (14), 2191-2192 (2015).
- Thibaudeau, L., et al. A tissue-engineered humanized xenograft model of human breast cancer metastasis to bone. Dis Model Mech. 7 (2), 299-309 (2014).
- Abarrategi, A., Foster, K., Hamilton, A., Mian, S., Passaro, D., Gribben, J., Mufti, G., Bonnet, D. Versatile humanized niche model enables study of normal and malignant human hematopoiesis. J Clin Invest. 127 (2), (2017).
- Abarrategi, A., et al. In vivo ectopic implantation model to assess human mesenchymal progenitor cell potential. Stem Cell Rev. 9 (6), 833-846 (2013).
- Rubio, R., et al. Bone environment is essential for osteosarcoma development from transformed mesenchymal stem cells. Stem Cells. 32 (5), 1136-1148 (2014).
- Abarrategi, A., et al. Multiwall carbon nanotube scaffolds for tissue engineering purposes. Biomaterials. 29 (1), 94-102 (2008).
- Abarrategi, A., et al. Gene expression profile on chitosan/rhBMP-2 films: A novel osteoinductive coating for implantable materials. Acta Biomater. 5 (7), 2633-2646 (2009).
- Abarrategi, A., et al. Biological properties of solid free form designed ceramic scaffolds with BMP-2: in vitro and in vivo evaluation. PLoS One. 7 (3), e34117(2012).
- Abarrategi, A., et al. Chitosan scaffolds for osteochondral tissue regeneration. J Biomed Mater Res A. 95 (4), 1132-1141 (2010).
- Abarrategi, A., et al. Improvement of porous beta-TCP scaffolds with rhBMP-2 chitosan carrier film for bone tissue application. Tissue Eng Part A. 14 (8), 1305-1319 (2008).
- Prasain, N., Meador, J. L., Yoder, M. C. Phenotypic and functional characterization of endothelial colony forming cells derived from human umbilical cord blood. J Vis Exp. (62), (2012).
- JoVE Science Education Database. General Laboratory Techniques. Histological Sample Preparation for Light Microscopy. J Vis Exp. , (2016).
- Hong, J. K., Yun, J., Kim, H., Kwon, S. Three-dimensional culture of mesenchymal stem cells. Tissue Eng Regen Med. 12 (4), 211-221 (2015).
- Bara, J. J., et al. Three-dimensional culture and characterization of mononuclear cells from human bone marrow. Cytotherapy. 17 (4), 458-472 (2015).
- Dong, H. W., Qin, S., Rafailovich, M., Ma, Y. Developing an Optimal Biofunctional Scaffold for Hematopoietic Stem Cell Quiescent Maintenance and Expansion. N Am J Med Sci. 8 (2), (2015).
- Raic, A., Rodling, L., Kalbacher, H., Lee-Thedieck, C. Biomimetic macroporous PEG hydrogels as 3D scaffolds for the multiplication of human hematopoietic stem and progenitor cells. Biomaterials. 35 (3), 929-940 (2014).
- Miyoshi, H., Morita, M., Ohshima, N., Sato, C. Expansion of mouse hematopoietic progenitor cells in three-dimensional cocultures on frozen-thawed stromal cell layers formed within porous scaffolds. Exp Hematol. 43 (2), 115-124 (2015).
- Cuddihy, M. J., Wang, Y., Machi, C., Bahng, J. H., Kotov, N. A. Replication of bone marrow differentiation niche: comparative evaluation of different three-dimensional matrices. Small. 9 (7), 1008-1015 (2013).
- Sharma, M. B., Limaye, L. S., Kale, V. P. Mimicking the functional hematopoietic stem cell niche in vitro: recapitulation of marrow physiology by hydrogel-based three-dimensional cultures of mesenchymal stromal cells. Haematologica. 97 (5), 651-660 (2012).
- Leisten, I., et al. 3D co-culture of hematopoietic stem and progenitor cells and mesenchymal stem cells in collagen scaffolds as a model of the hematopoietic niche. Biomaterials. 33 (6), 1736-1747 (2012).
- Ferreira, M. S., et al. Cord blood-hematopoietic stem cell expansion in 3D fibrin scaffolds with stromal support. Biomaterials. 33 (29), 6987-6997 (2012).
- Baldwin, J. G., et al. Periosteum tissue engineering in an orthotopic in vivo platform. Biomaterials. 121, 193-204 (2017).
- Rafii, S., Butler, J. M., Ding, B. S. Angiocrine functions of organ-specific endothelial cells. Nature. 529 (7586), 316-325 (2016).
- Seandel, M., et al. Generation of a functional and durable vascular niche by the adenoviral E4ORF1 gene. Proc Natl Acad Sci USA. 105 (49), 19288-19293 (2008).
- Medyouf, H. The microenvironment in human myeloid malignancies: emerging concepts and therapeutic implications. Blood. 129 (12), 1617-1626 (2017).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유