Method Article
Misurazioni di contrattilità della muscolatura liscia uterina umana per lo sviluppo di farmaci di aiuto
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo articolo descrive i protocolli sperimentali per lo Studio ex vivo contrazioni del miometrio umano e la loro applicazione nella scoperta della droga. Questa tecnica è utilizzata per migliorare la comprensione delle myometrial fisiologia e patofisiologia pure quanto a convalidare dati farmacologici da romanzo ricerca sonde o droga conduce.
Abstract
Individuazione e caratterizzazione di nuovi composti farmaceutici o biochimici sonde si basano su sistemi di dosaggio robusto e fisiologicamente rilevanti. Descriviamo i metodi per misurare la contrattilità del miometrio ex vivo . Questo test può essere utilizzato per studiare i fattori e molecole coinvolte nella modulazione della contrazione miometriale e per determinare le loro azioni eccitatori o inibitori e quindi loro potenziale terapeutico in vivo. Le biopsie sono ottenute dalle donne che subiscono la consegna cesarean sezione con consenso informato. Bene strisce di miometrio sono dissecati, ritagliati e collegati ad un trasduttore di forza all'interno di bagni dell'organo 1ml superfusi con soluzione fisiologica a 37 ° C. Strisce di sviluppare le contrazioni spontanee all'interno di 2 – 3 h sotto tensione impostata e rimangono stabili per molte ore (> 6 h). Strisce possono anche essere stimolate a contratto come dagli ormoni endogeni, ossitocina e vasopressina, che causano la modulazione della concentrazione-dipendente della frequenza di contrazione, forza e durata, che più assomigliano molto alle contrazioni in travaglio. Quindi, l'effetto di farmaci noti e romanzo può essere testato su contrazioni spontanee ed indotta da agonista.
Questo protocollo specificamente i dettagli come questo test può essere utilizzato per determinare la potenza degli agenti noti e romanzo misurando i loro effetti su vari parametri di contrazione miometriale umano. Usiamo l'ossitocina - e antagonisti dei recettori a V1a , atosiban e SR49059 come esempi di composti noti inibiscono le contrazioni indotte da ossitocina e vasopressina, che dimostrano come questo metodo può essere utilizzato per integrare e convalidare dati farmacologici ottenuti da analisi cell-based per aiutare lo sviluppo di farmaci. Gli effetti di nuovi agonisti in confronto di ossitocina e vasopressina possono anche essere caratterizzati. Mentre si usa l'esempio di ossitocina / sistema di vasopressina, questo metodo può anche essere usato per studiare altri recettori e canali ionici che svolgono un ruolo nella contrazione uterina e relax per far progredire la comprensione della fisiologia umana uterina e della patofisiologia.
Introduzione
L'obiettivo del drug discovery è di produrre il romanzo, potente e altamente selettivi ligandi che generano una risposta terapeutica attivando o inibendo le vie di segnalazione cellulare. Questo richiede un sistema di dosaggio appropriato in cui testare composti di piombo con risultati affidabili, robusti e rilevanti1. Tecniche farmacologiche come legame ligando-recettore e saggi funzionali spesso impiegano sistemi basati su cellule eterologhi, progettati per recettori iperesprimere che altrimenti non sarebbero presenti2. Mentre queste tecniche forniscono informazioni preziose per recettori farmacologia e lo sviluppo precoce di farmaci, i dati ottenuti potrebbero non riflettere uno scenario vero e proprio nel vivo . È quindi importante che dati farmacologici da analisi cell-based vengono convalidati anche nei modelli fisiologicamente rilevanti.
Muscolatura liscia uterina (miometrio) costituisce lo strato muscolare dell'utero che è responsabile per le contrazioni durante il travaglio che cancellare e dilatano la cervice e consegnare il feto3. Contrazione del miometrio è spontanea; non richiede input ormonale o nervoso per contratto4. Le contrazioni sono provocate da spontanea depolarizzazione della membrana cellulare myometrial che conduce all'apertura di operati di tensione Ca2 +-canali (canali di tipo L) e l'afflusso di Ca2 + nel cellulare5. Complessi di calcio con calmodulina e attiva la chinasi della catena leggera della miosina che a sua volta fosforila miosina permettendo di attraversare ponte ciclo di formazione con l'actina e la contrazione. Relax in genere è mediata da-fosforilazione della miosina di miosina fosfatasi e una riduzione della concentrazione di Ca2 + tramite sua estrusione da cella e/o sequestrante nel reticolo sarcoplasmatico (SR)5,6 ,7.
Diversi metodi sono stati sviluppati per studiare myometrial funzione e disfunzione, da interni ed esterni in vivo tocography e cateteri pressione intrauterina, alla generazione di cellule trasformate o immortalizzate di origine myometrial8 ,9,10,11,12. Mentre sistemi di colture cellulari in grado di rilevare se una sostanza può agire a livello cellulare, strisce di tessuti all'interno di bagni dell'organo possono essere utilizzati come strumenti per misurare le risposte funzionali dei tessuti tutta ai reagenti farmacologici. Il bagno tradizionale organo è in genere una camera grande vetro riscaldato che è in grado di tenuta tra 5 e 50 mL di soluzione fisiologica (PSS). Strisce all'interno di queste camere di ampie dimensioni richiedono normalmente aerazione con ossigeno e grandi volumi di PSS. Strisce di tessuto sono sezionati e sospeso all'interno della camera di balneazione e collegati ad un trasduttore di forza che misura le variazioni di tensione, come ad esempio durante una contrazione. Strisce di miometrio da umani e animali compresi, cavia13, mouse14, ratto15, coniglio16e gli altri17,18, sono stati utilizzati da un numero di gruppi di ricerca per esaminare molte domande relative alla myometrial fisiologia e patologia, tra cui lavori prematuri e disfunzionali. Ad esempio, myometrial strisce sono stati usati per identificare i fattori che regolano e modificare attività myogenic19,20,21, determinano organello funzione come il SR22, così come indagando modulatori dello ione canali23,24,26, pompe e scambiatori di25,27 per determinare il loro ruolo nella fisiologia myometrial.
Questa tecnica ex vivo permette per la valutazione delle performance di contrazione del tessuto e l'effetto diretto di diversi agenti sui parametri di contrazione deve essere misurata tra cui, forza di contrazione (resistenza), frequenza e durata, nonché la integrazione di questi valori, per generare un indice del lavoro totale svolto (forza media integrale o area sotto la curva, AUC). Come la preparazione di striscia di tessuto isolato costituisce un modello di più di un tipo di cellula, la risposta fisiologica del tessuto intero può essere misurata. La vasca di organo e la striscia di tessuto isolato sono pertanto uno strumento utile nel fornire il ponte tra il lavoro della coltura cellulare e animale intero /in vivo di lavoro. Quindi, nel campo della scoperta di farmaci, gli effetti di nuovi agenti in termini di loro eccitatori (cioè, stimolante) o inibitoria (cioè, rilassamento) potenziale in vivo può essere valutato più attentamente. Questa tecnica è stata utilizzata con successo nello sviluppo di ossitocina - e V1a-atosiban antagonista del recettore (OTR e V1aR) come agente tocolitico per inibire le contrazioni del travaglio pretermine e ritardare la nascita pretermine. Test in vitro di atosiban sulle strisce myometrial trovato l'antagonista in grado di ridurre significativamente l'ossitocina (OT)-indotto contrazioni28,29,30. Soprattutto questi studi ha contribuito a convalidare il valore traslazionale di atosiban e generati i dati di prova necessari per prendere in avanti a studi clinici31,32,33,34 . Atosiban ora è ampiamente usato come il farmaco di scelta per ritardare il lavoro in Europa. Studi di proof-of-concept simili sono stati effettuati per la carbetocina analogico di ossitocina mostrare il suo potenziale terapeutico nella prevenzione post-partum emorragia35,36,37. Altri composti di piombo in fase di sviluppo con questo test includono Langbeinite (GSK221149A)38 e nolasiban (dati non pubblicati). Questi metodi sono stati utilizzati con successo anche da confrontare tra gruppi di pazienti39,40,41,42,43,44, 45,46,47 ed esaminare le differenze intra-specie.
Qui descriviamo l'uso di strisce di tessuto isolato ex vivo da incinta miometrio umano all'interno di bagni su misura organo piccolo (1 mL) per illustrare come questo metodo può essere utilizzato per integrare e convalidare dati farmacologici ottenuti da analisi cell-based . Le biopsie sono state ottenute in gran parte da donne che subiscono la consegna Cesarean sezione (CS) elettiva pre-lavoro come sono ambulatorio previsto e quindi sono più facili da programmare insieme di biopsia, hanno facile accesso al myometrium, e tessuti non sono stati esposti a qualsiasi uterotonic stimolanti o rilassanti prima della chirurgia. Tuttavia, le biopsie si ottengono anche da donne che subiscono la consegna CS (emergenza) non pianificata in travaglio purché ci sia tempo sufficiente per consenso completamente il paziente. La maggior parte delle biopsie sono ottenute durante la chirurgia dal segmento uterino inferiore al sito di incisione chirurgica, tuttavia è anche possibile ottenere campioni dal segmento superiore48,49. In alcuni casi dopo il parto vaginale, le biopsie del punzone dal letto placenta sono state ottenute anche50. Tuttavia, questo non è il percorso più convenzionale e la quantità di tessuto myometrial estratto è piccola. Miometrio non-incinta possa essere ottenuto dalle donne pre- o post-menopausa che subisce l'isterectomia per circostanze ginecologiche benigne. Una biopsia di spessore completo è campionata post-patologia esame, dal corpus inferiore dalla cervice, e miometrio è preso dalla metà della parete uterina evitando le superfici serosal e dell'endometrio.
Protocollo
Appropriata revisione istituzionale, etico amministrazione e sicurezza approvazione per gli esperimenti con i tessuti umani dovrà essere a posto prima di lavorare con qualsiasi tessuti umani. Tutti i lavori descritti nel presente documento ricevuto approvazione del comitato etico di ricerca locale (East Liverpool, REC Ref 10/H1002/49) e commissioni di revisione istituzionale della ricerca e sviluppo dipartimento, ospedale di Liverpool donne e Università di Liverpool.
Nota: Tutte le biopsie descritte in questo protocollo sono state ottenute dalle donne in fase di pre-lavoro consegna elettiva CS presso Hospital Universitario e ogni donna hanno dato consenso informato scritto a partecipare.
1. soluzioni
- Preparare soluzione fisiologica salina modificata di Krebs (PSS) con la seguente composizione: 154 mM NaCl, 5,6 mM KCl, 1,2 mM MgSO4, 7,8 millimetri di glucosio, 10,9 mM HEPES e 2,0 mM CaCl2.
Nota: Il volume da effettuarsi è determinato in base al numero di bagni del tessuto in funzione, la portata del sistema (1 mL/min) e durata dell'esperimento, compreso il tempo di equilibrazione e sbiaditura approssimativa. - Regolare il pH a 7.4 utilizzo 4 M NaOH.
2. tessuto Bath Set Up
- Preriscaldare il serbatoio di sistema tessuto bagno a ~ 45 ° C con un bagno di acqua a ricircolo a 55-60 ° C.
Nota: Il serbatoio dell'acqua nella base dell'apparecchio viene riscaldato a ~ 45 ° C, che dopo aver consentito per lo scambio termico con il PSS della tubazione peristaltica che attraversa, assicura il PSS nel bagno del tessuto è a 37 ° C. Qualche aggiustamento per impostare le temperature può essere necessari per garantire che la temperatura del PSS nel bagno del tessuto raggiunge i 37 ° C. Questo può variare a seconda dell'apparecchio utilizzato e impostare la velocità di flusso. - Accendere manualmente qualsiasi altre attrezzature necessarie inclusi amplificatore, acquisizione dati e sistema di registrazione e le pompe di aspirazione.
- Posizionare ogni tubo peristaltica alimentatore (un tubo per bagno) intorno ai rulli della testa della pompa peristaltica. Fissare con le fermate di ritegno e rafforzando le camme di compressione e blocco tasti intorno ai tubi. Inserire le estremità libere dei tubi peristaltica dell'alimentatore in un contenitore da 1L di PSS e avviare la pompa per consentire il PSS per irrorare continuamente nei bagni del tessuto.
- Garantire le pompe di aspirazione funzionino correttamente e che il livello della soluzione nel bagno è costante, tale che la velocità del flusso nella vasca da bagno è uguale al tasso di rimozione. Il livello di PSS nel bagno del tessuto può essere regolato modificando la profondità del tubo di aspirazione nel bagno usando l'argilla di modeler.
- Calibrare i trasduttori di forza mettendo un peso noto (equivalente a 1 millinewton (mN, unità di forza)) sul gancio trasduttore e la deflessione rilevata dal software di acquisizione di registrazione.
Nota: I valori possono essere regolati nel software tale che i valori registrati vengono automaticamente convertiti in mN negando la necessità di eseguire eventuali ulteriori conversioni durante l'analisi. Taratura di trasduttori di forza deve essere eseguita prima del montaggio del tessuto.
3. preparazione e dissezione delle strisce
- Raccogliere le biopsie del miometrio umano incinta (1 – 2 cm3) alle CS dopo la consegna del bambino e della placenta. Ottenere le biopsie di spessore completo (tipico) in cui sono presenti sia il perimetrium (strato esterno sierosa dell'utero) e decidua (strato più interno dell'utero). Utilizzare soltanto il tessuto miometriale (strato centrale del muscolo). Vedere Figura 1A-B.
- Rimuovere la decidua (essenziale) e qualsiasi aderente membrane fetali (se presente) come questi tessuti sono noti per produrre sostanze che possono alterare la contrattilità miometriale.
Nota: In chirurgia, campioni sono collocati in matasse bilanciato sale soluzione (HBSS) o PSS fresco e conservati a 4 ° C. Idealmente i tessuti devono essere utilizzati entro 12-16 h della chirurgia, tuttavia non hanno dimostrato alcun danno per la contrattilità dopo 18 h dalla raccolta con conservazione a 4 ° C51. Opportuni controlli devono essere eseguiti per confermare la vitalità del tessuto e la funzione dopo una conservazione prolungata a 4 ° C. Dal bordo superiore del sito di incisione segmento uterino inferiore e non dal segmento superiore, sono prelevati i campioni qui. I segmenti inferiori e superiori dell'utero sono stati indicati per contratto similmente48, quindi le biopsie di segmento inferiore sono considerate una buona riflessione di attività myometrial di segmento superiore.
- Rimuovere la decidua (essenziale) e qualsiasi aderente membrane fetali (se presente) come questi tessuti sono noti per produrre sostanze che possono alterare la contrattilità miometriale.
- Preparare l'area di dissezione e necessari strumenti tra cui: grande dissezione Forbici, piccole forbici per dissezione di Allerød, due forcipe di dissezione, perni di dissezione e clip di tessuto di alluminio, intorno ad un microscopio di dissezione con fissi e zoom ingrandimento.
- Posto il campione di biopsia su un piatto di dissezione chiaro silastic-base (Vedi Tabella materiali) riempito con PSS e attentamente orientarsi la biopsia in modo che i bordi sierosa e decidua sono identificati nella Figura 1B.
- Utilizzare perni per fissare la biopsia alla base del piatto. Garantire che il tessuto rimane idratato con PSS durante tutto il processo di dissezione.
- Accendere la sorgente di luce microscopio e ispezionare il tessuto sotto il microscopio a ingrandimento 10x per identificare le aree del myometrium esente da tessuto cicatriziale, sierosa, decidua e qualsiasi aderente membrane fetali se presente manualmente.
- Eseguire una dissezione smussa utilizzando le forbici grande dissezione per separare i due strati di tessuto adiacente, rivelando due aerei o fogli del muscolo.
Nota: Spesso è più facile trovare una piccola tasca tra strati di tessuto per iniziare la separazione ma la cura deve essere presa per evitare piccoli vasi al bordo di biopsia, in quanto possono essere scambiati per 'tasche'. - Posto perni su ogni angolo del tessuto di dissezione per fissarlo. Ispezionare i fogli del muscolo alla ricerca di regioni del muscolo con fibre in esecuzione in parallelo.
Nota: L'identificazione di regione può essere aiutata da seguendo la direzione di piccoli capillari che irrora attraverso il tessuto. Gentle tirando al bordo del tessuto può anche aiutare a identificare la direzione in cui le fibre sono in viaggio. - Tagliare le strisce di tessuto ~ 2mm x 8 ampia lunghezza mm x 1 mm di spessore lungo l'asse longitudinale allineato con la direzione delle fibre del muscolo, usando le forbici piccole dissezione.
Nota: Deve prestare attenzione per contenere solo il tessuto di taglio iniziale per evitare danni. - Ripetere il processo per sezionare il numero di strisce necessari per l'esperimento.
- Perno di ciascuna striscia ad entrambe le estremità per raddrizzare e sicuro al piatto, avendo cura di non tratto il tessuto.
- Collegare clip di tessuto di alluminio a ciascuna estremità in modo che il tessuto tra di loro è ~ 5 mm lungo e attentamente tagliare qualsiasi tessuto in eccesso (Figura 1).
- Trasferire in un piatto pulito riempito con PSS pronto per il montaggio.
4. montaggio dei tessuti nei bagni
- Trasferire le strisce ai bagni del tessuto sperimentale. Montare le strisce orizzontalmente piuttosto che verticalmente (come bagni tradizionali dell'organo) (Figura 2B).
- Collegare un'estremità di ogni striscia di clip per il trasduttore di forza, che misura la contrazione del tessuto, e l'altro a un gancio sia all'interno della camera di tessuto.
Nota: La capacità della vasca del tessuto è ~ 1 mL che è grande abbastanza per assicurarsi che le strisce sono completamente immersa nella vasca da bagno. - Garantire che le strisce sono alla base di ogni gancio nel bagno.
- Aprire il software di registrazione facendo doppio clic sull'icona del software.
- Regolare la registrazione per ogni canale in modo che è in vista nella finestra del canale.
- Regolare la scala dell'asse Y a leggere tra 0-10 V (equivalente a 0-10 mN post calibrazione) facendo clic destro sull'asse Y, selezionando 'scala' e inserendo valori minimo e massimo di 0 e 10, rispettivamente. Selezionare 'OK'. Ripetere per ogni canale di registrazione.
- Premere il tasto 'record' sul software per iniziare la registrazione dal vivo.
Nota: Se le strisce non sono fissati alla base di ogni gancio, potrebbe scivolare durante la contrazione che apparirà come un 'notch' sulla registrazione. Cambierà la tensione impostata e quindi lo post-slittamento contrazioni può differire. - Allungare il tessuto in ogni vasca ruotando manualmente i micromanipolatori allegate ad ogni trasduttore. Seguire il movimento del tessuto verso l'alto dalla linea di base sullo schermo e continuare a girare i micromanipolatori, fino a quando la tensione della linea di base raggiunge 0,2 g (~ 2 mN).
Nota: Il tessuto inizierà subito a rilassarsi (indicato da un calo di tensione della linea di base), in genere arrivano fino a una tensione costante di tra 0,5 – 1 mN. Questa tensione definita è stata ottimizzata per le strisce di tessuto di queste dimensioni nelle nostre condizioni sperimentali. Se altri tessuti dimensioni devono essere utilizzati, è essenziale che le indagini di rapporto lunghezza-tensione appropriata vengono eseguite per ottimizzare la forza che riposa da applicare. - Consentire i tessuti equilibrare per ~ 2 ore fino a quando le contrazioni spontanee derivano.
Nota: una piccola elevazione in tensione della linea di base è di solito osservata ed è una buona indicazione della vitalità del tessuto e che sarà contrattile.
5. sfidando il tessuto con potassio 40 mM (alta K+)
- Se non le contrazioni spontanee accadono dopo 2 h di montaggio, sfida le strisce con una soluzione di sale di potassio in cui potassio è elevata a 40 mM di sostituzione isotonico di NaCl per KCl. Per l'alta K+, aggiungere quanto segue (in mM): 119,6 NaCl, 40 KCl, 1,2 MgSO4, 7,8 glucosio, 10,9 HEPES e 2.0 CaCl2.
Nota: Nel muscolo liscio come myometrium, applicazione di alta K+ provoca la contrazione aprendo indirettamente i canali del calcio voltaggio operato conduce al massimo afflusso di Ca2 + le cellule del tessuto. Alta K+ è quindi utilizzabile come misura per testare l'indice generale dell'integrità del tessuto, nonché a realizzare una misura della risposta massima del tessuto.- Posizionare il tubo di alimentazione per il bagno contenente la striscia ad essere sfidata in una bottiglia di laboratorio di vetro contenente alta K+ per 1-2 min.
- Restituire l'imboccatura al contenitore di PSS.
- Dove si ottiene una risposta ad alta K+ , continuare a monitorare la striscia per un ulteriore 1 h. Se non c'è nessuna risposta contrattile a alta K+ o nessuna attività spontanea ha suscitato post risposta elevata K+ , scartare la striscia.
Nota: Lo sperimentatore deve anche essere consapevole dello spazio morto (tempo impiegato per la soluzione raggiungere il bagno di tessuto) nel tubo di alimentazione prima di valutare la risposta ad alta K+. Questo può richiedere 2-3 min e dipenderà dalla velocità di flusso. - Per garantire un washout completo di alta K+ dai tubi della vasca e dell'alimentatore, che possono influire sulle successive manovre, attendere fino a quando le contrazioni spontanee tornare al pre alta ampiezza K+ prima di procedere ulteriormente con l'esperimento.
6. testare gli effetti di composti noti e romanzo sulla contrazione miometriale
Nota: Gli esperimenti per testare l'effetto di nuovi farmaci e reagenti sulla myometrial funzione possono essere eseguiti su spontanea (Figura 3A) o agonista-stimolato le contrazioni (Figura 3B-C). Per agonista ha stimolato le contrazioni, OT o arginina vasopressina (VP) viene aggiunto il PSS dare una concentrazione di 0,5 nM e viene utilizzato in tutto l'esperimento (Figura 3B-C). La concentrazione di OT è stata ottimizzata per questo test in quanto fornisce le contrazioni che sono fasiche in natura40,52. Concentrazioni di agonisti maggiori di questo può portare a contrazioni (tonico) di lunga durature, sostenute (Vedi Ref41,44 per esempi) in cui l'effetto di vari agenti è difficile da valutare e il lasso di tempo sperimentale ha bisogno di essere notevolmente esteso per supportare l'aumento della durata delle singole contrazioni e riduzione nella frequenza. In questo esperimento di esempio, OT o VP è aggiunto per stimolare le contrazioni così che l'antagonismo noto OTR e V1aR antagonisti, atosiban e SR49059, oppure il nostro composto novello [D-Arg8]-inotocin ([D-Arg8] INT.), può essere valutato.
- Preparare le concentrazioni del test presenti in PSS (con o senza 0,5 nM OT/VP) diluito a un minimo di diluizione di 1/1.000, garantendo una vasta gamma di concentrazioni sono inclusi ad esempio quelli che non suscitare una risposta alle concentrazioni che superano il massimale risposta.
- Preparare un insieme equivalente di diluizioni che coinvolgono volumi uguali di veicolo (ad es., solfossido dimetilico, acetonitrile o acqua distillata).
Nota: Spesso è più semplice preparare la più alta concentrazione, cioè, 10-6 M (da uno stock di 10-3 M) e quindi eseguire diluizioni seriali lungo una scala logaritmica (ad es., 10-6–10-10 M). Il volume a essere preparato dipende il tempo di applicazione, velocità di flusso dell'apparato e numero di strisce da esaminare, ad esempio, per un'applicazione di 25 min di reagente e una portata di 1 mL/min, un minimo di 25 mL di ciascuna concentrazione per bagno tessuto è requir ed. - Applicare la prima concentrazione di composto al tessuto inserendo il tubo di alimentazione per il bagno di tessuto in una bottiglia di laboratorio di vetro contenente il reagente alla concentrazione desiderata.
Nota: Questo dovrebbe essere fatto una volta ottenuta una linea di base stabile delle contrazioni spontanee o OT/VP-stimolata. - Applicare la soluzione di controllo veicolo corrispondente allo stesso modo di un secondo bagno.
- Registrare il tempo di applicazione (vale a dire, quando è stato cambiato il tubo dell'alimentatore).
- Ripetere il processo per ogni concentrazione mettendo in sequenza i tubi di alimentazione al flacone di laboratorio di vetro contenente la concentrazione successiva della serie e ripetere fino a quando tutte le concentrazioni sono state applicate.
L'applicazione di ciascuna concentrazione può essere compreso tra 15 e 30 min, ma deve essere coerenza per ogni concentrazione applicata e fra gli esperimenti. Quelli che coinvolgono OT o VP-stimolato le contrazioni tendono a richiedere lunghi periodi di applicazione(ad esempio, 25 min) a rappresentare la riduzione nella frequenza di contrazione osservata sotto stimolazione. Esperimenti preliminari per determinare il tempo di applicazione ottimale devono essere eseguiti in anticipo con qualsiasi nuovo reagente da testare. - Restituire l'imboccatura a PSS (con o senza OT/VP) di washout.
- Fare clic su 'stop' per terminare la registrazione dal vivo. Immediatamente salvare i dati in una cartella appropriata e una versione da esportazione come file 'mat'.
7. analisi dei dati
Nota: Acquisizione dei dati e analisi possono essere eseguite da qualsiasi numero di pacchetti di software di acquisizione dati commercialmente disponibili. Vedi Tabella materiali per i dettagli del software utilizzato in questo protocollo. Per una corretta valutazione dell'attività contrattile, i parametri delle contrazioni da misurare sono: i) l'ampiezza di contrazione, ii) la frequenza di contrazione, iii) durata di contrazione e forza iv) media integrale (Figura 4). Forza media integrale equivale all'area sotto la curva di contrazione ed è pertanto un indice del lavoro totale svolto dalla striscia di tessuto in un dato tempo. Alcuni o tutti i parametri possono essere analizzati. Come minimo, è consigliabile che la forza media di integrale e l'ampiezza della contrazione sono analizzati53. Negli esperimenti descritti qui abbiamo misurato i cambiamenti nell'ampiezza di contrazione e l'area sotto la curva.
- Consente di importare file the.mat il software di analisi.
- Regolare la colonna corrispondente all'asse X per riflettere il tempo sperimentale, tenendo conto della frequenza di intervallo di campionamento. Esperimenti sono in genere registrati a 10 Hz, corrispondente a 10 campioni/s o 600 campioni/min.
- Tracciare i dati come un X-Y coordinare grafico utilizzando "trama | Funzione di linea".
- Zero della linea di base di contrazione utilizzando la funzione 'tradurre verticale' sul software.
- Selezionare un periodo di controllo appropriato.
Nota: Questo è il periodo di tempo immediatamente precedente l'applicazione della concentrazione prima del reggente, ma pari alla durata di applicazione del reagente (Figura 4A). Per esempio, se l'applicazione del farmaco X è per 25 min, utilizzare il 25 min che precede la prima applicazione di droga X come il controllo. - Leggete l'asse Y, registrare l'ampiezza (forza) di contrazione al picco massimo di ogni contrazione che si verificano nell'intervallo di tempo selezionato e calcolare un valore medio.
- Misurare la durata di contrazione al 50% di questo picco massimo di lettura fuori asse X all'inizio e alla fine di ogni contrazione e registrare un valore medio.
- Contare il numero di contrazioni che si verificano nel lasso di tempo per generare un valore di frequenza.
- Utilizzare la funzione di 'integrazione' per calcolare AUC (in unità arbitrarie, a.u.) per il periodo di tempo selezionato.
Nota: Per registrare con precisione la AUC, è essenziale che la linea di base delle contrazioni è impostato a zero sull'asse Y. - In sequenza spostare attraverso ciascuna delle concentrazioni e registrare i parametri differenti di contrazione.
- Impostare i dati di controllo come 100% ed esprimere i valori ottenuti sotto ogni concentrazione di reagente come percentuale di questo controllano vale a dire, i valori per la stimolazione devono essere > 100% mentre rilassamento dovrebbe essere < 100%.
Nota: Normalizzare i dati in questo modo dovrebbe consentire all'utente di confrontare risultati in strisce e trattamenti farmacologici. - Ripetere per ogni esperimento e trasferire i dati in un pacchetto di grafica.
Risultati
Utilizzando questo modello, la risposta ai vari agonisti e antagonisti della contrazione, così come nuovi agenti della funzione conosciuta o sconosciuta può essere esaminata e quantificata. Parametri standard farmacologici come CE50 e IC50 i valori possono essere calcolati quando i reagenti sono usati in una vasta gamma di concentrazioni, ad esempio, 10-5– 10-9 M e aggiunto in aumento delle concentrazioni lungo un scala logaritmica.
Esperimenti di concentrazione-risposta di ossitocina recettore antagonista
In questo esperimento, accoppiati strisce di miometrio umano sono stati tagliati come sopra descritto e illustrati nella Figura 1, montato nei bagni del tessuto come raffigurato in Figura 2e permesso di equilibrare per produrre contrazioni stabile di uguale ampiezza e frequenza. Strisce poi sono stati esposti per l'agonista endogeno di OTR, OT (0,5 nM) per stimolare le contrazioni. Dopo un periodo di attività stabile sotto OT (in genere 45 min), atosiban è stata applicata su una strip in aumento delle concentrazioni lungo una scala logaritmica (10-9-10-6 M). La seconda striscia è stata lasciata in OT solo come controllo del tempo. Un esempio della risposta di atosiban può essere visto in Figura 5A. Prendendo le contrazioni immediatamente precedente la prima concentrazione di atosiban come controllo (100%), l'ampiezza e la AUC per ciascuna concentrazione applicato è stato calcolato come illustrato nella Figura 4. Per gli esperimenti di controllo del tempo, l'ora-equivalente di manovre sperimentale è stata misurata. I dati sono stati poi tracciati e curve montato utilizzando la funzione di regressione non lineare in un pacchetto di software di grafica (figura 5B-C). In termini di calcolo l'effetto inibitorio, la potenza relativa di atosiban è stata calcolata misurando la IC50 che è la concentrazione che causa mezzo massima (50%) risposta inibitoria. Lo stesso può essere fatto per agonisti o stimolatori di contrazione. In questo caso la potenza del composto viene calcolata dal CE50 (la concentrazione che causa mezza risposta stimolatore massima).
Indagare la risposta di nuovi composti e testare la loro selettività del ricevitore
Abbiamo usato questo modello fisiologicamente rilevante delle ex vivo umano myometrial contrazioni per esaminare gli effetti antagonistici di un composto recentemente sintetizzato, [D-Arg8]-inotocin ([D-Arg8] INT) sulle contrazioni stimolate sia con il nativo V1a Agonista R, VP o l'agonista nativo di OTR, OT. Abbiamo usato questo test per convalidare la selettività del ricevitore di [D-Arg8] INT, che era stato precedentemente determinato dai metodi farmacologici basati su cellule per essere un antagonista a V1aR ma non al OTR54.
In questo esperimento, strisce myometrial umano sono stati esposti a 0,5 nM VP o 0,5 nM OT per circa 1h per stimolare le contrazioni, come illustrato nella Figura 3, prima di aggiungere il nostro romanzo composto [D-Arg8] INT in aumento delle concentrazioni (Figura 6A e Figura 6C). questo era quindi confrontato con il commercialmente disponibile, noto V1aR antagonista, SR49059 (Figura 6B). Figura 6A illustra concentrazione dipendente diminuisce nelle contrazioni miometriale umano VP-stimolata con aumento delle concentrazioni di [D-Arg8] INT. I dati per ampiezza di contrazione e AUC per ciascuna concentrazione sono riassunti nella Figura 6Aii-iii. L'effetto è simile a quella mostrata per aumento delle concentrazioni del noto inibitore di1aR V, SR49059, mostrato in Figura 6Bi-iii. La selettività di INT [D-Arg8] verso il V1aR ma non verso l'OTR è dimostrata dal fatto che [D-Arg8] INT non non diminuzione umana myometrial contrazioni che sono state stimolate con OT (Figura 6) come ampiezza e AUC è rimasto stabile (Figura 6Cii-iii).
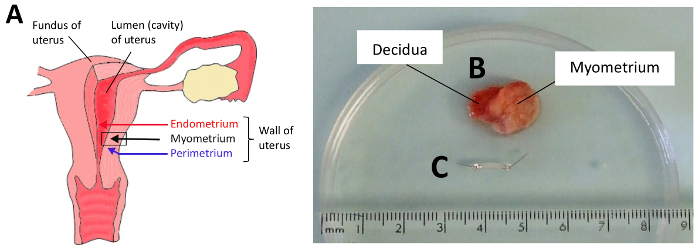
Figura 1: dissezione biopsia myometrial umano. (A) A diagramma dell'utero umano mostrando gli strati di tre tessuto che compongono la parete uterina. Lo strato più interno è l'endometrio (decidua in freccia gravidanza, rosso), lo strato intermedio è il miometrio (freccia di strato muscolare, nera) che genera le contrazioni e lo strato più esterno è il perimetrium (o membrana serosal, freccia blu) che forma un strato protettivo intorno l'utero. La regione di interesse per prelievo bioptico è rappresentata dal rettangolo nero. Una biopsia di esempio da una donna incinta prelevata durante la sezione caesarean è illustrata in (B) con decidua e myometrial strati evidenziata (serosa non visibile). È essenziale che gli strati differenti del tessuto sono identificati in modo da strisce di myometrium correttamente vengono sezionati per la sperimentazione. Una striscia di esempio del miometrio che è stato sezionato e ritagliato è mostrata in (C). In genere, 2 – 6 strisce sono tagliati e ritagliati come mostrato. Clicca qui per visualizzare una versione più grande di questa figura.
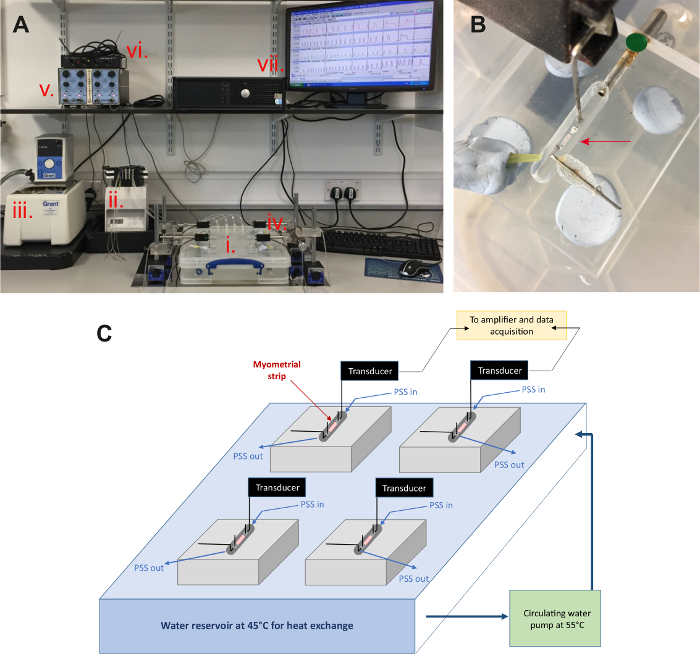
Figura 2: multi-organo set da bagno sperimentale fino utilizzato per misurare le contrazioni del miometrio umano. (A) strisce di miometrio è posti nell'organo piccolo (1 mL) bagno camere posizionate sulla parte superiore di un serbatoio riscaldato (i) e sono superfusi con soluzione fisiologica (PSS) mediante una pompa peristaltica (ii). Il serbatoio è mantenuto ad una temperatura impostata mediante un bagno di acqua circolante (iii). Ogni striscia è collegato ad un trasduttore di forza (iv), che registra le variazioni di tensione durante la contrazione. Questo è amplificato da un amplificatore di transbridge (v) e convertito in un segnale digitale (vi), che viene registrato su un sistema informatico (vii) in esecuzione il software di acquisizione associato. (B) immagine ingrandita di una camera di bagno dell'organo con una striscia di miometrio umano in situ (freccia rossa), bagnata nel PSS con un'estremità collegata ad un trasduttore di forza e l'altro a un gancio fisso. (C) descrizione schematica del set up. Camere di tessuto riempite con PSS sono continuamente irrorate con PSS riscaldato a 37 ° C che è tramite scambio termico con un serbatoio di acqua riscaldata sotto i bagni (mantenuti a 45 ° C) e una pompa di circolazione acqua impostata a 55 ° C. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: contrazioni spontanee e agonista-stimolata del miometrio umano in vitro. In condizioni libere da agonista, contrazioni spontanee rimangono stabili per oltre 3 ore di registrazione senza perdita significativa di ampiezza o zona-sotto-la-curva (AUC) (Aii, Aiii), dimostrando la robustezza di questo modello per indagare il applicazione di vari agenti sulla contrazione spontanea. Dopo aver stabilito le contrazioni spontanee, stabile, 0,5 nM ossitocina (B, OT) o vasopressina (C, VP) è stato aggiunto alla soluzione fisiologica (PSS). Le contrazioni sotto stimolazione anche rimangono stabili per un numero di ore senza una significativa perdita di ampiezza di contrazione (Bii, Cii) o AUC (Biii, Ciii) consentendo l'effetto di vari agenti contrattili per essere studiato in presenza di agonisti myometrial. I dati sono presentati come media ± errore standard della media (SEM). Nota, per contrazioni agonista-stimolata (B, C), il periodo di controllo (100%) è preso dopo i primi 45 min di applicazione dell'agonista, una volta le contrazioni si sono stabilizzati. In tutti i casi, strisce erano superfusi con PSS a 37 ° C, pH 7,4 (riprodotto da Arrowsmith et al. 40 con il permesso di Scienze riproduttive e Di Giglio et al. 54 con il permesso di Rapporti scientifici sotto la licenza Creative Common Open Access). Clicca qui per visualizzare una versione più grande di questa figura.
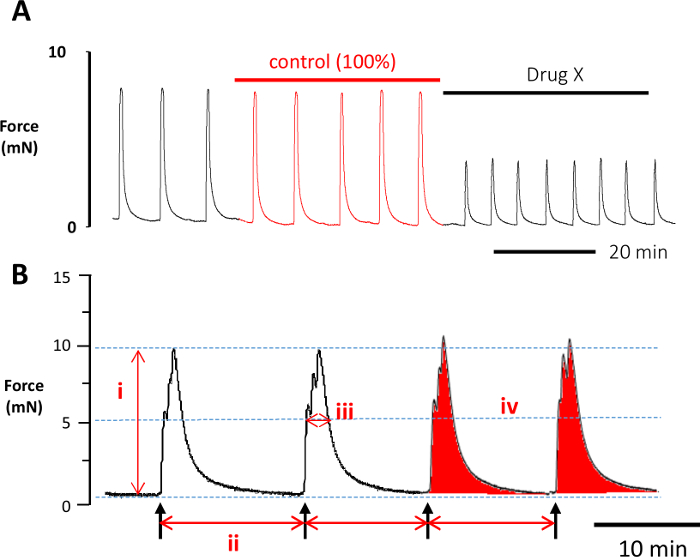
Figura 4: analisi dei dati. (A) Un periodo di controllo appropriato indicato in rosso è stato determinato selezionando le contrazioni immediatamente precedente l'applicazione del composto in esame (droga X). Questo periodo di controllo è anche uguale nel tempo l'applicazione della droga X (ad es., 40 min in questo esempio). Una volta misurati i valori per il periodo di controllo vengono impostati come 100%. Tutte le misure successive sono quindi espressi come percentuale del controllo. (B) ci sono 4 differenti parametri di contrazione che può essere misurata: (i) l'ampiezza di contrazione che misura la forza di contrazione (forza, mN), (ii) la frequenza di contrazione che misura la frequenza di contrazione, (iii) la durata della contrazione che viene misurata a metà picco massimo di contrazione e (iv) area sotto la curva (noto anche come forza integrale, arbitrario unità) che dà una misura del lavoro complessivo fatto. Clicca qui per visualizzare una versione più grande di questa figura.
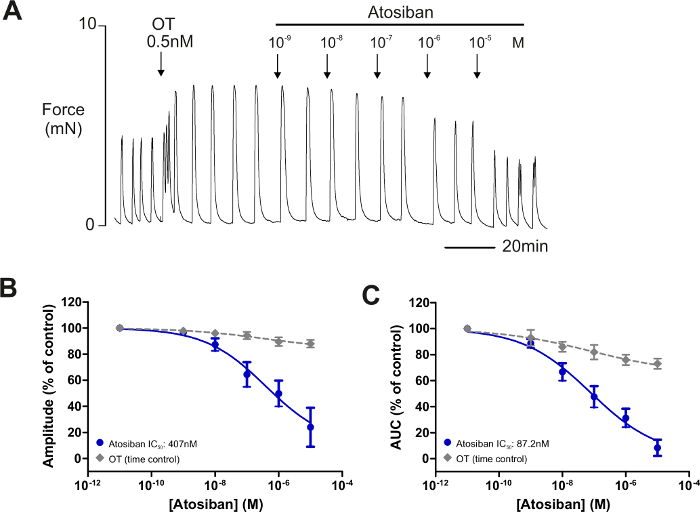
Figura 5: registrazione l'effetto antagonistico di atosiban sulle contrazioni indotte da ossitocina nel miometrio umano. Una volta che le contrazioni spontanee sono state stabilite, le contrazioni sono state stimolate con l'agonista del recettore dell'ossitocina, l'ossitocina (OT). Le contrazioni erano autorizzate a stabilizzare sotto lo stimolo per un ulteriore 45 min (A) la V1a e antagonista del recettore OT, atosiban è stato poi applicato in aumento delle concentrazioni lungo una scala logaritmica (10-9-10-5M). Le contrazioni durante il periodo precedente la prima concentrazione di atosiban sono state misurate e prese come controllo (100%). L'attività sotto ogni successiva concentrazione era misurata ed espressa in percentuale di controllo. Lo stesso è stato effettuato per le strisce esposti a OT da soli, utilizzando l'ora-equivalente di manovre sperimentali. Sono stati tracciati i dati nel software di grafico: (B, C) Visualizza le curve concentrazione-risposta per l'effetto antagonistico di atosiban (blu) e diluizione del veicolo (grigio, controllo di tempo) del caso su ampiezza di contrazione indotta da OT myometrial e area sotto la curva (AUC), rispettivamente. I dati sono presentati come media ± errore standard della media (SEM) percentuale di ampiezza e AUC dell'attività di controllo (prima dell'applicazione di atosiban). IC50 valori poi sono stati calcolati che danno la concentrazione a cui la mezza risposta inibitoria massima di (50%) per ampiezza di contrazione e integrale di forza (AUC) è raggiunto (riprodotto da Arrowsmith et al. 40 con il permesso di Scienze riproduttive). Clicca qui per visualizzare una versione più grande di questa figura.
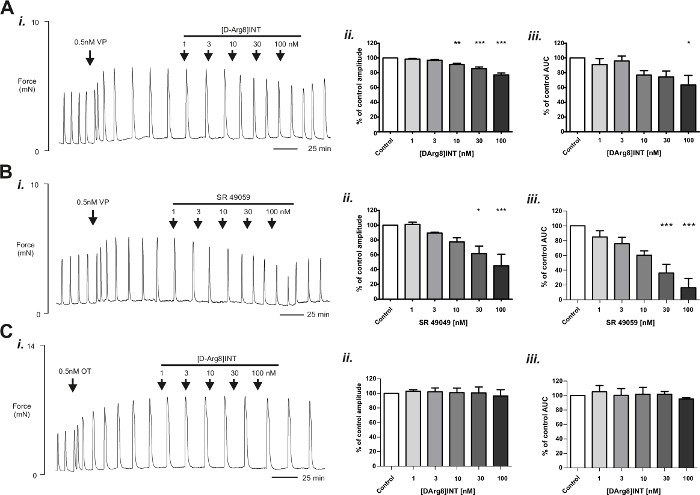
Figura 6: prova la selettività di effetto e del ricevitore di un romanzo composto sulla contrazione miometriale umano. Dopo le contrazioni spontanee di miometrio umano sono state stabilite, le contrazioni sono state stimolate con l'agonista del recettore di vasopressina, vasopressina (VP) (Ai, Bi) o l'agonista del recettore dell'ossitocina, l'ossitocina (OT) (Ci). L'effetto di [D-Arg8]-inotocin (INT [D-Arg8]) e l'antagonista di1aR V commercialmente disponibile, SR49059 sulle contrazioni stimolate dalla VP è stata valutata mediante l'applicazione di aumento delle concentrazioni dei composti. Le risposte tipiche sono mostrate in (Ai, Bi). L'associato ha analizzato i dati per l'ampiezza e la zona sotto la curva (AUC) sono mostrati in (ii) e (iii), rispettivamente dove l'effetto è stato espresso come percentuale del controllo attività (100%). [D-Arg8] INT sia il noto antagonista1aR V, SR49059 ha causato una diminuzione dipendente dalla dose in ampiezza e AUC, sostenendo il ruolo di [D-Arg8] INT come un antagonista del recettore di V1aR nel miometrio umano. Al contrario, [D-Arg8] INT non ha colpito le contrazioni stimolate da OT (IC-iii), quindi allo stesso modo per i nostri risultati da analisi di base delle cellule, [D-Arg8] INT Mostra anche la selettività verso il V1aR nel miometrio umano (dati riportati da Di Giglio et al. 54 con il permesso di Rapporti scientifici sotto la licenza Creative Common Open Access). Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Mentre la maggior parte lo sviluppo di farmaci è inteso per il trattamento dei disordini umani, ricerca di base viene eseguita principalmente in tessuti animali. Qui, descriviamo i metodi per studiare ex vivo contrazioni del miometrio umano ottenuti da un intervento chirurgico che può essere utilizzato per affrontare una serie di importanti questioni correlate a uterina fisiologia e patologia, come pure per convalidare le risposte funzionali agli agenti farmacologici noti e romanzo per aiutare lo sviluppo di farmaci. In particolare, si evidenzia l'uso di questo test per studiare la risposta antagonistica di un noto OTR e V1aR antagonista competitivo, atosiban sulle contrazioni myometrial incinta OT-indotta, come pure da stabilire la risposta e il recettore selettività di un nuova concezione V1aR antagonista selettivo, [D-Arg8] INT. Dimostriamo che i parametri farmacocinetici importanti quali CE50 e IC50 possono essere calcolati, che allineare bene con i dati di farmacologia basata sulle celle.
Utilizzo simultaneo di più strisce permette per un confronto diretto di più effetti di agente, esperimenti di competizione con gli antagonisti e i relativi controlli di tempo e veicolo. I nastri sono spesso preparati in gruppi di 2, 4 o 8, questa tecnica fornisce un throughput moderato, le prove di composti di 2 – 4 a 6 – 8 (cumulative) concentrazioni (per biopsia). Questo metodo fornisce anche dati in tempo reale in modo che gli effetti possono essere valutati rapidamente e protocolli possono essere regolate. Inoltre, questa tecnica può essere utilizzata per verificare qualsiasi composto di interesse ed è stata utilizzata con successo da un numero di gruppi di ricerca focalizzato sulla fisiologia myometrial e nella scoperta della droga. Oltre ad analizzare composti puri come descritto in questo documento, il modello di contrattilità uterina è stata anche e può essere utilizzato con successo per schermo per romanzo uterotonic composti da miscele, come preparazioni di erbe da medicina tradizionale7 , 55 , 56.
Anche se questo modello è tecnicamente robusto e Mostra buona riproducibilità, ha alcune limitazioni: dissezione può essere difficile per chi non ha dimestichezza con il tessuto o utilizzando attrezzature di dissezione, quindi nuovi utenti richiederà un certo tempo per ottimizzare il tessuto preparazione e protocolli. Si deve anche osservare che miometrio umano differisce da considerevolmente in apparenza ad altri modelli quali mouse e del ratto. Uteri di roditore la maggior parte sono composti da due corni uterini a forma di tubo, dotate di un'ovaia ad una estremità e si unì alla cervice. Ogni corno ha chiaramente definiti strati muscolari longitudinale e circolare, che possono essere facilmente separati alla dissezione, mentre i tipi di fibra differente nel miometrio umano spesso si intrecciano formando una 'maglia'. Inoltre, i profili di contrazione del miometrio umano sono molto diversi per i roditori. In particolare, le contrazioni nel miometrio umano sono meno frequenti ma più lungo nella durata. Tempi sperimentali per l'utilizzo di miometrio umano pertanto sono spesso molto più lunghi rispetto ai modelli del roditore. Le differenze nell'espressione del recettore tra specie possono anche contribuire a abbastanza marcate differenze nelle risposte agli agonisti e questo dovrebbe essere tenuto in mente se estrapolando i risultati tra le specie.
Ci sono anche un numero di passaggi che devono considerazione per massimizzare l'output da questo sistema. Fasi critiche includono la conservazione della vitalità del tessuto come prendersi cura nella manipolazione di tessuti per evitare eventuali danni inutili durante la dissezione o durante il montaggio. Un occhio esperto è necessario sezionare belle strisce di muscolo uterino, assicurando che l'orientamento delle fibre muscolari è nella direzione longitudinale e seguendo il piano del tessuto, come pure evitando i tessuti cicatriziali, decidua e piccoli vasi. Per fini di orientamento di aiuto una volta che il campione è in laboratorio, è possibile aggiungere un tag (come piccolo punto chirurgico) al momento della raccolta a un lato della biopsia per delineare il bordo serosal dal bordo deciduale.
Tessuti dovrebbero essere tenuti a una costante 36 – 37 ° C durante la sperimentazione come funzione del tessuto è soggetto a variazioni termiche. Ciò può essere ottenuto con un robusto condizionatore d'aria all'interno del laboratorio. Aspersione costante di PSS riscaldato assicura che la temperatura viene mantenuta così come le vampate di calore fuori prodotti di scarto da contrazione. Temperatura all'interno dei bagni dell'organo può essere modificato cambiando la portata o regolando la temperatura del bagno di acqua direttamente. La dimensione di piccola vasca rispetto ai bagni tradizionali 5-50 mL garantisce un relativamente rapido avvicendamento del PSS e l'interruzione dei reagenti. Il bagno di organo miniaturizzati come descritto qui, riduce anche il volume di PSS e reagenti di interesse necessario, riducendo così al minimo i costi e risparmiando prezioso, di recente sviluppato prodotti chimici. Inoltre, a causa delle dimensioni di piccola vasca e utilizzando un tampone HEPES-basato, questo sistema non richiede ossigenazione per esempio, dalla bollitura PSS con carbogen. È importante anche la normalizzazione della tensione applicata alle strisce. Per le strisce di queste dimensioni (5 x 2 x 1 mm), questo dovrebbe essere circa 2 mN (equivalente a ~0.2 g). Metodi alternativi includono l'applicazione di una soluzione di potassio per indurre la contrazione massima e che si estende a metà di questa contrazione massima. Deve essere notato tuttavia, che tensione applicata in vivo possono differire.
Le sfide principali comprendono l'ottenimento di tessuti da soggetti umani, ma anche se faticoso, tessuti umani chiaramente rappresentano il più fisiologicamente rilevante (e gratificante) modello per lo studio della contrazione uterina nella scoperta di droga e la malattia umana. Il tessuto isolato strisce tuttavia, non corrispondono necessariamente a tessuto in vivo come sono esenti per esempio, di ormonale e nervoso in ingresso che, anche se non essenziale per la contrazione, modulerà contrazioni in vivo. Questo test fornisce tuttavia la possibilità di analizzare le contrazioni miometriale in maniera controllata, separata da tali influenze. Permette anche per l'effetto di fattori quali il controllo ormonale di contrazione (ad es., tramite OT, VP, prostaglandine, ecc.) di essere indagati, fornendo indizi per la regolazione della funzione myometrial. Come sono i tessuti ottenuti da donne diverse, c'è naturalmente qualche variazione nei profili contrattili spontanei tra esemplari. Quindi spesso è necessario eseguire esperimenti su un numero elevato (~ n = 10) di campioni per minimizzare la variazione in alcuni DataSet53. Questo è più importante quando si confrontano l'attività contrattile tra diversi gruppi di pazienti. La risposta di agonisti e antagonisti per controllare attività di normalizzazione (cioè, esprimendo in percentuale di attività di controllo o alta K+) riduce alcuni di questa variazione. Inoltre, per ridurre la variazione inter-striscia, dati possono essere normalizzati per area della sezione trasversale della striscia misurando la loro lunghezza e peso post sperimentazione41. Questo è particolarmente utile quando si confrontano i modelli di contrazione tra diversi gruppi di pazienti.
Limitazioni di questa tecnica includono anche l'accesso a tessuti freschi che richiede buone relazioni di lavoro con personale ospedaliero, soprattutto personale del teatro e coloro che sono coinvolti nel processo di consenso. Autorizzazioni etiche dal comitato di revisione comitato etico di ricerca e l'Istituto o ospedale locale anche bisogno di essere a posto. Raccolta di miometrio umano è probabilmente eseguita durante la consegna di CS, quando il donatore è in fase di intervento chirurgico. La biopsia è presa dallo stesso sito di incisione uterina fatto per la consegna del bambino e quindi il paziente non ha bisogno di sottoporsi a qualsiasi ulteriore ulteriori procedure. Personale di teatro e il chirurgo esegue la biopsia hanno bisogno di essere a conoscenza dell'uso successivo dei tessuti e che non devono essere posizionate in soluzioni fissativi ad per quanto riguarda l'invio di un reparto di patologia. Il lasso di tempo lungo sperimentale è un'altra considerazione. Esperimenti con i tessuti umani richiedere molte ore (in genere > 6h) (al contrario di 2 – 3 h per un esperimento simile in utero del ratto o topo), a causa della frequenza più lenta di contrazione e il tempo di ritardo di 2 – 3 h tra tessuto montaggio e istituzione di spontanea contrazioni. Tuttavia, come abbiamo mostrato, contrazioni di tessuto umano sono robuste e quando stabilito può contrarre per molte ore senza notevole affaticamento40.
Questo sistema permette anche altre sfide del lavoro in vivo da superare tra cui la possibilità di testare reagenti farmaceutici sul tessuto incinto. Questa tecnica può essere facilmente estrapolata ad altre specie tra cui mouse per cui i risultati iniziali possono essere confermati prima di procedere ulteriormente in studi animali intero. Cambi controllati in temperatura, composizione del superfusate (PSS) e pH può essere fatto facilmente per simulare diversi scenari in vivo e analizzare l'effetto di queste modifiche il comportamento composto. I principi fondamentali della tensione isometrica in myometrial strisce di misurazione possono essere espanso per misurare i cambiamenti simultanei nella concentrazione di calcio intracellulare o pH mediante l'uso di Ca fluorescente o indicatori di pH (H+) e attrezzatura per rilevare e registrare la fluorescenza57,58,59,60.
Nel complesso, il miometrio umano rappresenta un modello robusto e fisiologicamente rilevante per caratterizzare e convalidare nuovi composti terapeutici nella scoperta della droga — sia composti puri e miscele. Abbiamo fornito esempi del suo utilizzo nella scoperta della droga rispetto al sistema di OT/VP e focalizzata suunaR antagonisti OTR e V1 per mostrare come questo modello può essere utilizzato per determinare l'efficacia di composto e potenza a obiettivi definiti e convalidare selettività ligando. Tuttavia, e ' da tener presente che questa tecnica può essere utilizzato per studiare qualsiasi destinazione di interesse o il percorso che porta a contrazione miometriale (o relax), nonché per facilitare la scoperta di nuovi farmaci di nuovi obiettivi e percorsi e avanzare la nostra comprensione di myometrial fisiologia e patofisiologia.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Questa ricerca è stata sostenuta dal fondo austriaco di scienza (FWF) attraverso il progetto I3243 e del Consiglio europeo della ricerca (CER) nell'ambito Horizon 2020 ricerca dell'Unione europea e programma per l'innovazione (sovvenzione No 714366). CWG è stata sostenuta da un Fellowship di futuro di Australian Research Council (ARC) (FT140100730) e MM da un Fellowship di ARC scoperta precoce carriera ricercatore (DECRA) (DE150100784). SA è supportato da un Harris-benessere pretermine nascita Research Centre Grant amministrato dal benessere delle donne, UK.
Materiali
| Name | Company | Catalog Number | Comments |
| Origin software | Origin Lab | 2015 version | |
| Labscribe Software | WPI | Formally Datatrax | |
| GraphPad Prism graphical software | GraphPad Prism | PRISM 5 | |
| LabTrax 4-Channel Data Acquisition | WPI | LAB-TRAX-4 | |
| Transbridge Transducer Amplifier | WPI | SYS-TBM4M | |
| Force-displacement Transducer | WPI | FORT10g | 10 g |
| BNC to BNC Cable | WPI | 500184 | |
| Magnetic Clamp stand | WPI | M10 | |
| Micrometer | Reconditioned from microscopes | ||
| Peristaltic pump | Gilson | MINIPULS3 | R4 Standard pump head |
| Suction pumps | Various | AP2 air pump | |
| Circulating Water bath | Grant Instruments | TC120 | 5L |
| Perspex Tissue Bath | Custom made | ||
| Water reservoir container | the reallyusefulbox | 7L | |
| Tissue Hooks (fixed) | Hand made in house | ||
| Peristaltic tubing | Gilson | F117948 | PVC 2.79 mm internal diameter |
| Tygon Tubing | Fisher Scientific | various diameters | R-3603 |
| Aluminium clips | Laser services, USA | custom made | |
| Stereo Zoom binocular microscope | WPI | PZMIV | |
| Microscope Fiber-optic Light Source | WPI | PHOTONIC PL 2000 | |
| Dissecting Dishes | Handmade with Sylgard | ||
| Sylgard Silicone Elastomer kit | Dow Corning | Sylgard 170 Kit | |
| Vannas Scissors | WPI | 50086 | 8.5 cm, straight edge |
| Iris Forceps | WPI | 15914 | 10 cm, straight edge (serrated) |
| Dissecting scissors | WPI | 14393 | 10 cm, straight |
| Dissecting pins | SIGMA | Z192341 | B-D precision guide syringe needle 30G |
| HBSS | SIGMA | H9269 | |
| Physiological Salt Solution | SIGMA | various | PSS |
| Oxytocin acetate salt | SIGMA | O6379 | |
| [Arg8]-vasopressin acetate salt | SIGMA | V9879 |
Riferimenti
- Hughes, J. P., Rees, S., Kalindjian, S. B., Philpott, K. L. Principles of early drug discovery. Br J Pharmacol. 162 (6), 1239-1249 (2011).
- Michelini, E., Cevenini, L., Mezzanotte, L., Coppa, A., Roda, A. Cell-based assays: fuelling drug discovery. Anal Bioanal Chem. 398 (1), 227-238 (2010).
- Wray, S. Insights into the uterus. Exp Physiol. 92 (4), 621-631 (2007).
- Wray, S., Kupittayanant, S., Shmygol, A., Smith, R. D., Burdyga, T. The physiological basis of uterine contractility: a short review. Exp Physiol. 86 (2), 239-246 (2001).
- Matthew, A., Shmygol, A., Wray, S. Ca2+ entry, efflux and release in smooth muscle. Biol Res. 37 (4), 617-624 (2004).
- Wray, S., et al. Calcium signaling and uterine contractility. J Soc Gynecol Investig. 10 (5), 252-264 (2003).
- Gruber, C. W., O'Brien, M. Uterotonic plants and their bioactive constituents. Planta medica. 77 (3), 207-220 (2011).
- Maul, H., Maner, W. L., Olson, G., Saade, G. R., Garfield, R. E. Non-invasive transabdominal uterine electromyography correlates with the strength of intrauterine pressure and is predictive of labor and delivery. J Matern Fetal Neonatal Med. 15 (5), 297-301 (2004).
- Newman, R. B. Uterine contraction assessment. Obstet Gynecol Clin North Am. 32 (3), 341-367 (2005).
- Haran, G., Elbaz, M., Fejgin, M. D., Biron-Shental, T. A comparison of surface acquired uterine electromyography and intrauterine pressure catheter to assess uterine activity. Am J Obstet Gynecol. 206 (5), 412-e415 (2012).
- Condon, J., et al. Telomerase immortalization of human myometrial cells. Biol Reprod. 67 (2), 506-514 (2002).
- Soloff, M. S., et al. Immortalization and characterization of human myometrial cells from term-pregnant patients using a telomerase expression vector. Mol Hum Reprod. 10 (9), 685-695 (2004).
- Buxton, I. L., Vittori, J. C. Cholesterol depletion enhances both spontaneous and agonist-evoked uterine smooth muscle contractions in a reversible manner. Proc West Pharmacol Soc. 48, 126-128 (2005).
- Matthew, A., Kupittayanant, S., Burdyga, T., Wray, S. Characterization of contractile activity and intracellular Ca2+ signalling in mouse myometrium. Journal of the Society for Gynecologic Investigation. 11 (4), 207-212 (2004).
- Heaton, R. C., Taggart, M. J., Wray, S. The effects of intracellular and extracellular alkalinization on contractions of the isolated rat uterus. Pflugers Arch. 422 (1), 24-30 (1992).
- Hutchings, G., Deprest, J., Nilius, B., Roskams, T., De Ridder, D. The effect of imatinib mesylate on the contractility of isolated rabbit myometrial strips. Gynecol Obstet Invest. 62 (2), 79-83 (2006).
- Wilson, R. J., Allen, M. J., Nandi, M., Giles, H., Thornton, S. Spontaneous contractions of myometrium from humans, non-human primate and rodents are sensitive to selective oxytocin receptor antagonism in vitro. BJOG. 108 (9), 960-966 (2001).
- Choudhury, S., Garg, S. K., Singh, T. U., Mishra, S. K. Functional and molecular characterization of maxi K+ -channels (BK(Ca)) in buffalo myometrium. Anim Reprod Sci. 126 (3-4), 173-178 (2011).
- Smith, R. C., McClure, M. C., Smith, M. A., Abel, P. W., Bradley, M. E. The role of voltage-gated potassium channels in the regulation of mouse uterine contractility. Reprod Biol Endocrinol. 5, 41 (2007).
- Jones, K., Shmygol, A., Kupittayanant, S., Wray, S. Electrophysiological characterization and functional importance of calcium-activated chloride channel in rat uterine myocytes. Pflugers Arch. 448 (1), 36-43 (2004).
- Popescu, L. M., et al. Imatinib inhibits spontaneous rhythmic contractions of human uterus and intestine. Eur J Pharmacol. 546 (1-3), 177-181 (2006).
- Taggart, M. J., Wray, S. Contribution of sarcoplasmic reticular calcium to smooth muscle contractile activation: gestational dependence in isolated rat uterus. J Physiol. 511 (Pt 1), 133-144 (1998).
- McCallum, L. A., Pierce, S. L., England, S. K., Greenwood, I. A., Tribe, R. M. The contribution of Kv7 channels to pregnant mouse and human myometrial contractility. J Cell Mol Med. 15 (3), 577-586 (2011).
- Bernstein, K., et al. Calcium-activated chloride channels anoctamin 1 and 2 promote murine uterine smooth muscle contractility. Am J Obstet Gynecol. , (2014).
- Khan, R. N., Morrison, J. J., Smith, S. K., Ashford, M. L. Activation of large-conductance potassium channels in pregnant human myometrium by pinacidil. Am J Obstet Gynecol. 178 (5), 1027-1034 (1998).
- Phillippe, M., Basa, A. Effects of sodium and calcium channel blockade on cytosolic calcium oscillations and phasic contractions of myometrial tissue. J Soc Gynecol Investig. 4 (2), 72-77 (1997).
- Ausina, P., et al. Effect of inhibition of the electrogenic Na+/K+ pump on the mechanical activity in the rat uterus. Fundam Clin Pharmacol. 10 (1), 38-46 (1996).
- Melin, P., Trojnar, J., Johansson, B., Vilhardt, H., Akerlund, M. Synthetic antagonists of the myometrial response to vasopressin and oxytocin. J Endocrinol. 111 (1), 125-131 (1986).
- Hahn, D. W., et al. Evaluation of 1-deamino-[D-Tyr(Oethyl)2, Thr4, Orn8] vasotocin, an oxytocin antagonist, in animal models of uterine contractility and preterm labor: a new tocolytic agent. Am J Obstet Gynecol. 157 (4 Pt 1), 977-982 (1987).
- Demarest, K. T., et al. Profile of an oxytocin antagonist, RWJ 22164 for treatment of preterm labor in laboratory models of uterine contractility. American journal of perinatology. 6 (2), 200-204 (1989).
- Goodwin, T. M., et al. The pharmacokinetics of the oxytocin antagonist atosiban in pregnant women with preterm uterine contractions. Am J Obstet Gynecol. 173 (3 Pt 1), 913-917 (1995).
- Goodwin, T. M., et al. The effect of the oxytocin antagonist atosiban on preterm uterine activity in the human. Am J Obstet Gynecol. 170 (2), 474-478 (1994).
- Goodwin, T. M., et al. Treatment of preterm labor with the oxytocin antagonist atosiban. American journal of perinatology. 13 (3), 143-146 (1996).
- Romero, R., et al. An oxytocin receptor antagonist (atosiban) in the treatment of preterm labor: a randomized, double-blind, placebo-controlled trial with tocolytic rescue. Am J Obstet Gynecol. 182 (5), 1173-1183 (2000).
- Norstrom, A., Andersson, A., Vilhardt, H. Contractile effect of oxytocin and 1-deamino-1-carba-2-tyrosine (0-methyl)-oxytocin in myometrial tissue from non-pregnant and term pregnant women. Acta Endocrinol (Copenh). 122 (5), 566-568 (1990).
- Atke, A., Vilhardt, H. Uterotonic activity and myometrial receptor affinity of 1-deamino-1-carba-2-tyrosine(O-methyl)-oxytocin. Acta Endocrinol (Copenh). 115 (1), 155-160 (1987).
- Hunter, D. J., Schulz, P., Wassenaar, W. Effect of carbetocin, a long-acting oxytocin analog on the postpartum uterus. Clin Pharmacol Ther. 52 (1), 60-67 (1992).
- Moraitis, A. A., Cordeaux, Y., Charnock-Jones, D. S., Smith, G. C. The Effect of an Oxytocin Receptor Antagonist (Retosiban, GSK221149A) on the Response of Human Myometrial Explants to Prolonged Mechanical Stretch. Endocrinology. 156 (10), 3511-3516 (2015).
- Al-Qahtani, S., et al. Diabetes is associated with impairment of uterine contractility and high Caesarean section rate. Diabetologia. 55 (2), 489-498 (2012).
- Arrowsmith, S., Neilson, J., Bricker, L., Wray, S. Differing In Vitro Potencies of Tocolytics and Progesterone in Myometrium From Singleton and Twin Pregnancies. Reprod Sci. 23 (1), 98-111 (2016).
- Arrowsmith, S., Quenby, S., Weeks, A., Burdyga, T., Wray, S. Poor spontaneous and oxytocin-stimulated contractility in human myometrium from postdates pregnancies. PloS one. 7 (5), e36787 (2012).
- Arrowsmith, S., Robinson, H., Noble, K., Wray, S. What do we know about what happens to myometrial function as women age?. J Muscle Res Cell Motil. 33 (3-4), 209-217 (2012).
- Quenby, S., Matthew, A., Zhang, J., Dawood, F., Wray, S. In vitro myometrial contractility reflects indication for caesarean section. BJOG. 118 (12), 1499-1506 (2011).
- Turton, P., et al. A comparison of the contractile properties of myometrium from singleton and twin pregnancies. PloS one. 8 (5), e63800 (2013).
- Zhang, J., Bricker, L., Wray, S., Quenby, S. Poor uterine contractility in obese women. BJOG. 114 (3), 343-348 (2007).
- Higgins, C. A., et al. Maternal obesity and its relationship with spontaneous and oxytocin-induced contractility of human myometrium in vitro. Reprod Sci. 17 (2), 177-185 (2010).
- Crankshaw, D. J., O'Brien, Y. M., Crosby, D. A., Morrison, J. J. Maternal body mass index and spontaneous contractility of human myometrium in pregnancy. J Perinatol. 37 (5), 492-497 (2017).
- Luckas, M. J., Wray, S. A comparison of the contractile properties of human myometrium obtained from the upper and lower uterine segments. BJOG. 107 (10), 1309-1311 (2000).
- Chapman, N. R., Kennelly, M. M., Harper, K. A., Europe-Finner, G. N., Robson, S. C. Examining the spatio-temporal expression of mRNA encoding the membrane-bound progesterone receptor-alpha isoform in human cervix and myometrium during pregnancy and labour. Mol Hum Reprod. 12 (1), 19-24 (2006).
- Robson, S. C., Simpson, H., Ball, E., Lyall, F., Bulmer, J. N. Punch biopsy of the human placental bed. Am J Obstet Gynecol. 187 (5), 1349-1355 (2002).
- Popat, A., Crankshaw, D. J. Variable responses to prostaglandin E(2) in human non-pregnant myometrium. Eur J Pharmacol. 416 (1-2), 145-152 (2001).
- Arrowsmith, S., Neilson, J., Wray, S. The combination tocolytic effect of magnesium sulfate and an oxytocin receptor antagonist in myometrium from singleton and twin pregnancies. Am J Obstet Gynecol. 215 (6), 789-e789 (2016).
- Crankshaw, D. J., Morrison, J. J. Methodology and pharmacological analysis of effects of uterotonic compounds in human myometrium in vitro. Am J Obstet Gynecol. 205 (2), 155-e156 (2011).
- Di Giglio, M. G., et al. Development of a human vasopressin V1a-receptor antagonist from an evolutionary-related insect neuropeptide. Sci Rep. 7, 41002 (2017).
- Attah, A. F., et al. Ethnobotanical survey of Rinorea dentata (Violaceae) used in South-Western Nigerian ethnomedicine and detection of cyclotides. J Ethnopharmacol. 179, 83-91 (2016).
- Koehbach, J., et al. Oxytocic plant cyclotides as templates for peptide G protein-coupled receptor ligand design. Proc Natl Acad Sci U S A. 110 (52), 21183-21188 (2013).
- Taggart, M. J., Burdyga, T., Heaton, R., Wray, S. Stimulus-dependent modulation of smooth muscle intracellular calcium and force by altered intracellular pH. Pflugers Arch. 432 (5), 803-811 (1996).
- Luckas, M. J., Taggart, M. J., Wray, S. Intracellular calcium stores and agonist-induced contractions in isolated human myometrium. Am J Obstet Gynecol. 181 (2), 468-476 (1999).
- Parratt, J. R., Taggart, M. J., Wray, S. Functional effects of intracellular pH alteration in the human uterus: simultaneous measurements of pH and force. J Reprod Fertil. 105 (1), 71-75 (1995).
- Taggart, M., Wray, S. Simultaneous measurement of intracellular pH and contraction in uterine smooth muscle. Pflugers Arch. 423 (5-6), 527-529 (1993).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon