Method Article
Visualizzare il nodo e la piastra Notochordal In embrioni di topo Gastrulating mediante microscopia elettronica a scansione e intero Monte immunofluorescenza
In questo articolo
Riepilogo
Il nodo e la piastra notochordal sono transitori organizzatori nello sviluppo di embrioni del mouse che possono essere visualizzati utilizzando diverse tecniche di segnalazione. Qui, descriviamo in dettaglio come eseguire due delle tecniche per studiare la loro struttura e morfogenesi: 1) microscopia elettronica (SEM); e 2) intero supporto immunofluorescenza (WMIF).
Abstract
L'embrione di topo post-impianto subisce cambiamenti principali forma dopo l'inizio della gastrulazione e morfogenesi. Un segno distintivo della morfogenesi è la formazione degli organizzatori transitori, il nodo e la piastra notochordal, dalle cellule che hanno attraversato la linea primitiva. La formazione adeguata di questi centri di segnalazione è essenziale per lo sviluppo del piano corpo e tecniche di visualizzarli sono di grande interesse ai biologi inerente allo sviluppo del mouse. Il nodo e la piastra notochordal si trovano sulla superficie ventrale degli embrioni del mouse gastrulating intorno (E) 7.5 dello sviluppo embrionale del giorno. Il nodo è una struttura a forma di Coppa, le cui cellule possiedono un singolo Cilio snello. La corretta localizzazione subcellulare e la rotazione delle ciglia nella fossa nodo determina asimmetria sinistra-destra. Le cellule di notochordal piastra possiedono anche singole ciglia, seppur più brevi di quelli delle cellule del nodo. La piastra notochordal forma la notocorda che agisce come un organizzatore di segnalazione importante per somitogenesis e patterning neurale. Perché le cellule del nodo e notochordal piastra sono transitoriamente presente sulla superficie e possiedono ciglia, possono essere visualizzate mediante microscopia elettronica a scansione (SEM). Tra le altre tecniche utilizzate per visualizzare queste strutture a livello cellulare è intero supporto immunofluorescenza (WMIF) usando gli anticorpi contro le proteine che sono altamente espressi nel nodo e piastra notochordal. In questo rapporto, descriviamo i nostri protocolli ottimizzati per eseguire SEM e WMIF del nodo e notochordal piastra in embrioni di topo in via di sviluppo per aiutare nella valutazione della forma del tessuto e organizzazione nel selvaggio-tipo ed embrioni mutanti gastrulazione.
Introduzione
Gastrulazione e i movimenti morfogenetici accompagnamento sono cruciali per modellare l' embrione del mouse1. I cambiamenti nella forma cellulare e organizzazione durante la morfogenesi dettano informazioni posizionali per regolare il destino delle cellule e consentire anche le vie di segnalazione che ne derivano precisamente eseguire le loro funzioni per diversificare la neonata germe strati1. La formazione organizzando strutture e segnalazione centri quali il nodo e la notocorda transitori è essenziale per l'esecuzione del programma di sviluppo2. Biologi inerente allo sviluppo hanno usato una varietà di tecniche per studiare la morfogenesi di queste strutture, più notevole dei quali è l'uso di cellulare reporter e live ex vivo imaging per seguire la dinamica nel comportamento cellulare e subcellulare2 ,3,4. In questo rapporto, ci concentriamo su che descrive i dettagli dei nostri protocolli ottimizzati per due di queste tecniche: microscopia elettronica (SEM) e intero supporto immunofluorescenza (WMIF), che erano e sono ancora strumentale nello studiare la morfogenesi del nodo e la piastra notochordal, il precursore della notocorda.
Il nodo embrionale del mouse è una tazza teardrop-a forma di cellule che si trova sulla superficie ventrale dell'embrione del mouse intorno all'inizio di fasi ritardate di testa piega durante la gastrulazione e morfogenesi (giorno embrionale, E7.5-E8)2,5, 6,7. La piastra notochordal morfologicamente emana anteriormente dal nodo3. Ogni cellula nel nodo e notochordal piastra è caratterizzata da un singolo Cilio che sporge verso l'esterno, che è più lungo nelle cellule del nodo ma la cui lunghezza varia con la fase inerente allo sviluppo2. La rotazione delle ciglia nella fossa nodo ha dimostrata di essere importante per la segnalazione che determina asimmetria sinistra-destra4. La piastra notochordal è il precursore della notocorda, il centro di segnalazione che è importante per la campitura di somiti adiacente e la sovrastante tubo neurale3.
A causa degli attributi di posizione (superficie), forma (Coppa) e che possiede strutture cellulari esterni distinti (ciglia), SEM è stato tradizionalmente usato per visualizzare il nodo e la piastra notochordal e studiare la loro formazione e struttura2, 7. SEM è anche usato per studiare i cambiamenti nella struttura del nodo stesso o le ciglia sulle sue cellule in mutazioni che colpiscono la gastrulazione, morfogenesi, nonché ciglia formazione8,9,10. SEM è una tecnica che utilizza un fascio focalizzato di elettroni per interrogare l'ultrastruttura topologica della superficie esterna dei materiali quali campioni biologici11. L'esempio è solitamente fisso, essiccato e poi Polverizzi rivestite con metalli per osservazione sotto un microscopio elettronico a scansione come descriviamo nel passaggio 1.
WMIF è una tecnica di colorazione per visualizzare i prodotti del gene, come le proteine, in tre dimensioni (3D). WMIF di tessuti, organi o addirittura interi organismi fornisce informazioni spaziali sulla distribuzione del segnale e la forma della struttura risultante in 3D. La tecnica si basa sull'esempio quindi macchiarla con i coniugati fluorescenti di fissaggio. Embrioni di topo ~ E7.5 sono piccole e trasparenti e quindi ideale per protocolli WMIF per visualizzare il nodo e la piastra notochordal. Ad esempio, il fattore di trascrizione Barchyury (T) è espresso nei nuclei del nodo e piastra notochordal e in misura minore in linea primitiva, intorno E7.5-E8 di sviluppo embrionale e buon lavoro anticorpi contro T di WMIF sono commercialmente disponibili e rendere possibile la procedura di colorazione. Le cellule del nodo e piastra notochordal sono anche caratterizzate da superfici apicale ristrette, che si affacciano all'esterno e quindi possono essere macchiate con falloidina fluorescenza-coniugato al segno di F-actina le costrizioni apicali. Utilizzando questi reagenti come esempi, la combinazione di T e F-actina che macchia di WMIF fornisce una rappresentazione del nodo e piastra notochordal in 3D in embrioni di topo gastrulating come dimostriamo nel passaggio 2 8. Tuttavia, marcatori di ciglia, come ARL13B o tubulina acetilata, nonché altri marcatori del nodo e piastra notochordal, ad esempio FOXA2, utilizzabile anche per eseguire WMIF su sviluppo del mouse embrioni3,4.
Abbiamo dimostrato che striatin-interacting protein 1 (STRIP1) è essenziale per la normale gastrulazione e morfogenesi in embrione del mouse8. STRIP1 è un componente fondamentale dei striatin-interazione fosfatasi e complessi di chinasi (STRIPAK), che noi ed altri abbiamo implicato nell'actina citoscheletrica organizzazione8,12. Un difetto di rilievo negli embrioni mutanti Strip1 è nella formazione del mesoderma assiale (nodo e notochordal piastra) ed estensione dell'asse antero-posteriore corpo. Abbiamo usato SEM e WMIF per analizzare il nodo e la piastra notochordal in wild-type (WT) e Strip1 mutanti embrioni come mostriamo nei Risultati rappresentante e cifre corrispondenti.
Protocollo
Tutti gli esperimenti che coinvolgono gli esperimenti sugli animali sono stati approvati dalle autorità responsabili in Nord Reno Westfalia (LANUV-NRW).
1. microscopia elettronica del nodo embrionale del Mouse
- Sacrificare il mouse femmina incinto a ~ E7.5 (2-4 fase somite) di dislocazione cervicale. Una spiegazione dettagliata con diagrammi di passaggi 1.1 - 1.7 è disponibile in mouse embrione laboratorio manuali13.
- Aprire l'addome attraverso la pelle e mesenteries e rimuovere l'utero con delle forbici, una pinzetta.
- Sciacquare l'utero brevemente in acqua distillata e posizionarlo in un piccolo piatto di Petri pulita (6 cm) contenente 1x tampone fosfato salino (PBS).
- Sotto un microscopio per dissezione e utilizzando una pinzetta, rimuovere i muscoli uterini per liberare il deciduae individuali o siti di impianto.
- Tenere ogni decidua con un paio di pinze e utilizzare l'altra coppia per fare un'incisione longitudinale di pieno-spessore tra la parte rossa (futura placenta) e la parte bianca (dove si trova l'embrione). Fare perforazioni superficiali verticalmente lungo la parte bianca della decidua contigui con l'incisione. Separare la decidua orizzontalmente in due metà e scoop attentamente l'embrione nella parte bianca della decidua.
- Trasferire l'embrione di un nuovo piatto di Petri (35 mm) con PBS sterile filtrata fresca. Ripetere per tutti gli embrioni e deciduae.
- Rimuovere la membrana di Reichert, una membrana relativamente opaca inghiottendo l'embrione, da ogni embrione di prendere in giro e via come un calzino a partire al cono ectoplacental (sito di impianto rossastro). Per la genotipizzazione, prendere un piccolo pezzo (~ 0.1 mm2) del sacco vitellino in questa fase.
- Sotto una cappa chimica e protezioni adeguate (guanti), è possibile trasferire gli embrioni per EM grado fissativo composto da 2,5% glutaraldeide in PBS sterile filtrata in un tubo del microcentrifuge (1,5 mL) a temperatura ambiente. Difficoltà gli embrioni durante la notte a 4 ° C.
- Con attenzione rimuovere il fissativo di glutaraldeide dal tubo senza toccare gli embrioni e gettarla in un adeguato contenitore per rifiuti. Lavare gli embrioni tre volte in PBS sterile filtrata, per 15 minuti ciascuno, a temperatura ambiente.
- Disidratare gli embrioni in una serie di etanolo per 5 minuti ciascuno: 50%, 70%, 85% e tre volte in 100% o etanolo assoluto. Conservare gli embrioni a − 20 ° C in etanolo o procedere direttamente al passaggio successivo.
- Trasferire gli embrioni in etanolo per cesti per punto critico (CPD) di asciugatura in asciugatrice un punto critico. Riempire la camera con etanolo per coprire completamente i cestini.
- Scambiare l'etanolo sciacquando accuratamente con liquido CO2 per dieci volte a 10 ° C. Defluire liquidi CO2 dopo l'ultimo passaggio fino a quando la camera è mezzo piena. Riscaldare fino a 40 ° C fino a quando la pressione raggiunge 80 bar (punto critico) e il liquido di CO2 passa a gas. Attendere 10 min e poi lentamente soffiare fuori il gas sopra circa 45 min.
- Come alternativa più semplice alla CPD per essiccazione, aggiungere esametildisilazano (HMDS) con un rapporto di 1:1 per gli embrioni in etanolo per 30 min. Quindi trasferire gli embrioni a puro HMDS per 30 min. Rimuovi gli embrioni fuori il liquido utilizzando una pipetta e lasciarli asciugare per 30 min.
Nota: Entrambi i metodi di essiccazione lavorano altrettanto bene nelle nostre mani. - Utilizzare un pennello fine per montare gli embrioni secchi con il lato ventrale (nodo) a uno stub di SEM con nastro biadesivo.
- Inserire gli stub con gli embrioni in una macchina di rivestimento di polverizzazione per rivestimento di particelle d'oro, che è preferita per caricare le ciglia lunghe e sottili. Applicare uno strato di 120-150 Å; il tempo è dipendente dalla corrente, che varia con ogni campione.
- Inserire gli stub rivestiti con embrioni in un microscopio SEM, applicare il vuoto e osservare il nodo embrionale e piastra notochordal cellule con ciglia ad ingrandimenti che vanno da 1000 X a 15, 000 X.
2. intero Monte immunofluorescenza del Mouse nodo e piastra Notochordal
- Con PBS ghiacciata con 0.05% Tween 20 (PBSTw), seguire la procedura 1.1-1.7 sopra per rimuovere gli embrioni a E7.75 e metterli in PBSTw in una capsula di Petri sul ghiaccio da 35 mm.
- Sotto una cappa chimica e protezioni adeguate (guanti), è possibile trasferire gli embrioni per una soluzione fissante di paraformaldeide al 4% in PBS in una microcentrifuga. Difficoltà gli embrioni durante la notte a 4 ° C.
- Con attenzione rimuovere il fissativo del paraformaldeide dal tubo senza toccare gli embrioni e gettarla in un adeguato contenitore per rifiuti. Lavare gli embrioni tre volte in PBS contenente 0,2% Triton X-100 (PBSTr) per 5 minuti ciascuno, a temperatura ambiente. Eseguire tutti i lavaggio e fasi di incubazione successiva su un agitatore oscillante.
- Rimuovere l'ultimo lavaggio e aggiungere soluzione bloccante contenente PBSTr con 10% siero inattivato per calore (da specie ospiti dell'anticorpo secondario). Blocco da 2 h a una notte (o più) su un nutator a 4 ° C.
- Rimuovere il blocco e aggiungere ~ 1 mL di anticorpo primario diluito in soluzione, ad esempio un anticorpo anti-T a una diluizione 1: 500 di blocco. Incubare per una notte (o più) su un nutator a 4 ° C.
- Rimuovere l'anticorpo primario e salvarlo per un uso successivo con l'aggiunta di sodio azide a una concentrazione finale dello 0,02% (1 µ l di brodo di 20% per 1 mL di soluzione di anticorpo). L'anticorpo può essere riutilizzato ~ 10 volte. Sciacquare gli embrioni due volte con PBSTr e poi lavarli tre volte per 30 minuti ciascuno, su un nutator a 4 ° C.
- Sostituire il lavaggio con un anticorpo secondario coniugato a fluorescenza, contro la specie ospite di anticorpo primario, diluito a ~ 1: 1000 una notte (o più) su un nutator a 4 ° C.
- Rimuovere l'anticorpo secondario e lavare due volte con PBSTr, quindi lavare tre volte per 30 min con PBSTr.
- Sostituire l'ultimo lavaggio con PBSTr contenente 1: 500 falloidina coniugata a fluorescenza, a macchia di F-actina e 1: 1000 DAPI, per macchiare i nuclei, per 1 h a temperatura ambiente.
- Sciacquare due volte in PBSTr e lavare una volta con PBSTr per 30 min a temperatura ambiente.
- Sostituire PBSTr con PBS e lasciare gli embrioni su ghiaccio. Preparare vetrini puliti positivamente (60 x 24 mm) e coprioggetti (24 x 24 mm) e mezzi di montaggio glicerolo-base acquosa, ad esempio, 90% glicerolo in 1xPBS e un reagente antifade, montare gli embrioni.
- Mettere due pezzi di nastro adesivo trasparente ad una distanza di ~ 15 mm da altro sulla parte chiara della diapositiva. Questo creerà abbastanza spazio 3D (nella dimensione Z) che consentirebbe appiattimento degli embrioni, ma non completamente loro schiacciamento.
- Sotto un microscopio per dissezione, spostare con cautela gli embrioni utilizzando una pipetta P200 tagliata (per consentire spazio sufficiente per l'embrione da trasferire e non danneggiato) alla diapositiva.
- Utilizzando una pinzetta, fare due tagli completo sui fianchi laterali del sacco vitellino a svilupparsi l'embrione. Posizionare l'embrione con il lato ventrale (nodo e piastra notochordal) fino (dorsale del tubo neurale giù sulla diapositiva).
- Aggiungere 50 µ l di supporti di montaggio sull'embrione. Posizionare gli embrioni di 4-5 per ogni diapositiva. Aggiungere una piccola quantità di montaggio media al lato del coprivetrino che sarà prima toccare la diapositiva (lato superiore o inferiore), quindi posizionarlo a cavallo tra i due pezzi di nastro e abbassarlo lentamente sugli embrioni utilizzando una pinzetta o un ago sottile piegato, evitando la creazione di bolle d'aria.
- Pulire il supporto di montaggio in eccesso utilizzando un panno assorbente. Fare attenzione a non spostare il vetrino coprioggetto nel processo.
- Utilizzando una generosa quantità di smalto per unghie, sigillare i lati del coprivetrino senza spostarlo.
- Osservare sotto un microscopio confocale.
Risultati
Al fine di esaminare la formazione del nodo in embrioni mutanti WT e Strip1 a ~ E7.5, abbiamo usato SEM come descritto nel passaggio 1 e mostrato in Figura 18. I dettagli ultrastrutturali della topologia esterno utilizzando SEM erano abbastanza informativi e fu subito chiaro che, a differenza del pozzo-a forma di nodo negli embrioni di WT, gli embrioni mutanti avevano un nodo appiattito e irregolare. Maggiore ingrandimento degli embrioni ha mostrato le ciglia caratteristiche sulle cellule del nodo che li identificato senza ambiguità. La densità apparente inferiore delle ciglia nel mutante potrebbe essere attribuibile alla perdita di struttura del pozzo di nodi e curvatura o un numero inferiore di cellule del nodo. La piastra notochordal che appare che emana dal nodo era anche irregolare negli embrioni mutanti. Essi erano identificabili con loro ciglia più brevi. Di conseguenza, SEM era importante per rivelare i difetti della morfogenesi di nodo in Strip1 mutanti8. Abbiamo anche utilizzato SEM negli studi precedenti per mostrare l'assenza di ciglia nel nodo embrionale di mutanti che mancava centrioli, che forniscono il modello per ciglia9.
Per studiare i difetti di formazione del mesoderma assiale negli embrioni mutanti di Strip1 a livello cellulare, abbiamo usato WMIF come descritto nel passaggio 2 ed è mostrata nella Figura 2. Utilizzando questa tecnica, il nodo e la piastra notochordal sono stati identificati facilmente di F-actina e la macchiatura di T. Nodo WT e piastra notochordal cellule hanno ristretto apicale domini dove F-actina è stata arricchita e la macchiatura nucleare T era evidente. La piastra notochordal esteso rostralmente nel WT, ma era breve e irregolare nel mutante. I dati hanno mostrato che l'organizzazione di F-actina è anormale nei diversi strati germinali degli embrioni mutanti tra cui il mesoderma assiale8. Così, WMIF era strumentale per studiare i difetti nel nodo e formazione di piastra notochordal negli embrioni mutanti Strip1 .
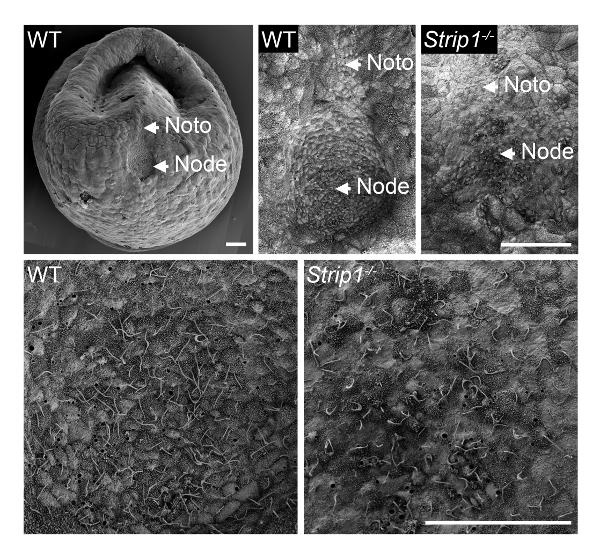
Figura 1 . Microscopia elettronica a scansione rivela i difetti nella morfogenesi del nodo in embrioni di topo mutante Strip1 . (In alto) Analisi SEM di nodi embrionali ventrali mutanti WT e Strip1 e piastre notochordal (Noto)8. A sinistra è riportato un esempio di un'immagine a basso ingrandimento di un embrione WT. (In basso) Ingrandimenti superiori del centro dei nodi sulla cima rivelando la lunga monocilia sporgenti dalle cellule del nodo. Anteriore è in tutti i pannelli. Scala bar: 30 µm. Clicca qui per visualizzare una versione più grande di questa figura.
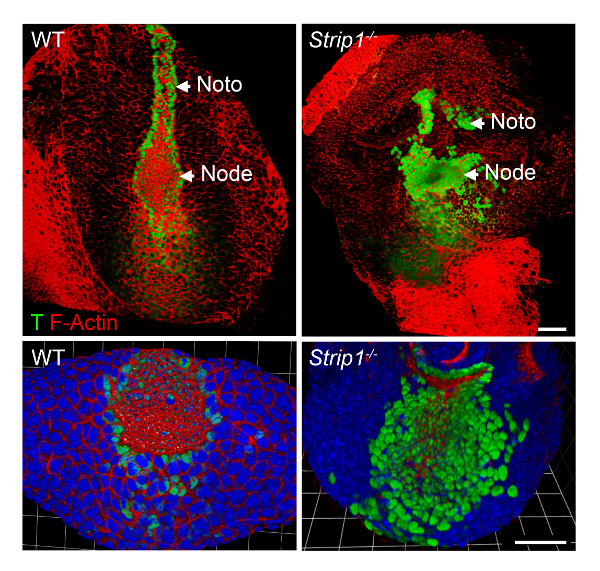
Figura 2 . Intero supporto immunofluorescenza Mostra il nodo anormale e notochordal piatto a livello cellulare in embrioni mutanti Strip1 . (In alto) Ventrale 3D rendering (Volocity software) di WMIF sull'embrione mutante WT e Strip1 usando una combinazione di fluorescenza-coniugato falloidina (F-actina, rosso) e T la macchiatura dell'anticorpo (verde). (In basso) Ulteriori esempi della colorazione mostrato sopra concentrandosi sul nodo con un alto livello zoom e compreso DAPI. Anteriore è in tutti i pannelli. Scala bar: 30 µm. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
In questo lavoro, dimostriamo come eseguire SEM e WMIF per visualizzare il nodo embrionale del mouse e notochordal piatto. Le piccole dimensioni degli embrioni del mouse gastrulating ~ E7.5 e la presenza di queste strutture sulla superficie li rendono ideali per studiare utilizzando le tecniche descritte2,7,8. La disponibilità di anticorpi buoni, ad esempio indicatori di T e le ciglia, dà informazioni 3D eccellente utilizzando WMIF sulla struttura, organizzazione e formazione di questi organizzatori embrionali essenziali8.
Perché lo sviluppo embrionale del mouse procede ad un ritmo molto rapido e il nodo e la piastra notochordal sono solo transitoriamente presenti sulla superficie dell'embrione, il tempismo è essenziale per il successo di questi esperimenti2,3. Ad esempio, 2-4 somite embrioni sono buoni per l'analisi di SEM di un pozzo di nodo maturo con lunghe ciglia. Negli embrioni molto prima o dopo (ad esempio, 12 ore prima o dopo), il nodo potrebbe non essere presente sulla superficie. WMIF è un po' più flessibile in questo senso, ma le strutture stesse sono anche transitorie durante lo sviluppo e la tempistica dipende in questo caso gli interessi dei ricercatori.
La purezza dei reagenti è inoltre essenziale per il successo di queste tecniche, soprattutto nel sondaggio l'ultrastruttura di SEM. Tiny impurità che si attaccano agli embrioni solitamente determinare artefatti di enormi.
Abbiamo provato due diversi metodi di fissazione dell'embrione per SEM uno utilizzando fissativo di mezza Karnowski (glutaraldeide al 2,5%, 2% di paraformaldeide e 0,1 M di tampone cacodilato) e una più semplice 2,5% glutaraldeide in PBS 1X. Preferiamo usare la glutaraldeide e fissativo PBS come descritto nel passaggio 1, tuttavia, noi ed altri abbiamo utilizzato anche fissativo di Karnofsky mezza con successo per SEM
Abbiamo anche confrontato due metodi di essiccazione gli embrioni per SEM e non trovato alcuna differenza nella qualità del campione utilizzando un punto critico asciugacapelli o HMDS come descritto nel passaggio 1 e segnalati altrove14.
Per il passaggio 2, abbiamo testato l'incorporamento degli embrioni dopo i passaggi di lavaggio finale a bassa fusione agarosio all'1% montato su un piatto fondo di vetro 35mm e quindi topping con ~ 10 µ l di soluzione di montaggio. Questo metodo di incorporamento funziona e conserva l'originale struttura 3D dell'embrione e strutture associate; Tuttavia, per il campione di immagine perché un normale microscopio confocale non può raggiungere in profondità in embrioni intatti è necessaria un microscopio multifotonica (~ 1 mm).
Riteniamo che con queste due tecniche dà informazioni complementari sulla struttura del nodo e la piastra notochordal durante lo sviluppo normale e nei mutanti che mostrano difetti nella formazione di queste strutture.
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
M.P. è supportato dal finanziamento di avvio dalla facoltà di medicina e SFB829 dell'Università di Colonia. C.X. è supportato da DFG concedere BA 5810/1-1. Vorremmo ringraziare i servizi di Imaging presso il centro di ricerca CECAD e Memorial Sloan Kettering Cancer Center (New York, USA). Ringraziamo Joaquín Grego-Bessa (centro nazionale spagnolo per la ricerca cardiovascolare, Madrid, Spagna) per la sua intuizione il montaggio gli embrioni per WMIF.
Materiali
| Name | Company | Catalog Number | Comments |
| 1,1,1,3,3,3 Hexamethyldisilazane (HMDS) | Carl Roth | 3840 | |
| Anti-T antibody | R&D Systems | AF2058 | |
| Critical Point Dryer | Blazers Union | CPD 020 | |
| DAPI | AppliChem | A4099,0005 | |
| Glutardialdehyde solution 25% | Merck | 1042390250 | |
| Triton X-100 | Sigma Aldrich | X100-100ML | |
| Tween 20 | AppliChem | A4974,0500 | |
| SEM coating unit PS3 | Agar Aids for Electron Microscopy | PS3 | |
| SEM microscope Quantum FEG 250 | ThermoFisher Scientific (FEI) | Quantum FEG 250 |
Riferimenti
- Rivera-Pérez, J. A., Hadjantonakis, A. K. The dynamics of morphogenesis in the early mouse embryo. Cold Spring Harbor Perspectives in Biology. , (2015).
- Lee, J. D., Anderson, K. V. Morphogenesis of the node and notochord: The cellular basis for the establishment and maintenance of left-right asymmetry in the mouse. Developmental Dynamics. 237 (12), 3464-3476 (2008).
- Balmer, S., Nowotschin, S., Hadjantonakis, A. K. Notochord morphogenesis in mice: Current understanding and open questions. Developmental Dynamics. 245 (5), 547-557 (2016).
- Yoshiba, S., et al. Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science. , (2012).
- Jurand, A. Some aspects of the development of the notochord in mouse embryos. Journal of Embryology and Experimental Morpholog. 32 (1), 1-33 (1974).
- Poelmann, R. E. The head-process and the formation of the definitive endoderm in the mouse embryo. Anatomy and Embryology (Berl). , 41-49 (1981).
- Sulik, K., et al. Morphogenesis of the murine node and notochordal plate. Developmental Dynamics. 201 (3), 260-278 (1994).
- Bazzi, H., Soroka, E., Alcorn, H. L., Anderson, K. V. STRIP1, a core component of STRIPAK complexes, is essential for normal mesoderm migration in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 10928-10936 (2017).
- Bazzi, H., Anderson, K. V. Acentriolar mitosis activates a p53-dependent apoptosis pathway in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 111 (15), 1491-1500 (2014).
- Huangfu, D., Liu, A., Rakeman, A. S., Murcia, N. S., Niswander, L., Anderson, K. V. Hedgehog signalling in the mouse requires intraflagellar transport proteins. Nature. 426 (6962), 83-87 (2003).
- McMullan, D. Scanning electron microscopy 1928-1965. Scanning. 17 (3), 175-185 (2006).
- Bai, S. W., et al. Identification and characterization of a set of conserved and new regulators of cytoskeletal organization, cell morphology and migration. BMC Biology. 9, (2011).
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual, Fourth Edition. Cold Harb Lab Press. , (2014).
- Braet, F., De Zanger, R., Wisse, E. Drying cells for SEM, AFM and TEM by hexamethyldisilazane: a study on hepatic endothelial cells. Journal of Microscopy. 186, 84-87 (1997).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon