Method Article
노드 및 스캐닝 전자 현미경 검사 법, 면역 형광 산 전체를 사용 하 여 Gastrulating 마우스 배아에서 Notochordal 접시를 시각화
요약
노드 및 notochordal 플레이트는 일시적 이며, 여러 가지 기술을 사용 하 여 시각 될 수 있는 마우스 배아 개발 주최 신호 여기, 우리가 자세히 설명 두 그들의 구조 및 morphogenesis 연구 기법을 수행 하는 방법: 1) 스캐닝 전자 현미경 (SEM); 그리고 2) 전체 마운트 면역 형광 검사 (WMIF).
초록
후 이식 마우스 배아 gastrulation 및 morphogenesis 개시 후 주요 모양 변화를 겪 습. Morphogenesis의 특징은 과도 주최, 노드 notochordal 접시, 원시 조 흔을 통해 통과 하는 셀의 형성. 적절 한 형성이 신호 센터의 몸 계획의 개발을 위해 필수적 이며 마우스 발달 생물학에 대 한 높은 관심은 그들을 시각화 하는 기법. 노드 및 notochordal 플레이트 gastrulating 마우스 배아 배아 하루 (E) 7.5 개발의의 복 부 표면에 거짓말. 노드는 그 셀 보유 한 단일 슬림 cilium 각 컵 모양의 구조. 적절 한 subcellular 지 방화 및 노드 구 덩이에 속눈썹의 회전 좌우 비대칭을 결정 합니다. Notochordal 플레이트 셀 또한 노드 셀 보다 짧은 이기는 하지만 단일 속눈썹을가지고. Notochordal 플레이트 notochord somitogenesis 및 신경 패턴에 대 한 중요 한 신호 주최자 역할을 형성 한다. 때문에 노드 및 notochordal 플레이트의 세포 표면에 뚜렷이 존재 하 고 속눈썹을가지고, 그들은 스캐닝 전자 현미경 (SEM)을 사용 하 여 구상 될 수 있다. 시각화 하는 데 사용 하는 다른 기술을 세포 수준에서 이러한 구조 전체 마운트 면역 형광 (WMIF)가 높은 노드 및 notochordal 격판덮개에 표시 된 단백질에 대 한 항 체를 사용 하 여입니다. 이 보고서에서 우리는 우리의 최적화 된 프로토콜의 조직 형태와 야생-타입에서 세포 조직 평가에 도움을 개발 마우스 배아 및 gastrulation 돌연변이 배아 SEM 및 WMIF 노드와 notochordal 플레이트의 수행을 설명 합니다.
서문
Gastrulation와 동반 전체적 움직임은 마우스 배아1형성을 위해 결정적 이다. 세포 모양과 morphogenesis 조직에 변화 세포 운명을 통제 하 고 뒤이어 신호 경로 정확 하 게 새로 형성된 된 세균 레이어1을 다변화 하기 그들의 기능을 수행 하도록 허용 하는 위치 정보를 지정 합니다. 일시적인 구조를 구성 하 고 노드 및 notochord 같은 센터를 신호 형성 발달 프로그램2의 실행을 위해 필수적 이다. 발달 생물학의 이러한 구조, 세포 기자와 라이브 ex vivo 세포 및 subcellular 동작2의 역학에 따라 이미지의 사용은의 가장 주목할 만한 morphogenesis 공부 기술의 다양 한 사용 ,,34. 이 보고서에서 우리는 두 이러한 기술에 대 한 우리의 최적화 된 프로토콜의 세부 묘사에 초점: 스캐닝 전자 현미경 (SEM) 및 전체 마운트 면역 형광 검사 (WMIF)를 노드의 morphogenesis 공부에서 여전히 쓸모 있다 그리고 notochordal 격판덮개는 notochord의 선구자.
마우스 배아 노드는 눈물 모양의 컵 셀의 gastrulation 및 morphogenesis (배아 일, E7.5-E8) 중 후반 머리 배 단계를 초기 주위 마우스 태아의 복 부 표면에 있는2,5, 6,7. Notochordal 플레이트 형태학 상으로 anteriorly 노드3에서 emanates. 노드 및 notochordal 격판덮개에 각 셀 단일 cilium는 노드 셀에 긴 하지만 길이 따라 발달 단계2외부에 돌출 하는 특징 이다. 노드 구 덩이에 속눈썹의 회전 좌우 비대칭4를 결정 하는 신호에 대 한 중요 한 것을 보였다. Notochordal 플레이트 notochord, 인접 somites, overlying 신경 관3의 모방에 대 한 중요 한 신호 센터의 선구자 이다.
위치 (표면), 모양 (컵)와 고유한 외부 세포 구조 (속눈썹) 소지의 특성 때문에 sem의 전통적으로 사용 되었습니다 노드 및 notochordal 접시를 시각화 하 고 그들의 형성과 구조2, 연구 7. SEM는 또한 노드 자체 또는 gastrulation, morphogenesis, 뿐만 아니라 속눈썹 형성8,,910에 영향을 주는 돌연변이 셀에 속눈썹의 구조에 변화를 공부 하는 데 사용 됩니다. Sem의 전자가 생물 표본11등 재료의 외부 표면의 토폴로지 열 대권 외의 집중된 광선을 이용 하는 기술입니다. 샘플은 고정, 건조 하 고 스퍼터 코팅 금속 스캐닝 전자 현미경 관찰에 대 한 1 단계에서에서 설명 하는 대로.
WMIF는 유전자 제품, 단백질, 3 차원 (3D) 등을 시각화 하는 착 색 기술입니다. 조직, 기관 또는 전체 유기 체는 WMIF 신호 및 3d에서 결과 구조의 모양의 분포에 대 한 공간 정보를 제공합니다. 기술은 다음 형광 어원이 같은 말과 얼룩 샘플 고정 기반으로 합니다. 마우스 배아 ~ E7.5는 고 투명 작고 따라서 노드 및 notochordal 접시를 시각화 하기 위해 WMIF 프로토콜에 대 한 이상적인. 예를 들어 Barchyury (T) 핵 노드 및 notochordal 플레이트, 그리고 원시 조 흔, E7.5-E8 배아 개발 및 WMIF에 의해 T에 대 한 좋은 작업 항 체의 주위에 덜 정도로 표현 된다 전사 요소는 상업적으로 사용 가능한 착 절차를 가능 하 게 하 고. 노드 및 notochordal 플레이트의 셀 외부를 직면 하 고 따라서 형광 활용 Phalloidin 마크 F 걸 꼭대기 constrictions로 얼룩이 질 수 있다 압축된 꼭대기 표면 또한 특징입니다. 예제로이 시 약을 사용 하 여, T와 F-말라 WMIF에 의해 착 색의 조합 제공 합니다 노드 및 gastrulating 마우스 배아에 3d에서 notochordal 플레이트의 표현을 우리가 2 단계 8에서 보여줍니다. 그러나, 노드 및 notochordal 플레이트, FOXA2, 등의 다른 마커 뿐만 아니라 ARL13B 또는 acetylated tubulin, 속눈썹의 마커 개발 마우스 배아3,4, WMIF를 수행 하기 위해 또한 사용할 수 있습니다.
우리는 striatin 상호 작용 단백질 1 (STRIP1) 정상 gastrulation 및 마우스 배아8morphogenesis 필수적입니다 나타났습니다. STRIP1 striatin-상호 작용 가수분해 및 kinases 복합물 (STRIPAK), 우리와 다른 걸 골격 조직8,12에 연루가의 핵심 구성 요소입니다. Strip1 돌연변이 체 배아에 주요 결함 축 mesoderm (노드 및 notochordal 플레이트)의 형성과 antero 후부 몸 축의 확장에 있다. 우리는 우리가 대표 결과 에 해당 수치 표시 노드 및 야생-타입 (WT)와 Strip1 돌연변이 배아 notochordal 접시를 분석 하 SEM 및 WMIF를 이용 했다.
프로토콜
모든 실험 동물 실험 관련 북 라인 베스트팔렌 (NRW LANUV)에 책임 있는 권위에 의해 승인 되었다.
1. 마우스 배아 노드 스캐닝 전자 현미경 검사 법
- 희생에서 임신 여성 마우스 ~ 자 궁 경부 전위에 의해 E7.5 (somite 단계 2-4). 대 한 자세한 설명은 다이어그램 단계 1.1-1.7 마우스 배아 실험실 설명서13에서 제공 됩니다.
- 피부와 mesenteries를 통해 복 부를 열고 위와 미세 집게를 사용 하 여 자 궁을 제거 합니다.
- 증류수에 간단히 자 궁을 헹 구 고 그것 작은 깨끗 한 페 트리 접시 (6 cm) 인산 염 버퍼 식 염 수 (PBS) x 1.
- 해 부 현미경 및 미세 집게를 사용 하 여, 개별 deciduae 또는 이식 사이트 무료 자 궁 근육을 제거 합니다.
- 한 쌍의 집게와 각 decidua 누른 다른 쌍을 사용 하 여 빨간 부분 (미래 태) 사이의 흰 부분 (태아가 위치한) 경도 전체 두께 절 개를 하 게. 표면 구멍에 decidua의 흰색 부분을 따라 수직으로 절 개 된 연속 확인 합니다. 두 개의 반쪽으로는 decidua 떨어져 가로 당겨 하 고 신중 하 게 푸는 decidua의 흰 부분에 배아 다.
- 새로운 페 트리 접시 (35mm) 신선한 살 균 필터링 PBS 가진 배아를 전송 합니다. 모든 deciduae/배아에 대 한 반복 합니다.
- Reichert의 막 제거, 태아를 덮어 상대적으로 불투명 막, 괴 롭 히 고 여 각 배아에서 그것 멀리 양말 ectoplacental 콘 (붉은 이식 사이트)에서 시작. 유전형을 받아 작은 조각 (~ 0.1 m m2) 노 른 자 색이이 단계에서의.
- 화학 후드 및 적절 한 보호 장치 (장갑), EM 학년 정착 액 2.5%도 실 온에서 microcentrifuge (1.5 mL) 튜브에 PBS 살 균 필터링에서 구성 된 배아 전송. 4 ° c.에 하룻밤 배아를 수정
- 조심 스럽게 배아를 건드리지 않고 튜브에서도 정착 액을 제거 하 고 적절 한 폐기물 컨테이너에서 삭제. 각 실 온에서 15 분에 대 한 살 균 필터링 PBS에 배아 세 번을 씻어.
- 5 분에 대 한 에탄올 시리즈에 배아를 탈수: 50%, 70%, 85%, 및 100% 또는 절대 에탄올에 세 번. 에탄올에서 −20 ° C에 배아를 저장 하거나 다음 단계로 바로 진행.
- 임계점 (일일) 임계점 건조 기 기계에 건조 대 바구니에 에탄올에 배아를 전송 합니다. 바구니를 완전히 커버 하는 에탄올으로 챔버를 채우십시오.
- 신중 하 게 액체 CO2 와 10 ° c.에 10 번 홍 조 하 여 에탄올을 교환 챔버 절반 가득 때까지 마지막 단계 후 액체 CO2 에서 드레인. 압력 80 바 (임계점) 되 고 액체 CO2 가스 변경 때까지 40 ° C까지가 열. 10 분 기다립니다 다음 약 45 분 동안 천천히 가스를 버릴.
- 건조에 대 한 일일 비용을 쉽게 대신, 30 분에 대 한 에탄올에 배아를 1: 1의 비율로 hexamethyldisilazane (HMDS)을 추가 합니다. 그런 다음 30 분 제거에 대 한 순수한 HMDS는 피 펫을 사용 하 여 액체에서 배아 배아를 전송 하 고 30 분 동안 건조 그들을 두고.
참고: 두 건조 방법 일 동등 하 게 우리 손에서 잘. - 좋은 브러시를 사용 하 여 이중 양면된 테이프와 sem의 스텁에 복 부 측 (노드)와 말린된 배아를 탑재.
- 충전 긴 얇은 속눈썹을 선호 골드 입자 코팅 용 스퍼터 코팅 기계에 배아와 명세서를 삽입 합니다. 120-150의 레이어 적용 Å; 시간 각 샘플 달라 집니다 전류에 따라 달라 집니다.
- 배아와 코팅된 명세서 SEM 현미경에, 진공 적용 놓고 배아 노드 및 15, 1000 X에서에서 까지의 배율에서 속눈썹 notochordal 플레이트 세포 관찰 000 X.
2. 전체 산 면역 형광 마우스 노드 및 Notochordal 플레이트의
- 0.05% 얼음 처럼 차가운 PBS를 사용 하 여 트윈 20 (PBSTw), 단계 1.1-1.7 위의 E7.75에서 배아를 제거 하 고 35mm 페 트리 접시에 얼음에에서 PBSTw에 배치를 합니다.
- 화학 후드 및 적절 한 보호 (장갑)을 착용, microcentrifuge 튜브에 PBS에 4 %paraformaldehyde 통 솔루션에 배아를 전송 합니다. 4 ° c.에 하룻밤 배아를 수정
- 조심 스럽게 배아를 건드리지 않고 튜브에서 paraformaldehyde 정착 액을 제거 하 고 적절 한 폐기물 컨테이너에서 삭제. 0.2%를 포함 하는 PBS에 배아 세 번 씻어 실 온에서 각 5 분에 대 한 Triton X-100 (PBSTr). Nutating 통에 모든 세척 및 다음 인큐베이션 단계를 수행 합니다.
- 마지막 세척 제거 하 고 차단 솔루션 PBSTr (이차 항 체의 호스트 종)에서 열 비활성화 세럼 10%로 포함 된 추가. 2 h에서 하룻밤 (또는 더 긴)으로 4 ° c.에 nutator에
- 차단 제거 하 고 추가 ~ 차단 솔루션, 1: 500 희석에 예를 들어 안티-T 항 체 희석 주 항 체의 1 mL. 4 ° c.에 nutator에 하룻밤 (또는 이상)를 품 어
- 1 차적인 항 체를 제거 하 고 0.02% (20% 주식의 항 체 솔루션의 1 mL에 1 µ L)의 최종 농도에 나트륨 아 지 드를 추가 하 여 나중에 사용을 위해 그것을 저장. 항 체를 다시 사용할 수 있습니다 ~ 10 번. PBSTr로 두 번 배아를 헹 구 고 4 ° c.에 nutator에 각 30 분에 대 한 세 번 그들을 씻어합니다
- 형광 활용 된 이차 항 체, 1 차적인 항 체 호스트 종에서 희석에 대 한 세척 바꿉니다 ~ 1:1000 하룻밤 (또는 이상) 4 ° c.에 nutator에
- 이차 항 체를 제거 하 고 두 번 PBSTr, 다음 PBSTr와 함께 30 분 동안 세 번 세척 린스.
- F-말라와 1:1000 DAPI, 실 온에서 1 h 핵 얼룩 얼룩을 1: 500 형광 활용 된 phalloidin를 포함 하는 PBSTr에 마지막 세척을 바꿉니다.
- PBSTr에 두 번 헹 구 고 실 온에서 30 분 동안 PBSTr로 한 번 씻어.
- PBS를 가진 PBSTr를 대체 하 고 얼음에 배아를 둡니다. 깨끗 한 긍정적으로 위탁 슬라이드 (60 x 24 mm) 및 coverslips (24 x 24 mm)과 수성 글리세롤 기반 설치 미디어, 예를 들어 1xPBS에 90% 글리세롤과 배아를 탑재 하는 antifade 시 약 준비.
- 거리에 명확한 테이프의 두 조각을 넣어 ~ 15mm 슬라이드의 명확한 부분에 서로 다른. 이것은 충분 한 3D 공간 (Z 차원) 배아 병합 하지만 완전히 그들을 함부로 대 하지 있도록 만듭니다.
- 해 현미경으로 신중 하 게 배아 (전송 하 여 손상 되지 배아에 대 한 충분 한 공간이 있도록) 컷된 P200 피 펫을 사용 하 여 슬라이드를 이동 합니다.
- 미세 집게를 사용 하 여 태아를 펼쳐 노 른 골목의 옆 측에 2 개의 전체 컷을 확인 합니다. 최대 복 부 측 (노드 및 notochordal 플레이트)와 태아 (슬라이드에 아래로 신경 튜브의 등 쪽) 놓습니다.
- 태아에 미디어를 마운트의 50 µ L를 추가 합니다. 슬라이드 당 4-5 배아를 놓습니다. 먼저 터치 슬라이드 (위쪽 또는 아래쪽 측면), 다음 테이프의 두 가지를 벌리고 배치 되며 기포 생성을 피하는 동안 좋은 집게 또는 구부러진된 정밀한 바늘을 사용 하 여 태아에 천천히 낮은 coverslip의 미디어를 마운트의 소량을 추가 합니다.
- 흡수 성 지우기를 사용 하 여 초과 설치 미디어를 청소. 수는 coverslip 과정에서 이동 하지 않도록 주의 하십시오.
- 매니큐어의 관대 한 금액을 사용 하 여, 그것을 이동 하지 않고는 coverslip의 측면을 봉인.
- 스캐닝 confocal 현미경으로 관찰 합니다.
결과
시험의 WT와 Strip1 돌연변이 배아에서 노드의 형성 하기 위하여 ~ E7.5, 우리는 1 단계에서에서 설명 하 고 그림 18과 같이 SEM 사용. SEM을 사용 하 여 외부 토폴로지의 ultrastructural 정보 아주 유익 되었고 그것은 즉시 분명 WT 배아에서 구 덩이 모양의 노드를 달리 돌연변이 배아는 평평 하 고 불규칙 한 노드 했다. 배아의 높은 확대에 그들을 명확 하 게 식별 하는 노드 셀 특성 속눈썹을 보여주었다. 돌연변이에 속눈썹의 명백한 낮은 밀도 노드 구 덩이 구조와 곡률 또는 노드 셀의 낮은 수의 손실에 기인 수 있습니다. 노드의 emanating 나타나는 notochordal 플레이트 또한 돌연변이 배아에 일반 했다. 그들은 그들의 짧은 속눈썹을 식별 했다. 따라서, SEM Strip1 돌연변이8노드 morphogenesis 결함을 공개 하는 것이 중요 했다. 우리는 또한 사용 sem의 이전 연구에서 부족 centrioles 속눈썹9에 대 한 서식 파일을 제공 하는 돌연변이의 배아 노드에 있는 속눈썹의 부재를 보여.
공부 하 고 세포 수준에서 Strip1 돌연변이 배아의 축 mesoderm 형성 결함, 우리는 2 단계에서에서 설명 하 고 그림 2에 표시 된 WMIF를 사용. 이 기술을 사용 하 여, 노드 및 notochordal 판 쉽게 확인 되었다 F-말라와 T 얼룩에 의해. WT 노드 및 notochordal 플레이트 셀 F 걸 농축 했다, 그리고 분명 했다 핵 T 얼룩 꼭대기 도메인 막혀서 있다. Notochordal 플레이트는 WT에 rostrally 확장 하지만 짧고 불규칙 돌연변이. 데이터 F 걸 조직 축 mesoderm8을 포함 하 여 돌연변이 배아의 다른 세균 층에서 비정상적인 보여주었다. 따라서, WMIF 노드에 결함 및 Strip1 돌연변이 체 배아에 notochordal 격판덮개 형성 연구 수단이 되었다.
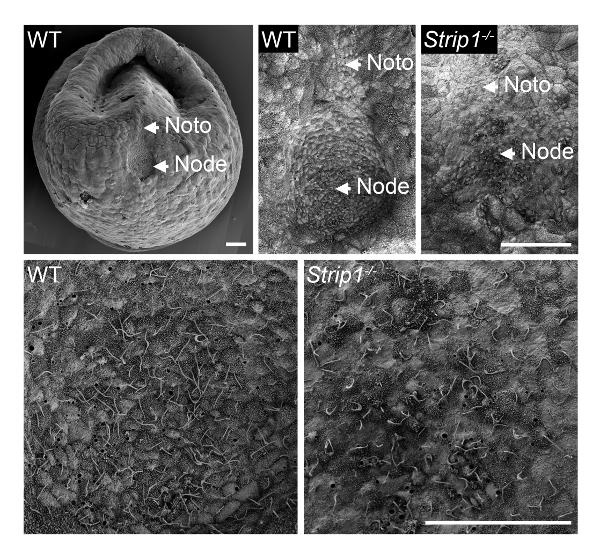
그림 1 . Strip1 돌연변이 마우스 배아에서 노드 morphogenesis에서 결함을 보여준다 스캐닝 전자 현미경 검사 법. (맨 위) SEM 분석의 WT와 Strip1 돌연변이 복 부 배아 노드 및 notochordal 플레이트 (노토)8. WT 태아의 낮은 확대 이미지의 예를 들어 왼쪽에 표시 됩니다. (아래) 노드의 노드 셀에서 예상 하는 긴 monocilia를 공개 하는 위에 표시 된 센터의 높은 배율. 앞쪽에서 모든 패널입니다. 스케일 바: 30 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
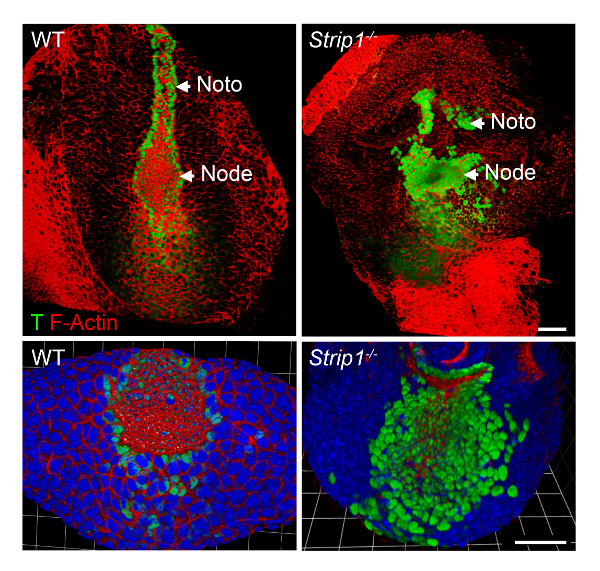
그림 2 . 전체 산 면역 형광 검사에서는 비정상적인 노드 및 세포 수준에서 notochordal 플레이트 Strip1 돌연변이 배아. (맨 위) 복 부 3D 렌더링 (Volocity 소프트웨어) WMIF WT와 Strip1 돌연변이 배아 형광 활용 된 phalloidin (F 걸, 빨간색)와 T (그린) 항 체 얼룩이 지기의 조합을 사용 하 여에. (아래) 얼룩 높은 줌 노드에 초점과 DAPI를 포함 하 여 위 그림의 더 많은 예제. 앞쪽에서 모든 패널입니다. 스케일 바: 30 µ m. 이 그림의 더 큰 버전을 보려면 여기를 클릭 하십시오.
토론
이 작품은, SEM 및 WMIF는 마우스 배아 노드 및 notochordal 접시를 시각화를 수행 하는 방법을 보여 줍니다. Gastrulating 마우스 배아의 작은 크기 ~ E7.5와 표면에 이러한 구조의 존재 그들을 이상적인 기술 설명된2,,78을 사용 하 여 공부 하 게. 좋은 항 체, T와 속눈썹 표식 등의 구조, 조직 및 이러한 필수 배아 주최8의 형성에 WMIF를 사용 하 여 우수한 3D 정보를 제공 합니다.
마우스 배아 개발은 매우 빠른 속도로 진행 되며 노드 및 notochordal 격판덮개만 정도 태아의 표면에 존재, 때문에 타이밍은 이러한 실험2,3의 성공을 위해 필수적입니다. 예를 들어 2-4 somite 배아는 긴 속눈썹과 성숙한 노드 구 덩이의 SEM 분석을 위해 좋다. 훨씬 이전 또는 이후 배아 (전이나 후에 예를 들어 12 h), 노드는 표면에 않을 수 있습니다. WMIF는이 점에서 좀 더 유연 하지만 스스로 구조는 또한 개발 하는 동안 과도 그리고 타이밍은이 경우에 연구자의 관심 분야에 따라 달라 집니다.
시 약의 순수성도 이러한 기술의 성공을 위해 필수적 이다 특히 열 대권 외의를 일반적으로 배아에 충실 SEM. 작은 불순물에 의해 조사 결과 거 대 한 유물에.
우리는 sem의 하나에 대 한 배아 정착의 두 가지 방법을 테스트 1 x PBS의 절반 Karnovsky의 정착 액 (2.5%도, 2 %paraformaldehyde 0.1 m M cacodylate 버퍼)와 간단 하 게 2.5%도 사용 하 여. 하지만 우리 글 및 PBS 정착 제 1 단계에에서 설명 된 대로 사용 하는 것을 선호, 우리와 다른 사용 해야, 또한 반 Karnovsky의 정착 액 성공적으로 SEM.에 대 한
우리는 또한 sem의 대 한 배아를 건조의 두 가지 방법에 비해 임계점 건조 기 또는 HMDS 1 단계에에서 설명 된 대로 사용 하 여 샘플의 품질에 차이가 발견 고14다른 곳에서 보고.
2 단계에 대 한 우리 1% 낮은 녹는 agarose의 최종 세척 단계 35 m m 유리 하단 접시에 장착 후 배아를 포함 하 고 다음 함께 그것을 토 핑 테스트 ~ 10 µ L 설치 매체의. 이 포함 하는 방법을 작동 하 고 태아의 원래 3 차원 구조 및 관련 된 구조; 그러나, multiphoton 현미경 표본 정기 confocal 현미경 그대로 배아로 깊은 도달할 수 없습니다 있기 때문에 이미지 하는 데 필요한 (~ 1 m m).
우리가 믿습니다 이러한 두 가지 기술을 사용 하 여 상호 보완적인 정보 노드와 notochordal 격판덮개의 구조에 정상적인 개발 하는 동안 이러한 구조의 형성에 결함을 표시 하는 돌연변이에.
공개
저자는 공개 없다.
감사의 말
Hb 인지 의료 교수진 및 쾰른 대학교의 SFB829에서 시작 자금에 의해 지원 됩니다. C.X.은 DFG 지원 바 5810/1-1을 부여. 우리는 CECAD 연구 센터와 기념 슬로 안 Kettering 암 센터 (뉴욕, 미국) 이미징 시설 감사 하 고 싶습니다. WMIF에 대 한 배아를 장착 하는에 그의 통찰력에 감사 호아킨 Grego Bessa (스페인어 국립 센터 심장 혈관 연구, 마드리드, 스페인) 하 고.
자료
| Name | Company | Catalog Number | Comments |
| 1,1,1,3,3,3 Hexamethyldisilazane (HMDS) | Carl Roth | 3840 | |
| Anti-T antibody | R&D Systems | AF2058 | |
| Critical Point Dryer | Blazers Union | CPD 020 | |
| DAPI | AppliChem | A4099,0005 | |
| Glutardialdehyde solution 25% | Merck | 1042390250 | |
| Triton X-100 | Sigma Aldrich | X100-100ML | |
| Tween 20 | AppliChem | A4974,0500 | |
| SEM coating unit PS3 | Agar Aids for Electron Microscopy | PS3 | |
| SEM microscope Quantum FEG 250 | ThermoFisher Scientific (FEI) | Quantum FEG 250 |
참고문헌
- Rivera-Pérez, J. A., Hadjantonakis, A. K. The dynamics of morphogenesis in the early mouse embryo. Cold Spring Harbor Perspectives in Biology. , (2015).
- Lee, J. D., Anderson, K. V. Morphogenesis of the node and notochord: The cellular basis for the establishment and maintenance of left-right asymmetry in the mouse. Developmental Dynamics. 237 (12), 3464-3476 (2008).
- Balmer, S., Nowotschin, S., Hadjantonakis, A. K. Notochord morphogenesis in mice: Current understanding and open questions. Developmental Dynamics. 245 (5), 547-557 (2016).
- Yoshiba, S., et al. Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science. , (2012).
- Jurand, A. Some aspects of the development of the notochord in mouse embryos. Journal of Embryology and Experimental Morpholog. 32 (1), 1-33 (1974).
- Poelmann, R. E. The head-process and the formation of the definitive endoderm in the mouse embryo. Anatomy and Embryology (Berl). , 41-49 (1981).
- Sulik, K., et al. Morphogenesis of the murine node and notochordal plate. Developmental Dynamics. 201 (3), 260-278 (1994).
- Bazzi, H., Soroka, E., Alcorn, H. L., Anderson, K. V. STRIP1, a core component of STRIPAK complexes, is essential for normal mesoderm migration in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 10928-10936 (2017).
- Bazzi, H., Anderson, K. V. Acentriolar mitosis activates a p53-dependent apoptosis pathway in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 111 (15), 1491-1500 (2014).
- Huangfu, D., Liu, A., Rakeman, A. S., Murcia, N. S., Niswander, L., Anderson, K. V. Hedgehog signalling in the mouse requires intraflagellar transport proteins. Nature. 426 (6962), 83-87 (2003).
- McMullan, D. Scanning electron microscopy 1928-1965. Scanning. 17 (3), 175-185 (2006).
- Bai, S. W., et al. Identification and characterization of a set of conserved and new regulators of cytoskeletal organization, cell morphology and migration. BMC Biology. 9, (2011).
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual, Fourth Edition. Cold Harb Lab Press. , (2014).
- Braet, F., De Zanger, R., Wisse, E. Drying cells for SEM, AFM and TEM by hexamethyldisilazane: a study on hepatic endothelial cells. Journal of Microscopy. 186, Pt 1 84-87 (1997).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유