Method Article
Piattaforma di microfluidica digitale basata su Electrowetting per l'analisi automatizzata di Immunosorbent legata all'enzima
In questo articolo
Riepilogo
Microfluidico digitale basato sull'elettrowetting è una tecnica che utilizza un cambiamento basato sulla tensione nell'angolo di contatto apparente di una goccia di microlitro-volume per facilitarne la manipolazione. La combinazione di questo con perline magnetiche funzionalizzate consente l'integrazione di più operazioni di unità di laboratorio per la preparazione del campione e l'identificazione di agenti patogeni utilizzando Immunosorbent Assay (ELISA) legato all'enzima.
Abstract
L'elettroumidità è l'effetto con cui viene modificato l'angolo di contatto di una goccia esposta a una carica di superficie. L'elettrowetting-on-dielectric (EWOD) sfrutta le proprietà dielettriche delle pellicole isolanti sottili per aumentare la densità di carica e quindi aumentare l'effetto di elettromutazione. La presenza di cariche si traduce in una diffusione elettricamente indotta della goccia che consente una manipolazione mirata su una superficie idrofobica. Qui, dimostri il protocollo basato su EWOD per l'elaborazione dei campioni e il rilevamento di quattro categorie di antigeni, utilizzando una piattaforma di riutilizzo automatica della superficie, tramite due varianti di un metodo ELISA (ELISA) di Immunosorbent Assay (ELISA) legato all'enzima. L'ELISA viene eseguito su perline magnetiche con anticorpi primari immobilizzati che possono essere selezionati per colpire un antigene specifico. Un anticorpo coniugato all'HRP si lega all'antigene ed è mescolato con H2O2/Luminol per la quantificazione degli agenti patogeni catturati. Sono stati raggiunti tempi di completamento del saggio compresi tra 6 e 10 min, mentre sono stati utilizzati minuscoli volumi di reagenti.
Introduzione
Il metodo proposto mira a facilitare la preparazione automatizzata dei campioni per ELISA con rilevamento quantitativo di antigeni utilizzando l'approccio basato su EWOD con microfluidica digitale (DMF) e la separazione magnetoforetica. È stato dimostrato per molteplici applicazioni biologiche che la DMF in combinazione con la magnetoforesi è un'interessante alternativa alle applicazioni di movimentazione liquida1. Più specificamente, la rilevazione di agenti patogeni è un aspetto implicito in molti settori, che vanno dall'assistenza sanitaria2 all'agricoltura e all'ambiente3,4 alla sicurezza nazionale5. Una tecnologia di rilevamento in grado di affrontare le minacce provenienti dagli agenti patogeni deve presentare un alto livello di produttività (ad esempio il tempo di analisi breve), l'efficienza (basso limite di rilevamento – LoD – e alta sensibilità) e la specificità (al tipo di agente patogeno di destinazione) affinché sia funzionale6.
In precedenza, il DMF basato su EWOD è stato implementato con successo per la reazione a catena della polimerasi di trascrizione inversa (RT-PCR), rilevamento di un patogeno resistente agli antibiotici (Staphylococcus aureaus resistente alla meticillina o MRSA), M.pneumonia e C.albicans utilizzando una scheda a circuito stampato a basso budget e magnetoforesi7. La tecnica è stata applicata anche per la rilevazione di mutazioni di acido deossiribonucleico (DNA) attraverso il pirosncing e il rilevamento chemiluminescente8. Le piattaforme basate su EWOD ampliano anche le loro funzionalità verso applicazioni di immunoanalisi, consentendo così il recupero e il rilevamento simultanei dei campioni all'interno di un'unica piattaforma integrata. Per esempio, un singolo progetto di chip EWOD è stato dimostrato con successo con una piattaforma DMF per test point-of-care sia per immunoassays a base di perline di troponina cardiaca I da un intero campione di sangue e come esperimento separato RT-PCR per il rilevamento MRSA2. Questo chip utilizza il riempitivo di olio, che impedisce l'evaporazione delle goccioline e facilita la manipolazione automatizzata affidabile dei volumi di nanollitri. Sono state studiate bioapplicazioni versatili con l'implementazione di simili approcci DMF che coprono immunoasdice quantitativi omogenei ed eterogenei9,10 inclusi studi di progettazione di esperimenti (DoE) per l'ottimizzazione dei parametri di analisi11.
Nonostante i suoi ovvi meriti di elaborare l'intensificazione a causa di piccoli volumi di lavoro, una piattaforma DMF piena di petrolio può essere impegnativa e richiede un certo livello di competenza per operare. I sistemi riempiti di petrolio, poiché richiedono componenti sigillati, non sono ideali per alcune applicazioni sul campo in cui la trasportabilità del sistema è importante. Inoltre, un sistema a base di olio sarebbe molto difficile se non impossibile da usare per alcune applicazioni specifiche che sfruttano la raccolta di materiale secco su una superficie come proposto da shao e Cho12, J 'nsson-Niedzi'ka et al.13, e Foat et al.14. Al contrario, i sistemi senza olio sono semplici da integrare e hanno il vantaggio di fornire una facile traduzione campione chip-to-chip. Per questi motivi, il metodo proposto è stato sviluppato per fornire un'immuno-unità di prova a base di EWOD su DMF che non richiederebbe petrolio, semplificando efficacemente il funzionamento del dispositivo.
In questo contributo, riportiamo l'utilizzo di una piattaforma DMF su misura, indipendente e completamente automatizzata per gli immunoasisti, ed elaboriamo il protocollo per il rilevamento rapido di biomolecole, vale a dire: proteine, batteri vegetativi, spore batteriche e virus. La combinazione di eWOD-chip con particelle magnetiche per la preparazione automatizzata del campione e l'immunoprecipitazioni è già stata dimostrata con un'ulteriore misurazione della SM off-line15. Recentemente, la diagnostica sul campo contro il metales e la rosolia IgG è stata dimostrata nella remota popolazione del Kenya nordoccidentalo dal gruppo Wheeler16. Sia Wheeler che il nostro sistema, essendo trasportabili, autonomi, completamente automatizzati con misurazioni chemiluminescenti in tempo reale incluse sono probabilmente tra i sistemi di biorilevamento DMF più avanzati disponibili.
I due sistemi sono stati progettati tenendo presenti applicazioni molto diverse. Il sistema di Wheeler si rivolge ai biomarcatori per consentire la diagnostica biomedica sui pazienti, mentre il nostro sistema di biorilevamento è costruito intorno al requisito di difesa per il rilevamento diretto di patogeni precedentemente campionati dall'aria. La somiglianza tra i due è il principio di base dell'attuazione delle goccioline, che dimostra l'ampia gamma di settori che influenzano la vita su cui la tecnologia basata sull'EWOD può avere un impatto. Vale a dire, la piattaforma di rilevamento basata su DMF e il sistema EWOD associato potrebbero trovare implicazioni chiave nella salute (diagnostica biomedica); protezione militare e civile (rilevamento delle minacce); Agri-tecnologia (monitoraggio delle colture) e sicurezza sul lavoro (monitoraggio controllato dell'ambiente)
Le prestazioni della nostra piattaforma DMF sono valutate contro il rilevamento completamente automatizzato dell'albumina del siero umano (HSA, una proteina globulare), l'Escherichia coli (E. coli, un batterio vegetativo), Bacillus atrofeo (BG, una spore batterica) e MS2 (un virus batteriophage). Ancora più importante, il metodo DMF proposto è estremamente versatile nel senso che gli anticorpi di cattura potrebbero essere scambiati per mirare al rilevamento di altri antigeni diversi dai quattro che sono considerati in questo articolo. Superando completamente il rilevamento basato su anticorpi, la piattaforma DMF potrebbe essere basata su una potenziale applicazione basata sul biosensing degli aptameri, dove le perline magnetiche trasportano aptamers specifici per la cattura e/o il rilevamento dei nucleotidi. La progettazione e la realizzazione dei diversi componenti che costituiscono la piattaforma DMF integrata e completamente autonoma, tra cui il generatore di forma d'onda ad alta tensione e l'elettronica di azionamento sono divulgati altrove6.
Protocollo
1. Passi preliminari necessari per il saggio
NOTA (IMPORTANTE): Tutte le fasi preliminari devono essere eseguite in un ambiente sterile per evitare contaminazioni. L'azide di sodio non deve essere utilizzato per lo stoccaggio in quanto inibirebbe l'attività dell'enzima perossidasi (HRP) del rafano.
- Preparare il buffer di corsa (100 mM HEPES, pH 7.5), utilizzando l'acido (4-(2-hydroxyethyl)piperazine-1-ethanesulfonic, e aggiungere Tween 80 a una concentrazione dello 0,01% (v/v).
- Immobilizza gli anticorpi primari (anticorpi di cattura) sulla superficie delle microsfere magnetiche attivate da NHS seguendo il protocollo fornito dal fornitore. In breve, il protocollo Magnetic IP/Co-IP Kit (Table of Materials) comprende i seguenti passaggi.
- Aliquota 0,2 mL di perline (2 mg) in un tubo di plastica e rimuovere il supernatante.
- Lavare le perline aggiungendo 1 mL di HCl ghiacciato.
- Legare l'anticorpo selezionato (Anti-Human Serum Albumin [15C7], Rb anti-BG policlonal, Rbanti-E.coli MRE 162 policlonale o Goat anti-MS2 policlonal), 40 g/mL in 67 mM Borate Buffer, covalentmente alle perline per 1 h con tremori a 37 . La tabella 1 contiene l'elenco di tutti gli anticorpi utilizzati con il protocollo corrente e gli agenti patogeni dell'antigene6.
- Lavare gli anticorpi non legati due volte con 0,8 mL di Buffer di eluzione.
- Scisso la reazione con 1 mL di Quenching Buffer per 1 h.
- Lavare le perline una volta con Modified Borate Buffer e una volta con IP Lysis/Wash Buffer.
- Risospendere le perline in 0,5 mL di IP Lysis/Wash Buffer e conservare a 4 gradi centigradi fino a quando non è necessario per l'uso.
NOTA: Per ottenere i migliori risultati, un nuovo lotto di microsfere viene accoppiato agli anticorpi il giorno prima dell'isolamento EWOD e del chip ELISA. Tuttavia, le microsfere accoppiate all'anticorpo primario possono essere conservate a 4 gradi centigradi fino a un mese. In caso di agglomerato, toccare la fiala per rompere il precipitato e per risospendere le perline nella soluzione. - Bloccare le microsfere con l'anticorpo accoppiato durante la notte, utilizzando la concentrazione finale 4 mg/mL per le microsfere, in una caseina Bloccante (1% w/v) in una salina con buffer fosfato da 100 mM (PBS).
NOTA: la fase di blocco viene sempre eseguita il giorno prima dell'esecuzione del test di biorilevamento. - Separare le perline dal Blocker Casein utilizzando un magnete e rimuovere il supernatante.
- Risospendere in 1 mL di buffer in esecuzione e mescolare per 1 min.
- Separare le perline utilizzando il magnete e rimuovere il supernatante.
- Ripetere i passaggi di lavaggio di cui sopra (1.2.10 e 1.2.11) due volte.
NOTA: Tre passaggi di lavaggio sono sufficienti per ridurre l'adesione delle perline alla superficie e per facilitare la libera circolazione della goccia. - Risospendere le perline nel buffer in esecuzione ad una concentrazione di 2,5 mg/mL. Questa soluzione di microsfere è pronta per l'uso con il chip EWOD.
- Preparare una soluzione del rafano coniugato neutronato perossidase (HRP) e l'anticorpo biotinylato secondario a una concentrazione finale per ciascuno di 1 g/mL nel buffer di corsa (utilizzato per il rilevamento BG6).
NOTA: Per colpire gli antigeni (Tabella 1) sono state testate con successo varie concentrazioni di anticorpi biotinylati secondari, che vanno da 0,5 a 4,0 g/mL. - Mescolare volumi uguali del Luminol con la soluzione di perossido di idrogeno appena prima di eseguire il saggio
NOTA: Luminol viene utilizzato per quantificare il numero di eventi di legame in base all'enzima HRP che è legato in modo covalente all'anticorpo secondario che si rivolge all'antigene (ad esempio, l'agente patogeno). Tuttavia, diverse molecole e strategie di segnalazione possono essere utilizzate per il rilevamentodi 17 invece della chemiluminescenza e del Luminol.
2. Produzione e trattamento superficiale dei componenti del chip EWOD
NOTA: Il chip EWOD è costituito da una piastra di azionamento con elettrodi di cromo modellati per alternare l'angolo di contatto apparente di una goccia e una piastra di copertura per definire l'altezza delle goccioline.
- Disegnare il design degli elettrodi e dei connettori in 2D utilizzando il software CAD standard. Includere anche il pad di raccolta dei rifiuti con dimensioni di 5 x 5 mm2 per memorizzare i solventi usati (Figura 1).
NOTA: Per manipolare le goccioline usiamo 47 elettrodi, ciascuno con dimensioni di 1,7 x 1,7 mm2. Questa dimensione dell'elettrodo può contenere volumi di goccia che vanno da 1,5 a 3 l (per uno spazio di 500 m). Per esperienza, quando si lavora con una distanza di 500 m, 1,5 l' è la dimensione minima delle goccioline che possono essere azionate. Corrisponde approssimativamente al contorno della goccia (proiettata) che viene circoscritto al pad quadrato. Tuttavia, non c'è alcun limite teorico di dimensioni diverse da quelle causate dalla resistenza (attrito) del corpo di fluido. Tuttavia, si raccomanda che il volume non superi 3 :L per un'attuazione affidabile utilizzando uno spazio di 500 m. Gli elettrodi sono indirizzati da elettronica a 48 canali.
NOTA: le dimensioni e le dimensioni di progettazione dei pad possono variare a seconda dei volumi previsti e delle operazioni delle unità di laboratorio (LUO) che compongono il protocollo. - Inviare il disegno disegno a un servizio di produzione di maschere per la stampa della maschera di cromo su un substrato di vetro. Lo spessore dello strato di cromo è di 100 nm.
NOTA: Lo strato di cromo sulla fotomaschera utilizzata come substrato per il chip EWOD è, per definizione, opaco. Il design di ciascuno dei nostri elettrodi include un layout a griglia per garantire la semi-trasparenza. - Tagliare la piastra a dimensioni 56 x 56 mm2 con una precisione CNC Dicing/Cutting Saw.
- Attaccare nastro adesivo sui contatti elettrici al fine di isolarli durante le due fasi di rivestimento.
- Rivestire la lastra di cromo-strato con uno strato dielettrico depositando 6 m Parylene-C sulla sua superficie. Il processo Gorham18 viene utilizzato con 7,4 g di DPX-C in un sistema di deposizione di Parylene (Tabella dei materiali).
- Fluoropolimeri amorfi amorfo spin-coat (Tabella dei materiali) utilizzando uno spin-coater a 1500 giri per 30 s sulla parte superiore del piatto e cuocere a 140 gradi centigradi per 30 min.
NOTA: Questo rende l'idrofobico della superficie. Si può verificare se il rivestimento è stato depositato con successo posizionando una goccia d'acqua sulla superficie. L'angolo di contatto tra la goccia e la piastra deve essere nella regione di 110o. - Rimuovere il nastro adesivo dai contatti elettrici.
- Fluoropolimeri amorfi spin-coat (Tabella dei materiali) utilizzando uno spin-coater a 1500 giri/mm per 30 s sulla parte superiore del wafer di silicio 4-in e cuocere a 140 gradi centigradi per 30 min.
NOTA: È importante che sia le superfici dell'attuazione che le piastre di copertura siano idrofobiche al fine di facilitare il movimento fluido delle goccioline discrete durante il test.
3. Caricamento, assemblaggio e funzionamento del chip EWOD sulla piattaforma DMF
NOTA: Il chip EWOD funziona utilizzando la configurazione a piastre parallele con uno spazio definito con precisione di 0,5 mm tra la piastra di azionamento e la piastra di copertura conduttiva, messa a terra. Questo assembly sandwich è descritto nella sezione corrente.
- Rimuovere il coperchio dalla piattaforma DMF6 e posizionarlo sulla panchina.
NOTA: Una camera vuota della gabbia di Faraday, è necessaria per evitare la luce vagante e l'interferenza elettromagnetica durante il rilevamento. Non c'è nessun interblocco sul coperchio, quindi, la piattaforma ci permette di osservare il movimento delle goccioline. - Posizionare una piastra di azione pulita sullo stadio rotante, cromo rivolto verso l'alto. La piastra deve essere allineata con l'angolo superiore sinistro della fase incassata (Figura 2A).
- Bloccare la piastra di entrata dall'alto utilizzando il pannello con i 47 pin di contatto. Questo assicura la piastra in posizione e facilita l'allineamento con i perni di contatto.
- Posare lo spessore di 0,5 mm e il separatore polimetilelmethacritato (PMMA) di 2 mm sullo stadio rotante, al fine di fornire un divario controllato tra l'atuazione e le piastre di copertura.
NOTA: Facoltativamente, la carta di stoping può essere posizionata sul tampone di smaltimento dei rifiuti prima di prelevare le goccioline prima del passo successivo. Man mano che il saggio procede, i rifiuti vengono assorbiti direttamente nella carta che può essere rimossa alla fine del saggio. - Caricare le goccioline sulle pastiglie di caricamento proposte (Figura 1).
- Aliquote quattro goccioline da 2,5 litri dal buffer in esecuzione sui pad B-, A-, R-, E-denotati, una goccia su ogni pad.
- Aliquota 2,5 - L di Luminol:H2O2 (1:1, v/v) soluzione sul pad D-denotato.
- Aliquota 2,5 - L' di Neutravidin coniugata a HRP (1 g/mL) sul pad F-denotato.
- Aliquota 2,5 -L di anticorpo secondario biotinylato (1 g/mL) sul pad con ditipo G.
- Aliquota 2,5 -L di Microperale con anticorpo primario coniugato (2,5 mg/mL) andare su I-denotato pad.
- Aliquota 2,5 - L del campione sconosciuto su pad C-denotato.
NOTA: il modello di caricamento proposto è solo un esempio di layout sperimentale, tuttavia, il modello di caricamento può essere modificato in base alle esigenze degli utenti, purché tali modifiche corrispondano alla sequenza definita nel software (Supplementary File 1).
- Posizionare la piastra di copertura sulla superficie del carro, oltre all'area di incavo rotondo, e farla scorrere lateralmente nell'incavo e sopra la piastra di attuazione (Figura 2B).
- Mettere il magnete permanente sulla parte superiore della piastra di copertura e fissarlo facendo scorrere i due latches (Figura 2C).
- Ruotare la fase di 180 gradi e controllare visivamente se le goccioline caricate sono ancora in posizione (Figura 1C).
NOTA: Si dovrebbe essere in grado di occhio la posizione e la forma delle goccioline attraverso lo stadio trasparente e la parte posteriore della piastra di attuazione (Figura 2D). Il saggio è pronto per l'esecuzione se le goccioline rotonde possono essere viste sopra le pastiglie degli elettrodi di carico. Nel caso in cui, una goccia viene spostata si può rimuovere il magnete e la piastra di copertura, quindi recuperare la goccia spostata con una pipetta pulita e posizionarla di nuovo sulla piastra di carico. - Verificare che la posizione di caricamento per ogni goccia corrisponda alla sequenza di gestione programmata nel software (vedere il file supplementare 1 per i dettagli sul software).
NOTA: Per poter controllare visivamente la posizione delle goccioline, il fotodetector deve essere smontato (Figura 2D). - Posizionare il fotodetector eseguito sullo schermo "può" nello slot della fase rotante.
NOTA: Il sistema di rilevamento foto ruota intorno a un fotodiodo, che ha una grande area di raccolta (10 x 10 mm2) per massimizzare la raccolta di luce senza ottica aggiuntiva, oltre a un amplificatore trans-impedito per ridurre al minimo il rumore6. Tuttavia, il sistema è estremamente sensibile e può raccogliere segnali minuti. Per ridurre il livello di rumore, sono state implementate una serie di strategie basate sull'elettronica (ad esempio, il sistema di fotorilevamento è stato protetto mettendolo in una gabbia di Faraday, un involucro metallico noto come "può" schermato). - Collegare il cavo al fotodetector schermo "può".
NOTA: Una volta che il chip EWOD è allineato con il fotodetector, la piattaforma DMF è completamente assemblata ed è ora pronta per funzionare. - Posizionare il coperchio sulla piattaforma DMF e avviare la sequenza del programma utilizzando l'interfaccia software sviluppata presso l'Università dell'Hertfordshire.
NOTA: viene utilizzato un software aggiuntivo per la lettura e la registrazione della luminescenza dalla goccia in funzione del tempo in un file CSV (vedere File supplementare 2).- Assicurarsi che i messaggi di richiesta della sequenza programmata (vedere File supplementare 1) vengano visualizzati nell'interfaccia per informare l'operatore che "La goccia di luminol è pronta a raccogliere i perline magnetiche estratte" o "La goccia di rilevamento è pronta per essere spostata nel sito di rilevamento". In entrambi i casi, la conferma da parte dell'operatore è tenuta a procedere con la sequenza.
4. Funzionamento in modalità visiva (facoltativo per l'ottimizzazione dei protocolli)
NOTA: se lo si desidera, per visualizzare ogni operazione basata sulle gocciole, l'analisi può essere eseguita saltando i passaggi 3.10-3.12 e sostituendoli con le seguenti operazioni.
- Avviare la sequenza del programma utilizzando l'interfaccia software.
NOTA: il movimento delle goccioline può essere osservato durante il funzionamento in modalità visiva, utile durante l'ottimizzazione del protocollo. In primo luogo, per verificare la riproducibilità del funzionamento di separazione magnetica. Ad esempio, se la quantità di perline utilizzate è troppo bassa, la separazione magnetica non si verificherà, viceversa, se la quantità di perline è troppo alta, la goccia può essere immobilizzata dal pellet di perline. In secondo luogo, per accertare l'affidabilità di un nuovo saggio, poiché una qualche formulazione di gocciolinia può causare un danno di azionamento che può essere rilevato dall'osservazione. - Montare il fotodetector schermato "può" nella scissione della fase rotante, quando richiesto.
- Collegare il cavo al fotodetector schermato "can", inserendo i perni nella presa.
- Posizionare il coperchio sulla piattaforma DMF e riprendere l'analisi.
NOTA: Utilizzare il software aggiuntivo per la lettura e la registrazione della luminescenza dal droplet in funzione del tempo in un file CSV (vedere File supplementare 2)
5. Rimozione dei rifiuti liquidi e pulizia del chip
AVVISO: Assicurarsi che l'apparecchiatura sia spenta e scollegata da fonti di alimentazione (computer, principale) prima della pulizia. Indossare guanti, un cappotto da laboratorio e occhiali vetro protettivo (PPE) quando si rimuovono i campioni biologici dal chip!
- Per accedere agli elettrodi e ai solventi utilizzati sulla piastra di azionamento, aprire il coperchio della piattaforma DMF e ruotare lo stadio di 180 gradi.
- Sganciare l'involucro del magnete, rimuovere il magnete dallo stadio rotante e posizionarlo sulla panca.
- Rimuovere la piastra di copertura, wafer di silicio, dalla scissione con un paio di pinzette, sciacquarla con acqua DI, asciugarla con aria compressa e metterla in una parabola Petri, dove il wafer può essere conservato e riutilizzato.
- Utilizzare una micropipetta per spostare i rifiuti liquidi dal pad senza toccare la superficie.
- Pulire la superficie allontanando il liquido dalla piastra di agitazione utilizzando carta assorbente (materiale filtrante).
NOTA: Mantenere intatta la superficie aumenterà la longevità della piastra di attuazione, che consente molteplici utilizzi. - Pulire la piastra di azionamento spazzando delicatamente la superficie degli elettrodi con una goccia d'acqua DI pulita utilizzando una pipetta pulita. Quindi rimuovere la goccia con carta wicking (materiale filtro).
AVVISO: Smaltire i tessuti, le carte, le punte delle pipette e i guanti contaminati con materiale biologico nel bidone dei rifiuti organici. - Utilizzare la piastra di entrata per un altro assaggio o rimuoverla dalla piattaforma DMF per lo stoccaggio o il riciclaggio.
Risultati
È stato studiato l'impatto della tensione di attuazione per chiarire quali fossero le condizioni ottimali per eseguire i saggi. Una goccia dal buffer è stata azionata a varie tensioni di azionamento e il suo movimento è stato registrato. I risultati dimostrati (Figura 3) esisteva una correlazione tra la tensione di attuazione quadrata media della radice (Vrms) e la velocità media. Tuttavia, la longevità di una piastra di attuazione è stata ridotta quando sono stati utilizzati valori elevati per Vrms. Sulla base di questi risultati, 105 Vrms è stato scelto come tensione di attuazione standard, 120 Vrms è stato trovato per funzionare meglio per la goccia H2O2/Luminol e 165 Vrms è stato implementato per l'estrazione LUO. Queste tensioni sono state incluse nella sequenza di programmazione automatica (Supplementary File 1).
Due immunoasisti (Figura 4) sono stati testati con successo utilizzando il chip EWOD con la piattaforma DMF per quattro diversi patogeni (Tabella 1). Il chip EWOD ha facilitato il movimento consecutivo delle goccioline dalle pastiglie di carico alla regione di miscelazione e infine ai rifiuti. C'erano due LUO di base che sono stati ripetuti in tutto il protocollo per completare ELISA. Il primo è stato l'estrazione LUO; brevemente descritto qui, la goccia contenente le perline sospese è stata guidata al sito di separazione nel mezzo della zona di miscelazione, il magnete è stato attivato automaticamente per avvicinarsi al chip e per mettere in comune le perline magnetiche in un pellet (Figura 5). Successivamente, la goccia è stata spostata verso il tampone di rifiuti, lasciando le perline sulla piastra di attuazione, concludendo così l'estrazione LUO. La miscelazione è stata la prossima chiave LUO che ha avuto luogo sul chip EWOD. Il campione di analita con una concentrazione sconosciuta di agenti patogeni è stato spostato sulle perline mediante elettroumidità. Poi le perline sono state risospese spostando la goccia con le perline agglomerate sopra l'area di miscelazione (10 pastiglie in totale). Questi due LSO erano essenziali in quanto facilitavano un'elaborazione dei campioni miniaturizzata, rapida e riproducibile con il rilevamento consecutivo degli agenti patogeni in 6-10 min. Figura 6 mostra la sequenza completa dei LUO da un immunoassay realizzato con il chip EWOD.
Per soddisfare i livelli desiderati di automazione, si potrebbero introdurre variazioni nel protocollo. Ad esempio, le perline sono state separate dalla goccia impoverito dell'antigene, che è stata poi trasferita al tappetino, ripetendo l'estrazione di base LUO. In questa fase, il protocollo potrebbe ramificarsi a seconda che l'anticorpo di rilevamento è stato già coniugato all'HRP, utilizzando in modo efficace otto LUO in totale per il rilevamento dei diversi antigeni (Figura 7A-C). In questi casi, la goccia con l'anticorpo di rilevamento è stata portata alle perline e poi mescolata per atuazione. In alternativa, legare l'anticorpo di rilevamento al coniugato Neutravidin-HRP potrebbe essere eseguito in sequenza in situ sul chip EWOD, come è stato dimostrato per la quantificazione di E. coli (Figura 7D). Entrambi i protocolli, l'ELISA in otto e dieci fasi (Figura 4), hanno prodotto il rilevamento riproducibile degli antigeni.
I tempi di incubazione e le concentrazioni coniugate erano variati per trovare sperimentalmente le condizioni ottimali per il saggio (Figura 7A). Si è constatato che il tempo di incubazione di 160 s e la concentrazione coniugata di 2 g/mL hanno raggiunto il miglior rapporto segnale/rumore con un aumento del 36% della potenza del segnale e praticamente nessun cambiamento nei livelli di rumore di fondo. Tutte le cifre e i dati utilizzati nella sezione dei risultati rappresentativi sono stati modificati da un precedente lavoro6.
| Anticorpo primario/cattura | Anticorpi di rilevamento | Antigene |
| Anti-Human Serum Albumin [15C7] (anti-HSA, Abcam ab10241) | Rafano Radish Peroxidase (HRP) etichettato anti-HSA [1A9] (Abcam ab24438) | Albumina del siero umano (HSA, Abcam) |
| Rb anti-BG policlonale | Rb biotinyato anti-BG policlonale | Spore B. globigii (BG) |
| Rb anti-E.coli MRE 162 policlonale | Rb biotinyato anti-E.coli 162 MRE policlonale | E. coli MRE 162 |
| Capra anti-MS2 policlonale | Rb biotinylato anti-MS2 policlonale | Virus batteriofano MS2 |
Tabella 1: Antigeni e anticorpi testati con questo protocollo. Sono stati utilizzati quattro tipi di antigeni patogeni per dimostrare le capacità del chip EWOD con la piattaforma DMF.
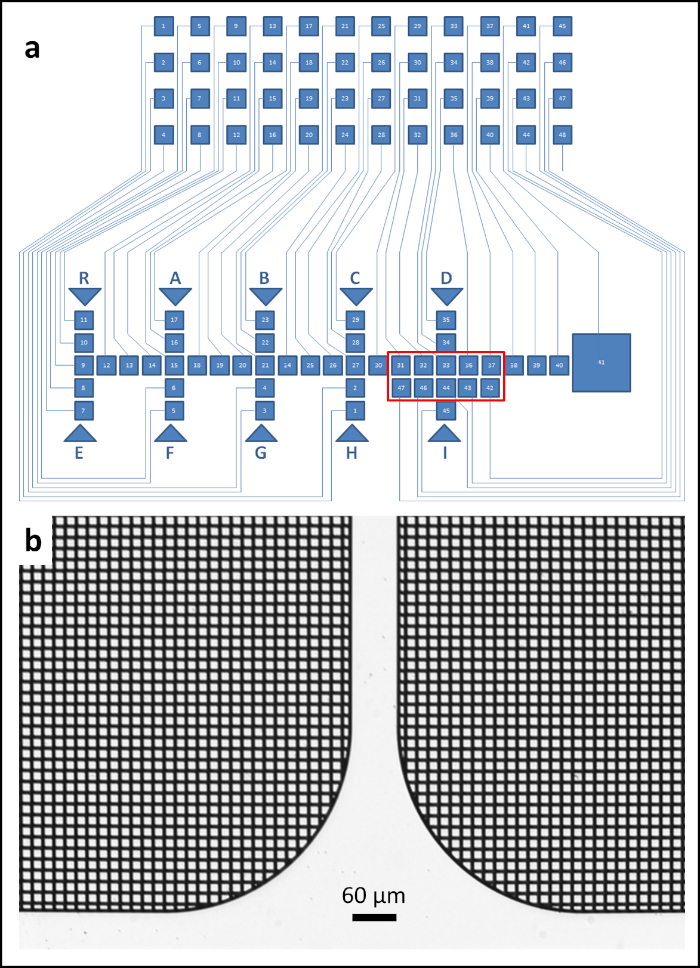
Figura 1: Progettazione della piastra EWOD. (a) Notazione schematica della piastra di azionamento EWOD con connettori (quadrati, superiore) collegati (linee) agli elettrodi (quadrati, inferiore). A ogni pad viene assegnato un numero e può essere indirizzato dal codice software (Supplementary File 1). I cuscinetti degli elettrodi di carico sono contrassegnati da frecce e indicati da una lettera maiuscola sopra o sotto ogni pad. Una caratteristica chiave per la piattaforma DMF è la zona di missaggio composta da dieci pad (N. 31, 32, 33, 36, 37, 42, 43, 44, 46, 47). Come guida visiva, la zona di miscelazione è contrassegnata da un rettangolo rosso. (b)Micrografo del design della microgrid delle pastiglie. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 2: Componenti e fasi chiave per l'assieme DMF (Digital microfluidic system). (A) Fissare la piastra di agitazione EWOD, posizionare lo shim sul palco rotante e caricare le goccioline. (B) Posizionare la piastra di copertura. (C) Montare la custodia del magnete, fissare i fermo e ruotare lo stadio di 180 gradi. (D) Il magnete automatico è rivolto verso il basso. Ispezionare la posizione e la forma delle goccioline, verificare che i pin del circuito stampato (PCB) siano allineati con i contatti sul chip EWOD, collegare il fotodetector e posizionarlo nello slot del fotodetector. Dopo aver collegato l'elettronica di controllo a un computer, il sistema è pronto per eseguire il saggio. Fare clic qui per visualizzare una versione più grande di questa figura.
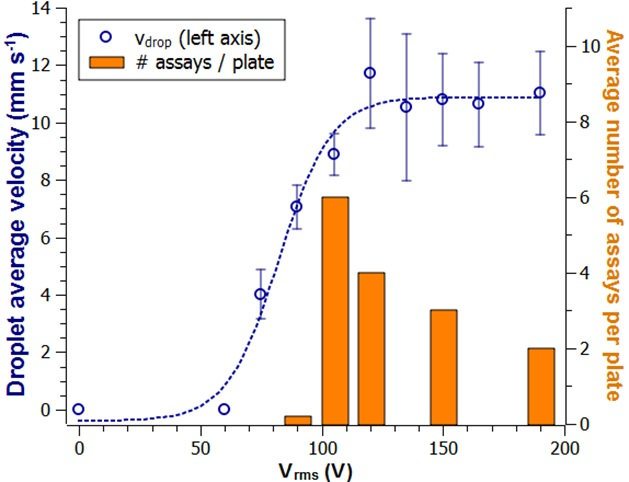
Figura 3: Utilizzo ripetitivo delle piastre di attuazione e impatto sulla tensione di attuazione. La velocità media di una goccia dal buffer in esecuzione viene tracciata in funzione della tensione di entrata (cerchi blu) e della deviazione standard da tre misurazioni indipendenti (N - 3). Qui il numero di saggi per piastra (barre grigie) indica un maggiore decadimento della superficie a tensioni più elevate. Fare clic qui per visualizzare una versione più grande di questa figura.
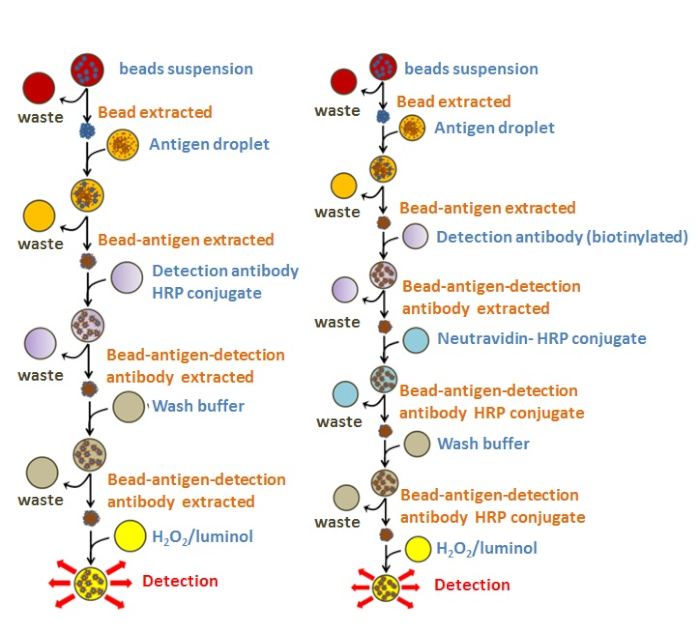
Figura 4: Diagramma delle immunoasische testate con EWOD. Ogni cerchio in questo diagramma rappresenta un volume di 2,5 litri caricato sul chip EWOD. Il primo protocollo (sul lato sinistro) mostra otto LUO che utilizzano il coniugato anticorpo-HRP premiscelato; mentre, il secondo protocollo comprende dieci LUO, aggiungendo separatamente l'anticorpo di rilevamento biotinylato, l'estrazione del tallone e il legame consecutivo del coniugato Neutravidin-HRP. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 5: Estrazione magnetica del tallone. Questo processo è suddiviso in (a-c) azionando la goccia con le perline magnetiche sospese al sito di separazione magnetica al centro della zona di miscelazione (pad No. 33), (d, e) il magnete si sta muovendo in posizione concentrando le perline, (f, g, h) perline sono tenute in posizione dalla forza mentre la goccia è azionata via da EWOD verso il cuscinetto di rifiuti (No. Fare clic qui per visualizzare una versione più grande di questa figura.

Figura 6: Sequenza completa dell'immunoanalisi utilizzando EWOD, che mostra i reagenti, il carico del campione e le operazioni delle unità di laboratorio. Ogni riga contiene una sequenza di immagini di esempio dalle operazioni caratteristiche su un droplet. Le operazioni sono suddivise in colonne. La miscelazione non viene eseguita per le perline in sospensione, presentate da una linea nera spezzata. Le direzioni delle goccioline sono indicate da frecce blu, le perline sono evidenziate in una delle immagini da una freccia arancione. La casella grigia (angolo inferiore destro) separa le due immagini che rappresentano il movimento e la posizione nell'area di rilevamento, il cerchio della linea spezzata evidenzia l'area di rilevamento. Fare clic qui per visualizzare una versione più grande di questa figura.
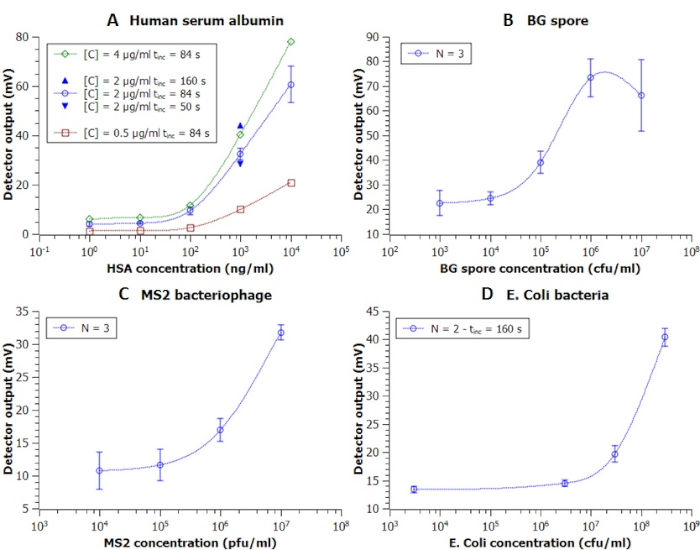
Figura 7: Curve di calibrazione da immunoassays condotte su chip EWOD con la piattaforma DMF. Come riportato in precedenza6 le tensioni di uscita (mV) e le concentrazioni sono mostrate per: (A) Albumina siero umana, che viene utilizzato per studiare l'effetto della concentrazione di anticorpi coniugati [C] e il tempo di incubazione, tinc, misurato dalla miscelazione delle perline con analita noto fino all'estrazione LUO, (B) B. spore di atrofia (BG) che mostrano la riproducibilità dell'immunoassay, (C) MS2 bacteriophageasasasasasassay e (D) dieci-LUO protocol E. coli. Abbreviazioni: unità formanti colonia (cfu), unità di formazione della placca (pfu), numero di esperimenti indipendenti (N), funzionamento dell'unità di laboratorio (LUO). Figura modificata rispetto alla precedente pubblicazione6. Fare clic qui per visualizzare una versione più grande di questa figura.
File supplementare 1: sequenza completa per eseguire la piattaforma DMF per il saggio automatico ELISA con Neutravidin-HRP come coniugato. Fare clic qui per scaricare questo file.
File supplementare 2: vengono mostrati la GUI per la misurazione della chemiluminescenza e un esempio da una misurazione con il software. Fare clic qui per scaricare questo file.
Discussione
Il protocollo di immunoanalisi EWOD è flessibile e può includere un numero elevato di operazioni di unità di laboratorio (ad esempio, antigene di cattura, miscelazione, incubazione, estrazione del tallone, lavaggio) a seconda del tipo di reagente, della stabilità e dei requisiti di utilizzo definiti dal protocollo di analisi. Come prova di principio, nell'articolo attuale, vengono considerati due protocolli di immunoanalisi che mostrano l'implementazione di otto o dieci LUO (Figura 4) con il chip EWOD descritto. Tale miniaturizzazione merita dal microlitro, volumi discreti di reagenti/analiti che aumentano l'efficacia dell'ELISA riducendo sia il consumo di reagenti, il tempo richiesto per operazione, essenzialmente, il tempo totale di tempo sperimentale (6 a 10 min). Inoltre, il test è automatizzato con la manipolazione a tempo delle goccioline che diminuisce le variazioni e migliora la precisione dell'immunoaspo17. Nel suo formato attuale, l'esperimento prevede la gestione manuale delle goccioline all'inizio di ogni saggio, che è un punto per ulteriori discussioni nella sezione successiva.
Un passo critico nell'attuale metodo DMF è l'erogazione delle goccioline sulla superficie del chip EWOD. Tipicamente, una micropipetta con una punta usa e getta viene utilizzata per misurare il volume esatto e per caricarlo. Tuttavia, può diventare difficile immobilizzare la goccia sulla superficie idrofobica della piastra di attuazione a causa delle interazioni tra la gocciolina e la superficie carica della punta usa e getta. Di conseguenza, la goccia può sparare seguendo la superficie esterna della punta invece di rimanere sul piatto. Per evitare questo, la micropipetta deve essere tenuta in posizione eretta, perpendicolare alla superficie del chip, senza toccarla, quindi la goccia può essere erogata alla rampa di carico portandola a contatto con la superficie. Se la gocciolina si attacca alla punta della pipetta, restituiscla alla soluzione di magazzino, scambia la punta e rideposita una goccia fresca. In un ulteriore sviluppo dell'attuale sistema proof-of-concept, si può prevedere la consegna automatica delle goccioline.
Un altro passo critico, prima di eseguire il saggio, è la chiusura del coperchio dell'assieme di piastra parallela. Come indicato in precedenza nel protocollo, il coperchio deve essere scivolato sopra la piastra di attuazione. La superficie idrofobica del coperchio impedisce la distorsione e lo spostamento delle goccioline sedute sulla piastra di agiazione. Per garantire il movimento regolare della gocciolina, si consiglia vivamente di utilizzare piastra di entrata incontaminata, il caricamento corretto delle goccioline e l'assemblaggio del chip. La riusabilità delle piastre di ausilio è possibile; tuttavia, il numero di cicli dipende dalle tensioni di attuazione (Figura 3) e dalla deposizione di analita/reagente sulla superficie, noto anche come biofouling. La piattaforma presentata utilizzava chip EWOD stampato in cromo, che poteva essere riutilizzato in modo affidabile per misurazioni consecutive fino a quattro volte a tensione operativa di 120 V e pulizia della piastra intermedia dopo ogni esperimento. Le piastre sono state riciclate, per ridurre il costo per esperimento, decontaminando (spazzolando la superficie con un agente di pulizia non diluito prima di risciacquare a fondo) i fluoropolimeri amorfi biofouled (Tabella dei materiali) rivestimento e spin-rivestimento uno fresco sulla parte superiore della piastra. Tuttavia, il riciclaggio delle piastre di attuazione richiede la movimentazione manuale, reagenti costosi (fluoromeri amorfi (Tabella dei materiali)) e attrezzature specializzate (spin-coater). I chip EWOD alternativi vengono studiati con successo con substrati convenienti come carta19,pellicole in acetato o circuiti stampati (PCB)20,21. Tali materiali di consumo usa e getta possono facilitare l'uso affidabile e conveniente della piattaforma DMF e possono fornire mezzi per eludere il problema del biofouling.
Il biofouling è la principale limitazione dell'EWOD per le applicazioni biologiche22,23. Studi precedenti sul DMF hanno identificato due meccanismi che contribuiscono al biofouling, vale a dire l'adsorbimento passivo dovuto alle interazioni idrofobiche, e un adsorbente guidato elettrostaticamente che si manifesta quando viene applicato un campo elettrico24. I risultati nell'articolo corrente sono coerenti con questa teoria in quanto è stata documentata la riutilizzabilità della piastra di atuazione diminuisce a tensioni ad alta atuazione. Una possibile spiegazione è che le proteine assorbono prontamente su superfici rivestite di fluoropolimero (simile a Un teflon) e si aggregano più velocemente sui fouling rispetto alle superfici incontaminate24. Di conseguenza, i saggi relativi alle proteine sul DMF sono difficili da quantificare e possono subire perdite di analita, contaminazione incrociata e minore precisione17. Lo scenario peggiore è quando una quantità critica di proteine adsorbs rendendo così il dispositivo inutile. Per ridurre al minimo il biofouling, sono stati studiati vari approcci dal ridurre al minimo il tempo di residenza della goccia sul chip, attraverso rivestimenti23, agli additivi (cioè, surfactants o acido pluronico) nelle goccioline cariche di biomateriale6,22. Quindi un aspetto importante del test dell'immunoanalisi sull'EWOD è quello di scegliere strategie anti-biofouling compatibili con il protocollo specifico a portata di mano.
La piattaforma d'Xml automatizzata è progettata per eseguire un singolo test ELISA a sandwich per esecuzione utilizzando volumi microliter sia per reagenti che per analiti. Quando è necessario, esistono kit ELISA sandwich convenzionali basati su pre-rivestiti 96-bene o 384-bene piastre che in combinazione con attrezzature di laboratorio ausiliario si traducono in una maggiore produttività per corsa; basato solo sul prezzo dei reagenti, il costo approssimativo per analisi/pozzo è rispettivamente di 6,04 USD (580 USD/96) e 0,33 USD (2-580 USD/384). Ciò rende i metodi ELISA convenzionali ideali per un gran numero di campioni elaborati tipicamente da personale tecnico qualificato presso strutture di laboratorio centralizzate. Tuttavia, in località remote, l'analisi dettagliata dei costi di ELISA per il monitoraggio ambientale ha mostrato che quando sono stati inclusi i costi di capitale (ad esempio, i costi operativi di laboratorio, i costi aggiuntivi, il trasporto di campioni, le forniture e il personale) il prezzo effettivo per ELISA era di 60 USD di cui 34 USD erano destinati alle forniture per base per campione25. Al contrario, la piattaforma DMF proposta è portatile, richiede una formazione minima per funzionare e con perline pre-rivestite può fornire analisi campione-risposta in pochi minuti. Di conseguenza, la tecnologia presentata può essere impiegata in posizioni point-of-need e integrare le analisi altrimenti disponibili nei laboratori centralizzati.
Nella sezione dei risultati rappresentativi, la piattaforma di immunoanalisi DMF automatizzata è stata utilizzata per il rilevamento diretto di agenti patogeni per l'applicazione della difesa. Altre possibili applicazioni per la piattaforma DMF comprendono, ma non si limitano a biodiagnostiche, monitoraggio continuo e campionamento automatizzato. Potenzialmente il DMF potrebbe avere un impatto su diversi settori, dal punto di assistenza per l'assistenza sanitaria personalizzata, nonché il monitoraggio controllato dell'ambiente per la protezione dei pazienti dall'aviotrasportato dell'infezione acquisita negli ospedali, al sistema di monitoraggio delle colture per l'agricoltura e produzione alimentare.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Vorremmo riconoscere il contributo dei nostri colleghi del Microfluidic & Microengineering Research Group per il loro lavoro sulla progettazione meccanica e l'integrazione dei sistemi. Gli autori desiderano ringraziare Dstl Porton Down per il loro prezioso sostegno e contributo finanziario, ai progetti passati e in corso che sviluppano ulteriormente la tecnologia DMF e le sue applicazioni.
Materiali
| Name | Company | Catalog Number | Comments |
| (4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid, HEPES | Sigma-Aldrich | H9897 | |
| Anti-Human Serum Albumin [15C7] | Abcam | ab10241 | |
| Anti-Human Serum Albumin [1A9] (HRP) | Abcam | ab24438 | |
| B. atrophaeus (BG) spores | Dstl, UK | N/a | |
| Biotinylated Rb anti-BG polyclonal | Dstl, UK | N/a | |
| Biotinylated Rb anti-E. coli MRE 162 polyclonal | Dstl, UK | N/a | |
| Biotinylated Rb anti-MS2 polyclonal | Dstl, UK | N/a | |
| Blocker Casein | Thermo Scientific | TFS 37582 | |
| CNC Dicing/Cutting Saw | MTI Corp, USA | SYJ-400 | |
| Cytop | AGC, Japan | CTL-809M | Amorphous fluoropolymers. This is a two component coating. |
| E. coli MRE 162 | Dstl, UK | N/a | |
| Goat anti-MS2 polyclonal | Dstl, UK | N/a | |
| Hamamatsu photodiode | Hamamatsu, Japan | S9270 | |
| Hidrochloric acid (32%) | Sigma-Aldrich | W530574 | |
| Mask manufacturing service | Compugraphics, Scotland, UK | N/a | |
| MS2 virus | Dstl, UK | N/a | |
| Parylene-C, DPX-C | Specialty Coating System, USA | CAS No.: 28804-46-8 | |
| Pierce Direct Magnetic IP/Co-IP Kit | Thermo Scientific | 88828 | Contains all buffers and reagents required for enzyme immobilisation. Store at 4 °C. |
| Rb anti-BG polyclonal | Dstl, UK | N/a | |
| Rb anti-E. coli MRE 162 polyclonal | Dstl, UK | N/a | |
| Recombinant Human Serum Albumin protein, HAS | Abcam | ab201876 | |
| SCS Parylene Deposition System | Specialty Coating System, USA | 2010 | |
| Silicon wafer, 4'', p-type, <100>, 1–10 Ωcm | Pi Kem Ltd | N/a | |
| Spin Coater | SÜSS MicroTec AG, Germany | ||
| SuperSignal ELISA Femto Maximum Sensitivity Substrate | Thermo Scientific | 37075 | It contains 50 mL of Luminol/ Enhancer and Stable Peroxide solutions. Store at 4 °C. |
| Tween 80 | Thermo Scientific | 28328 | The manifacturer is Surfact-Amps Detergent Solution. |
Riferimenti
- Kokalj, T., Pérez-Ruiz, E., Lammertyn, J. Building bio-assays with magnetic particles on a digital microfluidic platform. New Biotechnology. 32 (5), 485-503 (2015).
- Sista, R., et al. Development of a digital microfluidic platform for point of care testing. Lab on a Chip. 8 (12), 2091-2104 (2008).
- Starodubov, D., et al. Compact USB-powered mobile ELISA-based pathogen detection: design and implementation challenges. Advanced Environmental, Chemical, and Biological Sensing Technologies VIII. 8024, 80240 (2011).
- Delattre, C., et al. Macro to microfluidics system for biological environmental monitoring. Biosensors and Bioelectronics. 36 (1), 230-235 (2012).
- Gooding, J. J. Biosensor technology for detecting biological warfare agents: Recent progress and future trends. Analytica Chimica Acta. 559 (2), 137-151 (2006).
- Coudron, L., et al. Fully integrated digital microfluidics platform for automated immunoassay; A versatile tool for rapid, specific detection of a wide range of pathogens. Biosensors and Bioelectronics. 128, 52-60 (2019).
- Hua, Z., et al. Multiplexed Real-Time Polymerase Chain Reaction on a Digital Microfluidic Platform. Analytical Chemistry. 82 (6), 2310-2316 (2010).
- Zou, F., et al. real-time chemiluminescent detection of DNA mutation based on digital microfluidics and pyrosequencing. Biosensors and Bioelectronics. 126, 551-557 (2019).
- Ng, A. H. C., Choi, K., Luoma, R. P., Robinson, J. M., Wheeler, A. R. Digital microfluidic magnetic separation for particle-based immunoassays. Analytical Chemistry. 84 (20), 8805-8812 (2012).
- Vergauwe, N., et al. A versatile electrowetting-based digital microfluidic platform for quantitative homogeneous and heterogeneous bio-assays. Journal of Micromechanics and Microengineering. 21 (5), (2011).
- Choi, K., et al. Automated digital microfluidic platform for magnetic-particle-based immunoassays with optimization by design of experiments. Analytical Chemistry. 85 (20), 9638-9646 (2013).
- Zhao, Y., Cho, S. K. Microparticle sampling by electrowetting-actuated droplet sweeping. Lab on a Chip. 6 (1), 137-144 (2006).
- Jonsson-Niedziołka, M., et al. EWOD driven cleaning of bioparticles on hydrophobic and superhydrophobic surfaces. Lab on a Chip. 11 (3), 490-496 (2011).
- Foat, T. G., et al. A prototype personal aerosol sampler based on electrostatic precipitation and electrowetting-on-dielectric actuation of droplets. Journal of Aerosol Science. 95, 43-53 (2016).
- Seale, B., et al. Digital Microfluidics for Immunoprecipitation. Analytical Chemistry. 88 (20), 10223-10230 (2016).
- Ng, A. H. C., et al. A digital microfluidic system for serological immunoassays in remote settings. Science Translational Medicine. 10 (438), 6076-6088 (2018).
- Wild, D., Davies, C. Immunoassay fundamentals. The Immunoassay Handbook: Theory and Applications of Ligand Binding, ELISA and Related Techniques. , 1-26 (2013).
- Gorham, W. F. A New, General Synthetic Method for the Preparation of Linear Poly-p-xylylenes. Journal of Polymer Science Part A-1: Polymer Chemistry. 4 (12), 3027-3039 (1966).
- Soum, V., et al. Affordable fabrication of conductive electrodes and dielectric films for a paper-based digital microfluidic chip. Micromachines. 10 (2), (2019).
- Abdelgawad, M., Wheeler, A. R. Low-cost, rapid-prototyping of digital microfluidics devices. Microfluidics and Nanofluidics. 4 (4), 349-355 (2008).
- Jain, V., Devarasetty, V., Patrikar, R. Study of Two-Dimensional Open EWOD System using Printed Circuit Board Technology. Global Journal of Researches in Engineering: Electrical and Electronics Engineering. 17 (6), (2017).
- Luk, V. N., Mo, G. C. H., Wheeler, A. R. Pluronic additives: A solution to sticky problems in digital microfluidics. Langmuir. 24 (12), 6382-6389 (2008).
- Latip, E. N. A., et al. Protein droplet actuation on superhydrophobic surfaces: A new approach toward anti-biofouling electrowetting systems. RSC Advances. 7 (78), 49633-49648 (2017).
- Yoon, J. Y., Garrell, R. L. Preventing biomolecular adsorption in electrowetting-based biofluidic chips. Analytical Chemistry. 75 (19), 5097-5102 (2003).
- Dalvie, M. A., et al. Cost analysis of ELISA, solid-phase extraction, and solid-phase microextraction for the monitoring of pesticides in water. Environmental Research. 98 (1), 143-150 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon