È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Terahertz Imaging and Characterization Protocol for Freshly Excised Breast Cancer Tumors
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I tumori del cancro al seno umano appena ascisi sono caratterizzati da spettroscopia terahertz e imaging seguendo protocolli di manipolazione dei tessuti freschi. Il posizionamento dei tessuti viene preso in considerazione per consentire una caratterizzazione efficace, fornendo al contempo analisi in modo tempestivo per future applicazioni intraoperatorie.
Abstract
Questo manoscritto presenta un protocollo per gestire, caratterizzare e immagini tumori del seno umano appena ascisi utilizzando l'imaging terahertz pulsato e tecniche di spettroscopia. Il protocollo prevede la modalità di trasmissione terahertz a incidenza normale e la modalità di riflessione terahertz ad un angolo obliquo di 30 gradi. I dati sperimentali raccolti rappresentano impulsi del dominio temporale del campo elettrico. Il segnale del campo elettrico terahertz trasmesso attraverso un punto fisso sul tessuto asciso viene elaborato, attraverso un modello analitico, per estrarre l'indice di rifrazione e il coefficiente di assorbimento del tessuto. Utilizzando uno scanner motorio stepper, il terahertz emesso impulso viene riflesso da ogni pixel sul tumore fornendo un'immagine planare di diverse regioni del tessuto. L'immagine può essere presentata nel dominio del tempo o della frequenza. Inoltre, i dati estratti dell'indice di rifrazione e del coefficiente di assorbimento ad ogni pixel vengono utilizzati per fornire un'immagine terahertz tomografica del tumore. Il protocollo dimostra una chiara differenziazione tra tessuti cancerosi e sani. D'altra parte, non aderire al protocollo può provocare immagini rumorose o imprecise a causa della presenza di bolle d'aria e resti di liquido sulla superficie del tumore. Il protocollo fornisce un metodo per la valutazione dei margini chirurgici dei tumori al seno.
Introduzione
L'imaging e la spettroscopia Terahertz (THz) sono state un'area di ricerca in rapida crescita nell'ultimo decennio. Il continuo sviluppo di emettitori THz più efficienti e coerenti nell'intervallo di 0,1-4 THz ha fatto crescere significativamente le loro applicazioni1. Un'area in cui THz ha mostrato promesse e una crescita significativa è il campo biomedico2. La radiazione THz ha dimostrato di non essere non ionizing e biologicamente sicura ai livelli di potenza generalmente utilizzati per analizzare i tessuti fissi3. Di conseguenza, l'imaging e la spettroscopia THz sono stati utilizzati per classificare e differenziare varie caratteristiche dei tessuti come il contenuto di acqua per indicare danni da ustione e guarigione4, cirrosi epatica5e cancro nei tessuti ascisi6,7. La valutazione del cancro copre in particolare una vasta gamma di potenziali applicazioni cliniche e chirurgiche, ed è stata studiata per i tumori del cervello8, fegato9, ovaie10, tratto gastrointestinale11, e seno7,12,13,14,15,16,17,18,19.
Le applicazioni THz per il cancro al seno si concentrano principalmente sul supporto della chirurgia conservativa del seno, o lumpectomia, tramite la valutazione del margine. L'obiettivo di una lumpectomia è quello di rimuovere il tumore e un piccolo strato di tessuto sano circostante, in contrasto con la mastectomia completa, che rimuove l'intero seno. Il margine chirurgico del tessuto asciso viene quindi valutato tramite patologia una volta che il campione è stato fissato in formalina, sezionato, incorporato in paraffina, e montato in 4 fette di m-5 su vetrini al microscopio. Questo processo può richiedere molto tempo e richiede una procedura chirurgica secondaria in un secondo momento se si osserva un margine positivo20. Le attuali linee guida dell'American Society of Radiation Oncology definiscono questo margine positivo come avere cellule tumorali che contattano l'inchiostro margine a livello superficiale21. L'imaging THz per tessuto idratato ad alto assorbimento è principalmente limitato all'imaging superficiale con una penetrazione variabile in base al tipo di tessuto, che è sufficiente per soddisfare le esigenze chirurgiche di valutazione rapida del margine. Una rapida analisi delle condizioni di margine durante l'impostazione chirurgica ridurrebbe notevolmente i costi chirurgici e il tasso di procedura di follow-up. Ad oggi, THz si è dimostrato efficace nel differenziare tra il cancro e il tessuto sano nei tessuti fissati in formalina, incorporati in paraffina (FFPE), ma sono necessarie ulteriori indagini per fornire un rilevamento affidabile del cancro nei tessuti appena assordati7.
Questo protocollo descrive in dettaglio i passaggi per l'esecuzione di imaging THz e spettroscopia su campioni di tessuto umano appena eccitati ottenuti da una biobanca. Le applicazioni THz basate su tessuti di cancro al seno umano appena eccitati sono stati raramente utilizzati nella ricerca pubblicata7,18,22,23, soprattutto da gruppi di ricerca non integrati con un ospedale. L'uso di tessuti appena eccitati è altrettanto raro per altre applicazioni tumorali, con la maggior parte degli esempi di cancro umano non-seno essere segnalati per il cancro colonico24,25. Uno dei motivi è che i blocchi di tessuto FFPE sono molto più facili da raggiungere e gestire rispetto al tessuto appena assornato a meno che il sistema THz utilizzato per lo studio non faccia parte del flusso di lavoro chirurgico. Allo stesso modo, la maggior parte dei sistemi THz di laboratorio commerciale non sono preparati per gestire i tessuti freschi, e quelli che lo fanno sono ancora nelle fasi di utilizzo della crescita della linea cellulare o hanno solo iniziato a guardare il tessuto ascisato da modelli animali. Per applicare tHz a un'impostazione intraoperatoria è necessario sviluppare in anticipo le fasi di imaging e caratterizzazione per i tessuti freschi in modo che l'analisi non interferisca con la capacità di eseguire patologie standard. Per le applicazioni che non sono intrinsecamente destinate ad essere intraoperatorie, la caratterizzazione del tessuto fresco è ancora un passo impegnativo che deve essere affrontato per lavorare verso applicazioni in vivo e differenziazione.
L'obiettivo di questo lavoro è quello di fornire una linea guida per l'applicazione THz per i tessuti appena asbici utilizzando un sistema THz commerciale. Il protocollo è stato sviluppato su un sistema di imaging e spettroscopia THz26 per tumori del cancro al seno murini13,17,19 ed è stato esteso al tessuto chirurgico umano ottenuto dalle biobanche7,18. Mentre il protocollo è stato generato per il cancro al seno, gli stessi concetti possono essere applicati a sistemi di imaging THz simili e ad altri tipi di tumori del tumore solido che vengono trattati con chirurgia dove il successo dipende dalla valutazione del margine27. A causa di una quantità piuttosto piccola di risultati THz pubblicati sui tessuti appena eccitati, questo è il primo lavoro alle conoscenze degli autori per concentrarsi sul protocollo di movimentazione dei tessuti freschi per l'imaging e la caratterizzazione THz.
Protocollo
Questo protocollo segue tutti i requisiti stabiliti dal dipartimento per la salute e la sicurezza ambientale dell'Università dell'Arkansas.
1. Impostare l'area di movimentazione dei tessuti
- Prendere un vassoio metallico in acciaio inossidabile e coprirlo con il sacchetto di rischio biologico come mostrato nella Figura 1. Qualsiasi manipolazione dei tessuti biologici verrà eseguita all'interno dell'area del vassoio (ad esempio, l'area di movimentazione dei tessuti).
- Preparare pinzette da laboratorio, salviette tissutali, asciugamani di carta, pacchetto di carta filtrante, bottiglie di tintura di tessuto, bottiglia di candeggina e bottiglia di etanolo intorno al vassoio per un facile accesso quando necessario. Mantenere i tessuti usati, le salviette e i guanti sulla superficie del materiale di pericolo biologico da smaltire alla fine del protocollo.
- Riempire un tubo di centrifugatura da 50 mL con fino a 45 mL di formalina tampone neutra del 10% e inserirla nel vassoio di stoccaggio della centrifuga vicino al vassoio di movimentazione dei tessuti.
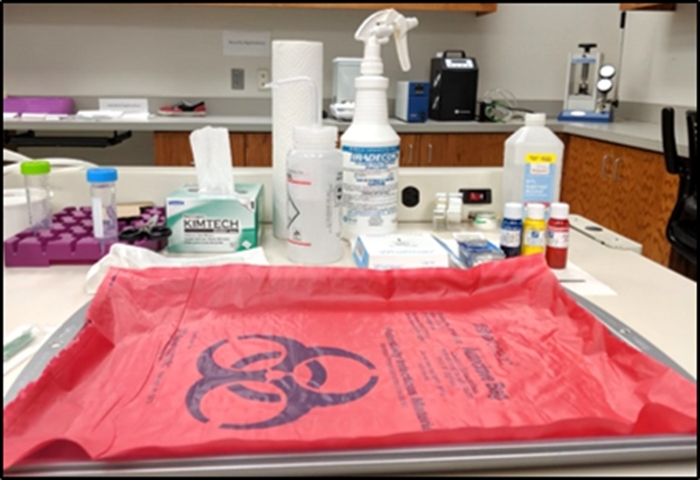
Figura 1: Configurazione dell'area di movimentazione dei tessuti. Fare clic qui per visualizzare una versione più grande di questa figura.
2. Gestione del tumore al cancro al seno fresco per la spettroscopia di trasmissione THz
ATTENZIONE: Prima di maneggiare qualsiasi tessuti vivi, indossare guanti nitrile mano, occhiali di protezione degli occhi, una maschera per il viso, e un cappotto da laboratorio. Utilizzare sempre pinzette da laboratorio per maneggiare i tessuti ed evitare di toccarli direttamente con le mani. Tutto il lavoro con tessuto fresco al di fuori di un contenitore sigillato o la fase di scansione devono essere condotti nell'area di movimentazione dei tessuti stabilita al punto 1.1.
NOT: Tutti i tessuti trattati in questo lavoro sono stati spediti nel mezzo di Dulbecco Modified Eagle (DMEM) e nella soluzione antibiotica della biobanca.
- Rimuovere il tumore sfuso dalla soluzione DMEM e metterlo in un piatto Petri sulla zona di movimentazione dei tessuti (vedere Figura 2A).
- Dall'ispezione lorda, identificare le regioni tumorali distinte da cui tagliare piccoli pezzi per la caratterizzazione della trasmissione. Tagliare un segmento di tumore spesso 0,5 mm dai punti identificati utilizzando una lama a basso profilo in acciaio inossidabile, come mostrato nella Figura 2B. Posizionare questa sezione tagliata tra due finestre di quarzo con un distanziale di 0,1 mm di spessore in un supporto di campione liquido, come illustrato nella Figura 2C.

Figura 2: Sezionamento del tumore per le misurazioni della spettroscopia di trasmissione THz. (A) Fotografia del tumore alla rinfusa. (B) Fotografia delle piccole sezioni (0,5 mm) del tumore tagliato dal tumore alla rinfusa. (C) La sezione tumorale tagliata nel supporto del campione liquido tra le due finestre al quarzo con un distanziale in politetrafluoroetilene da 0,1 mm per la misurazione della spettroscopia. Figura ripubblicata da T. Bowman etal. 18 con il permesso dello SPIE. Fare clic qui per visualizzare una versione più grande di questa figura.
3. Misurazioni spettroscopia di trasmissione THz
- Impostare il modulo di spettroscopia di trasmissione all'interno della camera di base THz allineando le maniglie del modulo sui pali di montaggio nel sistema principale e facendo scorrere la fase verso il basso nel sistema. Stringere le due viti di montaggio negli angoli superiore destro e inferiore sinistro del modulo, come illustrato nella Figura 3A.
- Svuotare il sistema con gas di azoto secco a 5 L/min (LPM) durante l'intera procedura di spettroscopia per rimuovere il vapore acqueo dallo spazio campione.
- Aprire il software di misurazione della spettroscopia di trasmissione THz dal desktop collegato al sistema THz. Si aprirà la finestra principale.
- Fare clic sulla scheda Scansione nella parte superiore della finestra. Verrà visualizzata una finestra Spectra Scan Setup (Imposta scansione Spectra). Dal menu a discesa della scheda Modalità di misurazione in alto a destra nella finestra, selezionare Trasmissione per impostare la spettroscopia di trasmissione. Se il picco non è visibile automaticamente, selezionare l'opzione Abilita nella scheda Ricerca di picco manuale e passare manualmente il ritardo ottico per visualizzare il picco.
-
Dopo 30 min di spurgo, registrare un segnale di riferimento aereo seguendo i passaggi riportati di seguito.
- Nella scheda Impostazioni scansione della finestra di configurazione della scansione degli spetti, immettere un Nome appropriato per il file di riferimento, impostare Num Scans su 1.800 e impostare Ritardo avvio (s) su 0. Lasciare le altre impostazioni come valori predefiniti.
- Fare clic su Misura riferimento nella finestra di configurazione della scansione per eseguire la misurazione del riferimento dell'aria. Quindi fare clic su Misura campione per misurare il segnale di trasmissione attraverso l'aria come una media campione di 1.800 segnali su 1 min.

Figura 3: impostazione del modulo di spettroscopia di trasmissione THz. (A) Camera di base THz con il modulo di trasmissione montato su di esso. (B) Una fotografia del supporto del campione liquido. (C) Il supporto del campione posto all'interno della camera centrale per le misurazioni. Fare clic qui per visualizzare una versione più grande di questa figura.
-
Misurare le due finestre di quarzo nel supporto del campione liquido, come illustrato nella figura 3B.
- Posizionare le due finestre di quarzo nel supporto del campione liquido senza un distanziale in mezzo.
- Aprire la camera di base THz. Montare il supporto del campione liquido sul modulo di spettroscopia di trasmissione, come illustrato nella figura 3C. Chiudi la camera.
- Fare clic sulla scheda Scansione nella finestra principale. Ripetere i passaggi da 3.5.1– 3.5.2 per il campione di quarzo, ma aggiornare ritardo di avvio (s) a 900. Ciò consente di eliminare qualsiasi vapore acqueo prima della misurazione.
- Se il quarzo è desiderato come riferimento per ulteriori campioni, fare clic sulla scheda Cancella riferimento sotto impostazioni scansione. Questo cancella il riferimento dell'aria. Quindi fare clic sulla scheda Misura riferimento per registrare le misure al quarzo come nuovo riferimento.
- Posizionare la sezione tumorale a fette tra le due finestre di quarzo all'interno del supporto del campione liquido e posizionare il supporto all'interno della camera per una misurazione della trasmissione a singolo punto del tessuto. Per registrare la misurazione, ripetere il passaggio 3.6.3.
- Estrarre il supporto del campione liquido dalla camera quando le misurazioni sono state completate e portarlo nell'area designata per la movimentazione dei tessuti. Smontare il supporto del campione liquido, pulire la sezione tumorale dalle finestre di quarzo con le salviette dei tessuti e posizionare le salviette di tessuto usate nello stesso vassoio per smaltire nel sacchetto di rischio biologico insieme agli altri rifiuti di rischio biologico.
- Ripetere i passaggi 2.2, 3.7 e 3.8 in base alle esigenze per caratterizzare ulteriori sezioni tumorali. Una volta completate le misurazioni, andare alla finestra principale e fare clic sulla scheda File per salvare i dati di misurazione. Chiudere la finestra del software.
4. Gestione del tumore al cancro al seno fresco per l'imaging della modalità Reflection THz
- Rimuovere il campione di tumore fresco dalla soluzione DMEM e antibiotici e metterlo su un piatto Petri. Utilizzando l'ispezione lorda, selezionare un lato del tumore da immaginare che è sufficientemente piatto e ha poco sangue e pochi vasi sanguigni. Evitare di imaging tessuto con sangue o vasi sanguigni, se possibile.
- Posizionare il tumore con il lato da immaginare sulla carta filtrante di grado 1 per asciugare il DMEM in eccesso e cancellare il tessuto di liquido o secrezioni dal tumore, come mostrato nella Figura 4A. Riposizionare il tumore sulla carta da filtro in un punto asciutto man mano che la carta si satura. Asciugare il tumore per 5 min.

Figura 4: Preparazione del campione di tumore fresco per l'imaging THz. (A) Tumore posto su carta da filtro per asciugare. ((B)Tumore posto sulla piastra di polistirolo sopra la finestra di imaging con tamponi per pulire i tessuti per assorbire i fluidi in eccesso. (C) Tumore visto dal basso per monitorare l'orientamento e controllare le bolle d'aria. Fare clic qui per visualizzare una versione più grande di questa figura.
- Smontare il modulo di spettroscopia di trasmissione e impostare la base del modulo di immagine di riflessione (RIM) sul sistema di base THz, come illustrato nella Figura 5A. Al momento dell'impostazione degli specchi, montare la fase di scansione RIM sopra la base dello specchio e avvitarla nel sistema di base (vedere La figura 5B).
- Spurgo del sistema con gas di azoto secco a 5 LPM per 30 minuti prima della procedura di imaging per rimuovere il vapore acqueo dal vano campione. Dopo 30 min, ridurre la quantità di gas di azoto secco a 3 LPM per il resto del tempo il sistema è in uso.
- Collocare una piastra di polistirolo di spessore di 1,2 mm sulla finestra di scansione di diametro di 37 mm. Centra la finestra di scansione insieme alla piastra di polistirolo sul palco del campione.

Figura 5: Configurazione del sistema per l'imaging riflesso. (A) Base speculare del modulo di imaging riflesso. (B) Fase di scansione. Fare clic qui per visualizzare una versione più grande di questa figura.
NOT: Altri spessori e materiali per lamiere sono adatti per la fase 4.5, ma dovrebbero avere uno spessore uniforme ed essere di assorbimento sufficientemente basso da non ostacolare il segnale THz.
- Aprire il software di misurazione dell'imaging riflesso THz dal desktop collegato al sistema THz. Apparirà una finestra che mostra diverse icone di finestra di dialogo per funzioni specifiche e due sottofinestre per i grafici di campo THz, (unità arbitrarie a.u.) rispetto al tempo e alla frequenza, rispettivamente.
- Per impostare i parametri per l'impostazione RIM, fare clic sull'icona Della finestra di dialogo Parametro immagine nella parte superiore della finestra. Apparirà una finestra Parametri di Acquisizione Immagine. Selezionare RIM dal menu a discesa della scheda Modello per la configurazione dell'immagine riflesso. Premere OK e tornare alla finestra principale del software.
- Nella finestra principale, fare clic sull'icona Scansione a virgola fissa. Questo attiverà le antenne THz per iniziare l'invio del segnale THz incidente e ricevere il segnale THz riflesso da un singolo punto sulla piastra di polistirolo.
- Fare clic sull'icona Finestra di dialogo dello stage motore nella parte superiore della finestra principale. Si aprirà la finestra di controllo del motore. Regolare l'asse ottico del ritardo facendo clic sulle frecce di direzione avanti/indietro per centrare l'impulso riflesso dal polistirolo nella finestra principale.
NOT: Dopo aver regolato l'asse di ritardo ottico, sulla finestra dovrebbero essere visualizzati due impulsi, come illustrato nella Figura 6:uno dall'interfaccia inferiore della piastra di polistirolo (riflessione primaria) e uno dall'interfaccia superiore della piastra di polistirolo (riflessione secondaria). -
Finestra fuori la riflessione primaria dalla piastra di polistirolo e mantenere la riflessione secondaria nella finestra, che contribuirà ai riflessi dal tessuto durante la procedura di imaging. Questa operazione viene eseguita in due passaggi.
- Innanzitutto, fare clic sul pulsante Impostazioni DAQ nella parte superiore della finestra principale per aprire la finestra di dialogo Impostazioni DAQ. Modificare il valore di ritardo ottico da 5 V (predefinito) a 4 V.
- In secondo luogo, regolare la posizione verticale della fase di scansione con la scala micrometrica sulla fase di scansione fino a quando il minimo dell'impulso secondario è il più forte. Regolare il ritardo ottico dell'asse nella finestra di controllo del motore per posizionare il riflesso primario al di fuori dell'intervallo del segnale riflesso misurato.
NOT: Per una piastra di polistirolo spessa 1,2 mm, la riflessione primaria viene finestrata quando il picco minimo di riflessione secondario è di circa -0,3 mm sull'asse di ritardo ottico della finestra del dominio temporale.
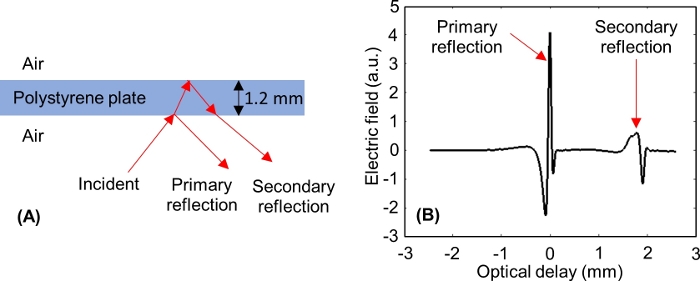
Figura 6: THz riflette dalle interfacce inferiore e superiore della piastra di polistirolo. (A) Incidente segnale THz da una piastra di polistirolo spessa 1,2 mm. (B) Misurato primario e secondario THz tempo dominio dal polistirolo. Fare clic qui per visualizzare una versione più grande di questa figura.
- Livellare la fase campione e registrare il segnale di riferimento.
- Selezionare due punti su ciascun asse (asse A e Asse B) che denotano le posizioni sulla piastra di polistirolo vicino al bordo della finestra campione. Ad esempio, per l'asse A che va da -15 mm–15 mm, i due punti di posizione possono essere -10 mm e 10 mm; e per l'asse B che va da -15 mm-15 mm, i due punti di posizione possono essere -10 mm e 10 mm.
- Fare clic sul pulsante Finestra di dialogo di controllo motore per aprire la finestra di controllo del motore. Riposizionare la finestra di controllo del motore e la finestra principale del software in modo che il segnale del dominio temporale sia visibile durante la regolazione delle posizioni del motore. Impostare sia l'asse A che l'asse B su 0 mm.
- Livellare l'asse A seguendo i seguenti passaggi. Ad esempio viene utilizzato un intervallo da -10 mm-10 mm.
- Nella finestra controllo motore, modificare il valore dell'asse A da 0 a -10 e premere INVIO. Lo stage si sposta alla posizione di -10 mm sull'asse A e si osserva uno spostamento nella posizione del segnale nella finestra principale.
- Utilizzare la scala del micrometro regolabile nella fase di scansione illustrata nella Figura 5B per spostare il picco minimo del segnale nella posizione impostata nel passaggio 4.10.2.
- Modificare il valore dell'asse A in 10 e premere Invio. Lo stage passerà ora dalla posizione di -10 mm alla posizione di 10 mm sull'asse A e si osserva di nuovo uno spostamento del segnale. Si noti la direzione e la distanza con cui il segnale si è spostato dalla posizione precedente e modificare nuovamente il valore dell'asse A in -10. Il segnale tornerà alla posizione impostata nel passaggio 4.11.5.
- Ruotare la vite di livellamento sull'asse A della fase di scansione, come illustrato nella Figura 5B e spostare il segnale per raddoppiare la distanza nella stessa direzione in cui si è spostato dalla posizione originale. Utilizzare il micrometro sulla fase di scansione per riportare il segnale nella posizione originale (-0,3 mm per 1,2 mm di polistirolo).
- Ripetere i passaggi da 4.11.6– 4.11.7 fino a quando il segnale a 10 e -10 è uguale e il picco per entrambe le posizioni è focalizzato sulla posizione originale (-0,3 mm sull'asse ottico).
- Una volta raggiunto il livellamento dell'asse A, modificare il valore dell'asse A su 0 e ripetere la stessa procedura per l'asse B. Iniziare modificando il valore dell'asse B sulla finestra di controllo del motore da 0 al valore più positivo (ad esempio, 10 mm). Inoltre, durante il livellamento, utilizzare la vite di livellamento sull'asse B della fase di scansione, come illustrato nella Figura 5B.
- Una volta che entrambi gli assi sono livellati, riportare sia l'asse A che l'asse B a 0 mm. Chiudere la finestra di controllo del motore e verificare che il segnale sia nella sua posizione originale nel caso in cui venga spostato un po '.
- Registrare questo segnale come riferimento.
- Passare alla finestra Delle proprietà del gruppo DAQ. Modificare il valore medio su 5 e mantenere tutti gli altri parametri come predefinito.
- Fare clic su Nuovo riferimento. Il contatore medio in alto a destra della finestra conterà da 0 a 20. Una volta che il contatore raggiunge 20, modificare il valore medio su 1 e fare clic su OK. Il segnale riflesso dal polistirolo verrà salvato come riferimento per eventuali scansioni eseguite in seguito.
NOTA: Se deve essere eseguita solo la procedura di imaging THz, è meglio eseguire i passaggi da 4.3 a 4.14 prima di estrarre il tessuto tumorale dalla soluzione DMEM.
- Montare il tumore sulla piastra di polistirolo che copre la finestra dello stadio di scansione.
- Rimuovere la finestra di imaging dalla fase di scansione e portarla nell'area di movimentazione dei tessuti. Posizionare il tumore su una piastra di polistirolo, come illustrato nella figura 4B.
- Assicurarsi che non ci siano bolle d'aria significative tra la piastra e il tumore. Se si osservano bolle d'aria, premere il tumore con una pinzetta o sollevare il tumore e rotolare delicatamente sul polistirolo fino a quando le lacune d'aria sono ridotte al minimo.
- Posizionare i distanziali assorbenti a intervalli regolari intorno al campione di prova, come illustrato nella figura 4B. Posizionare un'altra piastra di polistirolo sopra il tumore e premere delicatamente per rendere la superficie del tumore il più piatta possibile. Nastro verso il basso questa disposizione polistirolo-tumore-polistirolo sulla finestra del campione.
- Capovolgere la finestra di esempio come illustrato nella Figura 4Ce scattare foto del tumore per mantenere un record del suo orientamento. Riportare la finestra campione con il tumore alla fase di scansione.
- Fare clic sul pulsante Finestra di dialogo Parametro immagine per aprire la finestra Parametri acquisizione immagine. Impostare i valori di Axis1min, Axis1max, Axis2mine Axis2max per racchiudere completamente la posizione del tumore nella finestra di imaging
NOTA: per impostazione predefinita, Axis1 è l'asse A e Axis2 è l'asse B. - Impostare Axis1step e Axis2step su 0,2 mm per la scansione di imaging.
NOTA: l'impostazione di Axis1step e Axis2step imposterà la dimensione del passo dei motori stepper su incrementi di 200 m durante il processo di scansione. Il tempo di scansione totale può essere stimato nella finestra Parametri acquisizione immagine. - Fare clic sulla scheda Misura nella finestra principale e selezionare l'opzione Scansione 2D Flyback. Nella finestra che si apre, indicare la directory e il nome del file con cui salvare i dati di scansione.
5. Post-elaborazione del tessuto fresco in preparazione per la procedura istopatologia
- Al termine del processo di scansione, rimuovere la finestra campione, le piastre di polistirolo e il campione dal sistema THz del nucleo e spostarli nell'area designata per i rifiuti pericolosi. Rimuovere il tumore dalla piastra di polistirolo e posizionarlo su un pezzo piatto di cartone di una dimensione paragonabile a quella del tumore. Assicurarsi che l'orientamento del tumore sia lo stesso di quello del polistirolo, con il viso di imaging che tocca il cartone.
- Immergere un tampone di cotone in colorante di tessuto rosso e macchiare il lato sinistro del tumore fino a dove il bordo del tumore contatta il cartone. Allo stesso modo, macchiare il lato destro del tumore con colorazione tessuto blu. Macchiare la superficie esposta del tumore con una linea di coloranti tessuto giallo che collega la macchia rossa alla macchia blu per indicare la parte posteriore del campione, come mostrato nella Figura 7A.
NOT: Per evitare che l'inchiostro colori la soluzione di formalità, applicare solo uno strato sottile al tessuto. Questo può essere realizzato tamponando il tampone di cotone su una superficie diversa prima di macchiare il tessuto o utilizzando un tampone di cotone pulito per pulire eventuali coloranti in eccesso. Evitare di lasciare che il tinri contatti la pelle o i vestiti. Questo processo di colorazione del tumore è condotto come riferimento per fornire informazioni sul lato di imaging del tumore e il suo orientamento al patologo.

Figura 7: Post-elaborazione sul tumore dopo l'imaging THz. (A) Tumore posto a faccia in giù su supporto di cartone e tinturato con tintura di tessuto. (B) Filtrare la carta posta sopra il tumore e registrata per mantenere il contatto. (C) Tumore macchiato fissato sul cartone immerso in soluzione di formalina tampone 10% neutro e sigillato con parafilm. Fare clic qui per visualizzare una versione più grande di questa figura.
- Lasciare asciugare l'inchiostro per circa 3-4 min. Tagliare un pezzo di carta da filtro con le stesse dimensioni approssimative del cartone. Posizionarlo sul tumore e avvolgere completamente un pezzo di nastro adesivo intorno alla carta filtrante e cartone come mostrato nella Figura 7B. Il nastro e la carta filtrante dovrebbero fissare il tumore contro il cartone senza applicare alcuna pressione significativa.
- Immergere il tessuto macchiato apposto sul cartone in una soluzione di formalina tampone neutra al 10% e sigillare il tubo di centrifuga utilizzando una pellicola di paraffina, come illustrato nella Figura 7C. Indicare il numero di campione, la data, il tipo di tessuto e il numero di tumore per il campione sull'etichetta del tubo. Inviare il tumore al patologo per un'ulteriore elaborazione istopatologica.
6. Smaltimento di rifiuti pericolosi
- Raccogliere tutti i rifiuti dal vassoio di manipolazione dei tessuti insieme al sacchetto di rischio biologico utilizzato per coprire il vassoio e metterlo in un nuovo sacchetto di rischio biologico, come mostrato nella Figura 8. Portare il sacchetto nell'area di rifiuti biopericolosi designati nell'edificio e fissare un appuntamento con il reparto per la salute e la sicurezza ambientale (EH&S) per il ritiro dei rifiuti. Pulire il vassoio di movimentazione dei tessuti e l'area circostante sul tavolo con la soluzione di candeggina 10% ed etanolo.

Figura 8: Fotografia del sacchetto di rifiuti biopericolosi. Fare clic qui per visualizzare una versione più grande di questa figura.
- Prendi il supporto del campione liquido con i distanziali e le finestre al quarzo, la finestra di campionamento su cui è stato montato il tumore, le piastre di polistirolo e le pinzette da laboratorio nell'area di lavaggio. Risciacquare tutti i materiali con acqua e quindi 10% soluzione di candeggina, asciugandosi con gli asciugamani di carta, se necessario per rimuovere i detriti tissutali. Sciacquare di nuovo con acqua, strofinare con soluzione alconox e risciacquare accuratamente. Per vetro e plastica, risciacquare alcool isopropile al 70% e mettere da parte ad asciugare.
NOT: Una volta che il tumore è in formalina e lo spazio campione è pulito, l'elaborazione dei dati può essere gestita contemporaneamente all'imaging o in un secondo momento.
7. Elaborazione dei dati per costruire immagini THz
- Esportare i file di dati .tvl salvati dal sistema THz. I file di dati grezzi ottenuti dal sistema sono scritti in Python e sono meglio letti in Python prima di salvare come file di dati MATLAB.
- Per costruire l'immagine THz del tessuto fresco scansionato, convertire i dati di imaging di riflessione del dominio temporale grezzo nel dominio di frequenza utilizzando la trasformazione di Fourier sulla terza dimensione della matrice di dati non elaborati (ad esempio, la dimensione temporale). Prendere anche la trasformazione Diessidei dei dati di riferimento.
NOT: Uno spettro tipico del dominio di frequenza deve fornire dati che vanno da 0,1 THz a 4 THz. - Normalizzare i dati di esempio con i dati di riferimento ed eseguire gli spettri di potenza in base all'integrazione dei dati normalizzati nell'intervallo di frequenza da f1 x 0,5 THz a f2 x 1,0 THz utilizzando la seguente equazione19:

NOT: Qui Ecampione è il dominio di frequenza dati di imaging di riflessione del campione di tessuto e riferimento E è il dominio di frequenza di un singolo punto dati di riflessione del segnale di riferimento. - Costruire l'immagine bidimensionale tracciando i dati calcolati degli spettri di potenza in ogni punto della matrice definita dall'asse A e dall'asse B. Questa immagine è nota come Power spectra THz.
NOT: Il metodo per ottenere un'immagine THz tomografica invece è descritto nei passaggi da 7.5 a 7,7. - Per la caratterizzazione, calcolare la riflessione teorica dipendente dalla frequenza per una serie di potenziali proprietà del tessuto utilizzando la seguente equazione18:
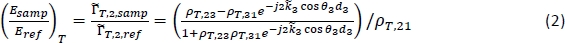
N.B.: In questo caso, il complesso coefficiente di riflessione di Fresnel tra la regione i e la regione j;dj è lo spessore della regione j; e j è l'angolo di propagazione nella regione j correlato all'angolo di incidenza da parte della Legge di Snell. è il coefficiente di propagazione complessa nella regione j, dove è la frequenza angolare, c è la velocità della luce nel vuoto, nj è la parte reale dell'indice di rifrazione, e s,j è il coefficiente di assorbimento18. La regione 1 è l'aria, la Regione 2 è la piastra di polistirolo e la Regione 3 è il tessuto.
è il coefficiente di propagazione complessa nella regione j, dove è la frequenza angolare, c è la velocità della luce nel vuoto, nj è la parte reale dell'indice di rifrazione, e s,j è il coefficiente di assorbimento18. La regione 1 è l'aria, la Regione 2 è la piastra di polistirolo e la Regione 3 è il tessuto. - Calcolare la riflessione nell'equazione (2) per un intervallo di indici di rifrazione definiti dall'utente e coefficienti di assorbimento per la Regione 3 (n3 e zabs,3) e confrontare con il segnale misurato in ogni punto per calcolare l'errore al quadrato medio combinato per la grandezza e la fase.
NOT: La soluzione per l'indice di rifrazione e il coefficiente di assorbimento è la coppia di valori che danno l'errore più basso. - Costruire l'immagine THz tomografica dall'indice di rifrazione estratto e dai dati del coefficiente di assorbimento (n3 e zabs,3) a ogni pixel. Analizzare le regioni tumorali confrontando con l'immagine della diapositiva di patologia ottenuta dal patologo. I risultati rappresentativi sono illustrati nella figura 9, con esempi di aderenza insufficiente al protocollo nella figura 10 e nella figura 11.
8. Estrazione delle proprietà elettriche del tessuto utilizzando i dati di spettroscopia di trasmissione
- Nella finestra principale del software di misurazione della spettroscopia di trasmissione THz, andare alla scheda File e fare clic sull'opzione Esporta. Verrà visualizzata una finestra per selezionare il tipo di dati e l'esempio da esportare. Scegliere i tipi di dati Transmittance and Transmittance Phase per le misurazioni del quarzo e del campione di tessuto.
- Calcolare la trasmissione teorica dipendente dalla frequenza per una serie di potenziali proprietà dei tessuti utilizzando la seguente equazione15:
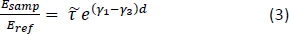
NOT: Ecco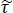 il rapporto tra i coefficienti di trasmissione Disnel per le configurazioni del campione e di riferimento; le1 costanti 3 di propagazione complesse dell'aria e dei tessuti, rispettivamente; e d è lo spessore del tessuto. La costante di propagazione
il rapporto tra i coefficienti di trasmissione Disnel per le configurazioni del campione e di riferimento; le1 costanti 3 di propagazione complesse dell'aria e dei tessuti, rispettivamente; e d è lo spessore del tessuto. La costante di propagazione  in generale è definita come . è l'indice di rifrazione complesso definito come
in generale è definita come . è l'indice di rifrazione complesso definito come  , dove n è la parte reale dell'indice di rifrazione; c è la velocità della luce; è la frequenza angolare; e -abs è il coefficiente di assorbimento15.
, dove n è la parte reale dell'indice di rifrazione; c è la velocità della luce; è la frequenza angolare; e -abs è il coefficiente di assorbimento15. - Calcolare l'errore al quadrato medio combinato tra la grandezza e la fase della trasmissione nell'equazione (3) e i dati di misurazione dal sistema per un intervallo di valori n e zabs definiti dall'utente.
NOT: La soluzione per l'indice di rifrazione e il coefficiente di assorbimento è la coppia di valori che danno l'errore più basso. - Tracciare l'indice di rifrazione estratto e i dati del coefficiente di assorbimento rispetto all'intervallo di Figure 12frequenza compreso tra 0,15 e 3,5 THz.
Risultati
I risultati di imaging THz18 ottenuti seguendo il protocollo di cui sopra del campione di tumore al seno umano #ND14139 ricevuti dalla biobanca sono presentati nella Figura 9. Secondo il rapporto di patologia, il #ND14139 tumore era un carcinoma duttale infiltrante di grado I/II ottenuto da una donna di 49 anni tramite una procedura di chirurgia della lumpectomia mammaria sinistra. La fotografia del tumore è illustrata nella figura 9A, l...
Discussione
L'acquisizione efficace di una riflessione THz del tessuto fresco dipende principalmente da due aspetti critici: 1) la corretta considerazione della manipolazione dei tessuti (sezioni 2 e 4,15); e 2) la messa a punto (principalmente sezione 4.11). Un'essiccazione insufficiente del tessuto può provocare una maggiore riflessione e incapacità di visualizzare le regioni a causa di alte riflessioni di DMEM e altri fluidi. Nel frattempo, un cattivo contatto dei tessuti con la finestra di imaging crea anelli o macchie di bass...
Divulgazioni
Gli autori dichiarano di non avere alcun conflitto di interessi.
Riconoscimenti
Questo lavoro è stato finanziato dal Premio National Institutes of Health (NIH) - R15CA208798 e in parte dal National Science Foundation (NSF) Award - 1408007. I finanziamenti per il sistema THz pulsato sono stati ottenuti tramite il premio NSF/MRI n. 1228958. Riconosciamo l'uso di tessuti acquistati dall'NDRI (National Disease Research Interchange) con il sostegno della sovvenzione NIH U42OD11158. Riconosciamo anche la collaborazione con Oklahoma Animal Disease Diagnostic Laboratory presso l'Oklahoma State University per condurre la procedura di istopatologia su tutti i tessuti gestiti in questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| 70% isopropyl alcohol | VWR | 89108-162 | Contains 70% USP grade isopropanol and 30% USP grade deionized water |
| Alconox powder detergent | VWR | 21835-032 | Concentrated detergent to remove organic contaminants from glass, metal, stainless steel, porcelain, ceramic, plastic, rubber, and fiberglass |
| Bio Hazard Bags | Fisher Scientific | 19-033-712 | Justrite FM-Approved Biohazard Waste Container Replacement Bags |
| Cardboard holder | N/A | N/A | Scrap cardboard to keep tissue imaging face intact when immersed in formalin |
| Centrifuge Tubes | VWR | 10026-078 | Centrifuge Tubes with Flat Caps, Conical-Bottom, Polypropylene, Sterile, Standard Line |
| Cotton Swabs | Walmart | 551398298 | Q-tips Original Cotton Swabs used to dye the tissue |
| Ethyl Alcohol | VWR | 71002-426 | KOPTECH Pure (undenatured) anhydrous (200 proof/100%) ethyl alcohol |
| Eye protection goggles | VWR | 89130-918 | Kimberly-clark professional safety glasses |
| Face Mask | VWR | 95041-774 | DUKAL Corporation surgical masks |
| Filter paper | Sigma Aldrich | Z240087 | Whatman grade 1 cellulose filters |
| Formalin solution | Sigma Aldrich | HT501128-4L | 10% neutral buffered formalin |
| Human freshly excised tumors (Infilterating Ductal Carcinoma (IDC)) | National Disease Research Interchange (NDRI biobank | N/A | A protocol is signed with the NDRI for the type of tumors required |
| IRADECON Bleach solution | VWR | 89234-816 | Pre-diluted Sodium Hypochlorite Bleach solution |
| KIMTECH SCIENCE wipes | VWR | 21905-026 | Kimberly-clark professional Kim wipes |
| Laboratory Coat | VWR | 10141-342 | This catalog number is for medium size coat |
| Laboratory tweezers/Forceps | VWR | 82027-388 | Any laboratory tweezers can be used as long as it does not damage the tissue |
| Liquid sample holder (two quartz windows with a 0.1 mm teflon spacer) | TeraView, Ltd | N/A | 1" diameter, and 0.1452" thick quartz windows |
| Nitrile hand gloves | VWR | 82026-426 | This catalog number is for medium size gloves |
| Nitrogen cylinder | Airgas | NI UHP300 | NITROGEN UHP GR 5.0 SIZE 300 |
| Paper towel | VWR | 14222-321 | 11" x 8.78" Sheets, 1 Ply |
| Parafilm | VWR | 52858-076 | Flexible thermoplastic. Rolled, waterproof sheet interwound with paper to prevent self-adhesion. |
| Petri Dish | VWR | 470210-568 | VWR Petri Dish, Slippable, Mono Plate (undivided bottom) |
| Polystyrene Plate | Home Depot | 1S11143A | ~ 10 cm x 10 cm square piece cut from a 11" x 14" x 0.05" Non-glare styrene sheet |
| ScanAcquire Software | TeraView, Ltd | N/A | System Software for THz reflection imaging measurements |
| Stainless steel low-profile blade (#4689) | VWR | 25608-964 | Tissue-Tek Accu-Edge Disposable Microtome Blades |
| Stainless steel metal tray | Quick Medical | 10F | Polar Ware Stainless Steel Medical Instrument Trays |
| Tissue Marking Dyes | Ted Pella, Inc | Yellow Dye #27213-1 Red Dye #27213-2 Blue Dye #27213-4 | Used to orient excised tissue samples sent to the histopathology laboratory |
| TPS Spectra 3000 | TeraView, Ltd | N/A | THz imaging and spectroscopy system |
| TPS Spectra Software | TeraView, Ltd | N/A | System Software for THz transmission spectroscopy measurements |
Riferimenti
- Burford, N. M., El-Shenawee, M. O. Review of terahertz photoconductive antenna technology. Optical Engineering. 56 (1), 010901 (2017).
- Sun, Q., et al. Recent advances in terahertz technology for biomedical applications. Quantitative Imaging in Medicine and Surgery. 7 (3), 345-355 (2017).
- Wilmink, G. J., et al. In vitro investigation of the biological effects associated with human dermal fibroblasts exposed to 2.52 THz radiation. Lasers in Surgery and Medicine. 43 (2), 152-163 (2011).
- Arbab, M. H., et al. Terahertz spectroscopy for the assessment of burn injuries in vivo. Journal of Biomedical Optics. 18 (7), 077004 (2013).
- Sy, S., et al. Terahertz spectroscopy of liver cirrhosis: investigating the origin of contrast. Physics in Medicine and Biology. 55 (24), 7587-7596 (2010).
- Yu, C., Fan, S., Sun, Y., Pickwell-Macpherson, E. The potential of terahertz imaging for cancer diagnosis: A review of investigations to date. Quantitative Imaging in Medicine and Surgery. 2 (1), 33-45 (2012).
- El-Shenawee, M., Vohra, N., Bowman, T., Bailey, K. Cancer detection in excised breast tumors using terahertz imaging and spectroscopy. Biomedical Spectroscopy and Imaging. 8 (1-2), 1-9 (2019).
- Yamaguchi, S., et al. Brain tumor imaging of rat fresh tissue using terahertz spectroscopy. Scientific Reports. 6 (30124), 1-6 (2016).
- Rong, L., et al. Terahertz in-line digital holography of human hepatocellular carcinoma tissue. Scientific Reports. 5 (8445), 1-6 (2015).
- Park, J. Y., Choi, H. J., Nam, G., Cho, K., Son, J. In Vivo Dual-Modality Terahertz / Magnetic Resonance Imaging Using Superparamagnetic Iron Oxide Nanoparticles as a Dual Contrast Agent. IEEE Transactions on Terahertz Science and Technology. 2 (1), 93-98 (2012).
- Ji, Y. B., et al. Feasibility of terahertz reflectometry for discrimination of human early gastric cancers. Biomedical Optics Express. 6 (4), 1413-1421 (2015).
- Bowman, T., et al. A Phantom Study of Terahertz Spectroscopy and Imaging of Micro- and Nano-diamonds and Nano-onions as Contrast Agents for Breast Cancer. Biomedical Physics and Engineering Express. 3 (5), 055001 (2017).
- Chavez, T., Bowman, T., Wu, J., Bailey, K., El-Shenawee, M. Assessment of Terahertz Imaging for Excised Breast Cancer Tumors with Image Morphing. Journal of Infrared, Millimeter, and Terahertz Waves. 39 (12), 1283-1302 (2018).
- Bowman, T. C., El-Shenawee, M., Campbell, L. K. Terahertz Imaging of Excised Breast Tumor Tissue on Paraffin Sections. IEEE Transactions on Antennas and Propagation. 63 (5), 2088-2097 (2015).
- Bowman, T., El-Shenawee, M., Campbell, L. K. Terahertz transmission vs reflection imaging and model-based characterization for excised breast carcinomas. Biomedical Optics Express. 7 (9), 3756-3783 (2016).
- Bowman, T., Wu, Y., Gauch, J., Campbell, L. K., El-Shenawee, M. Terahertz Imaging of Three-Dimensional Dehydrated Breast Cancer Tumors. Journal of Infrared, Millimeter, and Terahertz Waves. 38 (6), 766-786 (2017).
- Bowman, T., et al. Pulsed terahertz imaging of breast cancer in freshly excised murine tumors. Journal of Biomedical Optics. 23 (2), 026004 (2018).
- Bowman, T., Vohra, N., Bailey, K., El-Shenawee, M. Terahertz tomographic imaging of freshly excised human breast tissues. Journal of Medical Imaging. 6 (2), 023501 (2019).
- Vohra, N., et al. Pulsed Terahertz Reflection Imaging of Tumors in a Spontaneous Model of Breast Cancer. Biomedical Physics and Engineering Express. 4 (6), 065025 (2018).
- Jacobs, L. Positive margins: the challenge continues for breast surgeons. Annals of Surgical Oncology. 15 (5), 1271-1272 (2008).
- Moran, M. S., et al. Society of Surgical Oncology--American Society for Radiation Oncology Consensus Guideline on Margins for Breast-Conserving Surgery With Whole-Breast Irradiation in Stages I and II Invasive Breast Cancer. International Journal of Radiation Oncology. 88 (3), 553-564 (2014).
- Fitzgerald, A. J., et al. Terahertz Pulsed Imaging of human breast tumors. Radiology. 239 (2), 533-540 (2006).
- Ashworth, P. C., et al. Terahertz pulsed spectroscopy of freshly excised human breast cancer. Optics Express. 17 (15), 12444-12454 (2009).
- Doradla, P., Alavi, K., Joseph, C., Giles, R. Detection of colon cancer by continuous-wave terahertz polarization imaging technique. Journal of Biomedical Optics. 18 (9), 090504 (2013).
- Reid, C. B., et al. Terahertz pulsed imaging of freshly excised human colonic tissues. Physics in Medicine and Biology. 56 (1), 4333-4353 (2011).
- . Teraview.com Available from: https://teraview.com (2019)
- Orosco, R. K., et al. Positive Surgical Margins in the 10 Most Common Solid Cancers. Scientific Reports. 8 (1), 1-9 (2018).
- Bowman, T., et al. Statistical signal processing for quantitative assessment of pulsed terahertz imaging of human breast tumors. 2017 42nd International Conference on Infrared, Millimeter, and Terahertz Waves (IRMMW-THz). , 1-2 (2017).
- Gavdush, A. A., et al. Terahertz spectroscopy of gelatin-embedded human brain gliomas of different grades: a road toward intraoperative THz diagnosis. Journal of Biomedical Optics. 24 (2), 027001 (2019).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon