Method Article
Auto-trapianto di rene ortotopico in un modello suino utilizzando la conservazione degli organi 24 ore su 24 e la telemetria continua
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I grandi modelli animali svolgono un ruolo essenziale nella ricerca sui trapianti preclinici. A causa delle sue somiglianze con la configurazione clinica, il modello suino di auto-trapianto renale ortotopico descritto in questo articolo fornisce un eccellente ambiente in vivo per il test delle tecniche di conservazione degli organi e degli interventi terapeutici.
Abstract
Nell'attuale era del trapianto di organi con carenza critica di organi, vengono utilizzate varie strategie per espandere il pool di allosinconi disponibili per il trapianto di rene (KT). Anche se, l'uso di allosinformati provenienti da donatori di criteri estesi (ECD) potrebbe parzialmente alleviare la carenza di donatori di organi, gli organi ECD comportano un rischio potenzialmente più elevato per esiti inferiori e complicanze postoperatorie. Le tecniche dinamiche di conservazione degli organi, la modulazione delle lesioni da ischemia-riperfusione e conservazione e le terapie allograft sono sotto i riflettori dell'interesse scientifico nel tentativo di migliorare l'utilizzo dell'allografto e gli esiti dei pazienti in KT.
Gli esperimenti preclinici sugli animali svolgono un ruolo essenziale nella ricerca traslizionale, specialmente nello sviluppo di dispositivi medici e farmaci. Il principale vantaggio del modello di auto-trapianto ortotopico suino rispetto agli studi ex vivo o di piccoli animali risiede nelle somiglianze chirurgico-anatomiche e fisiologiche con l'ambiente clinico. Ciò consente lo studio di nuovi metodi e tecniche terapeutiche e garantisce una traduzione clinica facilitata dei risultati. Questo protocollo fornisce una descrizione completa e orientata ai problemi del modello di auto-trapianto renale ortotopico suino, utilizzando un tempo di conservazione di 24 ore e il monitoraggio della telemetria. La combinazione di sofisticate tecniche chirurgiche con metodi altamente standardizzati e all'avanguardia di anestesia, alloggiamento degli animali, follow-up perioperatorio e monitoraggio garantiscono la riproducibilità e il successo di questo modello.
Introduzione
Dal primo trapianto renale umano di successo tra gemelli identici nel 1954, eseguito dal gruppo pionieristico del chirurgo premio Nobel Joseph Murray1, il trapiantodi rene (KT) si è evoluto come pilastro del trattamento per i pazienti con malattia renale allo stadio finale (ESRD)2. KT mostra risultati clinici a lungo termine superiori e qualità della vita rispetto alla dialisi2. I tassi di sopravvivenza a breve e lungo termine dopo che KT è migliorato continuamente, a causa dei progressi nelle tecniche chirurgiche, nella conservazione degli organi, nella terapia immunosoppressiva e nelle cure critiche, quindi KT è diventato ampiamente disponibile suscala globale 2,3,4.
A causa della carenza critica di organi, c'è un divario in continuo aumento tra l'offerta di allografte la domanda 3,5,6. Nel 2018, circa 12.031 pazienti erano in attesa di KT in Germania, tuttavia, solo meno del 20% (2.291 pazienti) poteva ricevere un rene donatore a causa dell'estrema carenza di organi per il trapianto7. Purtroppo, non solo il numero assoluto di donatori di organi, ma anche la qualità generale degli allosinnesti offerti per il trapianto sono diminuiti negliultimi decenni 8,9. Una tendenza crescente è stata osservata nel numero di allosinnesti renali premago o "marginali" che dovevano essere accettati per iltrapianto 10. L'uso di allostati ECD può ridurre i tempi di attesa e la morbilità e la mortalità delle liste d'attesa, è tuttavia associato a una maggiore incidenza di complicanze correlate all'innesto come la non funzione dell'innesto primario (PNF) e /o la funzione di innesto ritardato (DGF)8,9,10. Ulteriori ricerche sono essenziali per ottimizzare l'utilizzo dell'allografto, espandere il pool di donatori e proteggere e ricondizionare gli allosintori marginali che alla finepossono migliorare gli esiti del paziente 3,6.
A causa della natura ad alta intensità di risorse e complessa dei grandi modelli di trapianto di animali, un gran numero di studi vengono eseguiti utilizzando piccoli animali o in contesti ex vivo11,12,13,14,15. Sebbene questi modelli possano fornire importanti dati scientifici, la traduzione di questi risultati nell'ambiente clinico è spesso limitata. Il modello suino dell'auto-trapianto renale ortotopico è un modello consolidato e riproducibile che consente di testare nuovi approcci terapeutici innovativi in un ambiente in vivo clinicamente rilevante, con periodi di follow-up potenzialmente più lunghi e abbondanti possibilità di raccolta ripetitivadel campione 16,17. Al di là del vantaggio delle dimensioni comparabili, che consente una traduzione relativamente diretta nell'ambiente clinico (in particolare per lo sviluppo di dispositivi medici e il dosaggio del farmaco), le somiglianze chirurgico-anatomiche e fisiologiche in termini di risposta ischemia-reperfusione (IRI) e danno renale, supportano l'uso di questo modello nella ricerca traslazionale17,18,19. Questo modello offre anche un'eccellente opportunità di formazione per preparare giovani chirurghi trapiantati per le sfide tecniche del trapianto clinico diorgani 20.
Ci sono anche molteplici differenze rispetto all'ambiente umano e varie modifiche tecniche del modello possono essere trovate nellaletteratura 16,17,19,20,21. Questo articolo descrive in modo completo dettagli tecnici, insidie e raccomandazioni che possono aiutare a stabilire il modello di auto-trapianto renale ortotopico suino. Il metodo di telemetria e monitoraggio video descritto, nonché la nostra struttura abitativa appositamente progettata, consentono una valutazione ravvicinata della gravità e l'osservazione clinica degli animali. L'uso di un catetere urinario percutaneo e di giacche suine designate offre la possibilità di una valutazione dettagliata della funzione renale senza l'uso di gabbie metaboliche. Queste modifiche tecniche sono descritte come potenziali soluzioni per soddisfare le moderne sfide del principio 3R (Sostituzione, Riduzione e Perfezionamento) e migliorare gli esperimenti sugli animali utilizzando grandi modelli animali22.
Protocollo
Il presente studio è stato progettato secondo i principi delle linee guida ARRIVE (Animal Research: Reporting of In Vivo Experiments)23. Gli esperimenti sono stati eseguiti in conformità con le linee guida istituzionali e la legge federale tedesca in materia di protezione degli animali. La proposta etica completa è stata approvata dalle autorità responsabili (Governmental Animal Care and Use Committee, LANUV NRW - "Landesamt für Natur, Umwelt und Verbraucherschutz Nordrhein-Westfalen", Recklinghausen, Germania, ID protocollo: 81-02.04.2018.A051). Tutti gli animali del presente studio hanno ricevuto cure umane secondo i principi della "Guida alla cura e all'uso degli animali da laboratorio" (ottava edizione, pubblicazione NIH, 2011, USA) e della direttiva 2010/63/UE sulla protezione degli animali utilizzati a fini scientifici (Gazzetta ufficiale dell'Unione Europea, 2010). I maiali landrace tedeschi femminili sono stati ottenuti da un impianto di allevamento di barriere ottimizzato igienicamente (Heinrichs GbR, Heinsberg, Nordrhein-Westfalen). La figura 1 illustra il riassunto del protocollo sperimentale descritto.
1. Animali e alloggi
- Utilizzare maiali landrace tedeschi (o comparabili) femminili per questo protocollo. Consegnare gli animali all'impianto di ricerca 14 giorni prima del primo intervento chirurgico (impianto di telemetria) per l'acclimatazione e ospitarli in un ambiente barriera controllato da temperatura e umidità con un ciclo di luce e buio di 12 ore (Figura 2).
- Montare due ricevitori di telemetria sul soffitto della stanza che consente di trasferire i dati registrati direttamente su un PC situato nella sala di osservazione. Assicurarsi che gli animali siano osservati visivamente durante le visite regolari da parte dei veterinari e del custode animale responsabile (ogni 8 ore e su richiesta).
NOTA: Inoltre, in questo esperimento è stato utilizzato un filmato della telecamera in tempo reale con imaging termico integrato collegato alla rete locale. I dettagli dell'impianto abitativo utilizzato nel presente studio sono illustrati nella figura 2.
2. Tecniche di base e procedure comuni
- Digiunare gli animali durante la notte prima dell'intervento chirurgico.
- Premedicato mediante iniezione intramuscolare iniziale di azaperone (4 mg/kg) e atropina (0,1 mg/kg), seguito da un'iniezione di chetamina (15 mg/kg) 10 min dopo.
- Dopo la premedicazione, pesare l'animale e trasferirlo direttamente dalla struttura abitativa alla sala centrale di preparazione dell'anestesia della struttura OR.
- Cannulate una delle grandi vene dell'orecchio usando un catetere venoso periferico da 18 G. Monitorare l'animale con un ECG standard e un'ossimetria a impulsi.
- Avviare l'anestesia con propofolo (3 mg/kg).
- Esporre la corda vocale con un laringoscopio e inserire un tubo endotracheale da 7,5 mm. Il bracciale è bloccato con aria secondo le raccomandazioni del produttore.
- Inserire un tubo di drenaggio oro-gastrico per rimuovere fluido e aria dallo stomaco.
- Inserire un catetere urinario attraverso l'uretra.
- Successivamente, tagliare la pelle nell'area dell'incisione chirurgica.
- Applicare unguento per gli occhi per prevenire l'essiccazione della cornea durante l'intervento chirurgico.
- Dopo l'intubazione orotracheale, mantenere l'anestesia con isoflurane (espiratorio finale 1,45-2,0 Vol.%) e fentanil (3 -7,5 μg/kg/h).
- Garantire il controllo attivo della temperatura intraoperatoria dell'animale da parte di una pastiglia riscaldante e utilizzando aria riscaldata. Inserire una sonda rettale per monitorare la temperatura corporea (temperatura target 36,5 °C - 37,5 °C).
- Somministrare profilassi antibiotica utilizzando cefuroxime (35 mg/kg di i.v.). Infondere la soluzione di suoneria a 4 mL/kg/h e aumentare a 8 mL/kg/h dopo l'incisione cutanea. Somministrare una dose profilattica di pantoprazolo (40 mg i.v.) sull'accesso alle vene dell'orecchio.
- Eseguire tutte le procedure chirurgiche in condizioni sterili secondo i principi generali dell'asepsi chirurgica e dell'antisepsi. Disinfettare il campo chirurgico con soluzione di povidone-iodio e coprire con tende chirurgiche.
3. Impianto di telemetria
- Preparare l'animale per l'intervento chirurgico seguendo i passaggi descritti nella sezione 2 del protocollo e confermare l'anestesia corretta con una frequenza cardiaca decrescente e una mancanza di movimento cosciente dell'animale.
- Raccogliere campioni di sangue e urine per determinare i singoli valori di laboratorio di base.
- Contrassegnare i siti di incisione utilizzando un marcatore permanente.
- Per impiantare il sensore arterioso del transponder di telemetria, eseguire un'incisione di 3-4 cm nell'inguine. Esporre e sezionare l'arteria in modo a 360°.
- Utilizzando un morsetto Overholt tirare attraverso anelli a due vasi sotto l'arteria e fissarli con morsetti di zanzara.
- Dopo aver fatto un'arteriotomia usando #11 bisturi della lama, inserire il sensore arterioso. Chiudere l'arteriotomia utilizzando la sutura in polipropilene 5-0 con suture a nodo singolo e fissare il sensore arterioso utilizzando una di queste suture.
- Fai un'incisione grande 3-4 cm sul fianco sinistro dell'animale e crea una busta sottocutanea per il transponder per dissezione smussata.
- Tunnelare il transponder di telemetria sul fianco e fissarlo alla fascia muscolare (3-0 polipropilene, nodo singolo). Tunnelare gli elettrodi ECG rossi e bianchi sul lato destro e sinistro del torace. Effettuare due incisioni di 1 cm e fissare gli elettrodi nel tessuto muscolare per garantire un buon segnale ECG con suture a nodo singolo (poliglactina 3-0).
- Inizia la registrazione dei dati di telemetria e controlla i vari segnali (ad esempio, la temperatura corporea registrata dal corpo del transponder stesso, la pressione arteriosa e i segnali ECG).
- Chiudere le incisioni nell'inguine, sul fianco sinistro e le due piccole incisioni toraciche usando suture muscolari e sottocutanee (3-0 poliglactina) e chiudere la pelle usando una sutura monofilamento non assorbibile (ad esempio, 2-0 Prolene).
- Utilizzare una medicazione a film spray per sigillare i siti di incisione.
- In questo momento prepara l'animale a indossare una giacca di porcino designata che l'animale indossa per il resto del periodo di studio. Sostituire le giacche con una giacca pulita dopo ogni intervento chirurgico.
NOTA: Per registrare dati di base stabili, i transponder di telemetria vengono impiantati 14 giorni prima dell'intervento chirurgico all'indice (nefrectomia sinistra, vedere anche Discussione).
4. Nefrectomia e recupero dell'innesto renale
- Preparare l'animale per l'intervento chirurgico di recupero dell'innesto seguendo le procedure descritte nella sezione 2.
- Dopo l'induzione dell'anestesia, cannulato la vena giugulare esterna. Dopo la disinfezione sterile del campo chirurgico, viene effettuata un'incisione di 4 cm sul lato destro nella scanalatura giugulare.
- Sezionare il tessuto sottocutaneo e il muscolo per esporre la vena giugulare esterna.
- Esporre e sezionare la vena in modo a 360°.
- Utilizzando un morsetto Overholt tirare attraverso anelli a due vasi sotto la vena e fissarli con morsetti di zanzara.
- Tunnelare il catetere giugulare sul retro dell'animale. Per questo, posizionare il maiale sul lato sinistro. Utilizzate il metodo Seldinger per inserire il catetere giugulare.
- Chiudere l'apertura sulla vena e fissare il catetere utilizzando la sutura in polipropilene 5-0.
- Chiudere l'incisione in due strati (ad esempio, poliglatina 3-0 per il muscolo e sottocutaneo e 2-0 polipropilene per la pelle).
- Fissare il catetere alla pelle con suture multiple (2-0 polipropilene).
- Testare il catetere venosa giugulare per l'aspirazione e l'iniezione gratuite. Successivamente, passare la linea endovenosa dalla cannula della vena dell'orecchio alla linea venosa centrale.
- Dopo la disinfezione chirurgica e il drappeggio, eseguire una laparotomia mediana per aprire l'addome (25-30 cm). Utilizzare un riavvolgitore addominale standard per esporre il campo chirurgico.
- Utilizzare asciugamani addominali bagnati e caldi per coprire il colon e il piccolo intestino. Chiedi al secondo assistente di tenere l'intestino nella direzione dell'emi-addome destro esponendo il rene e le sue strutture vascolari.
- Aprire lo strato peritoneale e sezionare il rene sinistro e l'uretero da qualsiasi tessuto aderente usando la cauteria monopolare, le forcelle bipolari e le forbici fini.
- Ligate e dividere l'uretro sinistro (poliglatina 3-0) lasciando un segmento lungo almeno 10-12 cm.
- Completare la dissezione delle vene renali sinistra e dell'arteria alla loro origine rispettivamente dalla vena cava inferiore e dall'aorta.
NOTA: Evitare lesioni e apertura dei grandi vasi linfatici in questa regione anatomica. Essere anche consapevoli di una potenziale lesione alla vena azygo-lombare che si unisce alla vena renale vicino alla sua origine dalla vena cava. - Sezionare e legare la vena azigo-lombare tra due legature (3-0 poliglatina).
- Prepararsi per la dissezione del back-table usando una ciotola di ghiaccio e una copertura sterile.
- Per recuperare il rene di innesto, bloccare l'arteria renale e la vena renale vicino all'aorta e alla vena cava con morsetti vascolari. Rimuovere l'innesto renale tagliando i vasi con una forbice vicino ai morsetti, quindi consegnare il rene alla squadra del tavolo posteriore.
- Chiudere il ceppo dell'arteria renale usando una sutura in polipropilene 5-0. Chiudere la vena renale utilizzando una sutura continua a due strati con polipropilene 5-0. Rimuovere i morsetti vascolari.
- Dopo aver controllato l'area per sanguinamento o perdita linfatica, chiudere l'addome in 4 strati.
NOTA: Peritoneo: 3-0 sutura di poliglactina; fascia: 0 sutura di poliglactina; strato sottocutaneo: 3-0 sutura di poliglactina; pelle: cucitrici della pelle dopo un intervento chirurgico di recupero renale, per facilitare la riapertura dell'addome il giorno successivo e 2-0 suture a nodo singolo in polipropilene dopo la procedura di trapianto per la chiusura definitiva. - Dopo aver applicato la medicazione sterile della ferita, riportare l'animale nella struttura abitativa e consentire il recupero dopo l'estrezione endotracheale. Per l'analgesia postoperatoria, utilizzare la buprenorfina (0,05 - 0,1 mg/kg) per via intramuscolare ogni 8 ore fino all'auto-trapianto.
5. Conservazione del back-table e degli organi
- Dopo il recupero dell'innesto, cannuare immediatamente l'arteria renale usando un catetere periferico standard da 14 G (arancione) e fissarlo usando un laccio emostatico preparato da poliglactina 3-0.
- Risciacquare il rene con soluzione di conservazione degli organi freddi.
- Dopo il lavaggio con 500 mL di soluzione di conservazione degli organi, rimuovere la cannula arteriosa, avvolgere l'innesto renale in sacchetti di organi sterili e conservare in soluzione di conservazione degli organi con un tempo ischemico freddo target (CIT) di 24 ore a 4 °C utilizzando un circuito di raffreddamento controllato dal computer.
NOTA: Si consiglia un breve scarico post-conservazione utilizzando 500 mL di soluzione salina normale a 4 °C.
6. Nefrectomia contralaterale e auto-trapianto di rene ortotopico
- Durante l'operazione ricevente, adattare la premedicazione e l'anestesia iniziale al metabolismo renale limitato ed evitare l'uso di ketamina. L'induzione viene eseguita con propofolo (3-5 mg/kg i.v.), midazolam (0,25 mg/kg di i.v.) e atropina (0,1 mg/kg i.m.). Successivamente, la preparazione preoperatoria è identica alle procedure descritte nella sezione 2.
- Mantenere l'anestesia con isoflurane (espiratorio finale 1,45-2,0 Vol.%) e fentanil (3 - 7,5 μg/kg/h) e propofolo (2 - 4 mg/kg/h).
- Controllare e monitorare continuamente L'ECG, l'ossimametria dell'impulso, la temperatura rettale e la funzione del transponder di telemetria.
NOTA: L'anestesia rigorosa e il controllo della pressione sanguigna sono di importanza cruciale durante la procedura di impianto. - Nei rari casi in cui il segnale di pressione arteriosa registrato sul transponder di telemetria non è soddisfacente a causa della posizione supina dell'animale, posizionare un ulteriore catetere arterioso nell'arteria femorale destra usando la puntura percutanea e la tecnica Seldinger.
- Dopo drappeggi sterili, riaprire la laparotomia mediana ed esporre il campo chirurgico utilizzando il riavvolgitore addominale. Il colon e il piccolo intestino sono posizionati sul lato sinistro dell'addome per esporre il rene destro intatto.
- Simile alla procedura del donatore, sezionare il rene contro-laterale e i suoi vasi dal tessuto circostante. Sezionare la vena renale destra e l'arteria renale nella direzione dell'hilum renale per garantire una lunghezza sufficiente del vaso per l'anastomosi.
- 5 min prima del bloccaggio vascolare, iniettare natrium-eparina per via endovenosa (100 I.U./ kg).
- Bloccare l'arteria renale destra e la vena renale destra utilizzando morsetti vascolari. Il rene destro viene rimosso. Le navi vengono controllate per verifica l'integrità prima di iniziare l'anastomosi.
- Posizionare il rene di innesto conservato nell'addome e iniziare le anastomosi venose e arteriose.
- Da questo punto in poi, mantenere la pressione arteriosa media oltre 80-90 mm Hg per garantire una buona perfusione precoce dell'innesto renale dopo la riperfusione. Raggiungere questo obiettivo parzialmente con un'adeguata gestione del volume e in parte con la somministrazione di noradrenalina (0,1 - 1,0 μg/kg/min come infusione continua utilizzando la pressione arteriosa media e la frequenza cardiaca per monitorare l'efficienza).
- Eseguire anastomosi end-to-end della vena renale:
- Dopo aver posizionato due punti d'angolo utilizzando il polipropilene 5-0, suturare la parete posteriore in modo continuo.
- Legare il punto d'angolo cranici e legarlo insieme al filo utilizzato per la parete posteriore.
- Dopo aver terminato la parete posteriore, utilizzare il punto d'angolo cranicio per suturare la parete anteriore in direzione cranio-caudale. Lavare la vena con soluzione salina eparinata (100 I.U./mL). Legare il punto d'angolo caudale.
NOTA: In caso di disallineamento delle dimensioni tra il donatore e il lato ricevente, è possibile utilizzare un piccolo fattore di crescita per garantire un'anastomosi ampia e sufficiente. Ci sono molte possibili variazioni dei rami della vena renale suina. Nel caso dell'anatomia venosa complessa, è necessario un approccio all'anastomosi modificato (cfr. figura 3).
- Eseguire l'anastomosi end-to-end dell'arteria renale:
- Utilizzare un punto d'angolo cranica in polipropilene 6-0 per eseguire l'anastomosi arteriosa. Posizionare un ulteriore punto d'angolo caudale e di supporto che viene successivamente rimosso, è facoltativo.
- Suturare la parete posteriore in modo continuo utilizzando la tecnica del paracadute. Dopo essere arrivato all'angolo caudale rimuovere il secondo punto d'angolo (se applicabile).
- Sutura la parete frontale con l'altra estremità della sutura in polipropilene 6-0 a doppio braccio. Lavare l'arteria con una soluzione salina eparinizzata (100 I.U./mL). Legare i due fili all'angolo caudale.
- Registrare il tempo necessario per eseguire entrambe le anastomosi con un tempo di ischemia calda target di <40 min.
- Perperfondire il rene aprendo il morsetto vascolare venoso e successivamente il morsetto arterioso. Verificare la presenza di sanguinamento significativo.
- Se non si osserva sanguinamento significativo dalle anastomosi, scartare l'innesto renale e versare una soluzione salina normale calda nell'addome che copre l'innesto perperfuso.
- Riposizionare l'innesto, se necessario, per garantire una riperfusione omogenea ed evitare la congestione.
- Somministrare la papaverina localmente all'esterno dell'arteria renale e dell'anastomosi arteriosa (5 mL non diluita).
- Dopo la riperfusione, infondere 250 mL di soluzione di glucosio al 20% per indurre la dieresi osmotica seguita dalla somministrazione di una singola dose di 80 mg di furosemide.
NOTA: A seguito di ciò, si può osservare la produzione iniziale di urina. - Per garantire il drenaggio urinario, passare un catetere di urina pediatrica francese attraverso la parete addominale del fianco destro dell'animale, retroperitonealmente.
- Fissare il catetere nell'uretro usando le legature (poliglatina 2-0) e bloccare il catetere con 2 mL di soluzione salina. Ulteriori suture vengono utilizzate per adattare e fissare l'uretro al peritoneo della parete addominale (2-0 polipropilene). Il catetere è anche fissato alla pelle con almeno due suture a nodo singolo (2-0 polipropilene).
- Chiudere lo strato peritoneale sul rene per evitare la lussazione dell'innesto renale e l'incepporsi delle anastomosi vascolari (3-0 poliglatina).
- Chiudere l'addome in modo simile a 4 strati come descritto in precedenza per il recupero dell'innesto.
- Dopo la chiusura addominale, mantenere la normotermia sul tavolo OR.
NOTA: La pressione arteriosa media deve essere mantenuta oltre 80 mm Hg fino a quando l'animale non è sveglio ed è in una posizione soggetta. - Dopo la chiusura addominale, utilizzare ultrasuoni Doppler a colori per garantire un'adeguata perfusione arteriosa e venosa dell'innesto renale (Figura 4). Monitora attentamente l'animale fino a quando non è completamente sveglio e può camminare e bere spontaneamente. Agli animali vengono somministrati 1 L di soluzione Ringer durante la fase di recupero.
- Successivamente, riportare l'animale nella sua scatola nella struttura abitativa.
7. Follow-up, campionamento e raccolta dati
- Fornire agli animali acqua ad libitum non appena possono bere spontaneamente. Fornire cibo solido dal giorno postoperatorio 1.
- Per l'analgesia postoperatoria, somministrare buprenorfina (0,05 - 0,1 mg/kg) per via intramuscolare ogni 8 ore per 72 ore, somministrare pantozolo (40 mg i.v.) una volta al giorno per 72 ore. Fornire un trattamento antibiotico (cefurossima 35 mg/kg di i.v. 2 volte al giorno) e profilassi della trombosi (500 mg di acido acetilsalicilico dal giorno postoperatorio 1) durante l'intero periodo di osservazione fino alla fine dell'esperimento.
NOTA: Se si verificano complicazioni di sanguinamento, l'aspirina viene interrotta. - Registrare i dati di telemetria continui durante il periodo di osservazione. Assicurarsi che gli animali siano visitati almeno ogni 8 ore dal veterinario e/o da un tecnico veterinario esperto e che le loro condizioni cliniche siano valutate utilizzando una scheda di valutazione utilizzata come base per terminare prematuramente l'esperimento, se richiesto dalle condizioni cliniche dell'animale.
NOTA: questi cosiddetti criteri endpoint umani sono definiti come descritto in precedenza24. - Eseguire la raccolta giornaliera del campione utilizzando la linea venosa centrale e il catetere urinario percutaneo. Cambiare le buste urinarie (2.000 mL) 2 volte al giorno.
- Dopo la raccolta del campione o la somministrazione di liquidi o farmaci, bloccare il catetere venoso centrale con soluzione salina eparinizzata (100 I.U./mL) tra ogni uso per evitare l'occlusione e coprirlo con un nuovo cappuccio sterile.
- Dopo il corrispondente periodo di osservazione da 5 a 7 giorni, sacrificare gli animali in anestesia profonda a seguito di relaparotomia, raccolta del campione ed espianto dell'innesto renale. Il sacrificio viene eseguito utilizzando una singola iniezione di pentobarbital (50 - 60 mg / kg i.v.).
NOTA: In conformità con il principio 3R, gli organi e i tessuti rimanenti degli animali sacrificati possono essere utilizzati per vari scopi di ricerca ex vivo ed educativi negli istituti interni.
Risultati
Il nostro gruppo ha diversi anni di esperienza con modelli di trapianto di organi solidi in animali piccoli e grandi e ha utilizzato il modello di auto-trapianto renale ortotopico suino, ottenendo risultati riproducibili invari contesti sperimentali 16,25,26,27. A seconda della configurazione sperimentale, si consiglia di eseguire da 3 a 5 trapianti automatici come esperimenti preliminari che garantisce una curva di apprendimento sufficiente dell'intero team sperimentale. Nell'attuale contesto sono stati necessari 5 trapianti per formare un chirurgo, con 8 anni di precedente esperienza chirurgica sperimentale e 5 anni di esperienza chirurgica clinica nel campo della chirurgia dei trapianti, nell'esecuzione di questi esperimenti. Questo può variare a seconda della precedente esposizione del chirurgo a queste tecniche.
Nell'ambito di questo protocollo, vengono dimostrati i risultati di una serie di 5 esperimenti di auto-trapianto di rene ortotopico suino. L'impianto di transponder ha avuto successo in ogni animale con sufficienti segnali di telemetria durante tutto il periodo di osservazione (tranne un animale con disfunzione parziale del transponder). L'intervallo da coltello a pelle per l'impianto del transponder è stato di 85 minuti ± 5 min(tabella 1). Dopo il recupero dell'innesto, tutti gli animali si sono ripresi bene nella struttura abitativa. L'intervallo da coltello a pelle per l'intervento di recupero è stato di 135 min ± 32 min (di cui circa 30-45 minuti per l'inserimento, il tunneling e la messa in sicurezza del catetere giugulare). Il rene sinistro è stato conservato in un bagno d'acqua fredda con un tempo di ischemia fredda bersaglio di 24 ore (24 ore ± 30 minuti). Il giorno seguente, dopo l'induzione e la relaparotomia dell'anestesia, il rene contralaterale (destro) è stato rimosso seguito dall'auto-trapianto ortotopico dell'innesto renale sinistro conservato a freddo come descritto in precedenza. L'intervallo da coltello a pelle per l'intervento di autotrapianto è stato di 168 minuti ± 27 minuti (incluso l'espianto del rene destro). Il tempo caldo di ischemia era di 34 minuti ± 7 minuti. Ogni innesto renale impiantato aveva una produzione minima ma diretta di urina dopo la riperfusione. Dopo la chiusura addominale, gli ultrasuoni Doppler a colori hanno mostrato una perfusione arteriosa e venosa soddisfacente del rene in tutti i casi(Figura 4). Tutti gli animali recuperati dall'anestesia e non sono state osservate complicazioni significative durante il periodo di osservazione. Sono stati raccolti campioni giornalieri di sangue e urine. Tutti i maiali erano in buone condizioni cliniche durante il follow-up e sono stati sacrificati dopo 5 giorni. I valori di creatinina sierica e potassio hanno raggiunto il picco su POD3-4. Il pH nel sangue è rimasto entro intervalli normali(figura 5). La produzione di urina è stata recuperata a valori normali nei primi quattro giorni postoperatori. Il numero di globuli bianchi è leggermente aumentato alla fine del periodo di follow-up (figura 5). La temperatura corporea, misurata mediante monitoraggio continuo della telemetria, ha mostrato lievi fluttuazioni nel periodo postoperatorio.
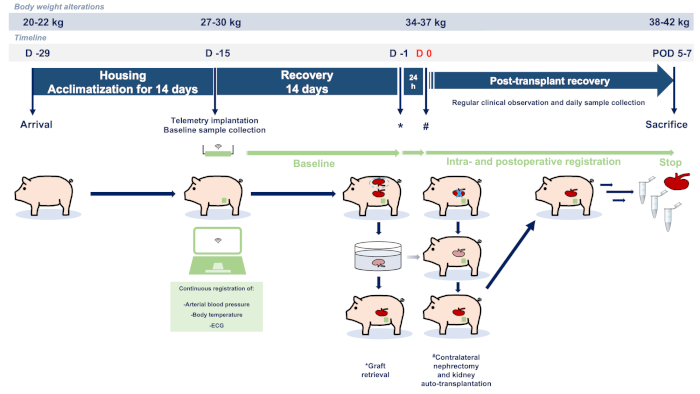
Figura 1: Diagramma di flusso e protocollo dello studio. Abbreviazioni utilizzate: GIORNO POD-postoperatorio; Elettrocardiografia ECG. Clicca qui per visualizzare una versione più grande di questa figura.
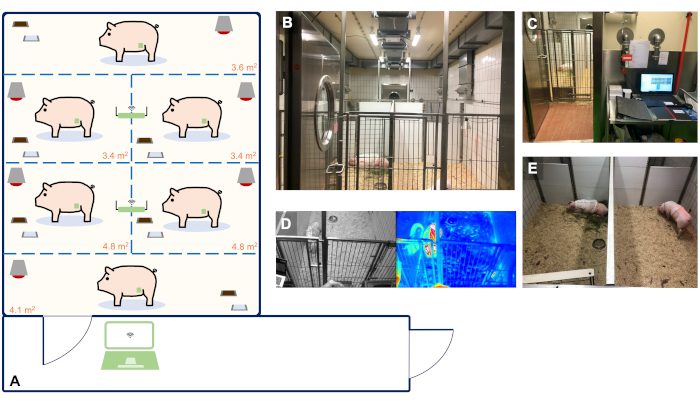
Figura 2: Impianto di alloggiamento degli animali con monitoraggio della telemetria in tempo reale e continuo di un massimo di 6 animali. (A) Schematico della nostra struttura adatto per l'alloggiamento e il monitoraggio della telemetria di un massimo di 6 animali. Le dimensioni delle singole scatole di detenzione sono state determinate sulla base delle linee guida della direttiva UE 2010/63 e dell'appendice A dell'ETS 123. I pannelli A-E mostrano immagini rappresentative dell'organizzazione della nostra struttura. (B)Stanza degli animali per l'alloggiamento di 6 animali. (C) Sala di osservazione con PC utilizzato per la registrazione continua dei dati di telemetria. (D) Riprese video e termiche in tempo reale degli animali. (E)Azienda individuale che assicura il contatto acustico e olfattivo degli animali con i loro compagni per evitare l'isolamento sociale. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Auto-trapianto di rene ortotopico e variazioni anatomiche e possibilità di ricostruzione. (A,B) Le fasi del modello ortotopico di auto-trapianto renale in caso di anatomia vascolare "standard". (C) Variazione 1: mentre una vena più grande viene fornita con il rene donatore, ci sono due vene sul lato ricevente. Gestione: la vena più piccola è chiusa da una legatura e l'anastomosi viene eseguita end-to-end tra le vene renali. (D) Variazione 2: mentre una vena più grande viene fornita con il rene donatore, non esiste un recipiente adatto sul lato contralaterale (ad esempio, disallineamento delle dimensioni). Gestione: anastomosi end-to-side della vena renale alla vena cava inferiore. (E) Variazione 3: due vene di dimensioni simili su entrambi i lati. Gestione: ricostruzione da parte di due anastomosi venose. (F) Variazione 4: mentre due vene di dimensioni simili sono con il rene donatore, non esiste un recipiente adatto sul lato contralaterale. Gestione: anastomosi end to side della vena renale alla vena cava inferiore nel caso di due vene renali. (G) Variazione 5: un rene donatore viene fornito con una vena che mostra una biforcazione precoce, mentre c'è una grande vena sul lato contralaterale. Gestione: anastomosi end-to-end del breve canale comune della vena renale del donatore con una grande vena sul lato ricevente. (H) Variazione 6: mentre il rene donatore è dotato di una singola vena renale con una biforcazione precoce, non esiste un recipiente adatto sul lato contralaterale. Gestione: anastomosi end to side del breve canale comune della vena renale donatrice alla vena cava inferiore. Questa figura descrive una manciata delle variazioni più frequenti e non è statisticamente completa in termini di tutte le variazioni possibili nei maiali di razza terrestre tedeschi. Abbreviazioni utilizzate: innesto di KG-rene; Rene destro RK; Vena cava ivc-inferiore; AO-aorta Clicca qui per visualizzare una versione più grande di questa figura.
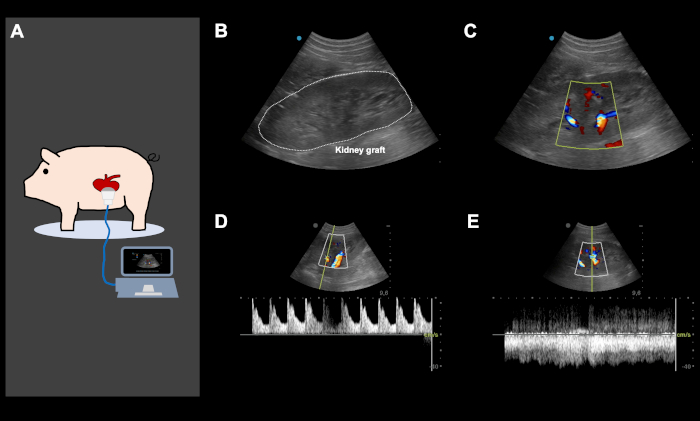
Figura 4 :Immagini ecografiche Doppler a colori rappresentative, direttamente dopo il trapianto automatico di rene ortotopico e la chiusura addominale. (A) L'ecografia Color Doppler viene eseguita direttamente dopo l'impianto della chiusura renale e addominale, per garantire una buona perfusione arteriosa e venosa dell'innesto renale e per lo schermo per potenziali nodi vascolari iatrogeni. Gli ultrasuoni sono stati utilizzati anche quotidianamente e su richiesta, in base alle prestazioni cliniche dell'animale per lo schermo per vari problemi. (B-E) Immagini ecografiche rappresentative di un innesto renale dopo l'impianto. L'immagine dell'innesto renale con e senza colore Doppler (B,C) mostra un'eccellente perfusione arteriosa (D) e venosa (E). Questa figura mostra immagini rappresentative dello stesso animale. Clicca qui per visualizzare una versione più grande di questa figura.
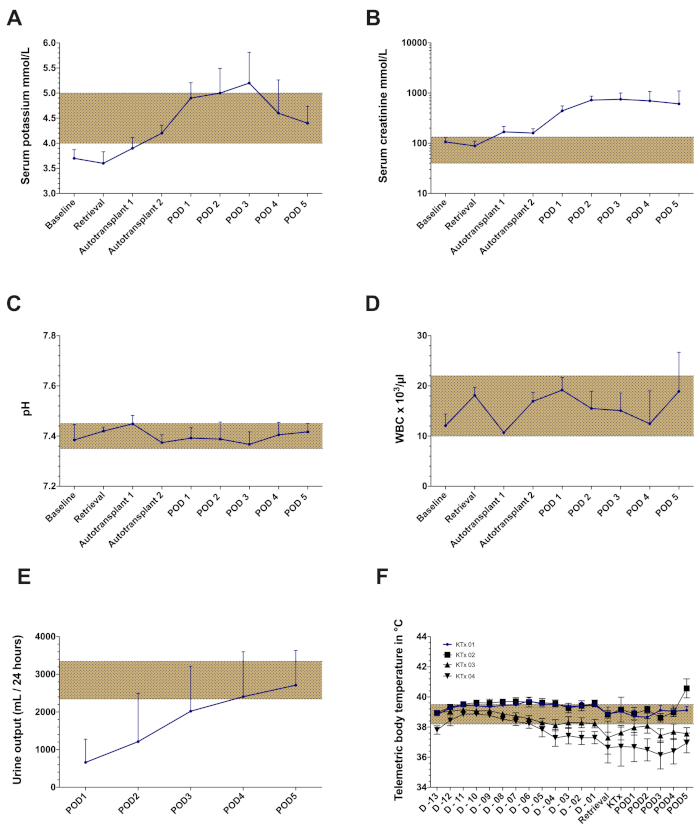
Figura 5: Risultati rappresentativi di laboratorio e dati di telemetria del modello ortotopico di auto-trapianto renale con un tempo di ischemia fredda di 24 ore. (A) Valori sierico di potassio (B) Valori di creatinina sierica (C) pH (D) Numero di globuli bianchi (WBC) (E) Produzione di urina. (F) Temperatura corporea media registrata dal monitoraggio telemetrico durante tutto il periodo di osservazione in quattro trapianti renali consecutivi (dati non presentati dal5 ° animale a causa della disfunzione parziale del transponder). Abbreviazioni utilizzate: GIORNO POD-postoperatorio. Clicca qui per visualizzare una versione più grande di questa figura.
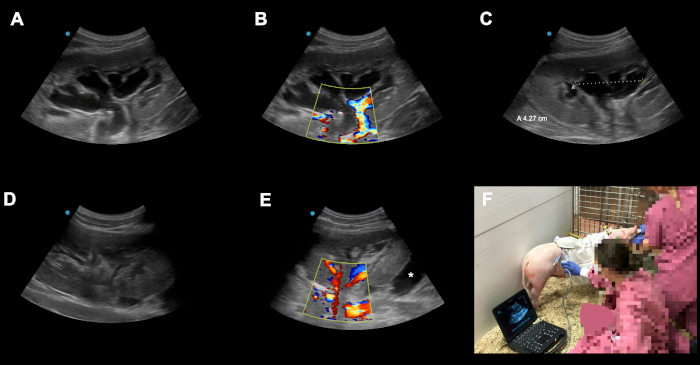
Figura 6: Esempi di possibili complicanze e insidie perioperatorie. (A-C) Congestione postoperatoria dell'innesto renale trapiantato su POD3 a seguito di un trapianto automatico ortotopico. (D) La causa della congestione è stata identificata come piegatura del catetere a causa di una sutura troppo tesa a livello della pelle. Dopo aver riadattato la sutura la congestione si è risolta quasi completamente in 24 h. (E) Qui viene mostrato un altro innesto renale su POD2 a seguito dell'auto-trapianto di rene ortotopico. Asterix (*) mostra una collezione di fluidi attorno al sottopolo dell'innesto (raccolta sanguinosa contro linfocele). A causa della nostra tecnica con chiusura del peritoneo sul rene queste collezioni sono solitamente autolimitanti a causa degli effetti vantaggiosi della compressione locale. Gli animali devono essere monitorati attentamente in termini di ritrovamento locale, segni di sanguinamento o infezione. (F) Gli ultrasuoni Doppler a colori qualificati eseguiti quotidianamente (e su richiesta) nella struttura abitativa hanno, oltre al suo utilizzo accademico (ad esempio, documentazione, registrazione degli indici di resistenza arteriosa), un ruolo diagnostico cruciale nel riconoscere potenziali complicazioni nella fase subclinica iniziale. Clicca qui per visualizzare una versione più grande di questa figura.
| Attività/fase sperimentale | Giorni | Tempo (min) | Chirurgo | Funzionario veterinario | Tecnico veterinario | Tecnico di laboratorio | Dottorando | Totale |
| Nr | ||||||||
| Cure preopreative | Da D-29 a D-15 | N.a. | 1 | 1 | 1 | 3 | ||
| Chirurgia dell'impianto di telemetria | D-15 | 85±5 | 1 | 1 | 1 | 1 | 1 | 5 |
| Cura postoperatoria dopo l'impianto di telemetria | Da D-15 a D-1 | N.a. | 1 | 1 | 1 | 3 | ||
| Chirurgia del recupero dell'innesto | D-1 | 135±32 anni | 1 | 2 | 1 | 2 | 2 | 8 |
| Chirurgia del trapianto automatico renale | D 0 | 168 ±27 anni | 1 | 2 | 1 | 2 | 2 | 8 |
| Cure postoperatorie a seguito dell'auto-trapianto di rene | Da D 0 a D5 | N.a. | 2 | 1 | 2 | 5 | ||
| Sacrificio | D 5 | N.a. | 2 | 1 | 1 | 4 |
La tabella 1. Descrizione delle risorse umane e dei tempi richiesti per l'esecuzione di varie fasi sperimentali del modello di auto-trapianto di rene suino.
Discussione
Il modello suino di KT consente lo studio di nuovi approcci terapeutici e dispositivi medici in un ambiente animale di grandi dimensioniclinicamente rilevante 15,17,21. Le somiglianze anatomiche, fisiopatiche e chirurgico-tecniche tra l'ambiente suino e quello umano possono facilitare l'interpretazione clinica dei dati e la rapida traduzione dei risultati e delle tecniche nei testclinici 15,16,17,18,19,21.
Il modello di auto-trapianto renale ortotopico non solo rispetta il principio 3R riducendo il numero di animali richiesti rispetto al trapianto allo, ad esempio non è richiesto alcun animale donatore separato, ma offre anche un'opportunità unica per indagare gli effetti dell'IRI e delle lesioni di conservazione senza gli effetti confondenti della risposta immunologica e dei farmaci immunosoppressivi17,21.
Lievi modifiche del protocollo consentono di modellare un ampio spettro di situazioni cliniche. Per imitare KT usando la donazione dopo la morte circolatoria (DCD) reni, le strutture vascolari vengono bloccate per 30-60 minuti in situ prima del recupero renale, mentre i tempi prolungati di ischemia fredda (24 ore e più) possono essere applicati al modello di lesioni estese diconservazione 16,17,28,29.
Sebbene, il modello KT suino sia chirurgicamente meno impegnativo dei modelli di trapianto di organi solidi in piccoli animali (ad esempio ratti e topi)26, ci sono molteplici aspetti tecnici e insidie che devono essere tenuti a mente per migliorare gli esiti ed evitare complicazioni specifiche17.
Non riuscendo a evitare i grandi vasi linfatici intorno alla vena cava inferiore e all'aorta durante il recupero o l'impianto dell'innesto a causa di errori tecnici o variazioni anatomiche, può portare a una fistola linfatica ad alta produzione e alla raccolta post-operatoria del fluido addominale, infezione e fallimento potenzialmente tecnico. I vasi linfatici devono essere completamente evitati durante l'intervento chirurgico o chiusi con suture di polipropilene 5-0 o 6-0. È consigliabile anche evitare l'uso di dispositivi bipolari o di qualsiasi altro dispositivo di coagulazione in caso di perdite linfatiche. Di solito porta ad un peggioramento della situazione. In caso di perdita linfatica a bassa produzione, il nostro team ha una buona esperienza con l'applicazione di chiazze di collagene a base di fibrina (ad esempio Tachosil)30, tuttavia, il loro alto costo limita la loro applicazione in questo ambiente.
Nel presente protocollo dimostriamo un approccio transperitoneale per il recupero dei reni e l'autotrasmissione. Questa è una grande differenza tecnica rispetto alla situazione clinica, in cui gli innesti renali vengono solitamente impiantati nella fossa iliaca utilizzando un approccio extraperitoneale. Sebbene la maggior parte dei gruppi utilizzi un approccio transperitoneale e ortotopico nel modello suino, il trapianto eterotopico alla fossa iliaca è possibile anche nei suini31. Tuttavia, a causa del diametro relativamente basso dell'arteria iliaca esterna nei suini da 30-40 kg e della sua tendenza al vasospasmo rende talvolta difficile eseguire l'anastomosi end-to-side dell'arteria renale all'arteria iliacaesterna 31. Per quanto riguarda il fatto che recuperiamo il rene sinistro attraverso un approccio transperitoneale per eseguire un successivo auto-trapianto, è più fattibile eseguire l'impianto riaprendo la stessa incisione e utilizzando un approccio ortotopico straigtforward, in particolare che per protocollo è anche necessario rimuovere il rene destro nativo per garantire che l'animale si riprenda con una sola specie premagine. La descrizione completa di tutte le possibili variazioni tecniche del modello esula dall'ambito di questo protocollo ed è stata riassunta da altri in articoli di revisionecompleti 31.
La lussazione dell'innesto renale trapiantato e la conseguente piegatura delle anastomosi vascolari è una delle principali fonti di insufficienza nel modello KT suino, che porta rapidamente all'occlusione vascolare e al completo fallimento dell'esperimento, a causa di una complicazione chirurgica. Per evitare questo, dopo il trapianto automatico chiudiamo lo strato peritoneale sul rene con una sutura in esecuzione usando 3-0 poliglactina. Inoltre, l'ecografia Doppler a colori viene eseguita direttamente dopo l'impianto della chiusura renale e addominale, per garantire una buona perfusione arteriosa e venosa dell'innesto renale. Gli ultrasuoni vengono utilizzati anche quotidianamente e su richiesta, in base alle prestazioni cliniche dell'animale, per lo schermo per la perfusione renale, i problemi post-renali (ad esempio ostruzione o piegamento del catetere urinario) e la raccolta del fluido a causa di fistola linfatica, sanguinamento o infezione(figura 4 e figura 6).
Poiché 24 ore di ischemia fredda spesso portano a compromissione funzionale e funzione di innesto ritardato, gli animali possono richiedere una terapia medica su richiesta se è considerata necessaria dal veterinario. Ciò può includere la terapia infusionale con glucosio al 5% e/o soluzione ringer somministrata attraverso la linea venosa centrale, iniezioni di bolo di furosemide (in caso di oliguria/anuria a seconda dello stato clinico e dei risultati di laboratorio, iniezioni di bolo da 60-80 mg fino a 200 mg/giorno) e la somministrazione orale di Polistirolo solfato di sodio (Resonium A) in caso di iperkaliemia grave32. Per evitare pregiudizi sperimentali, il veterinario responsabile della cura veterinaria post-trapianto degli animali deve essere accecato per il trattamento e il raggruppamento applicati.
Sebbene, l'anatomia dell'arteria renale sia piuttosto semplice nei maiali landrace tedeschi con di solito un'arteria da ricostruire, c'è un ampio spettro di variazioni anatomiche dei rami della vena renale che richiedono una certa creatività chirurgica durante la ricostruzione venosa. Spesso due (o più) rami della vena renale si uniscono su diversi livelli tra l'hilum renale e la vena cava inferiore. Le variazioni osservate più frequentemente e le possibili opzioni diricostruzione 17 sono indicate nella figura 3.
Dopo il primo intervento chirurgico (giorno -15, impianto di telemetria), tutti gli animali ricevono una giacca suina che indossano durante l'intero periodo degli esperimenti. Ciò fornisce un'eccellente protezione contro le lesioni accidentali e la lussazione dei cateteri impiantati e offre spazio per lo stoccaggio dei sacchetti di raccolta delle urine. L'uso di queste giacche è anche una soluzione fattibile per eliminare la necessità di gabbie metaboliche per la valutazione della clearance della creatinina come metodo di affinamento secondo il principio 3R.
La nostra struttura abitativa integra l'uso della telemetria e del monitoraggio peri-operativo basato su video. Sebbene questi metodi non possano sostituire le visite regolari del veterinario e dei tecnici, facilitano interventi rapidi e migliorano la valutazione della gravità per perfezionare ulteriormente le nostre impostazioni sperimentali per il futuro. C'è un ampio spettro di indicazioni per l'uso di un dispositivo di telemetria impiantabile in grandi modelli animali33. Sebbene, un attento monitoraggio dei parametri clinici a seguito di un intervento chirurgico importante come ECG, pressione sanguigna, la temperatura sia considerata standard nell'ambiente clinico umano di un'unità chirurgica di terapia intensiva e intermedia, nel monitoraggio della chirurgia sperimentale viene per lo più interrotto quando l'animale si sta svegliando dall'anestesia33,34,35. Pertanto, la telemetria fornisce un modo fattibile per il monitoraggio continuo di questi animali. Crediamo che tutti questi dati contribuiscano alla diagnosi precoce di possibili complicanze postoperatorie in modo accurato e tempestivo (ad esempio, shock emorragico o sepsi rilevata dall'aumento della temperatura, dell'ipotonia e della tachicardia). Ciò può facilitare un intervento tempestivo (ad esempio, introduzione di terapia antibiotica terapeutica, sostituzione del fluido, interruzione dell'anticoagulazione o sacrificio dell'animale per evitare sofferenze). Oltre a questi aspetti di monitoraggio "in tempo reale", il nostro gruppo si sta attualmente concentrando sulla valutazione della gravità e sulperfezionamento degli esperimenti sugli animali 36,37,38. L'analisi retrospettiva di una grande quantità di dati telemetrici raccolti in questi esperimenti può permetterci di stratificare meglio la gravità di questo tipo di interventi chirurgici e ottimizzare le cure perioperatorie (ad esempio, l'analgesia) negli animali da laboratorio.
In termini di telemetria impiantabile, si raccomanda un periodo di almeno 12 giorni dopo l'impianto del sistema di misurazione per garantire dati di misurazione stabili e ottimali (basati sulla comunicazione personale). Dopo aver discusso questo problema con vari produttori che forniscono soluzioni di telemetria per animali di grandi dimensioni e con altri gruppi di ricerca che utilizzano questi sistemi in vari contesti sperimentali, abbiamo deciso di integrare un periodo di 14 giorni tra l'impianto di telemetria e il trapianto di rene. Durante i giorni precedenti, le deviazioni possono ancora verificarsi a causa del movimento dell'animale poiché i processi di cicatrice e guarigione sono ancora incompleti.
Nonostante i suoi vantaggi, il modello sopra descritto ha alcune limitazioni. La complessità e le risorse e l'infrastruttura necessarie sono i limiti più importanti del modello. Il lungo protocollo sperimentale, le tecniche complesse e l'intenso follow-up perioperatorio richiedono la disponibilità di un alloggio e di una capacità or significativi e richiedono il coinvolgimento di un team più ampio, tra cui dottori, chirurghi, veterinari e tecnici (tabella 1). Pertanto, sulla base delle nostre osservazioni empiriche, di solito non è possibile eseguire più di due procedure al giorno. Un ulteriore svantaggio del modello suino rispetto ai piccoli modelli animali è la limitata possibilità di indagini meccaniche e molecolari-biologiche. Nel presente protocollo sono stati segnalati solo 5 giorni di follow-up. Ciò è stato adatto a dimostrare le caratteristiche sperimentali più importanti del modello, tuttavia, questo follow-up relativamente breve potrebbe non essere sufficiente per rispondere a determinate domande specifiche di ricerca (ad esempio, recupero a lungo termine della funzione rispetto ai danni acuti). Pertanto, potrebbe essere necessaria un'estensione del follow-up relativa al progetto. Questo manoscritto descrive le nostre attuali "best practice" nell'ambiente sperimentale dell'auto-trapianto di rene ortotopico suino. Mentre alcuni passaggi sono obbligatori per stabilire con successo questo modello, gli aspetti minori (ad esempio, l'uso intraoperatorio di un catetere vescicale, il posizionamento del catetere arterioso nell'arteria femorale vs carotide) sono facultativi e possono essere evitati / alterati a discrezione degli investigatori. La descrizione e la giustificazione di ogni singolo aspetto metodico esulerebbe dall'ambito del presente protocollo ed è stata discussa altrove31. Infine, è anche difficile replicare l'esatta situazione clinica dell'ECD KT nel modello suino in cui donatori anziani, allosintori con lesioni renali acute e donatori con molteplici comorbilità e malattie croniche come ipertensione, diabete mellito o arteriosclerosi rappresentano una parte importante del pool marginale di donatori8,9.
Nonostante i limiti sopra menzionati e le sfide tecniche e logistiche, questo modello animale di grandi dimensioni consolidato e riproducibile di KT offre un'opportunità unica per indagare nuove terapie e tecniche per migliorare la conservazione degli organi e gli esiti clinici e rappresenta un'eccellente piattaforma per i chirurghi più giovani per padroneggiare le tecniche di trapianto di organi in un grande modello animale.
Divulgazioni
Gli autori non hanno alcun conflitto di interessi da rivelare.
Riconoscimenti
Gli autori vorrebbero esprimere la loro gratitudine a Pascal Paschenda, Mareike Schulz, Britta Bungardt, Anna Kümmecke per la loro abile assistenza tecnica.
Gli autori dichiarano finanziamenti in parte dal programma START della Facoltà di Medicina, RWTH Aachen University (da #23/19 a Z.C.), dalla Fondazione B.Braun, Melsungen, Germania (BBST-S-17-00240 a Z.C.), dalla Fondazione tedesca per la ricerca (Deutsche Forschungsgemeinschaft - DFG; PER-2591, FINO A 542/5-1, FINO A 542/6-1; Dal 2016 a R.T. e SFB/TRR57, SFB/TRR219, BO3755/3-1, BO3755/6-1 a P.B.) e il Ministero tedesco dell'Istruzione e della Ricerca (BMBF: STOP-FSGS-01GM1901A a P.B.), senza il coinvolgimento dei finanziatori nella progettazione di studi, raccolta di dati, analisi dei dati, preparazione manoscritta o decisione di pubblicare.
Materiali
| Name | Company | Catalog Number | Comments |
| Anesthesia materials, drugs and medications | |||
| Aspirin 500mg i.v., powder for solution for injection | Bayer Vital AG, Leverkusen, Germany | 4324188 | antiplatelet agents |
| Atropine sulfate solution for injection, 100mg | Dr. Franz Köhler Chemie GmbH, Bensheim, Germany | 1821288 | parasympatholytic agent, premedication |
| Bepanthen ointment for eyes and nose | Bayer Vital AG, Leverkusen, Germany | 1578675 | eye ointment |
| BD Discardit II syringes, 2ml, 5ml, 10ml,20ml | Becton Dickinson GmbH, Heidelberg, Germany | 300928, 309050,309110, 300296 | syringes |
| BD Micolance 3 (20G yellow) Cannula | Becton Dickinson GmbH, Heidelberg, Germany | 305888 | venous catheter |
| BD Venflon Pro Safety (20G pink) | Becton Dickinson GmbH, Heidelberg, Germany | 4491101 | venous catheter |
| Buprenorphine (Buprenovet) | Bayer Vital AG, Leverkusen, Germany | 794-996 | analgesia |
| Cefuroxime 750mg, powder for preparing injection solution | FRESENIUS KABI Deutschland GmbH, Bad Homburg, Germany | J01DC02 | antibiotics |
| Covidien Hi-Contour, Endotracheal Tube 7,5 with Cuffed Murphy Eye | Covidien Deutschland GmbH,Neustadt/Donau, Germany | COV-107-75E | endotracheal Tube |
| FENTANYL 0,5 mg Rotexmedica solution for injection | Rotexmedica GmbH Arzneimittelwerk, Trittau, Germany | 4993593 | opioide analgetic agent |
| Furosemide-ratiopharm 250 mg/25 ml solution for injection | Ratiopharm GmbH, Ulm, Germany | 1479542 | loop diuretics |
| Glucose 5% solution for infusion (500ml, 250ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 3705273,03705422 | infusion fluid |
| Glucose 20% solution for infusion | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 4164483 | osmotic diuresis |
| Heparin-Sodium 5000 I.E./ml | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 15782698 | anticoagulant |
| Isoflurane-Piramal (Isoflurane) | Piramal Critical Care Deutschland GmbH, Hallbergmoos, Germany | 9714675 | volatile anaesthetic agent |
| Ketamine (Ketamine hydrochloride) 10% | Medistar Arzneimittelvertrieb GmbH, Ascheberg, Germany | 0004230 | general anaestetic agent |
| MIDAZOLAM 15mg/3ml | Rotexmedica GmbH Arzneimittelwerk, Trittau, Germany | 828093 | hybnotica, sedative agent |
| NaCl 0,9% solution for infusion (500ml,1000ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 864671.8779 | infusion fluid |
| Norepinephrine (Arterenol) | Sanofi-Aventis Deutschland GmbH, Frankfurt, Germany | 16180 | increase in blood pressure |
| Organ preservation solution (e.g. HTK) | Dr. Franz Köhler Chemie GmbH, Bensheim, Germany | should be decided based on preference and experimental design | organ preservation |
| Pantoprazole 40mg/solution for injection | Laboratorios Normon,Madrid, Spain | 11068 | proton pump inhibitor |
| Paveron N 25mg/ml solution for injection (Papaverine Hydrochloride) | LINDEN Arzneimittel-Vertrieb-GmbH, Heuchelheim, Germany | 2748990 | spasmolytic agent for vasodilatation |
| Pentobarbital (Narcoren) | Boehringer Ingelheim vetmedica GmbH, Ingelheim, Germany | 1,204,924,565 | used for euthanasia |
| Propofol 1% (10mg/ml) MCT Fresenius | FRESENIUS KABI Deutschland GmbH, Bad Homburg, Germany | 654210 | general anaesthetic agent |
| Ringer solution | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 1471411 | infusion fluid |
| Sterofundin ISO solution for infusion (1000ml) | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 1078961 | Infusion fluid |
| Stresnil (Azaperone) 40mg/ml | Elanco | 797-548 | sedative |
| Urine catheter ruffle 12CH | Wirutec Rüsch Medical Vertriebs GmbH, Sulzbach, Germany | RÜSCH-180605-12 | transurethral urinecatheter |
| Surgical materials | |||
| Appose ULC Skin Stapler | Covidien Deutschland GmbH,Neustadt/Donau, Germany | 8886803712 | skin stapler |
| Cavafix Certo 375 | B. Braun Deutschland GmbH & Co. KG, Melsungen, Germany | 4153758 | central venous catheter |
| EMKA Easytel +L-EPTA Transponder | emka TECHNOLOGIES S.A.S,Paris,France | L-EEEETA 100 | telemetry transponder |
| EMKA Reciever and Data Analyzer System | emka TECHNOLOGIES S.A.S,Paris,France | Reviever | telemetry receiver |
| Feather Disposable Scapel (11)(21) | Feather, Japan | 8902305.395 | scapel |
| Prolene 2-0, blue monofil VISI-BLACK, FS needle | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7038H | skin |
| Prolene 3-0,blue monofil,FS1 needle | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7694H | skin |
| Prolene 5-0 (simply angulated, C1 needle) blue monofil VISI-BLACK | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7227H | vascular |
| Prolene 5-0 (double armed, C1 needle) 60cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | KBB5661H | vascular |
| Prolene 6-0 (double armed, C1 needle) 60cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | EH7228H | vascular |
| Sempermed derma PF Surgical Gloves Seril Gr. 7, 7.5, 8 | Semperit investment Asia Pte Ltd, Singapore | 4200782,4200871,4200894 | surgical gloves |
| Sentinex® PRO Surgical Gowns Spunlace XL 150cm | Lohmann & Rauscher GmbH & Co. KG, Neuwied, Germany | 19302 | surgical gown |
| Tachosil | Takeda Pharma Vertrieb GmbH & Co. KG, Berlin, Germany | MAXI 9,5 x 4,8 cm | haemostasis |
| Telasorp Belly wipes (green 45x45cm) | PAUL HARTMANN AG,Heidenheim, Germany | 4542437 | abdominal towel |
| Pediatric urine catheter | Uromed Kurt Drews KG, Oststeinbeck, Germany | PZN 03280856 | used for the uretero-cutaneus stoma |
| VICRYL- 0 MH Plus | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V324 | fascial closure |
| VICRYL - 3-0, SH1 Plus needle, 75cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | W9114 | subcutaneous suture, peritoneal suture, |
| VICRYL - 3-0, SH1 Plus needle, 4*45cm | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V780 | subcutaneous suture, peritoneal suture, |
| VICRYL - ligatures Sutupak purple braided, 3-0 | Johnson & Johnson Medical GmbH - Ethicon Deutschland, Norderstedt, Germany | V1215E | threats for ligature |
| 3M™ Standard Surgical Mask 1810F | 3M Deutschland GmbH, Neuss, Germany | 3M-ID 7000039767 | surgical mask |
| Surgical instruments | |||
| Anatomical forceps Standard | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | PZ0260 | anatomical forceps |
| Atraumatic tweezers steel, De Bakey Tip 1,5mm 8" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF0840 | anatmical atraumatic forceps |
| Bipolar forceps 16 cm straight, Branch 0,30 mm pointed, universal fit | Bühler Instrumente Medizintechnik GmbH,Tuttlingen, Germany | 08/0016-A | biopolar forceps |
| Bulldog clamp atraumatic,curved, De bakey 78 mm, 3" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF0900 | bulldog clamps |
| DE BAKEY-SATINSKY vascular clamp 215mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | GF1661 | vascular clamp |
| Dissecting scissors Mayo,250 mm, 10" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC2232 | Scissors for dissection |
| Dissecting scissors Metzenbaum-Fino, 260 mm, 101/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC2290 | Scissors for dissection |
| Draeger CATO Anesthetic machine with PM8050 Monitor | Dräger, Drägerwerk AG & Co. KGaA, Lübeck, Germany | 106782 | Ventilation System |
| Fine Tweezers, ADSON 180 mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | ADSONPZ0571 | fine forceps |
| Gosset abdomenal wall spreader | CHIRU-INSTRUMENTE, Kaierstuhl,Germany | 09-621512 | abdominal retractor |
| HALSTEAD MOSQUITO,curved, surgical 125mm | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL2291 | mosquite clamps |
| HF surgical device ICC 300, Electrocautery | Erbe Elektromedizin Gmbh; Tübingen, Germany | 20132-043 | cautery, biopolar |
| MICRO HALSTED-MOSQUITO 100mm, curved | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL2187 | mosquite clamps |
| Micro steel needle holder straight 0,5mm, with spring lock | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | MN1324D | microsurgical needle holder |
| Microsurgical/watermaker tweezers LINZ 150mm 6" Ergo round handle | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | MN0087 | fine microsurgical forceps |
| needle holder Mayo-hegar,190 mm, 71/2" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | NH1255 | needle holder |
| Overhold Slimline Fig. 0 8 1/2" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | KL4400 | overholds |
| Sterile Gauze 10X10 | Paul HaRTMANN AG,Heidenheim, Germany | 401725 | sterile gauze |
| Suction tip OP-Flex Handpiece Yankauer | Pfm Medical AG, Köln, Germany | 33032182 | suction |
| surgical forceps Standard 5 3/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | PZ1260 | surgical forceps |
| surgical scissors standard pointed-blunt (thread/cloth scissors)175 mm, 7" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC1522 | surgical Scissors |
| Titanit vascular scissors POTTS-SMITH,185 mm, 71/4"60° | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | SC8562 | Pott scissors |
| Tunneling instrument | Marina Medical Instruments Inc,Davies,US | MM-TUN06025 | subcutaneous tunneling |
| Vessel loops | Medline International Germany GmbH,Kleve, Germany | VLMINB | hold and adjust the vessel |
| Wound spreaders Weitlander, Stump,110 mm, 41/4" | ASANUS Medizintechnik GmbH, Tuttlingen, Germany | WH5210 | wound care |
| Further material | |||
| Heating pad | Eickemeyer - Medizintechnik für Tierärzte KG, Tuttlingen, Germany | 648050 MHP-E1220 | maintain body temperature during surgery |
| Laryngoscope, customized | Wittex GmbH, Simbach, Germany | 333222230 | expose the vocal cord |
| Rectal temperature probe | Asmuth Medizintechnik, Minden, Germany | ASD-RA4 | measure body temperature |
| Spray wound film | Mepro-Dr. Jaeger und Bergmann GmbH, Vechta, Germany | 2830 | keep sterile condition |
| Sterile organ bag | Raguse Gesellschaft für medizinische Produkte, Ascheberg, Germany | 800059 | organ preservation |
| swine jacket small, adult Landrasse swine 30-50kg, customized for Emka Telemetry and urinary catheterization | Lomir Biomedical Inc., United Kingdom | SS J1LAPMP | swine jackets to pretect implanted catheters and store urine bag |
| Ultrasound device, Sonosite Edge-II | FUJIFILM SonoSite GmbH, Frankfurt, Germany | V21822 | ultrasound and color Doppler |
| Urine bag 2000ml Volume | ASID BONZ GmbH, Herrenberg, Germany | 2062578 | disposable urine bag connected to the uretero-cutaneous fistula catheter |
Riferimenti
- Watts, G. Joseph Murray: innovative surgeon and pioneer of transplantation. Lancet. 377 (9770), 987 (2011).
- Merion, R. M., et al. Deceased-donor characteristics and the survival benefit of kidney transplantation. Journal of the American Medical Association. 294 (21), 2726-2733 (2005).
- Jochmans, I., O'Callaghan, J. M., Pirenne, J., Ploeg, R. J. Hypothermic machine perfusion of kidneys retrieved from standard and high-risk donors. Transplant International. 28 (6), 665-676 (2015).
- Czigany, Z., et al. Machine perfusion for liver transplantation in the era of marginal organs-New kids on the block. Liver International. 39 (2), 228-249 (2018).
- Fabrizii, V., et al. Patient and graft survival in older kidney transplant recipients: does age matter. Journal of the American Soceity of Nephrology. 15 (4), 1052-1060 (2004).
- Jochmans, I., Nicholson, M. L., Hosgood, S. A. Kidney perfusion: some like it hot others prefer to keep it cool. Current Opinion in Organ Transplantation. 22 (3), 260-266 (2017).
- . DSO Jahresbericht Available from: https://www.dso.de/SiteCollectionDocuments/DSO_Jahresbericht_2018.pdf (2018)
- Meister, F. A., et al. Hypothermic Oxygenated Machine Perfusion of Extended Criteria Kidney Allografts from Brain Dead Donors: Protocol for a Prospective Pilot Study. JMIR Research Protocols. 8 (10), 14622 (2019).
- Meister, F. A., et al. Hypothermic oxygenated machine perfusion-Preliminary experience with end-ischemic reconditioning of marginal kidney allografts. Clinical Transplantation. 33 (10), 13673 (2019).
- Siedlecki, A., Irish, W., Brennan, D. C. Delayed graft function in the kidney transplant. American Journal of Transplantation. 11 (11), 2279-2296 (2011).
- Plenter, R., Jain, S., Ruller, C. M., Nydam, T. L., Jani, A. H. Murine Kidney Transplant Technique. Journal of Visualized Experiments. (105), e52848 (2015).
- Fabry, G., et al. Cold Preflush of Porcine Kidney Grafts Prior to Normothermic Machine Perfusion Aggravates Ischemia Reperfusion Injury. Scientific Reports. 9 (1), 13897 (2019).
- Kalenski, J., et al. Improved preservation of warm ischemia-damaged porcine kidneys after cold storage in Ecosol, a novel preservation solution. Annals of Transplantation. 20, 233-242 (2015).
- Kalenski, J., et al. Comparison of Aerobic Preservation by Venous Systemic Oxygen Persufflation or Oxygenated Machine Perfusion of Warm-Ischemia-Damaged Porcine Kidneys. European Surgical Research. 57 (1-2), 10-21 (2016).
- Kaths, J. M., et al. Normothermic Ex Vivo Kidney Perfusion for the Preservation of Kidney Grafts prior to Transplantation. Journal of Visualized Experiments. (101), e52909 (2015).
- Schreinemachers, M. C., et al. Improved preservation and microcirculation with POLYSOL after transplantation in a porcine kidney autotransplantation model. Nephrology Dialysis Transplantation. 24 (3), 816-824 (2009).
- Kaths, J. M., et al. Heterotopic Renal Autotransplantation in a Porcine Model: A Step-by-Step Protocol. Journal of Visualized Experiments. (108), e53765 (2016).
- De Deken, J., et al. Postconditioning effects of argon or xenon on early graft function in a porcine model of kidney autotransplantation. British Journal of Surgery. 105 (8), 1051-1060 (2018).
- Faure, A., et al. An experimental porcine model of heterotopic renal autotransplantation. Transplantation Proceedings. 45 (2), 672-676 (2013).
- Golriz, M., et al. Do we need animal hands-on courses for transplantation surgery. Clinical Transplantation. 27, 6-15 (2013).
- Gallinat, A., et al. Transplantation of Cold Stored Porcine Kidneys After Controlled Oxygenated Rewarming. Artificial Organs. 42 (6), 647-654 (2018).
- Russell, W. M. S., Burch, R. L. . The Principles of Humane Experimental Technique. , (1959).
- Kilkenny, C., Browne, W. J., Cuthill, I. C., Emerson, M., Altman, D. G. Improving bioscience research reporting: the ARRIVE guidelines for reporting animal research. PLoS Biology. 8 (6), 1000412 (2010).
- Hagemeister, K., et al. Severity assessment in pigs after partial liver resection: evaluation of a score sheet. Laboratory Animals. 54 (3), (2019).
- Doorschodt, B. M., et al. Hypothermic machine perfusion of kidney grafts: which pressure is preferred. Annals of Biomedical Engineering. 39 (3), 1051-1059 (2011).
- Czigany, Z., et al. Improving Research Practice in Rat Orthotopic and Partial Orthotopic Liver Transplantation: A Review, Recommendation, and Publication Guide. European Surgical Research. 55 (1-2), 119-138 (2015).
- Nagai, K., Yagi, S., Uemoto, S., Tolba, R. H. Surgical procedures for a rat model of partial orthotopic liver transplantation with hepatic arterial reconstruction. Journal of Visualized Experiments. (73), e4376 (2013).
- Doorschodt, B. M., et al. Evaluation of a novel system for hypothermic oxygenated pulsatile perfusion preservation. The Internation Journal of Artificial Organs. 32 (10), 728-738 (2009).
- Kaths, J. M., et al. Continuous Normothermic Ex Vivo Kidney Perfusion Is Superior to Brief Normothermic Perfusion Following Static Cold Storage in Donation After Circulatory Death Pig Kidney Transplantation. American Journal of Transplantation. 17 (4), 957-969 (2017).
- Tammaro, V., et al. Prevention of fluid effusion in kidney transplantation with the use of hemostatic biomaterials. Transplantation Proceedings. 46 (7), 2203-2206 (2014).
- Golriz, M., et al. Pig kidney transplantation: an up-to-date guideline. European Surgical Research. 49 (3-4), 121-129 (2012).
- Higgins, R., et al. Hyponatraemia and hyperkalaemia are more frequent in renal transplant recipients treated with tacrolimus than with cyclosporin. Further evidence for differences between cyclosporin and tacrolimus nephrotoxicities. Nephrology Dialysis and Transplantation. 19 (2), 444-450 (2004).
- Markert, M., et al. A new telemetry-based system for assessing cardiovascular function in group-housed large animals. Taking the 3Rs to a new level with the evaluation of remote measurement via cloud data transmission. Journal of Pharmacological and Toxicological Methods. 93, 90-97 (2018).
- Längin, M., et al. Perioperative Telemetric Monitoring in Pig-to-Baboon Heterotopic Thoracic Cardiac Xenotransplantation. Annals of Transplantation. 23, 491-499 (2018).
- Willens, S., Cox, D. M., Braue, E. H., Myers, T. M., Wegner, M. D. Novel technique for retroperitoneal implantation of telemetry transmitters for physiologic monitoring in Göttingen minipigs (Sus scrofa domesticus). Comparative Medicine. 64 (6), 464-470 (2014).
- van Dijk, R. M., et al. Design of composite measure schemes for comparative severity assessment in animal-based neuroscience research: A case study focussed on rat epilepsy models. PLoS One. 15 (5), 0230141 (2020).
- Zieglowski, L., et al. Severity assessment using three common behavioral or locomotor tests after laparotomy in rats: a pilot study. Laboratory Animals. , (2020).
- Bleich, A., Bankstahl, M., Jirkof, P., Prins, J. B., Tolba, R. H. Severity Assessment in animal based research. Laboratory Animals. 54 (1), 16 (2020).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon