Method Article
Radiografia neutronica e tomografia computerizzata di sistemi biologici presso il reattore isotopico ad alto flusso dell'Oak Ridge National Laboratory
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo manoscritto descrive un protocollo per la radiografia neutronica e la tomografia computerizzata di campioni biologici utilizzando una linea di fascio CG-1D del reattore isotopico ad alto flusso (HFIR) per misurare un impianto metallico in un femore di ratto, un polmone di topo e un sistema radice erbacea / suolo.
Abstract
I neutroni sono stati storicamente utilizzati per una vasta gamma di applicazioni biologiche impiegando tecniche come lo scattering neutronico a piccolo angolo, l'eco di spin neutronico, la diffrazione e lo scattering anelastico. A differenza delle tecniche di scattering neutronico che ottengono informazioni nello spazio reciproco, l'imaging neutronico basato sull'attenuazione misura un segnale nello spazio reale che viene risolto nell'ordine di decine di micrometri. Il principio dell'imaging neutronico segue la legge di Beer-Lambert e si basa sulla misurazione dell'attenuazione dei neutroni di massa attraverso un campione. Una maggiore attenuazione è esibita da alcuni elementi leggeri (in particolare, idrogeno), che sono componenti principali dei campioni biologici. Agenti di contrasto come deuterio, gadolinio o composti di litio possono essere utilizzati per migliorare il contrasto in modo simile a come viene fatto nell'imaging medico, comprese tecniche come l'imaging ottico, la risonanza magnetica, i raggi X e la tomografia ad emissione di positroni. Per i sistemi biologici, la radiografia neutronica e la tomografia computerizzata sono state sempre più utilizzate per studiare la complessità della rete di radici sotterranee delle piante, la sua interazione con i suoli e la dinamica del flusso d'acqua in situ. Inoltre, sono stati esplorati gli sforzi per comprendere i dettagli di contrasto nei campioni animali, come i tessuti molli e le ossa. Questo manoscritto si concentra sui progressi nella bioimaging neutronica come la preparazione del campione, la strumentazione, la strategia di acquisizione dei dati e l'analisi dei dati utilizzando la linea di fascio di imaging neutronico CG-1D del reattore isotopico ad alto flusso. Le capacità di cui sopra saranno illustrate utilizzando una selezione di esempi in fisiologia vegetale (pianta erbacea / radice / sistema del suolo) e applicazioni biomediche (femore di ratto e polmone di topo).
Introduzione
Il principio della radiografia neutronica (nR) si basa sull'attenuazione dei neutroni attraverso la materia che attraversano. A differenza dei raggi X che sono dispersi dalla nube elettronica di un atomo, i neutroni possono essere assorbiti o dispersi dal suo nucleo. I neutroni sono sensibili agli elementi leggeri, come l'idrogeno (H), e possono quindi essere utilizzati per radiografare applicazioni biologiche come animali 1,2,3,4,5,6,7 o tessuti umani 8,9 e sistemi sotterranei/radici10,11,12,13,14,15. L'imaging neutronico è una tecnica complementare all'imaging a raggi X, che è in grado di rilevare elementi pesanti16,17,18. L'nR basato sull'attenuazione è governato dai coefficienti di attenuazione lineare dei materiali all'interno del campione e dallo spessore del campione, come descritto dalla legge di Beer-Lambert, che afferma che il fascio trasmesso è direttamente proporzionale alla quantità di materiale e alla lunghezza del percorso attraverso il materiale. Quindi, la trasmittanza, T, può essere calcolata come:
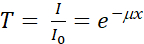 (1)
(1)
dove I 0 e I sono, rispettivamente, le intensità del fascio incidente e trasmessa; μ e x sono rispettivamente il coefficiente di attenuazione lineare e lo spessore di un campione omogeneo. Il coefficiente di attenuazione μ è dato da:
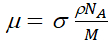 (2)
(2)
dove σ è la sezione d'urto di attenuazione neutronica del campione (sia lo scattering che l'assorbimento), ρ è la sua densità, NA è il numero di Avogadro e M è la sua massa molare.
Il contrasto nella radiografia di campioni biologici che utilizzano neutroni a bassa energia (cioè energie inferiori a 0,5 eV) è dovuto principalmente a una variazione della densità di H (per uno spessore fisso del campione). Ciò è dovuto alla probabilità di interazione di un neutrone con il nucleo H, che è maggiore rispetto ad altri nuclei presenti nei campioni biologici, e al fatto che la densità dell'atomo H è fondamentale in quanto è l'atomo più abbondante nei campioni biologici.
Fin dalle sue fasi iniziali, la tomografia computerizzata nR e neutronica (nCT) è stata ampiamente utilizzata per materiali e applicazioni ingegneristiche 19,20,21,22,23. I primi esperimenti dimostrativi di sensibilità neutronica all'H in campioni biologici iniziarono a metà degli anni 195024 con le misurazioni di campioni vegetali. Il lavoro è continuato per tutto il 1960 con, ad esempio, la radiografia di un torace umano25 o ratti26, in cui è stato esplorato l'uso di agenti di contrasto, come l'ossido di gadolinio (Gd2O3). Inoltre, è stato ipotizzato che il contrasto nel tessuto tumorale umano rispetto al tessuto normale fosse dovuto ad un aumento locale del contenuto di H. Durante questi studi iniziali, si è concluso che l'aumento del flusso di neutroni e della risoluzione spaziale migliorerebbe la qualità di nR e probabilmente aumenterebbe la sua popolarità come tecnica complementare per applicazioni industriali o biomediche. Gli studi più recenti comprendono misurazioni di nR e nCT eseguite su campioni di tessuto tumorale1 e sezioni di organi animali 2,3,27 per applicazioni biomediche e forensi.
Situato presso l'Oak Ridge National Laboratory, Oak Ridge, TN, l'High Flux Isotope Reactor (HFIR) è una potente sorgente di neutroni che produce neutroni per reazione di fissione. Questi neutroni hanno energie dell'ordine di 2 MeV e vengono "raffreddati" nella piscina del reattore da reazioni cinetiche con acqua pesante per raggiungere energie dell'ordine di 100-300 eV. L'ottimizzazione di un esperimento neutronico, sia esso di scattering o imaging, inizia con la comprensione della sorgente di neutroni e delle proprietà della linea di fascio come l'intensità del fascio, la distribuzione dell'energia e l'effetto del fondo (neutroni veloci, neutroni ritardati, raggi gamma). Nella sala di guida fredda HFIR dove si trova la linea di fascio di imaging, i neutroni vengono ulteriormente "raffreddati" dalle interazioni cinetiche con un moderatore H liquido. Vengono quindi trasportati in un sistema di guida curvo lontano dalla linea di vista della sorgente, eliminando così neutroni veloci e inquinamento gamma. Come illustrato nella figura 1, la linea di fascio CG-1D per immagini neutroniche28,29 è posta su una guida fredda, il che implica che l'intervallo di energia dei neutroni varia da pochi meV a poche decine di eV (in questo caso, la corrispondente lunghezza d'onda neutronica utilizzabile varia da 0,8 a 10 Å) con un flusso nell'intervallo 107 n/(cm2∙s) nella posizione del campione. Un sistema motorizzato di apertura/diffusore definisce la geometria stenopeica dello strumento di imaging. I neutroni percorrono una distanza di 6,59 m in un tubo di volo riempito di elio (He) con finestre in alluminio (Al) su ciascuna estremità. I tubi di volo sono usati per trasportare neutroni limitando la dispersione dell'aria in modo tale che la perdita di intensità del fascio sia minima. Per le misure descritte in questo manoscritto, il diffusore è costituito da una nano-polvere di ossido di alluminio (Al2O3) di 1 mm di spessore 50 nm racchiusa in un contenitore di Al. Il diffusore riduce gli artefatti del fascio provenienti dalla guida neutronica (che sono ingranditi dalla geometria stenopeica di una linea di fascio di imaging), altrimenti forti fluttuazioni di intensità orizzontale e verticale sono visibili nella radiografia e la normalizzazione dei dati diventa difficile. Per gli esperimenti qui illustrati, i neutroni vengono convertiti in luce usando un fluoruro di litio-6 di 25 μm di spessore / fosforo di solfuro di zinco (6LiF / ZnS: Ag).
L'ottimizzazione della collimazione dipende dalla posizione del campione al rivelatore, dalla risoluzione spaziale richiesta e dal tempo di acquisizione. Quando il campione si trova a pochi cm di distanza dallo scintillatore, collimazioni elevate (L/D superiore a 800, dove L è la distanza dall'apertura stenopeica del diametro, D, e dal rivelatore) producono una migliore risoluzione spaziale al costo del flusso neutronico. Una bassa collimazione (L/D inferiore a 800) è preferibile per studi dinamici in situ in cui la risoluzione temporale prevale sulla risoluzione spaziale. Per le misure descritte in questo manoscritto, L/D e la risoluzione spaziale erano rispettivamente di circa 355 e 75 μm. La risoluzione temporale variava in base al rapporto segnale-rumore (SNR). Il campione è stato posizionato il più vicino possibile allo scintillatore per ridurre la distorsione geometrica come la sfocatura. Sono disponibili fasi di traslazione e rotazione per posizionare il campione vicino ai rivelatori ed eseguire la tomografia computerizzata (TC). CG-1D offre tre tipi di rivelatori: un dispositivo ad accoppiamento di carica (CCD) con 2048 pixel x 2048 pixel con un pixel pitch di 13,5 μm, un rivelatore scientifico complementare a semiconduttore metallo-ossido (sCMOS) con 2560 pixel x 2160 pixel con un pixel pitch di 6,5 μm e un rilevatore a piastra a microcanali (MCP)30,31 con 512 pixel x 512 pixel con una dimensione dei pixel di 55μm. I neutroni diffusi vengono assorbiti con gomma di boro spessa ~ 5 mm per proteggere il chip del rivelatore dalla vista dei neutroni. Questo assorbimento genera raggi gamma che possono essere fermati dal piombo (Pb) posto tra la gomma di boro e il rivelatore. Ogni rilevatore è ottimizzato per un diverso campo visivo (FOV), nonché per risoluzioni spaziali e temporali. Per le misurazioni del femore di ratto e del polmone di topo, il rivelatore CCD è stato utilizzato per la sua grande capacità FOV (~ 7 cm x 7 cm) e una ragionevole risoluzione spaziale di circa 75 μm. L'nCT del sistema radice / suolo della pianta è stato eseguito con l'sCMOS, poiché l'obiettivo era quello di acquisire nCT il più rapidamente possibile al costo del FOV (che era limitato a ~ 5 cm x 4,2 cm); Quindi, la risoluzione spaziale evidentemente ne ha sofferto. In questi rivelatori, i neutroni vengono convertiti in luce o in una particella alfa per scopi di rilevamento. La rotazione del campione attorno al suo asse verticale e l'acquisizione di radiografie ad angoli di rotazione consecutivi consente l'acquisizione di nCT. Il modello volumetrico volumetrico 3-dimensionale del campione in esame è ottenuto utilizzando il notebook interno Jupyter filtered-back-projection (FBP) basato su python iMARS3D, pyMBIR o un software commerciale, tutti descritti di seguito.
Infine, i neutroni che non hanno interagito con il campione o il rivelatore vengono raccolti in una posizione di arresto del fascio a circa 1 m a valle del sistema rivelatore per ridurre al minimo il rumore di fondo. Il fermafascio CG-1D è largo 0,75 m, alto 0,5 m e spesso 35 mm ed è realizzato in resina epossidica B4C. L'arresto del fascio è rinforzato con 10 mm di carbonato di litio arricchito al 95% (6 Li2CO3) in una resina epossidica resistente al fuoco dove il fascio di neutroni colpisce, con una cavità rivestita con 6Li, piombo (Pb) e acciaio progettato per contenere l'alta velocità dei raggi gamma secondari. L'arresto del fascio è direttamente fissato alla parete di schermatura in acciaio della beamline. Una fotografia della linea di luce CG-1D è riportata nella Figura 2.
Tre software di ricostruzione sono stati utilizzati per ricostruire i tre dati sperimentali in 3D, rispettivamente. La ricostruzione del campione polmonare del topo è stata eseguita utilizzando Octopus32, un software di ricostruzione commerciale che utilizza FBP. Il software Octopus si trova su un PC server e può essere utilizzato per ricostruire i dati raccolti sulla beamline. Un software di ricostruzione, chiamato iMARS3D, è disponibile su CG-1D. Si basa sul codice open source TomoPY33 con funzionalità aggiuntive come la correzione automatica dell'inclinazione, i filtri di post-elaborazione, ecc. iMARS3D include la pre-elaborazione dei dati (sottrazione dello sfondo e del rumore), il ritaglio, il filtraggio mediano (per correggere gli attacchi gamma e i pixel morti), la correzione automatica delle fluttuazioni dell'intensità del fascio e la correzione dell'inclinazione del campione. Una volta creati i sinogrammi, un'ulteriore elaborazione dei dati come la rimozione dell'artefatto dell'anello e il livellamento sono un'opzione. I diversi passaggi della ricostruzione vengono salvati nel server di analisi (e successivamente spostati nella cartella condivisa della proposta), mentre le sezioni 2D finali vengono immediatamente archiviate nella cartella condivisa della proposta. Il femore del ratto è stato ricostruito utilizzando iMARS3D. Il campione di radice / suolo della pianta è stato pre-elaborato filtrando mediana i dati utilizzando TomoPY seguito dalla correzione dell'asse di inclinazione utilizzando la libreria SciPy di Python. La ricostruzione è stata effettuata utilizzando un pacchetto python sviluppato internamente chiamato pyMBIR (costruito utilizzando kernel dal toolbox ASTRA34) che implementa una suite di algoritmi tomografici dalla linea di base FBP a tecniche avanzate di ricostruzione iterativa basate su modelli35 che possono ottenere ricostruzioni di alta qualità da set di dati neutronici estremamente sparsi e rumorosi. Tutti i volumi renderizzati basati sugli strumenti di ricostruzione di cui sopra sono rappresentati in contrasto di attenuazione. Tutta la visualizzazione è stata eseguita utilizzando il pacchetto software di visualizzazione commerciale, segmentazione e analisi dei dati AMIRA36.
Questo manoscritto ha lo scopo di dimostrare la procedura di utilizzo dell'imaging neutronico (nR e nCT) sulla linea di fascio HFIR CG-1D. Questo studio illustra anche le attuali capacità all'avanguardia di nR e nCT per campioni biologici, in particolare un polmone di topo, un osso di ratto e sistemi radice / suolo delle piante. Il polmone di topo è stato scelto per illustrare la complementarità dei neutroni per misurare il tessuto polmonare, mentre i raggi X sono per lo più sensibili alle ossa. Il campione osseo, un femore di ratto, aveva un impianto di titanio (Ti), illustrando così il contrasto tra l'osso e il metallo e l'opportunità di vedere l'interfaccia osso / metallo (che è difficile da misurare con i raggi X poiché i metalli li attenuano fortemente4). Infine, il sistema idrico delle radici delle piante illustra la capacità tridimensionale (3D) di nCT di misurare i sistemi radicali/suolo in situ. Mostra inoltre i vantaggi / svantaggi dell'utilizzo di nR per campioni biologici. Evidentemente, questo metodo può essere tranquillamente utilizzato per misurare la dinamica dell'acqua in un sistema di radici vegetali, ma non può essere considerato come un animale vivo o una tecnica di imaging umana a causa dei rischi associati all'esposizione alle radiazioni, limitando così gli studi a topi (morti) o misurazioni simili alla patologia in cui, ad esempio, un campione di tessuto viene resecato da un paziente (animale o umano) e preparato per fissazione prima di essere misurato in un fascio di neutroni.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi Autorizzazione