Method Article
Automatizzare la quantificazione aggregata in Caenorhabditis elegans
In questo articolo
Riepilogo
Il seguente protocollo descrive lo sviluppo e l'ottimizzazione di un flusso di lavoro ad alto rendimento per la coltivazione di vermi, l'imaging a fluorescenza e l'elaborazione automatizzata delle immagini per quantificare gli aggregati di poliglutammina come valutazione dei cambiamenti nella proteostasi.
Abstract
L'aumento della prevalenza delle malattie neurodegenerative conformazionali proteiche (PCD) ha favorito negli anni un grande interesse per questo argomento. Questa maggiore attenzione ha richiesto la diversificazione e il miglioramento dei modelli animali in grado di riprodurre i fenotipi di malattia osservati negli esseri umani con PCD. Sebbene i modelli murini si siano dimostrati inestimabili, sono costosi e sono associati a metodi laboriosi e a bassa produttività. L'uso del modello di nematode Caenorhabditis elegans per studiare le PCD è stato giustificato dalla sua relativa facilità di manutenzione, basso costo e tempi di generazione rapidi, che consentono applicazioni ad alto rendimento. Inoltre, l'elevata conservazione tra C. elegans e genomi umani rende questo modello uno strumento di scoperta inestimabile. I nematodi che esprimono tratti di poliglutammina (polyQ) marcati con tag fluorescenti mostrano un'aggregazione dipendente dalla lunghezza dell'età e del poliQ caratterizzata da focolai fluorescenti. Tali reporter sono spesso impiegati come proxy per monitorare i cambiamenti nella proteostasi tra i tessuti. La quantificazione manuale degli aggregati richiede molto tempo e limita la produttività sperimentale. Inoltre, la quantificazione manuale dei fuochi può introdurre distorsioni, poiché l'identificazione aggregata può essere altamente soggettiva. Qui, un protocollo costituito da coltivazione di vermi, acquisizione di immagini ed elaborazione dei dati è stato standardizzato per supportare la quantificazione aggregata ad alto rendimento utilizzando C. elegans che esprimono polyQ specifico dell'intestino. Implementando una pipeline di elaborazione delle immagini basata su C. elegans utilizzando CellProfiler, un software di analisi delle immagini, questo metodo è stato ottimizzato per separare e identificare i singoli worm ed enumerare i rispettivi aggregati. Sebbene il concetto di automazione non sia del tutto unico, la necessità di standardizzare tali procedure per la riproducibilità, l'eliminazione dei pregiudizi dal conteggio manuale e l'aumento della produttività è elevata. Si prevede che questi metodi possano semplificare drasticamente il processo di screening di grandi librerie batteriche, genomiche o di farmaci utilizzando il modello C. elegans .
Introduzione
Le malattie conformazionali delle proteine neurodegenerative dipendenti dall'età (PCD) come l'Alzheimer, il Parkinson e la malattia di Huntington, o la sclerosi laterale amiotrofica, sono caratterizzate da un misfolding proteico che porta all'aggregazione, alla morte cellulare e alla degenerazione dei tessuti1. Mentre il misfolding proteico è riconosciuto come il colpevole, l'eziologia di queste malattie non è chiara. Come tale, lo sviluppo di terapie efficaci è stato ostacolato dalla mancanza di conoscenza dei fattori e delle condizioni che contribuiscono all'insorgenza e alla progressione della malattia. Studi recenti suggeriscono che i cambiamenti nel microbioma influenzano l'insorgenza, la progressione e la gravità delle PCD 2,3,4. Tuttavia, la complessità del microbioma umano, o addirittura murino, rende difficile condurre studi che rivelino l'esatta influenza dei microbi sul loro ospite. Pertanto, organismi più semplici, come Caenorhabditis elegans, sono spesso usati come strumento di scoperta 5,6,7,8. Studi recenti hanno impiegato C. elegans per studiare l'effetto dei batteri sulla proteostasi dell'ospite e sulla patogenesi della malattia 9,10. La colonizzazione batterica, l'ormesi e i cambiamenti genomici sono tra le condizioni esemplari che influenzano l'aggregazione dei tratti di poliglutammina (polyQ) 9,11,12. Inoltre, questi cluster proteici mal ripiegati mostrano un accumulo dipendente dalla lunghezza e dall'età del poliQ all'interno dell'ospite e sono associati a una motilitàcompromessa 9,13. L'approccio relativamente semplice di quantificare il puncta etichettato fluorescentemente può generare dati importanti su condizioni, fattori o farmaci che influenzano il ripiegamento e l'aggregazione delle proteine.
Sebbene la quantificazione della puncta fluorescente si sia dimostrata una procedura affidabile e relativamente semplice, la sfida rimane quella di sviluppare un protocollo che faciliti lo screening su larga scala di composti, batteri o condizioni che influenzano l'aggregazione proteica. Il concetto di elaborazione automatizzata delle immagini C. elegans e di quantificazione puntuale non è del tutto nuovo, poiché sono stati sviluppati numerosi strumenti di supporto pratico14,15. Tuttavia, l'integrazione della coltivazione, dell'acquisizione delle immagini e di una pipeline di elaborazione sono essenziali per eliminare la variabilità dei risultati e consentire schermi a throughput più elevato.
Come tale, l'intento di questo manoscritto è quello di standardizzare la procedura utilizzata per quantificare l'aggregazione polyQ in C. elegans come proxy per rilevare i cambiamenti nella proteostasi. Questo compito è stato realizzato utilizzando CellProfiler, un software di analisi delle immagini open source16 in grado di automatizzare l'identificazione di worm e aggregati, ed è integrato in un protocollo più ampio per la coltivazione di worm, l'acquisizione di immagini e l'elaborazione di dati.
Protocollo
Tutte le procedure hanno seguito le linee guida di sicurezza che sono state riviste e approvate dal Comitato istituzionale per la biosicurezza dell'Università della Florida. Sono state adottate misure di biosicurezza appropriate per mitigare il rischio di esposizione ai batteri di livello di sicurezza biologica-2.
NOTA: Per tutti gli esperimenti, C. elegans deve essere propagato e mantenuto su piastre di crescita di nematodi (NGM) seminate con Escherichia coli OP50.
1. Preparazione di piastre NGM da 10 cm
- Unire 3 g di NaCl, 2,5 g di triptasi-peptone e 17 g di agar in un matraccio da 2 L e riempire fino a 1 L con acqua doppia distillata (ddH2O). Aggiungere la barra magnetica prima dell'autoclave.
- Autoclave della miscela per 45 min a 121 °C e una pressione di 21 psi. Lasciare raffreddare il composto a 50 °C a bagnomaria.
- Utilizzando tecniche asettiche, aggiungere le seguenti soluzioni sterili: 1 mL di 1 M CaCl2· 2H2O, 1 mL di 1 M MgSO4· 7H2O, 1 mL di 5 mg/mL di colesterolo disciolto in etanolo al 100% (riscaldato a temperatura ambiente) e 25 mL di 1 M KH2PO4 (pH = 6,0). Mescolare usando una piastra magnetica. Il mixaggio può essere eseguito per 1 minuto a 700 RPM.
- Versare fino a quando il composto riempie l'intera piastra di 10 cm. In alternativa, utilizzare una pipetta sierologica graduata per aggiungere circa 20 ml di miscela per piastra.
- Lasciare asciugare le piastre per 24 ore a temperatura ambiente prima della semina con batteri o conservare le piastre semplici a 4 °C dopo l'essiccazione.
NOTA: tutti i componenti multimediali vengono gestiti utilizzando tecniche asettiche. I passaggi 1.3-1.4 devono essere eseguiti in una cappa a flusso laminare.
2. Preparazione dell'agar NGM con FUDR in piastre a 24 pozzetti
- Seguire i passaggi 1.1-1.3.
- Integrare NGM con 5-Fluoro-2′-deossiuridina (FUDR) e miscelare per ottenere una concentrazione finale di 100 μg/mL.
NOTA: FUDR inibisce la replicazione del DNA e, di conseguenza, blocca la riproduzione di C. elegans prendendo di mira la linea germinale e l'embriogenesi, influenzando in ultima analisi la durata della vita. Pertanto, è importante consentire ai vermi di svilupparsi completamente in giovani adulti prima di trasferirsi su piastre contenenti FUDR.
ATTENZIONE: il FUDR è tossico e deve essere maneggiato secondo la scheda di dati di sicurezza del produttore. - Utilizzando una pistola a pipetta, erogare 1 mL di NGM-FUDR in ciascun pozzetto.
NOTA: Questo processo può essere facilitato dall'uso di un sistema di colata automatico delle lastre. - Lasciare asciugare la piastra per 24 ore a temperatura ambiente prima di seminare con batteri o conservare piastre semplici a 4 °C.
3. Semina di piastre: OP50 e batteri di prova aggiuntivi
- Per preparare una coltura notturna di E. coli OP50, aggiungere 200 μL di aliquota batterica da un brodo congelato in un matraccio Erlenmeyer da 500 ml contenente 250 mL di brodo di Luria fresco e sterile (LB).
NOTA: il volume del supporto dipende dal numero di piastre che devono essere seminate. Per preparare altre colture batteriche, inoculare un tubo di coltura da 16 ml contenente 5 mL di terreno di coltura con batteri provenienti da stock congelati utilizzando una punta sterile a micropipetta. - Incubare durante la notte in un incubatore a 37 °C, agitando a 220 RPM (rotazioni al minuto).
NOTA: utilizzare palloni sterilizzati con almeno il doppio del volume di lavoro del supporto e sigillare con un foglio di alluminio autoclavato. Eseguire la fase di inoculazione e l'erogazione batterica utilizzando tecniche asettiche. - Erogare 1-2 ml della coltura notturna di E. coli OP50 al centro di ogni piastra NGM da 10 cm. Questa cultura non ha bisogno di essere diffusa intorno alla piastra NGM.
- Lasciare asciugare le piastre a temperatura ambiente prima dell'uso/conservazione.
NOTA: le piastre seminate con coperchi possono essere collocate in una cappa con flusso d'aria per facilitare l'asciugatura.
4. Coltivazione e semina di piatti: piastre a 24 pozzetti
- Preparare una coltura notturna dei ceppi batterici desiderati, aderendo alle istruzioni di coltivazione che si trovano nei passaggi 3.1-3.2.
- Trasferire 200 μL di ogni coltura batterica in ogni pozzetto di una piastra a 24 pozzetti contenente Agar NGM. Un volume di 200 μL di batteri coprirà l'intera area dell'agar, massimizzando la quantità di cibo per garantire che i vermi non evitino il prato batterico.
- Lasciare le piastre aperte in un armadio di sicurezza biologica (BSC) per facilitare l'asciugatura. Controllare periodicamente le piastre per evitare un'eccessiva disidratazione e cambiare l'orientamento della piastra per favorire un flusso d'aria e un'asciugatura uniformi. Le piastre dovrebbero asciugarsi entro 5 ore.
NOTA: Qualsiasi lavoro con batteri di livello di sicurezza biologica-2 deve essere eseguito in BSC certificati e approvati dal Comitato istituzionale per la biosicurezza.
5. Sincronizzazione dell'età
NOTA: Tutti i passaggi devono essere eseguiti utilizzando tecniche asettiche appropriate (ad esempio, lavorando vicino a una fiamma o all'interno di un BSC).
- Lavare gli ermafroditi gravidi dalle piastre OP50 da 10 cm utilizzando una soluzione M9 sterilizzata con filtro (5,8 g di Na2HPO4· 7H2O, 3,0 g di KH2PO4, 5 g di NaCl, 0,25 g di MgSO4·7H2O, in 1 L di ddH2O).
- Pipetta M9 soluzione sulla piastra più volte utilizzando un pipetto sierologico sterile di vetro o plastica per sollevare i vermi dal prato batterico.
- Raccogliere la sospensione di vite senza fine e trasferire la soluzione in un tubo conico di polistirene da 15 ml.
- Centrifuga a 270 x g, temperatura ambiente (RT, ~23 °C), per 2 min.
- Aspirare usando un pallone trappola sottovuoto e scartare il surnatante, lasciando indisturbato il pellet di verme.
- Risospesciare il pellet in 5-10 ml di M9 per lavare i vermi e ripetere i passaggi 5.2-5.3 due volte.
- Aggiungere 5 mL di soluzione sbiancante al 20% (8,25 mL di ddH2O, 3,75 mL di 1M NaOH, 3,0 mL di candeggina non germicida) al tubo e invertire continuamente per sciogliere i vermi. I vermi sono pronti per centrifugare una volta che si sono quasi completamente dissolti.
NOTA: i tempi di sbiancamento e il volume della soluzione sbiancante dipenderanno dalle dimensioni del campione. Lo sbiancamento eccessivo e insufficiente sono errori comuni. Pertanto, questo processo richiede generalmente l'ottimizzazione per determinare quando il campione è pronto per la centrifugazione. - Centrifugare per 2 minuti a 423 x g ed eliminare il surnatante.
- Aggiungere 10 ml di M9 sterile per risospendare il pellet d'uovo.
- Centrifugare il tubo per 2 minuti a 423 x g per pellettizzare le uova. Rimuovere il surnatante con un pallone aspiratore.
- Ripetere i passaggi 5.6-5.6.1.
- Risospentare il pellet d'uovo in 5 ml di M9 sterile e metterlo su un nutatore per una notte alla temperatura desiderata.
NOTA: le larve L1 sincronizzate con l'età saranno pronte per essere trasferite su piastre il giorno seguente.
6. Preparazione del worm dopo la sincronizzazione dell'età
- Centrifugare i vermi sincronizzati con l'età a 270 x g per 3 minuti a RT (~23 °C).
- Aspirare il surnatante in un ambiente pulito, come una cappa di flusso o accanto a un bruciatore Bunsen. Lasciare circa 200 μL del surnatante e risospese i vermi.
- Utilizzando una micropipetta, trasferire la sospensione di vite senza fine concentrata su piastre NGM da 10 cm che sono state precedentemente seminate con OP50.
NOTA: ogni piatto può supportare 1.500 vermi senza rimanere senza cibo; tuttavia, questa concentrazione può richiedere un aggiustamento a seconda della densità del prato batterico e della temperatura di crescita. Si consiglia di utilizzare più piastre per evitare che i vermi muoiano di fame. È importante notare che queste piastre non devono contenere FUDR. - Lasciare asciugare le piastre; quindi capovolgere e conservare a 25 °C per 48 ore.
NOTA: a seconda delle condizioni dello schermo, i vermi del passaggio 6.1 possono essere posizionati direttamente sulle piastre di prova (contenenti batteri, farmaci o composti di prova). Se la condizione di test desiderata influisce sullo sviluppo, i vermi devono essere coltivati su NGM contenente OP50 fino ai giovani adulti (~ 48 h) prima di esporli alle condizioni di test. - Dopo l'incubazione di 48 ore, lavare i vermi dalle piastre con una soluzione sterile di M9 e metterli in tubi conici.
NOTA: i vermi adulti affonderanno sul fondo del tubo. Il tempo esatto varierà in base al numero di vermi recuperati da piastre da 10 cm. In queste condizioni, i vermi si depositano entro 10 minuti. - Eseguire un'ispezione visiva per determinare la durata del tempo di assestamento in modo tale da rimuovere eventuali uova residue o larve schiuse.
- Aggiungere altri 10 ml di M9 per risciacquare i batteri residui dai corpi dei vermi.
- Centrifugare i vermi per 2-3 min a 270 x g a 23 °C.
- Eseguire la fase di lavaggio altre 3 volte. Per ottenere i migliori risultati, lasciare circa 1-1,5 ml di soluzione M9 nel tubo dopo il lavaggio finale.
- Trasferire 10 μL della sospensione di vite senza fine su un vetrino e contare il numero di vermi.
- Regolare la densità del worm a circa 150 worm per 10 μL di M9. La concentrazione di vermi in sospensione può essere regolata rimuovendo o aggiungendo la soluzione M9 dopo la centrifugazione.
- Confermare che la concentrazione desiderata è stata stabilita facendo la media dei conteggi da diverse gocce. Si consiglia di fare la media dei conteggi da almeno tre gocce.
- Utilizzando tecniche asettiche, trasferire 10 μL della sospensione di vite senza fine contenente circa 150 vermi in ciascun pozzetto della piastra di prova.
- Ispezionare i pozzetti al microscopio per assicurarsi che ciascuno abbia un numero sufficiente di vermi. Ulteriori vermi possono essere aggiunti prima dell'incubazione.
- Lasciare asciugare le piastre per circa 10 minuti; quindi invertire e trasferire in un incubatore a 25 °C per 72 ore.
NOTA: Il periodo di incubazione finale può essere regolato per soddisfare le esigenze dell'esperimento. Il tempo di incubazione di 72 ore è sufficiente per sostenere la crescita di 150 animali che si nutrono di batteri da 200 μL in una piastra a 24 pozzetti a 25 °C.
7. Preparazione dei worm per l'imaging
- Per facilitare una sedimentazione più efficace e ridurre al minimo la perdita di campione, immobilizzare i vermi prima del lavaggio per impedire il nuoto.
NOTA: Se si lavora con pochi campioni, questo può essere ottenuto attraverso l'esposizione al levamisolo (100 μM). Tuttavia, se si lavora con un gran numero di campioni, i vermi possono essere immobilizzati congelando. Inoltre, il congelamento prolungato (18-24 ore) impedirà l'ulteriore sviluppo di aggregati polyQ durante la preparazione.- Posizionare piastre multi-pozzetto a -20 °C per 15-20 minuti o fino a quando i vermi non si muovono più.
- Rimuovere i campioni dal congelatore e lasciarli riposare per 5 minuti.
- Utilizzando una micropipetta, aggiungere 1 mL di M9, refrigerato a 4 °C, in un pozzo di interesse, premere e premere ripetutamente lo stantuffo 4-6 volte per lavare i vermi in ciascun pozzetto.
NOTA: A volte, i vermi possono attaccarsi alle punte delle micropipette. Pertanto, è necessario utilizzare diversi suggerimenti tra ciascun pozzetto per prevenire la miscelazione di vermi. - Trasferire la sospensione a vite senza fine in un tubo microcentrifuga e consentire ai vermi di affondare sul fondo.
- Aspirare e scartare il surnatante. Lavare il campione per un totale di tre volte.
- Dopo che i vermi si sono depositati sul fondo durante il lavaggio finale, aspirare 500 μL di surnatante, lasciando 500 μL ai vermi risospesi.
- Trasferire la sospensione a vite senza fine rimanente in una nuova piastra a fondo piatto a 24 pozzetti e metterla in un congelatore a -20 °C per 48 ore.
NOTA: il congelamento dei worm riduce la fluorescenza di fondo e consente una migliore visualizzazione degli aggregati.
8. Imaging
- Rimuovere le piastre dal congelatore e lasciare scongelare, eliminare la condensa in eccesso e rimuovere il coperchio prima dell'imaging.
NOTA: i dettagli dell'acquisizione delle immagini variano in base all'apparecchiatura e al software utilizzati. I protocolli per questa sezione dovrebbero servire solo come guida e le modifiche sono prevedibili. È inoltre necessario acquisire immagini nel formato di file tiff. - Durante l'acquisizione dell'immagine, utilizzare le seguenti impostazioni del microscopio: Tempo di esposizione, 500 ms; Ingrandimento 40x con adattatore per fotocamera 0,63x (25,2x), intensità GFP impostata al 100%.
NOTA: Varie configurazioni e sistemi di microscopi potrebbero acquisire immagini diverse da quelle fornite nella sezione risultati. Per ottenere una descrizione più universale delle immagini richieste, vengono forniti dettagli più oggettivi riguardanti le immagini. Gli aggregati devono avere un diametro compreso tra 1,0 e 10,0 pixel con un'intensità fluorescente di 0,10-1,0 (unità arbitrarie, scala 0-1) per essere correttamente identificati dal CellProfiler. Lo sfondo fluorescente per queste immagini aggregate è generalmente inferiore alla soglia di 0,10. Per le immagini in campo luminoso, l'intensità del worm varia da 0,7 a 1,0 con un'intensità di sfondo di 0,1-0,2. La lunghezza media dei worm nelle immagini in campo luminoso varia da 250 pixel a 350 pixel di lunghezza dalla testa alla coda. - Regola i controlli della luce trasmessa fino a quando i vermi appaiono illuminati in modo brillante rispetto allo sfondo scuro. Evitare la sovraesposizione; aumenterà le dimensioni del worm.
- Potrebbe essere necessario modificare le posizioni dei vermi all'interno del pozzo per evitare eccessivi grumi. Disperdere i vermi raggruppati usando una punta di pipetta.
- Impostate il canale su GFP per stabilire un piano focale per entrambe le immagini.
NOTA: è essenziale che il piano focale sia determinato nel canale GFP. Qualsiasi cambiamento di messa a fuoco effettuato durante l'acquisizione di immagini in campo luminoso comporterà il disallineamento di aggregati e worm durante l'analisi delle immagini. - Cattura un'immagine in campo luminoso e scatta immediatamente la sua immagine fluorescente corrispondente senza disturbare la piastra.
- Eseguire immagini di test attraverso la pipeline per determinare i valori di intensità e dimensione per gli oggetti nell'immagine in base alla "NOTA" dopo il passaggio 8.2.
NOTA: CellProfiler può fornire tutte le informazioni necessarie sull'intensità e la lunghezza degli oggetti prima dell'analisi. - Per valutare le immagini, prima, scarica CellProfiler17. Apri il software e trascina e rilascia le immagini di interesse nella casella Immagini.
- Fare clic sulle immagini nell'elenco dei file per aprirle.
- Nell'angolo in alto a sinistra dello schermo ci sono diverse icone; usali per misurare le dimensioni degli oggetti o ingrandire una regione specifica. Selezionare la lente di ingrandimento per evidenziare un'area di interesse.
- Selezionare l'icona della freccia per misurare la lunghezza sia dei worm che degli aggregati.
- Passa il mouse sopra l'oggetto desiderato per determinarne il valore di intensità che può essere visto nella parte inferiore dello schermo.
NOTA: poiché tutte le immagini vengono scattate in scala di grigi, tutti i valori dei pixel rossi, blu e verdi saranno identici.
9. Analisi delle immagini
- Per utilizzare la pipeline di analisi delle immagini di CellProfiler, denominare correttamente le coppie di immagini. Utilizzare il seguente formato: P1_A01_S1_C1, dove P1 si riferisce alla targa specifica e alla rispettiva designazione numerica; "A", si riferisce alla riga e "01" alla colonna; "S" si riferisce a una coppia di immagini specifica per un singolo pozzo; "C" si riferisce al canale, dove "1" è usato per indicare le immagini in campo luminoso e "2" per le immagini fluorescenti.
- Scarica CellProfiler (versione 4.1.3 o successiva) dal sito ufficiale17.
- Scarica la pipeline (File supplementare 1). Caricare la pipeline (pipeline) in CellProfiler selezionando File > Importa > pipeline da file.
NOTA: i moduli 2 e 3 sono stati disabilitati in quanto ritenuti non necessari. La loro funzione può essere ripristinata se l'analisi delle immagini non produce una separazione e un'identificazione soddisfacenti dei vermi; tuttavia, è necessaria una modifica della pipeline. - Per incorporare questi moduli, selezionare le caselle situate a sinistra di ciascun modulo. Rinominare l'immagine binaria di input per il modulo "UntangleWorms" nell'immagine di output dal modulo "convertobjectstoimage".
- Un messaggio di errore può essere visualizzato durante l'utilizzo iniziale relativo al Modulo 2. In questo caso, procedere con l'analisi.
- Caricare un set di formazione utilizzato per identificare i worm nel modulo "UntangleWorms". Questo set di formazione è disponibile nel file supplementare 2.
- Selezionare il modulo UntangleWorms per aprirne le impostazioni.
- Identificare il nome del file del set di formazione e selezionare l'icona di caricamento del file.
- Carica il file supplementare 2 (set di allenamento).
- Carica le immagini selezionando il modulo Immagini nell'angolo in alto a sinistra. Trascinare e rilasciare immagini con nome corretto come descritto nel passaggio 9.1.
- Prima di analizzare le immagini, selezionare la cartella di output desiderata che verrà utilizzata per archiviare i risultati.
- Fare clic sul pulsante Impostazioni di output situato vicino all'angolo in basso a sinistra del programma.
- Selezionare l'icona della cartella a destra di Output predefinito per scegliere la posizione di output desiderata.
- Selezionare l'icona Analizza immagini per iniziare l'analisi delle immagini.
- Se l'analisi richiede troppo tempo per essere completata ed è bloccata nell'elaborazione di una singola immagine, è probabile che sia dovuta a problemi dovuti all'acquisizione dell'immagine. In questo caso, interrompere l'esecuzione e procedere all'identificazione delle immagini non elaborate ordinando la cartella di output e notando quali nomi di immagine non vengono trovati.
NOTA: le immagini potrebbero richiedere un'elaborazione aggiuntiva per rimuovere artefatti di grandi dimensioni o intensamente illuminati che non possono essere elaborati dalla pipeline. In alcuni casi, potrebbe essere necessario escludere tali immagini dall'analisi. - Dopo un'analisi completa, il software organizzerà i risultati in un foglio di calcolo excel contenente i singoli worm (colonna N) e il rispettivo numero di aggregati (colonna K).
NOTA: un'esecuzione riuscita produrrà un foglio di calcolo Excel contenente il numero di aggregati per worm identificato per ogni pozzetto. Questi dati possono essere manipolati in un modo determinato dallo sperimentatore. - Scarica Metadata Organizer (Graphical User Interface) da Supplemental File 3 (Windows) o Supplemental File 4 (Mac) per organizzare comodamente i dati dal file CSV di output di CellProfiler.
NOTA: Questo software non ha una licenza ufficiale e non verrà aperto automaticamente dopo il download. - Seguire i passaggi 9.14-9.17 se si utilizza il sistema operativo Windows a 64 bit. Il software non funzionerà su Windows a 32 bit. Segui i passaggi 9.18-9.20 se utilizzi Mac OS. I passaggi 9.21-9.22 sono gli stessi per entrambi i sistemi operativi.
- Per il sistema operativo Windows, individuare il file scaricato ed estrarlo nella posizione desiderata.
- Individua e apri la cartella estratta denominata gui_windowsOS_64x e avvia l'applicazione facendo clic sull'icona dell'applicazione "gui".
- Potrebbe aprirsi un prompt che richiede l'autorizzazione per l'esecuzione. Seleziona Altre informazioni e quindi fai clic su Fidati comunque.
- L'organizzatore di metadati è pronto per trascinare e rilasciare i file CSV di output di CellProfiler. Continuare con il passaggio 9.21.
- Per Mac OS, individuate il file scaricato e aprite gui_macOS_64x.zip. Questo passaggio dovrebbe estrarre automaticamente tutti i file.
- Apri la cartella estratta che si trova in "Download".
- Fare clic con il pulsante destro del mouse sull'applicazione "gui" e selezionare Apri. Apparirà un prompt che chiede il permesso di aprire a causa della mancanza di una licenza ufficiale. Selezionare Apri e continuare con il passaggio 9.21.
- Fai clic su Carica i tuoi file qui o trascina e rilascia i file CSV CellProfiler desiderati.
- Fare clic sul pulsante Organizza , che porterà l'utente a una nuova schermata con un pulsante Scarica file . Fare clic sul pulsante e selezionare la posizione desiderata per salvare il file di output. Il file di output verrà visualizzato come nome file originale con estensione "_organized" aggiunta al nome del file.
Risultati
Il presente documento è descritto un flusso di lavoro di C. elegans che include protocolli di coltivazione, acquisizione di immagini ed elaborazione che consentono la valutazione dell'aggregazione polyQ in presenza di vari batteri utilizzando un formato di piastra a 24 pozzetti come piattaforma di coltivazione e imaging (Figura 1). Questo protocollo può essere regolato per studiare l'effetto di batteri, condizioni specifiche, piccole molecole, farmaci o manipolazioni genomiche sulla proteostasi dell'ospite. Il metodo descritto è stato ottimizzato utilizzando vermi che esprimono costitutivamente il polyQ intestinale fuso con una proteina fluorescente gialla (vha6p::p olyQ44::YFP); tuttavia, altri modelli che riportano la proteostasi nei muscoli o nei neuroni possono anche essere utilizzati con un'ulteriore ottimizzazione. Ad esempio, esperimenti preliminari dimostrano l'applicazione di questi metodi nella quantificazione di aggregati proteici in altri tessuti come il polyQ muscolare (Figura supplementare 1). Tuttavia, sarà necessaria una modifica alla tubazione per regolare correttamente le dimensioni e la luminosità dell'aggregato, come indicato nella sezione 8 NOTA.
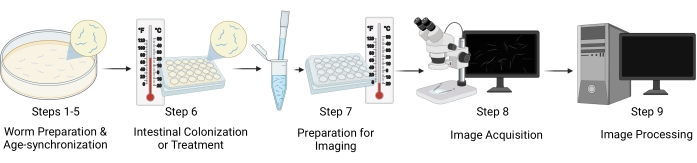
Figura 1: Rappresentazione visiva del flusso di lavoro. I passaggi principali del protocollo includono cinque fasi distinte: preparazione dei vermi e sincronizzazione dell'età (passaggi 1-5), colonizzazione intestinale / trattamento dei vermi (fase 6), preparazione del campione per l'imaging (fase 7), acquisizione delle immagini (fase 8) ed elaborazione delle immagini (fase 9). Le "Sezioni" del protocollo sono indicate come "Passi" nella figura. Fare clic qui per visualizzare una versione più grande di questa figura.
Gli esperimenti di ottimizzazione iniziali hanno rivelato varie difficoltà associate al sovraffollamento a causa di un gran numero di progenie, con conseguente esaurimento più rapido del cibo. L'integrazione di FUDR nelle piastre NGM descritte nella sezione 2 ha risolto questo problema (Figura 2). Inoltre, in presenza di FUDR, i vermi che sono stati nutriti con vari batteri avevano una dimensione corporea più coerente, che ha permesso un rilevamento dei vermi più uniforme e accurato.
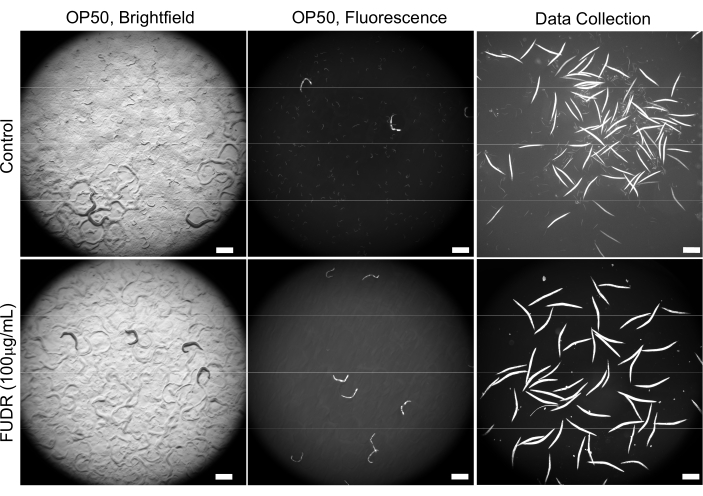
Figura 2: L'uso di FUDR migliora la qualità dell'immagine riducendo la progenie. Le piastre integrate con FUDR eliminano la progenie di C. elegans rispetto ai vermi coltivati su piastre NGM non di controllo FUDR seminate con E. coli OP50. Le immagini sono state acquisite con ingrandimento 25,2x (ingrandimento 40x con un adattatore per fotocamera 0,63x). Barre di scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
La fluorescenza di fondo ha contribuito al rilevamento di falsi positivi di aggregati polyQ. Per ridurre tale segnale di fluorescenza nel tratto intestinale e migliorare il rilevamento automatizzato degli aggregati, è stato necessario congelare i vermi prima dell'imaging. I vermi di congelamento a -20 °C per 18-48 ore hanno migliorato significativamente il rilevamento degli aggregati polyQ eliminando la fluorescenza di fondo (Figura 3A). L'occhio umano è in grado di distinguere tra aggregati e fluorescenza di fondo; quindi il conteggio manuale prima e dopo il congelamento è lo stesso (Figura 3B). Tuttavia, il conteggio automatico non è così accurato, ma il congelamento ha migliorato significativamente i conteggi automatizzati con una precisione paragonabile al conteggio manuale (Figura 3B).

Figura 3: Il congelamento migliora il rilevamento aggregato. (A) Immagini fluorescenti di C. elegans che esprimono poliQ44::YFP intestinale prima e dopo il congelamento. Gli inserti rappresentano immagini ravvicinate dell'area selezionata. Barre di scala = 500 μm. (B) Numero medio di aggregati per intestino in vermi colonizzati con P. aeruginosa MPAO1 prima e dopo il congelamento utilizzando la quantificazione aggregata manuale o automatizzata (pipeline). I dati rappresentano due repliche biologiche (n = 60-109). La significatività statistica è stata calcolata utilizzando il t-test dello studente (**** p < 0,0001). Le barre di errore rappresentano l'errore standard della media (SEM). Fare clic qui per visualizzare una versione più grande di questa figura.
L'illuminazione a campo luminoso invertito è stata utilizzata per rilevare l'intero C. elegans (Figura 4A) e il canale GFP per l'immagine poliQ44::YFP aggregati (Figura 4B). Il rilevamento, il districamento e la quantificazione degli aggregati per ogni worm sono stati eseguiti applicando una pipeline di elaborazione delle immagini CellProfiler ottimizzata (File supplementare 1), che consente di ottenere il numero di aggregati per singolo worm (Figura 4C-D). Per testare la fattibilità di questo approccio e l'accuratezza del rilevamento e della quantificazione automatizzata degli aggregati, i vermi che esprimono il poliQ44::YFP intestinale specifico sono stati coltivati e preparati per l'imaging secondo i protocolli stabiliti (sezioni 1-7). Il numero di aggregati per worm è stato valutato utilizzando la pipeline automatizzata (sezioni 8-9) o il conteggio manuale. Ogni esperimento è stato eseguito in tre studi indipendenti utilizzando 90-571 vermi per condizione. Mentre il numero medio di aggregati per intestino ottenuto con due studi non aveva differenze significative, i vermi nel terzo studio avevano significativamente meno aggregati quando quantificati utilizzando l'approccio automatizzato (Figura 5A). Il numero medio di aggregati dei tre studi ha prodotto aggregati leggermente, ma significativamente meno quando la quantificazione è stata effettuata utilizzando la pipeline CellProfiler (sezioni 8-9) (Figura 5B). Tuttavia, la differenza tra i due approcci era minima, indicando che il metodo automatizzato può essere applicato a schermi su larga scala.
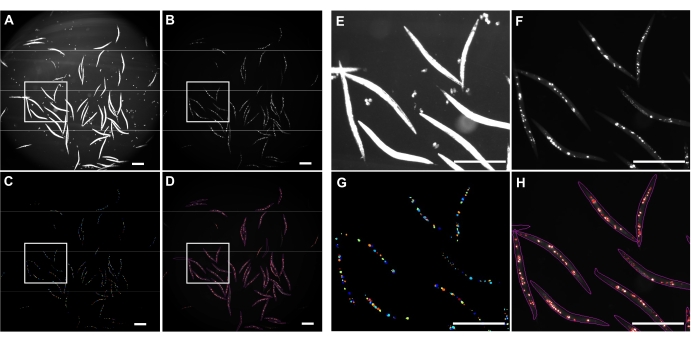
Figura 4: Rilevamento aggregato mediante CellProfiler. (A) Immagine Brightfield utilizzata per identificare i corpi dei vermi. (B) Immagine fluorescente originale acquisita utilizzando il canale GFP e utilizzata per identificare e quantificare un numero totale di aggregati poliQ44::YFP intestinali. (C) Aggregati identificati utilizzando CellProfiler. (D) Un numero totale di aggregati identificati sovrapposti all'immagine fluorescente originale con contorni worm e aggregati. L'acquisizione e l'elaborazione delle immagini sono state eseguite utilizzando le impostazioni descritte nelle sezioni 8-9. I pannelli E-H rappresentano immagini ravvicinate delle corrispondenti regioni delineate nelle immagini A-D. Le immagini sono state acquisite con ingrandimento 25,2x (ingrandimento 40x con un adattatore per fotocamera 0,63x). Barre di scala = 500 μm. Fare clic qui per visualizzare una versione più grande di questa figura.
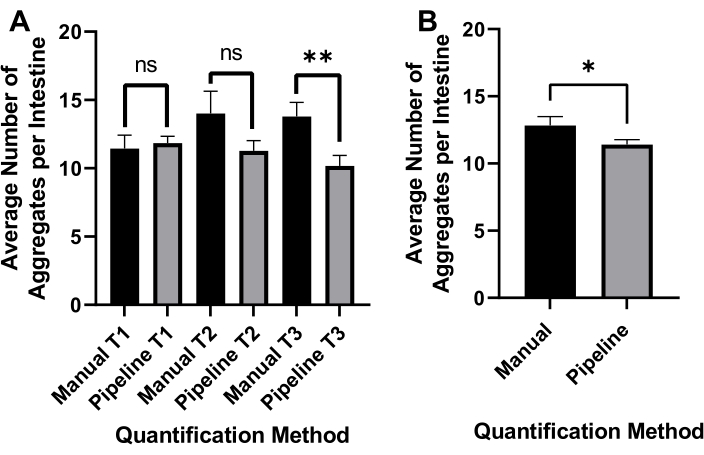
Figura 5: Efficacia della quantificazione automatica degli aggregati. (A) Numero aggregato medio per intestino nei vermi colonizzati con controllo E. coli OP50 utilizzando il conteggio manuale (manuale) e la quantificazione automatizzata basata su CellProfiler (Pipeline). I risultati rappresentano i dati analizzati in tre studi separati (T1-T3) (n = 90-571). (B) Il numero medio di aggregati per intestino è stato ottenuto utilizzando la quantificazione aggregata manuale o automatizzata (Pipeline). La significatività statistica è stata calcolata utilizzando il t-test dello studente (* p < 0,05, ** p < 0,01). Le barre di errore rappresentano SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
Per valutare la riproducibilità dei risultati tra diversi sperimentatori, le immagini di una piastra contenente sei pozzetti di vermi che sono stati alimentati con Pseudomonas aeruginosa MPAO1 o Escherichia coli OP50, sono state acquisite da tre individui, due dei quali non avevano alcuna esperienza precedente nell'imaging di vermi utilizzando questi protocolli. Le immagini raccolte da ciascun pozzo contenevano ovunque tra 30-115 vermi rilevati. Una differenza non significativa nell'aggregazione è stata rilevata nei vermi degli stessi pozzi che sono stati ripresi dai tre sperimentatori. Mentre il numero medio di aggregati per intestino è rimasto molto consistente tra i tre sperimentatori per vermi alimentati con MPAO1 e OP50, ci sono state alcune differenze statisticamente significative nel numero medio di aggregati ma solo nei vermi colonizzati da MPAO1 (Figura supplementare 2). Questi risultati evidenziano la riproducibilità dei risultati anche tra sperimentatori inesperti.
Per garantire che la riproducibilità della quantificazione aggregata non sia influenzata in modo significativo dalla posizione dei worm, è stato selezionato un set di 15 worm e ripresi 15 volte separatamente dopo l'agitazione tra ogni acquisizione dell'immagine utilizzando una punta di pipetta. Le immagini di aggregati in vermi alimentati con E. coli OP50 e P. aeruginosa MPAO1 sono state raccolte e analizzate utilizzando CellProfiler. Il numero medio di aggregati da ciascuno di questi diversi insiemi di immagini era leggermente ma non significativamente diverso, supportando ulteriormente la riproducibilità di questo approccio (Figura supplementare 3).
La colonizzazione dell'intestino di C. elegans con patogeni enterici gram-negativi ha dimostrato di interrompere la proteostasi attraverso i tessuti, con P. aeruginosa che è tra i più potenti induttori dell'aggregazione polyQ9. Per determinare se questi protocolli ottimizzati rileveranno e quantificheranno con successo il miglioramento dell'aggregazione mediato da P. aeruginosa, i vermi che esprimono polyQ intestinale sono stati colonizzati con E. coli OP50 (batteri di controllo) e P. aeruginosa MPAO1, sono state condotte sezioni 1-8. Le immagini acquisite sono state analizzate utilizzando CellProfiler (sezione 9, File supplementare 1). I risultati della quantificazione automatizzata mostrano un aumento significativo del numero di aggregati indotti da P. aeruginosa MPAO1, con conseguente aumento costante di due volte rispetto ai vermi alimentati con E. coli OP50 di controllo (Figura 6).

Figura 6: Il numero medio di aggregati per intestino nei vermi colonizzati con controllo E. coli OP50 e P. aeruginosa MPAO1. Il numero di aggregati per intestino è stato valutato utilizzando CellProfiler (paragrafi 8-9). I dati sono rappresentati come il numero medio di aggregati per intestino nei vermi colonizzati con OP50 (n = 1068) e MPAO1 (n = 1557). La significatività statistica è stata calcolata utilizzando il t-test dello studente (**** p < 0,0001). Le barre di errore rappresentano SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
La pipeline ottimizzata è stata progettata per supportare schermi su larga scala per le condizioni che influenzano la proteostasi. Per testare la fattibilità di questo approccio nello screening di grandi librerie di batteri per il loro effetto sulla proteostasi dell'ospite, è stata impiegata la pipeline qui descritta (sezioni 1-9) per testare l'effetto dei ceppi mutanti knock-out del gene non essenziale di 90 P. aeruginosa sull'aggregazione polyQ18. Questo schermo pilota fa parte di un progetto più ampio progettato per schermare tutti i ceppi mutanti non essenziali di P. aeruginosa per la loro capacità di influenzare la proteostasi dell'ospite. Su 90 ceppi batterici testati, la colonizzazione dell'intestino di C. elegans con un candidato ha mostrato una significativa diminuzione del numero di aggregati (Figura 7). Esperimenti di follow-up per valutare la sensibilità di questo test sono stati eseguiti tramite conteggi aggregati manuali da una selezione casuale di sei mutanti di P. aeruginosa che differivano in modo non significativo dal controllo MPAO1. Questi esperimenti sono stati eseguiti utilizzando le più tradizionali piastre NGM da 6 cm, trasferendo i vermi su ceppi di prova come L1 per ricapitolare i metodi precedentemente stabiliti9. Gli esperimenti di conferma mediante conteggio manuale hanno rivelato che nessuno dei mutanti, incluso quello che ha ridotto significativamente il numero di aggregati (Figura 7), ha influenzato l'aggregazione polyQ (Figura supplementare 4). Inoltre, i sottili cambiamenti nell'aggregazione osservati nello screening dei 90 ceppi mutanti non sono stati rilevati tra i conteggi manuali dei candidati selezionati, indicando che tali cambiamenti potrebbero verificarsi a causa della variabilità biologica e sperimentale, come il basso valore n. Collettivamente, i risultati indicano che mentre il nostro metodo può raccogliere in modo affidabile cambiamenti significativi, quelli sottili probabilmente mancheranno e tutti i potenziali candidati dovranno essere confermati individualmente.
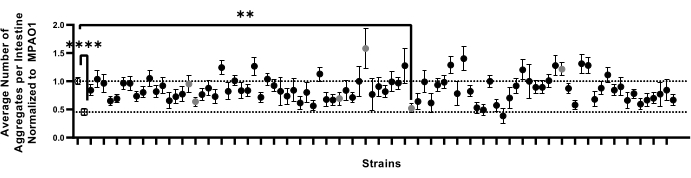
Figura 7: Il numero di aggregati per intestino in un campione rappresentativo di vermi colonizzati da 92 ceppi batterici. I dati sono rappresentati come il numero medio di aggregati per intestino normalizzato a quello dei vermi colonizzati con MPAO1. Le linee tratteggiate rappresentano il numero medio di aggregati nei vermi colonizzati con controllo MPAO1 (in alto, cerchio aperto) e OP50 (in basso, quadrato aperto). I simboli solidi rappresentano 90 distinti ceppi mutanti knock-out di P. aeruginosa MPAO1. Il numero medio di aggregati per verme tra i vermi colonizzati con MPAO1 e un singolo mutante era statisticamente significativo. I cerchi grigi rappresentano campioni che sono stati confermati manualmente (Figura supplementare 4). La significatività statistica è stata calcolata utilizzando l'analisi unidirezionale della varianza (ANOVA) seguita dal confronto multiplo del test post-hoc di Dunnett (** p < 0,01, **** p < 0,0001). Le barre di errore rappresentano SEM. Fare clic qui per visualizzare una versione più grande di questa figura.
Per gestire la grande quantità di dati generati da CellProfiler, è stata sviluppata un'interfaccia utente grafica (GUI) per automatizzare l'elaborazione e l'organizzazione dei dati (Figura 8). La GUI è stata sviluppata utilizzando Tkinter, un toolkit di widget multipiattaforma Python open source. Dai metadati forniti, l'applicazione estrae il numero di aggregati (colonna K) da ciascun pozzo (colonna J) presente in una piastra. Una libreria di gestione dei dati Python chiamata "Pandas" è stata utilizzata per eseguire il suddetto processo. L'applicazione GUI fornisce supporto drag-and-drop per gli utenti per caricare file di dati. I dati in ogni file vengono memorizzati sotto forma di una struttura tabulare bidimensionale chiamata frame di dati. Una coppia di dizionari vuota viene inizializzata per ogni pozzo univoco trovato all'interno del frame di dati. Successivamente, gli aggregati distinti trovati in ciascun pozzo vengono contati e aggiunti alle rispettive coppie di dizionari. La colonna con meno dati è imbottita con stringhe con valori vuoti per garantire che ogni colonna abbia dimensioni uniformi. Infine, la struttura viene convertita in un frame di dati che viene esportato sotto forma di foglio di calcolo nella directory specificata dall'utente.

Figura 8: Interfaccia utente grafica. Fare clic qui per visualizzare una versione più grande di questa figura.
Figura supplementare 1: Rilevamento di aggregati polyQ muscolo-specifici. I vermi che esprimono poliQ35::YFP muscolo-specifici sono stati placcati come L1 e coltivati su OP50 per 48 ore. Una volta che i vermi si sono sviluppati in giovani adulti, sono stati trasferiti in piastre NGM a 24 pozzetti, integrati con FUDR da 100 μg / mL e seminati con MPAO1 per ulteriori 72 ore prima dell'imaging. (A) Immagine Brightfield utilizzata per identificare i corpi dei vermi. (B) Immagine fluorescente originale acquisita utilizzando il canale GFP. (C) Aggregati identificati utilizzando CellProfiler. (D) Un numero totale di aggregati identificati sovrapposti all'immagine fluorescente originale con contorni worm e aggregati. L'acquisizione e l'elaborazione delle immagini sono state eseguite utilizzando le impostazioni descritte nelle sezioni 8-9. I pannelli E-H rappresentano immagini ravvicinate delle corrispondenti regioni delineate nelle immagini A-D. Barre di scala = 500 μm. Fare clic qui per scaricare questo file.
Figura supplementare 2: Riproducibilità della quantificazione aggregata tra diversi sperimentatori. Numero medio di aggregati quantificati utilizzando CellProfiler per sei pozzetti di vermi colonizzati con P. aeruginosa MPAO1 (barre nere) e sei pozzetti di vermi colonizzati con controllo E. coli OP50 (barre grigie). Ogni pozzo è stato ripreso da tre sperimentatori (AVS, DMC, RDH). I dati sono rappresentati come il numero medio di aggregati per intestino (n = 30-115). La significatività statistica è stata calcolata utilizzando ANOVA unidirezionale seguito dal test di confronto multiplo di Tukey (* p < 0,05, ** p < 0,01). Le barre di errore rappresentano SEM. Fare clic qui per scaricare questo file.
Figura supplementare 3: L'effetto della posizione del verme sulla riproducibilità della quantificazione aggregata. Numero aggregato medio per intestino nei vermi colonizzati con controllo E. coli OP50 (barre grigie) e P. aeruginosa MPAO1 (barre nere). I risultati rappresentano il numero medio di aggregati per intestino (15≥n≥12) quantificati utilizzando CellProfiler. La posizione dei vermi all'interno dei pozzi è stata cambiata dall'agitazione tra ogni acquisizione. Non sono state riscontrate differenze statisticamente significative in nessuno dei due gruppi. La significatività statistica è stata calcolata utilizzando ANOVA unidirezionale seguito dal test di confronto multiplo di Tukey. Le barre di errore rappresentano SEM. Fare clic qui per scaricare questo file.
Figura 4 supplementare: Conferma dello schermo pilota con conteggio manuale. Il numero medio di aggregati per intestino è stato quantificato manualmente. I dati rappresentano profili di aggregazione di vermi colonizzati con sei mutanti knock-out MPAO1 (cerchi grigi Figura 7) confrontati con i controlli MPAO1 e OP50 wild-type (n = 30). La significatività statistica è stata calcolata utilizzando ANOVA unidirezionale seguito dal confronto multiplo del test post-hoc di Dunnett (**** p < 0,0001). Le barre di errore rappresentano SEM. Fare clic qui per scaricare questo file.
Figura supplementare 5: L'effetto della FUDR sull'aggregazione del poliQ intestinale. I dati sono rappresentati come il numero medio di aggregati polyQ44::YFP per intestino (n = 20). I vermi sono stati trasferiti su piastre di controllo (senza FUDR) o contenenti FUDR (100 μg/mL) dopo 48 ore di crescita a 25 °C su E. coli OP50. I conteggi manuali sono stati raccolti dopo ulteriori 48 ore. La significatività statistica è stata calcolata utilizzando il t-test dello studente (ns = non significativo). Le barre di errore rappresentano SEM. Fare clic qui per scaricare questo file.
File supplementare 1: Pipeline di proteostasi. Pipeline di analisi delle immagini scaricabile da utilizzare in CellProfiler. Le istruzioni per l'applicazione sono disponibili nella sezione 9. Fare clic qui per scaricare questo file.
File supplementare 2: Set di allenamento che districa il worm. File da caricare nel modulo "UntangleWorms". Questo particolare set di formazione è specifico per i worm utilizzati nell'approccio iniziale. Le alterazioni delle dimensioni e della forma dei vermi cambieranno l'accuratezza e la qualità dell'identificazione. Potrebbe essere necessario creare un file di allenamento più personalizzato. Le istruzioni per la creazione di un nuovo set di formazione sono disponibili sul sito Web ufficiale di CellProfiler17. Fare clic qui per scaricare questo file.
File supplementare 3: Interfaccia utente grafica per il sistema operativo Windows. gui_windowsOS_64x.zip. Fare clic qui per scaricare questo file.
File supplementare 4: interfaccia utente grafica per il sistema operativo Mac. gui_MacOS_64x.zip. Fare clic qui per scaricare questo file.
Discussione
Il protocollo descritto delinea le procedure per la coltivazione, l'imaging e l'elaborazione delle immagini di C. elegans che incorpora CellProfiler, un software di analisi delle immagini open source. I risultati rappresentativi dimostrano riproducibilità, riduzione dei pregiudizi e scalabilità. Questa procedura standardizzata migliorerà le strategie di screening impiegate con grandi librerie batteriche, genomiche o farmacologiche. Mentre esistono altri metodi automatizzati di rilevamento degli oggetti di C. elegans , la tecnica descritta offre una pipeline standardizzata e a throughput più elevato che integra la coltivazione, l'acquisizione di immagini e l'analisi.
Diverse varianti della coltivazione dei vermi hanno dovuto essere testate per ottimizzare il protocollo qui descritto. Inizialmente, i vermi sono stati trasferiti ai batteri campione immediatamente dopo la sincronizzazione dell'età (stadio L1). Tuttavia, un tale approccio ha portato a una popolazione di vermi con dimensioni variabili, anche tra vermi all'interno dello stesso pozzo. C. elegans è noto per l'evitamento dei patogeni19, che potrebbe aver contribuito alla variabilità osservata in termini di dimensioni e, in ultima analisi, influenzare in particolare il rilevamento di worm di imaging a valle. Per eliminare tale variabilità, l'intera area NGM in ogni pozzo è stata coperta da batteri di prova. Inoltre, i vermi sono stati nutriti con E. coli OP50 e hanno permesso di svilupparsi completamente in giovani adulti per 48 ore a 25 °C. Consentire ai vermi di raggiungere l'età adulta su E. coli OP50 prima di trasferirli sui batteri di prova ha portato a dimensioni corporee più coerenti. Inoltre, il sovraffollamento e il rapido esaurimento alimentare da parte della progenie sono stati eliminati integrando NGM agar con FUDR. L'implementazione di FUDR ha rimosso la progenie e migliorato l'identificazione automatizzata dei vermi, che è stata oscurata dalla progenie che si mescola con la popolazione parentale. Tuttavia, è importante essere cauti e utilizzare controlli appropriati quando si utilizza FUDR, poiché il composto è noto per influenzare la proteostasi di C. elegans e la durata della vita20,21. Nelle condizioni descritte in questo protocollo, la FUDR non ha influenzato l'aggregazione del poliQ intestinale (Figura supplementare 5); pertanto, il suo utilizzo era adatto e vantaggioso per il metodo descritto.
Il congelamento dei campioni prima dell'imaging si è rivelato un passo fondamentale per il successo dell'impiego della pipeline. I conteggi aggregati prima del congelamento erano significativamente più alti dei conteggi manuali (Figura 3B). Mantenere i worm a -20 °C per 18-48 ore prima dell'imaging ha ridotto la fluorescenza di fondo e, in definitiva, migliorato il rilevamento degli aggregati (Figura 3A). Gli effetti del congelamento sul rilevamento aggregato sono stati studiati solo per polyQ e non dovrebbero essere generalizzati ad altri modelli senza ulteriori indagini su tali effetti.
Nonostante tutte le condizioni siano state mantenute invariate, è stato osservato che il numero medio di aggregati per verme potrebbe variare tra le diverse tirature, mentre il rapporto tra il numero di aggregati negli animali colonizzati con OP50 rispetto a MPAO1 è rimasto coerente (Figura 6, Figura supplementare 2, Figura supplementare 5). Pertanto, è essenziale includere sempre il controllo E. coli OP50, o eventuali ulteriori controlli di riferimento adeguati, in ogni corsa. Tale variabilità nei conteggi aggregati tra gli esperimenti potrebbe essere influenzata dalle condizioni ambientali (temperatura, umidità)22,23 o dal background genetico8. In effetti, è stato osservato che dopo una coltura prolungata, la fluorescenza intestinale diminuiva drasticamente o era completamente persa, il che richiedeva lo scongelamento di un nuovo ceppo dal brodo congelato. La diminuzione osservata della fluorescenza potrebbe essere il risultato di cambiamenti genetici che sopprimono i transgeni tossici, come quelli che esprimono polyQ. Tuttavia, l'eccezionale riproducibilità dei risultati osservati tra diversi sperimentatori (Figura supplementare 2), tra repliche biologiche (Figura 5) e all'interno dello stesso campione (Figura supplementare 3) sottolinea la forza di questo approccio.
Numerosi rapporti hanno impiegato il polyQ intestinale per studiare la proteostasi 9,11,12,13,24,25. Tuttavia, un confronto diretto tra i risultati non può essere effettuato a causa della variabilità tra approcci sperimentali e metodi di lettura. Tuttavia, alcuni risultati di dati precedentemente pubblicati sono ricapitolati dalla quantificazione automatizzata qui descritta, tra cui l'induzione batterica dell'aggregazione 9,13 e un numero comparabile di aggregati11. Collettivamente, la pipeline descritta offre uno strumento prezioso per studiare la proteostasi.
Il metodo qui descritto presenta alcune sfide intrinseche. Ad esempio, richiede tempo sufficiente per padroneggiare tutti i componenti di questo protocollo, il che è particolarmente vero per la sezione 8 del protocollo, che richiede familiarità con il test per determinare se le immagini acquisite sono appropriate per l'analisi della pipeline. Sono possibili deviazioni dalle impostazioni di acquisizione delle immagini utilizzate in questo protocollo; tuttavia, sarà probabilmente necessaria una modifica delle impostazioni e del set di addestramento dei worm. Questa pipeline è in grado di distinguere aggregati di varie dimensioni e quelli che si toccano, il che limita la "miscelazione" degli aggregati e, in definitiva, aumenta la sensibilità di rilevamento. Tuttavia, possono sorgere problemi quando si tenta di identificare aggregati di grandi dimensioni che superano l'intervallo di dimensioni accettato, poiché l'espansione della soglia di dimensione superiore può portare a errori causati da una scarsa identificazione, come l'impossibilità di differenziare gli aggregati che si toccano. Prima dell'analisi dell'immagine è necessario trovare un equilibrio tra precisione, dimensioni e intensità. L'efficienza dell'identificazione aggregata potrebbe essere ulteriormente migliorata incorporando l'apprendimento automatico per creare una rete neurale in grado di migliorare il rilevamento aggregato. Tali miglioramenti sono attualmente in fase di esplorazione e saranno di grande aiuto nell'affrontare questioni attuali come il rilevamento di aggregati che si trovano su diversi piani focali o che hanno forme anormali.
Un notevole punto debole del metodo descritto è la variabilità nei conteggi aggregati automatizzati, in quanto non sono sempre ricapitolati dai conteggi manuali in vermi alimentati con diversi ceppi batterici. Ad esempio, sulla base di conteggi automatizzati, i vermi alimentati con P. aeruginosa mutante 53 (M53) avevano significativamente meno aggregati rispetto al ceppo wild-type (MPAO1) (Figura 7); tuttavia, la conferma del successo non ha mostrato differenze significative (Figura supplementare 4). In generale, gli schermi di droga ad alto rendimento hanno un alto tasso di rilevamento di colpi falsi positivi e il metodo descritto non fa eccezione26. Pertanto, è una parte fondamentale del protocollo confermare tutti i potenziali colpi.
Mentre questo protocollo è stato ottimizzato per adattarsi a una strategia di screening per identificare i batteri che influenzano la proteostasi dell'ospite, ogni passaggio può essere ulteriormente modificato per testare l'effetto delle librerie RNAi genomiche, delle piccole molecole o di altre condizioni. Ulteriori modifiche possono essere apportate in ogni fase per soddisfare i requisiti di una specifica strategia di screening. Inoltre, questa tecnica fornisce un livello di flessibilità che consente l'ottimizzazione di ogni passaggio per adattarsi a un modello specifico. Ad esempio, questo approccio può essere esteso all'aggregazione polyQ in altri tessuti o all'estrazione di altre caratteristiche rilevate in immagini come il monitoraggio dell'espressione genica utilizzando reporter fluorescenti inducibili (ad esempio, geni di shock termico), la valutazione della localizzazione subcellulare delle proteine (ad esempio, la localizzazione nucleare di DAF-16), lo studio dell'aggregazione in altri modelli di malattia (Aβ1-42, α-sinucleina, TDP-43, ecc.) o la valutazione di fenotipi fisiologici, come la dimensione del worm.
Divulgazioni
Gli autori hanno dichiarato che non esistono conflitti di interesse.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health (1RO3AG069056-01) e dalla Infectious Diseases Society of America che finanzia DMC. I finanziatori non hanno avuto alcun ruolo nella progettazione dello studio, nella raccolta e nell'analisi dei dati, nella decisione di pubblicare o nella preparazione del manoscritto. Ringraziamo i membri del Czyz Lab per la correzione di bozze del manoscritto. Le figure dei cartoni animati sono state generate utilizzando la licenza a pagamento di BioRender.
Materiali
| Name | Company | Catalog Number | Comments |
| 1.7 mL Microtubes | Olympus Plastics | Cat#24-282 | Microcentrifuge tubes |
| 10 mL Serological Pipettes | GenClone | Cat#12-104 | Plastic pipettes |
| 15 mL Centrifuge Tubes, Racked | Olympus Plastics | Cat#28-101 | Conical tubes |
| 5-Fluoro-2′-deoxyuridine | Fisher Scientific | D2235100MG | FUDR |
| Accu-jet Pro Pipette Controller | Genesee Scientific | 91-600RB | Pipette gun |
| Agar | Fisher Scientific | Cat#BP1423-2 | Granulated agar |
| BioRender | BioRender | Graphical figure generator | |
| Bleach (Regular) | Clorox | Bar# 044600324111, Splash-less Bleach | 4.5% sodium hypochlorite |
| C. elegans: AM140: rmIs132 [unc-54p::q35::yfp] | Morimoto Lab (Northwestern University) | AM140, Q35::YFP | Muscle polyQ |
| C. elegans: AM738: rmIs297[vha-6p::q44::yfp; rol-6(su1006)] | Morimoto Lab (Northwestern University) | AM738, Q44::YFP | Intestinal polyQ |
| CaCl2·2H2O | Fisher Scientific | Cat#C79-500 | Calcium chloride dihydrate |
| CellProfiler | Broad Institute | Image analysis software | |
| Cholesterol | Fisher Scientific | Cat#ICN10138201 | Cholesterol |
| Circulating Water Bath Head | Lauda | 26LE | Lauda E 100 |
| CoolLED pE300lite 365 dir mount STEREO | CoolLED | 8114931 | Fluorescent light control and emitter |
| 16 mL Culture Tubes | Olympus Plastics | 21-129 | Culture tubes, 17 mm x 100 mm |
| Escherichia coli OP50 | Caenorhabditis Genetics Center | OP50 | E. coli control strain |
| Ethanol, 200 Proof | Decon Labs, Inc. | 2701 | |
| Eyepiece 10x/23B, adjustable, 3d gen | Leica Microsystems | 10450910 | Eyepiece set |
| Filter Set ET GFP - MZ10F | Leica Microsystems | 10450588 | Filter cube |
| GraphPad Prism v9.2.0 | GraphPad Software, Inc. | Statistical analysis tool | |
| Heratherm Incubator IMP180 | Thermo | 51031562 | Refrigerated incubator |
| Innova 4000 | New Brunswick Scientific | M1192-0000 | Shaking incubator |
| K5 Camera | Leica Microsystems | 11547112 | Stereomicroscope camera |
| KH2P04 | Fisher Scientific | Cat#P285-3 | Potassium phosphate monobasic |
| LAS X Imaging Software | Leica Microsystems | Microscope imaging software | |
| Leica MZ10 F Optics Carrier | Leica Microsystems | 10450103 | Stereomicroscope |
| Levamisole | Fisher Scientific | Cat#0215522805 | Levamisole hydrochloride |
| Luria Broth (Lennox) | Apex Bioresearch Products | Cat#11-125 | LB |
| Magnetic Stir Plate | Fisher Scientific | 11-100-49S | Stir plate |
| MgSO4·7H2O | Alfa Aesar | A14491 | Magnesium sulfate heptahydrate |
| Microscope Slides | Premiere | 8205 | Single frosted microscope slides |
| Na2HPO4·7H2O | Fisher Scientific | Cat#S373-500 | Sodium phosphate dibasic heptahydrate |
| NaCl | Fisher Scientific | Cat#S671-500 | Sodium chloride |
| NaOH | Fisher Scientific | Cat#S318-3 | Sodium hydroxide pellets |
| Objective Achromat, f = 100 mm | Leica Microsystems | 10411597 | Objective microscope lens |
| Petri Dishes | Genesee Scientific | Cat#32-107G | 100 mm x 15 mm |
| Pseudomonas aeruginosa Mutant Library | Manoil Lab (University of Washington) | P. aeruginosa mutant library | |
| Suspension Culture Plate 24-Well, Flat Bottom | Olympus Plastics | 25-102 | Used for worm growth and imaging |
| Trinocular Tube 100% M-series | Leica Microsystems | 10450043 | |
| Trypticase Peptone | ThermoFisher, Difco | Cat#211921 | |
| TX-400 Rotor | Thermo Scientific | Cat#75003181 | Swing bucket rotor |
| Vacuum Driven Filter System | GenClone | Cat#25-227 | 500 mL, PES Membrane, .22 µm |
| Video Objective with C-Mount | Leica Microsystems | 10447367 | 0.63x camera adapter tube |
Riferimenti
- Soto, C. Unfolding the role of protein misfolding in neurodegenerative diseases. Nature Reviews Neuroscience. 4 (1), 49-60 (2003).
- Fang, P., Kazmi, S. A., Jameson, K. G., Hsiao, E. Y. The microbiome as a modifier of neurodegenerative disease risk. Cell Host & Microbe. 28 (2), 201-222 (2020).
- Kundu, P., Blacher, E., Elinav, E., Pettersson, S. Our gut microbiome: The evolving inner self. Cell. 171 (7), 1481-1493 (2017).
- Sherwin, E., Dinan, T. G., Cryan, J. F. Recent developments in understanding the role of the gut microbiota in brain health and disease. Annals of the New York Academy of Sciences. 1420 (1), 5-25 (2018).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7 (1), 13023 (2016).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a tissue-selective heat shock response regulatory network. PLoS Genetics. 9 (4), 1003466 (2013).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438 (2011).
- Nollen, E. A., et al. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Walker, A. C., et al. Colonization of the Caenorhabditis elegans gut with human enteric bacterial pathogens leads to proteostasis disruption that is rescued by butyrate. PLOS Pathogens. 17 (5), 1009510 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against α-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Kumsta, C., Chang, J. T., Schmalz, J., Hansen, M. Hormetic heat stress and HSF-1 induce autophagy to improve survival and proteostasis in C. elegans. Nature Communications. 8, 14337 (2017).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108, 14204-14209 (2011).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. Journal of Biological Chemistry. 283 (1), 194-201 (2008).
- Hakim, A., et al. WorMachine: machine learning-based phenotypic analysis tool for worms. BMC Biology. 16 (1), 8 (2018).
- Wählby, C., et al. An image analysis toolbox for high-throughput C. elegans assays. Nature Methods. 9 (7), 714-716 (2012).
- Jones, T. R., et al. CellProfiler Analyst: data exploration and analysis software for complex image-based screens. BMC Bioinformatics. 9 (1), 482 (2008).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomona aeruginosa PA01. Journal of Bacteriology. 194 (23), 6387-6389 (2012).
- Schulenburg, H., Ewbank, J. J. The genetics of pathogen avoidance in Caenorhabditis elegans. Molecular Microbiology. 66 (3), 563-570 (2007).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964 (2014).
- Van Raamsdonk, J. M., Hekimi, S. FUdR causes a twofold increase in the lifespan of the mitochondrial mutant gas-1. Mechanisms of Ageing and Development. 132 (10), 519-521 (2011).
- Haldimann, P., Muriset, M., Vígh, L., Goloubinoff, P. The novel hydroxylamine derivative ng-094 suppresses polyglutamine protein toxicity in Caenorhabditis elegans. Journal of Biological Chemistry. 286 (21), 18784-18794 (2011).
- Shinn-Thomas, J. H. Wrapping culture plates with Parafilm M® increases Caenorhabditis elegans growth. BMC Research Notes. 12 (1), (2019).
- Alexander-Floyd, J., et al. Unexpected cell type-dependent effects of autophagy on polyglutamine aggregation revealed by natural genetic variation in C. elegans. BMC Biology. 18 (1), 18 (2020).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Sink, R., Gobec, S., Pecar, S., Zega, A. False positives in the early stages of drug discovery. Current Medicinal Chemistry. 17 (34), 4231-4255 (2010).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon