Method Article
Caenorhabditis elegans의 집계 정량화 자동화
요약
다음 프로토콜은 프로테오스타시스의 변화 평가로서 폴리글루타민 응집체를 정량화하기 위한 웜 배양, 형광 이미징 및 자동화된 이미지 처리를 위한 고처리량 워크플로우의 개발 및 최적화를 설명합니다.
초록
신경 퇴행성 단백질 형태 질환 (PCD)의 유병률의 증가는 수년에 걸쳐이 주제에 대한 큰 관심을 불러 일으켰습니다. 이러한 관심의 증가는 PCD를 가진 인간에서 관찰 된 질병 표현형을 재현 할 수있는 동물 모델의 다양 화와 개선을 요구하고있다. 뮤린 모델은 매우 귀중한 것으로 입증되었지만 비용이 많이 들고 힘들고 처리량이 낮은 방법과 관련이 있습니다. PCD를 연구하기 위해 Caenorhabditis elegans 선충류 모델을 사용하는 것은 유지 보수가 상대적으로 용이하고 비용이 저렴하며 빠른 생성 시간으로 인해 높은 처리량의 응용 프로그램을 사용할 수 있기 때문에 정당화되었습니다. 또한, C. elegans 와 인간 게놈 사이의 높은 보존은이 모델을 귀중한 발견 도구로 만듭니다. 형광 태깅된 조직 특이적 폴리글루타민(polyQ) 관을 발현하는 선충류는 형광 초점이 특징인 연령- 및 polyQ 길이 의존적 응집을 나타낸다. 이러한 기자들은 종종 조직 전반에 걸친 프로테오스타시스의 변화를 모니터링하기 위해 프록시로 고용된다. 수동 집계 정량화는 시간이 많이 걸리므로 실험 처리량이 제한됩니다. 또한, 수동 초점 정량화는 집계 식별이 매우 주관적일 수 있기 때문에 편향을 도입할 수 있습니다. 본원에서, 웜 배양, 이미지 획득 및 데이터 처리로 구성된 프로토콜은 장특이적 polyQ를 발현하는 C. elegans 를 이용한 고처리량 응집체 정량화를 지원하도록 표준화되었다. 이미지 분석 소프트웨어인 CellProfiler를 사용하여 C. elegans 기반 이미지 처리 파이프라인을 구현함으로써 이 방법은 개별 웜을 분리 및 식별하고 각각의 집계를 열거하도록 최적화되었습니다. 자동화의 개념이 완전히 독특하지는 않지만 재현성, 수동 계산에서 편향을 제거하고 처리량을 늘리기 위해 이러한 절차를 표준화해야 할 필요성이 높습니다. 이러한 방법은 C. elegans 모델을 사용하여 대규모 박테리아, 게놈 또는 약물 라이브러리의 스크리닝 과정을 크게 단순화 할 수 있다고 예상됩니다.
서문
알츠하이머, 파킨슨병, 헌팅턴병과 같은 연령 의존적 신경퇴행성 단백질 형태 질환(PCD) 또는 근위축성 측삭 경화증은 응집, 세포 사멸 및 조직 변성을 유발하는 단백질 오폴딩을 특징으로 한다1. 단백질 미스폴딩이 범인으로 인식되지만, 이러한 질병의 병인은 명확하지 않습니다. 따라서 효과적인 치료법의 개발은 질병 발병 및 진행에 기여하는 요인과 상태에 관한 지식이 부족하여 방해 받고 있습니다. 최근 연구에 따르면 미생물의 변화는 PCD 2,3,4의 발병, 진행 및 중증도에 영향을 미친다고 합니다. 그러나 인간 또는 심지어 뮤린 미생물의 복잡성으로 인해 미생물이 숙주에 미치는 정확한 영향을 밝혀내는 연구를 수행하기가 어렵습니다. 따라서 Caenorhabditis elegans와 같은 더 단순한 유기체는 종종 발견 도구 5,6,7,8로 사용됩니다. 최근 연구는 숙주 프로테오스타시스 및 질병 병인에 대한 박테리아의 효과를 조사하기 위해 C. elegans를 고용했다 9,10. 박테리아 콜로니화, 호메시스 및 게놈 변화는 폴리글루타민(polyQ) 관로9,11,12의 응집에 영향을 미치는 예시적 조건 중 하나이다. 추가적으로, 이들 미스폴딩된 단백질 클러스터는 숙주 내에서 polyQ 길이- 및 연령-의존적 축적을 나타내며, 손상된 운동성 9,13과 연관된다. 형광 표지된 누자를 정량화하는 비교적 간단한 접근법은 단백질 폴딩 및 응집에 영향을 미치는 조건, 인자 또는 약물에 대한 중요한 데이터를 생성할 수 있다.
형광 누점의 정량화가 신뢰할 수 있고 비교적 간단한 절차로 입증되었지만, 단백질 응집에 영향을 미치는 화합물, 박테리아 또는 조건의 대규모 스크리닝을 용이하게하는 프로토콜을 개발하는 것은 여전히 과제입니다. 자동화 된 C. elegans 이미지 처리 및 누점 정량화의 개념은 많은 실용적인 지원 도구가 개발되었으므로 완전히 새로운 것은 아닙니다14,15. 그러나 컬쳐링, 이미지 획득 및 처리 파이프라인의 통합은 결과의 변동성을 제거하고 더 높은 처리량의 스크린을 허용하는 데 필수적입니다.
따라서이 원고의 의도는 프로테오스타시스의 변화를 탐지하기위한 프록시로서 C. elegans 에서 polyQ 응집을 정량화하는 데 사용되는 절차를 표준화하는 것입니다. 이 태스크는 자동화된 웜 및 집계 식별이 가능한 오픈 소스 이미지 분석 소프트웨어(16 )인 CellProfiler를 채용함으로써 달성되었으며, 웜을 배양하고, 이미지를 획득하고, 데이터를 처리하기 위한 더 큰 프로토콜에 통합된다.
프로토콜
모든 절차는 플로리다 대학의 기관 생물 안전위원회에서 검토하고 승인 한 안전 지침을 따랐습니다. 생물학적 안전 레벨 2 박테리아에 노출 위험을 완화하기 위해 적절한 생물 안전 조치가 취해졌다.
참고 : 모든 실험에서 C. elegans는 Escherichia coli OP50으로 시드 된 선충류 성장 배지 (NGM) 플레이트에서 전파되고 유지되어야합니다.
1. 10cm NGM 플레이트의 제조
- NaCl 3g, 트립티카제-펩톤 2.5g, 한천 17g을 2L 플라스크에 넣고 1L를 이중 증류수(ddH2O)로 채운다. 오토클레이빙 전에 마그네틱 교반 바를 추가하십시오.
- 혼합물을 121°C 및 21 psi의 압력에서 45분 동안 오토클레이브한다. 혼합물을 수조에서 50°C로 냉각시킨다.
- 무균 기술을 사용하여 다음 멸균 용액을 첨가하십시오 : 1 mL의 1 MCaCl2· 2H2O, 1 mL의 1 MMgSO4· 7H2O, 100% 에탄올에 용해된 5 mg/mL 콜레스테롤 1 mL (실온으로 가온), 및 25 mL의 1 MKH2PO4(pH = 6.0). 마그네틱 교반 플레이트를 사용하여 혼합하십시오. 혼합은 700 RPM에서 1분 동안 수행될 수 있다.
- 혼합물이 전체 10cm 플레이트를 채울 때까지 붓는다. 또는 점진적 혈청학적 피펫을 사용하여 플레이트 당 약 20mL의 혼합물을 첨가한다.
- 박테리아로 시딩하기 전에 플레이트를 실온에서 24시간 동안 건조시키거나 건조 후 4°C에서 플레인 플레이트를 보관한다.
주: 모든 미디어 구성 요소는 무균 기술을 사용하여 처리됩니다. 단계 1.3-1.4는 층류 후드에서 수행되어야 한다.
2. 24웰 플레이트에서 FUDR을 사용한 NGM 한천 제조
- 1.1-1.3단계를 수행합니다.
- NGM을 5-플루오로-2'-데옥시우리딘(FUDR)으로 보충하고 혼합하여 100 μg/mL의 최종 농도를 달성하십시오.
참고: FUDR은 DNA 복제를 억제하고, 그 결과 생식계열 및 배아 발생을 표적화하여 C. elegans 생식을 차단하여 궁극적으로 수명에 영향을 미칩니다. 따라서 웜이 FUDR 함유 플레이트로 옮기기 전에 젊은 성인으로 완전히 발달 할 수 있도록하는 것이 중요합니다.
주의: FUDR은 독성이 있으므로 제조업체의 안전 데이터 시트에 따라 취급해야 합니다. - 피펫 건을 사용하여 NGM-FUDR 1mL를 각 웰에 분배합니다.
참고: 이 프로세스는 자동 플레이트 붓기 시스템을 사용하여 용이하게 할 수 있습니다. - 박테리아로 시딩하거나 일반 플레이트를 4°C에서 저장하기 전에 플레이트를 실온에서 24시간 동안 건조시킨다.
3. 플레이트의 시딩 : OP50 및 추가 테스트 박테리아
- 하룻밤 동안 대장균 OP50 배양물을 제조하기 위해, 냉동 스톡으로부터 박테리아 분취량 200 μL를 신선하고 멸균된 루리아 브로스(LB) 250 mL가 들어있는 500 mL 삼각 플라스크에 첨가한다.
참고: 미디어의 부피는 시드해야 하는 플레이트의 수에 따라 다릅니다. 다른 박테리아 배양물을 제조하기 위해, 멸균 마이크로피펫 팁을 사용하여 냉동 스톡으로부터 박테리아와 함께 성장 배지 5 mL를 함유하는 16-mL 배양 튜브에 접종한다. - 37°C 인큐베이터에서 하룻밤 동안 인큐베이션하고, 220 RPM(분당 회전수)에서 진탕한다.
참고: 적어도 두 배의 작동 부피의 매체로 멸균된 플라스크를 사용하고 오토클레이브 알루미늄 호일로 밀봉하십시오. 무균 기술을 사용하여 접종 단계 및 박테리아 분배를 수행하십시오. - 밤새 대장균 OP50 배양액 1-2 mL를 각 10 cm NGM 플레이트의 중앙에 분주한다. 이 배양물은 NGM 플레이트 주위에 확산될 필요가 없다.
- 사용 / 보관 전에 플레이트를 실온에서 건조시킵니다.
참고 : 뚜껑이있는 시드 된 플레이트는 건조를 용이하게하기 위해 공기 흐름이있는 후드에 배치 할 수 있습니다.
4. 접시의 배양 및 파종 : 24 웰 플레이트
- 원하는 박테리아 균주의 하룻밤 배양물을 준비하고, 단계 3.1-3.2에서 발견되는 배양 지침을 준수한다.
- 각 박테리아 배양물 200 μL를 NGM 한천을 함유하는 24-웰 플레이트의 각 웰로 옮긴다. 200 μL 부피의 박테리아가 전체 한천 지역을 덮을 것이며, 웜이 박테리아 잔디를 피하지 않도록 음식의 양을 극대화합니다.
- 건조를 용이하게하기 위해 생물학적 안전 캐비닛 (BSC)에서 금이 간 플레이트를 열어 두십시오. 과도한 탈수를 방지하고 플레이트 방향을 변경하여 공기 흐름과 건조를 촉진하기 위해 플레이트를 주기적으로 점검하십시오. 접시는 5 시간 이내에 건조해야합니다.
참고: 생물학적 안전 레벨 2 박테리아에 대한 모든 작업은 인증된 BSC에서 수행되어야 하며 기관 생물안전위원회의 승인을 받아야 합니다.
5. 연령 동기화
참고: 모든 단계는 적절한 무균 기술(즉, 화염 가까이에서 또는 BSC 내부에서 작업)을 사용하여 수행해야 합니다.
- 필터 멸균된 M9 용액(5.8 g의Na2HPO4· 7H2O, 3.0 g의 KH2PO4, 5 g의 NaCl, 0.25 g의 MgSO4·7H2O, 1 L의ddH2O).
- 피펫 M9 용액은 멸균 유리 또는 플라스틱 혈청 학적 피펫을 사용하여 박테리아 잔디밭에서 웜을 들어 올리기 위해 여러 번 플레이트 위에 올려 놓습니다.
- 웜 현탁액을 수집하고 용액을 15 mL 폴리스티렌 코니컬 튜브로 옮깁니다.
- 270 x g, 실온 (RT, ∼23°C)에서 2분 동안 원심분리한다.
- 진공 트랩 플라스크를 사용하여 흡인물은 상층액을 버리고, 웜 펠릿을 방해받지 않고 방치한다.
- 펠렛을 M9 5-10 mL에 재현탁하여 웜을 세척하고 5.2-5.3 단계를 두 번 반복하십시오.
- 튜브에 5 mL의 20% 표백 용액 (8.25 mL의ddH2O, 3.75 mL의 1M NaOH, 3.0 mL의 비살균성 표백제)을 첨가하고 웜을 용해시키기 위해 연속적으로 반전시킨다. 웜은 거의 완전히 용해되면 원심 분리할 준비가 되어 있습니다.
참고: 표백 시간과 표백 용액의 부피는 샘플의 크기에 따라 다릅니다. 과다 및 과소 표백은 일반적인 오류입니다. 따라서이 공정은 일반적으로 샘플이 원심분리 준비가되었는지를 결정하기 위해 최적화가 필요합니다. - 423 x g 에서 2분 동안 원심분리하고 상층액을 버린다.
- 멸균 M9 10 mL를 첨가하여 계란 펠릿을 재현탁하십시오.
- 튜브를 423 x g 에서 2분 동안 원심분리하여 알을 펠릿화한다. 흡인기 플라스크로 상층액을 제거하십시오.
- 5.6-5.6.1단계를 반복합니다.
- 달걀 펠렛을 멸균 M9 5 mL에 재현탁시키고 원하는 온도에서 밤새 너트 에이터에 놓습니다.
참고 : 연령 동기화 된 L1 유충은 다음날 플레이트로 옮길 준비가됩니다.
6. 웜 준비 후 연령 동기화
- 노화 동기화된 웜을 RT(∼23°C)에서 3분 동안 270 x g 에서 원심분리한다.
- 흐름 후드 또는 Bunsen 버너 옆과 같은 깨끗한 환경에서 상청액을 흡인하십시오. 약 200 μL의 상청액을 남겨두고 웜을 재현탁하십시오.
- 마이크로피펫을 사용하여 농축된 웜 현탁액을 이전에 OP50으로 시딩된 10cm NGM 플레이트로 옮깁니다.
참고 : 각 접시는 음식이 부족하지 않고 1,500 개의 웜을 지원할 수 있습니다. 그러나이 농도는 박테리아 잔디밭의 밀도와 성장 온도에 따라 조정이 필요할 수 있습니다. 웜이 굶주리는 것을 방지하기 위해 여러 개의 플레이트를 사용하는 것이 좋습니다. 이 플레이트에는 FUDR이 포함되어서는 안됩니다. - 접시가 마르게하십시오. 그런 다음 반전하여 25 °C에서 48 시간 동안 보관하십시오.
참고: 화면 상태에 따라 6.1단계의 웜을 테스트 플레이트(박테리아, 약물 또는 테스트 화합물 포함)에 직접 배치할 수 있습니다. 원하는 시험 조건이 발달에 영향을 미치는 경우, 웜은 시험 조건에 노출되기 전에 젊은 성인 (~ 48 시간)까지 OP50을 함유 한 NGM에서 배양해야합니다. - 48 시간 인큐베이션 후, 멸균 M9 용액으로 플레이트에서 웜을 씻어 원뿔형 튜브에 넣으십시오.
참고 : 성인 웜은 튜브 바닥으로 가라 앉습니다. 정확한 시간은 10cm 플레이트에서 회수 된 웜의 수에 따라 다릅니다. 이러한 조건 하에서 웜은 10 분 이내에 정착합니다. - 육안 검사를 수행하여 잔류 계란이나 부화 된 유충이 제거되도록 정착 시간의 지속 기간을 결정합니다.
- M9 10mL를 더 첨가하여 웜 바디에서 잔류 박테리아를 헹구십시오.
- 웜을 23°C에서 270 x g 에서 2-3분 동안 원심분리한다.
- 세척 단계를 추가로 3 번 수행하십시오. 최상의 결과를 얻으려면 최종 세척 후 약 1-1.5 mL의 M9 용액을 튜브에 두십시오.
- 웜 현탁액 10μL를 유리 슬라이드에 옮기고 웜의 수를 계산합니다.
- 웜 밀도를 M9의 10μL당 약 150개의 웜으로 조정합니다. 현탁액 중 웜의 농도는 원심분리 후 M9 용액을 제거하거나 첨가하여 조정할 수 있습니다.
- 원하는 농도가 여러 방울의 평균 카운트에 의해 설정되었는지 확인하십시오. 적어도 세 방울의 평균 카운트를 사용하는 것이 좋습니다.
- 무균 기술을 사용하여, 대략 150개의 웜을 함유하는 웜 현탁액 10μL를 시험 플레이트의 각 웰로 옮긴다.
- 현미경으로 우물을 검사하여 각 우물에 충분한 수의 웜이 있는지 확인하십시오. 추가 웜은 배양 전에 추가 할 수 있습니다.
- 플레이트를 약 10 분 동안 말리십시오. 그 후 반전시키고 72시간 동안 25°C 인큐베이터로 옮긴다.
참고: 최종 잠복기는 실험의 요구를 수용하도록 조정할 수 있습니다. 72시간 인큐베이션 시간은 25°C에서 24-웰 플레이트에서 200 μL 박테리아에 먹이를 주는 150마리의 동물의 성장을 지지하기에 충분하다.
7. 이미징을 위한 웜 준비
- 보다 효과적인 침전을 촉진하고 샘플 손실을 최소화하려면 수영을 방지하기 위해 세척 전에 웜을 고정시킵니다.
참고: 몇 개의 샘플로 작업하는 경우 레바미솔(100μM)에 노출되면 이를 달성할 수 있습니다. 그러나 많은 수의 샘플로 작업하는 경우 웜은 동결하여 고정시킬 수 있습니다. 추가적으로, 연장된 동결 (18-24 h)은 준비 동안 폴리Q 응집체의 추가 발달을 방지할 것이다.- 멀티 웰 플레이트를 -20 °C에서 15-20 분 동안 또는 웜이 더 이상 움직이지 않을 때까지 놓습니다.
- 냉동실에서 샘플을 꺼내 5 분 동안 그대로 두십시오.
- 마이크로 피펫을 사용하여 M9 1 mL를 첨가하고 4 °C로 냉각하고 관심있는 웰에 플런저를 4-6 번 반복적으로 누르고 눌러 각 웰에서 웜을 씻습니다.
참고 : 때로는 웜이 마이크로 피펫 팁에 달라 붙을 수 있습니다. 따라서 웜의 혼합을 방지하기 위해 각 우물 사이에 다른 팁을 사용해야합니다. - 웜 현탁액을 마이크로 원심 분리 튜브로 옮기고 웜이 바닥으로 가라 앉게하십시오.
- 상층액을 흡인하고 버립니다. 샘플을 총 세 번 세척하십시오.
- 웜이 최종 세척 동안 바닥에 침전 된 후, 500 μL의 상청액을 흡인하고 500 μL를 남겨두고 웜을 재현탁시킵니다.
- 나머지 웜 현탁액을 새로운 평평한 바닥 24-웰 플레이트로 옮기고 이를 48시간 동안 -20°C 냉동고에 넣는다.
참고: 웜을 얼리면 배경 형광이 감소하고 응집체를 더 잘 시각화할 수 있습니다.
8. 이미징
- 냉동실에서 플레이트를 분리하고 해동시키고 과도한 결로를 닦아내고 이미징 전에 뚜껑을 제거하십시오.
참고: 이미지 캡처의 세부 정보는 사용되는 장비 및 소프트웨어에 따라 다릅니다. 이 섹션의 프로토콜은 지침으로만 사용되어야 하며 수정이 예상됩니다. 또한 tiff 파일 형식으로 이미지를 캡처해야 합니다. - 이미지 캡처 중에 다음 현미경 설정을 사용하십시오: 노출 시간, 500ms; 0.63x 카메라 어댑터(25.2x)로 40배 배율, GFP 강도를 100%로 설정합니다.
참고: 다양한 현미경 구성 및 시스템은 결과 섹션에 제공된 것과 다른 이미지를 획득할 수 있습니다. 필요한 이미지에 대한보다 보편적 인 설명을 달성하기 위해 이미지에 대한보다 객관적인 세부 정보가 제공됩니다. 응집체는 CellProfiler에 의해 적절하게 식별되기 위해 직경이 1.0-10.0 픽셀이고 형광 강도가 0.10-1.0 (임의 단위, 스케일 0-1) 사이여야 합니다. 이들 응집체 이미지에 대한 형광 배경은 일반적으로 0.10 역치 미만이다. 밝은 필드 이미지의 경우 웜 강도의 범위는 0.7-1.0이며 배경 강도는 0.1-0.2입니다. 브라이트필드 이미지에서 웜의 평균 길이는 머리부터 꼬리까지 250픽셀에서 350픽셀 사이입니다. - 웜이 어두운 배경과 비교하여 밝게 비춰질 때까지 전송된 조명 컨트롤을 조정합니다. 과다 노출을 피하십시오; 그것은 웜 크기를 증가시킬 것입니다.
- 과도한 덩어리를 방지하기 위해 우물 내에서 웜의 위치를 변경해야 할 수도 있습니다. 피펫 팁을 사용하여 덩어리진 웜을 분산시킵니다.
- 채널을 GFP로 설정하여 두 이미지 모두에 대한 초점 평면을 설정합니다.
참고: GFP 채널에서 초점 평면을 결정하는 것이 중요합니다. 밝은 필드 이미지를 캡처하는 동안 초점이 변경되면 이미지 분석 중에 집계와 웜이 잘못 정렬됩니다. - 밝은 필드 이미지를 캡처하고 플레이트를 방해하지 않고 해당 형광 이미지를 즉시 촬영하십시오.
- 파이프라인을 통해 테스트 이미지를 실행하여 8.2단계 이후의 "참고"에 따라 이미지의 개체에 대한 강도 및 크기 값을 결정합니다.
참고: CellProfiler는 분석 전에 물체의 강도와 길이에 관한 모든 필요한 정보를 제공할 수 있습니다. - 이미지를 평가하려면 먼저 CellProfiler17을 다운로드하십시오. 소프트웨어를 열고 관심있는 이미지를 이미지 상자에 끌어다 놓습니다.
- 파일 목록에서 이미지를 클릭하여 엽니다.
- 화면의 왼쪽 상단 모서리에는 여러 아이콘이 있습니다. 이를 사용하여 물체의 크기를 측정하거나 특정 영역을 확대하십시오. 돋보기 유리를 선택하여 관심 영역을 강조 표시합니다.
- 화살표 아이콘을 선택하여 웜과 응집체의 길이를 측정합니다.
- 원하는 오브젝트 위로 마우스를 가져가면 화면 하단에서 볼 수 있는 강도 값을 확인할 수 있습니다.
참고: 모든 이미지는 회색조로 촬영되므로 모든 빨강, 파랑 및 녹색 픽셀 값이 동일합니다.
9. 이미지 분석
- CellProfiler 이미지 분석 파이프라인을 활용하려면 이미지 쌍의 이름을 올바르게 지정합니다. 다음 형식을 사용하십시오 : P1_A01_S1_C1, 여기서 P1은 특정 플레이트와 각각의 숫자 지정을 나타냅니다. "A"는 행을 나타내고 열에 "01"을 나타냅니다. "S"는 단일 웰에 대한 특정 이미지 쌍을 지칭하고; "C"는 채널을 의미하며, 여기서 "1"은 밝은 필드 이미지를 나타내고 "2"는 형광 이미지를 나타내는 데 사용됩니다.
- 공식 웹 사이트17에서 CellProfiler (버전 4.1.3 이상)를 다운로드하십시오.
- 파이프라인을 다운로드합니다(보충 파일 1). 파일에서 파이프라인으로 가져오기를 > 파일 >를 선택하여 파이프라인(파이프라인)을 CellProfiler에 업로드합니다.
참고: 모듈 2와 모듈 3은 불필요한 것으로 간주되어 비활성화되었습니다. 이미지 분석이 웜의 만족스러운 분리 및 식별을 산출하지 못하면 기능을 복원 할 수 있습니다. 그러나 파이프라인을 수정해야 합니다. - 이러한 모듈을 통합하려면 각 모듈의 왼쪽에 있는 상자를 선택합니다. "UntangleWorms" 모듈의 입력 이진 이미지의 이름을 "convertobjectstoimage" 모듈의 출력 이미지로 바꿉니다.
- 모듈 2와 관련된 초기 사용 중에 오류 메시지가 나타날 수 있습니다. 이 경우 분석을 진행하십시오.
- 웜을 식별하는 데 사용되는 교육 세트를 "UntangleWorms" 모듈에 업로드합니다. 이 교육 세트는 보충 파일 2에서 찾을 수 있습니다.
- UntangleWorms 모듈을 선택하여 해당 설정을 엽니다.
- 교육 세트 파일 이름을 식별하고 파일 업로드 아이콘을 선택합니다.
- 추가 파일 2(교육 세트)를 업로드합니다.
- 왼쪽 상단 모서리에 있는 이미지 모듈을 선택하여 이미지를 업로드합니다. 9.1단계에서 설명한 대로 적절하게 명명된 이미지를 끌어다 놓습니다.
- 이미지를 분석하기 전에 결과를 저장하는 데 사용할 원하는 출력 폴더를 선택하십시오.
- 프로그램의 왼쪽 하단 근처에있는 출력 설정 버튼을 클릭하십시오.
- 기본 출력 오른쪽에 있는 폴더 아이콘을 선택하여 원하는 출력 위치를 선택합니다.
- 이미지 분석 아이콘을 선택하여 이미지 분석을 시작합니다.
- 분석을 완료하는 데 너무 오래 걸리고 단일 이미지 처리가 중단되면 이미지 획득 문제로 인한 것일 수 있습니다. 이 경우 실행을 중단하고 출력 폴더를 통해 정렬하고 찾을 수 없는 이미지 이름을 기록하여 처리되지 않은 이미지를 식별합니다.
참고: 파이프라인에서 처리할 수 없는 크고 강렬한 조명의 아티팩트를 제거하기 위해 이미지를 추가 처리해야 할 수 있습니다. 일부 경우들에서, 이러한 이미지들은 분석으로부터 배제될 필요가 있을 수 있다. - 완전한 분석 후, 소프트웨어는 결과를 개별 웜 (열 N)과 각각의 집계 수 (열 K)가 포함 된 엑셀 스프레드 시트로 구성합니다.
참고: 성공적으로 실행하면 각 웰에 대해 식별된 웜당 집계 수가 포함된 Excel 스프레드시트가 생성됩니다. 이들 데이터는 실험자에 의해 결정된 방식으로 조작될 수 있다. - 보충 파일 3 (Windows) 또는 보충 파일 4 (Mac)에서 메타 데이터 구성 자 (그래픽 사용자 인터페이스)를 다운로드하여 CellProfiler의 출력 CSV 파일의 데이터를 편리하게 구성 할 수 있습니다.
참고: 이 소프트웨어에는 공식 라이센스가 없으며 다운로드 후 자동으로 열리지 않습니다. - Windows OS 64비트를 사용하는 경우 9.14-9.17단계를 수행합니다. 이 소프트웨어는 Windows 32 비트에서 작동하지 않습니다. Mac OS를 사용하는 경우 9.18-9.20단계를 수행합니다. 단계 9.21-9.22는 두 운영 체제 모두에서 동일합니다.
- Windows OS의 경우 다운로드한 파일을 찾아 원하는 위치로 압축을 풉니다.
- gui_windowsOS_64x라는 추출 된 폴더를 찾아 열고 "GUI"응용 프로그램 아이콘을 클릭하여 응용 프로그램을 시작하십시오.
- 실행 권한을 요청하는 프롬프트가 열릴 수 있습니다. 추가 정보를 선택하고 어쨌든 신뢰를 클릭합니다.
- 메타데이터 구성 도우미가 CellProfiler 출력 CSV 파일을 끌어다 놓을 준비가 되었습니다. 9.21단계를 계속 진행합니다.
- Mac OS의 경우 다운로드한 파일을 찾아 gui_macOS_64x.zip 엽니다. 이 단계에서는 모든 파일을 자동으로 추출합니다.
- "다운로드"에있는 추출 된 폴더를 엽니 다.
- "GUI"응용 프로그램을 마우스 오른쪽 버튼으로 클릭하고 열기를 선택하십시오. 공식 라이센스가 없기 때문에 개봉 허가를 요청하는 프롬프트가 나타납니다. 열기 를 선택하고 9.21단계를 계속합니다.
- 여기에 파일 업로드를 클릭하거나 원하는 CellProfiler CSV 파일을 끌어다 놓습니다.
- 구성 단추를 클릭하면 파일 다운로드 단추가 있는 새 화면으로 이동합니다. 버튼을 클릭하고 출력 파일을 저장할 원하는 위치를 선택하십시오. 출력 파일은 파일 이름에 "_organized"확장자가 추가 된 원래 파일 이름으로 나타납니다.
결과
본원에 기재된 것은 배양 및 이미징 플랫폼으로서 24-웰 플레이트 포맷을 사용하는 다양한 박테리아의 존재 하에 polyQ 응집의 평가를 허용하는 배양, 이미지 획득 및 프로세싱 프로토콜을 포함하는 C. elegans 워크플로우이다(도 1). 이 프로토콜은 숙주 프로테오스타시스에 대한 박테리아, 특정 조건, 소분자, 약물, 또는 게놈 조작의 효과를 연구하도록 조정될 수 있다. 기술된 방법은 황색 형광 단백질에 융합된 장내 폴리Q를 구성적으로 발현하는 웜을 사용하여 최적화되었다(vha6p::p olyQ44::YFP); 그러나 근육이나 뉴런의 프로테오스타시스에 대해보고하는 다른 모델도 추가 최적화와 함께 사용할 수 있습니다. 예를 들어, 예비 실험은 근육 polyQ와 같은 다른 조직에서의 단백질 응집체의 정량화에 이들 방법의 적용을 입증한다 (보충 도 1). 그러나 섹션 8 참고에서 언급한 대로 집계 크기와 밝기를 적절하게 조정하려면 파이프라인을 수정해야 합니다.
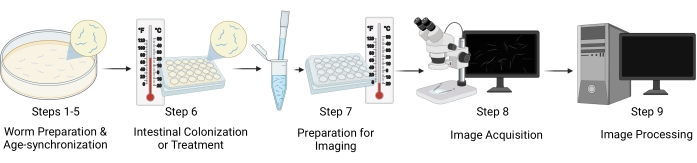
그림 1: 워크플로 시각적 표현. 프로토콜의 주요 단계에는 웜 준비 및 연령 동기화(단계 1-5), 장 콜로니화/웜 처리(단계 6), 이미징을 위한 샘플 준비(단계 7), 이미지 획득(단계 8) 및 이미지 처리(단계 9)의 다섯 가지 별개의 단계가 포함됩니다. 프로토콜의 "섹션"은 그림에서 "단계"로 참조됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
초기 최적화 실험은 많은 수의 자손으로 인한 과밀과 관련된 다양한 어려움을 밝혀 냈고, 결과적으로 더 빠른 식량 고갈을 초래했습니다. 섹션 2에 설명된 NGM 플레이트에서 FUDR을 보충하면 이 문제가 해결되었습니다(그림 2). 또한 FUDR이 존재할 때 다양한 박테리아를 먹인 웜은보다 일관된 신체 크기를 가지므로 더 균일하고 정확한 웜 탐지가 가능했습니다.
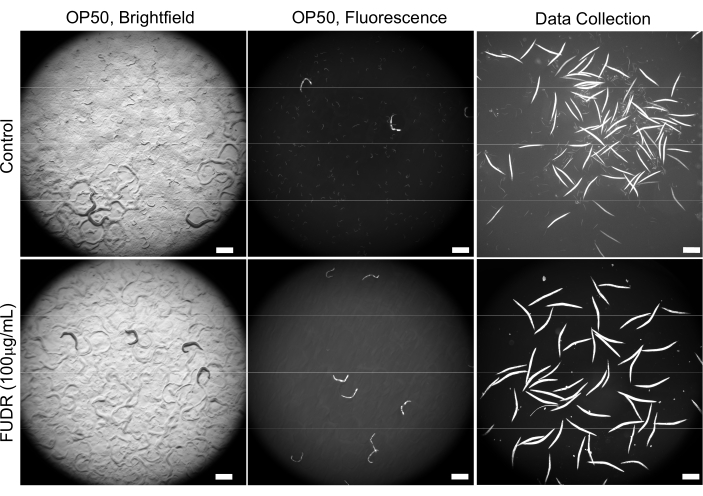
그림 2: FUDR을 사용하면 자손을 줄임으로써 이미지 품질이 향상됩니다. FUDR 보충 플레이트는 대장균 OP50으로 시드된 비 FUDR 대조군 NGM 플레이트에서 자란 웜과 비교하여 C. elegans 자손을 제거합니다. 이미지는 25.2x 배율(0.63x 카메라 어댑터로 40x 배율)으로 획득되었습니다. 배율 막대 = 500μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
배경 형광은 폴리Q 응집체의 위양성 검출에 기여하였다. 장내에서 이러한 형광 신호를 줄이고 응집체의 자동 검출을 개선하려면 이미징 전에 웜을 동결시켜야했습니다. 웜을 -20°C에서 18-48시간 동안 동결시키면 배경 형광을 제거함으로써 polyQ 응집체 검출이 크게 개선되었다(도 3A). 인간의 눈은 응집체와 배경 형광을 구별 할 수 있습니다. 따라서 동결 전후의 수동 계수는 동일합니다 (그림 3B). 그러나 자동 카운팅은 정확하지는 않지만 동결은 수동 카운팅과 비교할 수 있는 정확도로 자동 카운트를 크게 개선했습니다(그림 3B).

그림 3: 동결은 응집체 검출을 개선합니다. (A) 동결 전후에 장내 polyQ44::YFP를 발현하는 C. elegans의 형광 이미지. 삽입은 선택한 영역의 클로즈업 이미지를 나타냅니다. 스케일 바 = 500 μm. (B) 수동 또는 자동화된 (파이프라인) 응집체 정량화를 사용하여 동결 전후에 P. aeruginosa MPAO1로 콜로니화된 웜의 장당 평균 응집체 수. 데이터는 두 개의 생물학적 반복실험(n=60-109)을 나타낸다. 통계적 유의성은 스튜던트 t-검정(**** p < 0.0001)을 사용하여 계산하였다. 오차 막대는 평균(SEM)의 표준 오차를 나타낸다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
반전된 브라이트필드 조명은 전체 C. 엘레간(도 4A) 및 GFP 채널을 검출하여 polyQ44::YFP 응집체를 이미지화하는데 사용되었다(도 4B). 각 웜에 대한 웜 감지, 디엉클링 및 집계 정량화는 최적화된 CellProfiler 이미지 처리 파이프라인(보충 파일 1)을 적용하여 수행되었으며, 이를 통해 개별 웜당 집계 수를 얻을 수 있습니다(그림 4C-D). 이 접근법의 실현 가능성과 자동화 된 집계 검출 및 정량화의 정확성을 테스트하기 위해 장 특이적 polyQ44 : : YFP를 발현하는 웜을 배양하고 확립 된 프로토콜 (섹션 1-7)에 따라 이미징을 준비했습니다. 웜당 집계 수는 자동화된 파이프라인(섹션 8-9) 또는 수동 카운팅을 사용하여 평가되었습니다. 각 실험은 조건 당 90-571 개의 웜을 사용하여 세 번의 독립적 인 시험에서 수행되었습니다. 두 번의 임상시험으로 얻은 장당 평균 응집체 수는 큰 차이가 없었지만, 세 번째 시험의 웜은 자동화된 접근 방식을 사용하여 정량화할 때 응집체가 상당히 적었습니다(그림 5A). 세 번의 임상시험에서 얻은 평균 집계 수는 약간 발생했지만, CellProfiler 파이프라인(섹션 8-9)을 사용하여 정량화를 수행할 때 집계가 상당히 적었습니다(그림 5B). 그럼에도 불구하고 두 접근법의 차이는 미미하여 자동화 된 방법을 대규모 화면에 적용 할 수 있음을 나타냅니다.
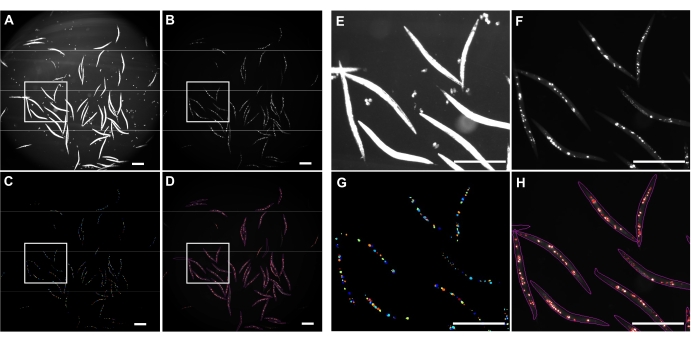
그림 4: CellProfiler를 사용한 집계 탐지. (A) 웜 바디를 식별하는 데 사용되는 브라이트필드 이미지. (B) GFP 채널을 사용하여 획득한 원본 형광 이미지로, 장내 polyQ44::YFP 응집체의 총 수를 확인하고 정량화하는 데 사용됩니다. (C) CellProfiler를 사용하여 식별된 응집체. (D) 원래의 형광 이미지 위에 웜 및 응집체 윤곽선으로 겹쳐진 확인된 응집체의 총 수. 이미지 캡처 및 처리는 섹션 8-9에 설명된 설정을 사용하여 수행되었다. 패널 E-H는 이미지 A-D에서 대응하는 윤곽선 영역의 클로즈업 이미지를 나타낸다. 이미지는 25.2x 배율(0.63x 카메라 어댑터로 40x 배율)으로 획득되었습니다. 배율 막대 = 500μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
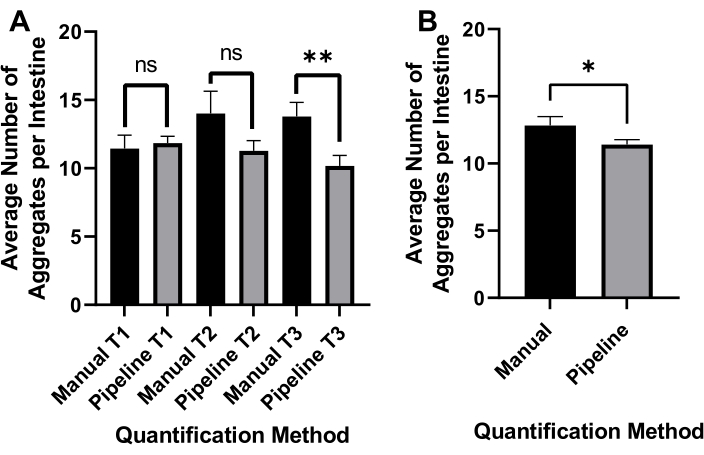
그림 5: 자동화된 골재 정량화의 효능. (A) 수동 계수 (수동) 및 자동화 된 CellProfiler 기반 정량 (파이프 라인)을 사용하여 대조군 대장균 OP50으로 식민지화 된 웜의 장당 평균 집계 수. 결과는 3개의 개별 시험(T1-T3)에서 분석된 데이터를 나타낸다(n=90-571). (B) 장당 평균 응집체 수는 수동 또는 자동화된 (파이프라인) 응집체 정량화를 사용하여 수득되었다. 통계적 유의성은 스튜던트 t-검정을 사용하여 계산하였다 (*p< 0.05, **p< 0.01). 오류 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
서로 다른 실험자들 사이에서 결과의 재현성을 평가하기 위해, 슈도모나스 aeruginosa MPAO1 또는 에스케리치아 콜라 이 OP50을 먹인 웜의 여섯 웰이 들어있는 플레이트의 이미지는 세 명의 개인에 의해 획득되었으며, 그 중 두 명은 이러한 프로토콜을 사용하여 웜을 이미징 한 경험이 없었습니다. 각 우물에서 수집 된 이미지에는 30-115 개의 웜이 감지되었습니다. 응집의 유의하지 않은 차이는 세 명의 실험자가 이미징 한 동일한 우물에서 웜에서 발견되었습니다. 장당 평균 응집체 수는 MPAO1과 OP50을 먹인 웜에 대한 세 명의 실험자 사이에서 매우 일관되게 유지되었지만, 평균 응집체 수에는 통계적으로 유의미한 차이가 있었지만 MPAO1에 의해 식민지화 된 웜에서만 나타났습니다 (보충 그림 2). 이 결과는 경험이없는 실험자 사이에서도 결과의 재현성을 강조합니다.
집계 정량화의 재현성이 웜 위치에 의해 크게 영향을 받지 않도록 하기 위해, 15개의 웜 세트를 선택하고 피펫 팁을 사용하여 각 이미지 캡처 사이에 교반을 한 후 15번 개별적으로 이미징했습니다. 대장균 OP50 및 P. aeruginosa MPAO1을 공급한 웜에서 응집체의 이미지를 수집하고 CellProfiler를 사용하여 분석하였다. 이러한 서로 다른 이미지 세트들 각각으로부터의 평균 집계 수는 약간이지만 유의하게 다르지 않았으며, 이 접근법의 재현성을 더욱 뒷받침한다(보충 그림 3).
그람 음성 장내 병원균을 가진 C. elegans 장의 식민지화는 조직 전반에 걸친 프로테오스타시스를 방해하는 것으로 나타났으며, P. aeruginosa는 polyQ 응집9의 가장 강력한 유도인자 중 하나이다. 이들 최적화된 프로토콜이 P. aeruginosa-매개된 응집 증진을 성공적으로 검출하고 정량화할 것인지 여부를 결정하기 위해, 장내 폴리Q를 발현하는 웜을 대장균 OP50 (대조군 박테리아) 및 P. aeruginosa MPAO1, 섹션 1-8로 콜로니화하였다. 획득된 이미지는 CellProfiler(섹션 9, 보충 파일 1)를 사용하여 분석하였다. 자동화된 정량화의 결과는 P. aeruginosa MPAO1에 의해 유도된 응집체의 수가 상당히 증가한 것을 보여주며, 대조군 대장균 OP50을 공급받은 웜에 비해 지속적으로 두 배 향상된 결과를 가져왔다(도 6).

도 6: 대조군 대장균 OP50 및 P. aeruginosa MPAO1로 콜로니화된 웜의 장당 평균 응집체 수. 장당 응집체의 수는 CellProfiler를 사용하여 평가되었다 (섹션 8-9). 데이터는 OP50 (n = 1068) 및 MPAO1 (n = 1557)로 콜로니화 된 웜에서 장당 평균 응집체 수로 표시됩니다. 통계적 유의성은 스튜던트 t-검정(**** p < 0.0001)을 사용하여 계산하였다. 오류 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
최적화된 파이프라인은 프로테오스타시스에 영향을 미치는 조건에 대한 대규모 스크린을 지원하도록 설계되었습니다. 숙주 프로테오스타시스에 대한 그들의 효과에 대해 박테리아의 대형 라이브러리를 스크리닝하는데 있어서 이러한 접근법의 타당성을 시험하기 위해, 본원에 기재된 파이프라인(섹션 1-9)을 사용하여 폴리Q 응집18에 대한 90P. aeruginosa 비필수 유전자 녹아웃 돌연변이 균주의 효과를 시험하였다. 이 파일럿 스크린은 숙주 프로테오스타시스에 영향을 미치는 그들의 능력에 대해 모든 P. aeruginosa 비필수 돌연변이 균주를 스크리닝하도록 설계된 더 큰 프로젝트의 일부이다. 시험된 90개의 박테리아 균주 중에서, 하나의 후보물질을 사용한 C. elegans 장의 콜로니화는 응집체 수의 현저한 감소를 보였다(도 7). 이 검정의 민감도를 평가하기 위한 후속 실험은 MPAO1 대조군과 유의하게 상이한 여섯 개의 P. aeruginosa 돌연변이체의 무작위 선택으로부터 수동 응집체 카운트를 통해 수행되었다. 이러한 실험은 보다 전통적인 6cm NGM 플레이트를 사용하여 수행되었으며, 이전에 확립된 방법9를 재검토하기 위해 L1과 같이 웜을 시험 균주로 옮겼다. 수동 카운팅에 의한 확인 실험은 응집체의 수를 유의하게 감소시킨 돌연변이체를 포함하여 어느 것도 폴리Q 응집에 영향을 미치지 않는다는 것을 밝혀냈다 (보충 도 4). 또한, 90개의 돌연변이 균주의 스크린에서 관찰된 응집의 미묘한 변화는 선택된 후보물질의 수동 카운트들 사이에서 검출되지 않았으며, 이는 낮은 n값과 같은 생물학적 및 실험적 가변성 때문에 그러한 변화가 발생할 수 있음을 나타낸다. 종합적으로, 결과는 우리의 방법이 중요한 변화를 안정적으로 포착 할 수 있지만, 미묘한 것들은 놓칠 가능성이 높으며, 모든 잠재적 인 후보자는 개별적으로 확인되어야한다는 것을 나타냅니다.
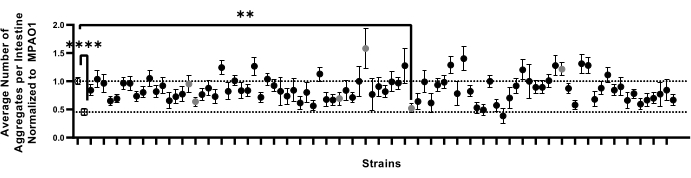
도 7: 92개의 박테리아 균주에 의해 콜로니화된 웜의 대표적인 샘플 세트에서 장당 응집체의 수. 데이터는 MPAO1로 콜로니화된 웜의 집계로 정규화된 장당 평균 응집체 수로 표현된다. 점선은 MPAO1(위쪽, 열린 원) 및 OP50 제어(아래쪽, 열린 사각형)로 콜로니화된 웜의 평균 집계 수를 나타냅니다. 고체 기호는 P. aeruginosa MPAO1의 90개의 뚜렷한 녹아웃 돌연변이 균주를 나타낸다. MPAO1로 콜로니화된 웜과 단일 돌연변이체 사이의 웜당 평균 응집체 수는 통계적으로 유의하였다. 회색 원은 수동으로 확인된 샘플을 나타냅니다(보충 그림 4). 통계적 유의성은 분산의 단방향 분석(ANOVA)에 이어 다중 비교 Dunnett의 사후 검정(**p < 0.01, **** p < 0.0001)을 사용하여 계산하였다. 오류 막대는 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
CellProfiler에서 생성된 많은 양의 데이터를 관리하기 위해 데이터 처리 및 구성을 자동화하기 위해 그래픽 사용자 인터페이스(GUI)가 개발되었습니다(그림 8). GUI는 오픈 소스 파이썬 크로스 플랫폼 위젯 툴킷 인 Tkinter를 사용하여 개발되었습니다. 주어진 메타데이터로부터, 애플리케이션은 플레이트에 존재하는 각 웰(컬럼 J)으로부터 다수의 응집체(컬럼 K)를 추출한다. 앞서 언급 한 프로세스를 수행하기 위해 "Pandas"라는 Python 데이터 처리 라이브러리가 사용되었습니다. GUI 응용 프로그램은 사용자가 데이터 파일을 업로드 할 수 있도록 드래그 앤 드롭 지원을 제공합니다. 각 파일의 데이터는 데이터 프레임이라는 이차원 테이블 형식 구조의 형태로 저장됩니다. 빈 사전 쌍은 데이터 프레임 내에서 발견되는 모든 고유 우물에 대해 초기화됩니다. 다음으로, 각 웰에서 발견되는 별개의 응집체가 계산되어 각각의 사전 쌍에 추가됩니다. 데이터가 적은 열에는 빈 값 문자열이 채워져 각 열의 크기가 균일한지 확인합니다. 마지막으로, 구조는 사용자가 지정한 디렉토리로 스프레드시트 형태로 내보내지는 데이터 프레임으로 변환됩니다.

그림 8: 그래픽 사용자 인터페이스. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: 근육 특이적 polyQ 응집체의 검출. 근육 특이적 polyQ35::YFP를 발현하는 웜을 L1s로서 플레이팅하고 OP50 상에서 48시간 동안 배양하였다. 웜이 젊은 성인으로 발전하면 24웰 NGM 플레이트로 옮겨져 100μg/mL FUDR로 보충되고 이미징 전에 72시간 동안 MPAO1을 추가로 시드했습니다. (A) 웜 바디를 식별하는 데 사용되는 브라이트필드 이미지. (b) GFP 채널을 이용하여 획득한 원본 형광 이미지. (C) CellProfiler를 사용하여 식별된 응집체. (D) 원래의 형광 이미지 위에 웜 및 응집체 윤곽선으로 겹쳐진 확인된 응집체의 총 수. 이미지 캡처 및 처리는 섹션 8-9에 설명된 설정을 사용하여 수행되었다. 패널 E-H는 이미지 A-D에서 대응하는 윤곽선 영역의 클로즈업 이미지를 나타낸다. 배율 막대 = 500 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 2 : 서로 다른 실험자 간의 집계 정량화의 재현성. P. aeruginosa MPAO1 (검은 막대)로 식민지화 된 웜의 여섯 웰과 대조군 대장균 OP50 (회색 막대)으로 식민지화 된 웜의 여섯 웰에 대해 CellProfiler를 사용하여 정량화 된 평균 응집체 수. 각 웰은 세 명의 실험자(AVS, DMC, RDH)에 의해 이미지화되었다. 데이터는 장당 응집체의 평균 수로서 표현된다(n=30-115). 통계적 유의성은 단방향 ANOVA를 사용하여 계산하였고, 이어서 Tukey의 다중 비교 검정 (*p< 0.05, **p<0.01). 오류 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 3: 웜 위치가 집계 정량화의 재현성에 미치는 영향. 대조군 대장균 OP50 (회색 막대) 및 P. aeruginosa MPAO1 (검은 색 막대)로 식민지화 된 웜의 장당 평균 집계 수. 결과는 CellProfiler를 사용하여 정량화된 장당 평균 응집체 수(15≥n≥12)를 나타낸다. 우물 내의 웜의 위치는 각 획득 사이의 동요에 의해 변경되었습니다. 어느 그룹에서도 통계적으로 유의미한 차이는 발견되지 않았다. 통계적 유의성은 단방향 ANOVA를 사용하여 계산하였고, 이어서 Tukey의 다중 비교 검정이 뒤따랐다. 오류 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 4: 수동 계산으로 파일럿 화면 확인. 장당 평균 응집체 수는 수동으로 정량화되었다. 데이터는 야생형 MPAO1 및 OP50 대조군(n=30)과 비교하여 여섯 개의 MPAO1 녹아웃 돌연변이체(회색 원 그림 7)로 콜로니화된 웜의 응집 프로파일을 나타낸다. 통계적 유의성은 단방향 ANOVA를 사용하여 계산하였고, 이어서 다중 비교 Dunnett의 사후 검정(**** p < 0.0001)을 계산하였다. 오류 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 그림 5: 장 폴리Q 응집에 대한 FUDR의 효과. 데이터는 장당 폴리Q44::YFP 응집체의 평균 수로서 표현된다(n=20). 웜을 대장균 OP50 상에서 25°C에서 48시간 성장시킨 후 대조군(FUDR 없음) 또는 FUDR 함유 플레이트(100 μg/mL) 상으로 옮겼다. 수동 카운트는 추가적인 48 h 후에 수집되었다. 통계적 유의성은 스튜던트 t-검정을 사용하여 계산하였다(ns = 유의하지 않음). 오류 막대는 SEM을 나타냅니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 프로테오스타시스 파이프라인. CellProfiler에서 사용할 수 있는 다운로드 가능한 이미지 분석 파이프라인입니다. 신청에 대한 지침은 섹션 9에서 찾을 수 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2 : 웜 풀기 교육 세트. "UntangleWorms" 모듈에 업로드할 파일입니다. 이 특정 훈련 세트는 초기 접근법에 사용 된 웜에만 해당됩니다. 웜의 크기와 모양이 변경되면 식별의 정확성과 품질이 변경됩니다. 보다 개인화된 교육 파일을 만들어야 할 수도 있습니다. 새로운 교육 세트를 만드는 방법은 공식 CellProfiler 웹 사이트17에서 찾을 수 있습니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 3: Windows 운영 체제용 그래픽 사용자 인터페이스. gui_windowsOS_64x.zip. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 4 : Mac 운영 체제를위한 그래픽 사용자 인터페이스. gui_MacOS_64x.zip. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
설명된 프로토콜은 오픈 소스 이미지 분석 소프트웨어인 CellProfiler 를 통합하는 C. elegans 배양, 이미징 및 이미지 처리 절차를 간략하게 설명합니다. 대표적인 결과는 재현성, 편향성 감소 및 확장성을 보여줍니다. 이 표준화 된 절차는 대규모 박테리아, 게놈 또는 약물 라이브러리와 함께 사용되는 스크리닝 전략을 향상시킵니다. 다른 자동화된 C. elegans 개체 감지 방법이 존재하지만, 설명된 기술은 배양, 이미지 획득 및 분석을 통합하는 표준화되고 더 높은 처리량의 파이프라인을 제공합니다.
웜 재배의 몇몇 변형은 본원에 기술된 프로토콜을 최적화하기 위해 시험되어야 했다. 초기에, 웜은 연령 동기화 직후(L1 단계) 즉시 샘플 박테리아로 옮겨졌다. 그러나 이러한 접근법은 동일한 우물 내의 웜들 사이에서도 다양한 크기의 웜 집단을 초래했습니다. C. 엘레간은 병원체 회피19로 알려져 있는데, 이는 관찰된 크기 변동성에 기여하고 궁극적으로 다운스트림 이미징-웜 검출에 영향을 미칠 수 있다. 이러한 가변성을 제거하기 위해, 각 웰의 전체 NGM 영역을 테스트 박테리아로 덮었다. 또한, 웜은 대장균 OP50을 공급하고 25°C에서 48시간 동안 젊은 성인으로 완전히 발달하도록 허용하였다. 웜이 테스트 박테리아로 옮기기 전에 대장균 OP50에서 성인이 될 수 있도록 허용함으로써 신체 크기가 더 일관되게 유지되었습니다. 또한, 자손에 의한 과밀 및 급속한 식량 고갈은 NGM 한천에 FUDR을 보충함으로써 제거되었습니다. FUDR의 구현은 자손을 제거하고 부모 집단과 자손이 섞여서 가려진 자동화 된 웜 식별을 강화했습니다. 그러나 화합물이 C. elegans proteostasis 및 수명20,21에 영향을 미치는 것으로 알려져 있으므로 FUDR을 사용할 때는 신중하고 적절한 대조군을 사용하는 것이 중요합니다. 이 프로토콜에 기술된 조건 하에서, FUDR은 장내 폴리Q 응집에 영향을 미치지 않았다 (보충 도 5); 따라서, 그의 활용은 기술된 방법에 적합하고 유익하였다.
이미징 전에 샘플을 동결하는 것은 파이프 라인의 성공적인 고용에 중요한 단계로 판명되었습니다. 동결 이전의 집계 카운트는 수동 카운트보다 상당히 높았습니다(그림 3B). 이미징 전에 웜을 -20°C에서 18-48시간 동안 유지하면 배경 형광이 감소하고 궁극적으로 응집체 검출이 개선되었습니다(그림 3A). 응집체 검출에 대한 동결의 효과는 polyQ에 대해서만 조사되었으며 그러한 효과에 대한 추가 조사 없이는 다른 모델로 일반화되어서는 안됩니다.
모든 조건이 동일하게 유지되었음에도 불구하고, 웜당 평균 응집체 수는 상이한 실행마다 변할 수 있는 반면, OP50으로 콜로니화된 동물의 응집체 수 대 MPAO1 사이의 비율은 일관되게 유지되는 것으로 관찰되었다(도 6, 보충 그림 2, 보충 그림 5). 따라서, 매 실행마다 대장균 OP50 대조군 또는 임의의 추가적인 적합한 기준 대조군을 항상 포함하는 것이 필수적이다. 실험 사이의 집계 카운트의 이러한 변동성은 환경 조건 (온도, 습도)22,23 또는 유전 적 배경8에 의해 영향을받을 수 있습니다. 실제로, 장기간 배양 후, 장 형광이 급격히 감소하거나 완전히 소실되는 것이 관찰되었고, 이는 냉동 스톡으로부터 새로운 균주를 해동시킬 필요가 있었다. 형광의 관찰된 감소는 polyQ를 발현하는 것과 같은 독성 전이유전자를 억제하는 유전적 변화의 결과일 수 있다. 그럼에도 불구하고, 상이한 실험자들 사이에서(보충 그림 2), 생물학적 반복실험 사이(도 5), 및 동일한 샘플 내(보충 그림 3) 사이에서 관찰된 결과의 예외적인 재현성은 이 접근법의 강도를 강조한다.
수많은 보고들이 프로테오스타시스9,11,12,13,24,25를 연구하기 위해 장내 polyQ를 사용했다. 그러나 실험 접근법과 판독 방법 간의 변동성으로 인해 결과 간의 직접적인 비교는 이루어질 수 없습니다. 그럼에도 불구하고, 이전에 공개된 데이터로부터의 몇몇 결과들은 응집(9,13) 및 대등한 수의 응집체(11)의 박테리아 유도를 포함하는 본원에 기술된 자동화된 정량화에 의해 재요약된다. 총체적으로, 설명 된 파이프 라인은 프로테오스타시스를 연구하는 데 유용한 도구를 제공합니다.
본원에 기재된 방법은 몇 가지 고유한 과제를 갖는다. 예를 들어, 이 프로토콜의 모든 구성 요소를 마스터하는 데 충분한 시간이 필요하며, 이는 특히 프로토콜의 섹션 8에 해당되며, 획득한 이미지가 파이프라인 분석에 적합한지 여부를 결정하기 위해 분석에 익숙해야 합니다. 이 프로토콜에 사용되는 이미지 획득 설정으로부터의 편차가 가능합니다. 그러나 설정 및 웜 학습 집합을 수정해야 할 수 있습니다. 이 파이프라인은 다양한 크기의 집계와 터치하는 집계를 구별할 수 있으므로 집계의 "혼합"을 제한하고 궁극적으로 감지 감도를 높일 수 있습니다. 그러나 허용된 크기 범위를 초과하는 큰 집계를 식별하려고 할 때 상위 크기 임계값을 확장하면 터치하는 집계를 구분할 수 없는 등의 식별 불량으로 인해 오류가 발생할 수 있으므로 문제가 발생할 수 있습니다. 이미지 분석 전에 정확도, 크기 및 강도 간의 균형을 찾아야 합니다. 집계 식별의 효율성은 기계 학습을 통합하여 집계 탐지를 향상시킬 수 있는 신경망을 생성함으로써 더욱 향상될 수 있습니다. 이러한 개선은 현재 탐구되고 있으며 다른 초점면에 놓여 있거나 비정상적인 모양을 가진 응집체의 탐지와 같은 현재 문제를 해결하는 데 크게 도움이 될 것입니다.
설명 된 방법의 한 가지 주목할만한 약점은 자동화 된 집계 수의 변동성인데, 이는 다른 박테리아 균주를 먹인 웜의 수동 카운트에 의해 항상 되풀이되는 것은 아니기 때문입니다. 예를 들어, 자동화된 카운트에 기초하여, P. aeruginosa 돌연변이체 53(M53)을 먹인 웜은 야생형 균주(MPAO1)에 비해 상당히 적은 응집체를 가졌다(도 7); 그러나 히트의 확인은 큰 차이를 보이지 않았다 (보충 그림 4). 일반적으로, 고처리량 약물 스크린은 높은 위양성 히트 검출률을 가지며, 기술된 방법은 예외는 아니다(26). 따라서 모든 잠재적 인 히트를 확인하는 것이 프로토콜의 중요한 부분입니다.
이 프로토콜은 숙주 프로테오스타시스에 영향을 미치는 박테리아를 확인하기 위한 스크리닝 전략에 맞게 최적화되었지만, 각 단계는 게놈 RNAi 라이브러리, 소분자 또는 다른 조건의 효과를 시험하기 위해 추가로 변형될 수 있다. 특정 스크리닝 전략의 요건에 맞게 각 단계에서 추가적인 수정이 이루어질 수 있다. 또한이 기술은 특정 모델에 맞게 각 단계를 최적화 할 수있는 수준의 유연성을 제공합니다. 예를 들어, 이러한 접근법은 다른 조직에서의 폴리Q 응집으로 확장되거나 유도성 형광 리포터(예를 들어, 열 충격 유전자)를 사용하여 유전자 발현을 모니터링하거나, 단백질의 세포내 국소화를 평가하고(예를 들어, DAF-16의 핵 국소화), 다른 질병 모델에서의 응집을 연구(Aβ1-42, α-synuclein, TDP-43 등) 또는 생리학적 표현형을 평가하는 것과 같은 이미지에서 검출된 다른 특징들을 추출할 수 있고, 웜 크기와 같은.
공개
저자들은 이해 상충이 존재하지 않는다고 선언했다.
감사의 말
이 연구는 국립 보건원 (1RO3AG069056-01)과 DMC에 대한 미국 전염병 학회 기금에 의해 지원되었습니다. 기금 제공자는 연구 설계, 데이터 수집 및 분석, 출판 결정 또는 원고 준비에 아무런 역할을하지 못했습니다. 원고를 교정해 주신 Czyz Lab 회원들에게 감사드립니다. 만화 수치는 BioRender 유료 라이센스를 사용하여 생성되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| 1.7 mL Microtubes | Olympus Plastics | Cat#24-282 | Microcentrifuge tubes |
| 10 mL Serological Pipettes | GenClone | Cat#12-104 | Plastic pipettes |
| 15 mL Centrifuge Tubes, Racked | Olympus Plastics | Cat#28-101 | Conical tubes |
| 5-Fluoro-2′-deoxyuridine | Fisher Scientific | D2235100MG | FUDR |
| Accu-jet Pro Pipette Controller | Genesee Scientific | 91-600RB | Pipette gun |
| Agar | Fisher Scientific | Cat#BP1423-2 | Granulated agar |
| BioRender | BioRender | Graphical figure generator | |
| Bleach (Regular) | Clorox | Bar# 044600324111, Splash-less Bleach | 4.5% sodium hypochlorite |
| C. elegans: AM140: rmIs132 [unc-54p::q35::yfp] | Morimoto Lab (Northwestern University) | AM140, Q35::YFP | Muscle polyQ |
| C. elegans: AM738: rmIs297[vha-6p::q44::yfp; rol-6(su1006)] | Morimoto Lab (Northwestern University) | AM738, Q44::YFP | Intestinal polyQ |
| CaCl2·2H2O | Fisher Scientific | Cat#C79-500 | Calcium chloride dihydrate |
| CellProfiler | Broad Institute | Image analysis software | |
| Cholesterol | Fisher Scientific | Cat#ICN10138201 | Cholesterol |
| Circulating Water Bath Head | Lauda | 26LE | Lauda E 100 |
| CoolLED pE300lite 365 dir mount STEREO | CoolLED | 8114931 | Fluorescent light control and emitter |
| 16 mL Culture Tubes | Olympus Plastics | 21-129 | Culture tubes, 17 mm x 100 mm |
| Escherichia coli OP50 | Caenorhabditis Genetics Center | OP50 | E. coli control strain |
| Ethanol, 200 Proof | Decon Labs, Inc. | 2701 | |
| Eyepiece 10x/23B, adjustable, 3d gen | Leica Microsystems | 10450910 | Eyepiece set |
| Filter Set ET GFP - MZ10F | Leica Microsystems | 10450588 | Filter cube |
| GraphPad Prism v9.2.0 | GraphPad Software, Inc. | Statistical analysis tool | |
| Heratherm Incubator IMP180 | Thermo | 51031562 | Refrigerated incubator |
| Innova 4000 | New Brunswick Scientific | M1192-0000 | Shaking incubator |
| K5 Camera | Leica Microsystems | 11547112 | Stereomicroscope camera |
| KH2P04 | Fisher Scientific | Cat#P285-3 | Potassium phosphate monobasic |
| LAS X Imaging Software | Leica Microsystems | Microscope imaging software | |
| Leica MZ10 F Optics Carrier | Leica Microsystems | 10450103 | Stereomicroscope |
| Levamisole | Fisher Scientific | Cat#0215522805 | Levamisole hydrochloride |
| Luria Broth (Lennox) | Apex Bioresearch Products | Cat#11-125 | LB |
| Magnetic Stir Plate | Fisher Scientific | 11-100-49S | Stir plate |
| MgSO4·7H2O | Alfa Aesar | A14491 | Magnesium sulfate heptahydrate |
| Microscope Slides | Premiere | 8205 | Single frosted microscope slides |
| Na2HPO4·7H2O | Fisher Scientific | Cat#S373-500 | Sodium phosphate dibasic heptahydrate |
| NaCl | Fisher Scientific | Cat#S671-500 | Sodium chloride |
| NaOH | Fisher Scientific | Cat#S318-3 | Sodium hydroxide pellets |
| Objective Achromat, f = 100 mm | Leica Microsystems | 10411597 | Objective microscope lens |
| Petri Dishes | Genesee Scientific | Cat#32-107G | 100 mm x 15 mm |
| Pseudomonas aeruginosa Mutant Library | Manoil Lab (University of Washington) | P. aeruginosa mutant library | |
| Suspension Culture Plate 24-Well, Flat Bottom | Olympus Plastics | 25-102 | Used for worm growth and imaging |
| Trinocular Tube 100% M-series | Leica Microsystems | 10450043 | |
| Trypticase Peptone | ThermoFisher, Difco | Cat#211921 | |
| TX-400 Rotor | Thermo Scientific | Cat#75003181 | Swing bucket rotor |
| Vacuum Driven Filter System | GenClone | Cat#25-227 | 500 mL, PES Membrane, .22 µm |
| Video Objective with C-Mount | Leica Microsystems | 10447367 | 0.63x camera adapter tube |
참고문헌
- Soto, C. Unfolding the role of protein misfolding in neurodegenerative diseases. Nature Reviews Neuroscience. 4 (1), 49-60 (2003).
- Fang, P., Kazmi, S. A., Jameson, K. G., Hsiao, E. Y. The microbiome as a modifier of neurodegenerative disease risk. Cell Host & Microbe. 28 (2), 201-222 (2020).
- Kundu, P., Blacher, E., Elinav, E., Pettersson, S. Our gut microbiome: The evolving inner self. Cell. 171 (7), 1481-1493 (2017).
- Sherwin, E., Dinan, T. G., Cryan, J. F. Recent developments in understanding the role of the gut microbiota in brain health and disease. Annals of the New York Academy of Sciences. 1420 (1), 5-25 (2018).
- Mondal, S., et al. Large-scale microfluidics providing high-resolution and high-throughput screening of Caenorhabditis elegans poly-glutamine aggregation model. Nature Communications. 7 (1), 13023 (2016).
- Guisbert, E., Czyz, D. M., Richter, K., McMullen, P. D., Morimoto, R. I. Identification of a tissue-selective heat shock response regulatory network. PLoS Genetics. 9 (4), 1003466 (2013).
- Silva, M. C., et al. A genetic screening strategy identifies novel regulators of the proteostasis network. PLoS Genetics. 7 (12), 1002438 (2011).
- Nollen, E. A., et al. Genome-wide RNA interference screen identifies previously undescribed regulators of polyglutamine aggregation. Proceedings of the National Academy of Sciences of the United States of America. 101 (17), 6403-6408 (2004).
- Walker, A. C., et al. Colonization of the Caenorhabditis elegans gut with human enteric bacterial pathogens leads to proteostasis disruption that is rescued by butyrate. PLOS Pathogens. 17 (5), 1009510 (2021).
- Goya, M. E., et al. Probiotic Bacillus subtilis protects against α-Synuclein aggregation in C. elegans. Cell Reports. 30 (2), 367-380 (2020).
- Kumsta, C., Chang, J. T., Schmalz, J., Hansen, M. Hormetic heat stress and HSF-1 induce autophagy to improve survival and proteostasis in C. elegans. Nature Communications. 8, 14337 (2017).
- Prahlad, V., Morimoto, R. I. Neuronal circuitry regulates the response of Caenorhabditis elegans to misfolded proteins. Proceedings of the National Academy of Sciences of the United States of America. 108, 14204-14209 (2011).
- Mohri-Shiomi, A., Garsin, D. A. Insulin signaling and the heat shock response modulate protein homeostasis in the Caenorhabditis elegans intestine during infection. Journal of Biological Chemistry. 283 (1), 194-201 (2008).
- Hakim, A., et al. WorMachine: machine learning-based phenotypic analysis tool for worms. BMC Biology. 16 (1), 8 (2018).
- Wählby, C., et al. An image analysis toolbox for high-throughput C. elegans assays. Nature Methods. 9 (7), 714-716 (2012).
- Jones, T. R., et al. CellProfiler Analyst: data exploration and analysis software for complex image-based screens. BMC Bioinformatics. 9 (1), 482 (2008).
- Held, K., Ramage, E., Jacobs, M., Gallagher, L., Manoil, C. Sequence-verified two-allele transposon mutant library for Pseudomona aeruginosa PA01. Journal of Bacteriology. 194 (23), 6387-6389 (2012).
- Schulenburg, H., Ewbank, J. J. The genetics of pathogen avoidance in Caenorhabditis elegans. Molecular Microbiology. 66 (3), 563-570 (2007).
- Feldman, N., Kosolapov, L., Ben-Zvi, A. Fluorodeoxyuridine improves Caenorhabditis elegans proteostasis independent of reproduction onset. PLoS One. 9 (1), 85964 (2014).
- Van Raamsdonk, J. M., Hekimi, S. FUdR causes a twofold increase in the lifespan of the mitochondrial mutant gas-1. Mechanisms of Ageing and Development. 132 (10), 519-521 (2011).
- Haldimann, P., Muriset, M., Vígh, L., Goloubinoff, P. The novel hydroxylamine derivative ng-094 suppresses polyglutamine protein toxicity in Caenorhabditis elegans. Journal of Biological Chemistry. 286 (21), 18784-18794 (2011).
- Shinn-Thomas, J. H. Wrapping culture plates with Parafilm M® increases Caenorhabditis elegans growth. BMC Research Notes. 12 (1), (2019).
- Alexander-Floyd, J., et al. Unexpected cell type-dependent effects of autophagy on polyglutamine aggregation revealed by natural genetic variation in C. elegans. BMC Biology. 18 (1), 18 (2020).
- Moronetti Mazzeo, L. E., Dersh, D., Boccitto, M., Kalb, R. G., Lamitina, T. Stress and aging induce distinct polyQ protein aggregation states. Proceedings of the National Academy of Sciences of the United States of America. 109 (26), 10587-10592 (2012).
- Sink, R., Gobec, S., Pecar, S., Zega, A. False positives in the early stages of drug discovery. Current Medicinal Chemistry. 17 (34), 4231-4255 (2010).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유