Interazione acido-base di Lewis in Ph3P-BH3
Panoramica
Fonte: Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
Uno degli obiettivi della chimica è quello di utilizzare modelli che tengano conto delle tendenze e forniscano approfondimenti sulle proprietà dei reagenti che contribuiscono alla reattività. Le sostanze sono state classificate come acidi e basi fin dai tempi degli antichi greci, ma la definizione di acidi e basi è stata modificata e ampliata nel corso degli anni. 1
Gli antichi greci caratterizzavano le sostanze in base al gusto e definivano gli acidi come quelli che avevano un sapore aspro, come il succo di limone e l'aceto. Il termine "acido" deriva dal termine latino per "sapore aspro". Le basi erano caratterizzate dalla loro capacità di contrastare o neutralizzare gli acidi. Le prime basi caratterizzate erano quelle delle ceneri di un fuoco, che venivano mescolate con i grassi per fare il sapone. In effetti, il termine "alcalino" deriva dalla parola araba per "arrostire". Infatti, è noto fin dall'antichità che acidi e basi possono essere combinati per dare un sale e acqua.
La prima descrizione ampiamente utilizzata di un acido è quella del chimico svedese Svante Arrhenius, che nel 1894 definì gli acidi come sostanze che si dissociano in acqua per dare ioni idronio, e basi come sostanze che si dissociano in acqua per dare ioni idrossido. Questa definizione è quindi limitata agli acidi acquosi e richiede che un acido contribuisca a un protone. 2 Ad esempio, in acqua, HCl è un acido, in quanto si dissocia per dare lo ione idronio (H3O)+ e lo ione cloruro. Il tricloruro di boro non sarebbe considerato un acido, poiché nell'acqua idrolizza per dare B(OH)3 e 3 HCl; il prodotto HCl però è un acido di Arrhenius.
Nel 1923, Johannes Nicolaus Brønsted e Martin Lowry definirono indipendentemente gli acidi e le basi sulla loro capacità di donare e accettare ioni idrogeno, o protoni. Così venne il concetto di coppie coniugate acido-base e l'espansione della definizione di acidi e basi in solventi diversi dall'acqua. Ad esempio, l'ammonio è un acido, in quanto può donare un protone e generare ammoniaca. L'ammoniaca può accettare un protone, per dare ammonio. Pertanto, l'ammoniaca è la base coniugata dell'ammonio. Questa reazione acido-base può verificarsi in acqua, ammoniaca o altri solventi.
Questo video tratta della definizione acido-base del chimico americano Gilbert N. Lewis, che definì anche acidi e basi nel 1923. In effetti, questo è lo stesso Lewis delle strutture a punti di Lewis in Chimica Generale. Il suo approccio si concentra non sulla capacità degli acidi e delle basi di donare e accettare protoni, ma piuttosto sulla loro capacità di accettare e donare coppie di elettroni, rispettivamente. Questo comprende la definizione di Brønsted-Lowry, poiché H+ accetta una coppia di elettroni da una base di Brønsted durante la protonazione. Tuttavia, espande notevolmente la definizione di acido, ora comprendendo ioni metallici e composti del gruppo principale. Qui, confrontiamo la NMR 31P dell'addotto acido-base di Lewis Ph3P-BH3 con la trifenilfosfina libera.
Principi
Considera il legame tra trifenilfosfina e borano. Considereremo prima come appaiono entrambe le molecole prima di formare un addotto di Lewis.
Ricordiamo le strutture a punti di Lewis e la teoria della repulsione a coppie di elettroni a guscio di valenza (VSEPR), dalla chimica generale. La struttura a punti di Lewis della trifenilfosfina è mostrata nella Figura 1. Ci sono tre legami covalenti tra l'atomo di fosforo e uno degli atomi di carbonio in ciascuno dei tre anelli fenilici. Due elettroni (una coppia solitaria) risiedono sull'atomo di fosforo per completare l'ottetto. Il centro del fosforo è ibridato sp3 e ha una geometria elettronica tetraedrica, con la coppia solitaria di elettroni che risiede in un orbitale sp3. La trifenilfosfina ha una coppia solitaria che può essere donata ad un'altra molecola ed è quindi classificata come base di Lewis.
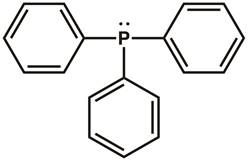
Figura 1. Struttura a punti di Lewis della trifenilfosfina.
La struttura a punti di Lewis del borano è mostrata nella Figura 2. Ci sono tre legami covalenti tra l'atomo di boro e gli atomi di idrogeno. In questo caso, il centro del boro ha solo sei elettroni di valenza e quindi non segue laregola 8 e-. Il borano è quindi planare e sp2 ibridato, con gli orbitali sp2 che formano legami con gli atomi di idrogeno e l'orbitale p solitario vuoto. Il borano è quindi un acido di Lewis.

Figura 2. Struttura a punti di Lewis di borano.
Poiché il fosforo nella trifenilfosfina ha un orbitale riempito e il boro del borano ha un orbitale vuoto, può formarsi un addotto acido-base di Lewis, con la trifenilfosfina che dona i suoi due elettroni al boro. Alla formazione dell'addotto, il centro del boro diventa ibridato sp3 (Equazione 1).
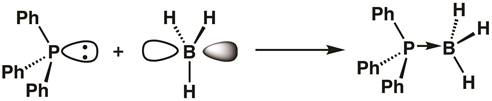 (1)
(1)
L'equazione 1 dimostra l'idea dell'acidità di Lewis, con gli acidi di Lewis che accettano coppie solitarie di elettroni e le basi di Lewis che donano coppie di elettroni. A volte, gli acidi di Lewis sono indicati come elettrofili e le basi di Lewis come nucleofili. I legami tra gli acidi e le basi di Lewis sono spesso chiamati legami covalenti o dativi coordinati e talvolta sono designati con frecce anziché linee.
Procedura
1. Impostazione della linea Schlenk per la sintesi del complesso borano trifenilfosfina
NOTA: Per una procedura più dettagliata, consultare il video "Schlenk Lines Transfer of Solvent" nella serie Essentials of Organic Chemistry). La sicurezza della linea Schlenk deve essere rivista prima di condurre questo esperimento. I bicchieri devono essere ispezionati per le crepe delle stelle prima dell'uso. Prestare attenzione per assicurarsi che O2 non sia condensato nella trappola della linea di Schlenk se si utilizza N2liquido . A temperatura N2 liquida, O2 condensa ed è esplosivo in presenza di solventi organici. Se si sospetta che O2 sia stato condensato o che si osservi un liquido blu nella trappola fredda, lasciare la trappola fredda sotto vuoto dinamico. NON rimuovere latrappola N 2 liquida o spegnere la pompa pervuoto. Nel tempo, il liquido O2 evaporerà nella pompa; sarà sicuro rimuovere latrappola N 2 liquida solo una volta che tutto l'O2 è evaporato.
- Chiudere la valvola di rilascio della pressione.
- Accendere il gas N2 e la pompa per vuoto.
- Quando il vuoto della linea Schlenk raggiunge la sua pressione minima, preparare la trappola fredda con N2 liquido o ghiaccio secco/acetone.
- Assemblare la trappola fredda.
2. Sintesi del Borano Trifenilfosfina Complesso3
- Aggiungere 5,3 g (20,3 mmol) di trifenilfosfina in un matraccio Schlenk A da 250 ml e preparare il matraccio Schlenk per il trasferimento del solvente in cannula.
- Aggiungere 20 ml di THF secco/degassato al pallone Schlenk A tramite trasferimento di cannula. Mescolare la soluzione per sciogliere la trifenilfosfina.
- Preparare un secondo matraccio Schlenk (B) contenente 1,15 g (30,5 mmol) naBH4 per il trasferimento della cannula.
- Raffreddare sia il pallone Schlenk A che il B in un bagno di ghiaccio.
- La cannula trasferisce il contenuto del pallone Schlenk A nel pallone Schlenk B.
- Con pressione positiva N2, sostituire il setto di gomma sul pallone Schlenk B con un imbuto aggiuntivo dotato di setto di gomma.
- All'imbuto di aggiunta, aggiungere 8 ml di THF secco/degassato mediante trasferimento di cannula.
- Con la pressione positiva di N2, rimuovere il setto dalla parte superiore dell'imbuto di caduta e aggiungere 2 ml di acido acetico glaciale all'imbuto di addizione.
- Tenendo il pallone Schlenk B in un bagno di ghiaccio, aggiungere il THF / acido acetico glaciale a goccia per oltre 30 minuti. Durante l'aggiunta, potrebbe verificarsi schiuma. Assicurarsi che la reazione si stia muovendo vigorosamente per ridurre al minimo questo.
- Dopo l'aggiunta, lasciare che la reazione si riscaldi a temperatura ambiente e mescolare per un'ora aggiuntiva.
- Rimuovere l'imbuto che cade e aggiungere lentamente 20 ml di acqua.
- Preparare una soluzione di 2 mL di acido acetico glaciale in 25 ml di acqua. Aggiungere lentamente questa miscela alla reazione.
- Se i cristalli non si formano spontaneamente, raffreddare la reazione in un bagno di ghiaccio per promuovere la cristallizzazione.
- Filtrare il prodotto per aspirazione attraverso un imbuto fritto. Lavare il solido risultante con 20 ml di acqua 3 volte.
- Lasciare asciugare il prodotto nel cappuccio prima di preparare il campione per l'analisi NMR.
3. 31P NMR Analisi del complesso borano trifenilfosfina
- Preparare un campione NMR di trifenilfosfina e borano trifenilfosfina complesso in CDCl3.
- Raccogliere una NMR di 31P di ciascun campione (con riferimento all'acido fosforico) e osservare come il segnale fosforoso della trifenilfosfina si sposta dopo la coordinazione con il borano.
Risultati
Complesso di trifenilfosfina di borano:
31 anni P NMR (cloroformio-d, 500 MHz, δ, ppm): 20.7 (doppietto largo)
Trifenilfosfina:
31 anni P NMR (cloroformio-d, 500 MHz, δ, ppm): -5,43
Il segnale NMR 31P del complesso borano trifenilfosfina è a valle rispetto alla trifenilfosfina libera. Ciò è coerente con la rimozione della densità elettronica dal centro del fosforo, che viene descuotato alla formazione dell'addotto.
Applicazione e Riepilogo
Il complesso di trifenilfosfina borano è un esempio di addotto di Lewis, per cui una base di Lewis dona elettroni a un acido di Lewis. Sebbene BH3 e PPh3 non siano necessariamente considerati un acido e una base, rispettivamente, utilizzando altre teorie acido-base, la teoria acido-base di Lewis prevede correttamente che le molecole formino un addotto stabile.
Attivazione di piccole molecole:
Mentre gli ioni dei metalli di transizione sono stati storicamente considerati acidi di Lewis, l'idea che possano servire come basi di Lewis è in fase di avanzata. Ad esempio, Jonas Peters e colleghi del Caltech hanno dimostrato che i complessi metallo-borano, che possono donare elettroni al borano acido di Lewis (un ligando di tipo Z), possono dare origine a una nuova reattività. Una specie di borano di nichel ha dimostrato di aggiungere reversibilmente H2, scindendo eteroliticamente il legame H-H. 4 La specie H2aggiunta è un catalizzatore per l'idrogenazione delle olefine. Il gruppo ha anche riferito che i complessi ferro-borano possono ridurre cataliticamente l'azoto in ammoniaca. 5 Questo è stato il primo esempio di catalizzatore omogeneo a base di ferro per questa reazione impegnativa ma critica.
Coppie lewis frustrate:
Un'altra area di ricerca attuale è quella delle "Coppie di Lewis frustrate" o FLP. Si tratta di "addotti" acido-base di Lewis che, per motivi sterici, non possono formare un legame dativo. 6 Douglas Stephan e colleghi dell'Università di Toronto hanno riflettuto sulla reattività di tali addotti, in particolare con l'idea di usarli per l'attivazione e la catalisi di piccole molecole. Pensando ai complessi di metalli di transizione, che possono sia accettare che donare densità di elettroni da e verso i substrati, hanno ipotizzato le proprietà di donatore / accettore di ciò che hanno definito "coppie di Lewis frustrate" potrebbero avere per quanto riguarda la reattività.
Nel 2006, Stephan e colleghi hanno riferito in Science che lo zwitterionico (C6H2Me3)2PH (C6F4) BH (C6F5)2 perde reversibilmente H2 per dare (C6H2Me3)2P (C6F4) B (C6F5)2. 7 Questo è stato il primo esempio di attivazione reversibile di H2 con elementi del gruppo principale, e altri esempi sono seguiti (Figura 3). Questo studio ha spianato la strada allo sviluppo della ricerca FLP. Da allora, sono stati sviluppati FLP che sono catalizzatori di idrogenazione competenti e possono attivare una varietà di piccole molecole tra cui CO2. Questa è una nuova area di ricerca attiva ed eccitante.
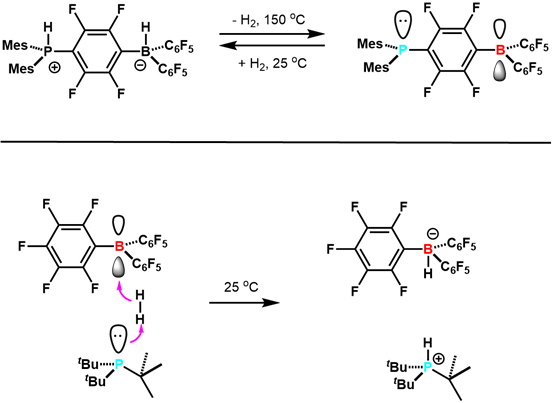
Figura 3. Primi esempi di reattività di FLP con H2. Adattato dal riferimento 5.
Riferimenti
- Lesney, Today's Chemist at Work, 2003, 47-48.
- Miessler, P. J. Fischer and D. A. Tarr, Inorganic Chemistry, Pearson, 2014.
- McNulty, J.; Zhou, Y. Tetrahedron Letters, 2004, 45, 407-409.
- Harman and J. C. Peters, J. Am. Chem. Soc., 2012, 134, 5080-5082.
- Anderson, J. Rittle and J. C. Peters, Nature, 2013, 501, 84-87.
- Stephan, J. Am. Chem. Soc., 2015, 137, 10018-10032.
- Welch, R. R. S. Juan, J. D. Masuda and D. W. Stephan, Science, 2006, 314, 1124-1126.
Tags
Vai a...
Video da questa raccolta:

Now Playing
Interazione acido-base di Lewis in Ph3P-BH3
Inorganic Chemistry
38.7K Visualizzazioni

Sintesi di un Ti(III) metallocene utilizzando la tecnica della linea Schlenk
Inorganic Chemistry
31.5K Visualizzazioni

Scatola a guanti (Glove Box) e sensori di impurezze
Inorganic Chemistry
18.6K Visualizzazioni

Purificazione del ferrocene per sublimazione
Inorganic Chemistry
54.3K Visualizzazioni

Il metodo di Evans
Inorganic Chemistry
68.0K Visualizzazioni

Diffrazione a raggi X su cristallo singolo e su polveri
Inorganic Chemistry
104.0K Visualizzazioni

Spettroscopia di risonanza paramagnetica elettronica (EPR)
Inorganic Chemistry
25.4K Visualizzazioni

Spettroscopia Mössbauer
Inorganic Chemistry
21.9K Visualizzazioni

Struttura del ferrocene
Inorganic Chemistry
79.1K Visualizzazioni

Applicazione della teoria dei gruppi nella spettroscopia infrarossa
Inorganic Chemistry
45.0K Visualizzazioni

Teoria degli orbitali molecolari
Inorganic Chemistry
35.1K Visualizzazioni

Paddlewheel a quadruplo legame metallo-metallo
Inorganic Chemistry
15.3K Visualizzazioni

Celle di Grätzel (Dye-sensitized Solar Cells)
Inorganic Chemistry
15.7K Visualizzazioni

Sintesi di un complesso di cobalto (II) legato ad ossigeno
Inorganic Chemistry
51.5K Visualizzazioni

Inizio fotochimico di una reazione di polimerizzazione radicalica
Inorganic Chemistry
16.7K Visualizzazioni