Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Panoramica
Fonte: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unità di Linfopoiesi, Dipartimento di Immunologia, Istituto Pasteur, Parigi, Francia
2 INSERM U1223, Parigi, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Parigi, Francia
4 Platfrom, Citometria a flusso e biomarcatori UtechS, Center for Translational Science, Pasteur Institute, Parigi, Francia
Il trasferimento di cellule adottive è un metodo per introdurre cellule in un paziente o in un organismo di studio al fine di trattare una malattia o studiare un processo biologico, come l'ematopoiesi. Gli obiettivi del trasferimento adottivo sono vari; può essere utilizzato in biologia fondamentale e nelle scienze mediche (1, 2). Nei modelli murini, la migrazione e la distribuzione delle cellule trasferite possono essere studiate e seguite da un sistema di tracciamento (marcatore della superficie cellulare, colorazione mediante CFSE, ecc.). Negli studi sul cancro su modelli murini, il trasferimento di specifiche popolazioni cellulari può essere utilizzato come trattamento sperimentale contro i tumori. Un altro esempio di questa tecnica è la creazione di topi chimerici mediante trasferimento di cellule del midollo osseo a topi irradiati o topi con un fenotipo di immunodeficienza grave. Questo modello murino può essere utilizzato per valutare l'impatto della delezione genica su una specifica popolazione cellulare, ad esempio. Il trasferimento di cellule di prestito osseo è anche usato nel trattamento medico umano. Quando i pazienti vengono irradiati in caso di terapia antitumorale, il trasferimento adottivo del midollo osseo consente la ricostituzione del sistema immunitario.
Il primo passo in questa tecnica è quello di ottenere la popolazione cellulare di interesse. La tecnica scelta per isolare questa popolazione dipende dal livello di specificità della popolazione target. Il più grande livello di selezione è l'intero organo, in cui vengono prese tutte le popolazioni cellulari presenti nell'organo. Un metodo più preciso è la selezione di una popolazione cellulare target, spesso selezionata da un marcatore di superficie cellulare. Il metodo ideale per ordinare le celle in questo caso è lo smistamento magnetico. Infine, il livello più rigoroso è la selezione delle cellule da parte di diversi marcatori di superficie cellulare per ordinare popolazioni cellulari molto specifiche. Lo smistamento della citometria a flusso è il metodo più popolare per questo livello di selezione. Una volta ottenuta la popolazione di interesse, può essere trasferita all'host. Prima del trasferimento adottivo è essenziale garantire la compatibilità tra ospite e donatore. Infatti, indipendentemente dall'obiettivo di trasferimento, la compatibilità è fondamentale per garantire l'adozione delle cellule da parte dell'ospite senza il rigetto delle cellule.
In questo esercizio di laboratorio, dimostriamo la tecnica di trasferimento cellulare adottivo trasferendo gli splenociti da un topo CD45.2 in un topo Ragγc CD45.1 (privo di linfociti) e quattro giorni dopo confermiamo il trasferimento degli splenociti usando la citometria a flusso (vedi Figura 1).
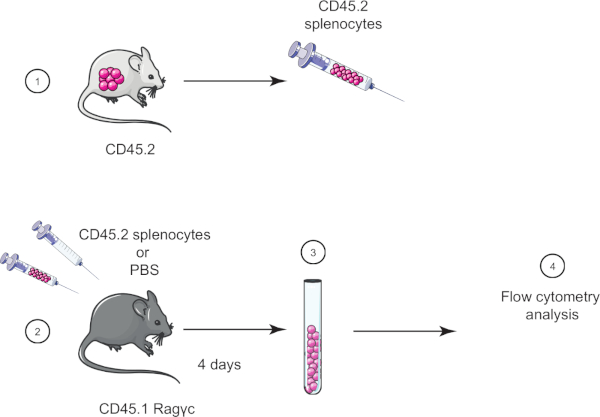
Figura 1: Rappresentazione schematica del trasferimento adottivo. (1) Gli splenociti sono isolati dai topi CD45.2 e (2) trasferiti nel topo CD45.1 Ragγc, il mouse di controllo viene iniettato solo con PBS. (3) 4 giorni dopo il trasferimento adottivo, gli splenociti vengono recuperati dai topi e (4) analizzati mediante citometria a flusso. Fare clic qui per visualizzare una versione più grande di questa figura.
Procedura
1. Preparazione
- Prima di iniziare, indossare guanti da laboratorio e gli indumenti protettivi appropriati.
- Sterilizzare tutti gli strumenti di dissezione, prima con un detergente e poi con etanolo al 70% e poi asciugare accuratamente.
- Preparare 50 ml di soluzione salina bilanciata di Hank (HBSS) contenente il 2% di siero fetale per vitelli (FCS).
2. Dissezione
- Utilizzando un sistema di rilascio di anidride carbonic
Risultati
I topi Ragγc hanno una composizione alterata del sistema immunitario, principalmente privi di linfociti. Il trasferimento adottivo di splenociti consente l'introduzione di popolazioni carenti come le cellule T e B. La nostra colorazione includeva marcatori di superficie cellulare CD45.1 e CD45.2 per distinguere rispettivamente le cellule ospiti e donatrici (Figura 2A). Ha anche incluso altri marcatori della superficie cellulare per evidenzia.
Applicazione e Riepilogo
Il trasferimento adottivo è una tecnica traslazionale in diversi campi della scienza, con applicazioni in medicina. Questa tecnica può essere utilizzata per studiare la migrazione cellulare e il tropismo o l'incidenza della carenza proteica in specifiche popolazioni cellulari. In quest'ultimo caso, possono essere utilizzate diverse tecnologie, in particolare topi OGM in cui specifiche popolazioni cellulari sono intrinsecamente carenti. Tuttavia, la costruzione genetica per ottenere topi OGM può essere un processo molt...
Riferimenti
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).
Vai a...
Video da questa raccolta:

Now Playing
Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.3K Visualizzazioni

Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
92.9K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.9K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
238.3K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.5K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
78.9K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.5K Visualizzazioni

Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.8K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.2K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.7K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.2K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni