Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Panoramica
Fonte: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unità di Linfopoiesi, Dipartimento di Immunologia, Istituto Pasteur, Parigi, Francia
2 INSERM U1223, Parigi, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Parigi, Francia
4 Platfrom, Citometria a flusso e biomarcatori UtechS, Center for Translational Science, Pasteur Institute, Parigi, Francia
La funzione generale del sistema immunitario è quella di difendere il corpo da organismi infettivi e altri invasori. I globuli bianchi, o leucociti, sono i giocatori chiave del sistema immunitario. Al momento dell'infezione, vengono attivati e iniziano una risposta immunitaria. I leucociti possono essere suddivisi in varie sotto-popolazioni (ad esempio, cellule mieloidi, linfociti, cellule dendritiche) in base a diversi parametri che possono essere biologici, fisici e / o funzionali (ad esempio, dimensioni, granularità e secrezione). Un modo per caratterizzare i leucociti è attraverso le loro proteine di superficie, che sono principalmente recettori. Ogni popolazione di leucociti esprime una specifica combinazione di recettori (ad esempio, recettori citotossici, attivanti, di migrazione) che possono definire sottoinsiemi tra le popolazioni. Poiché il sistema immunitario comprende una vasta gamma di popolazioni cellulari, è essenziale caratterizzarle per decifrare la loro partecipazione alla risposta immunitaria.
La citometria a flusso (FC o FCM) è un metodo ampiamente utilizzato per analizzare l'espressione della superficie cellulare e delle molecole intracellulari, caratterizzando e definendo diversi tipi di cellule in una miscela cellulare eterogenea. I citometri a flusso sono composti da tre sottosistemi principali: fluidica, ottica ed elettronica. Il sistema fluidico trasporta le cellule in un flusso tale che passano davanti a un laser una per una. Il sistema ottico è costituito da sorgenti luminose (laser) per illuminare le particelle, filtri ottici per dirigere la luce risultante e segnali fluorescenti verso rilevatori appropriati. Infine, il sistema elettronico converte i segnali luminosi rilevati in segnali elettronici che possono essere elaborati dal computer. Quando una singola cellula passa davanti al raggio laser, disperde la luce. Un rilevatore davanti al fascio misura la diffusione in avanti (FS) e diversi rilevatori per misurare lateralmente la diffusione laterale (SC). La FS è correlata alla dimensione delle cellule e sc è proporzionale alla granularità delle cellule. In questo modo, le popolazioni cellulari possono spesso essere distinte in base alle differenze nelle loro dimensioni e granularità da sole.
Oltre ad analizzare le dimensioni, la forma e la complessità di una cellula, la citometria a flusso è ampiamente utilizzata per rilevare l'espressione dei recettori di superficie cellulare (1). Ciò si ottiene utilizzando anticorpi monoclonali marcati con fluorocromo che si legano a recettori cellulari specifici noti. Dopo l'eccitazione, questi fluorocromi legati emettono una luce di lunghezza d'onda specifica, chiamata lunghezza d'onda di emissione, che può essere rilevata e valutata. Le misurazioni di fluorescenza forniscono dati quantitativi e qualitativi sui recettori di superficie cellulare etichettati con fluorocromo. Gli ematologi sono stati i primi a utilizzare FC per il follow-up terapeutico delle popolazioni di cellule immunitarie (2). Ora, viene utilizzato per una vasta gamma di applicazioni come l'immunofenotipizzazione, la vitalità cellulare, l'espressione genica, il conteggio cellulare e l'analisi GFP.
FACS (Fluorescent Activated Cell Sorter) è un tipo specializzato di citometria a flusso, che ordina una popolazione di cellule in sottopopolazione utilizzando l'etichettatura fluorescente. Proprio come la citometria a flusso convenzionale, vengono raccolti i primi dati FS, SC e fluorescenti. Quindi, la macchina applica una carica (negativa o positiva) e un sistema di deflessione elettrostatica (elettromagneti) facilita la raccolta di goccioline cariche contenenti celle in tubi appropriati.
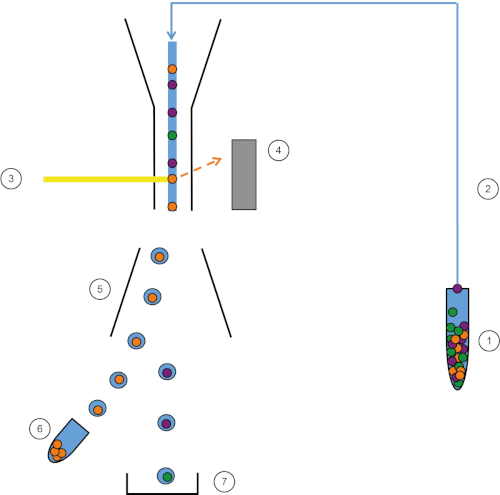
Figura 1: Rappresentazione schematica di FACS. Il campione (1) viene aspirato nel FACS (2) e passato davanti al laser (3). La fluorescenza cellulare viene percepita dai rivelatori a fluorescenza (4). Infine, le cellule sono incorporate in goccioline e le cellule di interesse vengono deviate da piastre di deflessione (5) e raccolte in un tubo di raccolta (6). Le celle rimanenti vanno nel cestino (7). Fare clic qui per visualizzare una versione più grande di questa figura.
L'aspetto dello smistamento del FACS presenta molti vantaggi. Molti test possono aiutare a capire il ruolo di cellule specifiche nel sistema immunitario, come le analisi dell'espressione genica come RT-qPCR, ciclo cellulare o secrezione di citochine. Tuttavia, le cellule dovrebbero essere purificate a monte per ottenere risultati chiari e specifici. Qui, FACS è utile e le cellule desiderate possono essere ordinate con grande purezza, ottenendo risultati altamente affidabili e riproducibili. FACS può anche essere utilizzato per ordinare le cellule in base alla colorazione nucleare o ad altre colorazioni intracellulari e in base alla presenza, all'assenza e alla densità dei recettori di superficie. FACS è ora una tecnica standard per la purificazione di sottopopolazioni di cellule e ha la capacità di ordinare fino a quattro popolazioni contemporaneamente.
Questo esercizio di laboratorio dimostra come isolare i leucociti splenici e quindi come ordinare specificamente le cellule linfoidi B dalla miscela di cellule leucocitarie spleniche usando FACS.
Procedura
1. Preparazione
- Prima di iniziare, indossare guanti da laboratorio e gli indumenti protettivi appropriati.
- Sterilizzare tutti gli strumenti di dissezione, prima con un detergente e poi con etanolo al 70% e poi asciugare accuratamente.
- Preparare 50 ml di soluzione salina bilanciata di Hank (HBSS) contenente il 2% di siero fetale di vitello (FCS).
2. Dissezione
- Utilizzando un sistema di rilascio di anidride carbonica
Risultati
In questo protocollo, abbiamo purificato i linfociti B splenici utilizzando la tecnologia FACS. Per prima cosa abbiamo isolato i leucociti dalla milza e li abbiamo macchiati. Utilizzando una combinazione di marcatori di superficie delle celle B, abbiamo creato una strategia di gating per ordinarli (Figura 2, pannello superiore). Alla fine dell'esperimento abbiamo verificato se le cellule nella provetta di raccolta erano cellule B tramite un "test di purezza". Abbiamo mantenuto la stessa s
Applicazione e Riepilogo
La citometria a flusso è una tecnica di prima mano per caratterizzare e ordinare le popolazioni di cellule immunitarie con un alto grado di purezza. È uno strumento primordiale in campo di ricerca in quanto consente l'arricchimento di specifiche popolazioni cellulari e di decifrare la risposta immunitaria ai patogeni. Con l'aumento del numero di fluorocromi e citometri disponibili, il numero di parametri rilevabili è notevolmente aumentato. Di conseguenza, l'analisi bioinformatica dei dati FACS ha iniziato ad emergere...
Riferimenti
- Lanier, L. L. Just the FACS. The Journal of Immunology, 193 (5), 2043-2044 (2014).
- Walker, J. M. Epiblast Stem Cells IN Series Editor.
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks. D. R., Herzenberg, L. A., and Herzenberg. L. A. Modern Flow Cytometry: A Practical Approach. Clinics in Laboratory Medicine. 27 (3), 453-468 (2007).
- Walker, J. M. Tumor Angiogenesis Assays IN Series Editor.
Vai a...
Video da questa raccolta:

Now Playing
Citometria a flusso e selezione cellulare attivata dalla fluorescenza (FACS): isolamento dei linfociti B della milza
Immunology
93.0K Visualizzazioni

Magnetic Activated Cell Sorting (MACS): isolamento dei linfociti T timici
Immunology
22.9K Visualizzazioni

Saggi ELISA: indiretti, sandwich e competitivi
Immunology
238.7K Visualizzazioni

EliSPOT Assay: Rilevamento di splenociti secernenti IFN-γ
Immunology
28.5K Visualizzazioni

Immunoistochimica e immunocitochimica: imaging dei tessuti tramite microscopia ottica
Immunology
79.0K Visualizzazioni

Generazione di anticorpi: produzione di anticorpi monoclonali attraverso l'utilizzo di ibridomi
Immunology
43.6K Visualizzazioni

Microscopia a immunofluorescenza: colorazione a immunofluorescenza di sezioni di tessuto incorporato in paraffina
Immunology
53.9K Visualizzazioni

Microscopia a fluorescenza confocale: una tecnica per determinare la localizzazione delle proteine nei fibroblasti di topo
Immunology
43.2K Visualizzazioni

Tecniche basate sull'immuno-precipitazione: purificazione di proteine endogene con l'impiego di microsfere di agarosio
Immunology
87.8K Visualizzazioni

Analisi del ciclo cellulare: valutazione della proliferazione delle cellule T CD8 e CD4 in seguito a stimolazione tramite colorazione CFSE e citometria a flusso
Immunology
24.3K Visualizzazioni

Trasferimento di cellule adottive: introduzione degli splenociti di topo donatore a un topo ospite e valutazione del successo tramite FACS
Immunology
22.5K Visualizzazioni

Saggio per la morte cellulare: saggio di rilascio di cromo della capacità citotossica
Immunology
151.4K Visualizzazioni