16.6 : 滴定計算:強酸-強塩基
滴定溶液のpH計算: 強酸および強塩基
0.100 MのHCl(強酸)25.00 mLを0.100 MのNaOH(強塩基)で滴定する場合を考えます。加えた塩基性溶液の量が異なるときのpHは、以下のように計算できます。
(a) 滴定液の容量=0 mLの場合。この溶液のpHは、HClの電離により決定されます。HClは強酸なので全て電離し、ヒドロニウムイオンのモル数は0.100 Mとなります。溶液のpHは、

(b) 滴定液量 = 12.50 mLの場合。酸および塩基はともに1価かつ等濃度であるため、この滴定溶液の添加に伴う塩基の量は化学量論的な量よりも少なく、溶液中の過剰な酸との反応で完全に消費されます。残った酸の濃度は、最初の量から消費された量を差し引き、溶液の体積で割って算出します。
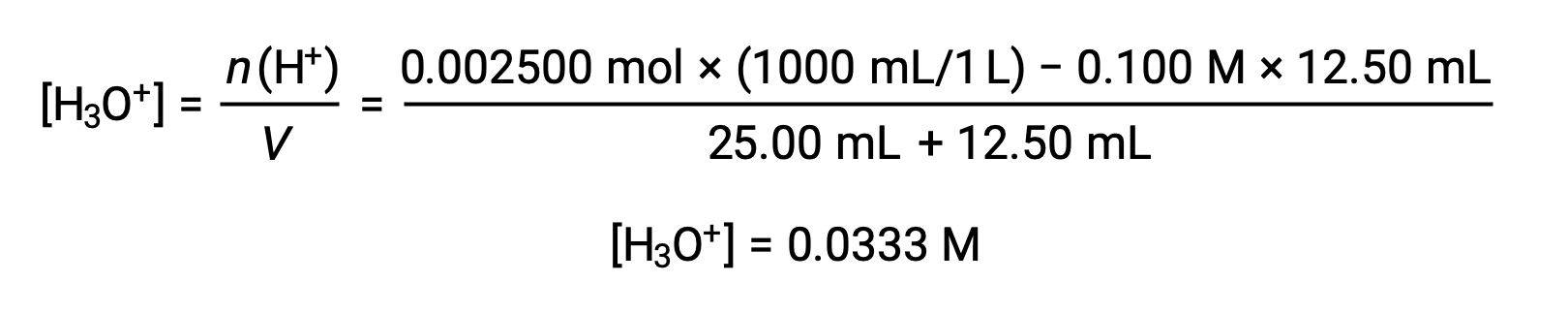
(c) 滴定液量 = 25.00 mLの場合。この量の滴定溶液には化学量論的な塩基量が含まれているため(等量点)、中和反応の生成物のみが溶液中に存在します(水とNaCl)。この塩の陽イオンも陰イオンも加水分解を起こさず、ヒドロニウムイオンを生成する唯一のプロセスは水の電離です。溶液は中性で、pH=7.00です。
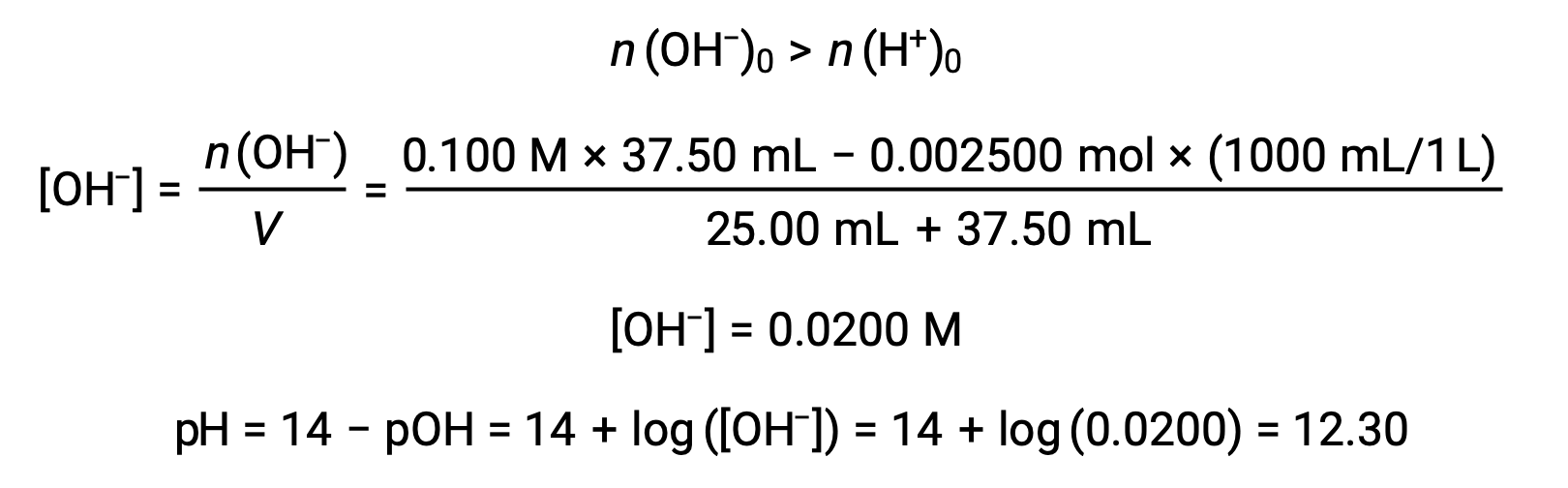
(d) 滴定液量 = 37.50 mLの場合。これは、滴定溶液が当量点を超えて添加されていることを意味します。溶液のpHは水酸化物イオンの濃度から算出できます。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.7: Acid-base Titrations.
章から 16:

Now Playing
16.6 : 滴定計算:強酸-強塩基
酸塩基と溶解度平衡
28.9K 閲覧数

16.1 : 共通イオン効果
酸塩基と溶解度平衡
40.8K 閲覧数

16.2 : 緩衝液
酸塩基と溶解度平衡
163.2K 閲覧数

16.3 : ヘンダーソン-ハッセルバルヒ式
酸塩基と溶解度平衡
67.9K 閲覧数

16.4 : 緩衝液中のpHの変化の計算
酸塩基と溶解度平衡
52.5K 閲覧数

16.5 : 緩衝液の有効性
酸塩基と溶解度平衡
48.3K 閲覧数

16.7 : 滴定計算:弱酸-弱塩基
酸塩基と溶解度平衡
43.7K 閲覧数

16.8 : 指示薬
酸塩基と溶解度平衡
47.7K 閲覧数

16.9 : 多価酸の滴定
酸塩基と溶解度平衡
95.6K 閲覧数

16.10 : 溶解平衡
酸塩基と溶解度平衡
51.8K 閲覧数

16.11 : 溶解性に影響する因子
酸塩基と溶解度平衡
32.9K 閲覧数

16.12 : 錯体イオンの形成
酸塩基と溶解度平衡
23.1K 閲覧数

16.13 : イオンの沈殿
酸塩基と溶解度平衡
27.4K 閲覧数

16.14 : 定性分析
酸塩基と溶解度平衡
20.0K 閲覧数

16.15 : 酸塩基滴定曲線
酸塩基と溶解度平衡
126.1K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved