16.6 : 적정 계산: 강산 - 강염기
적정 용 용 pH 계산 : 강한 산 / 강한 기지
적층은 0.100 M HCl(강한 산)의 25.00 mL에 대해 0.100 M의 강한 염기 NaOH를 수행한다. 추가된 기본 솔루션의 다양한 볼륨에서 pH는 다음과 같이 계산할 수 있습니다.
(a) 적대물 = 0mL. 용액 pH는 HCl의 산 이온화 때문입니다. 이것은 강한 산이기 때문에, 이온화가 완료되고 하이드로늄 이온 어모함은 0.100 M이다. 솔루션의 pH는 다음과 같습니다.

(b) 적대물 = 12.50 mL. 산 시료와 베이스 티란트는 단보틱하고 동등하게 농축되기 때문에, 이 적정 첨가는 염기의 배양 이하를 수반하므로 시료내의 과잉 산과의 반응에 의해 완전히 소모된다. 남은 산의 농도는 초기 양에서 소비된 양을 빼고 용액 부피로 나누어 계산됩니다.
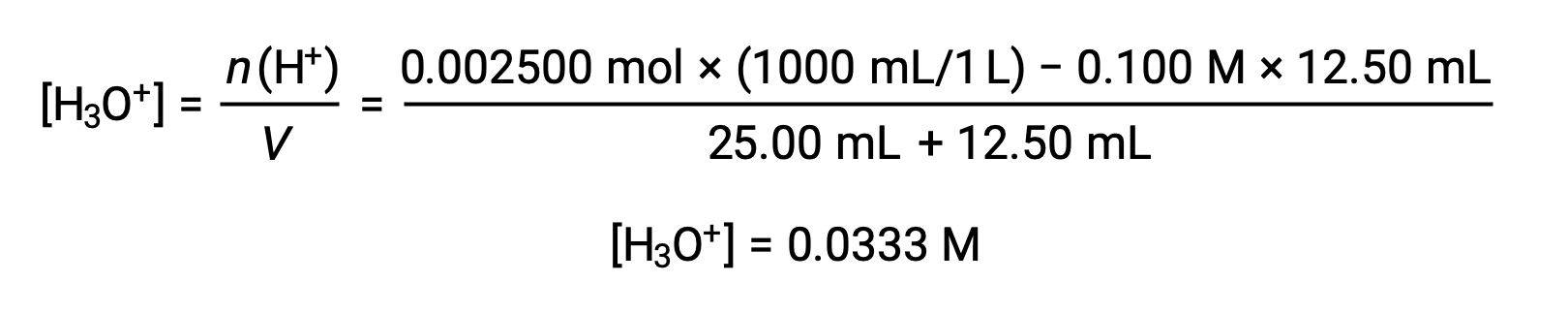
(c) 적대물 = 25.00 mL. 이러한 적신은 방사능 적정량의 염기(등가점)를수반하므로 중화 반응의 제품만이 용액(물과 NaCl)에 있다. 이 염의 양이온이나 애니온은 산염 이온화를 거치지 않습니다. 하이드로늄 이온을 생성하는 유일한 공정은 물의 자동 발화입니다. 솔루션은 pH = 7.00을 갖는 중립입니다.
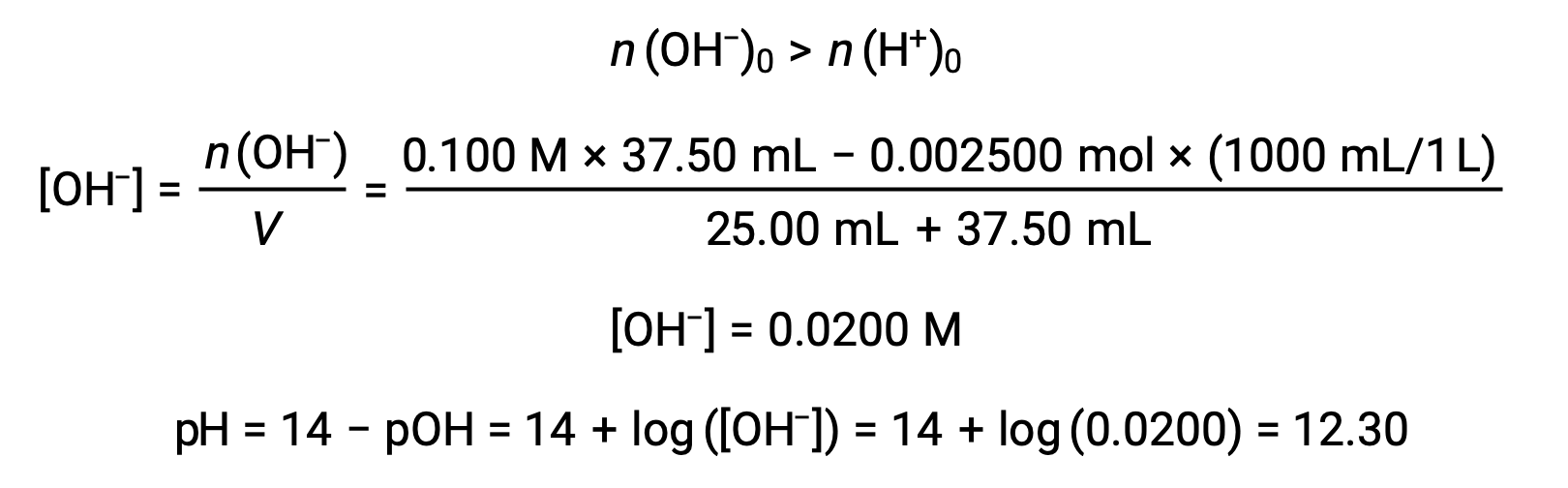
(d) 적대물 = 37.50 mL. 이것은 등가 점을 초과하는 적성의 추가를 관련시킵니다. 그런 다음 용액 pH는 수산화 이온의 농도를 사용하여 계산됩니다.
장에서 16:

Now Playing
16.6 : 적정 계산: 강산 - 강염기
산-염기와 용해평형
28.9K Views

16.1 : 공통이온효과
산-염기와 용해평형
40.8K Views

16.2 : 완충용액
산-염기와 용해평형
163.2K Views

16.3 : 핸더슨-하셀바흐 식
산-염기와 용해평형
67.9K Views

16.4 : 완충용액 내 pH 변화 계산
산-염기와 용해평형
52.5K Views

16.5 : 완충용액 효과성
산-염기와 용해평형
48.3K Views

16.7 : 적정 계산: 약산 - 약염기
산-염기와 용해평형
43.7K Views

16.8 : 지시약
산-염기와 용해평형
47.7K Views

16.9 : 다양성자 산의 적정
산-염기와 용해평형
95.6K Views

16.10 : 용해평형
산-염기와 용해평형
51.8K Views

16.11 : 용해도에 영향을 미치는 요인
산-염기와 용해평형
32.9K Views

16.12 : 착이온의 형성
산-염기와 용해평형
23.1K Views

16.13 : 이온의 침전
산-염기와 용해평형
27.4K Views

16.14 : 정성분석
산-염기와 용해평형
20.0K Views

16.15 : 산-염기 적정곡선
산-염기와 용해평형
126.1K Views
Copyright © 2025 MyJoVE Corporation. 판권 소유