16.6 : Расчеты титрования: сильная кислота - сильное основание
Расчет pH для титрационной растворов: Сильная кислота/сильная основание
Титрование выполняется для 25.00 мл 0.100 M HCl (сильная кислота) с 0.100 M сильного основание NaOH. PH в различных объемах добавленного основание раствор может быть рассчитан следующим образом:
(A) объем титранта = 0 мл. PH раствор обусловлен ионизацией HCl кислотой. Поскольку это сильная кислота, ионизация завершена, а молярность ионов гидрония составляет 0.100 M. pH раствор является следующим:

(b) объем титранта = 12.50 мл. Так как кислотный образец и титрант основание являются как монопротическими, так и одинаково концентрированными, это титрантное добавление включает в себя меньше, чем стехиометрическое количество основание, и поэтому оно полностью потребляется реакцией с избыточной кислотой в пробе. Концентрация оставшейся кислоты вычисляется путем вычитания потребленной суммы из первоначальной суммы и деления на объем раствор:
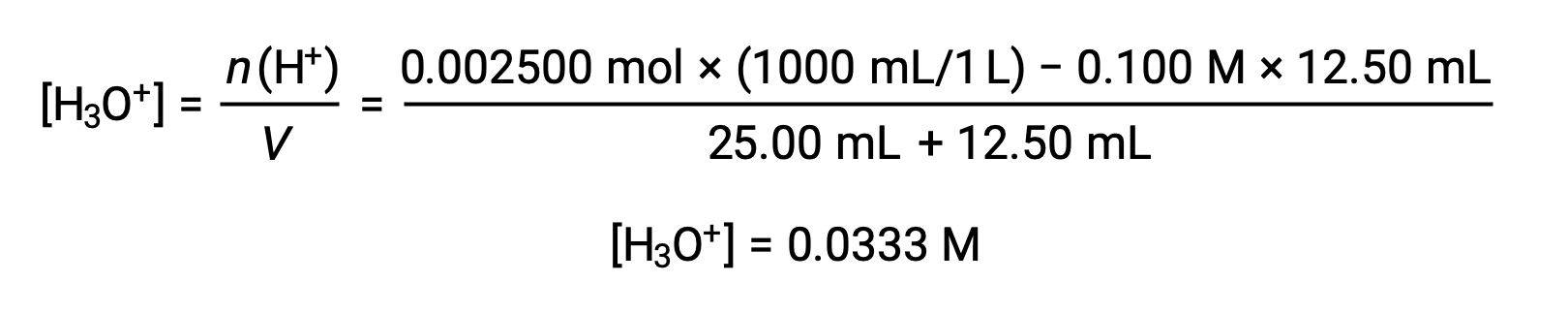
(c) объем титранта = 25.00 мл. Это титрантное добавление включает стехиометрическое количество основание (точка эквивалентности), и поэтому только продукты реакции нейтрализации находятся в раствор (вода и NaCl). Ни катион, ни анион этой соли не подвергаются ионизации кислотно-основная; единственным процессом, генерирующим ионы гидрония, является аутопротеолиз воды. раствор находится в нейтральном положении, с pH = 7.00.
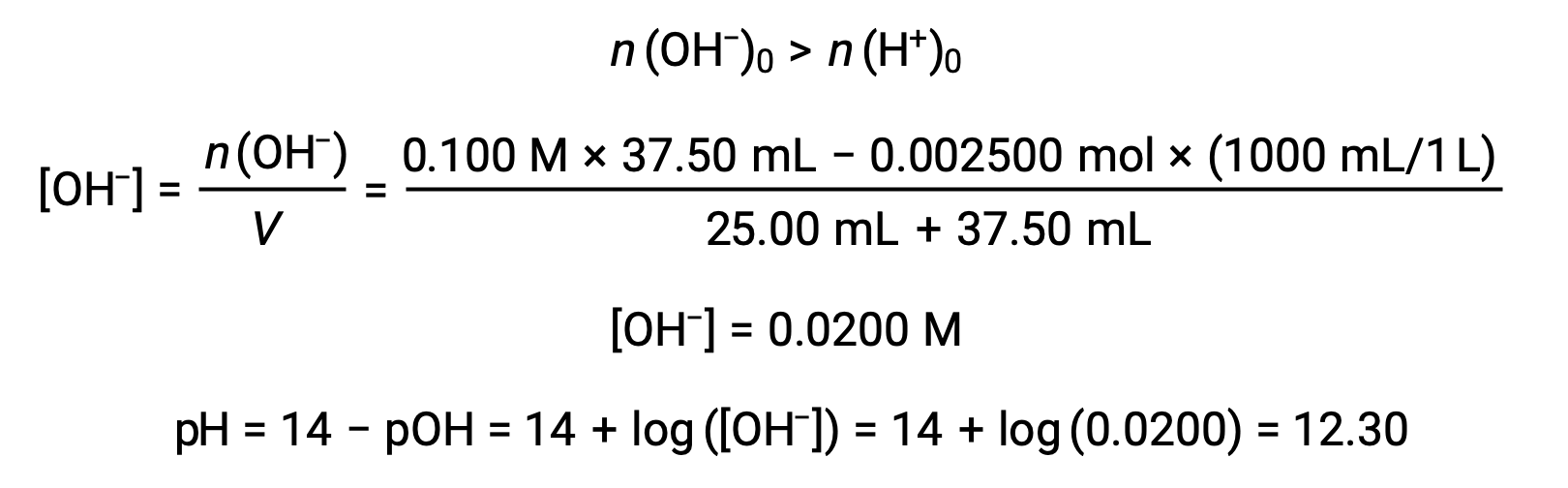
(d) объем титранта = 37.50 мл. Это предполагает добавление титранта, превышающего точку эквивалентности. Затем pH раствор рассчитывается с использованием концентрации ионов гидроксида:
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.7: Титраки кислотно-основная.
Из главы 16:

Now Playing
16.6 : Расчеты титрования: сильная кислота - сильное основание
Кислотно-основное равновесие и равновесие растворимости
28.9K Просмотры

16.1 : Общий ионный эффект
Кислотно-основное равновесие и равновесие растворимости
40.8K Просмотры

16.2 : Буферы
Кислотно-основное равновесие и равновесие растворимости
163.2K Просмотры

16.3 : Уравнение Хендерсона-Хассельбаха
Кислотно-основное равновесие и равновесие растворимости
67.9K Просмотры

16.4 : Расчет изменений pH в буферном растворе
Кислотно-основное равновесие и равновесие растворимости
52.5K Просмотры

16.5 : Эффективность буфера
Кислотно-основное равновесие и равновесие растворимости
48.3K Просмотры

16.7 : Расчеты титрования: слабая кислота - слабое основание
Кислотно-основное равновесие и равновесие растворимости
43.7K Просмотры

16.8 : Индикаторы
Кислотно-основное равновесие и равновесие растворимости
47.7K Просмотры

16.9 : Титрование полипротонной кислоты
Кислотно-основное равновесие и равновесие растворимости
95.6K Просмотры

16.10 : Равновесия растворимости
Кислотно-основное равновесие и равновесие растворимости
51.8K Просмотры

16.11 : Факторы, влияющие на растворимость
Кислотно-основное равновесие и равновесие растворимости
32.9K Просмотры

16.12 : Образование сложных ионов.
Кислотно-основное равновесие и равновесие растворимости
23.1K Просмотры

16.13 : Осаждение ионов
Кислотно-основное равновесие и равновесие растворимости
27.4K Просмотры

16.14 : Качественный анализ
Кислотно-основное равновесие и равновесие растворимости
20.0K Просмотры

16.15 : Кривые кислотно-основного титрования
Кислотно-основное равновесие и равновесие растворимости
126.1K Просмотры
Авторские права © 2025 MyJoVE Corporation. Все права защищены