Method Article
エンジニアリング細胞透過性のタンパク質
要約
タンパク質導入は、細胞に生物学的に活性なタンパク質の直接配信を可能にします。このようなDNAトランスフェクションまたはウイルス形質導入などの従来の方法とは対照的に、この非侵襲的なパラダイムは、細胞毒性および永久的な遺伝子修飾による発癌性形質転換のリスクを回避滴定可能な方法で高効率な細胞の操作が可能になります。
要約
タンパク質導入法は、哺乳動物細胞への生物学的活性物質の直接配信が可能になります[レビューのために1,2を参照してください]。この1つは、いわゆる細胞透過性ペプチド(CPPの)の転位能力を利用することができるため、また、タンパク質導入ドメイン(PTDs)として指定。ヒト免疫不全ウイルス1型(HIV - 1)タット(転写のトランス活性化因子)タンパク質は、広く使用されているから派生したTAT - CPP。正に帯電したTATは、それによってエンドサイトーシスまたは/およびダイレクト膜貫通2で細胞膜の障壁を克服する細胞透過性を促進する。核局在化シグナルとの組み合わせで(NLS)の融合タンパク質は核展示機能を入力することができます。私たちのビデオプレゼンテーションは、細胞透過性タンパク質のエンジニアリング、建設、生産とDNA修飾酵素Creの細胞透過性のバージョンのアプリケーションのための例示として、示しています。
CREは、in vitroおよびin vivoでの哺乳類細胞には34塩基対のloxP部位を認識し、再結合することができる部位特異的リコンビナーゼである。そのためのCre / loxP部位システムが広く、条件付きで生きている細胞3,4のゲノムに突然変異を誘発するために使用されます。細胞へのアクティブなCreリコンビナーゼの配信は、しかし、制限を表します。
我々は、目的遺伝子の直接挿入を可能にし、急速に便利と標準化された方法でベクトル内で使用される別のドメインとタグのクローンを作成するためのプラットフォームを提供するpSESAMEベクターシステムを、説明します。別のタグの再配置は、より高い収率と良好な溶解性を達成する可能性を提供する融合タンパク質の生化学的特性を変更することが示されている。我々は、で、大腸菌から組換え細胞透過性のタンパク質を発現し、精製する方法を示しています。組換えのCreタンパク質の機能は、最終的にその細胞内リコンビナーゼの活性を評価することにより、細胞培養で検証されます。
プロトコル
発現ベクターおよび発現の建設:
pSESAME - Creを発現ベクターは、標準的なクローニング方法を使用してAvrIIおよびNheI制限部位を介してpSESAMEにCreをコードする断片を挿入することにより構築した。 pSESAMEはヒスチジン - タグ、TAT -ドメイン、NLS配列とCre、略称HTNCreで構成される融合タンパク質をコードしている。 HTNCreの発現のためpSESAME - CreをはTUNER(DE3)pLacIに変換してグリセロールストックを調製した。
- 一晩培養物は、グリセロールストックから形質転換した細菌をコーティングしたピペットチップを用いて接種した。オーバーナイト培養液は、濃度50μg/ mlの最終濃度で0.5%のグルコース[V / V]とカルベニシリンを補充したLB培地で構成され、37で成長させた℃で16時間C。
- 次の日密栽培オーバーナイト培養液を1〜40の割合で発現培養を接種したと37℃のインキュベーターに入れ、発現培養は100μg/ mlの最終濃度で0.5%のグルコース[V / V]とアンピシリンを添加したTBメディアから成っていた。
- 1.5のOD 595で発現培養を1時間では0.5 mMのIPTGで誘導した
- その後、細菌はSLA3000ローターで10分間5000rpmで遠心分離によって回収した。
- バクテリアペレットは-20℃で精製されるまで保存されていました。
細胞透過性のタンパク質の精製:
- 冷凍細菌ペレットを室温で15分間リットルのフラスコの培養液あたり10mLの溶解バッファーに再懸濁した。
- 室温で混合しながら次いで、この懸濁液をさらに15分間に1 mg / mLのリゾチームとインキュベートした。
- 25 U / mLのベンゾナーゼはその後加え、室温で15分間混合しながらインキュベートした。
- 混合し、氷上で5分間インキュベートしながら電力の45%で0.5秒のパルスで1.5分、1 mLの冷酒石酸塩緩衝液(TSB)氷上で超音波処理した後1mLあたり懸濁液を注意深く加えた。ライセート分画(L)のSDS - PAGEのサンプルを採取した。
- 清澄化ライセート℃で30分間30,000 gで4℃で遠心分離によって得られた水溶性(S)と不溶性画分(I)のSDS - PAGEのサンプルを採取した。
- 上清を新しい50mlファルコンチューブに移し、4℃で1時間の初期発現培養リットル当たり50%のNi - NTAのスラリーを2mLとCのためにして穏やかに混合したれました。
- 懸濁液を重力流EconoPacのカラムに充填(フロースルーフラクション(FT)のSDS - PAGEのサンプルが取られた)と洗浄バッファーの5ベッドボリュームで2回洗浄した。両方の洗浄画分(W1&W2)のSDS - PAGEのサンプルを採取した。
- HTNCre含有画分をSDS - PAGE解析のための溶出画分の溶出緩衝液と試料(E)の3ベッドボリュームで溶出された取られた。
- イミダゾール二回高塩緩衝液に対して溶出画分を透析により除去した。
- タンパク質溶液は、さらに2回グリセロール緩衝液に対して透析により濃縮した。すべての透析の手順でサンプルへのバッファの比率は少なくとも50あった。この手順は、200および450μMの間で通常の濃度でHTNCreを含むグリセロールストック溶液をもたらした、すなわち発現培養1リットルは、タンパク質の約12ミリグラムになります。 SDS - PAGE解析のためのグリセロールストック(GS)のサンプルを採取した。 HTNCreストック溶液は、マイナス20℃で保存することができます
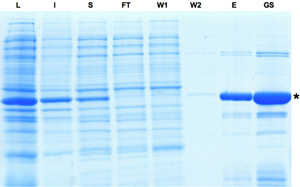
図1:Creリコンビナーゼの精製の 過程で収集されたサンプルのSDS - PAGE分析。 Creリコンビナーゼの発現誘導は、ライセート画分における支配的なバンドで示されます。タンパク質の一部が不溶性であるが溶出液とグリセロールストックの分画に見られるようにCREのタンパク質をさらに充実させることができます。 L:ライセート、I:不溶性、S:上清を、FT:フロースルー、W:洗浄、E:溶出液、GS:Gylcerolストック。してくださいここをクリックして図1の拡大バージョンを参照すること。
マウス胚性幹(ES)細胞へのタンパク質導入:
- 条件付きのβ-ガラクトシダーゼレポーター5コンストラクトを運ぶES細胞は接着細胞の解離のためTrypLE™Expressを使用して、単一の細胞として播種した。 4〜6時間後に細胞を再装着していたと培地を除去した。
- その後、ES細胞は、16時間HTNCre含有培地でインキュベートした。
- グリセロールストックからHTNCre蛋白質の適切な量(10μMに相当)は、ES培地と続いて無菌ろ過(0.22μmの)中に希釈した。
- タンパク質導入後の培地は、通常の増殖培地に戻って変更されました。
- 二日間の細胞をPBSで洗浄し、10分間4%パラホルムアルデヒド(PFA)で固定した後。
- さらに2X - gal染色を行う前にPBSでtional洗浄ステップが実行されました。
- 固定された細胞は、X - gal染色液6の層で覆い、37℃で一晩インキュベートした。
代表的な結果:
翌日、X - gal染色液を熱望し、細胞を顕微鏡分析のためのPBSの層で覆われていた。組換え細胞の80〜100%がβ-ガラクトシダーゼ活性が判断したマウスES細胞内で観察することができた。
ディスカッション
Creを融合タンパク質の精製プロセス中にそれは遠心分離の前に氷冷TBS緩衝液の添加を省略することが重要です。そうしないとCreリコンビナーゼは、グリセロールのバッファ内に沈殿する傾向がある。
溶出画分は、融合タンパク質、追加の溶出緩衝液の高濃度に起因する混濁になるために表示されている場合は解決策が再びクリアされるまで追加する必要があります。
Creを融合タンパク質の10μMのアプリケーションは、通常80〜100%の組換えの効率が低下します。 ES細胞用培地の主要な成分であるウシ胎児血清(FCS)が強くタンパク質導入を阻害する。したがって、Creリコンビナーゼの高濃度は、使用する必要がありました。無血清条件下での作業時に以下の蛋白質(0.5 - 2μM)は、同様の組換えの効率を達成するために使用することができます。
手でpSESAMEベクター系では、ある者は、Oct4とSox2の7とScl/Tal1 8などなどの転写因子を含む他のタンパク質へのタンパク質導入の手法を適用することができます。
謝辞
我々は、オリバーBrüstleおよび幹細胞工学グループ、サポートと貴重な議論のためのボン大学、のすべてのメンバーに感謝。我々は、SDS - PAGEの準備とプロジェクト全体で永続的なサポートのためのザビーネシェンクに感謝。ニコルラスとアンナMagerhansは、優れた技術サポートを提供した。さらに、映画の制作のためにアンドレアスバーとシーラメルテンスに感謝します。この作品は、フォルクスワーゲン財団(AZ I/77864)と教育研究のドイツ省(BMBF、01 GN 0813)からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| TUNER (DE3) pLacI | Novagen, EMD Millipore | 70625 | |
| Glycerol | Carl Roth GmbH | 3783.2 | |
| Na2HPO4 | Carl Roth Gmbh | T876.1 | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| HCl | Carl Roth Gmbh | 4625.1 | |
| Imidazol | Carl Roth Gmbh | X998.4 | |
| NaCl | Carl Roth Gmbh | 9265.2 | |
| Yeast Extract | Carl Roth Gmbh | 2363.4 | |
| Trypton/Pepton | Carl Roth Gmbh | 8952.4 | |
| K2HPO4 | Carl Roth Gmbh | P749.2 | |
| KH2PO4 | Carl Roth Gmbh | 3904.1 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| Carbenicillin | Sigma-Aldrich | 6344.2 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Lysozyme | Sigma-Aldrich | 62971 | |
| Benzonase | Novagen, EMD Millipore | ||
| L-Tartaric acid, disodium salt | Sigma-Aldrich | ||
| 50% Ni-NTA slurry | Invitrogen | R901-15 | |
| EconoPac columns | Bio-Rad | 732-1010 | |
| Sterile filter 0,22μm | Whatman, GE Healthcare | ||
| Paraformaldehyde (PFA) | Sigma-Aldrich | ||
| LB medium | Yeast extract, Trypton/Pepton, NaCl | ||
| TB medium | Yeast extract, Trypton/Pepton, Glycerol, K2HPO4, KH2PO4 | ||
| Lysis Buffer | 50 mM Na2HPO4, 5 mM Tris, pH 7.8 | ||
| Tartaric Salt Buffer (TSB) | PTB containing 2 M L-Tartaric acid, disodium salt, and 20 mM Imidazol | ||
| Washing Buffer | PTB, 500 mM NaCl, 15 mM Imidazol | ||
| Elution Buffer | PTB, 500 mM NaCl, 250 mM Imidazol | ||
| High Salt Buffer | 600 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| Gylcerol Buffer | 50% glycerol, 500 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| TrypLE™ Express | Invitrogen | ||
| ESGRO (LIF) | EMD Millipore | ||
| NEAA | GIBCO, by Life Technologies | 11140035 | |
| L-Glutamin | GIBCO, by Life Technologies | 25030024 | |
| β-Mercapt–thanol | GIBCO, by Life Technologies | 31350010 | |
| DMEM | GIBCO, by Life Technologies | 11960044 | |
| PBS | GIBCO, by Life Technologies | ||
| Fetal Calf Serum (FCS) | PAA Laboratories | ||
| X-Gal staining solution: | 4 mM K3(FeIII(CN)6), 4 mM K4(FeII(CN)6), 2mM MgCl2 0.4 mg/mL X-Gal solved in PBS | ||
| K3(FeIII(CN)6) | Sigma-Aldrich | P-3367 | |
| K4 (FeII(CN)6) | Sigma-Aldrich | P-9387 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| X-Gal | Sigma-Aldrich | B4252 |
参考文献
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Edenhofer, F. Protein transduction revisited: novel insights into the mechanism underlying intracellular delivery of proteins. Curr Pharm Des. 14 (34), 3628-3636 (2008).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6 (1), 7-28 (2004).
- Nolden, L. Site-specific recombination in human embryonic stem cells induced by cell-permeant Cre recombinase. Nat Methods. 3 (6), 461-467 (2006).
- Zhang, Y. Inducible site-directed recombination in mouse embryonic stem cells. Nucleic Acids Res. 24 (4), 543-548 (1996).
- Peitz, M. Enhanced purification of cell-permeant Cre and germline transmission after transduction into mouse embryonic stem cells. Genesis. 45 (8), 508-517 (2007).
- Bosnali, M., Edenhofer, F. Generation of transducible versions of transcription factors Oct4 and Sox2. Biol Chem. 389 (7), 851-861 (2008).
- Landry, J. R. Runx genes are direct targets of Scl/Tal1 in the yolk sac and fetal liver. Blood. 111 (6), 3005-3014 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved