Method Article
Engenharia de Proteínas Cell-permeáveis
Neste Artigo
Resumo
Transdução da proteína permite a entrega direta de proteínas biologicamente ativos nas células. Em contraste com os métodos convencionais, tais como a transfecção de DNA viral ou transdução este paradigma não-invasivo altamente eficiente permite a manipulação celular de uma forma titulável contornar toxicidade celular eo risco de transformação oncogênica por modificação genética permanente.
Resumo
A técnica de transdução de proteína permite a entrega directa do material biologicamente ativo em células de mamíferos [para revisão ver 1,2]. Para este pode-se fazer uso da capacidade translocação dos peptídeos chamada célula penetrante (CPPs), também designado como domínios de proteína de transdução (PTDs). O TAT-CPP derivado do tipo de vírus da imunodeficiência humana 1 (HIV-1) Tat proteína (trans-ativador de transcrição) tem sido amplamente utilizada. O TAT positivamente carregada promove permeabilidade celular, assim, superar as barreiras da membrana celular por endocitose e / ou penetração direta da membrana 2. Em combinação com um sinal de localização nuclear (NLS) proteínas de fusão são capazes de entrar a funcionalidade núcleo expositoras. Nossa apresentação em vídeo demonstra, como uma exemplificação para a engenharia de células-permeável proteínas, a construção, produção e aplicação de uma versão de células-permeável do DNA-enzima Cre modificando.
Cre recombinase é um site-specific que é capaz de reconhecer e recombinar base de 34 sites de loxP par em células de mamíferos in vitro e in vivo. Portanto, o sistema Cre / loxP é amplamente utilizado para condicionalmente induzir mutações no genoma das células vivas 3,4. A entrega de ativos Cre recombinase para as células, no entanto, representa uma limitação.
Nós descrevemos o sistema vector pSESAME, que permite uma inserção direta do gene de interesse e fornece uma plataforma para rapidamente clone diferentes domínios e marcas usadas dentro do vetor de uma maneira conveniente e padronizado. Reorganização das tags diferentes tem sido mostrado para modificar as propriedades bioquímicas das proteínas de fusão com a possibilidade da obtenção de maior rendimento e melhor solubilidade. Demonstramos como expressar e purificar recombinante de células-permeante proteínas e de E. coli. A funcionalidade da proteína recombinante Cre está finalmente validada em cultura de células, avaliando sua atividade recombinase intracelular.
Protocolo
Construção de vetor de expressão e de expressão:
O vetor de expressão pSESAME-Cre foi construído através da inserção de um fragmento de Cre-codificação em pSESAME através de sites e AvrII NheI restrição utilizando os métodos de clonagem padrão. pSESAME codifica uma proteína de fusão que consiste de uma tag histidina, TAT-domínio, a seqüência NLS e Cre, abreviado HTNCre. À manifestação de HTNCre o pSESAME-Cre foi transformado em TUNER (DE3) pLacI e usado para preparar um estoque de glicerol.
- Uma cultura de over-noite, foi inoculado com uma ponta de pipeta revestidos com bactérias transformadas a partir do estoque de glicerol. A cultura noite mais consistia em media LB suplementado com glicose 0,5% [v / v] e carbenicilina numa concentração final de 50 mcg / mL e foi autorizado a crescer a 37 ° C por 16 horas.
- Dia seguinte, a densamente cresceu durante a noite de cultura foi usada para inocular a cultura de expressão na proporção de 1 a 40 e foi colocado em uma incubadora a 37 ° C. Cultura consistia expressão dos meios de comunicação TB suplementado com glicose 0,5% [v / v] e ampicilina na concentração final de 100 mcg / mL.
- Em um OD 595 de 1,5 a cultura expressão foi induzida com IPTG 0,5 mM por 1 h.
- Posteriormente as bactérias foram coletadas por centrifugação a 5000 rpm por 10 minutos em um rotor SLA3000.
- Pellets bactérias foram armazenadas a -20 ° C até a purificação.
Purificação de proteínas de células-permeável:
- Pellets congelados bactérias foram ressuspendidas em 10 mL tampão de lise por cultura frasco litro por 15 minutos em temperatura ambiente.
- Suspensão foi, então, incubadas com lisozima 1 mg / mL para o adicional de 15 minutos, enquanto a mistura em temperatura ambiente.
- 25 U / mL benzonase foi adicionado depois e incubados durante a mistura por 15 minutos em temperatura ambiente.
- Depois de sonorização no gelo por 1,5 min com 0,5 pulsos s em 45% do poder, 1 mL de buffer sal fria tartárico (TSB) por mL de suspensão foi cuidadosamente adicionado durante a mistura e incubado por 5 min no gelo. SDS-PAGE da amostra da fração lisado (L) foi tirada.
- Lisado limpo foi obtida por centrifugação a 4 ° C por 30 min a 30.000 g. SDS-PAGE de amostras das frações solúvel (S) e insolúvel (I) foram tomadas.
- O sobrenadante foi transferido para novos tubos de 50 mL falcon e foi então delicadamente misturados por 1 hora a 4 ° C com 2 mL de 50% Ni-NTA suspensão por litro de cultura expressão inicial.
- A suspensão foi embalado em um fluxo de gravidade coluna EconoPac (SDS-PAGE amostra de fluxo através fração (FT) foi tomada) e lavadas duas vezes com 5 leitos volumes de tampão de lavagem. SDS-PAGE de amostras de ambas as frações de lavagem (W1 e W2) foram coletados.
- HTNCre contendo frações foram eluídas com três cama-volumes de tampão de eluição e amostra da fração eluato (E) para análise de SDS-PAGE foi tirada.
- Imidazol foi removido por diálise contra tampão de eluição fração elevada de sal duas vezes.
- A solução de proteína foi ainda mais concentrada por diálise contra tampão glicerol duas vezes. Em todas as etapas de diálise a relação de tampão para amostra foi de pelo menos 50. Este procedimento resultou em uma solução estoque contendo glicerol HTNCre na concentração usual entre 200 e 450 mM, ou seja, 1 litro de cultura expressão resultará em ~ 12 mg de proteína. Amostra de estoque de glicerol (GS) para SDS-PAGE análise foi coletado. HTNCre solução estoque pode ser armazenado a menos 20 ° C.
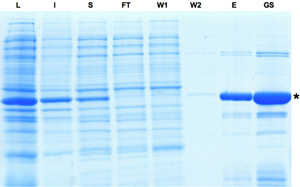
Figura 1: SDS-PAGE análise das amostras coletadas durante o processo de purificação da Cre recombinase. Indução da expressão do Cre é indicado por banda dominante na fração de lisado. Embora uma parte da proteína é insolúvel da proteína Cre pode ser enriquecido como visto no eluato e frações de ações glicerol. L: Lysate, I: Insolúvel, S: O sobrenadante, FT: Flow-through, W: E lavar roupa,: eluato, GS: Stock Gylcerol. Por favor, clique aqui para ver uma versão ampliada da figura 1.
Transdução de proteína em camundongos-tronco embrionárias (ES) células:
- Células ES carregando uma condicional β-Galactosidase repórter construir cinco foram semeadas como células isoladas usando TrypLE ™ Express para a dissociação de células aderentes. Após 4 a 6 horas as células tinham re-inscritos e meio foi removido.
- Posteriormente as células ES foram incubadas com HTNCre meio contendo por 16 horas.
- Uma quantidade adequada de proteína HTNCre (correspondente a 10 mM) do estoque de glicerol foi diluído em meio ES e posteriormente filtrado estéril (0,22 m).
- Depois de meio de transdução de proteína foi alterado novamente para meio de crescimento normal.
- Depois de dois dias as células foram lavadas com PBS e fixadas com paraformaldeído 4% (PFA) por 10 minutos.
- Dois aditradicionais etapas de lavagem com PBS foram executados antes de X-Gal coloração foi realizada.
- Células fixadas foram cobertos com uma camada de X-Gal solução de coloração 6 e incubadas durante a noite a 37 ° C.
Resultados representativos:
No dia seguinte solução de coloração X-Gal foi aspirado e as células foram cobertos com uma camada de PBS para a análise de microscopia. 8-10% das células recombinadas pôde ser observado no interior das células ES de camundongos julgado por β-Galactosidase atividade.
Discussão
Durante o processo de purificação da proteína de fusão Cre, é importante não omitir a adição de gelo tampão TBS frio antes da centrifugação. Caso contrário Cre recombinase tende a precipitar dentro do buffer de glicerol.
Se a fração eluato parece tornar-se turva devido à alta concentração de proteína de fusão do buffer de eluição deve ser adicionado até que a solução cancelou novamente.
A aplicação de 10 mM de Cre proteína de fusão normalmente resulta em uma eficiência de recombinação de 80 a 100%. Soro fetal bovino (FCS), sendo um componente importante do ES médio de células inibe fortemente transdução de proteína. Portanto, alta concentração de Cre recombinase teve que ser usado. Ao trabalhar no soro livre de condições menos proteínas (0,5-2 mM) pode ser utilizado para alcançar a eficiência de recombinação semelhante.
Com o sistema vector pSESAME na mão pode-se aplicar a técnica de transdução de proteína para outras proteínas, incluindo fatores de transcrição como Oct4 e Sox2 7 e 8 Scl/Tal1.
Agradecimentos
Agradecemos a Oliver Brüstle e todos os membros do Grupo de Engenharia de Células-Tronco da Universidade de Bonn, de apoio e valiosas discussões. Agradecemos a Sabine Schenk para a preparação do SDS-PAGE e apoio permanente ao longo do projeto. Nicole Russ e Anna Magerhans prestou apoio técnico excelente. Além disso, gostaríamos de agradecer a Andreas Bär e Sheila Mertens para a produção do filme. Este trabalho foi financiado por doações da Fundação Volkswagen (Az I/77864) eo Ministério Alemão de Educação e Pesquisa (BMBF, 01 GN 0813).
Materiais
| Name | Company | Catalog Number | Comments |
| TUNER (DE3) pLacI | Novagen, EMD Millipore | 70625 | |
| Glycerol | Carl Roth GmbH | 3783.2 | |
| Na2HPO4 | Carl Roth Gmbh | T876.1 | |
| Trizma Base | Sigma-Aldrich | T1503 | |
| HCl | Carl Roth Gmbh | 4625.1 | |
| Imidazol | Carl Roth Gmbh | X998.4 | |
| NaCl | Carl Roth Gmbh | 9265.2 | |
| Yeast Extract | Carl Roth Gmbh | 2363.4 | |
| Trypton/Pepton | Carl Roth Gmbh | 8952.4 | |
| K2HPO4 | Carl Roth Gmbh | P749.2 | |
| KH2PO4 | Carl Roth Gmbh | 3904.1 | |
| Ampicillin | Sigma-Aldrich | A9518 | |
| Carbenicillin | Sigma-Aldrich | 6344.2 | |
| HEPES | Sigma-Aldrich | H3375 | |
| Lysozyme | Sigma-Aldrich | 62971 | |
| Benzonase | Novagen, EMD Millipore | ||
| L-Tartaric acid, disodium salt | Sigma-Aldrich | ||
| 50% Ni-NTA slurry | Invitrogen | R901-15 | |
| EconoPac columns | Bio-Rad | 732-1010 | |
| Sterile filter 0,22μm | Whatman, GE Healthcare | ||
| Paraformaldehyde (PFA) | Sigma-Aldrich | ||
| LB medium | Yeast extract, Trypton/Pepton, NaCl | ||
| TB medium | Yeast extract, Trypton/Pepton, Glycerol, K2HPO4, KH2PO4 | ||
| Lysis Buffer | 50 mM Na2HPO4, 5 mM Tris, pH 7.8 | ||
| Tartaric Salt Buffer (TSB) | PTB containing 2 M L-Tartaric acid, disodium salt, and 20 mM Imidazol | ||
| Washing Buffer | PTB, 500 mM NaCl, 15 mM Imidazol | ||
| Elution Buffer | PTB, 500 mM NaCl, 250 mM Imidazol | ||
| High Salt Buffer | 600 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| Gylcerol Buffer | 50% glycerol, 500 mM NaCl, 20 mM HEPES, pH 7.4 | ||
| TrypLE™ Express | Invitrogen | ||
| ESGRO (LIF) | EMD Millipore | ||
| NEAA | GIBCO, by Life Technologies | 11140035 | |
| L-Glutamin | GIBCO, by Life Technologies | 25030024 | |
| β-Mercapt–thanol | GIBCO, by Life Technologies | 31350010 | |
| DMEM | GIBCO, by Life Technologies | 11960044 | |
| PBS | GIBCO, by Life Technologies | ||
| Fetal Calf Serum (FCS) | PAA Laboratories | ||
| X-Gal staining solution: | 4 mM K3(FeIII(CN)6), 4 mM K4(FeII(CN)6), 2mM MgCl2 0.4 mg/mL X-Gal solved in PBS | ||
| K3(FeIII(CN)6) | Sigma-Aldrich | P-3367 | |
| K4 (FeII(CN)6) | Sigma-Aldrich | P-9387 | |
| MgCl2 | Sigma-Aldrich | M8266 | |
| X-Gal | Sigma-Aldrich | B4252 |
Referências
- Gump, J. M., Dowdy, S. F. TAT transduction: the molecular mechanism and therapeutic prospects. Trends Mol Med. 13 (10), 443-448 (2007).
- Edenhofer, F. Protein transduction revisited: novel insights into the mechanism underlying intracellular delivery of proteins. Curr Pharm Des. 14 (34), 3628-3636 (2008).
- Branda, C. S., Dymecki, S. M. Talking about a revolution: The impact of site-specific recombinases on genetic analyses in mice. Dev Cell. 6 (1), 7-28 (2004).
- Nolden, L. Site-specific recombination in human embryonic stem cells induced by cell-permeant Cre recombinase. Nat Methods. 3 (6), 461-467 (2006).
- Zhang, Y. Inducible site-directed recombination in mouse embryonic stem cells. Nucleic Acids Res. 24 (4), 543-548 (1996).
- Peitz, M. Enhanced purification of cell-permeant Cre and germline transmission after transduction into mouse embryonic stem cells. Genesis. 45 (8), 508-517 (2007).
- Bosnali, M., Edenhofer, F. Generation of transducible versions of transcription factors Oct4 and Sox2. Biol Chem. 389 (7), 851-861 (2008).
- Landry, J. R. Runx genes are direct targets of Scl/Tal1 in the yolk sac and fetal liver. Blood. 111 (6), 3005-3014 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados