このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
リビングでのイメージング、細胞の形状の変更ショウジョウバエ胚
要約
ショウジョウバエ、キイロショウジョウバエ、開発の初期段階はよくイメージングアプローチに適している細胞の形状の変更の数によって特徴付けられる。この記事では、ショウジョウバエの胚のライブ共焦点イメージングに必要な基本的なツールと方法を説明します、そして細胞化と呼ばれる細胞の形状変化に焦点を当てます。
要約
開発キイロショウジョウバエの胚では、共焦点イメージングを生きるために非常に従順な細胞形状の変化の回数を受ける。ハエの細胞の形状の変化は、高等生物と似ています、そして、彼らは組織の形態形成を駆動する。そう、多くの場合、彼らの研究は、ヒトの疾患(表1)1-5を理解するための直接的な意味を持っています。サブセルラー規模で、これらの細胞形状の変化は、遺伝子発現からシグナル伝達、細胞極性、細胞骨格の再構成と膜輸送に至るまでの活動の産物です。このように、 ショウジョウバエの胚は、彼らが組織の形態形成に関連する細胞の形状の変化を評価するだけでなく、文脈を提供するだけでなく、形状の細胞がそのサブ細胞の活動を研究するために完全に生理学的な環境を提供しています。
プロトコルは、画像細胞化と呼ばれる特定の細胞の形状変化をするように設計されてここで説明する。細胞化は、劇的な細胞膜の成長の過程であり、そしてそれは最終的に細胞性胞胚にシンシチウム胚を変換します。有糸分裂サイクル14の相間で、すなわち、原形質膜は、同時に一次上皮細胞のシートを生成するために〜6000皮質固定された核のそれぞれの周囲に陥入する。前の提案にカウンター、細胞化は、ミオシン- 2収縮6によって駆動されていませんが、代わりに主に内部貯蔵7から膜のエキソサイトーシスによって支えられています。従って、細胞化は、細胞質分裂や筋肉の横-細管(T管)形態形成などの原形質膜の陥入や拡張を必要とする細胞の形状の変化、中膜輸送を研究するための優れたシステムです。
このプロトコルは簡単にハエの胚で他の細胞の形状変化のイメージングに適用される、そして唯一のそのような胚のコレクションのステージを変更する、または特定の方向(表で胚をマウントする"胚の接着剤"を使用するなど、わずかな適応を必要としていることに注意してください1)8-19。すべてのケースでは、ワークフローは基本的には(図1)と同じです。クローニングおよびショウジョウバエ遺伝子導入のための標準的な方法は、緑色蛍光タンパク質(GFP)またはその変異体に融合された、興味のあるタンパク質を発現するサシバエの在庫を準備するために使用され、これらのハエでは胚の再生可能エネルギー源を提供しています。また、蛍光蛋白質/プローブを直接簡単なマイクロインジェクション技術90から10を経由してハエの胚に導入されています。その後、発生事象および撮像される細胞の形状変化に応じて、胚を回収して解剖顕微鏡で形態によって上演され、最後に位置し、共焦点顕微鏡でタイムラプスイメージングのためにマウント。
プロトコル
1。胚のコレクションカップを組み立てる
- 可能な限りスムーズにエッジを作り、かみそりで100mLのトライコーンビーカーの底を切り取ります。これは絶対に必要ではないがカップは、この他、トップのオフ三つ角をトリミングした場合の処理が容易です。
- ワイヤーメッシュ(6センチメートル× 6 cm)の正方形をカット。予め温めておいたホットプレート上で、内部の換気フード、層頑丈なアルミ箔の部分の上にワイヤーメッシュの正方形の。ホットメッシュの上にしっかりとカップのカット下端を押してください。数秒待ってから、現在接続されているメッシュでカップを持ち上げる。箔も付く場合、単にオフに皮。
- 一晩コップを冷やす。細粒度のサンドペーパーを持つ任意の鋭いエッジをオフはさみ、そして砂で余分なメッシュを削除します。
2。アップルジュース寒天平板を作る
- 6Lフラスコに、100グラムBDバクト寒天と3L蒸留水を組み合わせる。遅い排気の設定で30分間寒天をオートクレーブ。
- 攪拌棒付き2Lフラスコに、100gのショ糖、1Lリンゴジュース、6 G P -ヒドロキシ安息香酸を組み合わせる。ホットプレート上で攪拌しながら沸騰するソリューションを加熱する。 2分以上沸騰しないでください。リンゴジュースの混合物が冷却し、寒天の撹拌棒を追加することができます。完全に混ぜる。
- 60x15ミリメートルペトリ皿に注ぐ前に60℃の水浴中で冷却するために統合されたソリューションを可能にする。また、蠕動ポンプは、寒天を分配するために使用することができます。プレートは、少なくとも4時間室温に冷却してください。 4のウェットペーパータオルとストアの層℃でラバーメイドのコンテナにスタック
注意事項:
- 秋や冬には、それは寒天に水のさらに100 mLを追加する必要がある場合があります。
- シャーレのブランドは重要です!唯一のBDファルコンの料理はトライコーンビーカーに合う。特定の注文情報は、以下の材料の表に記載されています。
3。胚のコレクションカップにGFPのフライを追加
- の瓶を設定することで、コレクションのニーズに基づいたGFP株を展開は、イメージングの前に約2週間飛ぶ。ハエの1本のボトルには通常50以上の女性と30人の男性の最小値を使用すると、ワン胚のコレクションのコップを満たすのに十分です。最高の敷設のために、ハエは(後の孵化5日以内すなわち、)新たにeclosedでなければなりません。
- ほぼ同じ部品レッドスターアクティブドライイーストと蒸留水で小さなカップに充填して貼り酵母を加えて、酵母が溶解するまで撹拌する。ペーストは、ウェットピーナッツバターのおおよその一貫すべき。より多くの酵母や水は一貫性を変更するために追加することができます。酵母ペーストは4で、数日間使用することができ、保存する必要があります、カバー℃に
- 酵母ペーストの準備が整ったら、4からリンゴジュースのプレートを取り外し℃の貯蔵を。リンゴジュース酵母ペーストとプレート、そして、それらが22から25に戻してくださいストリーク° C、産卵促進される。
- 再び半分にし、半分に円形のろ紙を折る。 8〜9センチメートルの直径にトリム、および四半期のサークルでアコーディオンのひだを作る。 、円を広げる、それを反転し、それがメッシュに当たるまで、コレクションカップに挿入します。それが落下してハエを破砕しないように紙のコップに安全であることを確認してください。ろ紙はオプションですが、交配のための快適な環境を提供していない、とカップの湿度を維持します。
- 株式の名前と日付をカップにラベルを付けます。軽く飲みながら倒立ボトルを振って、ボトルからコレクションカップにハエを移し、すぐに準備したりんごジュースのプレートとカップをカバー。輪ゴムでカップにプレートを固定します。直接光と地域でCUPSのメッシュ側を設定します。ハエは、暗闇の中でうまくレイアウトできないので、影がカップに落ちていないことを確認してください。
- 必要に応じて、リンゴジュースのプレートを変更します。 2時間のコレクションは、室温で、イメージング細胞化に適しています。
4。取付チャンバーを準備
- 胚のための取付け室を準備するには、2〜3センチの両面テープの部分をカットし、スライドの上に置き、テープとスライドの長軸を整列させる。その辺が揃っていることを確認し、テープの他の部分の上に両面テープの長い作品第二2〜3センチメートルをカットしてレイヤー。
- カミソリの刃を使用して、スライドの長軸にテープと垂直の中央に離れた二つカット約3mmを行います。チャンネルを作るためにカットの間にテープをはがします。ピペットチャンネルにハロカーボン27オイルのドロップ。胚がマウントされる場所をこのチャネルがあります。
注意事項:
- のみ½インチスコッチ両面テープは、胚を収容するために右の厚さです。
- 胚の脱水を防ぎながら、ハロカーボン27オイルは酸素透過性であり、そしてその酸素交換ができます。その屈折率のために、ハロカーボン27オイルはまた、ステージングに最適です。とイメージング胚。
5。 Dechorionate胚
- 収集とdechorionate胚に、完全に水没表面全体をにリンゴジュース寒天プレートにに十分な50%の漂白剤を注ぐ。胚は、彼らの絨毛膜から解放するためにこのような透過光とツァイスディスカバリーV8として、解剖顕微鏡を使って、見て。とすぐに絨毛膜が緩むと、いくつかの胚(30〜60秒)からのリリースとして、セルストレーナーに漂白剤や胚を注ぐ。
- 噴霧ボトルから蒸留水ですぐにと精力的にストレーナーで胚を洗浄してください。ペーパータオルの上でDABストレーナー。どんなピンクが軽くたたく後にタオルで見られている場合、水で胚を洗浄し続けます。
- きれいなリンゴジュースのプレート(無酵母ペースト)に10から50胚を転送するために湿った絵筆を使用してください。ペーパータオルの引き裂かれたエッジで水を離れてウィック、そしてすぐにハロカーボン27オイル少量の胚をカバー。
注意事項:
- クロロックス漂白剤を使用しないでください。代わりに、<6%の次亜塩素酸ナトリウムであるオースティンのA - 1商業ブリーチ、などのブランドを使用してください。
- 以上、漂白や洗浄が不十分で不規則な細胞化とどろどろ胚になります。
6。舞台とマウント胚
- 透過光と解剖顕微鏡を使って、プレート上に胚をステージングするBownes 20の形態学的なガイドラインに従ってください。鉗子を使用して、取付チャンバーのチャンネルに、Bownesステージ4に対応する、5有糸分裂サイクル11または12胚を転送する。目に見えると側面には、下に背側と腹側の側面と、ラインの胚を手配する。胚は容易に単独で石油にこの方向に配置されています。カバースリップを下に適用されると、彼らは酸素の隣人を奪うので観客の胚は、一緒にしないでください。 (それらの間の胚の長さの約半分のまま)。
- チャネルの片側に両面テープで25 × 25 mmのカバースリップの一方の端に横たわっていた。チャンネルをカバーするためにカバースリップをドロップします。空気が下にキャッチされている場合は、カバースリップの端にハロカーボン27オイルを少量。毛細管作用はチャネルに油を引き、空気を押し出されます。
注意事項:
- 胚をステージングするための別の優秀なリソースは以下です:カンポス-オルテガ、JAとハルテンシュタイン、V.(1985)。 キイロショウジョウバエの胚発生。シュプリンガー、ベルリン。この本はもう公開されていないが、使用されるコピーは定期的にAmazon.comで入手できます。
- 控えめにハロカーボン27オイルを常に使用します。これは、取り付けが容易になります。また、以下の画像の手順で顕微鏡対物にオイルの滲みが誤って防止します。
7。画像の胚
- ここ進め方もちろんあなたが撮影していること、細胞の形状変化、そしてあなたが取り組んでいるという質問によって決定されます。関心領域に焦点を共焦点イメージングに切り替えて、任意の形状変化のため、どちらかの正立または倒立顕微鏡上に取り付け室を置き、透過光であなたの胚を見つける、と。このようなニコンのMicroscopyU(で説明されたような共焦点顕微鏡のためのベストプラクティス、に従ってhttp://www.microscopyu.com/articles/confocal )。退色や光毒性を防止するために、できるだけ少ないレーザパワーにあなたの生きている胚を公開するには、特に厳格である。
- ツァイス710レーザー走査型共焦点顕微鏡で細胞化のため、我々は画像、C -アポクロマート40x/1.2 Wコアーの対物レンズを用いて。この顕微鏡は、18〜20℃からの範囲の温度で、恒温室に収容されています温度制御は絶対に必要ではないが、それは顕微鏡のためのより良いですし、画像がより一貫性です。胚の中央付近に単一の平面に我々は定期的に画像、、断面(図2)で原形質膜の陥入に従うこと。単に次の陥入のダイナミクスについては、30〜60秒間隔でタイムラプスイメージングのための十分であり、そして胚は酸素欠乏の明らかな兆候と> 90分間のイメージングに耐えるはず。
- 画像を取得した後、彼らは、ImageJの(と呼ばれる国立衛生研究所からのフリーウェア、を含む画像解析パッケージ、任意の数を使用して解析することができますhttp://rsbweb.nih.gov/ijを )。データは、ムービー(動画1)、シーケンス(図2)、またはkymographs 21として提示することができます。
注:
- 水浸漬C -アポクロマート40x/1.2 Wコアーの目的は、胚に近いイメージング水溶液サンプルの深部組織のイメージングのための収差を制限する、高開口、のために中間部に適しています、そして、高解像度と高い蛍光シグナルを与える。加えて、この目標非常に長い作動距離(220μm)を持っています。しかし、他の水またはグリセリン浸対物は、目的の細胞形状の変化が胚の表面近くで撮影可能場合は特に、よく実行されます。
8。代替方法:"胚接着剤"でマウント胚
- 画像細胞化以外の細胞の形状変化をする、それは容易に単独で石油に維持されていない特定の向きで胚をマウントする必要があります。そのためには、前述のいずれかに別の実装方法を使用します。シンチレーションバイアルにヘプタンの250μLで両面テープを20cmを組み合わせて、"胚接着剤"を作ることから始めます。 nutatorまたは回転台にシンチレーションバイアルを置き、一晩混ぜる。
- 胚の接着剤に黄色のピペットの先端を浸し、次に接着剤の跡を、スライドに沿って先端をトレース。ヘプタンが蒸発している間、あなたの寒天ブロック上に、必要な向きに胚を段階的に合わせます。 (寒天が直面する必要がある胚の表面を撮像することを忘れないでください。例えば、画像セルの形状変化に腹溝の形成時に、寒天が直面している彼らの腹側に胚をマウントする。)
- 接着剤でスライドを反転させ、ゆっくりと寒天ブロック上胚に対する接着剤の痕跡を押してください。今、再びスライドを反転。胚を適切な方向にスタックされます。胚の両側に両面テープの二つの層を追加して、ハロカーボン27オイルでそれらをカバーし、カバースリップを適用します。上記のような画像処理を続行します。
9。代表的な結果:
胚が正常であるとイメージングが最適である場合、その後細胞化は50〜60分を取る必要があります、と形質膜の陥入は、入口約40ミクロンをすべき。胚は、過漂白、酸素光毒性によって奪われたか壊れているしかし、、その後陥入は、特に画像化領域に、減速または停止されます。胚の健康のそのような悪化は、頻繁に変更された開発、および幼虫として孵化に失敗をもたらす。このように、イメージング後のアッセイの胚の健康への厳格なテストのために、加湿チャンバー内でスライドを維持し、次の日に孵化を待ちます。
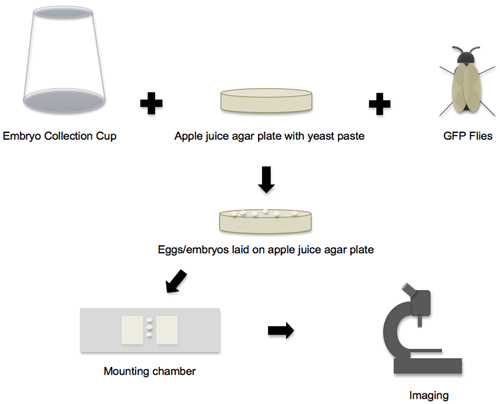
図1。胚のコレクションから画像へのワークフロー。プロトコルのワークフローは、主に4つの段階に分けることができます。最初のフェーズで、すべての個々の消耗品およびコンポーネントが用意され、その後、胚コレクションカップ、リンゴジュース寒天プレートとGFPのハエは、胚の敷設環境を作成するために一緒に置かれている。第二段階では、リンゴジュース寒天プレート上に配置されている卵や胚が収集されます。第3段階で、胚は、プレートから除去上演と取付チャンバーに転送されます。第四段階では、マウントされている胚は、共焦点顕微鏡で画像化される。
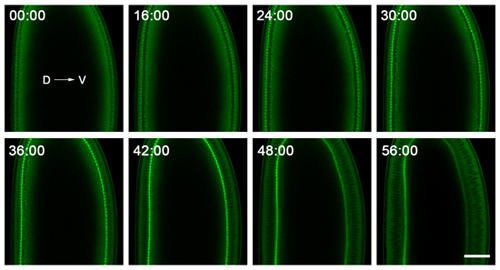
図2。細胞化のタイムラプスイメージングから代表的なデータ。胚の背側(D) とはっきりと見える腹側(V)側面にマウントされ、断面の原形質膜の陥入に従うように彼らの真ん中付近に撮像される。ここに示されている胚は、細胞膜の陥入の先端に集中するGFP -ミオシン- 2プローブ6を 、表現しています。このように、時間をかけてこの前の侵入を追跡することは、細胞膜が陥入する速度を与えます。夜12時00分分の時点では、細胞化の開始に対応しています。まもなく56:00分の時点の後、原腸陥入が胚の腹側に開始されます。バーは40ミクロンです。
ムービー1。細胞化のタイムラプスイメージングからの代表的な映画。この映画は、図2に対応しています。細胞化のプロセス全体を記録するには、イメージングはpseudocleavageの溝の回帰を取り込み、前の有糸分裂サイクル13で開始し、原腸形成の動きが胚の腹側に見られたまで続いた。画像は1分間隔で収集された。強度は、買収後はそれが容易に原腸の動きを見やすくするために増加した。
映画のためにここをクリック
| 発生事象とタイミング* | に関連する細胞の形状変化 | 病気や人間の健康へのリンク | ライブイメージングによる最近の参照 |
| 疑似分裂溝の形成 (4; 90分PF) | 細胞質分裂 | 倍数性と癌の進行1 | Mavrakisら、2009年08 Caoら、2010 9 |
| 細胞化 (5; 130分PF) | 細胞質分裂 | 倍数性と癌の進行1 | Caoら、2008年10 Sokac&ヴィーシャウ、2008 11 |
| 腹溝の形成、中胚葉の陥入 (6; 180分PF) | 心尖部収縮、上皮間葉移行 | 癌転移2 | フォックス&Peifer、2007 12 Martinら、2009年04月14 |
| 胚帯の拡張 (7; 195分PF) | 収斂伸長 | 神経管欠損3 | Bertetら、2004 14 ブランケンシップら、2006 15 |
| Tracheogenesis (11; 320分PF) | 上皮管腔形成と分岐 | 血管新生4 | Caussinusら、2008 16 ジェル&カサノバ、2010 17 |
| 背部閉鎖 (14、620分PF) | 心尖部収縮 | 創傷治癒5 | Gorfinkielら、2009 年 04月20 ソロンら、2009年04月19 |
表1。生きたハエの胚で画像化される細胞の形状の変更の例
* Bownesステージ数と時間、受精後(PF)、各イベントの開始時に、カンポス、オルテガ、1985にしたがって記載されています。
| 株式を飛ばす | ラベル | 元の参照 |
| スパイダー- GFP(95から1) | プラズマ膜 | モリンら、2001 22 |
| Resille - GFP(117〜2) | プラズマ膜 | モリンら、2001 22 |
| GAP43 -ヴィーナス | プラズマ膜 | Mavrakisら、2009年08 |
| スパゲッティスカッシュ- GFP(Sqh - GFP) | ミオシン- 2 | Royouら、2002 6 |
| E -カドヘリン- GFP(ECAD - GFP) | 細胞間の接合 | 小田ら、2001 23 |
| GFP -モエシン | F -アクチン | Kiehartら、2000 24 |
| ユートロフィン-ヴィーナス(Utro -ヴィーナス) | F -アクチン | Sokacら、未発表結果 |
表2。ハエの胚でのイメージング、細胞の形状変化のための有用な株
Access restricted. Please log in or start a trial to view this content.
ディスカッション
ここに記述されているプロトコルは、開発途上ハエの胚の細胞の形状の変化の数のライブ、共焦点イメージングを可能にするでしょう。イメージングのためのGFPの株式は、個々の研究室(表2)により調製するが、多くのそのような株は、インディアナ大学(アットブルーミントンショウジョウバエストックセンターとしてのセンターからも公開されていることができる
Access restricted. Please log in or start a trial to view this content.
開示事項
謝辞
我々は感謝して、このプロトコルが開発された基盤を提供するエリックヴィーシャウを、認めます。私たちの仕事は、ヴァーナ&マーズマクリーン生化学部および分子生物学スタートアップ賞、ベイラー医科大学でサポートされています。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
参考文献
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. uf a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. artinez, A, Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved