È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Imaging Forma Modifica cella in Living Drosophila Embrioni
In questo articolo
Riepilogo
Prime fasi dello sviluppo del moscerino della frutta, Drosophila melanogaster, è caratterizzato da una serie di modifiche la forma delle cellule che sono adatti per gli approcci di imaging. Questo articolo descrive gli strumenti di base e metodi necessari per vivere l'imaging confocale di embrioni di Drosophila, e si concentrerà su un cambiamento di forma delle cellule chiamato cellularization.
Abstract
Lo sviluppo dell'embrione Drosophila melanogaster subisce una serie di modifiche la forma delle cellule che sono altamente suscettibili di vivere l'imaging confocale. Alterazioni cellulari forma nel volo sono analoghi a quelli di organismi superiori, e guidano la morfogenesi dei tessuti. Così, in molti casi, il loro studio ha implicazioni dirette per la comprensione delle malattie umane (Tabella 1) 1-5. Sulla scala sub-cellulare, queste alterazioni cellulari forma sono il prodotto di attività che vanno dalla espressione genica di trasduzione del segnale, polarità cellulare, rimodellamento del citoscheletro e il traffico di membrana. Quindi, l'embrione di Drosophila fornisce non solo il contesto per valutare le variazioni forma delle cellule in cui riguardano la morfogenesi dei tessuti, ma offre anche un ambiente del tutto fisiologico per studiare le sub-cellulare attività che le cellule forma.
Il protocollo qui descritto è stato progettato per una specifica immagine di cambiare la forma delle cellule chiamato cellularization. Cellularization è un processo di crescita drammatica della membrana plasmatica, e lo converte in ultima analisi, l'embrione sinciziale nel Blastoderm cellulare. Cioè, in interfase del ciclo mitotico 14, la membrana plasmatica invaginates simultaneamente intorno a ciascuno dei nuclei ~ 6000 corticale ancorato a generare un foglio di primaria cellule epiteliali. Contro suggerimenti precedenti, cellularization non è guidato da miosina-2 contrattilità 6, ma è invece alimentato in gran parte da esocitosi della membrana dai depositi interni 7. Così, cellularization è un sistema eccellente per studiare il traffico di membrana durante i cambi di forma delle cellule che richiedono invaginazione della membrana plasmatica o di espansione, come citocinesi o trasversali-tubulo (T-tubuli) morfogenesi nel muscolo.
Si noti che questo protocollo può essere facilmente applicato al di imaging di altri cambiamenti forma delle cellule nell'embrione volare, e richiede solo piccole modifiche come cambiare la fase di raccolta degli embrioni, o usando "colla embrione" per montare l'embrione con un orientamento specifico (Tabella 1) 8-19. In tutti i casi, il flusso di lavoro è fondamentalmente la stessa (Figura 1). Metodi standard per la clonazione e la Drosophila transgenesi vengono utilizzati per preparare le scorte volare stabili che esprimono una proteina di interesse, unito alla proteina fluorescente verde (GFP) o sue varianti, e queste mosche fornire una fonte rinnovabile di embrioni. In alternativa, proteine fluorescenti / sonde vengono inserite direttamente in embrioni di volare attraverso semplici micro-iniezione tecniche 9-10. Poi, a seconda dell'evento di sviluppo e cambiano forma delle cellule per essere ripreso, gli embrioni sono raccolti e messo in scena da morfologia su un microscopio da dissezione, e finalmente posizionato e montato per time-lapse imaging su un microscopio confocale.
Protocollo
1. Montare Coppe di raccolta degli embrioni
- Tagliare il fondo fuori di un 100 mL Tri-corn becher con un rasoio, rendendo il bordo il più agevole possibile. Le coppe sono più facili da gestire se anche tagliare i tre angoli via dalla cima, anche se questo non è assolutamente necessario.
- Tagliare un quadrato di rete metallica (6 cm x 6 cm). Su un pre-riscaldato piastra calda, all'interno di un fumo cappuccio, strato piazza di rete metallica sulla parte superiore di un pezzo di pesanti foglio di alluminio. Spingere il bordo inferiore taglio della coppa saldamente la maglia calda. Attendere qualche secondo, e sollevare la coppa con la maglia ora attribuita. Se la pellicola anche bastoni, basta staccare.
- Raffreddare il bicchiere durante la notte. Rimuovere l'eccesso con le forbici in rete, e sabbia al largo eventuali bordi affilati con carta vetrata a grana fine.
2. Fai di Apple Juice piastre di agar
- In un pallone 6L, unire 100 g BD Agar Bacto e 3L di acqua distillata. Autoclave l'agar per 30 minuti sulla creazione di scarico lento.
- In un pallone 2L con un ancoretta, unire 100 g di saccarosio, 1 litro di succo di mela, e 6 g di p-idrossibenzoico. Riscaldare la soluzione ad ebollizione, mescolando in un piatto caldo. Non bollire per più di 2 minuti. Lasciare il composto di succo di mele a raffreddare, quindi aggiungere con ancoretta per l'agar. Miscelare completamente.
- Lasciare che la soluzione combinata per raffreddare in un bagno d'acqua a 60 ° C prima di versare in piastre Petri 60x15 millimetri. In alternativa, una pompa peristaltica può essere usata per erogare l'agar. Lasciare le piastre a temperatura ambiente per almeno 4 ore. Pila in Rubbermaid contenitori con uno strato di asciugamani di carta bagnata e conservare a 4 ° C.
Note:
- In autunno o in inverno, può essere necessario aggiungere ulteriori 100 ml di acqua per l'agar.
- Il marchio di piastre Petri è importante! Solo i piatti Falcon BD adattare il Tri-corn bicchieri. Specifiche informazioni sugli ordini si possono trovare nella tabella dei materiali di seguito.
3. Aggiungi mosche GFP al Coppe Collezione l'Embrione
- Ampliare le scorte GFP in base alle proprie esigenze di raccolta attraverso la creazione di bottiglie di mosche circa due settimane prima di imaging. Una bottiglia di mosche è di solito più che sufficiente a riempire una tazza di raccolta degli embrioni con un minimo di 50 femmine e 30 maschi. Per ottenere i migliori posa, vola dovrebbe essere nuovamente eclosed (cioè meno di 5 giorni dopo la schiusa).
- Fare una pasta di lievito compilando una piccola tazza con il lievito parti pressoché uguali Stella Rossa attiva a secco e acqua distillata, e mescolare fino a quando il lievito è sciolto. La pasta dovrebbe approssimare la consistenza del burro di arachidi bagnato. Più lievito o acqua può essere aggiunta ad alterare la consistenza. Pasta di lievito può essere utilizzato per diversi giorni, e deve essere conservato, coperto, a 4 ° C.
- Una volta che la pasta di lievito è pronto, rimuovere le piastre succo di mela da 4 ° C di stoccaggio. Streak le piastre succo di mela con la pasta di lievito, e permettere loro di caldo a 22-25 ° C, che incoraggerà la deposizione delle uova.
- Piegare un foglio circolare filtro a metà, poi a metà. Tagliare a 8-9 cm di diametro, e fare pieghe fisarmonica nel quarto di cerchio. Aprire il cerchio, negarli, e inserirla in un bicchiere di raccolta fino a toccare la rete. Assicurarsi che la carta sia correttamente inserita nel bicchiere in modo che non cada e schiacciare le mosche. La carta da filtro è facoltativo, ma fornisce un ambiente accogliente per l'accoppiamento, e mantiene l'umidità in tazza.
- Etichetta una tazza con nome fotografici e data. Trasferire le mosche dalla bottiglia al bicchiere di raccolta delicatamente scuotendo la bottiglia rovesciata sopra la coppa, e subito coprire la coppa con un piatto preparato succo di mela. Fissare la piastra per la coppa con un elastico. Set coppe laterali in rete in una zona con luce diretta. Assicurarsi che non le ombre cadono sulla tazza, come le mosche non getterà bene al buio.
- Cambia la piastra succo di mela, se necessario. Due ore di collezioni, a temperatura ambiente, funzionano bene per cellularization imaging.
4. Preparare una Camera di montaggio
- Per preparare una camera di montaggio per gli embrioni, tagliare un pezzo di nastro biadesivo 2-3 cm di lunghezza e posizionarlo su una diapositiva, allineando l'asse longitudinale del nastro e far scorrere. Un secondo taglio 2-3 cm lungo pezzo di nastro biadesivo e lo strato sopra l'altro pezzo di nastro adesivo, assicurandosi che i bordi siano allineati.
- Utilizzando una lama di rasoio, fare due tagli di circa 3 mm l'una dall'altra nel centro del nastro e perpendicolare all'asse lungo della diapositiva. Rimuovere il nastro tra i tagli di fare un canale. Pipettare una goccia di olio Halocarbon 27 nel canale. Questo canale è dove gli embrioni verranno montati.
Note:
- Solo il pollice ½ scotch biadesivo è lo spessore giusto per accogliere gli embrioni.
- Halocarbon 27 Il petrolio è permeabile all'ossigeno, e consente quindi lo scambio di ossigeno, prevenendo la disidratazione dell'embrione. Grazie al suo indice di rifrazione, Halocarbon 27 olio è ideale anche per la stadiazionee imaging embrioni.
5. Embrioni Dechorionate
- Per raccogliere embrioni e dechorionate, basta versare il 50% di candeggina al piastra di agar succo di mela per immergere completamente l'intera superficie. Utilizzando un microscopio da dissezione, come la scoperta Zeiss V8 a luce trasmessa, per guardare gli embrioni di liberare dal loro corion. Non appena il corion scioglie e libera da alcuni embrioni (30-60 secondi), versare candeggina e gli embrioni in un colino cellula.
- Lavare gli embrioni nel colino immediatamente e vigorosamente con acqua distillata da un flacone con spruzzatore. Tamponare filtro su carta assorbente. Se qualche rosa è visto su la spugna dopo tamponando, continuare il lavaggio degli embrioni con l'acqua.
- Utilizzare un pennello umido di trasferire gli embrioni 10-50 ad un piatto pulito succo di mela (senza pasta di lievito). Stoppino via l'acqua con il bordo strappato di un tovagliolo di carta, e coprire immediatamente gli embrioni con una piccola quantità di olio Halocarbon 27.
Note:
- Non usare candeggina Clorox. Al contrario, utilizzare un marchio come Austin A-1 Bleach commerciale, che è l'ipoclorito di sodio <6%.
- Over-candeggio o insufficiente risciacquo si tradurrà in embrioni pastoso con cellularization irregolari.
6. Stage e Monte embrioni
- Utilizzando il microscopio da dissezione a luce trasmessa, seguire le indicazioni morfologiche delle Bownes 20 a tappa embrioni sul piatto. Con le pinzette e trasferire da 5 mitotica del ciclo 11 o 12 embrioni, corrispondenti a Bownes fase 4, al canale della camera di montaggio. Disporre gli embrioni in una linea, con i lati laterali dorsale e ventrale visibile e laterale verso il basso. Gli embrioni sono facilmente disposti in questo orientamento in olio da solo. Non embrioni folla insieme in quanto priverebbe i loro vicini di ossigeno una volta che il vetrino viene applicato sotto. (Lascia in circa la metà di lunghezza dell'embrione tra loro).
- Posare un bordo di una copertura 25x25 mm scivolare sul nastro biadesivo su un lato del canale. Caduta la polizza di copertura per coprire il canale. Se l'aria e 'colto in sotto, applicare una piccola quantità di olio Halocarbon 27 a bordo del vetrino. Azione capillare tirerà l'olio nel canale e spingere fuori l'aria.
Note:
- Un'altra risorsa eccellente per gli embrioni messa in scena è la seguente: Campos-Ortega, e JA Hartenstein, V. (1985). Lo sviluppo embrionale di Drosophila melanogaster. Springer-Verlag, Berlino. Anche se questo libro non è più pubblicato, le copie usate sono regolarmente disponibile su Amazon.com.
- Utilizzare sempre i 27 Oil Halocarbon parsimonia. Questo renderà più facile il montaggio. Eviterà anche accidentale stillicidio di olio sul microscopio obiettivo nei passi seguenti immagini.
7. Immagine embrioni
- Come si procede qui sarà ovviamente dettata dalla cambiare forma cella che si sta imaging, e la domanda che si sta affrontando. Per qualsiasi cambiamento di forma, inserire il vostro camera di montaggio su entrambi un microscopio in posizione verticale o invertita, trovare il tuo embrioni da luce trasmessa, e quindi passare a confocale di concentrarsi su una regione di interesse. Attenersi alle buone pratiche per la microscopia confocale, come quelli discussi in MicroscopyU Nikon ( http://www.microscopyu.com/articles/confocal ). Essere particolarmente rigorosa nei esporre il embrioni vivi come potenza del laser meno possibile, per evitare photobleaching e fototossicità.
- Per cellularization, abbiamo un'immagine 710 su un microscopio confocale a scansione laser Zeiss, con un C-Apochromat 40x/1.2 W obiettivo Corr. Questo microscopio è ospitato in una stanza a temperatura controllata, con temperature comprese tra 18-20 ° C. Mentre il controllo della temperatura non è assolutamente necessario, è meglio per il microscopio e rende l'immagine più coerente. Abbiamo regolarmente immagine in un unico piano, quasi al centro dell 'embrione, per seguire la invaginazioni della membrana plasmatica nella sezione trasversale (Figura 2). Per semplicemente seguendo dinamiche invaginazione, 30-60 intervalli di secondi sono sufficienti per time-lapse imaging, e gli embrioni devono sopportare di imaging per> 90 minuti senza segni evidenti di mancanza di ossigeno.
- Dopo aver acquisito le immagini, possono essere analizzati utilizzando un qualsiasi numero di pacchetti di analisi dell'immagine, tra cui gratuito dal National Institutes of Health, chiamato ImageJ ( http://rsbweb.nih.gov/ij ). I dati possono poi essere presentato come film (Movie 1), sequenze (Figura 2), o kymographs 21.
Nota:
- L'immersione in acqua C-Apochromat 40x/1.2 W Corr obiettivo è adatto per l'imaging vicino l'embrione sezione centrale a causa della sua elevata apertura, che limita le aberrazioni per l'imaging dei tessuti profondi in campioni acquosi, e dà ad alta risoluzione e alta segnale fluorescente. Inoltre, questo obiettivoha una distanza molto lunga di lavoro (220 micron). Tuttavia, altri obiettivi di immersione in acqua o glicerina si esibiranno bene, soprattutto se il cambiamento di forma delle cellule di interesse può essere ripreso vicino alla superficie dell'embrione.
8. Metodo alternativo: il Monte embrioni con "embrio-colla"
- Per cambiare l'immagine di una cella di forma diversa cellularization, può essere necessario per il montaggio degli embrioni con un orientamento specifico che non è facilmente mantenuta in olio da solo. Per fare questo, utilizzare un metodo alternativo di montaggio a quello descritto in precedenza. Inizia facendo "embrione-colla", combinando 20 cm di nastro biadesivo con 250 ml di eptano in un flaconcino scintillazione. Posizionare la fiala di scintillazione in un nutator o piattaforma rotante, e mescolare durante la notte.
- Immergere una punta di giallo pipetta nella colla embrione, e quindi tracciare la punta lungo una diapositiva, lasciando una scia di colla. Mentre l'eptano è evaporazione, allineare il allestita embrioni nella posizione indicata su un blocco di agar. (Ricordate che la superficie embrione da acquisire deve essere rivolto verso l'agar. Per esempio, per modificare la forma di immagine durante la formazione delle cellule solco ventrale, montare gli embrioni con il loro lato ventrale rivolto verso l'agar.)
- Invertire la diapositiva con la colla, e premere delicatamente le tracce di colla contro gli embrioni sul blocco agar. Ora invertire la diapositiva di nuovo. Gli embrioni verranno bloccati con l'orientamento appropriato. Aggiungere due strati di nastro biadesivo su entrambi i lati degli embrioni, copriteli con Halocarbon 27 Olio, e applicare un vetrino coprioggetti. Procedere con l'imaging come descritto sopra.
9. Rappresentante dei risultati:
Se gli embrioni sono sani e l'imaging è ottimale, poi cellularization dovrebbe prendere 50-60 minuti, e il invaginazioni della membrana plasmatica deve penetrazione quasi 40 micron. Tuttavia, se gli embrioni sono troppo sbiancato, ossigeno o privati danneggiati da fototossicità, allora invaginazione sarà lento o interrompere, in particolare nel settore imaging. Tale deterioramento della salute dell'embrione si traduce spesso in sviluppo alterato, e un fallimento per covare come larve. Così, per un test rigorosi test per la salute degli embrioni dopo l'imaging, tenere le diapositive in una camera umidificata e guardare da cova il giorno successivo.
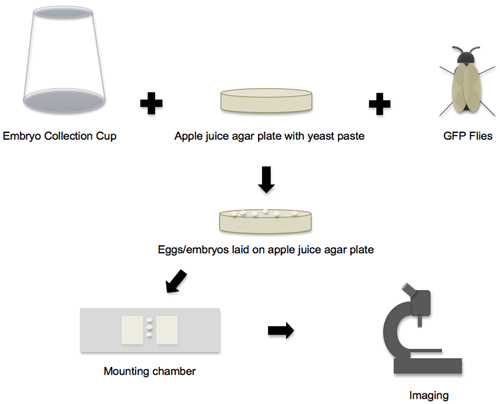
Figura 1. Flusso di lavoro dalla raccolta degli embrioni per l'imaging. Il flusso di lavoro del protocollo può essere suddiviso in quattro fasi principali. Nella prima fase, tutte le singole forniture ed i componenti sono preparati, e poi vola la coppa di raccolta degli embrioni, piastra di succo di mela e agar GFP sono messi insieme per creare l'embrione posa ambiente. Nella seconda fase, le uova e gli embrioni che sono disposti sulle piastre di agar succo di mela sono raccolti. Nella terza fase, gli embrioni vengono rimosse dalla piastra, messo in scena e trasferiti alla camera di montaggio. Nella quarta fase, gli embrioni vengono esposte montato su un microscopio confocale.
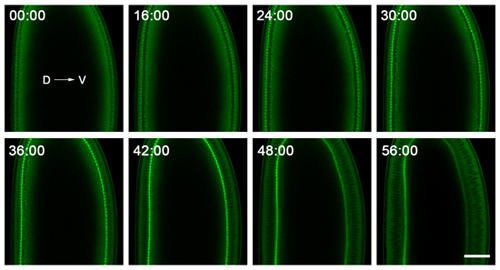
Figura 2. Dati indicativi di time-lapse imaging cellularization. Embrioni vengono montati con dorsale (D) e ventrale (V) i lati ben visibili, e sono ripreso vicino al loro mezzo di seguire le invaginazioni della membrana plasmatica nella sezione trasversale. L'embrione qui esprime un GFP-miosina-2 sonda 6, che si concentra sulla punta delle invaginazioni della membrana plasmatica. Così, il tracciamento della ingressione di questo fronte nel corso del tempo dà la velocità con cui la membrana plasmatica invaginates. Il punto di 0:00 minuti di tempo corrisponde a insorgenza cellularization. Poco dopo il punto di 56:00 minuti di tempo, gastrulazione inizia sul lato ventrale dell'embrione. Bar è di 40 micron.
Movie 1. Film rappresentante di time-lapse imaging cellularization. Questo film corrisponde alla figura 2. Per registrare l'intero processo di cellularization, l'imaging ha iniziato nel ciclo mitotico precedenti 13, catturando solco regressione pseudocleavage, e continuò fino movimenti gastrulazione sono stati visti dalla parte ventrale dell'embrione. Le immagini sono state raccolte ad intervalli di un minuto. Le intensità sono stati aumentati post-acquisizione per rendere più facile vedere i movimenti gastrulazione.
Clicca qui per i film
| Evento di sviluppo e tempi * | Cellulare cambia forma relativi alla | Un link a malattia o la salute umana | Riferimenti recenti con immagini dal vivo |
| Pseudo-scissione solco formazione (4; 90 minuti pf) | Citocinesi | Poliploidia e la progressione del cancro 1 | Mavrakis et al. 2009 8 Cao et al., 2010 9 |
| Cellularization (5; pf 130 minuti) | Citocinesi | Poliploidia e la progressione del cancro 1 | Cao et al., 2008 10 Sokac & Wieschaus, 2008 11 |
| Solco ventrale formazione; invaginazione Mesoderma (6; 180 minuti pf) | Apicale costrizione; epiteliale-mesenchimale transizione | Metastasi del cancro 2 | Fox & Peifer, 2007 12 Martin et al., 2009 13 |
| Germband estensione (7; pf 195 minuti) | Estensione convergente | Difetti del tubo neurale 3 | Bertet et al., 2004 14 Blankenship et al., 2006 15 |
| Tracheogenesis (11, 320 pf minuti) | Tubo formazione epiteliali e ramificazione | Angiogenesi 4 | Emmanuel Caussinus et al., 2008 16 Gervais e Casanova, 2010 17 |
| Chiusura dorsale (14, 620 minuti pf) | Costrizione apicale | Guarigione delle ferite 5 | Gorfinkiel et al., 2009 18 Solone et al., 2009 19 |
Esempi Tabella 1. Cambiamenti di forma delle cellule ripreso a volare embrioni viventi
* Il numero palco Bownes e ora post-fertilizzazione (pf), in cui ogni evento ha inizio, sono elencati in base a Campos-Ortega, 1985.
| Vola magazzino | Etichette | Riferimento originale |
| Spider-GFP (95-1) | Membrana plasmatica | Morin et al., 2001 22 |
| Resille-GFP (117-2) | Membrana plasmatica | Morin et al., 2001 22 |
| GAP43-Venere | Membrana plasmatica | Mavrakis et al. 2009 8 |
| Spaghetti Squash-GFP (Sqh-GFP) | Miosina-2 | Royou et al., 2002 6 |
| E-caderina-GFP (ECAD-GFP) | Giunzioni cellula-cellula | Oda et al., 2001 23 |
| GFP-Moesin | F-actina | Kiehart et al., 2000 24 |
| Utrophin-Venere (Utro-Venere) | F-actina | Sokac et al., Risultati non pubblicati |
Scorte Tabella 2. Utile per cambiare la forma delle cellule negli embrioni di imaging volare
Discussione
Il protocollo qui descritto consentirà di vivere, l'imaging confocale di una serie di cambiamenti nella forma delle cellule dell'embrione volano di sviluppo. Scorte GFP per l'imaging può essere preparato da un laboratorio individuale (Tabella 2), ma molte di tali scorte sono accessibili anche al pubblico da centri come Bloomington Drosophila archivi Center presso l'Università dell'Indiana ( http://flystocks.bio.indiana.edu ) e flytrap magazzi...
Divulgazioni
Riconoscimenti
Noi riconosciamo con gratitudine Eric Wieschaus, che ha fornito il fondamento su cui è stato sviluppato questo protocollo. Il nostro lavoro è supportato da una McLean Verna & Marrs Dipartimento di Biochimica e Biologia Molecolare Start-up Award, Baylor College of Medicine.
Materiali
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
Riferimenti
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. u. f. a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. a. r. t. i. n. e. z., A, . Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon