Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Changement de forme d'imagerie cellulaire en vie Drosophile Embryons
Dans cet article
Résumé
Le développement précoce de la mouche des fruits, Drosophila melanogaster, est caractérisée par un certain nombre de changements de forme cellulaire qui sont bien adaptés pour des approches d'imagerie. Cet article décrit les outils et méthodes de base nécessaires à l'imagerie confocale direct d'embryons de drosophile, et mettra l'accent sur un changement de forme de la cellule appelée cellularisation.
Résumé
Le développement de l'embryon de Drosophila melanogaster subit un certain nombre de changements de forme cellulaire qui sont extrêmement sensibles à vivre l'imagerie confocale. Les changements de forme cellulaire chez la mouche sont analogues à celles dans les organismes supérieurs, et ils conduisent la morphogenèse des tissus. Ainsi, dans de nombreux cas, leur étude a des implications directes pour la compréhension de la maladie humaine (tableau 1) 1-5. Sur l'échelle sub-cellulaire, ces changements de forme des cellules sont le produit d'activités allant de l'expression génique au transduction du signal, la polarité cellulaire, le remodelage du cytosquelette et le trafic membranaire. Ainsi, l'embryon de drosophile permet non seulement le contexte pour évaluer les changements de forme cellulaire comme ils se rapportent à la morphogenèse des tissus, mais offre également un environnement complètement physiologique pour étudier les activités sub-cellulaire que les cellules forme.
Le protocole décrit ici est conçu à l'image d'un changement de cellule spécifique forme appelée cellularisation. Cellularisation est un processus de croissance de la membrane plasmique dramatique, et il convertit finalement l'embryon syncytial dans le blastoderme cellulaire. C'est, à l'interphase du cycle mitotique 14, la membrane plasmique s'invagine simultanément autour de chacun des noyaux ~ 6000 corticale ancré à générer une feuille de cellules épithéliales primaires. Contre les suggestions précédentes, cellularisation n'est pas entraîné par la myosine-2 de la contractilité 6, mais est plutôt largement alimentée par exocytose de la membrane des magasins internes 7. Ainsi, cellularisation est un excellent système pour étudier le trafic membranaire pendant les changements de forme des cellules qui nécessitent une invagination membrane plasmique ou d'expansion, comme la cytocinèse ou transversale-tubules (T-tubules) morphogenèse dans le muscle.
Notez que ce protocole est facilement appliquée à l'imagerie d'autres changements de forme cellulaire dans l'embryon de mouche, et ne nécessite que de légères adaptations telles que changer la scène de la collecte d'embryons, ou en utilisant "colle embryon" pour monter l'embryon dans une orientation spécifique (tableau 1) 8-19. Dans tous les cas, le workflow est fondamentalement le même (figure 1). Les méthodes standard pour le clonage et la transgénèse chez la drosophile sont utilisées pour préparer les stocks de mouche des étables qui expriment une protéine d'intérêt, fusionnée à la protéine fluorescente verte (GFP) ou ses variantes, et ces mouches de fournir une source renouvelable d'embryons. Alternativement, les protéines fluorescentes / sondes sont directement introduits dans des embryons volée via simples techniques de la micro-injection 9-10. Ensuite, selon l'événement de développement et de changer de forme cellulaire à imager, les embryons sont collectés et mis en scène par la morphologie d'un microscope à dissection, et enfin positionné et monté pour imagerie time-lapse sur un microscope confocal.
Protocole
1. Assemblez Coupes de collecte d'embryons
- Découpez le fond d'un 100 mL de Tri-maïs bécher avec un rasoir, ce qui rend le bord aussi lisse que possible. Les tasses sont faciles à manipuler si vous aussi vous taillez les trois coins hors du top, même si cela n'est pas absolument nécessaire.
- Couper un carré de grillage (6 cm x 6 cm). Sur une plaque pré-chauffée à chaud, à l'intérieur d'une hotte, une couche de fumée au carré de grillage sur le dessus d'un morceau de papier d'aluminium épais. Poussez le bord inférieur de la coupe du coupé fermement sur le maillage chaud. Attendez quelques secondes, et soulever la coupe avec la maille maintenant attaché. Si la feuille colle aussi, juste le retirer.
- Refroidir la Coupe du jour au lendemain. Retirer l'excès filet avec des ciseaux, et le sable des bords tranchants avec du papier de verre grain fin.
2. Fabriquer des plaques d'Apple Juice Agar
- Dans un flacon de 6L, mélanger 100 g de BD Bacto Agar et 3L d'eau distillée. Autoclave l'agar-agar pendant 30 minutes sur le réglage d'échappement lent.
- Dans un flacon de 2L avec un agitateur, mélanger 100 g de saccharose, 1L de jus de pomme, et 6 g d'acide p-hydroxybenzoïque. Chauffer la solution à ébullition tout en remuant sur une plaque chauffante. Ne pas faire bouillir pendant plus de 2 minutes. Laisser le mélange de jus de pomme pour refroidir, puis ajoutez-le avec un barreau d'agitation à l'agar-agar. Mélanger complètement.
- Laisser la solution combinée refroidir dans un bain d'eau à 60 ° C avant de verser dans des boîtes de Pétri 60x15 mm. Alternativement, une pompe péristaltique peut être utilisé pour distribuer l'agar-agar. Laisser les plaques refroidir à température ambiante pendant au moins 4 heures. Pile dans des contenants Rubbermaid avec une couche de serviettes en papier humide et conserver à 4 ° C.
Notes:
- À l'automne ou en hiver, il peut être nécessaire d'ajouter un supplément de 100 mL d'eau à l'agar-agar.
- La marque des boîtes de Pétri est important! Seuls les plats BD Falcon ajustement des béchers Tri-maïs. Des informations spécifiques à la commande peut être trouvé dans la table de matières ci-dessous.
3. Ajouter mouches GFP aux Coupes de collecte d'embryons
- Développer les stocks de la GFP en fonction de vos besoins en mettant en place la collecte des bouteilles de mouches environ deux semaines avant l'imagerie. Une bouteille de mouches est généralement plus que suffisant pour remplir une tasse de collecte d'embryons avec un minimum de 50 femelles et 30 mâles. Pour mieux la pose, les mouches doivent être nouvellement eclosed (c'est à dire moins de 5 jours après l'éclosion).
- Faites une pâte de levure en remplissant une petite tasse avec parties égales Red Star de levure sèche active et de l'eau distillée, et remuer jusqu'à ce que la levure est dissoute. La pâte doit être proche de la consistance du beurre d'arachide humide. Plus de levure ou de l'eau peuvent être ajoutés pour modifier la consistance. Pâte de levure peut être utilisée pour plusieurs jours, et doit être stocké, couvert, à 4 ° C.
- Une fois la pâte la levure est prête, retirez les plaques de jus de pomme à partir de 4 ° C stockage. Streak les plaques de jus de pomme avec la pâte de levure, et leur permettre de se réchauffer à 22-25 ° C, ce qui encouragera la ponte.
- Pliez un papier filtre circulaire en deux, puis de nouveau en deux. Garniture à 8-9 cm de diamètre, et de faire des plis en accordéon dans le quart de cercle. Déplier le cercle, l'inverser, et l'insérer dans un récipient de collecte jusqu'à ce qu'il touche le filet. Assurez-vous que le papier est bloqué dans la coupe afin qu'il ne tombe pas et écraser les mouches. Le papier filtre est facultative, mais elle fournit un environnement accueillant pour l'accouplement, et maintient l'humidité dans la tasse.
- Etiquette d'une tasse avec le nom des stocks et la date. Transférer les mouches de la bouteille à la coupelle en agitant la bouteille renversée sur la tasse et couvrir immédiatement la tasse avec une assiette de jus de pomme préparé. Fixez la plaque à la tasse avec une bande élastique. Set coupes latérales en filet dans une zone avec une lumière directe. Assurez-vous qu'aucune ombre tombe sur la tasse, comme les mouches ne poseront pas bien dans l'obscurité.
- Changer la plaque de jus de pomme, au besoin. Deux heures de collections, à la température ambiante, bien travailler pour cellularisation imagerie.
4. Préparer une chambre de montage
- Pour préparer une chambre de montage pour les embryons, couper un morceau de scotch double-face 2-3 cm de long et le placer sur une diapositive, en alignant l'axe long de la bande et de diapositives. Couper de 2-3 secondes cm long morceau de ruban adhésif double face et couche sur le dessus de l'autre morceau de ruban adhésif, s'assurer que leurs bords sont alignés.
- En utilisant une lame de rasoir, faire deux coupes de 3 mm environ à part dans le centre de la bande et perpendiculairement à l'axe longitudinal de la glissière. Retirez la bande entre les coupes de faire un canal. Pipeter une goutte d'huile sur les halocarbures 27 dans le canal. Ce canal est l'endroit où les embryons seront montés.
Notes:
- Seuls les pouces ½ Scotch ruban adhésif double face est la bonne épaisseur pour accueillir les embryons.
- Halocarbures 27 pétrole est perméable à l'oxygène, et permet ainsi l'échange d'oxygène, tout en prévenant la déshydratation des embryons. Grâce à son indice de réfraction, les halocarbures 27 Le pétrole est également idéale pour la stadificationet l'imagerie des embryons.
5. Embryons Dechorionate
- Pour collecter et d'embryons dechorionate, verser suffisamment d'eau de Javel à 50% sur la plaque de gélose de pomme jus totalement submerger toute la surface. En utilisant un microscope à dissection, tels que le V8 Zeiss Découverte en lumière transmise, regarder pour les embryons de libérer de leur chorion. Dès que le chorion se desserre et les rejets de quelques embryons (30-60 secondes), versez l'eau de Javel et d'embryons de cellules dans une passoire.
- Lavez les embryons dans la passoire immédiatement et vigoureusement à l'eau distillée à partir d'un vaporisateur. Tamponnez la crépine sur du papier absorbant. Si le rose est visible sur la serviette après tamponnant, continuer à laver les embryons avec de l'eau.
- Utilisez un pinceau humide pour le transfert des embryons de 10 à 50 sur une plaque de jus de pomme propre (sans pâte de levure). Évacuer l'eau avec le bord déchiré d'une serviette en papier, et couvrir immédiatement les embryons avec une petite quantité d'huile sur les halocarbures 27.
Notes:
- Ne pas utiliser de javel Clorox. Au lieu de cela, utiliser une marque comme les Austin A-1 de javel commerciale, qui est l'hypochlorite de sodium à <6%.
- Plus de blanchiment ou de rinçage insuffisant se traduira dans les embryons bouillie avec cellularisation irrégulière.
6. Embryons au stade et le mont
- Utilisation de la loupe binoculaire en lumière transmise, suivez les directives morphologique des Bownes 20 au stade d'embryons sur la plaque. En utilisant des pinces, transférer 5 mitotique cycle de 11 ou 12 embryons, qui correspond à Bownes stade 4, le canal de la chambre de montage. Disposer des embryons dans une ligne, avec le côté côtés dorsales et ventrales et latérales visibles vers le bas. Les embryons sont facilement arrangés dans cette orientation dans de l'huile seule. Ne pas embryons s'entasser comme ils se privent de leurs voisins de l'oxygène une fois que la lamelle est appliquée ci-dessous. (Laissez environ la moitié d'une longueur d'embryons entre eux).
- Lay un bord d'une couverture de 25x25 mm glisser sur le ruban adhésif double face sur un côté du canal. Déposer la lamelle afin de couvrir le canal. Si l'air est pris en dessous, appliquer une petite quantité d'huile sur les halocarbures 27 au bord de la lamelle. L'action capillaire va tirer de l'huile dans le canal et faire sortir l'air.
Notes:
- Une autre excellente ressource pour les embryons scène est la suivante: Campos-Ortega, JA et Hartenstein, V. (1985). Le développement embryonnaire de Drosophila melanogaster. Springer-Verlag, Berlin. Bien que ce livre n'est plus publié, les copies utilisées sont régulièrement disponibles sur Amazon.com.
- Toujours utiliser les halocarbures 27 huile avec parcimonie. Cela rendra le montage plus facile. Il permettra également d'éviter accidentelle suintement de l'huile sur l'objectif du microscope dans les étapes suivantes d'imagerie.
7. Embryons image
- Comment vous procéder ici sera bien sûr dictée par le changement de forme de la cellule que vous êtes d'imagerie, et la question que vous abordez. Pour tout changement de forme, placez votre chambre de montage sur un microscope soit droite ou inversée, trouvez votre embryons par lumière transmise, et ensuite passer à l'imagerie confocale de se concentrer sur une région d'intérêt. Respectez les meilleures pratiques pour la microscopie confocale, tels que ceux discutés au MicroscopyU Nikon ( http://www.microscopyu.com/articles/confocal ). Être particulièrement rigoureuse dans les exposer votre embryons vivants comme la puissance du laser peu que possible, afin de prévenir photoblanchiment et de phototoxicité.
- Pour cellularisation, nous l'image sur un Zeiss 710 microscope confocal laser à balayage, en utilisant un C-Apochromat 40x/1.2 W Corr objectif. Ce microscope est logé dans une pièce à température contrôlée, avec des températures allant de 18-20 ° C. Bien que le contrôle de température n'est pas absolument nécessaire, il vaut mieux pour le microscope et rend l'imagerie plus cohérente. Nous avons régulièrement l'image dans un seul plan, près du milieu de l'embryon, de suivre les invaginations membranaires en coupe (figure 2). Pour suivre simplement la dynamique invagination, 30-60 secondes sont suffisantes pour imagerie time-lapse, et les embryons doivent supporter d'imagerie pour> 90 minutes avec aucun signe évident de manque d'oxygène.
- Après l'acquisition des images, ils peuvent être analysés en utilisant n'importe quel nombre de logiciels d'analyse d'image, y compris en freeware de la National Institutes of Health, a appelé ImageJ ( http://rsbweb.nih.gov/ij ). Les données peuvent ensuite être présentées comme des films (Film 1), les séquences (figure 2), ou kymographs 21.
Note:
- L'immersion dans l'eau C-Apochromat 40x/1.2 W Corr objectif est bien adapté pour l'imagerie à proximité de l'embryon mi-section en raison de sa grande ouverture, ce qui limite les aberrations de l'imagerie des tissus profonds dans les échantillons aqueux, et donne une haute résolution et haute signal fluorescent. En outre, cet objectifa une très longue distance de travail (220 m). Cependant, d'autres objectifs immersion dans l'eau ou la glycérine se comporteront bien, surtout si le changement de forme de cellule d'intérêt peut être imagée près de la surface embryon.
8. Autre méthode: Embryons Monter avec «embryon-colle"
- Pour l'image un changement de forme des cellules autres que cellularisation, il peut être nécessaire de monter des embryons dans une orientation spécifique qui n'est pas facilement maintenu dans l'huile seule. Pour ce faire, utilisez une autre méthode de montage à celui décrit précédemment. Commencez par faire «embryon-colle» en combinant les 20 cm de ruban adhésif double face avec 250 uL d'heptane dans un flacon à scintillation. Placer le flacon à scintillation sur une plateforme rotative ou nutator, et mélanger pendant la nuit.
- Tremper une extrémité de la pipette jaune dans la colle embryon, puis trace la pointe long d'une glissière, laissant une traînée de colle. Alors que l'heptane est l'évaporation, aligner votre mise en scène des embryons dans l'orientation indiquée sur un bloc de gélose. (Rappelez-vous que la surface d'embryon à imager doit être orientée vers l'agar-agar. Par exemple, pour changer de forme d'image lors de la formation de cellules sillon ventral, monter embryons avec leur face ventrale face à l'agar-agar.)
- Inverser la lame avec de la colle, et appuyez doucement sur la piste de colle contre les embryons sur le bloc de gélose. Maintenant inverser la glisser à nouveau. Les embryons seront coincés dans l'orientation appropriée. Ajouter deux couches de ruban adhésif double face de chaque côté de l'embryon, les couvrir avec les halocarbures 27 huile et recouvrir d'une lamelle. Procéder à l'imagerie tel que décrit ci-dessus.
9. Les résultats représentatifs:
Si les embryons sont sains et l'imagerie est optimale, alors cellularisation devrait prendre 50-60 minutes, et les invaginations membranaires devrait pénétration de près de 40 microns. Cependant, si les embryons sont sur-blanchi, privés d'oxygène ou endommagés par la phototoxicité, puis invagination sera soit ralentir ou d'arrêter, en particulier dans la zone imagée. Cette détérioration de la santé embryonnaire se traduit souvent par le développement altéré, et un échec à éclore sous forme de larves. Ainsi, pour un test rigoureux pour la santé des embryons de dosage après l'imagerie, gardez vos diapositives dans une chambre humidifiée et regarder à couver le jour suivant.
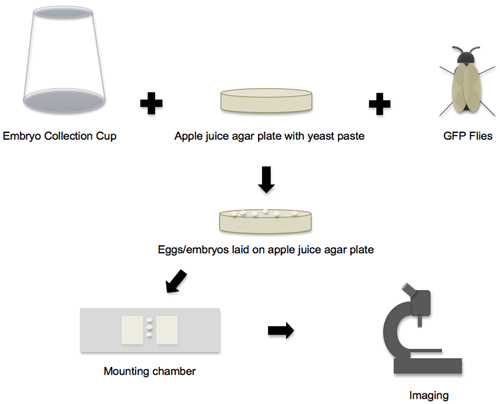
Figure 1. Flux de travail de collecte d'embryons à l'imagerie. Le workflow du protocole peut être décomposé en quatre phases principales. Dans la première phase, toutes les fournitures individuelles et les composants sont préparés, puis vole la coupe de collecte d'embryons, la plaque de gélose de pomme jus et GFP sont mis ensemble pour créer l'environnement d'embryon de pose. Dans la deuxième phase, les oeufs et les embryons qui sont définies sur des assiettes de pommes de l'agar jus sont recueillis. Dans la troisième phase, les embryons sont retirés de la plaque, mise en scène et transféré à la chambre de montage. Dans la quatrième phase, les embryons sont montés imagé sur un microscope confocal.
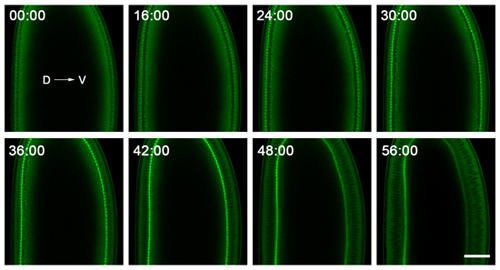
Figure 2. Les données représentatives de imagerie time-lapse de cellularisation. Embryons sont montés avec dorsale (D) et ventrale (V) côtés clairement visibles, et sont imagés à proximité de leur milieu pour suivre les invaginations membranaires en coupe. L'embryon montré ici exprime une GFP-myosine-2 sonde 6, qui se concentre à l'extrémité des invaginations membrane plasmique. Ainsi, le suivi de l'ingression de ce front au cours du temps donne la vitesse à laquelle la membrane plasmique s'invagine. Le point le temps 0:00 minute correspond à l'apparition cellularisation. Peu de temps après le point de temps minute 56:00, gastrulation commence sur la face ventrale de l'embryon. Bar est de 40 microns.
Film 1. Représentant du film imagerie time-lapse de cellularisation. Ce film correspond à la figure 2. Pour enregistrer la totalité du processus de cellularisation, l'imagerie a commencé dans le cycle mitotique avant 13, la capture de régression sillon pseudocleavage, et s'est poursuivie jusqu'en mouvements de gastrulation ont été vus sur la face ventrale de l'embryon. Les images ont été collectées à intervalles d'une minute. Les intensités ont été augmentées post-acquisition pour le rendre plus facile de voir les mouvements de gastrulation.
Cliquez ici pour le film
| Si le calendrier de développement et * | Les changements de forme cellulaire liés à la | Un lien vers la maladie ou la santé humaine | Références récentes avec imagerie en temps réel |
| Formation de sillons pseudo-clivage (4; 90 minutes pf) | Cytokinèse | La polyploïdie et la progression du cancer 1 | Mavrakis et al., 2009 8 Cao et al., 2010 9 |
| Cellularisation (5, 130 pf minutes) | Cytokinèse | La polyploïdie et la progression du cancer 1 | Cao et al., 2008 10 Sokac & Wieschaus, 2008 11 |
| Formation de sillon ventral; invagination du mésoderme (6; 180 minutes pf) | Constriction apicale; de transition épithélio-mésenchymateuse | Cancer métastatique 2 | Fox & Peifer, 2007 12 Martin et al., 2009 13 |
| L'extension Germband (7; 195 pf minutes) | Extension convergente | Anomalies du tube neural 3 | Bertet et al., 2004 14 Blankenship et al., 2006 15 |
| Tracheogenesis (11; 320 pf minutes) | Formation du tube épithélial et la ramification | L'angiogenèse 4 | Caussinus et al., 2008 16 Gervais & Casanova, 2010 17 |
| Fermeture dorsale (14; 620 minutes pf) | Constriction apicale | 5 cicatrisation des plaies | Gorfinkiel et al., 2009 18 Solon et al., 2009 19 |
Exemples Tableau 1. Des changements de forme cellulaire imagé dans les embryons de vie volée
* Le numéro de l'étape et le temps Bownes après la fécondation (PF), lors de chaque événement commence, sont répertoriés en fonction de Campos-Ortega, 1985.
| Fly stocks | Étiquettes | Référence originale |
| Spider-GFP (95-1) | La membrane plasmique | Morin et al., 2001 22 |
| Resille-GFP (117-2) | La membrane plasmique | Morin et al., 2001 22 |
| GAP43-Vénus | La membrane plasmique | Mavrakis et al., 2009 8 |
| Courge spaghetti-GFP (SQH-GFP) | Myosine-2 | Royou et al., 2002 6 |
| E-cadhérine-GFP (ECAD-GFP) | Jonctions cellule-cellule | Oda et al., 2001 23 |
| GFP-Moesin | F-actine | Kiehart et al., 2000 24 |
| L'utrophine-Vénus (Utro-Vénus) | F-actine | Sokac et al., Résultats non publiés |
Stocks Tableau 2. Utiles pour le changement de forme d'imagerie cellulaire dans des embryons de volée
Discussion
Le protocole décrit aux présentes permettra de vivre, l'imagerie confocale d'un certain nombre de changements de forme cellulaire dans l'embryon de mouche en développement. Stocks GFP pour l'imagerie peut être préparé par un laboratoire individuel (tableau 2), mais beaucoup de ces stocks sont également accessibles au public à partir des centres tels que la drosophile Bloomington Stock Center à l'Université d'Indiana ( http://flystocks....
Déclarations de divulgation
Remerciements
Nous remercions chaleureusement Eric Wieschaus, qui a fourni la base sur laquelle ce protocole a été développé. Notre travail est soutenu par un ministère Verna & Marrs McLean, de Biochimie et Biologie Moléculaire Start-up Award, Baylor College of Medicine.
matériels
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
Références
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. u. f. a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. a. r. t. i. n. e. z., A, . Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon