Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Изображениями сотовый изменения формы в живых Drosophila Эмбрионы
В этой статье
Резюме
Раннее развитие плодовой мушки, дрозофилы, характеризуется количеством клеточных изменения формы, которые хорошо подходят для работы с изображениями подходов. В данной статье описываются основные инструменты и методы, необходимые для живых конфокальной микроскопии эмбрионов дрозофилы, и сосредоточится на изменение формы клеток называется cellularization.
Аннотация
The developing Drosophila melanogaster embryo undergoes a number of cell shape changes that are highly amenable to live confocal imaging. Cell shape changes in the fly are analogous to those in higher organisms, and they drive tissue morphogenesis. So, in many cases, their study has direct implications for understanding human disease (Table 1)1-5. On the sub-cellular scale, these cell shape changes are the product of activities ranging from gene expression to signal transduction, cell polarity, cytoskeletal remodeling and membrane trafficking. Thus, the Drosophila embryo provides not only the context to evaluate cell shape changes as they relate to tissue morphogenesis, but also offers a completely physiological environment to study the sub-cellular activities that shape cells.
The protocol described here is designed to image a specific cell shape change called cellularization. Cellularization is a process of dramatic plasma membrane growth, and it ultimately converts the syncytial embryo into the cellular blastoderm. That is, at interphase of mitotic cycle 14, the plasma membrane simultaneously invaginates around each of ~6000 cortically anchored nuclei to generate a sheet of primary epithelial cells. Counter to previous suggestions, cellularization is not driven by Myosin-2 contractility6, but is instead fueled largely by exocytosis of membrane from internal stores7. Thus, cellularization is an excellent system for studying membrane trafficking during cell shape changes that require plasma membrane invagination or expansion, such as cytokinesis or transverse-tubule (T-tubule) morphogenesis in muscle.
Note that this protocol is easily applied to the imaging of other cell shape changes in the fly embryo, and only requires slight adaptations such as changing the stage of embryo collection, or using "embryo glue" to mount the embryo in a specific orientation (Table 1)8-19. In all cases, the workflow is basically the same (Figure 1). Standard methods for cloning and Drosophila transgenesis are used to prepare stable fly stocks that express a protein of interest, fused to Green Fluorescent Protein (GFP) or its variants, and these flies provide a renewable source of embryos. Alternatively, fluorescent proteins/probes are directly introduced into fly embryos via straightforward micro-injection techniques9-10. Then, depending on the developmental event and cell shape change to be imaged, embryos are collected and staged by morphology on a dissecting microscope, and finally positioned and mounted for time-lapse imaging on a confocal microscope.
протокол
1. Соберите Кубка эмбрионов коллекции
- Отрежьте нижнюю офф 100 мл Tri-кукурузы стакан с бритвой, делая края как можно более гладко. Чашки легче обращаться, если вы также отделка трех углах офф топ, хотя это не является абсолютно необходимым.
- Отрежьте квадратный из проволочной сетки (6 см х 6 см). На подогретого плитке, внутри вытяжного шкафа, слой квадрата сетки в верхней части тяжелой алюминиевой фольги. Нажмите края вырезать дно чашки твердо на горячую сетку. Подождите несколько секунд, и поднять чашку с сеткой теперь прилагается. Если фольга также палки, только кожура его.
- Прохладный чашки на ночь. Удалите излишки сетки с ножницами и песка от острых краев с мелкозернистой наждачной бумагой.
2. Сделать Яблока Плиты Сок Агар
- В 6L колбу, объединить 100 г BD Бакто агар и 3 л дистиллированной воды. Автоклав агара в течение 30 минут на медленном настройка выхлопа.
- В 2L колбе с мешалкой, объединить 100 г сахарозы, 1 л яблочного сока и 6 г р-гидроксибензойной кислоты. Тепло решение до кипения при помешивании на горячей плите. Не кипятите в течение более 2 минут. Разрешить смесь яблочного сока, чтобы охладиться, а затем добавить с мешалкой, чтобы агар. Смешайте полностью.
- Разрешить комбинированное решение для охлаждения в 60 ° С водяной бане перед заливкой в 60x15 мм чашках Петри. Кроме того, перистальтического насоса могут быть использованы для обойтись агара. Разрешить пластины для охлаждения до комнатной температуры в течение не менее 4 часов. Стек в Rubbermaid контейнеров со слоем мокрой салфеткой и хранят при температуре 4 ° C.
Примечания:
- Осенью или зимой, это может быть необходимо добавить еще 100 мл воды в агар.
- Марки чашках Петри важно! Только BD Сокол блюда подходят Tri-кукурузы стаканы. Конкретные информации о заказе можно найти в таблице ниже материалы.
3. Добавить GFP летит в Кубках эмбрионов коллекции
- Развернуть GFP запасов в соответствии с вашими потребностями коллекции, создав бутылки мух примерно за две недели до визуализации. Одна бутылка мухи, как правило, более чем достаточно, чтобы заполнить один эмбрион коллекции чашку с минимум 50 женщин и 30 мужчин. Для лучшей укладки, мухи должны быть вновь eclosed (то есть меньше чем за 5 дней после вылупления).
- Сделать дрожжей пасты, заполнив небольшую чашку с примерно равными частями Красной Звезды активных сухих дрожжей и дистиллированной воды, и движение, пока дрожжи не растворится. Паста должна приблизительный согласованность мокрой арахисового масла. Более дрожжей или воды могут быть добавлены для изменения консистенции. Дрожжи пасты могут быть использованы в течение нескольких дней, и должны быть сохранены, накрытый, при 4 ° C.
- Как только дрожжи паста готова, снимите пластины яблочный сок от 4 ° C хранения. Подряд яблочного сока пластин с дрожжами пасты, и дать им прогреться до 22-25 ° С, что будет способствовать откладки яиц.
- Сложите круговой фильтровальной бумаги в два раза, то в полтора раза. Обрезать до 8-9 см в диаметре, и сделать аккордеон складки в четверть круга. Открываются круг, инвертировать, и вставить его в коллекцию чашку до касания сетки. Убедитесь, что бумага является безопасным в чашку так, чтобы он не упал и сокрушить мух. Фильтровальная бумага не является обязательным, но предоставляет благоприятные условия для спаривания, и поддерживает влажность в чашке.
- Этикетка чашку с названием акции и дату. Передача мух от бутылки для сбора пены, осторожно встряхивая бутылку перевернутой чашки, крышки и сразу же чашку с подготовленный фундамент яблочного сока. Закрепите пластину чашку с резинкой. Установите чашки сетку стороной вверх в районе с прямой свет. Убедитесь в том, что ни тени падают на чашку, как мухи не трону, а в темное время суток.
- Изменение пластины яблочный сок по мере необходимости. Двухчасовая коллекций, при комнатной температуре, хорошо работают для визуализации cellularization.
4. Подготовка Монтаж палаты
- Для подготовки установки камеры для эмбрионов, вырезать кусок двухсторонней ленты 2-3 см длиной и поместить его на слайд, выравнивая длинной оси ленты и слайдов. Отрежьте второй 2-3 см длиной кусок двухсторонней ленты и слой его поверх другой кусок ленты, убедившись, что их края выровнены.
- Использование лезвие бритвы, делают два разреза примерно на 3 мм друг от друга в центре ленты и перпендикулярно длинной оси слайда. Удалите ленту между разрезами, чтобы сделать канал. Внесите каплю Хладон 27 Масло в канал. Этот канал, где эмбрионы будут смонтированы.
Примечания:
- Только скотч ½ дюйма двусторонней ленты толщиной право для размещения эмбрионов.
- Хладон 27 Масло кислорода проницаемой, и так позволяет кислородный обмен, предотвращая обезвоживание эмбрионов. Из-за его преломления, хладон 27 Масло также идеально подходит для постановкии изображения эмбрионов.
5. Dechorionate Эмбрионы
- Для сбора и dechorionate эмбрионов, залить достаточно 50% отбеливателя на агар яблочный сок пластины, чтобы полностью погрузиться всей поверхности. Использование рассекает микроскоп, такие как Zeiss Discovery V8 в проходящем свете, следите за эмбрионы для освобождения от хориона. Как только хориона разрыхляет и освобождает от нескольких эмбрионов (30-60 секунд), залить отбеливателем и эмбрионов в ячейку фильтра.
- Вымойте эмбрионов в фильтр немедленно и энергично с дистиллированной водой из шприца бутылку. Dab фильтр на бумажных полотенцах. Если какой-либо розовые видно на полотенце после вытирая, продолжают мытье эмбрионов с водой.
- Используйте влажную кисть для передачи 10-50 эмбрионов чистый яблочный сок пластиной (без дрожжей вставить). Вика от воды с разорванной края бумажным полотенцем и сразу же покрытие эмбрионов с небольшим количеством Хладон 27 Нефть.
Примечания:
- Не используйте отбеливатель Clorox. Вместо этого используйте бренда, такие как A-1 Остина Коммерческая Bleach, которая <6% гипохлорита натрия.
- Чрезмерное отбеливание или недостаточное полоскание приведет к мягким эмбрионов с нерегулярными cellularization.
6. Этап и горы Эмбрионы
- Использование рассекает микроскопом в проходящем свете, следуйте морфологического направления Bownes 20 до стадии эмбриона на тарелку. Использование щипцов, передача 5 митотического цикла 11 или 12 эмбрионов, соответствующие Bownes 4-й стадии, на канале монтажа камеры. Упорядочить эмбрионов в линию, с дорсальной и вентральной сторон видимой и боковой стороной вниз. Эмбрионы легко организовать в этой ориентации на нефть в одиночку. Не толпы эмбрионы вместе, как они будут лишать своих соседей кислорода раз покровное стекло наносят ниже. (Оставить примерно половина эмбрионов длиной между ними).
- Положите один край крышки 25x25 мм поскользнуться на двухсторонней ленты на одной стороне канала. Оставьте покрытие скольжения для покрытия канала. Если воздух под поймали, нанесите небольшое количество Хладон 27 Нефть на краю крышки скольжения. Капиллярное действие будет тянуть масла в канал и вытолкнуть воздух.
Примечания:
- Другим отличным ресурсом для постановки эмбрионов заключается в следующем: Кампос-Ортеги, JA и Хартенштайн, В. (1985). Эмбриональное развитие дрозофилы. Springer-Verlag, Berlin. Хотя эта книга больше не опубликованы, используемых копий регулярно доступна на Amazon.com.
- Всегда используйте Хладон 27 Масло экономно. Это позволит сделать монтаж проще. Это также поможет избежать случайных просачивание нефти на микрообъектив в следующих шагах обработки изображений.
7. Изображение Эмбрионы
- Как вы продолжите здесь, конечно, будет продиктовано изменением формы клеток, что вы с изображениями, и вопрос, который вы обращаетесь. Для любого изменения формы, разместить монтаже камеры на любой прямой или инвертированный микроскоп, найти своего эмбрионов в проходящем свете, а затем переключиться на конфокальной микроскопии, чтобы сосредоточиться на интересующей нас области. Придерживаться наилучшей практики для конфокальной микроскопии, таких, как те, которые обсуждались на MicroscopyU Никона ( http://www.microscopyu.com/articles/confocal ). Будьте особенно строгим в разоблачении вашей жизни эмбрионов до всего лишь мощность лазера насколько это возможно, чтобы предотвратить фотообесцвечивания и фототоксичности.
- Для cellularization, мы изображение на 710 Zeiss лазерной сканирующей конфокальной микроскопии, используя C-Apochromat 40x/1.2 W Corr цели. Этот микроскоп расположен в контролируемой температурой комнаты, с температурой от 18-20 ° С. Хотя контроль температуры не является абсолютно необходимым, то лучше для микроскопа и делает изображение более последовательными. Мы регулярно изображение в одной плоскости, около середины эмбриона, следовать впячивания плазматической мембраны в поперечном сечении (рис. 2). Для просто следуют динамике инвагинации, 30-60 секундными интервалами являются достаточными для покадровой обработки изображений, и эмбрионы должны выдерживать визуализации для> 90 минут без каких-либо явных признаков недостатка кислорода.
- После получения изображения, они могут быть проанализированы с использованием любого количества пакетов для анализа изображений, в том числе бесплатных от Национального института здоровья, называемый ImageJ ( http://rsbweb.nih.gov/ij ). Затем данные могут быть представлены в виде фильмов (Movie 1), последовательности (рис. 2), или kymographs 21.
Примечание:
- Погружения в воду С-Apochromat 40x/1.2 W Corr цели хорошо подходит для работы с изображениями возле эмбриона средней части из-за его высокой светосилой, что ограничивает аберраций для глубоких изображений тканей в водных образцов, и дает высокое разрешение и высокая флуоресцентный сигнал. Кроме того, эта цельимеет очень большое рабочее расстояние (220 мкм). Однако другие погружением в воду или глицерин цели будет хорошо, особенно если изменение формы клеток интересов могут быть отображены рядом эмбриона поверхности.
8. Альтернативный метод: Гора Эмбрионы с "эмбрион-клей"
- Чтобы создать образ, изменение формы клеток, кроме cellularization, это может быть необходимо смонтировать эмбрионов в определенной ориентации, которые не легко поддерживать на нефть в одиночку. Для этого, используйте альтернативный метод монтажа на описанную ранее. Начните с создания "эмбрион-клей", объединив 20 см двухсторонней ленты с 250 мкл гептана в сцинтилляционный флакон. Место сцинтилляционный флакон на nutator или вращающейся платформе, и соединение в одночасье.
- Dip желтый наконечник пипетки в эмбрион клей, а затем проследить за кончик по слайду, оставляя следы клея. В то время как гептан испаряется, выровнять поставил эмбрионов в требуемом положении на блоке агар. (Помните, что эмбрион поверхности для включения в образ должен быть обращен агара. Например, для изображения формы клеток изменяются в процессе образования вентральной борозды, смонтировать эмбрионов с вентральной стороне, обращенной агара.)
- Обратить слайд с клеем, и слегка нажмите следы клея от эмбрионов на агар блока. Теперь инвертируйте слайд снова. Эмбрионы будут застрял в соответствующей ориентации. Добавить два слоя двухсторонней ленты по обе стороны от эмбрионов, покройте их Хладон 27 Нефть и применять покровное. Приступить к визуализации, как описано выше.
9. Представитель Результаты:
Если эмбрионы были здоровыми и изображений является оптимальным, то cellularization должны 50-60 минут, и впячивания плазматической мембраны должны попадание почти 40 микрон. Однако, если эмбрионы более отбеленной, кислорода лишен или повреждены фототоксичности, то инвагинации либо замедлить или остановить, особенно в отображаемой области. Такое ухудшение здоровья эмбриона часто приводит к развитию изменен, и неспособность люк, как личинки. Таким образом, для строгий тест для анализа здоровья эмбриона после съемки, сохранить слайды в увлажненной камере и наблюдать за штриховкой на следующий день.
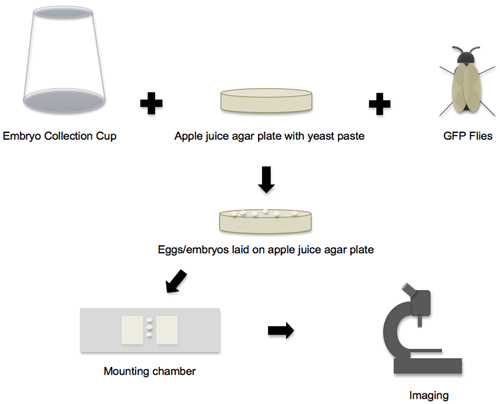
Рисунок 1. Workflow из эмбриона коллекцию изображений. Документооборота протокол может быть разбита на четыре основных этапа. В первой фазе все отдельные материалы и компоненты готовы, а затем чашку эмбриона сбора, яблочный сок пластины агара и GFP мух положить вместе, чтобы создать эмбрион прокладке окружающей среды. На втором этапе, яйца и эмбрионы, которые заложены на пластинках агара яблочный сок собирают. На третьем этапе, эмбрионы снимают с пластинки, постановка и переданы в монтаже камеры. На четвертом этапе, установленный эмбрионы отображается на конфокальной микроскопии.
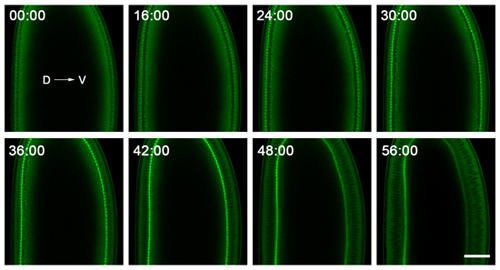
Рисунок 2. Представитель данные из замедленная съемка cellularization. Эмбрионы с установленными на спинной (D) и вентральной (V) стороны хорошо видно, и в образ будут включены около их среднего следовать впячивания плазматической мембраны в поперечном сечении. Эмбриона показано здесь выражает GFP-миозина-2 датчика 6, который концентрируется на концах впячивания плазматической мембраны. Таким образом, отслеживая проникновению этого фронта в течение долгого времени дает скорость, с которой плазматической мембраны впячивается. 0:00 минутный точка соответствует cellularization начала. Вскоре после 56:00 момент времени минуте, гаструляции начинается на брюшной стороне зародыша. Бар находится в 40 микрон.
Фильм 1. Представитель фильма с покадровой визуализации cellularization. Этот фильм соответствует Рисунок 2. Чтобы записать весь процесс cellularization, работы с изображениями начали в предыдущем цикле митотические 13, захватив регрессии pseudocleavage борозду, и продолжалась до гаструляции движения были замечены на брюшной стороне зародыша. Изображения были собраны интервалом в одну минуту. Интенсивности были увеличены после приобретения, чтобы сделать его легче увидеть гаструляции движений.
Щелкните здесь для кино
| Развития событий и времени * | Сотовые формы изменений, связанных с | Ссылаются на болезни или здоровья человека | Последние ссылки с живыми изображениями |
| Псевдо-расщепления борозды образование (4; 90 минут PF) | Цитокинез | Полиплоидия и прогрессии рака 1 | Мавракис и соавт., 2009 8 Цао и соавт., 2010 9 |
| Cellularization (5, 130 минут в ПФ) | Цитокинез | Полиплоидия и прогрессии рака 1 | Цао и соавт., 2008 10 Sokac & Wieschaus, 2008 11 |
| Брюшной формирование борозды; мезодермы инвагинации (6, 180 минут в ПФ) | Апикального сужения; эпителиально-мезенхимальных перехода | Рак метастазы 2 | Fox & Peifer, 2007 12 Мартин и соавт., 2009 13 |
| Germband расширение (7; 195 минут в ПФ) | Конвергентная расширение | Дефекты нервной трубки 3 | Bertet и соавт., 2004 14 Бланкеншип и соавт., 2006 15 |
| Tracheogenesis (11; 320 минут в ПФ) | Эпителиальные формирование трубки и ветвление | Ангиогенез 4 | Caussinus и соавт., 2008 16 Жерве и Казанова, 2010 17 |
| Спинной закрытия (14; 620 минут в ПФ) | Апикального сужения | Заживление ран 5 | Gorfinkiel и соавт., 2009 18 Солон и соавт., 2009 19 |
Таблица 1. Примеры изменения формы клеток отображаемого в живых эмбрионов летать
* Количество Bownes сцене и время после оплодотворения (р), когда каждое событие запускается, перечислены в соответствии с Кампос-Ортеги, 1985.
| Fly акции | Этикетки | Ссылка на первоисточник |
| Spider-GFP (95-1) | Плазменная мембрана | Морин и соавт., 2001 22 |
| Resille-GFP (117-2) | Плазменная мембрана | Морин и соавт., 2001 22 |
| GAP43-Венера | Плазменная мембрана | Мавракис и соавт., 2009 8 |
| Спагетти Сквош-GFP (Sqh-GFP) | Миозина-2 | Royou и соавт., 2002 6 |
| E-кадгерина-GFP (ECAD-GFP) | Межклеточных контактов | Ода и соавт., 2001 23 |
| GFP-Moesin | F-актин | Kiehart и соавт., 2000 24 |
| Атрофин-Венера (Утро-Венера) | F-актин | Sokac и соавт., Неопубликованные результаты |
Таблица 2. Полезное запасов для работы с изображениями формы клеток изменение летать эмбрионов
Обсуждение
Протокол, описанный здесь позволю жить, конфокальной микроскопии ряда изменений формы клеток в развивающемся эмбрионе летать. GFP запасов для работы с изображениями могут быть получены отдельные лаборатории (табл. 2), но многие из таких запасов также публично доступных из центров, таких ...
Раскрытие информации
Благодарности
Мы выражаем искреннюю благодарность Эрик Wieschaus, которые предоставили фундамент, на котором этот протокол разработан. Наша работа опирается на Верна и Маррс Маклин кафедры биохимии и молекулярной биологии запуск Award, Бейлор медицинский колледж.
Материалы
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
Ссылки
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. u. f. a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. a. r. t. i. n. e. z., A, . Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены