Method Article
GFP -アクチンを発現するライブ内皮細胞におけるアクチン細胞骨格の研究
要約
GFP -アクチンを発現している生内皮細胞の顕微鏡イメージングは、細胞骨格構造の動的変化の特性評価が可能になります。固定標本を使用する技法とは異なり、この方法は前と同じ細胞内のアクチン細胞骨格の時間的変化の詳細な評価、中、および様々な物理的、薬理学的、または炎症性刺激の後にしています。
要約
微小血管内皮細胞は、流体と溶質の選択的透過性障壁として重要な役割を果たしている。内皮細胞間の接着剤接合は、内皮の透過性を調節し、そして多くの研究では、接合部の整合性1-5を決定するために、アクチン細胞骨格の重要な貢献を示している。皮質アクチンのベルトは、安定した接合部1、2、4、5の維持に重要であると考えられている。対照的に、アクチンストレスファイバーは接合2-5を弱める内皮細胞内の求心緊張を生成すると考えられている。ずっとこの理論のは内皮細胞が血管内皮透過性を高めるために知られている炎症性メディエーターで処理し、細胞を固定し、顕微鏡観察のためにF -アクチンのラベル付けされた研究に基づいている。に固定された細胞の画像のみスナップショットを提供するため、しかし、これらの研究は、アクチン細胞骨格の役割を非常に限られた理解を提供するアクチンの構造5のダイナミクスに関する情報がないと時間。
生きた細胞のイメージングは、内皮障壁の完全性を決定するメカニズムの研究にアクチン細胞骨格の動的な性質に取り込むことができます。この方法の大きな利点は、内皮細胞でのアクチンの構造上の様々な炎症性刺激の影響は、固定標本を観察するときに発生する可能性のある潜在的なバイアスを除去する、治療前と後の生細胞の同じセットで評価することができるということです。ヒト臍帯静脈内皮細胞(HUVEC)をプラスミドGFP -β-アクチンをトランスフェクションし、ガラスのカバースリップ上でコンフルエンスまで増殖されています。コンフルエントHUVECにおけるGFP -アクチンの時間経過の画像は、内皮障壁の完全性の時間依存性の変化を誘導する炎症性メディエーターを添加する前と後にキャプチャされます。これらの研究は、内皮に貢献するアクチン細胞骨格の変化の流体シーケンスの視覚的な観察が可能lのバリアの破壊と修復。
我々の結果は一貫して内皮細胞の局所、アクチン豊富な葉状仮足の形成と売上高を示しています。アクチンストレスファイバーの形成と動きも観察することができます。炎症性刺激による治療の前と後のローカル葉状仮足の形成やターンオーバーの頻度の分析は、カイモグラフ解析によって文書化することができます。これらの研究は、内皮障壁の完全性の維持のための重要な以前に正体不明の分子機構を発見するために使用することができる内皮細胞におけるアクチン細胞骨格の動的な性質に関する重要な情報を提供しています。
プロトコル
1。 GFP -アクチンによるHUVECのトランスフェクション
- 様々な方法がHUVECをトランスフェクションすることができます。私たちの研究室では、以下に概説するNucleofectorシステム(ロンザ、バーゼル、スイス)を使用します。一般的に、細胞の生存およびトランスフェクション効率を向上させるために迅速に働く。各トランスフェクションには2つのガラス製カバースリップ(コーニング第1番、22 × 50 mm)の上に播種される5 × 10 5 HUVECが必要です。 Nucleofectorは、プラスミドDNAをトランスフェクトするためにエレクトロポレーションおよび化学試薬を組み合わせ、一般的に> 50%の発現効率を実現しています。ケミカルトランスフェクション試薬は、代替の方法です。一つのグループは、正常にGenePORTER試薬6を使用して GFP -アクチンとのウシ内皮細胞をトランスフェクトした。私たちが使用するNucleofectorプロトコルは以下に説明されています。
- 滅菌済みculturewareまたは通常のカバースリップは、チャンバーの種類に応じて、使用することができます。ガラス製カバースリップの場合は、10 cmの培養プレートにそれらを置くことによって生物学的安全フード内で滅菌する2分間70%エタノールの約5 mlを入れた。別々の培養プレートの側面にそれらをたれで滅菌ピンセットで乾燥した空気とそれらを拾う。
- 一度乾燥した、独自の10 cm培養プレートの各カバースリップを配置。その後ピペットカバースリップの中心で暖かいゼラチン溶液のビーズ300μLの塩化ナトリウム(NaCl 0.9%1.5%)とそれが5分間放置する。、と吸引。エッジに触れることなく、中心にこの行列のコーティングを維持、細胞が密に播種されるとすぐに合流を達成することが保証されます。
- EGM2MVメディア(ロンザ)500μLのトランスフェクションごとに一つの1.5mlマイクロチューブを用意し、° C、5%CO 2インキュベーター37に置いておきます。
- 0.25%トリプシン- EDTAでHUVECをデタッチし、15 mLコニカルチューブに集める。細胞を数える。 5 × 10 5細胞は、それぞれのトランスフェクションのために必要とされる。 transfeの数を掛けた5 × 10 5細胞を含むペレットを得るために細胞懸濁液の量を調整する実行するctions。
- 室温で3分間、5000rpmでの臨床遠心機で細胞懸濁液を遠心してください。可能な限り多くのメディアを削除するには、傾斜管によって上清を吸引除去する。
- HUVECまたはプライマリ内皮細胞Nucleofectorキット(ロンザ)のどちらかから基本Nucleofectorソリューションでペレットを再懸濁します。 5 × 10 5細胞あたり100μLを使用してください。このソリューションの毒性のために、それは細胞をこの溶液に懸濁している間に素早く作業することが重要です。
- トランスフェクションのサンプルにプラスミドGFP -β-アクチンのベクトルを(Nucleofector懸濁液100μLあたり0.2〜2μg)を追加。トランスフェクション当たり5 × 10 5細胞あたりのGFP -アクチンプラスミドDNAの0.2〜2μgの。
- Nucleofectorキュベットに細胞懸濁液100μLを転送する。キュベットをカバーし、タップ細胞懸濁液を確実にするために倍の数は底にすべての方法です。
- Nucleofector IIデバイスキュベットスロットにキュベットを配置し、dを実行します。esiredエレクトロポレーションプログラム。我々は、HUVECのプログラム- 034を使用してください。
- 生物学的安全のフードにキュベットを返します。フードにEGM2MVの500μLを含む37℃のインキュベーターからマイクロチューブの1本を持参してください。 Nucleofectorキットに付属の転送ピペットのいずれかを使用して、静かにキュベットに細胞懸濁液にメディアの暖かい500μLを加える。 15分間インキュベーターにマイクロチューブや場所に戻ってキュベットの内容のすべてを譲渡する。細胞が回復できるようにする。
- より多くの細胞がトランスフェクトされる場合は、必要に応じて繰り返します9-11を繰り返します。
- トランスフェクトされたHUVEC懸濁液600μLを含むいずれかのマイクロ遠心チューブは2つのカバースリップ上に播種することができます。フードの下、1000μLマイクロピペットで、穏やかに懸濁液を混合し、次にゼラチンでコーティングされたカバースリップ上に直接懸濁液300μLを配置するために一回上下にピペッティングし。サスペンションは、カバースリップの端に接触させてはいけません。 37℃/ 5%CO 2の場所インキュベーターは1-4時間細胞接着を可能にする。
- 1から4時間後、彼らはカバースリップに接続されていることを確認するためにトランスフェクトした細胞を検査する。その後EGM2MVメディアの10 mLを加え、そして37に板に戻ります° C / 5%CO 2インキュベーター。 GFP -アクチンの発現は、通常は4-8時間以内に観察することができます。実験は、通常、24から48時間以内に実行されます
2。生細胞イメージングチャンバーとステージヒータの設定
- 我々の研究のほとんどは、我々は、重力流システムによって供給されるPH - 1段階のヒーターに置かワーナーインスツルメンツオープンダイヤモンド風呂(RC22)を、使用している。しかし、いくつかのオプションは、ガラス底の培養皿に、オープンとクローズチャンバー、及び様々なmicroincubator /客観ヒーターの組み合わせは、大規模なインキュベーターシステムに対応チャンバーを含む生細胞イメージングのステージ、利用可能です。最終的に、チャンバーの選択は、WHE、テストエージェントまたは薬剤を追加するには、バスにアクセスする必要性などの要因に依存しますそこに培地は、静的または流れにあり、実験の長さになります。さらに、時々温度不安定性などの要因は、フォーカスのドリフトを引き起こす可能性、そして安定したバスタブと客観的な温度を維持できる制御システムを最小限に抑えることができます。
- 実験のための十分な培地のアリコート。実験は続くそれぞれの時間のために、我々は、分注しアルブミン生理食塩液50ml(表1 APSS)。
- どちらポンプや重力流システムは、チャンバーに培地を提供するために使用することができます。私たちのシステムでは、インラインヒーター(ワーナーインスツルメンツモデルSH - 27A)に接続されている静脈のフローライン、から構築されたシンプルな重力流システムにAPSSを追加します。我々は、約40 mLの/ hで流れを適用する
- 私たちのような露天風呂のチャンバーを使用する場合は、ダイヤモンドのバスの下側にして綿棒で外側の縁に真空グリースを塗布してください。次に、我々は、インキュベーターのひとつのセルで覆われたカバースリップを取得し、ゆっくりと鉗子を用いてカバースリップを持ち上げる。 Gentlyは、細胞に覆われた側のウェットを保ちながら余分な培地を吸い取るためにキムワイプに裏面には触れない。細胞を表向きにして、チャンバーを形成するためにカバースリップ上のダイヤモンドのバスを配置。
- すぐにステージヒーターに室を配置し、チャンバーを介してクランプを手で締めます。この段階での主要な関心事は、細胞が乾燥する可能性があります。したがって、それを迅速に動作することが重要です、終わったら、すぐにピペット〜乾燥から細胞を防ぐために、チャンバーに培地1mL。
- 私たちのチャンバーは細胞上の培地の安定したフローが可能になります。ただ流れをオンにする前に、それは過剰な培養液(APSS)の出口を許可するチャンバー上のホルダーに真空ホースを接続することが重要です。インラインヒーターや風呂釜もこの時点(37℃)オンにする必要があります。私たちのシステムはまた、バスの端に配置する必要がある温度を監視するサーミスタプローブを、持っています。
- 慎重に共同の裏側を拭く残りEGM2MVメディアと塩の蓄積を削除するには70%エタノールを浸したキムワイプでverslip。乾いたキムワイプまたはレンズペーパーで2回目を拭きます。
- チャンバーがセットアップされた後に、流れがオンになっていて、温度は37℃で安定であり、細胞の少なくとも30分は、実験を開始する前に調整して安定化することができます。
- 待っている間、ライブセルイメージング顕微鏡(ランプ、フィルタホイールコントローラ、カメラ、コンピュータ)のすべてのコンポーネントをオンにします。
3。ライブセルイメージング顕微鏡によるデータの取得
- 様々な生細胞の顕微鏡システムが利用可能です。私たちのシステムは、次のコンポーネントでニコンのEclipse TE - 2000Uです。
- サターインスツルメンツラムダLS 300 Wキセノンランプ
- SmartShutterとS492フィルターとサターインスツルメンツラムダ10月3日励起フィルターホイール(D350とS572エキサイターフィルターはUVとRFPのアプリケーションにも使用可能です)
- ダイクロイック2002bsエミッタ(ニコン61002メートル)
- CI計画フルアー10X DLLの目的、NA 0.30(ニコンMRH10100)
- 計画フルアーELWD 40X DM目的、NA 0.60(ニコンMRH08420)
- プランアポVC 100Xの油浸対物、NA 1.40(ニコンMRD01901)
- Photometrics CoolSNAP HQ2カメラ、1392 × 1040画像アレイ、6.45 X 6.45μmのピクセル
(ローパーサイエンティフィック) - 我々はまた、画像収集に使用できる2つのソフトウェアパッケージを持っている。ニコンの要素- AR 3.0、およびMetamorph 6.1。
- セルの表示および研究のための適切な領域を発見した後、粗フォーカスノブをロックし、そのため、ソフトウェアの取得設定を確認してください。
- フィルターホイールはS492フィルター(私たちの設定で"FITC"というラベル)に設定されています
- 買収のソフトウェアでは、客観的には所望の倍率を(私達の顕微鏡は電動ですが、これはμm/ピクセル比を設定されていない)と一致するように設定されています。また、顕微鏡でoptivarレンズは1.0Xの倍率に設定されていることを確認してください。 optivを設定する1.5倍にarは信号強度を失うことを犠牲にしてしかし、倍率が増加する可能性があります。
使用される倍率は、研究の目的に依存します。最高の詳細は、高い開口数と100Xの目的は、最高の空間分解能と信号の伝送を提供します。私たちの顕微鏡は、余分な距離を必要とするさまざまなアプリケーションを対象とした長作動距離40倍の目標を装備しています。我々は同時に複数のセルを観察したいときしかし、この目的は、有用なことができ、空間分解能と信号強度を失うことのコストでしかし、細胞小器官サイズの構造を表示するために正常に動作します。信号強度がエンドポイントである、またはそのような、より高度なイメージング技術のために蛍光は顕微鏡をスペックな任意調査の場合は、100Xの目的をお勧めします。 - カメラの露光時間は0.5〜2秒の間に設定されていますこれは、細胞内のGFP -アクチンの強度に依存する。我々は一般的にBLを避けるために、可能な限り低い露光時間を使うGFP -アクチンと細胞への潜在的な毒性をeaching。
- 最高の分解能を達成するために、ビニング1で1 × 1とゲインに設定してください。我々は露光時間を減らすために2 × 2のビニングを設定しているいくつかのケースで、しかしこれは我々が時間経過の研究でオブジェクトを移動させるに作ることができる測定値の精度を低減します。
- タイムラプス設定を構成します。
- 撮影した画像を保存し、ファイル名を入力するフォルダを選択してください。
- 実験用画像との間隔期間の回数を設定します。我々は通常、画像や持続時間は最大2時間の間に15秒〜1分の間隔を使用してください。
- アクティブシャッターが買収との間で閉じれるように設定されていることを確認します。
- タイムラプス画像取得を開始する前に、部屋の照明をオフにし、設定を確認するために単一のイメージをキャプチャします。
- また、明視野イメージをキャプチャします。コンデンサーは、適切な位相またはDICフィルタに設定されていることを確認します。オンにするハロゲンランプと画像を収集する。ハロゲンランプの電源を切ります。
- タイムラプスイメージングのための"FITC"の設定に戻すと、テストイメージをキャプチャします。
- タイムラプスシリーズをキャプチャします。
実験の間、彼らが取得される画像を監視することが重要です。いくつかの例ではチャンバー内の温度の小さな変化は、フォーカスのドリフトを引き起こす可能性があります。これは、そのフローは、細胞上に安定になるように流入し、真空ラインを最適化することによって回避することができます。また、顕微鏡室でトラフィックを最小限に抑え、そして離れて顕微鏡から天井の通気孔からドラフトをリダイレクトすると便利です。我々の経験でもうまく機能している代替手段は、ステージ全体と目標を囲む37℃/ 5%CO 2インキュベーター室の使用です。これらの申し出晩以上モニタリング細胞の利点が、セルへのアクセスが制限されています。
必要に応じて、タイムラプス買収を一時停止し、画像に再び焦点を合わせる。に可能な限り迅速に再び焦点を実行する画像間の時間間隔を変更することは避けてください。 - 典型的なプロトコルは、追加の画像取り込みの0.5〜4時間続いて、テストエージェントを追加する前に、ベースラインの画像の20〜30分で構成されます。実験の長さは可能な限り最短の露光時間を選択することが重要である理由である、時間の経過とともにGFPを退色によって制限することができます。また、長く研究を希望する場合は30から60 sまでの時間経過の画像間の間隔を変更することが望ましい場合があります。
4。データ分析
- いくつかのソフトウェアパッケージは、我々は通常、私たちの研究室や自宅での任意のコンピュータ上で分析を可能にするNIH ImageJを使って私たちの画像解析を行うNISなどの要素、Metamorph、Slidebook、などの画像のセットを、分析するために使用することができます。我々が使用するバージョンは次のとおりです。
MBFはImageJ( http://www.macbiophotonics.ca/imagej/ )
フィジー(私"ターゲット="_blank"> http://pacific.mpi-cbg.de/wiki/index.php/Fiji)。 - ImageJはを含む多くの動的なプロセスを、分析するために使用できます。
- 葉状仮足の突起の周波数
- 距離、時間、および突起の速度
- 時間をかけてアクチン繊維の運動
- ImageJのでは、画像のセットはスライス番号/総スライスを開いたときにファイル名と一緒に、ウィンドウの左上隅に表示されます、ピクセル、ファイルタイプ、およびサイズの数。下部のスクロールバーZは時間に対応しています。さらに、画像の上にマウスポインタをホバリングしても、x、y、およびImageJのツールバーの下部にあるzのピクセルの位置が表示されます。
- 葉状仮足の突起は、時間の経過とともに新たな突起の数を決定することによって調べることができます。これは、セル全体の周囲や、選択した領域に対して行うことができます。このタイプの分析はまた、位相コントラストやDIC顕微鏡と非融合、トランスフェクトされていない細胞で行うことができます。しかし、GFP -アクチンを発現する細胞を使用することを含むとGFP -アクチンを欠いている細胞が互いに隣接している場合は特に、コンフルエントな単層の分析を行うことができます。
- 葉状仮足の突出距離、持続性(時間)、および速度はカイモグラフ(ラインスキャン)解析によって評価することができる。セルの端(は隣接するセル、または隣接するセルは、GFP -アクチンを発現しないがない場合はここが最も簡単です)に垂直な線を描画します。 ImageJのでは、押すと"/"dを表すx軸と、カイモグラフが生成されます。istanceとy軸を表すタイム(15秒1ピクセルあたり1分に上記の時間間隔のガイドラインにしたがって)。行が突出葉状仮足の上に描画し、ボックスの寸法は、(ImageJのにMを押して)測定することができます。距離、時間、および速度は、計算することができます。
- ストレスファイバーの動きも、同様の方法でカイモグラフ分析によって測定することができる。
5。代表的な結果:
私たちのトランスフェクションのプロトコルで、我々は一般的にトランスフェクトしたHUVECの少なくとも50%にGFP -アクチンの発現を参照してください、としばしば地域GFPを発現する、アクチンのHUVECの> 90%カバースリップ上の領域を見つけることができます。 GFP -アクチンを発現しているサブコンHUVECとの生細胞イメージング実験の例は、ムービー1に示します。この特定の実験では、画像は分ごとに買収された。映画で見られるように、HUVECにおけるGFP -アクチンは細胞質全体に、同様に糸状の構造体で観察することができます。URESと地元の葉状仮足では、セル端に沿って突出。映画の中でも、見かけ上は、GFP -アクチンの発現が細胞間の一様ではないということです。研究用に選択されたセルは、通常、繊維状アクチンを含む様々な構造を可視化するために十分なGFP -アクチンが存在している。これらの細胞では、G -アクチンの存在の高い量からF -アクチンの構造を区別するために一般的に困難であるため、GFP -アクチンの非常に高いレベルを発現する細胞は、研究で問題となる場合があります。
ムービー2は、GFP -アクチンを発現してコンフルエントHUVECの挙動の例を示しています。 subconflent HUVECと同じように、細胞の周囲に沿って、アクティブな葉状仮足の形成と売上高は明らかであった。しかし、これらの仮足は、あまり効率的な突起7を示し、膜ラッフルをもたらした。これはおそらく、近くの基層をブロックし、隣接する細胞の存在によるものです。アクチン皮質線維とストレスファイバーはビデオが1と2にも表示されます。我々はOセルもののbservedが静止して残った、ストレスファイバーは、セル端付近に形成し、彼らは8,9を分解セルの中心に向かって横方向に移動し、移動細胞内の横アーク繊維に似ています。これらの細胞で観察された追加の動的な機能は、以前はアクチン雲10という名前の、同心円状に拡大しアクチンのリング構造の形成だった。
キモグラフ分析を使用して設定する方法距離、持続性、および細胞の突起の速度はこれらのタイムラプス画像から定量化されているの例を図1に示されています。図1Aに、単一ピクセルの線をカイモグラフ(図1B)の生成のためにセル端にほぼ垂直に描画されます。このキモグラフでは、行で定義された領域は垂直方向に配置され、タイムラプス各地からの画像が水平方向に積層される。キモグラフで左から右に見ると、突起は、細胞の縁に上向きの動きとして表現されます。図1Cに、ラインは渉だったこれらの突起の一つの端にerimposed、その行に関連付けられているピクセルデータを収集し、パネルの下部にある[結果]ウィンドウに表示されます。この分析では、突起のダイナミクスの定量化を可能にし、また細胞のこの地域で突起の周波数を(突起部/時間の数)を推定するために使用することができます。
ストレスファイバーの動きの分析の例を図2に示されています。我々が観察したほとんどのストレス繊維は、細胞の周囲近傍に形成され、彼らは最終的に逆アセンブルされたセルの中心に向かって移動する。これはまたカイモグラフ分析によって定量することができる。線は(図2B)に生成されるセルの端にとストレスファイバー(図2A)とカイモグラフに垂直に描画されます。ストレスファイバーは、多くの場合、上下に動かすと右(セルの中心に向かって)に、カイモグラフの細胞質領域における連続的な線として表示されます。時々、繊維は元カイモグラフで確認するのは困難であり、これらのケースで我々画像(図2C)をシャープにするアンシャープマスクフィルタを使用してください。行は、ストレスファイバーに描かれており、ピクセルデータは、測定機能(図2D)を使用して収集されます。このデータを収集する別の方法は、繊維が(図2E)が観察されている時間の平均勾配を得るために同定されたストレスファイバーの最初から最後までラインを描画することです。この分析では、ストレスファイバー横移動の定量化を可能にし、また細胞のこの地域で観測されたストレスファイバーの数を定量化するために使用することができます。
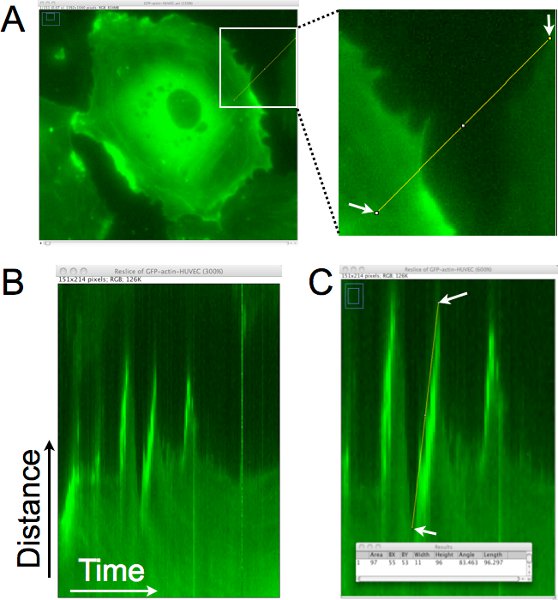
図突起の距離、持続性、そして地元の葉状仮足の速度を決定するために、セルのエッジの1。カイモグラフ分析。。単一ピクセルの線は、セルの端にほぼ垂直に描画されます。この地域は、時間の経過とともに地域のモンタージュを生成するために設定された時間経過の各画像から抽出される。Bは 。番目のキモグラフの結果の電子は、x軸は左から右に移動し、時間を表し、y軸は距離を示しています。時間をかけてセル端の移動は、このカイモグラフで評価することができる、と葉状仮足は、セル端で、右方向に移動し、上向きになる領域を同定している。Cは 。ラインは、葉状仮足によって突起が識別されているセルの端に描かれています。引かれた線に外接する四角形の大きさは、(スーパーインポーズウィンドウに示すように)買収されています。幅は、突起の時間や持続性を計算するために使用されます。高さは、突起の距離を計算するために使用されます。突起の速度は、幅が高さで除して計算されます。この例では、上向きの距離は96ピクセル× 0.16125μm/ピクセル= 15.5μmであった、と時間は、x 1 /ピクセル= 11分を最小11ピクセルだった。速度は15.5μm/11分として計算した。 = 1.4μm/分。

Fアクチンストレスファイバーの動きのigure 2カイモグラフの分析。。単一ピクセルの線はカイモグラフを生成するために、セルのエッジに対して垂直に描かれています。Bは 。図に示す。 1は、結果としてカイモグラフで、x軸は時間、y軸の距離を表します。ストレスファイバーは、多くの場合、下向きに移動し、右(矢印)Cに、セル内の連続的な線として観察されています。より良いストレスファイバーを可視化するために、アンシャープマスクフィルタを使用することができます。この例では、0.60の3ピクセルとマスクの重さの半径が使用されました。Dは 。単一ピクセルの線は、特定されたストレスファイバーの上に描画、およびデータが収集されます。このパネルでは、3つのラインが描かれていましたし、"削除"の各測定の後にその場所の恒久的な注釈(白い線)を作成するために押された。Eは 。また、平均距離、時間、およびストレスファイバーの速度が望まれる場合、行は開始と終了ポイント(黄色のライン)から描画することができる、とのデータ(結果]ウィンドウで強調表示)に取得することができるR。この例では、測定値は、37フレームのこのストレスファイバー× 1フレーム/分で行った。 = 37分。距離は、この期間は、x 0.16125μm/ピクセル= 12.1μmの75フレームだったにわたって旅した。ストレスファイバーの結果として横方向の速度は12.1μm/37min= 0.33μm/分であった。速度の正の値がセルの中心に向かって移動する繊維のために割り当てられており、周辺に向かって移動する繊維のマイナスです。
GFP -アクチンを発現しているライブHUVECの動画1。タイムラプス画像。画像間の間隔は1分です。地元の葉状仮足は細胞の全周に沿って突出する。さらに、横方向の円弧のストレスファイバーは細胞の中心に向かって横方向に移動する。トロンビン(1 U / ml)をバスに追加したときに、細胞がわずかに縮小し、葉状仮足の外側に突起は約10分間一時停止。細胞が収縮した後、葉状仮足の形成と売上高が再開 D.は、 映画を鑑賞するためにはここをクリックしてください。
映画(2)トロンビンによる治療の前と後に、GFP -アクチンを発現してコンフルエントなHUVEC。秒:経過時間が分として右下隅に表示されます。画像間の間隔は30秒です。トロンビン(1 U / ml)を45分後に追加されました。ベースライン期間。 、アクチン雲(矢印、午前1時59分 - 21時29分) - 注釈付きのイベントは地元の葉状仮足の形成と売上高を(37:29セル端の近くに矢印、0:59)含んで、およびトロンビンの後に広がる三細胞の接合部のギャップが追加されます(矢印、62:30 - 70:00)。横アークストレスファイバーは、細胞のいくつかにも明らかです。細胞は、多くのフリル膜を生じさせるとともに、その周囲に沿って地元の葉状仮足のアクティブ形成し、売上高を表示します。トロンビンは、葉状仮足の形成と売上高の一時停止を引き起こし、細胞の間にいくつかの小さな隙間の簡単な外観。https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.aviは">映画を鑑賞するためにはここをクリックしてください。
ディスカッション
生内皮細胞におけるGFP -アクチンのイメージングは、炎症性刺激に反応してアクチン細胞骨格のダイナミクスの詳細な分析が可能になります。また、このメソッドは、せん断応力11のように物理的な力に反応して細胞骨格のリモデリングを示すこれまでの知見に基づいて構築すると便利な場合があります。さらに、この方法は、マイグレーション、有糸分裂、細胞間接合部と接合部の成熟の形成、及びバリア機能の維持など、さまざまな内皮細胞の活動へのアクチン細胞骨格の動態の寄与の詳細な評価が可能になります。
示されたデータでは、内皮のアクチン細胞骨格の挙動は、トロンビンによる治療前後で観察することができます。すべての内皮細胞の縁に沿って地元の葉状仮足を形成し、非融合と合流両方の細胞の単層で時間をかけて回帰が観察された。トロンビンによる治療は一時的に葉状仮足の形を中断ationと離職。トロンビンはまた、トロンビンは内皮細胞12-14にアクチンストレスファイバーの形成と増加求心張力発生を引き起こすことが以前の報告と一致して、細胞がわずかに縮小していました。しかし、このような生細胞イメージング研究から、ストレスファイバーの起源は、今決定することができます。 HUVECにおいては、ストレスファイバーのほとんどは、細胞の周囲に発信し、細胞の8,9の移行に横アーク繊維に似ている。固定された細胞を使用する場合に比べてこの方法のもう一つの強みは、ストレスファイバーの数は、実験群の間で選択バイアスを排除し、トロンビンの治療の前と後の個々の細胞で定量化できることです。
このプロトコルでは、セルのエッジとアクチンストレスファイバーの動的な動きを評価する。内皮細胞でのアクチンの単量体のダイナミクスを理解するために、このような蛍光退色後回復(FRAP)や蛍光などのより高度な技術がマイクロスペックルコピー(FSM)は、16、15を適用することができます。微小血管内皮細胞は微小血管のバリア機能のより良いモデルを表すことができるので、さらに、効果的に微小血管内皮細胞にGFP -アクチンを発現するようにトランスフェクションプロトコールの最適化は論理的な将来の方向を表します。
要約すると、GFP -アクチンを発現している生内皮細胞のイメージングは、内皮細胞のアクチン細胞骨格は、刺激の様々なタイプに応答する方法を決定する強力なツールを表します。しっかりと密内皮単層を用いた研究は、このようなアクチンに富んだ葉状仮足および内皮バリア機能の横アークストレスファイバーなどの動的構造の役割を決定するのに役立ちます。さらに、GFP -アクチンまたは他の細胞内構造の可視化を可能にする他の融合タンパク質を発現する内皮細胞の生細胞イメージングでは、シグナリングと構造的なメカニズムを理解するために必要な詳細な時空間情報を提供することをDetermineバリアの完全性。
開示事項
利害の衝突は宣言されません。
謝辞
GFP -β-アクチンプラスミドは、寛大に博士ウェインオアー、病理学のLSUHSC - S部門によって提供された、と博士はベッキーWorthylake、薬理学のLSUHSC - NO学科の研究室で増幅した。この作品は、国立衛生研究所(P20 RR - 018766)とアメリカ心臓協会(05835386N)からの補助金によって支えられている。
資料
| Name | Company | Catalog Number | Comments |
| 1。リンガー5倍証券 | |||
| 化学 | 会社 | カタログ番号 | 量は |
| 塩化ナトリウム | EMD | SX0420 - 3 | 35グラム |
| 塩化カリウム | JTベーカー | 3040 | 1.75グラム |
| 塩化カルシウム | シグマ | C - 3881 | 1.47グラム |
| 硫酸マグネシウム | シグマ | M - 9397 | 1.44グラム |
| 滅菌ろ過された水 | N / | N / | 1 Lへ移動 |
| 4℃オートクレーブボトルや店舗に滅菌フィルターは、° C | |||
| 2。 MOPSバッファー | |||
| 化学 | 会社 | カタログ番号 | 量は |
| MOPS | シグマ | M3183 | 125.6グラム |
| 滅菌ろ過された水 | N / | N / | 1 Lへ移動 |
| 4℃オートクレーブボトルや店舗に滅菌フィルターは、° C | |||
| 3。アルブミン生理食塩水(APSS) | |||
| 化学 | 会社 | カタログ番号 | 量は |
| リンガー株式(5倍) | N / | N / | 200 mLの |
| MOPS緩衝液 | N / | N / | 5 mLの |
| リン酸ナトリウム | シグマ | S - 9638 | 0.168グラム |
| ピルビン酸ナトリウム | シグマ | P5280 | 0.22グラム |
| EDTAのナトリウム塩 | シグマ | ED2SS | 0.0074グラム |
| グルコース | シグマ | G7528 | 0.901グラム |
| アルブミン、ウシ | USB | 10856 | 10グラム |
| 滅菌ろ過された水 | N / | N / | 1 Lへ移動 |
| 37 7.4にpHを調整° C、4℃オートクレーブボトルや店舗にして滅菌フィルター℃に | |||
| 4。 0.9%生理食塩水 | |||
| 化学 | 会社 | カタログ番号 | 量は |
| 塩化ナトリウム | EMD | SX0420 - 3 | 9グラム |
| 滅菌ろ過された水 | N / | N / | 1 Lへ移動 |
| 4℃オートクレーブボトルや店舗に滅菌フィルターは、° C | |||
| 5。 1.5パーセントゼラチン溶液 | |||
| ブタの皮からゼラチン | シグマ | G2500 | 15グラム |
| 0.9%生理食塩水 | N / | N / | 1 Lへ移動 |
| ° C十分にゼラチン溶解するために37にソリューションを温める。一方、4℃オートクレーブ滅菌ボトルとストアにまだ温かい、滅菌フィルター° C | |||
参考文献
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved