Method Article
GFP-Aktin ifade Canlı Endotel Hücreleri Aktin Sitoiskelet Çalışması
Bu Makalede
Özet
GFP-aktin ifade canlı endotel hücreleri mikroskobik görüntüleme iskelet yapıları dinamik değişimlere karakterizasyonu sağlar. Sabit örneklerinde kullanan teknolojilerden farklı olarak, bu yöntem önce aynı hücrelerde aktin hücre iskeletinin temporal değişikliklerin ayrıntılı bir değerlendirme sırasında, çeşitli fiziksel, farmakolojik veya inflamatuvar uyaranlara sonra sağlar.
Özet
Mikrovasküler endotele çözünen sıvıları ve seçici geçirgen bir bariyer olarak önemli bir rol oynar. Endotel hücreleri arasındaki yapışkan kavşak endotel geçirgenliği düzenleyen ve birçok çalışmalar junctional bütünlüğünü belirleyen 1-5 aktin hücre iskeletinin önemli bir katkı koymuştur. Kortikal aktin kemeri istikrarlı kavşaklar 1, 2, 4, 5, bakım için önemli olduğu düşünülmektedir. Buna karşılık, aktin stres lifler kavşaklar 2-5 zayıflatır endotel hücreleri içinde merkezcil gerginlik oluşturmak için düşünülmektedir. Bu teorinin endotel hücreleri, endotel geçirgenliği arttırdığı bilinen inflamatuvar mediatörlerin tedavi ve sonra hücrelerin mikroskobik gözlem için sabitleme ve F-aktin etiketleme olduğu çalışmalar esas almıştır. Ancak, sabit hücrelerin görüntüler sadece anlık görüntü sağlar, çünkü bu çalışmalar aktin hücre iskeletinin rolü çok sınırlı bir anlayış sağlamakaktin yapılar 5 dinamikleri hakkında hiçbir bilgiye sahip.
Canlı hücre görüntüleme endotel bariyer bütünlüğünü belirleyen mekanizmaların çalışmalar içine aktin hücre iskeletinin dinamik yapısı dahil sağlar. Bu yöntemin en büyük avantajı, önce canlı hücreler aynı set ve tedaviden sonra değerlendirilir sabit örneklerinde gözlemleyerek oluşabilecek olası önyargı kaldırarak, endotel hücreleri aktin yapılar üzerinde çeşitli inflamatuvar uyaranların etkisi olabilir ki. İnsan umbilikal ven endotel hücreleri (HUVEC) plazmid GFP-β-aktin ile transfekte ve cam lamelleri izdiham büyüdü. Ayrıca endotel bariyer bütünlük içinde zamana bağlı değişimlere sebep inflamatuvar mediatörlerin önce ve sonra, GFP-aktin konfluent HUVEC Time-lapse görüntüleri yakalanır. Bu çalışmalar endotelin katkıda aktin hücre iskeletinin değişiklikleri sıvı sıra görsel gözlem sağlarl bariyer bozulması ve restorasyon.
Bizim sonuçlarımız, endotel hücreleri yerel, aktin-zengin lamellipodia oluşumu ve ciro sürekli göstermektedir. Aktin stres liflerinin oluşumu ve hareketi de görülebilir. Inflamatuar uyaranlara ile tedavi öncesi ve sonrası, yerel lamellipodia oluşumu ve ciro sıklığını bir analiz, kymograph analizleri ile belgelenmiştir. Bu çalışmalar endotel bariyer bütünlüğünün sürdürülmesi için önemli, önceden tanımlanmamış moleküler mekanizmalarını keşfetmek için kullanılabilir endotel hücreleri aktin hücre iskeletinin dinamik yapısı hakkında önemli bilgiler sağlar.
Protokol
1. GFP-aktin ile HUVEC Transfeksiyon
- HUVEC transfect için çeşitli yöntemler kullanılabilir. Bizim laboratuvar Nucleofector sistemi (Lonza, Basel İsviçre) aşağıda özetlenen kullanır. Genel olarak, hücre canlılığı ve transfeksiyon verimliliği artırmak için hızlı bir şekilde çalışır. Her transfeksiyon iki cam lamelleri (Corning, No: 1, 22 x 50 mm) üzerine seribaşı olacak 5 x 10 5 HUVEC gerektirir . Nucleofector plazmid DNA transfect elektroporasyon ve kimyasal reaktifler birleştirir ve genellikle>% 50 ifadesi verimliliği sağlar. Kimyasal transfeksiyon ayıraçları alternatif bir yöntem. Bir grup başarılı GenePORTER reaktif 6 kullanılarak GFP-aktin ile sığır endotel hücreleri transfekte. Kullandığımız Nucleofector protokol aşağıda açıklanmıştır.
- Presterilized Kültür varlıkları, ya da sıradan lamelleri, oda tipine bağlı olarak kullanılabilir. Cam lamelleri için biyolojik güvenlik kabini, 10 cm kültür plakasına onları koyarak sterilize2 dakika süreyle% 70 etanol içeren yaklaşık 5 ml. Steril forseps ve kuru hava ile onlara karşı ayrı bir kültür plaka yan eğilerek Pick up.
- Kuruduktan sonra, kendi 10 cm kültür plakasına her lamel yerleştirin. Pipet lamel merkezinde sıcak jelatin çözüm boncuk 300 mcL (% 0.9 NaCl içinde% 1.5) ve 5 dakika stand ve ardından aspire için bekleyin. Kenarlarına dokunmadan, bu matris kaplama merkezinde tutmak, hücrelerin yoğun seribaşı olacak ve hızlı izdiham ulaşacaktır sağlayacaktır.
- EGM2MV medya (Lonza) 500 mcL ile transfeksiyon başına bir 1.5 mL mikrofuge'ye tüp hazırlayın ve 37 ° C,% 5 CO2 inkübatör kenara koyun.
- % 0.25 'lik tripsin-EDTA ile HUVEC ayırın ve 15 ml konik bir tüp içine koyunuz. Hücre sayımı. 5 x 10 5 hücrelerin her biri transfeksiyon için ihtiyaç vardır. Transfe sayısı ile çarpılır 5 x 10 5 hücre içeren bir pelet almak için hücre süspansiyonu ses seviyesini ayarlamactions yapılacak.
- Bir klinik oda sıcaklığında 3 dakika 5000 rpm'de santrifüj hücre süspansiyonu santrifüjleyin. Mümkün olduğunca ortamı çıkarmak için devirme tüp süpernatantı aspire.
- Temel HUVEC veya İlköğretim Endotel Hücre Nucleofector Kiti (Lonza) ya Nucleofector Çözüm pelletini tekrar. 5 x 10 5 hücre başına 100 mcL kullanın. Bu çözüm toksisite nedeniyle, hücrelerin bu çözüm asılı iken hızlı bir şekilde çalışmak için çok önemlidir.
- Transfeksiyon örnek plazmid GFP-β-aktin vektör (100 mcL Nucleofector süspansiyon başına 0,2-2 mg) ekleyin. GFP-aktin plazmid DNA transfeksiyon başına 5 x 10 5 hücre başına 0,2-2 mg.
- Nucleofector Küvet hücre süspansiyonu 100 mcL aktarın. Kapak küvet ve dokunun kez hücre süspansiyonu sağlamak için birkaç altındaki tüm yol.
- Nucleofector II cihaz küvet yuvasına küvet koyun ve d çalıştırmakesired elektroporasyon programı. Biz HUVEC A-034 için programı kullanın.
- Biyolojik güvenlik kabini, küvet dönün. Kaputun EGM2MV 500 mcL içeren 37 ° C inkübatör mikrofuge'ye tüplerinin birini getirin. Nucleofector kiti sağlanan transfer pipetler birini kullanarak, nazikçe küvete hücre süspansiyonu sıcak ortam 500 mcL ekleyin. Küvet geri içeriğini mikrofuge'ye tüp ve 15 dakika için inkübatör yer aktarın. hücreleri kurtarmak için izin vermek.
- Daha fazla hücre transfekte eğer gerektiği gibi tekrarlayın 9-11 adımları.
- 600 mcL transfekte HUVEC süspansiyon içeren bir mikrofuge'ye tüp, iki lamelleri üzerine numaralı seribaşı olabilir. Kaputun altında ve 1000 mcL mikropipet, jelatin kaplı lamel üzerine doğrudan bir süspansiyon 300 mcL yere hafifçe sonra pipet ve aşağı bir kez süspansiyonu karıştırmak için, ve. Süspansiyon lamel kenarına dokunacak izin vermeyin. 37 ° C /% 5 CO 2 Yeri inkübatör hücre eki için 1-4 saat izin vermek.
- 1-4 saat sonra, lamel bağlı onaylamak için transfekte hücreler kontrol edin. Daha sonra 10 ml EGM2MV medya ekleyin ve 37 plaka dönmek ° C /% 5 CO 2 inkübatör. GFP-aktin ifade genellikle 4-8 saat içinde görülebilir. Deneyler genellikle 24-48 saat içinde yapılır
2. Canlı hücre görüntüleme odası kurma ve sahne ısıtıcı
- Çalışmaların çoğu için, PH-1 sahne ısıtıcı yerleştirilen bir ağırlık akış sistemi ile beslenen bir Warner Instruments açık elmas banyosu (RC22), kullanmıştır. Ancak, cam alt kültür yemekleri, açık vs kapalı odaları ve çeşitli microincubator / objektif ısıtıcı kombinasyonları ve büyük inkübatör sistemleri karşılamak odaları da dahil olmak üzere canlı hücre görüntüleme aşamalarında, çeşitli seçenekler mevcuttur. Sonuçta, oda seçimi bir test aracı veya ilaç eklemek için banyo erişim ihtiyacı da dahil faktörler, whe bağlıdırorta statik veya akış altında ve deney uzunluğu. Buna ek olarak, bazen sıcaklık istikrarsızlık gibi faktörler odak kayması neden olabilir, ve istikrarlı bir banyo ve objektif sıcaklıkları koruyabilirsiniz kontrol sistemleri ile minimize edilebilir.
- Deneme için yeterli orta kısım. Biz albümin fizyolojik tuz çözeltisi kısım her saat için 50 ml (APSS; Tablo 1) deney sürecektir.
- Ya bir pompa ya da yerçekimi akış sistemi odasına ortamı sunmak için kullanılabilir. Bizim sistem için, basit bir ağırlık akış sistemi, bir satır içi ısıtıcı (Warner Instruments modeli SH-27A) bağlı bir intravenöz akış hattı inşa APSS ekleyin. Biz yaklaşık 40 ml / h akış geçerlidir
- Bizimki gibi bir açık banyo odası olacaksa, elmas banyo alt ve pamuk uçlu bir aplikatör ile dış kenarına vakum gres sürün. Sonra, bir hücre kaplı lamel inkübatör olsun, ve yavaşça forseps kullanarak lamel kaldırın. Gently hücre kaplı yan ıslak tutarak fazla orta emmek için bir kimwipe arka dokunun. Hücreler yukarı yüz ile, bir oda oluşturmak için lamel üzerinde elmas banyo yerleştirin.
- Sahne ısıtıcı hızla odasına yerleştirin ve odanın içinde kelepçeler el sıkın. Bu aşamada büyük bir endişe hücrelerin kurumasına olasılığıdır. Bu nedenle hızlı bir şekilde çalışması için önemli olduğunu ve tamamlandığı zaman, hemen pipet ~ hücrelerinin kurumasını önlemek için odasına orta 1 ml.
- Odamızca hücreleri üzerinde orta kararlı akış sağlar. Sadece akışı üzerinde açmadan önce, aşırı kültür vasatı (APSS) çıkış izin odasının sahibine bir vakum hortumu takmak için önemlidir. Satıriçi ısıtıcı ve banyo ısıtıcı da bu noktada (37 ° C) açık olmalıdır. Sistemimiz aynı zamanda banyo kenarına yerleştirilmiş olmalıdır sıcaklığını izlemek için bir termistör probu vardır.
- Co alt dikkatlice silinKalan EGM2MV medya ve tuz birikmesi kaldırmak için,% 70 EtOH ile ıslatılmış bir kimwipe verslip. Kuru bir kimwipe veya lens kağıdı ile ikinci kez silin.
- Odanın kurulduktan sonra, akış üzerinde ve sıcaklık 37 sabit ° C, hücrelerin en az 30 dakika, deney başlamadan önce ayarlamak ve stabilize etmek için izin.
- Beklerken, canlı hücre görüntüleme mikroskobu (lambalar, filtre tekerlek kontrolörü, kamera, bilgisayar) tüm bileşenleri açın.
3. Canlı hücre görüntüleme mikroskop ile veri alımı
- Çeşitli canlı hücre mikroskopi sistemleri mevcuttur. Sistemimiz aşağıdaki bileşenleri ile Nikon Eclipse TE-2000U:
- Sutter Aletleri Lambda LS 300 W Xenon lamba
- Sutter Aletleri Lambda 10-3 SmartShutter ve S492 filtre ile uyarma filtre tekerleği (D350 ve S572 uyarıcı filtreler, UV ve RFP uygulamalar için de mevcuttur)
- Dikroik 2002bs yayıcı (Nikon 61002m)
- CI Planı Fluor 10X DLL Amaç, NA 0.30 (Nikon MRH10100)
- Plan Fluor ELWD 40X DM Amaç, NA 0.60 (Nikon MRH08420)
- Plan Apo VC 100X Yağ Amaç, NA 1.40 (Nikon MRD01901)
- Photometrics CoolSNAP HQ2 kamera, 1392 x 1040 görüntüleme dizi, 6.45 x 6.45 mikron piksel
(Roper Bilimsel) - Biz de görüntü elde etmek için kullanılan iki yazılım paketleri var. Nikon Elemanları-AR 3.0, ve Metamorph 6.1.
- Hücreleri inceleyen ve uygun bir çalışma alanı bulmakta sonra, kaba odak düğmesi kilitlemek ve böylece yazılım satın alma ayarlarını kontrol edin:
- Filtre tekerleği S492 filtresi (yapılandırma FITC "etiketli) için ayarlanır.
- Kazanım yazılım, objektif, istenilen büyütmede (bizim mikroskop motorlu, ancak bu mikron / piksel oranı ayarlar değildir) maç ayarlanır. Ayrıca mikroskop Optivar Objektif 1.0x büyütme ayarlanmış olduğundan emin olun. Optiv Ayarı1.5x için ar Ancak sinyal yoğunluğu kaybetme pahasına, büyütme artırabilir.
Kullanılmak üzere büyütme çalışmanın amaçları bağlıdır. En iyi ayrıntı için, yüksek bir sayısal diyafram ile 100X amacı iyi uzaysal çözünürlüğü ve sinyal iletimi sağlayacaktır. Bizim mikroskop de ekstra mesafe gerektiren farklı bir uygulama için tasarlanan uzun bir çalışma mesafesi 40X amacı ile donatılmıştır. Ancak, biz aynı anda birden fazla hücreleri gözlemlemek için istediğiniz zaman bu hedefe yararlı olabilir, ancak uzaysal çözünürlüğü ve sinyal yoğunluğu kaybetme pahasına, organel ölçekli yapıları inceleyen gayet iyi çalışıyor. Sinyal yoğunluğu bir bitiş noktası, ya da floresan mikroskobu gibi daha gelişmiş görüntüleme teknikleri speckle herhangi bir çalışma için, 100X objektif tavsiye edilir. - Kamera pozlama süresi 0.5-2 sn arasında ayarlanabilir. Bu hücreler, GFP-aktin yoğunluğuna bağlıdır. Biz genellikle bl önlemek için mümkün olan en düşük maruz kalma süresiGFP-aktin ve hücrelerin potansiyel toksisitesi eaching.
- En iyi çözünürlük elde etmek için binning, 1 x 1 ve 1 karı olmalıdır. Bazı durumlarda biz maruz kalma süresini azaltmak için 2 x 2 binning, ancak bu ölçümlerin hassas biz time-lapse çalışmasında hareketli nesneleri yapabilirsiniz azaltır.
- Time-lapse ayarları yapılandırın:
- Yakalanan görüntüleri kaydetmek ve bir dosya adı yazın klasörü seçin.
- Deneme için görüntüler ve aralık süresi kat sayısını ayarlayın. Biz genellikle görüntüleri ve süresi 2 saat kadar arasında 15 sn ile 1 dk aralık kullanın.
- Active shutter satın almalar arasında kapalı ayarlanmış olduğundan emin olun.
- Time-lapse görüntü toplama başlamadan önce, odanın ışıkları kapatmak ve ayarlarını kontrol etmek için tek bir görüntü yakalamak.
- Ayrıca bir aydınlık görüntü yakalamak. Kondenser uygun faz ya da DIC filtre olarak ayarlanmış olduğundan emin olun. Açmakhalojen lamba ve görüntü toplamak. Halojen lamba kapatın.
- "Time-lapse görüntüleme için FITC" ayarlarına geri dönmek ve bir test görüntü yakalamak.
- Time-lapse serisi yakalayın.
Deneme sırasında elde edilen görüntüleri izlemek için önemlidir. Bazı durumlarda, odanın içinde sıcaklık küçük değişiklikler odak kayması neden olabilir. Bu, o akış hücreleri üzerinde sabit, böylece girişi ve vakum hatları optimize ederek önlenebilir. Ayrıca, mikroskop oda en aza indirerek, trafik ve mikroskop uzak tavan hava delikleri taslaklar yeniden yönlendirerek yardımcı olabilir. 37 tüm sahne ve objektif içine ° C /% 5 CO 2 inkübatör odaları, deneyimlerimiz iyi çalıştı bir alternatif . Bu teklif bir gecede veya daha uzun izleme hücrelerinin avantaj, ama hücrelere erişim sınırlıdır.
Gerekirse, time-lapse satın alma duraklatma ve görüntü tekrar odaklayın. Mümkün olduğunca çabuk tekrar odaklayın gerçekleştirin görüntü arasındaki zaman aralığı değiştirerek kaçının. - Tipik bir protokol ek görüntü alımı 0,5-4 saat takip eden bir test aracı eklemeden önce 20-30 dakika bazal görüntü oluşacaktır. Deney süresini mümkün olan en kısa pozlama süresi seçmek için önemli olmasının nedeni zaman içinde GFP photobleaching ile sınırlı olabilir. Aynı zamanda, daha uzun bir çalışma isteniyorsa, 30-60 s zaman atlamalı görüntüleri arasındaki aralığı değiştirmek için istenebilir.
4. Veri analizi
- Çeşitli yazılım paketleri genellikle bizim laboratuar ya da evde herhangi bir bilgisayarda analiz sağlayarak NIH ImageJ kullanarak görüntü analizi gerçekleştirmek NIS Elements Metamorph, Slidebook, vb gibi görüntü setleri, analiz etmek için kullanılabilir. Kullandığımız versiyonları:
MBF ImageJ ( http://www.macbiophotonics.ca/imagej/ )
Fiji (i "target =" _blank "> http://pacific.mpi-cbg.de/wiki/index.php/Fiji). - ImageJ dahil olmak üzere pek çok dinamik süreçleri analiz etmek için kullanılabilir:
- Frekans lamellipodia çıkıntılar
- Mesafe, süre ve çıkıntılar hızı
- Aktin zamanla lif hareketi
- ImageJ, görüntüyü ayarlamak dilim sayısı / toplam dilimleri açıldığında dosya adı ile birlikte, pencerenin sol üst köşesinde görüntülenir olacak, piksel, dosya türü, büyüklüğü ve sayısı. Z kaydırma çubuğu alt zamana tekabül eder. Buna ek olarak, işaretçiyi resmin üzerine asılı x, y ve z ImageJ araç çubuğunun alt piksel konumunu gösterecektir.
- Lamellipodia çıkıntı zamanla yeni çıkıntılar sayısını belirleyen incelenebilir. Bu, tüm hücre çevre veya seçilen bir bölge için de yapılabilir. Bu tür analiz, faz kontrast ya da DIC mikroskobu ile nonconfluent untransfected hücreleri de yapılabilir. Ancak, GFP-aktin ifade hücreleri kullanarak içeren ve GFP-aktin yoksun hücreler, birbirine bitişik olan, özellikle konfluent mono tabakaları analizi sağlar.
- Lamellipodia çıkıntı mesafesi, sebat (zaman) ve hız kymograph (line-scan) analizi ile tespit edilebilir. (Herhangi bir komşu hücre veya komşu hücre GFP-aktin ifade etmez varsa bu en kolay) bir hücrenin kenar dik bir çizgi çizin. ImageJ olarak, presleme "/" d temsil eden x-ekseni ile bir kymograph üretecekistance ve y-ekseni temsil süresi (15 sn yukarıdaki zaman aralığı kurallarına göre piksel başına 1 dakika). Hatları çıkıntılı lamellipodia ve (M ImageJ basarak) ölçülen box boyutları üzerinde çizilebilir. Mesafe, süre ve hız sonra hesaplanabilir.
- Stres liflerin hareketi de benzer bir moda kymograph analizi ile ölçülebilir.
5. Temsilcisi Sonuçlar:
Bölgenin ifade GFP-aktin HUVEC>% 90 bizim transfeksiyon protokolü ile, genellikle en az% 50 transfekte HUVEC GFP-aktin ifade ve genellikle lamel alanları bulabilirsiniz. Movie 1 GFP-aktin ifade akışkan HUVEC ile canlı bir hücre görüntüleme deney bir örnek gösterilmiştir. Bu deneme için bir görüntü dakikada bir kez satın alınmıştır. HUVEC film, GFP-aktin görüleceği gibi ipliksi yapı yanı sıra, sitoplazma boyunca gözlenebilir.ures ve yerel lamellipodia hücre kenarı boyunca çıkıntılı. Ayrıca filmde görünen GFP-aktin ifade hücreleri arasında düzgün olmasıdır. Çalışma için seçilen hücreler genellikle ipliksi aktin içeren çeşitli yapılar görselleştirmek için yeterli GFP-aktin var. Bu hücrelerde yüksek miktarda G-aktin mevcut F-aktin yapıları ayırt etmek genellikle zordur, çünkü GFP-aktin çok yüksek düzeyde eksprese eden hücrelerin çalışması için sorunlu olabilir.
Film 2 GFP-aktin ifade konfluent HUVEC davranışı bir örnek gösterir. Subconflent HUVEC gibi, hücrelerin çevrelerinin boyunca aktif lamellipodia oluşumu ve ciro belliydi. Ancak bu lamellipodia, genellikle daha az verimli çıkıntı gösteren 7, membran Karıştırdı doğurdu . Bu büyük olasılıkla yakındaki altyapısını engelleme komşu hücrelerin varlığı nedeniyle. Aktin kortikal liflerin ve stres lifleri Filmler 1 ve 2 de görülebilir. Her ne kadar biz o hücreleribserved sabit kaldı, stres liflerinin hücre kenarına yakın şekillendirme ve onlar 9 8 sökmeye hücre merkezine doğru yanal hareket eden, göç eden hücreleri enine yay liflerine benzer . Bu hücreleri gözlenen bir ek dinamik özelliği, aktin halka yapıların oluşumunu önceden aktin bulutlar 10 adlı eşmerkezli genişletilmiş oldu .
Hücre çıkıntılar mesafe, sebat ve hız bu zaman hızlandırılmış görüntü sayısal nasıl bir örnek kymograph analizi kullanılarak Şekil 1'de gösterildiği ayarlar. Şekil 1A, tek piksellik bir çizgiyi kabaca bir kymograph nesil (Şekil 1B) için hücre kenarına dik çizilir. Bu kymograph hattı ile tanımlanan bölgede dikey olarak konulacak ve geçen zaman boyunca görüntüleri yatay olarak dizilir. , Soldan kymograph sağa doğru bakıldığında, çıkıntılar hücrenin kenar yukarı yönlü hareketler olarak temsil edilir. Şekil 1C, bir çizgi destek olduBu çıkıntılar birinin kenarında erimposed ve piksel veri hattı ile ilgili, panelin alt kısmında Sonuçları penceresinde toplanmış ve gösterilir. Bu analiz, çıkıntı dinamikleri ölçümü sağlar ve hücrenin bu bölgede çıkıntı frekans (çıkıntılar sayısı / saat) tahmin etmek için de kullanılabilir.
Stres lif hareket analizi bir örneği Şekil 2'de gösterilmiştir. Stres liflerinin çoğu hücre çevre yakınında oluşturduğu gözlenir ve sonunda demonte nerede, hücre merkezine doğru taşındı. Bu da kymograph analizi ile belirlenebilir. Hücre kenar ve stres lifleri (Şekil 2A) ve kymograph oluşturulur (Şekil 2B) dik bir çizgi çizilir. Kymograph sitoplazmik alan sürekli çizgiler, genellikle hücre merkezine doğru) sağa (aşağı hareket ve stres lifleri gibi görünür. Bazen lifleri orijinal kymograph görmek zordur ve bu gibi durumlardagörüntü (Şekil 2C) netleştirmek için keskinlik giderme maskesi filtresi kullanın. Çizgiler stres lifleri üzerinde çizilmiş ve piksel verilerini ölçüm fonksiyonu (Şekil 2B) kullanılarak toplanmıştır. Bu veri toplamak için alternatif bir yol belirlenmiş stres lif lif (Şekil 2E) gözlenmiştir süresince ortalama eğim almak için bitirmek için en başından itibaren bir çizgi çizin. Bu analiz, stres fiber yanal hareket ölçümü sağlar ve hücrenin bu bölgede gözlenen stres liflerinin sayısını ölçmek için de kullanılabilir.
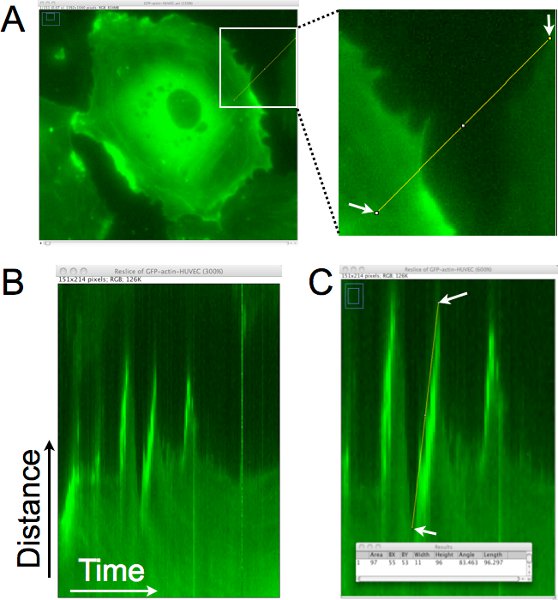
Şekil 1. hücre kenar Kymograph analizi çıkıntı mesafesi, sebat ve yerel lamellipodia hız belirlemek için. Tek piksellik çizgi kabaca hücre kenarına dik çizilir. Bu bölge, zamanla bölgenin bir montaj oluşturmak için her zaman atlamalı görüntü elde edilir. B . In the kymograph sonucunda, x-ekseni, soldan sağa doğru hareket zamanı temsil etmektedir ve y ekseni mesafeyi gösterir. Zamanla hücre kenar hareketi bu kymograph değerlendirilir ve lamellipodia hücre kenarı, sağa doğru hareket, yukarı doğru gider bölgelerde belirlenmiştir. C. Bir lamellipodium bir çıkıntı tespit edilmiştir hücre kenarına bir çizgi çizilir. Daha sonra çizilen hat için sınırlayıcı dikdörtgenin boyutları (üst üste pencerede gösterildiği gibi) elde edilir. Genişliği çıkıntı veya kalıcılık hesaplamak için kullanılır. Yüksekliği çıkıntı mesafe hesaplamak için kullanılır. Çıkıntı hızı, genişlik, yükseklik bölünmesi ile hesaplanır. Bu örnekte, yukarı doğru mesafe 96 piksel x 0,16125 mm / piksel = 15.5 mm x 1 / piksel = 11 dk dk. 11 piksel. Hızı 15,5 μm/11 dakika olarak hesaplandı. = 1.4 mm / dak.

Faktin stres liflerinin hareket igure 2 Kymograph analizi. Kymograph oluşturmak için tek bir piksel hattı hücrenin kenarına dik çizilir B. Şekil. 1, ortaya çıkan kymograph, x-ekseni ve y-ekseni temsil ediyor. Stres lifler sürekli hücre hatları, genellikle aşağı doğru gidiyor ve sağa (oklar) C görülmektedir. Stres lifleri daha iyi görselleştirmek için, keskinlik giderme maskesi filtresi kullanılabilir. Bu örnekte, 3 piksel ve 0.60 maskesi ağırlığı yarıçapı D. Tek bir piksel hatları belirlenmiş stres fiber üzerinden çizilen ve veri toplanmıştır. Bu panelde üç çizgi çizilir ve daha sonra "delete" her ölçümden sonra konumlarını kalıcı bir açıklama (beyaz çizgi) basıldığında E. Alternatif stres lif ortalama mesafe, zaman ve hız isteniyorsa, başlangıç ve bitiş noktaları (sarı çizgi) bir çizgi çizilmiş ve veriler için olabilirr elde edilebilir Sonuçları penceresinde vurgulanır. Bu örnek için, 37 kare için bu stres lif x 1 kare / dak ölçümleri yapıldı. = 37 dk. Bu süre oldu 75 kare x 0,16125 mm / piksel = 12.1 mm mesafe dolaştı. Stres lif yanal hızı 12.1 μm/37min = 0,33 mm / dak. Hızı için çevre doğru hareket eden lifler için hücre merkezi ve negatif doğru hareket eden lifler için pozitif bir değer atanır.
GFP-aktin ifade canlı HUVEC Film 1 Time-lapse görüntüleri. Görüntüleri arasında süre 1 dakika. Yerel lamellipodia hücrelerin tüm çevresi boyunca fırlamıştı. Buna ek olarak, enine yay stres lifleri hücre merkezine doğru yanal taşındı. Trombin (1 U / ml) banyosuna ilave edildiğinde, hücreler biraz sözleşmeli ve lamellipodia dışa doğru çıkıntılar yaklaşık 10 dakika durakladı. Hücrelerin sözleşmeli sonra, lamellipodia oluşumu ve ciro devam d. film izlemek için buraya tıklayın.
Movie 2 trombin ile tedavi öncesi ve sonrası, GFP-aktin ifade konfluent HUVEC. Saniye: Geçen süre dakika olarak sağ alt köşesinde gösterilir. Görüntüleri arasında aralığı 30 saniye Trombin (1 U / ml), 45 dakika sonra eklendi. başlangıçtaki dönemde. Aktin bulutlar (oklar, 1:59 - 21:29) ve trombin eklendikten sonra genişler tricellular bir kavşakta bir boşluk - Açıklamalı olaylar yerel lamellipodia oluşumu ve ciro (37:29 hücre kenarlarına yakın ok uçları, 00:59) (ok, 62:30 - 70:00). Enine yay stres lifleri bazı hücrelerin de fark edilir. Hücre zarı sebebiyet veren birçok fırfır ile çevredeki boyunca yerel lamellipodia aktif oluşumu ve ciro,. Trombin lamellipodia oluşumu ve ciro bir duraklama neden ve hücreler arasındaki bazı küçük boşlukları kısa bir görünüm.https://www.jove.com/files/ftp_upload/3187/Movie2-confluentHUVEC.avi "> film izlemek için buraya tıklayın.
Tartışmalar
Canlı endotel hücreleri GFP-aktin görüntüleme inflamatuar uyaranlara yanıt aktin hücre iskeletinin dinamiklerini ayrıntılı bir analiz sağlar. Bu yöntem ayrıca, kayma gerilmesi 11 gibi fiziksel güçlerine yanıt olarak hücre iskeletinin yeniden şekillenme gösteren önceki bulgularla üzerine inşa etmek için yararlı olabilir . Buna ek olarak, bu yöntem, göç, mitoz, hücrelerarası kavşaklar ve junctional olgunlaşma oluşumu ve bariyer fonksiyonu bakım dahil olmak üzere çeşitli endotel hücre faaliyetleri, aktin hücre iskeleti dinamiklerinin katkısı ayrıntılı bir şekilde değerlendirilmesini sağlar.
Gösterilen veriler, trombin ile tedavi öncesi ve sonrası endotel aktin hücre iskeletinin davranışı görülebilir. Endotelyal hücrelerin kenarlarında Yerel lamellipodia oluşturan ve hem nonconfluent ve konfluent hücre mono tabakaları zamanla gerileyebilen gözlendi. Trombin ile tedavisi kısaca lamellipodia formu kesilditirme ve ciro. Trombin, ayrıca endotel hücreleri 12-14 trombin aktin stres lifli yapısı ve artan merkezcil gerginlik geliştirme neden olduğu daha önceki raporlarda ile anlaşma hücreleri, biraz sözleşme neden oldu . Ancak, bu gibi canlı hücre görüntüleme çalışmaları, stres liflerin kökeni artık tespit edilebilir. HUVEC, stres liflerinin çoğu hücre çevre kaynaklı ve hücreleri 8, 9 göç enine yay liflerin benzeyebilir. Sabit hücreleri kullanarak üzerinde bu yöntemi başka bir gücü, deneysel gruplar arasında seçim yanlılığı ortadan kaldırarak, stres liflerin sayısı, trombin tedavi öncesi ve sonrasında tek tek hücrelerin sayısal olabilir ki.
Bu protokol ile, hücre kenar ve aktin stres lifleri dinamik hareketi değerlendirir. Endotel hücreleri, floresan kurtarma gibi daha gelişmiş teknikleri photobleaching sonra aktin monomeri dinamiklerini anlamak (sıkı bağlamak) veya floresan mikro specklekopyası (FSM) 16, 15 uygulanabilir. Buna ek olarak, çünkü mikrovasküler endotel hücreleri mikrovasküler bariyer fonksiyonunu daha iyi bir modeli, etkin bir şekilde mantıksal bir gelecekteki yönünü temsil mikrovasküler endotel hücrelerinde GFP-aktin ifade etmek transfeksiyon protokolleri optimizasyonu temsil edebilir.
Özetle, GFP-aktin ifade canlı endotel hücreleri görüntüleme endotel hücre aktin hücre iskeletinin çeşitli tipte uyaranlara nasıl tepki vereceğini belirlemek için güçlü bir araçtır temsil eder. Sıkı konfluent endotel mono tabakaları kullanılarak yapılan çalışmalar, aktin-zengin lamellipodia ve endotel bariyer fonksiyonu enine yay stres lifleri gibi dinamik yapıların rolleri belirlemek yardımcı olacaktır. Buna ek olarak, GFP-aktin veya diğer hücre içi yapıların görüntülenmesi sağlayan diğer füzyon proteinleri ifade endotel hücreleri canlı hücre görüntüleme, sinyalizasyon ve yapısal mekanizmaları anlamak için gerekli detaylı uzaysal bilgi sağlayacak bu determine bariyer bütünlük.
Açıklamalar
Çıkar çatışması ilan etti.
Teşekkürler
GFP-β-aktin plazmid cömertçe Dr. Wayne Orr LSUHSC-S Patoloji Bölümü tarafından sağlanan ve LSUHSC-NO Farmakoloji Bölümü Dr. Becky Worthylake, laboratuvar amplifiye edildi. Bu çalışma Ulusal Sağlık Enstitüsü (P20 RR-018.766) ve Amerikan Kalp Derneği (05835386N) hibe tarafından desteklenmiştir.
Malzemeler
| Name | Company | Catalog Number | Comments |
| 1. Zil 5x STOKUN | |||
| Kimyasal | Şirket | Katalog Numarası | Miktar |
| Sodyum klorür | EMD | SX0420-3 | 35 g |
| Potasyum klorid | JT Baker | 3040 | 1.75 g |
| Kalsiyum Klorür | Sigma | C-3881 | 1.47 g |
| Magnezyum Sülfat | Sigma | M-9397 | 1,44 g |
| Steril Filtreli su | N / A | N / A | 1 L Getir |
| 4 otoklavlanmış mağaza şişe ve içine steril filtre ° C | |||
| 2. MOPS tampon | |||
| Kimyasal | Şirket | Katalog Numarası | Miktar |
| MOPS | Sigma | M3183 | 125.6 g |
| Steril Filtreli su | N / A | N / A | 1 L Getir |
| 4 otoklavlanmış mağaza şişe ve içine steril filtre ° C | |||
| 3. Albumin Fizyolojik Tuz Çözeltisi (APSS) | |||
| Kimyasal | Şirket | Katalog Numarası | Miktar |
| Zil stoku (5x) | N / A | N / A | 200 ml |
| Mops Tampon | N / A | N / A | 5 ml |
| Sodyum Fosfat | Sigma | S-9638 | 0.168 g |
| Sodyum Piruvat | Sigma | P5280 | 0,22 g |
| EDTA sodyum tuzu | Sigma | ED2SS | 0,0074 g |
| Glikoz | Sigma | G7528 | 0,901 g |
| Albümin, Bovine | USB | 10856 | 10 g |
| Steril Filtreli su | N / A | N / A | 1 L Getir |
| 37 ° pH 7.4 'e ayarlayın ° C, 4 otoklavlanmış şişe ve depoya sonra steril filtre ° C | |||
| 4. % 0.9 salin | |||
| Kimyasal | Şirket | Katalog Numarası | Miktar |
| Sodyum klorür | EMD | SX0420-3 | 9 g |
| Steril Filtreli su | N / A | N / A | 1 L Getir |
| 4 otoklavlanmış mağaza şişe ve içine steril filtre ° C | |||
| 5. % 1,5 jelatin Çözüm | |||
| Domuz deri gelen Jelatin | Sigma | G2500 | 15 g |
| % 0.9 salin | N / A | N / A | 1 L Getir |
| 37 çözüm Sıcak ° C yeterince jelatin çözülür. Iken 4 otoklavlanmış şişe ve mağaza hala sıcak, steril filtre ° C | |||
Referanslar
- Spindler, V., Schlegel, N., Waschke, J. Role of GTPases in control of microvascular permeability. Cardiovasc. Res. 87, 243-253 (2010).
- Wojciak-Stothard, B., Ridley, A. J. Rho GTPases and the regulation of endothelial permeability. Vascul. Pharmacol. 39, 187-199 (2002).
- Yuan, S. Y. Signal transduction pathways in enhanced microvascular permeability. Microcirculation. 7, 395-403 (2000).
- Birukov, K. G. Small GTPases in mechanosensitive regulation of endothelial barrier. Microvasc. Res. 77, 46-52 (2009).
- Duran, W. N., Sanchez, F. A., Breslin, J. W. Microcirculatory Exchange Function. Handbook of Physiology: Microcirculation. Tuma, R. F., Duran, W. N., Ley, K. , 2nd Edition, Elsevier. San Diego. 81-124 (2008).
- Hu, Y. L., Chien, S. Dynamic motion of paxillin on actin filaments in living endothelial cells. Biochem. Biophys. Res. Commun. 357, 871-876 (2007).
- Borm, B., Requardt, R. P., Herzog, V., Kirfel, G. Membrane ruffles in cell migration: indicators of inefficient lamellipodia adhesion and compartments of actin filament reorganization. Exp. Cell. Res. 302, 83-95 (2005).
- Hotulainen, P., Lappalainen, P. Stress fibers are generated by two distinct actin assembly mechanisms in motile cells. J. Cell. Biol. 173, 383-394 (2006).
- Pellegrin, S., Mellor, H. Actin stress fibres. J. Cell. Sci. 120, 3491-3499 (2007).
- Ballestrem, C., Wehrle-Haller, B., Imhof, B. A. Actin dynamics in living mammalian cells. J. Cell. Sci. 111, 1649-1658 (1998).
- Helmke, B. P., Rosen, A. B., Davies, P. F. Mapping mechanical strain of an endogenous cytoskeletal network in living endothelial cells. Biophys. J. 84, 2691-2699 (2003).
- Birukova, A. A., Smurova, K., Birukov, K. G., Kaibuchi, K., Garcia, J. G., Verin, A. D. Role of Rho GTPases in thrombin-induced lung vascular endothelial cells barrier dysfunction. Microvasc. Res. 67, 64-77 (2004).
- van Nieuw Amerongen, G. P., van Delft, S., Vermeer, M. A., Collard, J. G., van Hinsbergh, V. W. Activation of RhoA by thrombin in endothelial hyperpermeability: role of Rho kinase and protein tyrosine kinases. Circ. Res. 87, 335-340 (2000).
- Moy, A. B., Blackwell, K., Kamath, A. Differential effects of histamine and thrombin on endothelial barrier function through actin-myosin tension. Am J Physiol Heart Circ Physiol. 282, H21-H29 (2002).
- Wittman, T., Littlefield, R., Waterman-Storer, C. Fluorescent speckle microscopy of cytoskeletal dynamics in living cells. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 184-204 (2005).
- Rabut, G., Ellenberg, J. Photobleaching techniques to study mobility and molecular dynamics of proteins in live cells: FRAP, iFRAP, and FLIP. Live Cell Imaging: A Laboratory Manual. Goldman, R. D., Spector, D. L. , Cold Spring Harbor Laboratory Press. 101-126 (2005).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır